一种用于治疗脓毒症的脂质金纳米颗粒复合物及其制备方法
本发明属于脓毒症治疗药物,具体涉及一种用于治疗脓毒症的脂质金纳米颗粒复合物及其制备方法。
背景技术:
1、这里的陈述仅提供与本发明相关的背景技术,而不必然地构成现有技术。
2、脓毒症是指宿主对感染的反应失调,并产生危及生命的器官功能障碍。脓毒症是造成全球疾病负担的主要因素之一。患者住院时间长、治疗费用高且死亡率高。尽管近年来在抗生素治疗和支持性治疗等重症监护方面取得了进展,但目前在许多问题上仍然存在重大的知识空白,包括与脓毒症发病机理相关的基本机制仍然不明确。深入研究脓毒症发病机制,寻找新的防治途径,已成为国际危重症医学领域的迫切任务。
3、临床中发现脓毒症患者通常会出现进行性的皮下水肿和体腔积液,这表明脓毒症患者血管通透性普遍增加。血管通透性增加会导致水和大分子蛋白不受控制地进入组织,造成组织水肿,进一步会导致组织缺氧;同时由于间质压升高损害微血管灌注,可能造成器官功能障碍。内皮完整性的丧失与脓毒症相关的器官损伤和死亡密切相关。因此,改善内皮屏障功能,维持血管内皮完整性,可能会成为脓毒症治疗的新靶点,具有重要的临床意义。
4、血管内皮屏障取决于相邻血管内皮细胞之间结合的完整性。紧密连接(tightjunctions,tjs)是血管内皮细胞之间的主要连接方式之一。其中,claudin-5蛋白是紧密连接的主要组成部分,在维持内皮细胞通透性方面起到了至关重要的决定。研究表明上调claudin-5蛋白的表达,可修复受损的紧密连接,有效降低血管通透性。
5、基因治疗是指利用基因载体将目标基因运入靶细胞中,通过沉默致病基因或增加治疗基因的表达来治疗许多目前难解决的疑难杂症,如癌症等。因此,通过基因治疗的方式直接上调claudin-5蛋白的表达,是修复血管内皮细胞连接损伤的一种潜在的新策略。然而,核酸在体内会被核酸酶降解,导致到达目标部位的核酸浓度较低,治疗效果并不理想,这极大地限制了核酸药物的临床应用。为了解决核酸分子在体内易被核酸酶降解的问题,科学家们设计出一系列基因载体,用于保护核酸分子,提高递送效率。目前,基因治疗所用基因载体主要分为两大类,病毒载体和非病毒载体。病毒载体转染效率高,但其自身具有免疫原性,进入机体后容易触发免疫反应,大大限制了病毒载体的临床应用。
技术实现思路
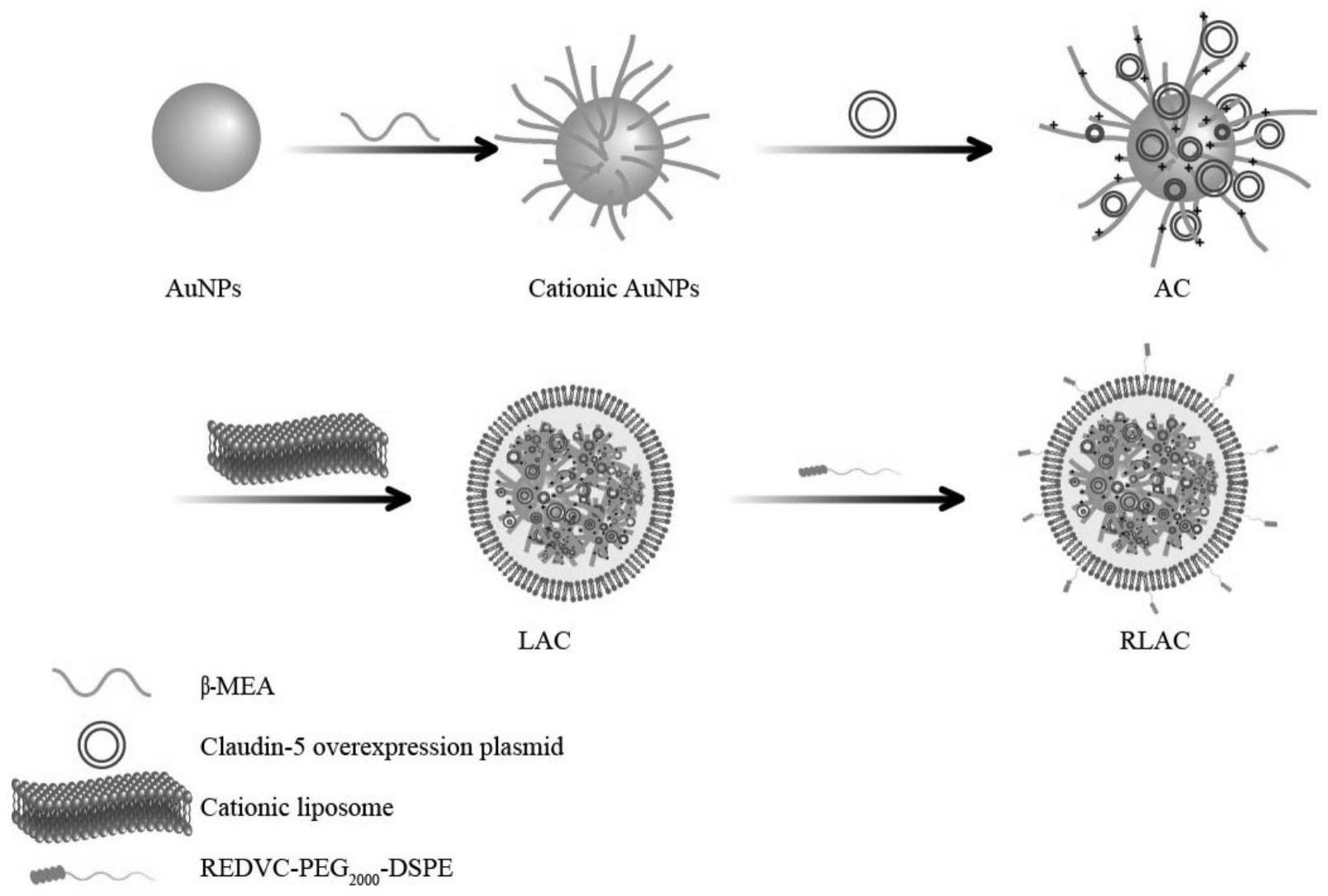
1、针对现有技术存在的不足,本发明的目的是提供一种用于治疗脓毒症的脂质金纳米颗粒复合物rlac及其制备方法。本发明采用基因治疗的方式,通过将claudin-5过表达质粒运载进入内皮细胞中表达以升高claudin-5的表达水平,重建血管内皮屏障,从而降低血管通透性,起到治疗脓毒症的目的。
2、为了实现上述目的,本发明是通过如下的技术方案来实现:
3、一种用于治疗脓毒症的脂质金纳米颗粒复合物,其制备方法包括如下步骤:
4、将十二烷基硫酸钠(sds)加入金纳米颗粒(aunps)的分散液中,并分散均匀;
5、向溶液中加入β-巯基乙胺(β-mea),其中,aunps、sds和β-mea的终浓度分别为(1~4nm)、(12~18mm)和(55~60mm),继续搅拌4~10h后过滤除去sds,将剩余溶液在12000~18000rpm/min离心浓缩,将浓缩液进行透析纯化,纯化完成后,调节ph值为4~5,得到表面带正电荷的aunps溶液;
6、向阳离子aunps溶液中加入claudin-5过表达质粒,搅拌过夜,得aunp-claudin-5复合物(ac)溶液;
7、将大豆卵磷脂、胆固醇和2-二油酰基羟丙基-3-n,n,n-三甲铵氯dotap按质量比为0.2~0.6:0.05~0.3:0.01~0.09加入茄形瓶中,并加入甲醇溶液150~200ml,加热使其溶解,然后冷却至室温,旋转蒸发除去甲醇,得到附着在茄形瓶瓶壁上的脂质体薄膜;
8、将ac复合物溶液加入所述茄形瓶中,震荡水化1~4h,然后超声破碎脂质体,离心纯化、过滤后,即得lipo-aunp-claudin-5复合物(lac)。
9、将redvc-peg2000-dspe溶液加入lac复合物溶液中,其中redvc-peg2000-dspe是磷脂质量的5%~20%。所述溶液震荡4~8h,使redvc-peg2000-dspe完全插入lac复合物的脂质体层中,即得rlac复合物。
10、阳离子aunps与claudin-5过表达质粒通过静电连接在一起时,aunps作为核,可以使附近claudin-5过表达质粒的浓度大大升高。随后在最外层包裹了一层阳离子脂质体,将claudin-5过表达质粒与aunps封闭在阳离子脂质体内,保护claudin-5过表达质粒不被核酸酶降解。并且阳离子脂质体因与细胞膜表面所带电荷相反,可以增加基因载体进入细胞以及发生内体逃逸的能力。在阳离子脂质体表面修饰了靶向肽redv,通过redv肽与内皮细胞膜上整合素α4β1的特异性作用,可以使基因载体特异性靶向血管内皮细胞。基因载体将claudin-5过表达质粒运载进入血管内皮细胞后,claudin-5过表达质粒表达,claudin-5表达水平增加,重建血管内皮屏障,降低血管通透性,起到治疗脓毒症的目的。
11、在一些实施例中,所述aunps分散液的制备方法为:在两口瓶中加入质量分数为20%~30%的四氯化金溶液和蒸馏水,四氯化金溶液和蒸馏水的体积比为10-3~5×10-3:4~8,加热至沸腾;
12、然后加入质量分数为0.8%~1.5%的柠檬酸三钠溶液,柠檬酸三钠溶液与蒸馏水的体积比为6~10:40~80,继续加热,沸腾15~30min后停止加热,降温后,即得aunps分散液。
13、优选的,柠檬酸三钠溶液的浓度为0.8%~1.2%。
14、在一些实施例中,所述四氯化金溶液的质量分数为24%~28%。
15、优选的,制得的aunps分散液于3~5℃避光保存。
16、在一些实施例中,所述滤膜为0.22μm。
17、在一些实施例中,透析纯化采用的透析袋的截流量为3000~4000da。
18、优选的,采用hcl调节溶液的ph值为4~5。
19、在一些实施例中,向阳离子aunps溶液中加入claudin-5过表达质粒,阳离子aunps与claudin-5过表达质粒的质量比为(35~40ng):(6~10mg)。
20、所述claudin-5过表达质粒的提取方法如下:
21、准备工作:清洗锥形瓶,配制lb培养基(5g胰蛋白胨+5g氯化钠+2.5g酵母提取物,加蒸馏水定容至500ml):封口进行高压。待培养基冷却至室温,向培养基中加入1:1000的kana抗生素与2ml claudin-5菌种,在150rpm/min,37℃的摇床上震荡12~16h。
22、实验步骤:
23、1)将震荡结束的菌液分批转移至50ml离心管中,以4000rpm/min室温离心10min。
24、2)弃上清后,向离心管中加入10ml的solutioni/rnase a,吹吸均匀,使溶液变浑浊。
25、3)向溶液中加入10ml的solutionⅱ,轻轻上下颠倒8~10次,以便溶液彻底变澄清,此操作在2~3min内完成。
26、4)随后向溶液中加入5ml预冷的n3 buffer,立即上下颠倒使溶液充分混匀,此时瓶内出现白色絮状沉淀。
27、5)打开除杂滤器的塞子,将上一步的裂解物迅速转移至过滤器中,用塞子轻轻将lysate转移到新的50ml离心管中。
28、6)向上述离心管中加入0.1倍溶液体积的ert solution,轻轻上下颠倒溶液,此时溶液变得混浊。将溶液放于冰上孵育10min,期间每隔2~3min上下颠倒几次,冰浴后溶液变澄清。
29、7)将溶液在42℃水浴孵育5min,溶液再次变浑浊。将溶液以4000rpm/min室温离心5min,此时ert solution在管底形成蓝色沉淀。
30、8)将上层水相小心吸入新的50ml离心管中,向其加入0.5倍体积的无水乙醇,轻轻颠倒6~7次。
31、9)将hibind dna maxi column装入离心管中,向column中加入3ml gps buffer,室温下放置4min,4000rpm/min离心3min后,弃去滤液。
32、10)取第8步中的上清液20ml加入column,4000rpm/min离心3min,弃去滤液。重复此步骤至全部溶液离心完毕。
33、11)向column中加入10ml预先用异丙醇稀释的hbc buffer,4000rpm/min离心3min,弃滤液。
34、12)向column中加入15ml预先用无水乙醇稀释的dna wash buffer,4000rpm/min离心3min后弃滤液。再次向column中加入10ml的dna wash buffer,4000rpm/min离心3min,弃滤液。column以4000rpm/min离心空转10min,以甩干column上的无水乙醇。
35、13)将column转移至新的无酶的50ml离心管中。向column的柱膜上均匀滴加500μl的endo-free elution buffer,室温下放置5min。4000rpm/min,离心5min。离心完的滤液再次加到column的柱膜上二次离心。收集离心下来的液体,即为质粒dna,于-80℃长期保存。
36、在一些实施例中,redvc-peg2000-dspe的制备方法为:将两亲性化合物dspe-peg2000-mal和靶向多肽redvc以摩尔比1.3:1~1.7:1的比例溶解在水中,3~5℃反应8~15h,即得。
37、上述本发明的一种或多种实施例取得的有益效果如下:
38、脂质金纳米颗粒复合物rlac作为claudin-5过表达质粒的基因载体具有良好的生物相容性和较高的递送效率。当rlac被内皮细胞摄取后,claudin-5过表达质粒在细胞内释放并表达,进而升高claudin-5蛋白的表达水平,可以起到修复血管内皮屏障、治疗脓毒症的作用。
39、使用脂质体运载质粒dna,将质粒dna包裹在脂质体中,可以保护dna不受核酸酶的降解。阳离子脂质体因与细胞膜表面带相反电荷,可以大大提高脂质体进入细胞的能力。阳离子aunps与质粒通过静电吸附连接时,阳离子aunps作为核,可以大大提高周围的质粒浓度。因此本发明同时应用阳离子脂质体与aunps两种基因载体,首先使用功能性aunps浓缩质粒浓度,然后使用阳离子脂质体将aunps与质粒包裹起来。这一策略不仅通过浓缩质粒浓度和保护质粒dna免受降解来提高质粒dna的递送效率,还使用阳离子脂质体增加进入细胞以及内体逃逸的能力。
40、为了提高基因载体的靶向性,本发明还使用了多肽redv肽。redv(arg-glu-asp-val)是一种具有特异靶向性功能的四肽,由纤维粘连蛋白衍生而来,能够高效特异性地结合α4β1整合素。该整合素在内皮细胞膜表达量丰富,而在平滑肌细胞表面含量很少,使得redv多肽对内皮细胞能够特异性粘附,有利于基因载体对内皮细胞的选择性粘附。
41、针对脓毒症导致血管内皮细胞连接受损的问题,设计利用脂质金纳米颗粒复合物(redvc-lipo-aunp-claudin-5,rlac)靶向血管内皮细胞递送claudin-5过表达质粒,从而增加claudin-5蛋白的表达,重构细胞间紧密连接。aunps经过β-mea修饰后表面带正电,作为“核”吸引带负电的claudin-5过表达质粒,使得aunps附近的质粒浓度升高,可有效提高递送效率。为了保护claudin-5过表达质粒不受核酸酶降解,在claudin-5过表达质粒的外侧包裹一层阳离子脂质体膜,隔绝claudin-5过表达质粒与核酸酶的接触。并且由于细胞膜表面带负电,阳离子脂质体有利于通过内吞作用进入细胞以及发生内体逃逸。最后,为了使合成的复合物具有靶向血管内皮细胞的能力,在脂质体最外层修饰了redv肽。redv肽可与在血管内皮细胞表面高表达的α4β1整合素高效特异性结合,具有主动靶向血管内皮细胞的能力。在redv肽的尾部增加一个半胱氨酸得到redvc肽,利用半胱氨酸的巯基与dspe-peg2000-mal中马来酰亚胺的双键部位发生加成反应连接得到redvc-peg2000-dspe。通过“后插法”将redvc-peg2000-dspe插入到脂质体的表面,赋予脂质复合物靶向血管内皮细胞的能力。综上所述,作者设计合成了redvc肽修饰的脂质金纳米颗粒复合物rlac用于靶向运送claudin-5过表达质粒进入血管内皮细胞,通过claudin-5过表达质粒在细胞中表达来升高claudin-5蛋白的表达水平,用于修复受损的紧密连接,治疗脓毒症。
- 还没有人留言评论。精彩留言会获得点赞!