一种多臂Anti-CD40抗体介导纳米双药递送体系及其制备方法与应用
本发明属于生物医药,具体涉及一种多臂anti-cd40抗体介导纳米双药递送体系及其制备方法与应用。
背景技术:
1、癌症的治疗传统上包括三种主要方法:外科手术、化疗和放疗。尽管在这些领域中已取得巨大进步,但手术、化疗和放疗等肿瘤治疗策略常伴有治疗不彻底、易复发、易转移、易引起多种并发症的缺点,往往给患者带来较为严重的毒副作用和极大的痛苦,同时也不利于癌症患者的康复,所以需要寻找更有效、更安全的替代治疗方法。在纳米载体表面修饰靶向分子(包括dna、适配体、蛋白等)及其设计化学、酶响应化学机制释放负载药物,得到环境敏感刺激响应型的新型药物递送系统。通过设计生物大分子门控介孔氧化硅纳米药物递送体系,实现多种药物的同时递送和刺激响应控制释放已经成为当前药物递送领域的研究热点之一。
2、金纳米棒(gold nanorods,gnrs)具有良好的、可控的表面化学性质和独特的局部表面等离子体共振效应(lspr),在近红外光一区(650~900nm)具有很强的吸收和散射作用,具有连续可调的lspr吸收峰和很高的光热转换效率(50%~100%),已经广泛应用于光热治疗、疾病诊断和药物输送等生物医学领域。
3、介孔二氧化硅纳米粒子(mesoporous silica nanoparticles,msn)是由许多蜂窝状的介孔通道组成的纳米材料。其不仅具有比表面积大,孔容积大,孔径可调节等性质,还具有化学性质稳定,生物相容性好等优点。因此,介孔二氧化硅纳米材料不仅可以包载不同性质的化学抗癌药物,还可以通过在其表面修饰各种功能性基团从而实现药物的递送和刺激响应药物控制释放。肿瘤微环境具有酸化、缺氧、炎症反应性、免疫抑制等复杂多变的特性,而且许多药物由于具有不稳定性和缺乏目标靶向性等缺点往往难以到达病灶区域。因此,实现药物的刺激响应释放对于提高药物的治疗效果及其精准治疗具有重要意义。
4、近红外长余辉发光材料znga2o4:cr3+(zgc)具有独特的深层组织穿透和可充能长余辉发光特性。并且,该材料具有较好的化学稳定性、生物相容性和循环充能特性,能够应用于生物传感、医学成像、手术指导和肿瘤诊断等领域。近红外长余辉材料应用于成像领域,与其它光学材料相比,具有更高的信噪比和分辨率。传统长余辉材料的激发光源波长大多限于紫外光区,开发近红外区发光的长余辉材料具备显著优势,能够实现长余辉发光材料在多种新领域的应用。
5、cd40受体(cluster of differentiation of 40)是一种跨膜蛋白,属于肿瘤坏死因子(tumor necrosis factor,tnf)超家族,主要表达于乳腺癌、肺癌、肾癌等恶性肿瘤细胞表面。基于cd40/cd40l(cd40配体)相互作用增强免疫应答的启发,anti-cd40抗体在增强抗肿瘤应答方面表现出令人振奋的活性,已被证明是一种有吸引力的癌症治疗策略。同时,近年来基于钆(ⅲ)的磁共振成像造影剂受到了较为显著的关注。由于含氮杂环多羧酸配体(如1,4,7,10-四氮杂环十二烷-1,4,7,10-四羧酸,dota)更易于被功能性基团修饰,并且其钆(ⅲ)配合物比线性配合物具有更高的热力学稳定性和动力学惰性,与蛋白结合的钆基造影剂具备更好的生物相容性和成像对比度,因此在研发新型钆基造影剂领域备受青睐。
6、因此,需要开发一种设计生物大分子门控介孔氧化硅纳米药物递送体系,同时发挥化学治疗、免疫治疗和光热治疗的协同作用,实现多种药物的同时递送和刺激响应控制释放,进而优化肿瘤治疗效果。
技术实现思路
1、针对现有技术中存在不足,本发明提供了一种多臂anti-cd40抗体介导纳米双药递送体系及其制备方法与应用;本发明中将铬离子掺杂的镓酸锌znga2o4:cr3+(zgc)纳米晶嵌入二氧化硅包覆金纳米棒纳米颗粒gnr@msns制备获得复合纳米粒子cgnr@msns,然后在该纳米颗粒表面修饰1,4,7,10-四氮杂环十二烷-1,4,7,10-四乙酸(dota)连接二乙烯基嘧啶衍生物(dotv),进而共价偶联anti-cd40抗体作为纳米门得到所述多臂anti-cd40抗体介导纳米双药递送体系;所述多臂anti-cd40抗体介导纳米双药递送体系通过结合多模态成像提高诊断准确性,并且推动成像引导的联合治疗的发展,发挥化学治疗、免疫治疗和光热治疗的协同作用,优化肿瘤治疗效果,适用于多种恶性实体瘤的治疗,具有很好的实用性。
2、为了实现上述技术目的,本发明采用如下技术手段:
3、本发明首先提供了一种多臂anti-cd40抗体介导纳米双药递送体系,所述多臂anti-cd40抗体介导纳米双药递送体系中,在cgnr@msns纳米复合材料表面逐级自组装多臂dotv和anti-cd40抗体形成多层膜结构;所述cgnr@msns纳米复合材料为球形纳米结构,其通过在核壳结构的介孔二氧化硅(msns)包覆金纳米棒(gnr)嵌入znga2o4:cr3+纳米晶得到;所述抗肿瘤药物负载在多臂anti-cd40抗体介导纳米双药递送体系的壳层介孔中。
4、优选地,所述多臂dotv均匀分布在cgnr@msns纳米复合材料的壳层和介孔孔道中,anti-cd40抗体分布在cgnr@msns纳米复合材料的表面形成抗体最外层;
5、所述抗肿瘤药物包括喜树碱。
6、本发明还提供了上述多臂anti-cd40抗体介导纳米双药递送体系的制备方法,具体包括如下步骤:
7、s1.采用种子介导生长法合成金纳米棒(gnrs):
8、将氯金酸溶液、十六烷基三甲基溴化铵(ctab)溶液和硼氢化钠溶液混合搅拌,然后室温下陈化反应,反应结束后得到反应液1,备用;
9、将ctab、油酸钠溶于去离子水,混合均匀后加入硝酸银水溶液,然后在搅拌条件下进行反应1,得到反应液2;
10、向反应液2中加入haucl4溶液并在搅拌条件下进行反应2,反应结束后调节ph值,然后加入抗坏血酸,搅拌混合均匀后加入反应液1,静置,最后离心,得到gnrs,分散在去离子水中备用。
11、优选地,步骤s1中,所述氯金酸溶液、ctab溶液和硼氢化钠溶液的体积比为5:5:1,所述氯金酸溶液的浓度为0.3~0.6mm,ctab溶液的浓度为0.1~0.2mm,所述硼氢化钠溶液为0.6ml浓度为0.01m的硼氢化钠溶液稀释成1ml;
12、所述陈化反应的时间为30~60min;
13、所述ctab、油酸钠、去离子水的用量比为9g:1.234g:250ml
14、所述ctab硝酸银溶液、haucl4溶液、抗坏血酸和反应液1的用量比为9g:14.5ml:250ml:1.25ml:0.8ml;所述硝酸银水溶液的浓度为4mm,haucl4溶液的浓度为1mm,抗坏血酸的浓度为0.064m;
15、所述反应1为在30℃下搅拌15~30min;
16、所述反应2为30℃下搅拌至溶液呈无色状态;
17、所述调节ph值为使用2.1ml浓度为12m的浓hcl调节ph值至1.30;
18、所述静置为30℃下静置12h。
19、s2.核壳结构二氧化硅包覆金纳米棒纳米颗粒(gnr@msns)的制备:
20、将gnrs分散液与ctab溶于去离子水中,然后加入naoh溶液和硅酸四乙酯溶液,在搅拌条件下反应,反应结束后离心取固体沉淀物,烘干得固体粉末;
21、然后将固体粉末分散在盐酸和甲醇的混合溶液中回流反应,反应结束后离心、洗涤、干燥,得到gnr@msns。
22、优选地,步骤s2中,gnrs分散液、ctab、去离子水、naoh溶液和硅酸四乙酯溶液的用量比为5ml:0.1g:0.5ml:450μl;
23、其中所述gnrs分散液的浓度为1.5~2mg·ml-1,所述naoh溶液的浓度为0.1m;
24、所述硅酸四乙酯溶液为以甲醇为溶剂,体积分数为20%;
25、所述硅酸四乙酯溶液份三次滴加,每次滴加后在搅拌条件下反应6h;
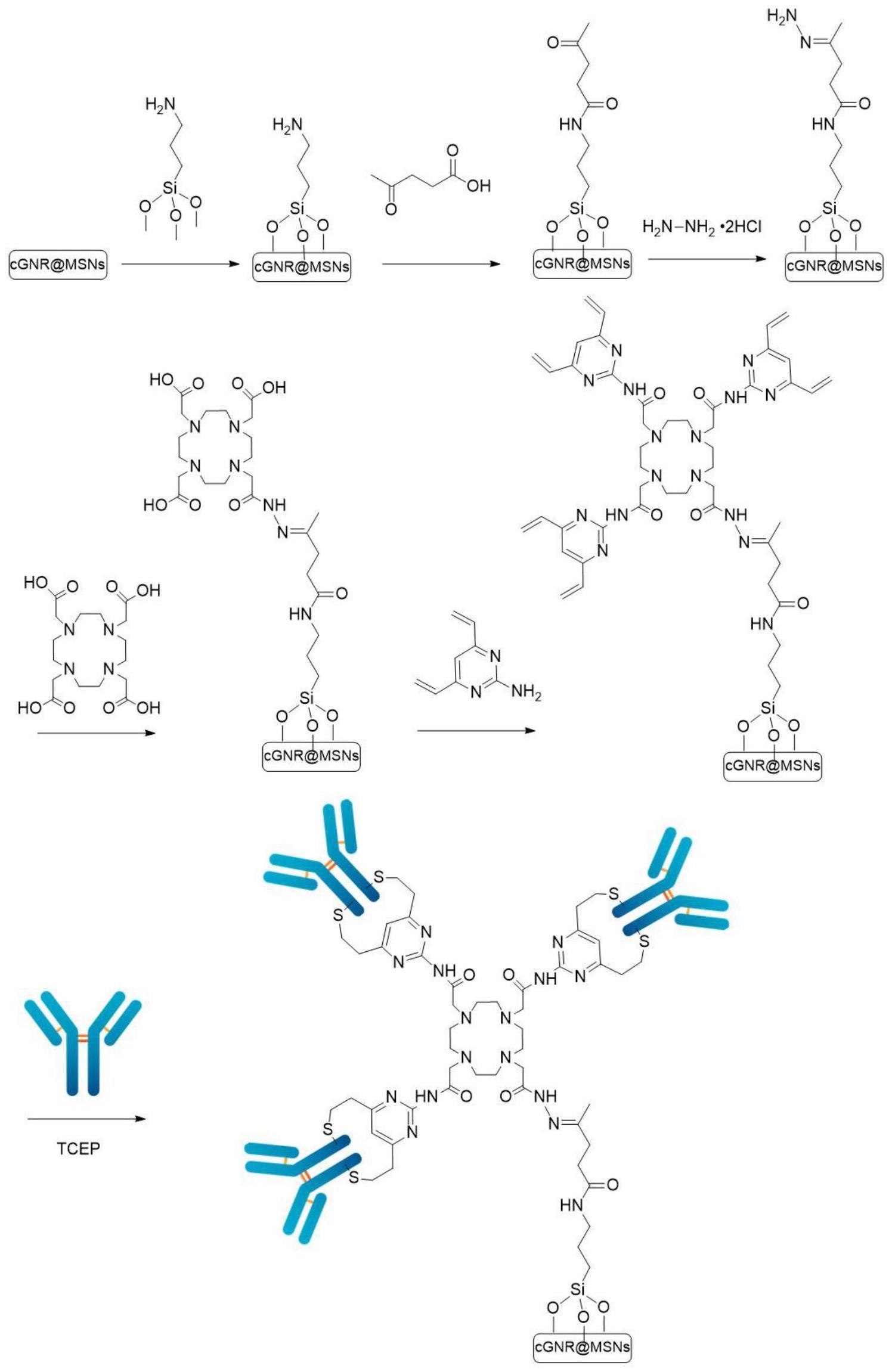
26、所述gnrs分散液、盐酸和甲醇的用量比为5ml:0.2ml:20ml,所述盐酸的浓度为12m;
27、所述回流反应为在室温下回流1h。
28、s3.cgnr@msns纳米复合材料的制备:
29、将ga(no3)3、zn(no3)2和cr(no3)3溶于水/乙醇溶液中,得到了含有ga(no3)3、zn(no3)2和cr(no3)3的前驱体混合溶液;
30、然后将前驱体混合溶液与gnr@msns纳米材料共同孵育,孵育结束后离心,干燥,得固体粉末;将固体粉末煅烧得到cgnr@msns纳米复合材料。
31、优选地,步骤s3中,前驱体混合溶液中ga3+、zn2+和cr3+的最终离子浓度分别为1m、0.5m和0.002m;
32、所述gnr@msns、前驱体混合溶液的用量比为500mg:300μl;
33、所述孵育为室温下孵育;
34、所述煅烧的条件为以5℃/min的速度加热至600℃,在600℃下煅烧1h。
35、s4.dota衍生二乙烯基嘧啶(dotv)功能化cgnr@msns(dotv-cgnr@msns)的制备:
36、s4.1.nh2-cgnr@msns的制备:
37、将cgnr@msns纳米复合材料分散在四氢呋喃中,然后向其中加入3-氨丙基三甲氧基硅烷,在加热搅拌的条件下进行回流反应,反应结束后离心、洗涤、干燥,得到伯胺功能化cgnr@msns(nh2-cgnr@msns);
38、s4.2.ch3co-cgnr@msns的制备:
39、将nh2-cgnr@msns,乙酰丙酸,n-(3二甲氨基丙基)-n'-乙基碳二亚胺盐酸盐(edc·hcl)、n-羟基琥珀酰亚胺(nhs)和三乙胺溶于四氢呋喃中,室温下搅拌反应,反应结束后,离心、洗涤、干燥,得到β-乙酰丙酰胺衍生物功能化cgnr@msns(ch3co-cgnr@msns);
40、s4.3.nh2-n=cgnr@msns的制备:
41、将ch3co-cgnr@msns分散于甲醇溶液中,向其中加入溶解了二盐酸肼和naoh的甲醇溶液,进行回流反应2,反应结束后离心、洗涤、干燥,得到肼功能化cgnr@msns纳米颗粒(nh2-n=cgnr@msns);
42、s4.4.dota-cgnr@msns纳米颗粒的制备:
43、将nh2-n=cgnr@msns纳米颗粒分散于四氢呋喃中,向其中加入edc·hcl、nhs、1,4,7,10-四氮杂环十二烷-1,4,7,10-四乙酸(dota)和三乙胺,室温下进行搅拌反应2,反应结束后离心、洗涤、干燥,得到dota-cgnr@msns纳米颗粒;
44、s4.5.dotv-cgnr@msns的制备:
45、将dota-cgnr@msns纳米颗粒分散于四氢呋喃中,向其中加入edc·hcl、nhs、2-氨基-4,6-二乙烯基嘧啶(dotv),和三乙胺,室温下进行搅拌反应3,反应结束后离心、洗涤、干燥,得到dotv-cgnr@msns。
46、优选地,步骤s4.1中,cgnr@msns纳米复合材料和3-氨丙基三甲氧基硅烷的用量比为0.1g:1~2mmol;所述回流反应的条件为在80℃下搅拌回流12h;
47、步骤s4.2中,nh2-cgnr@msns、乙酰丙酸、edc·hcl、nhs和三乙胺的用量比为0.1g:1~2mmol:2mmol:2mmol:2mmol,所述搅拌反应的时间为12h;
48、步骤s4.3中,ch3co-cgnr@msns、二盐酸肼、naoh的用量比为0.1g:0.5~1mmol:1~2mmol,所述回流反应2的条件为在80℃下回流2h;
49、步骤s4.4中,nh2-n=cgnr@msns纳米颗粒、edc·hcl、nhs、dota和三乙胺的用量比为0.1g:1~2mmol:1mmol:1mmol:1mmol;所述搅拌反应2的条件为室温下搅拌12h;
50、步骤s4.5中,dota-cgnr@msns纳米颗粒、edc·hcl、nhs、2-氨基-4,6-二乙烯基嘧啶和三乙胺的用量比为0.2g:2~3mmol:3mmol:3mmol:3mmol;所述搅拌反应3的条件为在室温下搅拌12h。
51、s5.多臂anti-cd40抗体介导纳米双药递送体系的制备:
52、将抗肿瘤药物溶于tris-hcl缓冲液中,得到抗肿瘤药物负载液;将anti-cd40和三(2-羧乙基)盐酸盐膦加入到tris-hcl缓冲液中,孵育后得到anti-cd40抗体溶液,备用;
53、将dotv-cgnr@msns与抗肿瘤药物负载液混合,搅拌反应,反应结束后向反应液中加入anti-cd40抗体溶液,搅拌下反应,反应结束后离心,洗涤,得到多臂anti-cd40抗体介导纳米双药递送体系。
54、优选地,步骤s5中,所述抗肿瘤药物包括喜树碱(cpt);
55、所述抗肿瘤药物负载液的浓度为0.2mm,ph值为7.4;
56、所述anti-cd40抗体溶液的制备过程中,anti-cd40、三(2-羧乙基)盐酸盐膦和tris-hcl缓冲液的用量比为0.1ml(3μm):0.2mg:10ml所述孵育的条件为在0℃下孵育2h;
57、所述dotv-cgnr@msns、cpt负载液和anti-cd40抗体溶液的用量比为10mg:10ml(0.2mm):10ml;
58、所述反应的条件为0℃下连续搅拌6h。
59、本发明还提供了上述多臂anti-cd40抗体介导纳米双药递送体系在作为多模态成像制剂中的应用。
60、优选地,所述多模态成像包括磁共振成像、长余辉发光成像和荧光成像。
61、本发明还提供了上述多臂anti-cd40抗体介导纳米双药递送体系在制备治疗肿瘤的药物中的应用。
62、优选地,所述肿瘤包括cd40受体过表达的恶性肿瘤。
63、与现有技术相比,本发明的有益效果在于:
64、(1)本发明中将铬离子掺杂的镓酸锌znga2o4:cr3+(zgc)纳米晶嵌入二氧化硅包覆金纳米棒纳米颗粒gnr@msns的制备方法获得cgnr@msns复合纳米粒子。一方面,所述cgnr@msns复合纳米粒子能够作为药物载体用于抗肿瘤药物靶向输送,另一方面,cgnr@msns复合纳米粒子中掺杂的zgc纳米晶能够作为无机长余辉探针,在led光源照射下能够保持余辉放光时间10分钟,具有较好长余辉发光寿命,能够用于医学成像。
65、(2)本发明所述多臂anti-cd40抗体介导纳米双药递送体系在cgnr@msns复合纳米粒子表面修饰1,4,7,10-四氮杂环十二烷-1,4,7,10-四乙酸(dota)连接二乙烯基嘧啶衍生物(dotv),进而共价偶联anti-cd40抗体作为纳米门。所述anti-cd40单克隆抗体作为免疫调节药物和门控元件,适用于多种肿瘤的治疗,特别应用于cd40受体过表达的恶性肿瘤的联合治疗,能够提高递送体系安全性和化学药物的治疗效果,实现免疫治疗和化学治疗结合的联合治疗策略,改善肿瘤患者的用药体验和治疗效果。
66、并且,cgnr@msns表面的多臂anti-cd40抗体,不仅促进了抗体纳米门对药物分子的包封作用,达到靶向给药的高输送效率,而且提高了anti-cd40抗体与肿瘤细胞表面cd40受体的结合作用力,改善了免疫调节效果,能够应用于肿瘤细胞免疫治疗领域。
67、(3)本发明所述多臂anti-cd40抗体介导纳米双药递送体系同时实现了化学治疗、免疫治疗和光热治疗的结合,对抑制肿瘤细胞增殖有明显的协同作用,发展了用于肿瘤联合治疗的纳米药物,能够应用于肺癌、肝癌和乳腺癌等多种肿瘤的临床治疗。所述多臂anti-cd40抗体介导纳米双药递送体系在弱酸性ph条件下,断开cgnr@msns复合纳米材料表面修饰的酰腙键,打开anti-cd40抗体纳米门,实现负载药物的cpt的可控释放;在近红外照射下,金纳米棒作为光热转换器件,将光能转换为热能引起纳米颗粒周围溶液温度升高,增强了多臂抗体的动态振动,导致抗体纳米门打开,实现了cpt的可控释放。
68、(4)本发明所述多臂anti-cd40抗体介导纳米双药递送体系可以实现荧光成像(fluorescence imaging)、近红外长余辉发光成像(persistent luminescence imaging)和磁共振成像(magnetic resonance imaging)结合的多模态成像。本发明发展了anti-cd40抗体门控的纳米复合粒子药物输送体系,进而通过结合多模态成像提高诊断准确性,并且推动成像引导的联合治疗的发展,发挥化学治疗、免疫治疗和光热治疗的协同作用,优化肿瘤治疗效果,适用于多种恶性实体瘤的治疗。
69、(5)本发明所述多臂anti-cd40抗体介导纳米双药递送体系实现了负载药物cpt对特定肿瘤细胞的靶向递送,anti-cd40抗体能够识别并结合肿瘤细胞表面过表达的cd40受体,其中抗体能够引导药物输送体系靶向肿瘤细胞并提高细胞对药物的摄取效率,并且抗体纳米门的构建减少了药物的提前释放,使其毒性只对肿瘤细胞发挥作用,改善了药物输送体系的毒副作用。
70、(6)本发明所述多臂anti-cd40抗体介导纳米双药递送体系在螯合钆离子后能够作为磁共振成像(mri)造影剂,抗体介导的成像模式能够增强磁共振成像灵敏度。该体系能够同时实现磁共振成像、长余辉发光成像和荧光成像,该多模态成像方法能够应用于生物医学成像、肿瘤诊断和手术导航等领域,与单一成像模式相比,能够提高成像诊断的分辨率和准确性。并且,该体系能够实现led光源照射下的反复充能,具有长的组织穿透深度,在体内深组织成像方面优势明显。
- 还没有人留言评论。精彩留言会获得点赞!