基因工程化超声触发可注射水凝胶及其制备方法与应用与流程
本发明属于水凝胶药物递送系统,具体涉及一种基因工程化超声触发可注射水凝胶及其制备方法与应用。
背景技术:
1、骨质疏松症是一种由多种原因引起的骨密度和骨质下降引起的骨骼疾病。骨质疏松症可分为原发性、继发性和特发性三类,其发病率高、致残率高,一直是骨科领域的一项世界性难题[1]。随着人口老龄化社会的加剧,骨质疏松症的患病率呈现出逐年升高的趋势,严重影响了老年人的生活质量。
2、目前,临床上骨质疏松症以药物治疗为主,主要包括抑制骨吸收药,防止骨过量丢失与促进骨形成药物,刺激成骨细胞活性,但药物种类繁多,且都有其局限性及副作用,需要有针对性选择药物治疗[2]。
3、基因工程技术为基因结构和功能的研究和应用提供了强有力的手段,实现了高效协调组织再生和控制细胞行为,基因治疗骨质疏松症正是当前国内外学者研究的热点之一。随着现代分子生物学技术的不断进步与成熟,研究人员正试图将治疗基因导入动物体内来治疗骨质疏松和骨折。当前处于研究阶段的基因药物有dickkopf-1、骨形成蛋白、骨保护素等[3]。而基因治疗的关键涉及如何准确无误的选择合适的基因片段,以及基因的靶向定位、载体的选择、机体的免疫等一系列纷繁复杂的问题。因此基因工程技术用于骨质疏松症的治疗正有待大力开展。
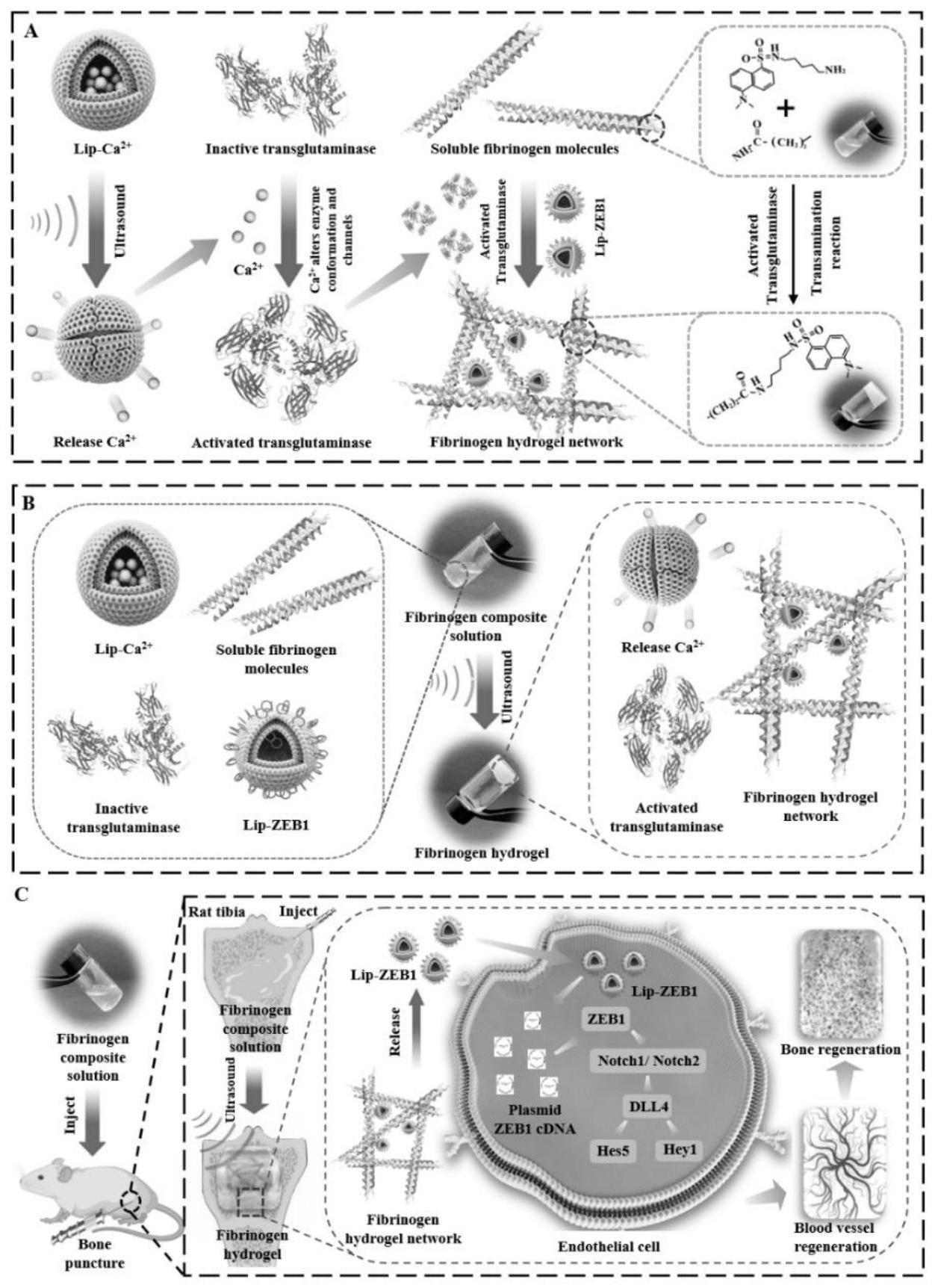
4、目前,纳米颗粒、3d打印支架、水凝胶等多种基因传递载体可以与基因工程策略相结合,实现多种疾病的原位基因治疗。例如,纳米颗粒被用来装载两种生长因子质粒,并与缝合线结合,将两种生长因子基因整合到受伤的肌腱组织中,以促进愈合[4]。水凝胶和携带血管内皮生长因子基因质粒的结合已被证明可以加速烧伤创面愈合和促进微血管生成[5],然而,单一生长因子基因质粒导入内皮细胞后,对血管再生的影响较低。moncal等[6]展示了bmp2质粒dna的成骨生物墨水,通过3d打印支架促进骨修复,但该基因治疗方案在植入材料时创口较大,极有可能造成二次损伤,难以实现微创治疗。
5、因此,现有的纳米颗粒、3d打印支架、水凝胶等载体结合基因治疗促进组织再生的策略还存在许多缺陷,如复杂的质粒体系、单基因治疗方式、无法进行原位微创治疗等。因此,目前的诸多载体在骨重建领域,很难实现先进的基因工程来促进骨再生。
6、为了有效突破基因治疗促进组织重建的瓶颈,各种触发技术如光、磁、电、声等已与基因工程广泛结合。然而,光触发的方式在穿透更深的组织时作用是微弱的,其强度极为有限;磁场触发的强度难以进行精确控制;电场和电疗的方式存在生物安全性低,副作用大。因此,目前磁、电、光等触发技术与基因工程相结合,仍不能满足基因治疗促进组织再生的需要。
7、近年来,超声触发技术作为一种令人兴奋和独特的治疗方法出现,可以跟踪药物传递,在剂量、空间和/或时间上控制治疗,并以较高的空间精度提高药物传递效率。将超声触发技术与水凝胶、微囊泡、纳米囊泡、脂质体、胶束等生物材料结构,有望从不同角度满足不同组织、器官、疾病的基因治疗需求。
8、例如,超声触发的微泡增强了bmp靶基因向内源性干细胞传递的效率,并诱导有效的组织再生和修复[7],该研究发挥了超声触发在基因转染效率上的优势。
9、脂质体是一种生物相容性好的药物载体,使用脂质体进行基因传递时,脂质体载体具有基因组安全性好、免疫原性可忽略、生物相容性好等优点。然而,有限的转染率和较低的包封率阻碍了其在基因治疗中的广泛应用。因此,想要利用脂质体制备基因工程超声触发生物材料来促进骨再生,首先面临着如何提高脂质体的转染效率并实现更好的促进骨组织再生效果的问题。
10、水凝胶是另一种生物相容性好的药物载体,在制备基因工程超声触发水凝胶用于骨修复时,水凝胶的形成时间、超声触发钙离子的释放效率和水凝胶的形态均是影响骨修复效果的关键因素。因此,如何在体内实现原位成胶,并达到成胶速度快,成胶效果好,钙离子释放效果好,成为将该材料用于骨修复的另一大难题。
11、因此,在基因工程超声触发生物材料促进骨组织再生的研究中,一方面使用脂质体材料负载基因药物如何实现较高的转染效率,并实现更好的骨组织再生效果;另一方面在利用水凝胶材料作为基因工程超声触发生物材料的载体时,如何能够实现在体内原位成胶和快速高效成胶,成为治疗骨质疏松症亟待突破的技术问题。
12、[1]潘瑞玲,邵艳清.治疗骨质疏松的药物研究进展[j].北方药学,2010(3):2.doi:cnki:sun:bfyx.0.2010-03-015.
13、[2]reid ir,billington eo.drug therapy for osteoporosis in olderadults[j].the lancet,2022,399(10329):1080-1092.
14、[3]bez m.,sheyn d.,tawackoli w.,avalos p.,shapiro g.,giaconi j.c.,etal.in situ bone tissue engineering via ultrasound-mediated gene delivery toendogenous progenitor cells in mini-pigs.science translational medicine.2017;9(390).
15、[4]zhou y.l.,yang q.q.,yan y.y.,zhang l.,wang q.h.,ju f.,et al.gene-loaded nanoparticle-coated sutures provide effective gene delivery to enhancetendon healing.molecular therapy.2019;27(9):1534-1546.
16、[5]wang p.,huang s.b.,hu z.c.,yang w.,lan y.,zhu j.y.,et al.in situformed anti-inflammatory hydrogel loading plasmid dna encoding vegf for burnwoundhealing.acta biomaterialia.2019;100:191-201.
17、[6]moncal k.k.,aydin r.s.t.,godzik k.p.,acri t.m.,heo d.n.,rizk e.,etal.controlled co-delivery of ppdgf-b and pbmp-2fromintraoperativelybioprinted bone constructs improves the repair of calvarial defects inrats.biomaterials.2022;281.
18、[7]bez m.,sheyn d.,tawackoli w.,avalos p.,shapiro g.,giaconi j.c.,etal.in situ bone tissue engineering via ultrasound-mediated gene delivery toendogenous progenitor cells in mini-pigs.science translational medicine.2017;9(390).
技术实现思路
1、本发明就是为了解决上述技术问题,从而提供一种基因工程化超声触发可注射水凝胶及其制备方法与应用。本发明的技术目的在于,一方面保证基因工程化水凝胶在采用脂质体负载基因时具有较高的转染效率,并能够更好地促进骨组织再生,解决现在脂质体基因工程骨修复材料存在转染效率低、骨再生效果差的问题;另一方面实现可注射水凝胶材料能够在骨组织中更好地原位成胶以及快速成胶,解决现有水凝胶骨修复材料存在成胶时间长的问题。
2、为了实现上述目的,本发明采用的技术方案如下:
3、本发明首先提供了一种基因工程化超声触发可注射水凝胶的制备方法,包括以下步骤:
4、(1)配制289w多肽溶液,然后与二硬脂酰基磷脂酰乙醇胺-聚乙二醇-马来酰亚胺溶液混合,搅拌反应,经透析、冷冻干燥,得到289w-peg-dspe;
5、(2)将二油酰磷脂酰乙醇胺、(2,3-二油酰基-丙基)-三甲胺、胆固醇和289w-peg-dspe混合,溶解于有机溶剂中,经干燥、超声,得到脂质体二;将含有zeb1基因的质粒与脂质体二共孵育,得到负包载有zeb1基因的脂质体,记为lip-zeb1-289w;
6、(3)将卵磷脂、胆固醇和甲氧基聚乙二醇-磷脂酰乙醇胺混合,溶解于有机溶剂中,经干燥成膜,然后与cacl2溶液混合,超声水化,得到载钙脂质体;
7、(4)将纤维蛋白原溶解,与载钙脂质体、lip-zeb1-289w和谷氨酰胺转胺酶混合制备成纤维蛋白原复配液,经超声处理,得到基因工程化超声触发可注射水凝胶。
8、本发明首次成功开发出利用超声技术构建基因工程化水凝胶,在体内超声触发原位交联实现细胞基因转染,最终完成原位基因治疗促进骨重建。首先,载钙脂质体在超声触发下释放钙离子,钙离子改变谷氨酰胺转胺酶的能量配位,引起谷氨酰胺转胺酶构象变化,打开通道,从而激活谷氨酰胺转胺酶。其次,活化的谷氨酰胺转胺酶催化转酰胺化,使纤维蛋白原分子的赖氨酸和谷氨酰胺侧链残基共价交联,同时负载zeb1基因质粒脂质体,从而触发基因工程原位交联可注射水凝胶的形成。第三,基因工程可注射水凝胶可通过lip-zeb1的缓释将zeb1基因质粒导入内皮细胞,使zeb1基因整合到内皮细胞基因组中,持续激活内皮细胞zeb1/notch信号通路,通过基因工程促进血管生成和骨再生,最终实现了先进的基因工程超声触发可注射水凝胶促进骨质疏松骨再生。
9、本发明提供的上述制备方法,超声触发基因工程可注射水凝胶负载了289w修饰的脂质体lip-zeb1,其与负载普通脂质体lip-10相比,大幅度提高了cdna对细胞的转染效率,当n/p为10:1时,细胞转染效率为34.4%。因此,本发明的超声触发基因工程可注射型跨膜肽水凝胶缓释脂质体能够有效转染细胞,完成骨重建。
10、另一方面,如本发明实施例所示,虽然不采用脂质体包载的超声触发基因工程水凝胶组内皮细胞的活力更高,基因转染效率更强,但是由于缺乏脂质体的缓释作用,该水凝胶组的生物相容性出现了下降。因此本发明提供的超声触发基因工程可注射水凝胶材料在保证基因转染效率较高的前提下,还具有生物相容性高的特点。
11、更进一步,本发明方法制备得到的超声触发基因工程可注射水凝胶,具备在骨缺损部位可实现原位成胶,并能实现快速成胶的效果。如本发明实施例所示,在超声触发下本发明组水凝胶的形成时间较其它组明显缩短。本发明中,脂质体的加入进一步缩短了超声触发的基因工程可注射水凝胶的交联时间,另外,超声能显著诱导脂质体中钙离子的释放,从而触发水凝胶的形成。
12、因此,本发明构建的先进基因工程超声触发可注射水凝胶有效解决了现有基因治疗促进组织重建的诸多不足,不仅实现了脂质体在包载基因时可实现较高的转染效率,同时还具有很好的生物相容性;不仅实现了可在骨缺损处原位成胶,还可实现在极短时间内快速成胶,在促进骨再生方面的效果极为显著。因此,本发明提供的基因工程超声触发可注射水凝胶在治疗骨质疏松等退行性疾病方面具有巨大的治疗潜力。
13、进一步的是,步骤(1)中所述289w多肽与二硬脂酰基磷脂酰乙醇胺-聚乙二醇-马来酰亚胺的摩尔比为1.2:1。
14、进一步的是,步骤(1)中所述搅拌反应的时间为4h。
15、进一步的是,步骤(1)中所述透析为采用3.5kda透析袋透析。
16、进一步的是,步骤(2)中所述二油酰磷脂酰乙醇胺、(2,3-二油酰基-丙基)-三甲胺、胆固醇和289w-peg-dspe的摩尔比为40:30:30:2。
17、进一步的是,步骤(2)和(3)中所述有机溶剂为氯仿。
18、进一步的是,步骤(2)和(3)中所述干燥为在60℃下采用旋转蒸发器进行抽真空干燥。
19、进一步的是,步骤(2)和(3)中所述超声的条件为:于超声波功率为3w下超声处理10min。
20、本发明的目的之二是提供一种如上所述方法制备得到的基因工程化超声触发可注射水凝胶。
21、本发明的目的之三是提供如上所述的基因工程化超声触发可注射水凝胶的应用,其是将该水凝胶作为治疗骨退行性疾病方面的药物载体材料,或是将该水凝胶制备成治疗骨退行性疾病方面的药物。
22、本发明的有益效果如下:
23、(1)本发明制备了一种基因工程化超声触发可注射水凝胶,在体内超声触发原位交联实现细胞基因转染,最终完成原位基因治疗促进骨重建。基因工程化超声触发可注射水凝胶可通过脂质体的缓释将zeb1基因质粒导入内皮细胞,使zeb1基因整合到内皮细胞基因组中,持续激活内皮细胞zeb1/notch信号通路,通过基因工程促进血管生成和骨再生,最终实现先进的基因工程超声触发可注射水凝胶促进骨质疏松骨再生。
24、(2)本发明制备的基因工程化超声触发可注射水凝胶不仅生物相容性好、安全性高,而且基因的转染效率高,同时其在体内骨缺损处可原位成胶,并可明显缩短水凝胶的形成时间。
- 还没有人留言评论。精彩留言会获得点赞!