一种联合光动力、肿瘤干细胞分化与化学疗法的给药系统
本发明属于医药领域,具体涉及联合光动力、肿瘤干细胞分化和化疗的给药系统及其制备方法和应用。
背景技术:
1、癌症是全球范围内的重大健康问题,已成为绝大多数国家/地区70岁以下人的主要致死原因。肿瘤的耐药、复发和转移是肿瘤治疗的巨大挑战。肿瘤异质性是恶性肿瘤的重要特征之一,表现为同一肿瘤内存在不同基因型或不同表型的肿瘤细胞。部分肿瘤细胞亚群富含cd133和cd44的表达,且具有干细胞特点,因此被称作肿瘤干细胞(csc)或肿瘤起始细胞。csc在整个肿瘤中所占的百分比非常低,但在恶性肿瘤和低分化肿瘤中占比显著高于一般肿瘤,csc对药物的敏感度很差,是导致肿瘤耐药的原因之一。而且,肿瘤干细胞主要位于肿瘤深处,常规治疗药物很难达到肿瘤干细胞的位置。肿瘤干细胞与正常干细胞有许多共同的特征,如自我更新和分化,促使肿瘤发展和耐药性产生。
2、csc比分化的肿瘤细胞对化疗和放疗具有更强的抵抗力,它们可以逃避常规细胞毒性治疗的影响。因此,分化治疗就成为一种可行的临床治疗方法,利用具有分化功能的药物分子诱导恶性细胞分化成更成熟的表型,使干细胞分化在抗肿瘤治疗中发挥有益作用。例如,全反式维a酸(简写为atra),通过与细胞核上的受体结合调节分化,最早在急性早幼粒细胞白血病患者的治疗中应用。将csc转化为非肿瘤干细胞是肿瘤治疗的方向。
3、正常细胞的氧化与抗氧化维持在相对平衡的状态。活性氧(reactive oxygenspecies,ros)是在线粒体和内质网等细胞器内的各种生化反应中自然产生的。正常细胞的ros一般处于较低的状态,肿瘤细胞内ros水平较正常细胞高几十倍。ros是机体氧化应激时产生的主要分子,被认为是肿瘤发生和发展的重要因素。最新的研究还发现,ros水平升高可通过内源性和外源性途径诱导细胞凋亡,因此增加ros水平可以通过加速肿瘤细胞死亡而达到治疗的目的。
4、近年来,纳米药物或载药纳米递送系统在抗肿瘤治疗中的应用十分广泛。越来越多的纳米治疗药物已经商业化或进入临床阶段,但大多数纳米药物或载药纳米递送系统在体内循环时间较短,显著降低了药物的疗效和效率。通过一些特定手段在纳米载体外层形成保护层,使其具有隐身作用,能逃避网状内皮系统的识别和吞噬,达到长时间血液循环的效果,从而增强其抗肿瘤效果。但仅仅达到长循环效果是不够的,还需要增强药物对肿瘤部位的靶向性和药物在肿瘤部位的浓度,从而提高疗效、减少毒副作用,因此构建靶向纳米载体是非常有潜力的。
5、透明质酸(hyaluronic acid,ha)是细胞外基质的主要成分,是分子量在5~800kda的糖胺聚糖,具有亲水性,并且与肿瘤细胞上高表达的cd44受体有很高的亲和力,因此被视为靶向实体肿瘤的潜在药物。维生素e琥珀酸酯(tos)是维生素e家族中最有效的抗癌化合物之一。tos可以通过多种途径抑制肿瘤生长,主要包括抑制肿瘤增殖、诱导细胞凋亡和防止转移。更重要的是,tos的线粒体靶向性和损伤性使其在与常规化疗药物协同作用和克服多药耐药(mdr)方面表现出巨大潜力。
技术实现思路
1、本发明的目的在于提供一种制备方法简便、结构明确、着眼肿瘤干细胞分化与光动力治疗、化疗联合给药系统。
2、本发明提供的给药系统是以自组装材料为载体,包载光动力药、肿瘤干细胞分化功能分子和化疗药,在注射用水中组装而成的纳米给药系统。
3、进一步的,所述光动力药选自卟啉类光敏剂、酞菁类光敏剂和稠环醌类光敏剂中的一种,具体可选自二氢卟吩e6(chlorin e6,cas号:19660-77-6,分子式:c34h36n4o6)、焦脱镁叶绿酸a(pheophorbide a,cas号:15664-29-6,分子式:c33h34n4o3)中的一种,优选焦脱镁叶绿酸a(简称ppa)。
4、进一步的,所述肿瘤干细胞分化功能分子选自全反式维a酸(all-trans-retinoicacid,retinoic acid,cas号:302-79-4,分子式:c20h28o2)、brd7552(cas号:1137359-47-7,分子式:c33h33n3o15)、头蛋白、尼克酰胺(nicotinamide,cas号:98-92-0,分子式:c6h6n2o)、地塞米松(dexamethasone,cas号:50-02-2,化学式c22h29fo5)、阿糖胞苷(cytarabine,cas号:147-94-4,分子式:c9h13n3o5)中的一种或多种,优选全反式维a酸。
5、进一步的,所述化疗药选自微管抑制剂、烷化剂、抗代谢药、激素、小分子靶向药物中的一种或多种,具体可选自紫杉醇(paclitaxel,cas号:33069-62-4,分子式:c47h51no14)、多西他赛(docetaxel,cas号:114977-28-5;分子式:c43h53no14)、多柔比星(doxorubicinhydrochloride,cas号:25316-40-9,分子式:c27h29no11 hcl)、喜树碱[(+)-camptothecin,cas号:7689-03-4,分子式:c20h16n2o4]、长春新碱(vincristine,cas号:57-22-7,分子式:c46h56n4o10)、氟尿嘧啶(5-fluorouridine,cas号:316-46-1,分子式:c9h11fn2o6)、伊马替尼(imatinib mesylate,cas号:152459-95-5,分子式:c29h31n7o)中的一种,优选多柔比星。
6、本发明提供的给药系统的自组装材料,以透明质酸(cas号:9004-61-9,分子式:(c14h21no11)n,简称ha)为亲水片段,通过接枝的方式偶联亲脂性片段。
7、所述亲脂性片段,选自中长链(c6~c18)脂肪酸(rcooh)、中长链(c6~c18)脂肪胺(rnh2)、中长链(c6~c18)脂肪醇(roh)、磷脂、维生素e琥珀酸酯(d-alpha-tocopherolsuccinate,cas号:4345-03-3,分子式:c33h54o5,简称tos)中的一种,优选维生素e琥珀酸酯。
8、本发明构建两亲性ha-tos自组装纳米递送系统用于药物递送。亲水的ha外壳可以靶向到cd44过表达的肿瘤细胞,疏水的tos用于水溶性差的药物的包封,从而实现靶向递送。此外,tos还可以作为药物外排转运蛋白p-糖蛋白(p-gp)的抑制剂抑制肿瘤耐药。在本发明提供的ha-tos自主装材料中,透明质酸的分子量为6000~35000da,优选为7000~15000da。
9、本发明提供的ha-tos自主装材料中,tos的接枝率的测定方法为核磁共振,在1hnmr谱中,2.5~2.9ppm(α-tos的亚甲基)与1.9~2.1ppm(ha的n-乙酰基)的特征峰的比值,定义为tos的接枝率。本发明提供的ha-tos自主装材料中,tos的接枝率为2%-15%,优选为5%-10%,更优选为6%-9%。
10、在本发明提供的给药系统中,所述光动力药还可以通过酯键、酰胺键或肿瘤环境敏感键与化疗药连接形成偶联物。
11、所述肿瘤环境敏感键可以是ph敏感键或氧化/还原环境敏感键,所述的ph敏感键例如碳酸酯键、酰腙键、亚胺键、腙键、肟键、缩酮键或顺乌头酸苷键,所述的氧化/还原环境敏感键例如硫醚键、二硫醚键、二硫键或酮缩硫醇键。
12、在本发明的一些实施例中,焦脱镁叶绿酸a通过酮缩硫醇键与多柔比星连接的前药偶联物的结构如式i所示:
13、
14、上述前药偶联物的制备方法包括如下步骤:
15、(1)将焦脱镁叶绿酸a溶解于无水四氢呋喃,分别加入氯化亚砜和二甲基甲酰胺,搅拌一段时间后,加入丙烷-2,2-二基双(硫)基二乙酸,搅拌过夜,加入冷正己烷析出沉淀物,过滤,洗涤沉淀物,干燥,即得羧基-酮缩硫醇-焦脱镁叶绿酸a(ppa-tk-cooh);
16、(2)称取适量ppa-tk-cooh、1-(3-二甲氨基丙基)-乙基碳二亚胺(edc)和n-羟基琥珀酰亚胺(nhs),溶解于有机溶剂,搅拌2小时后,加入适量多柔比星(dox),反应一段时间。
17、(3)将反应溶液用去离子水于室温透析,取透析液冻干,即得焦脱镁叶绿酸a-酮缩硫醇-多柔比星(ppa-tk-dox)。
18、本发明所述给药系统的制备方法简单,可以是:称适量自组装材料与光动力药、肿瘤干细胞分化功能分子、化疗药,溶解于适量有机溶剂中制成分散液,将分散液置茄形瓶中,旋转蒸发除去有机溶剂,在瓶壁上形成一层均匀的膜,加入pbs,漩涡震荡水化,然后经历适当的后处理(如透析或柱分离,冷冻干燥等),即得载药纳米给药系统。
19、以自主装材料ha-tos,包载光动力药和化疗药的前药偶联物ppa-tk-dox,以及肿瘤干细胞分化功能分子全反式维a酸为例,该给药系统的制备方法如下:
20、称适量ha-tos溶解于水作为水相,另称适量焦脱镁叶绿酸a-酮缩硫醇-多柔比星(ppa-tk-dox)与全反式维a酸共同溶解于有机溶剂(如二氯甲烷)作为油相,将油、水相混合后,使用探头超声将混合体系制成初级乳状液,通过旋转蒸发除去有机溶剂,即得载药纳米给药系统(ptd/a-nps)。
21、本发明提供的给药系统中多柔比星的载药量为1%-10%,优选为2%-10%,更优选为3%-10%。其中,多柔比星的载药量=(多柔比星的质量/给药系统冻干粉末总质量)×100%。
22、本发明提供的给药系统中全反式维a酸的载药量为2%-6%,优选为3%-6%,更优选为4%-6%。其中,全反式维a酸的载药量=(全反式维a酸的质量/给药系统冻干粉末总质量)×100%。
23、本发明提供的给药系统加适量水分散后,平均粒径在60-300nm之间,优选为60-200nm之间,更优选为60-160nm之间。
24、本发明提供的给药系统应用于抗肿瘤治疗系统,优选地,用于治疗乳腺癌、肺癌、结肠癌、前列腺癌、胰腺癌、卵巢癌。
25、本发明中选用光动力学性质良好的光敏剂ppa、成熟的肿瘤干细胞分化功能分子atra与经典化疗药物多柔比星作为实施例模型分子,三种物质均能获得。
26、本发明提供的给药系统制备方法,采用本领域经典方法制备纳米粒,使用本领域经典的动态光散射法、柱分离法等,对纳米粒的体外性质进行了表征并给出表征的结果。
27、本发明实施例中以小鼠乳腺癌细胞(4t1细胞)作为非肿瘤干细胞模型,采用本领域经典的方法通过流式分选获得4t1侧群干细胞(4t1 sp细胞)作为肿瘤干细胞模型,此两种细胞均为本领域所公认且熟知。
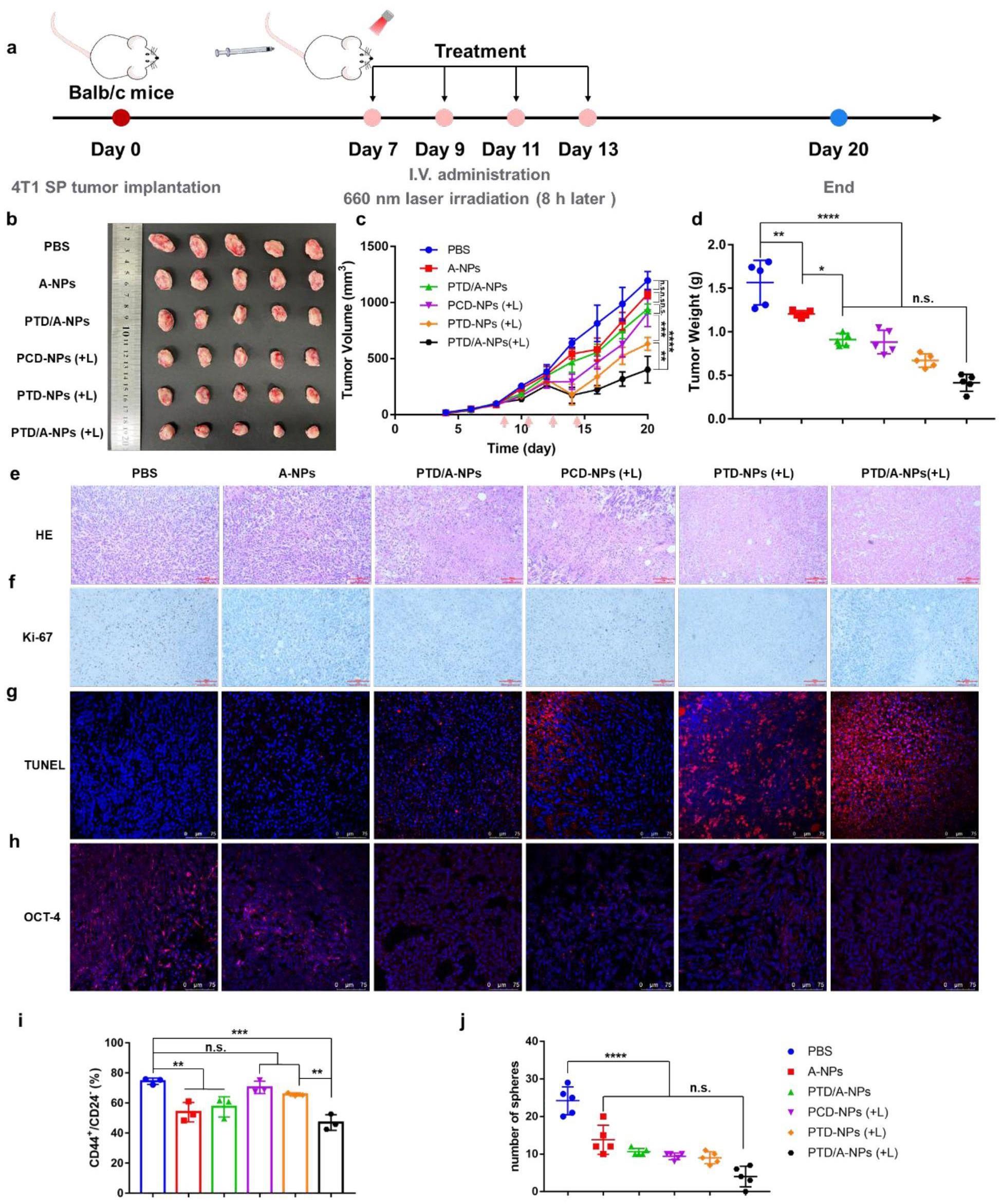
28、本发明选择使用本领域公认的成熟、先进的生物学手段,对本发明给药系统进行体内外评价和机制研究:采用透析法研究组合物纳米粒的释放特征,加入h2o2模拟ros氧化断裂tk键,以测定功能分子的释放速率,结合激光照射后释放速率的变化,推测化合物或组合物体内作用细节;利用干细胞具有cd44+/cd24群体丰富、干细胞相关因子表达高的特点,用pe-cd44和fitc-cd24抗体对细胞进行染色,并使用流式细胞仪进行分析,此外,用蛋白质印迹分析技术检测肿瘤干细胞标志物——sox2、nanog和oct4的表达水平,该实验不仅用于鉴定细胞干性,还用于评价本发明组合物纳米粒分化肿瘤细胞干性的能力;采用dcfh-da探针法检测细胞内活性氧的产生,结合激光照射,使用激光共聚焦显微镜和流式细胞仪考察本发明组合物纳米粒是否具有提高细胞内ros表达的能力;使用划痕实验和transwell板(加基质胶)实验评价本发明组合物纳米粒体外抗肿瘤细胞侵袭、迁移能力;构建建立3d肿瘤球模型,使用激光共聚焦显微镜观察本发明给药系统渗透进入肿瘤的深度,探索给药系统能否深入肿瘤内部的干细胞群;在给药系统作用下将4t1 sp细胞接种于balb/c雌性小鼠构建原位肿瘤,观察肿瘤形成和发展,以评价给药系统对4t1细胞致瘤能力的作用;于balb/c雌性小鼠原位构建4t1 sp肿瘤模型,检测肿瘤抑制率、tunel分析肿瘤细胞凋亡、h&e染色观察肿瘤转移、分析干细胞因子下调、测定血常规,该研究目的在于评价本发明给药系统体内抗肿瘤干细胞活性。
29、本发明首次公开了肿瘤干细胞分化与光动力治疗、化疗联合应用的给药系统,具有以下有益效果:1)本发明提供了简单、快速的给药系统制备方法,制得给药系统稳定性好,能实现多种活性分子的高效共装载;2)本发明提供的载体材料透明质酸对cd44(一种肿瘤细胞表面过度表达的受体)具有很强的亲和力,使给药系统具有良好的肿瘤靶向性;3)本发明提出一种全新的自反馈模式治疗策略,本发明提供的给药系统包载的肿瘤干细胞分化功能分子首先通过给药系统纳米粒的扩散和/或膨胀而释放,促使肿瘤干细胞分化为非干细胞,上调胞内ros表达水平,产生更多的ros以断裂偶联物结构中的敏感键(如酮缩硫醇键),引起光敏剂和化疗药的同时释放,发挥光动力治疗和化疗作用,最终杀死非肿瘤干细胞。同时,激光照射后的光敏剂也会产生更多的ros,进一步断裂tk键释放更多的光敏剂和化疗药,发挥更强的杀伤肿瘤功效。随着化学键断裂引起纳米粒的解散,更多的肿瘤干细胞分化功能分子进一步被释放并渗透到肿瘤中心的肿瘤干细胞密集区,促进肿瘤干细胞转化,突破肿瘤异质性和耐药性;4)本发明提供的联合干细胞分化、光动力治疗联合化疗策略,重复运行分化与消灭策略模式,形成一个增强肿瘤治疗效果的良性循环。
- 还没有人留言评论。精彩留言会获得点赞!