一种多功能纳米免疫调节制剂及其制备方法与免疫系统重塑的抗肿瘤应用
本发明属于生物医学材料领域,具体涉及一种多功能纳米免疫调节制剂及其制备方法与免疫系统重塑的抗肿瘤应用。
背景技术:
1、癌症免疫疗法通过对患者自身免疫系统进行重塑来根除癌细胞,已在临床上被证明是一种具有重要应用前景的治疗策略。当前,癌症免疫疗法主要有免疫检查点阻断(icb)疗法、细胞因子疗法、癌症疫苗和嵌合抗原受体(car)t细胞疗法等,然而,这些疗法通常只通过缓解肿瘤免疫抑制微环境或激活细胞免疫反应的单一途径,以抑制肿瘤生长、转移和复发。这种单一免疫治疗效果有限,往往只在一小部分患者中具有治疗效果。
2、多通路靶向联合治疗,有望弥补单一免疫治疗的缺陷,如基于低剂量化疗可诱导肿瘤免疫原性细胞死亡(icd)的作用,可开发化疗与免疫协同的治疗方法。然而,该方式会产生过激的免疫反应,导致淋巴耗竭,或增强肿瘤的免疫抑制反应。可见,通过多种途径,一味增强抗肿瘤免疫反应,亦不能达到安全有效的抗肿瘤治疗效果。
3、免疫检查点抑制剂(ici)可阻断肿瘤的免疫抑制作用,使免疫系统得以识别并杀伤肿瘤,当前,亦有诸如pd-1,pdl-1,ido-1,cd47等靶点靶向的免疫检查点抑制剂,被开发用于临床研究。然而,仅阻断肿瘤的免疫抑制作用,亦不能使免疫系统充分发挥其抗肿瘤作用,且随之而来还会产生耐药、自身免疫相关副作用及器官毒性等。
4、为弥补激活抗肿瘤免疫反应与抑制肿瘤免疫抑制作用这两种治疗方式的缺陷,可开发在激活免疫反应的同时,阻断肿瘤免疫抑制的双重抗肿瘤免疫治疗策略。在该治疗策略中,免疫激活剂(如低剂量的化疗药物、肿瘤疫苗、免疫激动剂等)可刺激免疫系统,产生更多的抗肿瘤免疫细胞,分泌大量抗肿瘤细胞因子;于此同时,免疫抑制阻断剂(如免疫检查点小分子抑制剂、可沉默免疫检查点基因表达的小干扰核酸(sirna)分子等)则可降低肿瘤对免疫系统的抵御作用,使增强的抗肿瘤免疫系统得以有效识别并杀伤肿瘤细胞。该方法能有效避免对免疫系统的过度激活与抑制,双重调节并平衡免疫系统的抗肿瘤反应,有望真正实现安全有效的抗肿瘤免疫治疗。然而,免疫激活剂与免疫抑制阻断剂要发挥作用,需能有效到达体内特定部位并与特定细胞相互作用,游离药物往往不具有体内分布的靶向性,且在生物体内还存在易降解、易被清除等问题。
5、纳米制剂因其纳米尺寸效应,具有诸如靶向输送药物到目标作用靶点、延长体内循环时间、缓控式释放药物、提高药物的稳定性和疗效、降低药物毒副作用、提高药物溶解程度和速度、利于储存和运输、可改变给药途径等特性,在多种药物的靶向递送中具有重要应用前景。金属有机框架材料(mof)是一类由金属结点与有机配体的配位作用连接而成的新型材料,其中,沸石咪唑酯骨架-8(zif-8)因其巨大的孔隙率、结构可调、易修饰、ph响应降解和良好的生物相容性,有望在药物的靶向可控递送中发挥重要作用。与载体材料相比,zif-8具有以下特点:1)zif-8由2-甲基咪唑和zn2+组成,锌是生物体内第二丰富的过渡金属,而咪唑基团是组氨酸的组成部分,生物相容性高;2)zif-8具有特殊的化学和热稳定性,在中性条件下稳定存在,而在酸性条件下容易分解,有利于ph控制载荷药物的释放;3)zif-8的合成是一种温和的仿生矿化过程,可用于包埋酶、dna和蛋白质等多种生物大分子,且不影响其生物活性。此外,zif-8载体自身具有其特殊的生物活性(如诱发自噬等),其生物活性可与所装载的药物产生协同作用,从而发挥更强的疾病治疗作用。然而,裸露的zif-8纳米颗粒在体内仍不稳定,亦被巨噬吞噬系统清除。
6、细胞膜“隐身技术”通过在纳米颗粒表面包覆细胞膜,可使纳米颗粒模拟源细胞的表面性质,从而提高其稳定性、靶向性、长循环等性能,如基于巨噬细胞膜包被的zif-8纳米颗粒,可被用于多种药物的肿瘤或炎症靶向递送中。然而,当前未有基于巨噬细胞膜仿生化zif-8纳米载体用于抗肿瘤免疫激活及阻断免疫抑制药物的靶向共递送中,其递送过程及抗肿瘤免疫应用仍鲜有报道。
技术实现思路
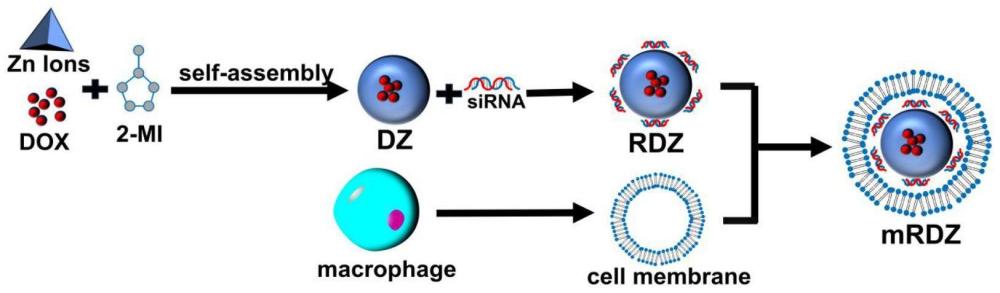
1、针对上述问题,本发明提供了一种基于细胞膜仿生化zif-8的多功能纳米免疫调节剂系统。通过沸石咪唑啉酸盐骨架-8(zif-8)包裹化疗药物dox,负载靶向ido-1的sirna,并且给予该纳米颗粒巨噬细胞膜(raw 264.7)涂层,最终构建了mrdz仿生化多功能纳米免疫调节制剂,实现了基于icd,ido1和自噬的三通路靶向协同抗肿瘤。
2、本发明mrdz的多途径激活,可提高杀伤性免疫细胞在肿瘤微环境、肿瘤引流淋巴结、脾脏中的浸润及数量,同时降低抑制性免疫细胞的数量,相应细胞因子也表现出与免疫细胞相似的变化趋势,更重要的是,激活的抗肿瘤免疫响应表现出显著的免疫记忆性。这种肿瘤组织局部与全身性的免疫系统重塑,使得mrdz可有效抑制肿瘤生长,并阻碍二次接种的肿瘤生长。
3、本发明的技术方案如下:
4、一种多功能纳米免疫调节制剂,由金属有机框架材料包裹化疗药物并负载免疫抑制阻断剂之后,再经巨噬细胞膜包膜而得;
5、其中,
6、金属有机框架材料为zif-8;
7、化疗药物为dox(阿霉素);
8、免疫抑制阻断剂为sirna;
9、巨噬细胞膜为raw264.7细胞中提取的细胞膜。
10、本发明所述的多功能纳米免疫调节制剂的制备方法,包括如下步骤:
11、(1)将六水合硝酸锌溶液和dox溶液混合,搅拌下加入2-甲基咪唑溶液,继续搅拌0.5~2h,离心,收集沉淀,得到dz载药纳米颗粒;
12、优选六水合硝酸锌溶液的浓度为2mg/ml,溶剂为纯水;
13、优选dox溶液的浓度为1mg/ml,溶剂为纯水;
14、优选2-甲基咪唑溶液的浓度为40mg/ml,溶剂为纯水;
15、优选六水合硝酸锌溶液、dox溶液、2-甲基咪唑溶液的体积比为4:1:4;
16、该步中,由于金属离子和有机配体的自组装配位反应,迅速形成中空网状晶体结构,此时dox被包封在中空网状晶体结构内部,得到包裹药物的dz纳米颗粒;
17、(2)将步骤(1)所得dz载药纳米颗粒与sirna混合,室温静置,通过静电吸附作用sirna被吸附到dz载药纳米颗粒表面,形成rdz纳米颗粒;
18、优选dz载药纳米颗粒包封的dox与sirna的质量比为25:1;
19、优选室温静置的时间为30min;
20、(3)从raw264.7细胞中提取细胞膜,将步骤(2)所得rdz纳米颗粒与提取所得细胞膜混合进行冰浴超声包膜,之后离心,收集得到mrdz纳米颗粒(即所述的多功能纳米免疫调节制剂);
21、从raw264.7细胞中提取细胞膜后,用bca试剂盒定量,提取效率约为每100万细胞提取1mg膜蛋白量;优选rdz纳米颗粒与巨噬细胞膜膜蛋白量的质量比为10:1;
22、优选超声的时间为30min。
23、本发明所述的多功能纳米免疫调节制剂可用于制备免疫系统重塑的抗肿瘤药物,具体的肿瘤例如结肠癌。
24、本发明所述的多功能纳米免疫调节制剂的作用机制如下:
25、本发明基于icd,ido1和自噬三者相互协同的“三联疗法”的仿生化多功能纳米免疫调节系统,主要包括以下几部分:icd的诱导,ido1的沉默和自噬的激活。免疫原性细胞死亡(icd)作为一种特殊的细胞死亡形式,能够触发针对死亡细胞相关抗原的特异性免疫反应。阿霉素(dox)等化疗药物不仅可诱导肿瘤细胞损伤,还可诱导icd效应。icd依赖于一系列损伤相关分子模式(damps)的协调表达和释放,包括内质网伴侣蛋白(crt)暴露、三磷酸腺苷(atp)分泌和高迁移率族蛋白1(hmgb1)释放。不过化疗药物杀死的肿瘤细胞具有的免疫原性非常弱,因为化疗药物例如阿霉素(dox)诱导icd的同时,也会通过ctl分泌的干扰素-γ(ifn-γ)导致ido1上调,从而出现免疫抑制现象;吲哚胺2,3-双加氧酶1(ido1)是肿瘤免疫微环境中的一种重要免疫抑制因子,其在肿瘤组织中高表达,起着关键的免疫抑制作用。此外,ido1的高表达可通过激活pi3k/akt通路来抵抗应激诱导的细胞凋亡并抑制自噬;自噬是一种自我降解的活动,通过膜将部分胞质和细胞内需降解的细胞器、蛋白质等组分包裹起来形成自噬体,然后与溶酶体融合形成自噬溶酶体,最终降解其所包裹的内容物的过程。其被作为icd的“使能器”,因为它可以促进atp的分泌和诱导显著的抗肿瘤免疫反应。因此,自噬的激活能够增强icd效应诱导的免疫应答。
26、在基于icd,ido1和自噬三者相互协同的“三联疗法”的仿生化多功能纳米免疫调节系统中,所述icd的诱导是依靠能诱导icd的化疗药物(dox),所述ido1的沉默是依靠能诱导ido1基因沉默的功能性sirna(sirnaido1),所述自噬的激活是依靠能激活自噬的纳米材料(zif-8)。通过诱导自噬的纳米材料(zif-8)包裹诱导icd的化疗药物(dox),并且负载上能沉默ido1基因的功能性sirna(sirnaido1)。此外,为了使其能够逃避单核吞噬系统(mps)的清除,靶向肿瘤部位,并且进入到肿瘤内部缺氧区,赋予了其巨噬细胞膜涂层。
27、基于icd,ido1和自噬三者相互协同的“三联疗法”的仿生化多功能纳米免疫调节系统具有众多优势:1)与未涂层相比,巨噬细胞膜的涂层,使得mrdz能够逃避mps清除,靶向肿瘤,并且进入肿瘤内部缺氧区,提高纳米颗粒在体内循环时间,从而产生更好的治疗效果;2)单独的dox在诱导icd效应,激活特异性免疫反应的同时,会诱导ido1高表达,从而出现免疫抑制,减弱特异性免疫反应的问题;而当dox与sirnaido1联合使用时,则避免出现了上述的问题;3)与单一的免疫检查点抑制剂相比,sirnaido1的特异性更高,可直接靶向性抑制免疫抑制基因ido1;4)zif-8诱导的自噬会促进icd效应,同时sirnaido1抑制ido1而促进自噬,从而放大了icd效应。
28、本发明的有益效果在于:
29、1.本发明所述的基于icd,ido1和自噬三者相互协同的“三联疗法”的仿生化多功能纳米免疫调节系统,其中基础材料zif-8由无机锌离子通过2-甲基咪唑盐键连接而成,不仅可以通过简单、低成本的生物矿化过程来包埋酶、dna和蛋白质等多种生物大分子,可以防止生物大分子的泄露,保持其生物活性。而且在生理条件下稳定,在酸性条件下分解,可用于构建ph敏感的药物递送系统,能够实现对肿瘤细胞内微环境的响应。当位于酸性的肿瘤微环境中时,可响应性释放药物。此外,作为zif-8结构组成中的金属离子也有着独特的优势。金属离子可以作为提高抗癌免疫力的元素,发挥清除肿瘤的功能。
30、2.本发明所述的基于icd,ido1和自噬三者相互协同的“三联疗法”的仿生化多功能纳米免疫调节系统,通过低张溶解过程排空内部以获得细胞膜,巨噬细胞膜的涂层可以通过挤压或在超声波中实现。巨噬细胞膜的涂层不仅赋予其逃避单核吞噬系统(mps)清除和靶向肿瘤部位的能力,而且有助于延长纳米颗粒在体内的循环时间,从而进一步提高药物递送效率和治疗效果。
31、3.本发明所述的基于icd,ido1和自噬三者相互协同的“三联疗法”的仿生化多功能纳米免疫调节系统,通过简单有效的zif-8材料将自噬,icd和ido1三者相互协同,这种“三联疗法”相较于传统纳米免疫疗法具有显著的优势。仿生化多功能纳米免疫调节剂mrdz可激活抗肿瘤免疫反应,重塑肿瘤免疫抑制微环境和重构了肿瘤相关巨噬细胞(tam),可选择性诱导cd8+t细胞从脾脏迁移到肿瘤,并激发了强大的免疫记忆反应。此外,mrdz能够有效抑制原发肿瘤的生长,抑制肿瘤转移,并且防止肿瘤的复发。
- 还没有人留言评论。精彩留言会获得点赞!