花生四烯酸抑制剂在改善肿瘤免疫微环境中的应用
本发明涉及肿瘤免疫领域,具体涉及花生四烯酸抑制剂在制备改善肿瘤免疫微环境的药物中的应用。
背景技术:
1、肿瘤微环境(tme)是一种营养贫乏、缺氧和酸性的环境,在该环境下,效应t细胞的代谢方式只能从氧化磷酸化转变为有氧糖酵解。但由于营养缺乏,葡萄糖不足,因此不利于效应t细胞的生存和功能。但调节性t细胞(treg)依赖于氧化磷酸化,可以利用乳酸和脂肪酸代谢,被认为在tme中具有增殖和功能优势。由于treg细胞对免疫细胞的抑制作用,所以肿瘤免疫微环境中的treg细胞现在被认为是有效抗肿瘤免疫的障碍。
2、treg细胞作为免疫系统的主要调节细胞,treg细胞的全身耗竭可能同时引发有害的自身免疫。因此,抑制treg细胞功能的同时避免treg细胞的foxp3表达失调在抗肿瘤过程十分重要。treg细胞ifn-γ分泌上调,但foxp3表达无明显下降的现象,被称为treg细胞脆性状态,是一种介于稳定和功能失衡之间的状态。脆性treg细胞无法抑制cd8+t细胞分泌ifng,恢复了cd8+t细胞的肿瘤杀伤功能。现有文献表明,抗pd1、抗gitr的有效肿瘤治疗都具有treg细胞脆性表型,因此诱导treg细胞获得脆性,提高cd8+t细胞的效应功能,可能是改善肿瘤免疫微环境,提高肿瘤免疫治疗效果的重要手段。
3、近年来,越来越多的证据表明,肿瘤微环境中的炎症和血管生成与肿瘤发生有关。内源性脂质类化合物及局部作用的小分子介质,被统称为类花生酸,在炎症和组织稳态中起核心作用,与癌症发展有关。最广为人知的类花生酸是花生四烯酸(aa)的代谢产物,包括前列腺素、白三烯和细胞色素p450(cyp)衍生的代谢物等。这些类花生酸可能参与肿瘤的存活和生长,以及促进支持肿瘤进展的机制过程。
4、花生四烯酸是一种储存在膜磷脂中的必需脂肪酸,是一种ω-6多不饱和脂肪酸。花生四烯酸的代谢产物是ppar通路的配体,能够调节ppar通路进而改变t细胞的分化命运。前列腺素和白三烯作为花生四烯酸的代谢产物,被称为ppar激动剂,具有调节ppar通路活性的功能。ppar是转录因子过氧化物酶体增殖激活受体,属于转录因子核激素受体超家族的亚科,包括pparα,pparγ和pparδ(也称为pparβ)三种亚型。作为代谢的关键调节因子,ppar指导各种免疫细胞类型的分化、扩增和命运。因此花生四烯酸可能通过代谢影响ppar通路的活性相关蛋白,进而影响肿瘤环境下免疫细胞的命运。
技术实现思路
1、本发明是鉴于上述的现有技术而完成的,其目的在于提供花生四烯酸抑制剂在制备改善肿瘤免疫微环境的药物中的应用。
2、本发明人为了解决上述问题,进行了深入研究。其结果首次发现使用花生四烯酸抑制剂能够通过诱导肿瘤免疫微环境中的treg细胞产生脆性,可恢复cd8+t细胞的肿瘤杀伤功能,进而可改善肿瘤免疫微环境。由此,本发明提供了以下几个方面:
3、1.花生四烯酸抑制剂在制备改善肿瘤免疫微环境的药物中的应用。
4、2.根据项1所述的应用,其中所述花生四烯酸抑制剂提高效应cd8+t细胞分泌的穿孔素和ifn-γ比例以及表达量。
5、3.根据项1所述的应用,其中所述花生四烯酸抑制剂提高treg细胞分泌的ifn-γ和il-17a比例以及表达量。
6、4.根据项1~3中任一项所述的应用,其中所述花生四烯酸抑制剂为花生四烯酰氟膦酸甲酯。
7、5.根据项1~3中任一项所述的应用,其中所述花生四烯酸抑制的浓度为1~5mg/kg。
8、6.根据项1~3中任一项所述的应用,其中所述肿瘤选自黑色素瘤、肝癌、皮下肿瘤。
9、根据本发明,花生四烯酸抑制剂能够通过诱导肿瘤免疫微环境中的treg细胞产生脆性,可恢复cd8+t细胞的肿瘤杀伤功能,进而可改善肿瘤免疫微环境,因此在提高肿瘤免疫效果产生积极影响,为提高临床肿瘤治疗效果奠定理论基础。
10、附图简单说明
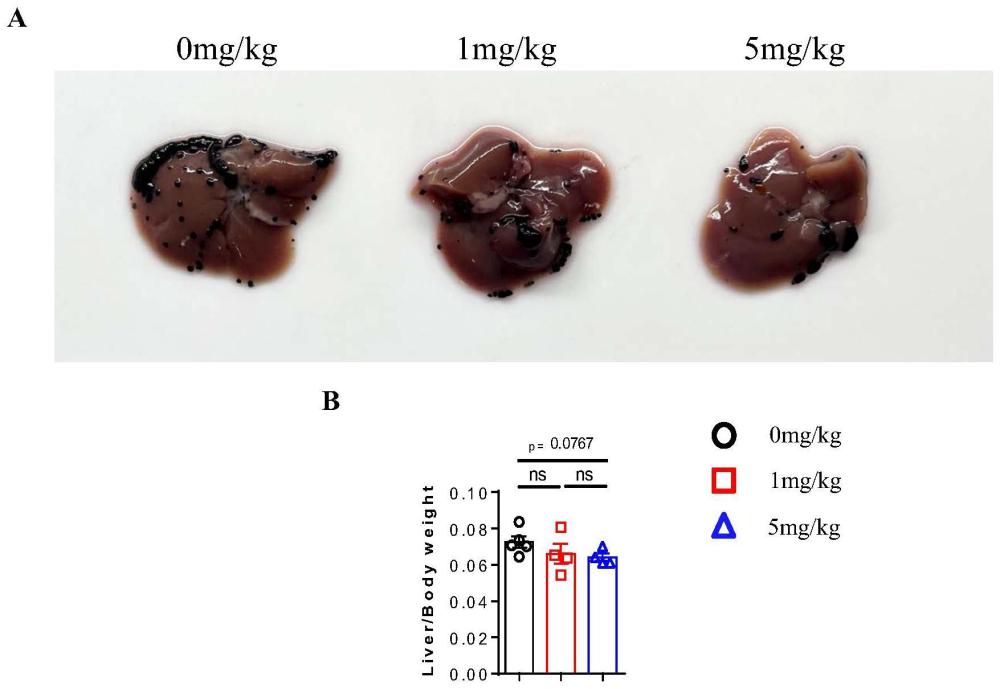
11、图1为本发明实施例1中肝癌模型下,使用不同浓度花生四烯酸抑制剂的肿瘤表型结果。(a为肿瘤大小的照片;b为肿瘤重量与小鼠重量的比值)
12、图2为本发明实施例2中肝癌模型下,使用不同浓度花生四烯酸抑制剂后肿瘤免疫微环境中cd4+t细胞和cd8+t细胞的情况。(a为cd4+t细胞比例和数量;b为cd8+t细胞比例和数量)
13、图3为本发明实施例2中肝癌模型下,使用不同浓度花生四烯酸抑制剂后肿瘤免疫微环境中cd4+t细胞分化的情况。(a为cd4+t细胞分化为th1细胞的比例和数量;b为cd4+t细胞分化为th17细胞的比例和数量)
14、图4为本发明实施例2中肝癌模型下,使用不同浓度花生四烯酸抑制剂后肿瘤免疫微环境中cd8+t细胞发挥效应功能分子的情况。(a为效应cd8+t细胞中gzmb的比例和表达情况;b为效应cd8+t细胞中穿孔素(perforin)的比例和表达情况;c为效应cd8+t细胞中ifn-γ的比例和表达情况)
15、图5为本发明实施例2中肝癌模型下,使用不同浓度花生四烯酸抑制剂后肿瘤免疫微环境中treg细胞相关情况。(a为treg细胞的比例和数量;b为treg细胞分泌的ifn-γ的比例和表达量;c为treg细胞分泌的il17-a的比例和表达量)
16、图6为本发明实施例3中皮下肿瘤模型下,注射1×pbs溶剂的对照组和使用花生四烯酸抑制剂后肿瘤表型结果。(a为肿瘤大小的照片;b为皮下肿瘤体积生长曲线;c为肿瘤重量)
17、图7为本发明实施例3中皮下肿瘤模型下,注射1×pbs溶剂的对照组和使用花生四烯酸抑制剂后肿瘤免疫微环境中cd4+t细胞和cd8+t细胞的情况。(a为cd4+t细胞比例和数量;b为cd8+t细胞比例和数量)
18、图8为本发明实施例3中皮下肿瘤模型下,注射1×pbs溶剂的对照组和使用花生四烯酸抑制剂后肿瘤免疫微环境中cd4+t细胞分化的情况。(a为cd4+t细胞分化为th1细胞的比例和数量;b为cd4+t细胞分化为th17细胞的比例和数量)
19、图9为本发明实施例3中皮下肿瘤模型下,注射1×pbs溶剂的对照组和使用花生四烯酸抑制剂后肿瘤免疫微环境中cd8+t细胞发挥效应功能分子的情况。(a为效应cd8+t细胞中ifn-γ的比例和表达情况;b为效应cd8+t细胞中perforin的比例和表达情况)
20、图10为本发明实施例3中皮下肿瘤模型下,注射1×pbs溶剂的对照组和使用花生四烯酸抑制剂后肿瘤免疫微环境中treg细胞相关情况。(a为treg细胞的比例和数量;b为treg细胞分泌的ifn-γ的比例和表达量;c为treg细胞分泌的il17-a的比例和表达量)。
21、发明的具体实施方式
22、为使本发明的目的、技术方案和优点更加清楚明白,以下结合具体实施例,并参照附图,对本发明进一步详细说明。
23、下述实施例中所用方法如无特别说明均为常规方法,所用的试剂如无特别说明均为可商购的试剂。
24、本实验使用的小鼠为wild-type(wt)c57bl/6,基因型为foxp3-yfp-cre。在正常条件下饲养,12小时光照和黑暗循环周期处理,自由取食和取水。
25、本实验中,作为肿瘤使用黑色素瘤,具体使用b16-f10黑色素瘤细胞(从atcc购买)。将该b16-f10黑色素瘤细胞采用含10%的胎牛血清(c04001-020,bi),1%三抗(s120jv,basalmedia)的rpmi-1640(c3010-0500,vivacell)培养基在37℃,5% co2的培养箱中培养,贴壁至80%左右传代,得到b16-f10细胞系,以下所有实验均使用指数生长的细胞进行。
26、本实验使用的花生四烯酸抑制剂为花生四烯酰氟膦酸甲酯(methyl arachidonylfluorophosphonate,mafp,188404-10-6,cayman),由于其使用的浓度较低,所以使用1×pbs缓冲液(bl302a,biosharp)作为溶剂溶解药物。
27、实施例1:不同浓度花生四烯酸抑制剂治疗肿瘤效果的表型观察
28、为了确定花生四烯酸抑制剂对于治疗肿瘤是否具有效果,首先对野生型小鼠荷瘤,使用不同浓度的花生四烯酸抑制剂进行治疗,观察使用花生四烯酸抑制剂治疗后小鼠肿瘤的表型变化。
29、1、实验材料及处理
30、mafp工作液:mafp的初始浓度是10mg/kg,根据试剂的说明书,使用1×pbs进行浓度稀释,获得不同浓度的工作液,现用现配。
31、2、实验方法
32、2.1建立肿瘤模型
33、将小鼠麻醉,用手术直剪在小鼠左肋骨下方剪开长度约1cm左右的表皮与腹膜,将脾脏轻柔拉出腹腔,在脾脏处用1ml胰岛素注射器,注射b16-f10细胞,细胞数量为每只5×105个,注射体积为100μl。注射后等待五分钟,使细胞有充足的时间经血液循环至肝脏。五分钟后,使用可吸收手术缝合线对脾脏两端血管处进行结扎并随即摘除脾脏,再用可吸收手术缝合线缝合内皮,最后用皮肤缝合器固定夹紧外皮。整个过程小鼠保持麻醉状态,且均遵循无菌操作原则。
34、2.2使用mafp进行肿瘤治疗
35、从肿瘤建立第五天开始,使用mafp对小鼠进行肿瘤治疗,注射方式为腹腔注射,注射频率为2天一次,共5次,其中注射浓度分别设置0mg/kg、1mg/kg、5mg/kg、10mg/kg,注射体积为200μl。
36、2.3观察抗肿瘤效果
37、治疗结束后,在肿瘤建立的第14天,牺牲小鼠。牺牲前测量小鼠体重,取肝脏器官拍照,并测量肝脏肿瘤体重,观察肝脏肿瘤的表型。
38、3、结果分析
39、结果如图1a,mafp注射浓度为10mg/kg的小鼠,无法承受药物的刺激,全部死亡。而与0mg/kg的空白对照组相比,使用1mg/kg和5mg/kg mafp的小鼠肝癌发展程度更低,具有较好的抗肿瘤表型;结果如图1b,与0mg/kg的空白对照组相比,使用5mg/kg mafp的小鼠肝脏肿瘤与体重的比值更低,肿瘤症状较轻,具有较好的抗肿瘤表型。
40、实施例2:不同浓度花生四烯酸抑制剂作用于肿瘤免疫微环境的分析
41、通过实验例1已经观察到花生四烯酸抑制剂具有较好的抗肿瘤效果,为了分析其对肿瘤免疫微环境的影响,本实验展开了对肿瘤环境中淋巴细胞的相关流式分析。
42、1、实验材料及处理
43、相关流式抗体:
44、pe:gzmb(mhgb04,eb)il17a(12-7177-81,eb)
45、percp-cy5.5:cd44(560570,bd)ifng(45-7311-80,eb)
46、pe-cy7:cd44(25-0441-82,eb)
47、apc:cd45.2(109814,biolegend)perforin(154304,biolegend)
48、apc-efluor 780:cd45.2(47-0454-82,eb)
49、pb450:nk1.1(562921,bd)
50、ko525:cd4(563106,bd)cd8(563068,bd)
51、rp10培养基:向1640培养基中加入10%胎牛血清,得到rp10培养基。
52、100% percoll:将percoll原液(17089109,cytiva)与10×pbs缓冲液(bl316a,biosharp)以9:1比例配置成混合液100% percoll。
53、42% percoll:取42ml 100% percoll与58ml 1×pbs混合配置成42%percoll混合液,现配现用。
54、70% percoll:取70ml 100% percoll与30ml 1×pbs混合配置成70%percoll混合液,现配现用。
55、facs缓冲液:向1×pbs缓冲液中加入5%胎牛血清,得到facs缓冲液。
56、2、实验方法
57、2.1肝脏肿瘤淋巴细胞分离
58、分别设置0mg/kg、1mg/kg、5mg/kg组,使用与组名相对应浓度的花生四烯酸抑制剂对荷瘤的野生型小鼠进行治疗,具体步骤同实施例1相同。在肿瘤建立的第14天,牺牲小鼠,取出肝脏肿瘤组织。
59、将200目不锈钢筛网置于10cm细胞培养皿上,再将肝脏放置筛网上,加少许rp10培养基进行研磨。将研磨液转移至50ml离心管中,加入适量rp10培养基使得每管液体体积均为40ml。
60、将离心管中的液体上下颠倒混匀,立刻4℃,50g,离心1min,再转移上层液体至新50ml离心管中。补齐液体体积至40ml,4℃,500g,离心5min,弃上清,留下离心管中的沉淀物。
61、先取3ml 70% peroll加入至新的15ml离心管中,再用3ml 42%percoll重悬上一操作步骤得到的沉淀,充分混匀后,轻轻加于70% percoll上。
62、进行密度梯度离心。设置离心机:室温23℃,750g,升速为6,降速为2,离心30min。
63、离心结束后,轻缓从离心机中拿出离心管,用3ml巴氏滴管吸取中间白膜层淋巴细胞,转移至新15ml离心管中,加入适量rp10培养基将液体补齐至10ml,上下颠倒混匀后,4℃,500g,离心5min,弃上清,留下离心管底部沉淀的肝脏淋巴细胞。
64、再加入1ml红细胞裂解液,重悬混匀细胞,静置3min,加入rp10培养基至液体体积为10ml,上下颠倒混匀后,4℃,500g,离心5min,弃上清。
65、加入1ml facs缓冲液重悬沉淀细胞,并过滤转移至新1.5ml ep管,用于后续细胞计数和流式染色。
66、2.2流式细胞术检测细胞表面分子
67、向96孔板中加入2.1步骤所得的细胞悬液,每孔加入100μl。
68、4℃,1500rpm,离心5min,弃上清,细胞沉淀于96孔板底部。
69、将外标抗体与facs缓冲液按一定比例混合后加入96孔板中,每孔加入100μl。重悬沉淀细胞,4℃避光孵育40min,隔20分钟吹匀一次。
70、孵育结束后,向96孔板中加入facs缓冲液,每孔加100μl,4℃,1500rpm,离心5min,弃上清,细胞沉淀于96孔板底部。
71、加facs缓冲液重悬沉淀细胞,每孔加入200μl,吹匀后用0.45μm过滤器过滤,再转移至流式管中。
72、按照流式细胞仪检测细胞操作说明调整参数,上机检测。
73、2.3流式细胞术检测细胞内分子
74、向96孔板中加入2.1步骤所得的细胞悬液,每孔加入100μl。
75、4℃,1500rpm,离心5min,弃上清,细胞沉淀于96孔板底部。
76、将外标抗体与facs缓冲液按一定比例混合后加入96孔板中,每孔加入100μl。重悬沉淀细胞,4℃避光孵育40min,隔20分钟吹匀一次。
77、使用transcription factor staining buffer set试剂盒(2511819,thermofisher scientific),按说明书现配现用破膜液,加入至96孔板中,每孔加入100μl,重悬沉淀细胞,4℃避光反应1小时,隔30分钟吹匀一次。
78、破膜结束后,向96孔板中加入稀释后的试剂盒中配套wash buffer,每孔加入100μl。4℃,2500rpm,离心5min,弃上清,细胞沉淀于96孔板底部。
79、将内标抗体与facs缓冲液按一定比例混合后加入96孔板中,每孔加入100μl。重悬沉淀细胞,4℃避光孵育40min,隔20分钟吹匀一次。
80、孵育结束后,向96孔板中加入facs缓冲液,每孔加100μl,4℃,1500rpm,离心5min,弃上清,细胞沉淀于96孔板底部。
81、加facs缓冲液重悬沉淀细胞,每孔加入200μl,吹匀后用0.45μm过滤器过滤,再转移至流式管中。
82、按照流式细胞仪检测细胞操作说明调整参数,上机检测。
83、2.4流式细胞术检测转录因子
84、向流式管中加入250μl细胞悬液,再加入250μl rp10培养基,构成500μl体系。再加入pma(终浓度30ng/ml)、离子霉素(终浓度1μg/ml)、莫能菌素(终浓度2.5μg/ml)、bfa(终浓度0.6μl/ml)混匀后放置37℃,5%co2培养箱中孵育5-6小时。
85、刺激结束后,4℃,1500rpm,离心5min,弃上清,细胞沉淀于流式管底部。
86、加facs缓冲液重悬沉淀细胞,每管加入200μl,吹匀后转移至96孔板中。4℃,1500rpm,离心5min,弃上清,细胞沉淀于96孔板底部。
87、将外标抗体与facs缓冲液按一定比例混合后加入96孔板中,每孔加入100μl。重悬沉淀细胞,4℃避光孵育40min,隔20分钟吹匀一次。
88、使用transcription factor staining buffer set试剂盒,按说明书现配现用破膜液,加入至96孔板中,每孔加入100μl,重悬沉淀细胞,4℃避光反应1小时,隔30分钟吹匀一次。
89、破膜结束后,向96孔板中加入稀释后的试剂盒中配套wash buffer,每孔加入100μl。4℃,2500rpm,离心5min,弃上清,细胞沉淀于96孔板底部。
90、将内标抗体与facs缓冲液按一定比例混合后加入96孔板中,每孔加入100μl。重悬沉淀细胞,4℃避光孵育40min,隔20分钟吹匀一次。
91、孵育结束后,向96孔板中加入facs缓冲液,每孔加100μl,4℃,1500rpm,离心5min,弃上清,细胞沉淀于96孔板底部。
92、加facs缓冲液重悬沉淀细胞,每孔加入200μl,吹匀后用0.45μm过滤器过滤,再转移至流式管中。
93、按照流式细胞仪检测细胞操作说明调整参数,上机检测。
94、3、结果分析
95、如图2所示,mafp并不会影响肿瘤免疫微环境中cd4+t细胞和cd8+t细胞的比例和数量。同时图3显示cd4+t细胞分化的th 1和th 17细胞比例和数量也无显著差异。但图4的结果显示,检测效应cd8+t细胞的功能分子,会发现与0mg/kg的对照组相比,使用5mg/kg的mafp进行治疗后,效应cd8+t细胞分泌的perforin和ifn-γ比例显著增多,且表达量有升高的趋势。这表明注射5mg/kg的mafp进行肿瘤治疗,可以显著提高cd8+t细胞抗肿瘤功能。之后,本实验对肿瘤免疫微环境中具有重要调节作用的treg细胞进行分析,结果如图5所示,各组之间treg细胞的比例虽然没有明显的差异,但是与对照组相比,使用5mg/kg的mafp进行治疗后,treg细胞分泌了更高比例的ifn-γ和il-17a,且具有显著差异。这表明注射5mg/kg的mafp进行肿瘤治疗,可以显著增加肿瘤环境下treg的脆性,使treg细胞免疫抑制功能下降。
96、实施例3:检测不同肿瘤模型下花生四烯酸抑制剂改善肿瘤免疫微环境的效果
97、实施例1和实施例2已经证明了花生四烯酸抑制剂mafp对于改善肝癌肿瘤免疫微环境的治疗效果,为了验证mafp治疗效果的普遍性,使用b16-f10细胞对野生型小鼠进行皮下荷瘤,观察在不同肿瘤模型下mafp的肿瘤治疗效果及对肿瘤免疫微环境的改善效果。实施例3中对照组vehicle使用200μl 1×pbs,实验组使用浓度为5mg/kg mafp。
98、1、实验方法
99、1.1建立肿瘤模型
100、用剃毛器将小鼠腹背部的毛发剃除,使用1ml胰岛素注射器,皮下注射b16-f10细胞,细胞数量为每只1×105个,注射体积为100μl。
101、1.2肿瘤体积跟踪测量
102、从建立肿瘤第五天起,用游标卡尺每隔两天进行肿瘤测量,肿瘤体积公式为v=(长×宽×宽)/2。
103、1.3mafp治疗肿瘤效果的表型观察
104、在建立肿瘤第14天时,牺牲小鼠,取皮下肿瘤拍照,观察肿瘤大小。
105、1.3流式分析肿瘤免疫微环境
106、按照实施例2的方法,流式检测肿瘤环境下淋巴细胞的表面分子、内部分子和转录因子的比例和表达情况。
107、2、结果分析
108、结果如图6所示,与注射1×pbs溶剂的对照组相比,注射mafp治疗的小鼠肿瘤体积和重量有减小的趋势。具体分析肿瘤免疫微环境中的情况,发现与肝癌模型结果一致。如图7所示,cd4+t cd8+t的比例和数量无显著差异。cd4+t细胞分化情况如图8所示,th 1和th 17细胞比例和数量无显著差异。检测效应cd8+t细胞的功能分子,发现如图9所示,与对照组相比,mafp治疗组肿瘤免疫微环境中效应cd8+t细胞分泌的ifn-γ比例显著增多,且perforin的比例有升高的趋势。对treg细胞进行分析,结果如图10所示,两组的treg细胞比例虽然没有明显的差异,但mafp治疗组treg细胞的ifn-γ和il-17a的比例和表达显著高于对照组。这表明在皮下肿瘤模型中,mafp能够提高cd8+t细胞的效应功能,使肿瘤免疫微环境中的treg细胞获得脆性,改善肿瘤免疫微环境,此结果与肝癌模型一致,具有普遍性。
109、以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!