一种抗PD-1抗体和法米替尼联合在制备治疗肿瘤的药物中的用途的制作方法
本公开中涉及一种抗pd-1抗体和法米替尼或其可药用盐联合在制备治疗肿瘤的药物中的用途。
背景技术:
1、癌症具有许多遗传和表观遗传改变,产生可被免疫系统识别的新抗原。适应性免疫系统,包括t和b淋巴细胞,具有强大的抗癌潜力,具有广泛的能力和精细的特异性,以响应各种肿瘤抗原。此外,免疫系统表现出相当大的可塑性和记忆成分。成功利用适应性免疫系统的所有这些属性将使免疫治疗在所有癌症治疗模式中是独特的。
2、癌症免疫治疗已经集中在通过激活的效应细胞的过继转移,针对相关抗原的免疫或提供非特异性免疫刺激剂如细胞因子来增强抗肿瘤免疫反应的方法上。近年来,开发特异性免疫检查点途径抑制剂已经开始成为一种新的治疗癌症的免疫治疗方法,例如用于治疗晚期黑色素瘤的ctla抗体ipilimumab(hodi等人,2010),特异性结合程序性死亡受体(pd-1)nivolumab或pembrolizumab等。
3、pd-1抗体特异性识别并结合淋巴细胞表面pd-1,阻断pd-1/pd-l1信号通路,进而激活t细胞对肿瘤的免疫杀伤作用,调动机体免疫系统而清除体内肿瘤细胞。wo2015085847公开了一种新的抗pd-1抗体,目前pd-1抗体正处于临床试验阶段,已经显示出一定的抗肿瘤作用。
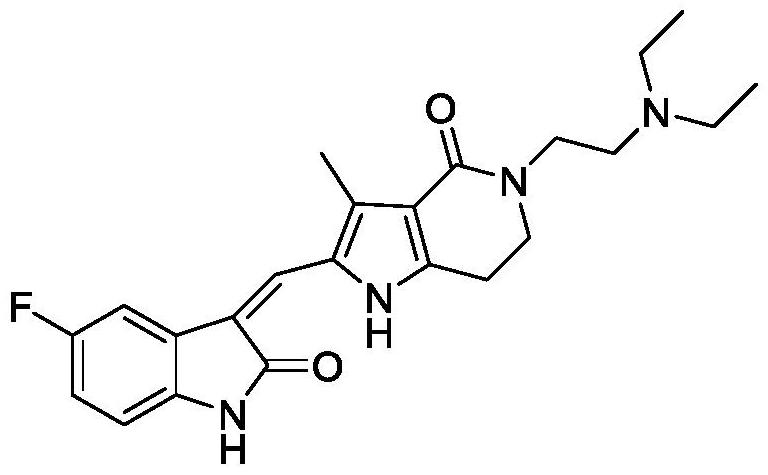
4、在一项法米替尼二线或二线以上标准化疗失败的晚期/转移性结直肠腺癌的多中心随机双盲安慰剂对照ii期试验中,法米替尼组(25mg,1天/次,42天为一个周期)较安慰剂组可改善晚期/转移性结直肠癌患者无进展生存期(pfs)1.3个月(hr为0.596,p为0.0053)。客观缓解率(orr)为2.2%,疾病控制率(dcr)为59.8%),中位生存期(mos)为7.5个月,安慰剂组为7.6个月,且不良事件可控。结构如下:
5、
6、目前已有多个pd-1抗体与vegfr抑制剂(如舒尼替尼,索拉菲尼等)联合疗法正处于临床ii/iii期,适应症分别为恶性肝癌(索拉菲尼与pd-1抗体联用)和转移性肾细胞癌(舒尼替尼与pd-1抗体联用),初步结果显示两种药物联用效果均优于单药,但尚未见法米替尼与pd-1抗体联用的报告。
技术实现思路
1、本公开中提供了一种抗pd-1抗体或其抗原结合片段和法米替尼或其可药用盐联合在制备治疗肿瘤的药物中的用途。
2、pd-1抗体是已知的,优选所述的pd-1抗体的轻链可变区包含分别如seq id no:4、seq id no:5和seq id no:6所示的lcdr1、lcdr2和lcdr3。
3、所述的pd-1抗体的重链可变区包含分别如seq id no:1、seq id no:2和seq idno:3所示的hcdr1、hcdr2和hcdr3。
4、其中,前面所述的各cdr序列如下表所示:
5、 名称 序列 编号 hcdr1 symms seq id no:1 hcdr2 tisgggantyypdsvkg seq id no:2 hcdr3 qlyyfdy seq id no:3 lcdr1 lasqtigtwlt seq id no:4 lcdr2 tatslad seq id no:5 lcdr3 qqvysipwt seq id no:6
6、优选的,所述的pd-1抗体为人源化抗体。
7、在一些实施方案中,所述人源化抗体包含seq id no:10所示的轻链可变区或其变体,所述变体优选在seq id no:10所示的轻链可变区有0-10的氨基酸变化,更优选a43s的氨基酸变化;所述人源化抗体包含seq id no:9所示的重链可变区或其变体,所述变体优选在seq id no:9所示的重链可变区有0-10的氨基酸变化,更优选g44r的氨基酸变化。
8、前述的人源化抗体重、轻链可变区的序列如下所示:
9、重链可变区
10、evqlvesggglvqpggslrlscaasgftfssymmswvrqapgkglewvatisgggantyypdsvkgrftisrdnaknslylqmnslraedtavyycarqlyyfdywgqgttvtvss
11、seq id no:9
12、轻链可变区
13、diqmtqspsslsasvgdrvtitclasqtigtwltwyqqkpgkapklliytatsladgvpsrfsgsgsgtdftltisslqpedfatyycqqvysipwtfgggtkveik
14、seq id no:10
15、在另一些实施方案中,所述人源化抗体包含seq id no:8所示的轻链或其变体,所述变体优选在轻链可变区有0-10的氨基酸变化,更优选a43s的氨基酸变化;所述人源化抗体包含seq id no:7所示的重链或其变体,所述变体优选在重链可变区有0-10的氨基酸变化,更优选g44r的氨基酸变化。
16、在另一实施方案中,所述的人源化抗体含有如seq id no:8所示的轻链,和如seqid no:7所示的重链。
17、所述人源化抗体重、轻链的序列如下所示:
18、重链
19、evqlvesggglvqpggslrlscaasgftfssymmswvrqapgkglewvatisgggantyypdsvkgrftisrdnaknslylqmnslraedtavyycarqlyyfdywgqgttvtvssastkgpsvfplapcsrstsestaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtktytcnvdhkpsntkvdkrveskygppcppcpapeflggpsvflfppkpkdtlmisrtpevtcvvvdvsqedpevqfnwyvdgvevhnaktkpreeqfnstyrvvsvltvlhqdwlngkeykckvsnkglpssiektiskakgqprepqvytlppsqeemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflysrltvdksrwqegnvfscsvmhealhnhytqkslslslgk
20、seq id no:7
21、轻链
22、diqmtqspsslsasvgdrvtitclasqtigtwltwyqqkpgkapklliytatsladgvpsrfsgsgsgtdftltisslqpedfatyycqqvysipwtfgggtkveikrtvaapsvfifppsdeqlksgtasvvcllnnfypreakvqwkvdnalqsgnsqesvteqdskdstyslsstltlskadyekhkvyacevthqglsspvtksfnrgec
23、seq id no:8
24、本公开中所述联合抗pd-1抗体或其抗原结合片段和法米替尼或其可药用盐具有协同药效作用。
25、本公开中所述的用途,根据患者体重给药,所述抗pd-1抗体或其抗原结合片段在人类受试者中的施用剂量为0.1~10.0mg/kg,可以为0.1mg/kg、0.2mg/kg、0.3mg/kg、0.4mg/kg、0.5mg/kg、0.6mg/kg、0.7mg/kg、0.8mg/kg、0.9mg/kg、1.0mg/kg、1.2mg/kg、1.4mg/kg、1.6mg/kg、1.8mg/kg、2.0mg/kg、2.2mg/kg、2.4mg/kg、2.6mg/kg、2.8mg/kg、3.0mg/kg、3.2mg/kg、3.4mg/kg、3.6mg/kg、3.8mg/kg、4.0mg/kg、4.2mg/kg、4.4mg/kg、4.6mg/kg、4.8mg/kg、5.0mg/kg、5.2mg/kg、5.4mg/kg、5.6mg/kg、5.8mg/kg、6.0mg/kg、6.2mg/kg、6.4mg/kg、6.6mg/kg、6.8mg/kg、7.0mg/kg、7.2mg/kg、7.4mg/kg、7.6mg/kg、7.8mg/kg、8.0mg/kg、8.2mg/kg、8.4mg/kg、8.6mg/kg、8.8mg/kg、9.0mg/kg、9.2mg/kg、9.4mg/kg、9.6mg/kg、9.8mg/kg、10.0mg/kg或任意两数值间任意值。
26、在可选实施方案中,其中所述pd-1抗体或其抗原结合片段在人类受试者中的施用剂量为10~300mg,可以为10.0mg、15mg、20mg、25mg、30mg、35mg、40mg、45mg、50mg、55mg、60mg、65mg、70mg、75mg、80mg、85mg、90mg、95mg、100mg、105mg、110mg、115mg、120mg、125mg、130mg、135mg、140mg、145mg、150mg、155mg、160mg、165mg、170mg、175mg、180mg、185mg、190mg、195mg、200mg、205mg、210mg、215mg、220mg、225mg、230mg、235mg、240mg、245mg、250mg、255mg、260mg、265mg、270mg、275mg、280mg、285mg、290mg、295mg、300mg或任意两数值间任意值,优选50~300mg,最优选200mg。
27、本公开中所述抗pd-1抗体或其抗原结合片段的给药频为一天一次、两天一次、三天一次、四天一次、五天一次、六天一次、一周一次、二周一次、三周一次、四周一次或一月一次,优选三周一次。
28、在可选实施方案中,本公开中所述抗pd-1抗体或其抗原结合片段给药剂量为50~300mg/2-3周一次,更优选为200mg/2-3周一次。
29、本公开中所述的用途,根据患者体重给药,所述法米替尼或其可药用盐在人类受试者中的施用剂量为0.1~10.0mg/kg,可以为0.1mg/kg、0.2mg/kg、0.3mg/kg、0.4mg/kg、0.5mg/kg、0.6mg/kg、0.7mg/kg、0.8mg/kg、0.9mg/kg、1.0mg/kg、1.2mg/kg、1.4mg/kg、1.6mg/kg、1.8mg/kg、2.0mg/kg、2.2mg/kg、2.4mg/kg、2.6mg/kg、2.8mg/kg、3.0mg/kg、3.2mg/kg、3.4mg/kg、3.6mg/kg、3.8mg/kg、4.0mg/kg、4.2mg/kg、4.4mg/kg、4.6mg/kg、4.8mg/kg、5.0mg/kg、5.2mg/kg、5.4mg/kg、5.6mg/kg、5.8mg/kg、6.0mg/kg、6.2mg/kg、6.4mg/kg、6.6mg/kg、6.8mg/kg、7.0mg/kg、7.2mg/kg、7.4mg/kg、7.6mg/kg、7.8mg/kg、8.0mg/kg、8.2mg/kg、8.4mg/kg、8.6mg/kg、8.8mg/kg、9.0mg/kg、9.2mg/kg、9.4mg/kg、9.6mg/kg、9.8mg/kg、10.0mg/kg或任意两数值间任意值。
30、在可选实施方案中,所述法米替尼或其可药用盐在人类受试者中的施用剂量为0.1~100mg,可以为0.1mg、0.2mg、0.3mg、0.4mg、0.5mg、0.6mg、0.7mg、0.8mg、0.9mg、1.0mg、2mg、3mg、4mg、5mg、6mg、7mg、8mg、9mg、10mg、11mg、12mg、13mg、14mg、15mg、16mg、17mg、18mg、19mg、20mg、21mg、22mg、23mg、24mg、25mg、26mg、27mg、28mg、29mg、30mg、31mg、32mg、33mg、34mg、35mg、36mg、37mg、38mg、39mg、40mg或任意两数值间任意值,优选1~20mg。
31、本公开中所述的用途,其中,所述法米替尼或其可药用的给药频率为一天一次,两天一次,三天一次,四天一次,五天一次,六天一次,一周一次,每周给药三天、一天一次,每周给药四天、一天一次,每周给药五天、一天一次。
32、在可选实施方案中,所述抗pd-1抗体或其抗原结合片段在人类受试者中的施用剂量为10~300mg,所述法米替尼或其可药用盐在人类受试者中的施用剂量为0.1~100mg。
33、在可选实施方案中,所述抗pd-1抗体或其抗原结合片段在人类受试者中的施用剂量为10~300mg,2-3周一次,所述法米替尼或其可药用盐给药在人类受试者中的施用剂量为0.1~100mg,一天一次。
34、在可选实施方案中,所述抗pd-1抗体或其抗原结合片段在人类受试者中的施用剂量为50~300mg,所述法米替尼或其可药用盐在人类受试者中的施用剂量为1~20mg。
35、在可选实施方案中,所述抗pd-1抗体或其抗原结合片段在人类受试者中的施用剂量为50~300mg,2-3周一次,所述法米替尼或其可药用盐在人类受试者中的施用剂量为1~20mg,一天一次。
36、在可选实施方案中,所述抗pd-1抗体或其抗原结合片段在人类受试者中的施用剂量为200mg,所述法米替尼或其可药用盐在人类受试者中的施用剂量为1~20mg。
37、在可选实施方案中,所述抗pd-1抗体或其抗原结合片段在人类受试者中的施用剂量为200mg,2-3周一次,所述法米替尼或其可药用盐在人类受试者中的施用剂量为1~20mg,一天一次。
38、在可选实施方案中,所述抗pd-1抗体或其抗原结合片段在人类受试者中的施用剂量为200mg,3周一次,所述法米替尼或其可药用盐在人类受试者中的施用剂量为1~20mg,一天一次。
39、另一方面,在可选实施方案中,本公开用途中,相比于单独施用同等剂量的法米替尼或其可药用盐,所述法米替尼或其可药用盐的auc提高了至少15%(包括15%、16%、17%、18%、19%、20%、21%、22%、23%、24%、25%、26%、27%、28%、29%、30%或更高),优选至少20%,最优至少25%。
40、在可选实施方案中,本公开用途中,相比于单独施用同等剂量的法米替尼或其可药用盐,所述法米替尼或其可药用盐的cmax提高了至少15%(包括15%、16%、17%、18%、19%、20%、21%、22%、23%、24%、25%、26%、27%、28%、29%、30%或更高),优选至少20%。
41、在本公开中优选的实施方案中,所述的pd-1抗体以注射的方式给药,例如皮下或静脉注射,注射前需将pd-1抗体配制成可注射的形式。特别优选的pd-1抗体的可注射形式是注射液或冻干粉针,其包含pd-1抗体、缓冲剂、稳定剂,任选地还含有表面活性剂。缓冲剂可选自醋酸盐、柠檬酸盐、琥珀酸盐、以及磷酸盐中的一种或几种。稳定剂可选自糖或氨基酸,优选二糖,例如蔗糖、乳糖、海藻糖、麦芽糖。表面活性剂选自聚氧乙烯氢化蓖麻油、甘油脂肪酸酯、聚氧乙烯山梨醇酐脂肪酸酯,优选所述聚氧乙烯山梨醇酐脂肪酸酯为聚山梨酯20、40、60或80,最优选聚山梨酯20。最为优选的pd-1抗体的可注射形式包含pd-1抗体、醋酸盐缓冲剂、海藻糖和聚山梨酯20。
42、本公开中提供上述抗pd-1抗体联合法米替尼或其可药用盐作为治疗制备治疗肿瘤的药物。
43、本公开中提供上述抗pd-1抗体联合法米替尼或其可药用盐作为减少药物不良反应的药物,优选的,所述的药物不良反应选自由抗pd-1抗体引起或由法米替尼或其可药用盐引起。
44、在可选实施方案中,本公开用途中所述不良反应优选抗pd-1抗体的不良反应,最优选反应性毛细血管增生症。
45、在一些实施方案中,相比于单独施用同等剂量的抗pd-1抗体(如重、轻链的序列如本公开中seq id no:7和seq id no:8),所述反应性毛细血管增生症发生率不高于15%(包括15%、14.5%、14%、13.5%、13%、12.5%、12%、11.5%、11%、10.5%、10%、9.5%、9%、8.5%、8%、7.5%、7%、6.5%、6%、5.5%、5%、4%、4.5%、3.5%、3%、2.5%、2%、1.5%、1%或更低),优选不高于2.5%。
46、本公开中提供上述抗pd-1抗体联合法米替尼或其可药用盐作为降低抗pd-1抗体单独施用剂量和/或法米替尼或其可药用盐单独施用剂量的药物。
47、在本公开中,提供了一种治疗肿瘤的办法,包括向患者施用上述抗pd-1抗体和法米替尼或其可药用盐。
48、在本公开中,提供了一种降低抗pd-1抗体单独施用剂量和/或法米替尼或其可药用盐单独施用剂量的方法,包括向患者施用上述抗pd-1抗体联合法米替尼或其可药用盐。
49、在另一些实施方案中,与pd-1联合使用时,所述法米替尼或其可药用盐的给药剂量是其单独施用剂量的10%~100%(包括10%、15%、20%、30%、35%、40%、45%、50%、55%、60%、70%、75%、80%、90%、95%),优选10%~75%,更优选75%、50%、25%、12.5%。
50、在另一些实施方案中,与法米替尼或其可药用盐联用时,抗pd-1抗体剂量是抗pd-1抗体单独施用剂量的10%~100%(包括10%、15%、20%、30%、35%、40%、45%、50%、55%、60%、70%、75%、80%、90%、95%),优选10%~50%。
51、本公开还提供了一种降低抗pd-1抗体或其抗原结合片段、法米替尼或其可药用盐导致的不良反应的方法,包括向患者联合施用法米替尼或其可药用盐和前述的pd-1抗体,所述不良反应优选抗pd-1抗体的不良反应,最优选反应性毛细血管增生症。
52、在可选实施方案中,本公开所述不良反应优选抗pd-1抗体的不良反应,最优选反应性毛细血管增生症。
53、在一些实施方案中,相比于单独施用同等剂量的抗pd-1抗体(如重、轻链的序列如本公开中seq id no:7和seq id no:8),所述反应性毛细血管增生症发生率不高于15%(包括15%、14.5%、14%、13.5%、13%、12.5%、12%、11.5%、11%、10.5%、10%、9.5%、9%、8.5%、8%、7.5%、7%、6.5%、6%、5.5%、5%、4%、4.5%、3.5%、3%、2.5%、2%、1.5%、1%或更低),优选不高于2.5%。
54、本公开中还提供了一种药物套组,或者一种药物包装盒,或者药物组合,其中含有法米替尼或其可药用盐,和pd-1抗体。
55、本公开中还提供了一种抗pd-l1抗体或抗ctal-4抗体,和法米替尼或其可药用盐联合在制备治疗肿瘤的药物中的用途。
56、在可选实施方案中,根据患者体重给药,所述抗pd-l1抗体或其抗原结合片段或抗ctal-4抗体或其抗原结合在人类受试者中的施用剂量为0.1~10.0mg/kg,可以为0.1mg/kg、0.2mg/kg、0.3mg/kg、0.4mg/kg、0.5mg/kg、0.6mg/kg、0.7mg/kg、0.8mg/kg、0.9mg/kg、1.0mg/kg、1.2mg/kg、1.4mg/kg、1.6mg/kg、1.8mg/kg、2.0mg/kg、2.2mg/kg、2.4mg/kg、2.6mg/kg、2.8mg/kg、3.0mg/kg、3.2mg/kg、3.4mg/kg、3.6mg/kg、3.8mg/kg、4.0mg/kg、4.2mg/kg、4.4mg/kg、4.6mg/kg、4.8mg/kg、5.0mg/kg、5.2mg/kg、5.4mg/kg、5.6mg/kg、5.8mg/kg、6.0mg/kg、6.2mg/kg、6.4mg/kg、6.6mg/kg、6.8mg/kg、7.0mg/kg、7.2mg/kg、7.4mg/kg、7.6mg/kg、7.8mg/kg、8.0mg/kg、8.2mg/kg、8.4mg/kg、8.6mg/kg、8.8mg/kg、9.0mg/kg、9.2mg/kg、9.4mg/kg、9.6mg/kg、9.8mg/kg、10.0mg/kg。
57、在另一可选实施方案中,其中所述pd-l1抗体或其抗原结合片段或抗ctal-4抗体或其抗原结合片段在人类受试者中的施用剂量为50~700mg,可以为50mg、55mg、60mg、65mg、70mg、75mg、80mg、85mg、90mg、95mg、100mg、105mg、110mg、115mg、120mg、125mg、130mg、135mg、140mg、145mg、150mg、155mg、160mg、165mg、170mg、175mg、180mg、185mg、190mg、195mg、200mg、205mg、210mg、215mg、220mg、225mg、230mg、235mg、240mg、245mg、250mg、255mg、260mg、265mg、270mg、275mg、280mg、285mg、290mg、295mg、300mg、305mg、310mg、315mg、320mg、325mg、330mg、335mg、340mg、345mg、350mg、355mg、360mg、365mg、370mg、375mg、380mg、385mg、390mg、395mg、400mg、405mg、410mg、415mg、420mg、425mg、430mg、435mg、440mg、445mg、450mg、455mg、460mg、465mg、470mg、475mg、480mg、485mg、490mg、495mg、500mg、505mg、510mg、515mg、520mg、525mg、530mg、535mg、540mg、545mg、550mg、555mg、560mg、565mg、570mg、575mg、580mg、585mg、590mg、595mg、600mg、605mg、610mg、615mg、620mg、625mg、630mg、635mg、640mg、645mg、650mg、655mg、660mg、665mg、670mg、675mg、680mg、685mg、690mg、695mg、700mg,优选50~600mg,最优选200mg。
58、本公开中所述抗pd-l1抗体或其抗原结合片段或抗ctal-4抗体或其抗原结合片段的给药频为一天一次、两天一次、三天一次、四天一次、五天一次、六天一次、一周一次、二周一次、三周一次、四周一次或一月一次。
59、在可选实施方案中,本公开中所述抗pd-l1抗体或其抗原结合片段或抗ctal-4抗体或其抗原结合片段在人类受试者中的施用剂量为50~600mg/2-3周一次,更优选为200mg/2-3周一次。
60、在可选实施方案中,所述抗pd-l1抗体或其抗原结合片段或抗ctal-4抗体或其抗原结合片段在人类受试者中的施用剂量为50~700mg,2-3周一次,所述法米替尼或其可药用盐在人类受试者中的施用剂量为为0.1~100mg,一天一次。
61、在可选实施方案中,所述抗pd-l1抗体或其抗原结合片段或抗ctal-4抗体或其抗原结合片段在人类受试者中的施用剂量为50~600mg,所述法米替尼或其可药用盐在人类受试者中的施用剂量为1~20mg。
62、在可选实施方案中,所述抗pd-l1抗体或其抗原结合片段或抗ctal-4抗体或其抗原结合片段在人类受试者中的施用剂量为50~600mg,2-3周一次,所述法米替尼或其可药用盐在人类受试者中的施用剂量为1~20mg,一天一次。
63、在可选实施方案中,所述抗pd-l1抗体或其抗原结合片段或抗ctal-4抗体或其抗原结合片段在人类受试者中的施用剂量为200mg,所述法米替尼或其可药用盐在人类受试者中的施用剂量为1~20mg。
64、在可选实施方案中,所述抗pd-l1抗体或其抗原结合片段或抗ctal-4抗体或其抗原结合片段在人类受试者中的施用剂量为200mg,2-3周一次,所述法米替尼或其可药用盐在人类受试者中的施用剂量为1~20mg,一天一次。
65、在本公开中优选的实施方案中,所述的pd-l1抗体或抗ctal-4抗体以注射的方式给药,例如皮下或静脉注射,注射前需将pd-l1抗体或抗ctal-4抗体配制成可注射的形式。
66、本公开中提供上述抗pd-l1抗体或抗ctal-4抗体联合法米替尼或其可药用盐作为减少药物不良反应的药物,优选的,所述的药物不良反应选自由抗pd-l1抗体或抗ctal-4抗体引起或由法米替尼或其可药用盐引起。
67、本公开中提供上述抗pd-l1抗体联合法米替尼或其可药用盐作为降低抗pd-l1抗体单独施用剂量和/或法米替尼或其可药用盐单独施用剂量的药物。
68、本公开中提供上述抗ctal-4抗体联合法米替尼或其可药用盐作为降低抗ctal-4抗体单独施用剂量和/或法米替尼或其可药用盐单独施用剂量的药物。
69、在本公开中,提供了一种治疗肿瘤的办法,包括向患者施用上述抗pd-l1抗体或抗ctal-4抗体和法米替尼或其可药用盐。
70、在本公开中,提供了一种降低抗pd-l1抗体单独施用剂量和/或法米替尼或其可药用盐单独施用剂量的方法,包括向患者施用上述抗pd-l1抗体联合法米替尼或其可药用盐。
71、在本公开中,提供了一种降低抗ctal-4抗体单独施用剂量和/或法米替尼或其可药用盐单独施用剂量的方法,包括向患者施用上述抗ctal-4抗体联合法米替尼或其可药用盐。
72、在可选实施方案中,与pd-l1联合使用时,所述法米替尼或其可药用盐的给药剂量是其单独施用剂量的10%~100%(包括10%、15%、20%、30%、35%、40%、45%、50%、55%、60%、70%、75%、80%、90%、95%),优选10%~75%,更优选75%、50%、25%、12.5%。
73、在可选实施方案中,与法米替尼或其可药用盐联用时,抗pd-l1抗体剂量是抗pd-l1抗体单独施用剂量的10%~100%(包括10%、15%、20%、30%、35%、40%、45%、50%、55%、60%、70%、75%、80%、90%、95%),优选10%~50%。
74、在可选实施方案中,与抗ctal-4抗体联合使用时,所述法米替尼或其可药用盐的给药剂量是其单独施用剂量的10%~100%,优选10%~75%,更优选75%、50%、25%、12.5%。
75、在可选实施方案中,与法米替尼或其可药用盐联用时,抗ctal-4抗体剂量是抗ctal-4抗体单独施用剂量的10%~100%,优选10%~50%。
76、本公开中还提供了一种药物套组,或者一种药物包装盒,其中含有法米替尼或其可药用盐,和pd-l1抗体或ctal-4抗体。
77、在本公开中的用途中,所述肿瘤示例选自但不限于:乳腺癌(如三阴性乳腺癌)、肺癌、胃癌、肠癌(如直肠癌、结直肠癌)、肾癌(如肾细胞癌)、肝癌(如原发性肝癌、肝细胞癌、胆管细胞癌、转移性肝癌、继发性肝癌)、黑素瘤(如转移性黑色瘤)、非小细胞肺癌、尿路上皮癌(如膀胱癌、输尿管、尿道癌)、宫颈癌、卵巢癌(如复发性卵巢癌)、子宫内膜癌、成淋巴细胞t细胞白血病、慢性髓细胞性白血病、甲状腺癌、慢性淋巴细胞白血病、毛细胞白血病、急性成淋巴细胞性白血病、急性髓细胞白血病(aml)、慢性中性粒细胞白血病、急性成淋巴细胞t细胞白血病、免疫母细胞大细胞白血病、套细胞白血病、多发性骨髓瘤巨核母细胞白血病、急性巨核细胞白血病、早幼粒细胞白血病、红白血病、恶性淋巴瘤、多发性骨髓瘤、浆细胞瘤、霍奇金淋巴瘤、非霍奇金淋巴瘤、淋巴母细胞t细胞淋巴瘤、伯基特淋巴瘤、滤泡性淋巴瘤、骨髓增生异常综合征(mds)。
78、在可选实施方案中,本公开用途中肿瘤为非小细胞肺癌、甲状腺癌、乳腺癌(如三阴性乳腺癌)、黑素瘤(如转移性黑色瘤)、肾癌、尿路上皮癌(如膀胱癌、输尿管、尿道癌)、宫颈癌、甲状腺癌、卵巢癌(如复发性卵巢癌)、子宫内膜癌、肠癌或肝癌。
79、在优选实施方案中,所述肿瘤患者为接受过铂类药物治疗的。例如接受铂类药物治疗失败或者不可耐受的患者,或者接受铂治疗方案治疗期间或治疗结束后<6个月进展或复发。
80、在一些实施方案中,本公开用途中所述肿瘤为肾癌(肾细胞癌)。优选地,为组织或细胞学确诊的晚期肾透明细胞癌(混合型肿瘤,如肾透明细胞癌)。
81、在优选实施方案中,本公开用途中所述肾细胞癌患者为既往经过白细胞介素-2和/或抗血管新生靶向药治疗、治疗失败的。
82、在一些实施方案中,本公开用途中所述肿瘤为尿路上皮癌(如膀胱癌、输尿管、尿道癌)。优选地,为组织或细胞学确诊的无法根治的尿路上皮癌(如包括肾盂癌、输尿管癌、膀胱癌及尿道癌,混合型癌如组织学类型为移行细胞癌亚型)。
83、在优选实施方案中,本公开用途中所述尿路上皮癌患者为接受过铂类药物治疗的。例如,接受接受铂类药物治疗失败或者不可耐受的患者,或者接受铂治疗方案治疗期间或治疗结束后进展或复发。
84、在一些实施方案中,本公开用途中所述肿瘤为宫颈癌。优选地,为组织或细胞学确认的晚期宫颈鳞状细胞癌。
85、在优选实施方案中,所述宫颈癌患者为既往经过≥1线系统治疗失败的。
86、在另一些实施方案中,本公开用途中所述肿瘤为卵巢癌,优选地,为复发性卵巢癌,进一步地,为组织病理学确诊的复发性卵巢上皮癌、输卵管癌或原发性腹膜癌。
87、在优选实施方案中,所述复发性卵巢癌患者为接受过铂类药物治疗的。例如接受铂类药物治疗失败或者不可耐受的患者,或者接受铂治疗方案治疗期间或治疗结束(完成4程及以上治疗)后<6个月进展或复发。
88、在另一些实施方案中个,本公开用途中所述肿瘤为子宫内膜癌,优选地,为组织病理学确诊的子宫内膜癌。在优选实施方案中,所述子宫内膜癌患者为接受过铂类药物治疗的。例如,例如接受铂类药物治疗失败或者不可耐受的患者,或者接受铂治疗方案治疗期间或治疗结束(完成4程及以上治疗)后<6个月进展或复发。
89、本公开中还提供了一种法米替尼或其可药用盐在制备治疗受益于抑制tyro3和/或axl和/或mer的病症的药物中的用途。
90、本公开中还提供了一种法米替尼或其可药用盐治疗受益于抑制tyro3和/或axl和/或mer的病症的方法,包括向患者施用上述法米替尼或其可药用盐。进一步地,在可选实施方案中,所述法米替尼或其可药用盐是可单用或联用。
91、进一步地,在可选实施方案中,所述法米替尼或其可药用盐是可以单独施用或联合施用的。
92、本公开中所述受益于抑制tyro3(tyro3 tyrosine kinase receptor inhibitor)和/或axl(axl tyrosine kinase receptor inhibitor)和/或mer(mer tyrosine kinasereceptor inhibitor)的病症示例包括但不限于:成淋巴细胞t细胞白血病、慢性髓细胞性白血病、慢性淋巴细胞白血病、毛细胞白血病、急性成淋巴细胞性白血病、急性髓细胞白血病(aml)、慢性中性粒细胞白血病、急性成淋巴细胞t细胞白血病、免疫母细胞大细胞白血病、套细胞白血病、多发性骨髓瘤巨核母细胞白血病、急性巨核细胞白血病、早幼粒细胞白血病、红白血病、恶性淋巴瘤、多发性骨髓瘤、浆细胞瘤、霍奇金淋巴瘤、非霍奇金淋巴瘤、淋巴母细胞t细胞淋巴瘤、伯基特淋巴瘤、滤泡性淋巴瘤,骨髓增生异常综合征(mds)、血栓性病症(如心肌梗死、缺血性脑梗塞、外周血管病、静脉血栓栓塞等),等等。
93、本公开中所述法米替尼可药用的盐选自但不限于甲磺酸盐、马来酸盐、酒石酸盐、琥珀酸盐、醋酸盐、二氟醋酸盐、富马酸盐、柠檬酸盐、枸橼酸盐、苯磺酸盐、苯甲酸盐、萘磺酸盐、乳酸盐、苹果酸盐、盐酸盐、氢溴酸盐、硫酸盐、以及磷酸盐,优选苹果酸盐。
94、在一些所述方案中,本公开中法米替尼可药用的盐在人类受试者中的施用剂量以自由碱形式计算。
95、如无相反解释,本公开中术语具有如下含义:
96、本公开关于“auc”是指药代动力学血药浓度曲线对时间轴所包围的面积,该参数是评价药物吸收程度的重要指标,反映药物在体内的暴露特性。由于药动学研究中血药浓度只能观察至某时间点t,因此auc有两种表示方式:auc(0-t)和auc(0-∞),前者根据梯形面积法得到,后者计算式:auc(0-∞)=auc(0-t)+末端点浓度/末端消除速率。本技术中所述的auc是指单次给药或多次给药达到稳态后患者的平均auc0-24,优选多次给药达到稳态后患者的平均auc0-24(即aucss)。
97、本公开关于“联合”是一种给药方式,是指在一定时间期限内给予至少一种剂量的法米替尼或可药用盐,和少一种剂量的抗pd-1抗体或其抗原结合片段,其中两种物质都显示药理学作用。所述的时间期限可以是一个给药周期内,优选4周内,3周内,2周内,1周内,或24小时以内。可以同时或依次给予法米替尼或可药用盐和抗pd-1抗体或其抗原结合片段。这种期限包括这样的治疗,其中通过相同给药途径或不同给药途径给予法米替尼或可药用盐和抗pd-1抗体或其抗原结合片段。本公开所述联合的给药方式选自同时给药、独立地配制并共给药或独立地配制并相继给药。总生存期(os)指从随机期至任何原因导致死亡的期。末次随访时仍存活的受试者,其os以末次随访时间计为数据删失。失访的受试者,其os以失访前末次证实存活时间计为数据删失。数据删失的os定义为从随机分组到删失的时间。
98、客观缓解率(objective response rate,orr)指肿瘤缩小达到一定并且保持一定时间的病人的比例,包含了cr和pr的病例。采用实体瘤缓解评估标准(recist 1.1标准)来评定肿瘤客观缓解。受试者在基线时必须伴有可测量的肿瘤病灶,疗效评定标准根据recist 1.1标准分为完全缓解(cr)、部分缓解(pr)、稳定(sd)、进展(pd)。
99、疾病控制率(disease control rate,dcr)指经确认的完全缓解、部分缓解和疾病稳定(≥8周)病例数在可评价疗效患者中的百分比。
100、完全缓解(cr):所有靶病灶消失,全部病理淋巴结(包括靶结节和非靶结节)短直径必须减少至<10mm。
101、部分缓解(pr):靶病灶直径之和比基线水平减少至少30%。
102、疾病进展(pd):以整个实验研究过程中所有测量的靶病灶直径之和的最小值为参照,直径和相对增加至少20%(如果基线测量值最小就以基线值为参照);除此之外,必须满足直径和的绝对值增加至少5mm(出现一个或多个新病灶也视为疾病进展)。
103、疾病稳定(sd):靶病灶减小的程度没达到pr,增加的程度也没达到pd水平,介于两者之间,研究时可以直径之和的最小值作为参考。
104、“mpk”:毫克/每公斤。
105、本公开中所用试剂、生物样品或活性物可通过商业途径获得,如所用人pd-1转基因小鼠,4-5周龄,可从英国cephrim biosciences,inc公司购买。
- 还没有人留言评论。精彩留言会获得点赞!