一种可增加瘤内硼蓄积量的含硼制剂及其制备方法和应用
本发明涉及药物制剂领域,具体涉及一种可增加瘤内硼蓄积量的含硼制剂及其制备方法和应用。
背景技术:
1、肿瘤尤其是恶性肿瘤是严重威胁人类健康的主要疾病,其对患者、家庭和社会都带来了沉重的负担。放疗是临床肿瘤治疗的主要手段之一,有超过70%的恶性肿瘤患者在病程中需要放射治疗,其中,硼中子俘获治疗(boron neutron capture therapy,bnct)是一项结合了“生物靶向”和“重离子放疗”优势的精准肿瘤放疗技术,被称为继手术、传统放疗、化疗、免疫治疗之后的“第五疗法”,具有精准度高、疗效高和疗程短等多重优势,引起了世界范围内放疗领域的广泛关注。
2、硼中子俘获治疗是一种基于核俘获和核裂变反应的二元生物靶向放疗技术。稳定的非辐射性同位素硼10(10b)和低能热中子发生俘获反应后诱发核衰变和核裂变,产生高能α粒子(4he)和反冲锂核(7li)。这些粒子均属高传能线密度射线,射程仅为5~9μm,具有能量高和射程短的特点,杀伤范围局限于高摄取10b的肿瘤组织细胞,而对未摄取或者低摄取10b的正常组织损伤很小。其利用肿瘤细胞和正常细胞间形成明显的硼浓度梯度,实现对肿瘤细胞的精准高效打击,使之成为极有前景的治疗手段。
3、应用bnct技术需有以下几个关键点:①合适的硼递送剂使其高度浓集于肿瘤组织。②能提供一定能量中子束的中子源。③建立精确的辐射剂量测定模型。随着加速器源项中子源的临床应用,硼递送剂的局限性成为了bnct中主要的短板,研发优良的新型硼递送剂具有十分重要科学意义。理想的硼递送剂应符合以下要求:正常组织低摄取,肿瘤组织高摄取;肿瘤中硼浓度应达到约20μg 10b/g肿瘤组织;硼的肿瘤/正常组织浓度比(tumor-normal tissue,t/n)和硼的肿瘤/血液浓度比(tumor-blood,t/b)不能低于3;血液和正常组织能快速清除,低系统毒性;除了被处于分裂期的肿瘤细胞摄取之外,还可以被乏氧肿瘤细胞吸收。
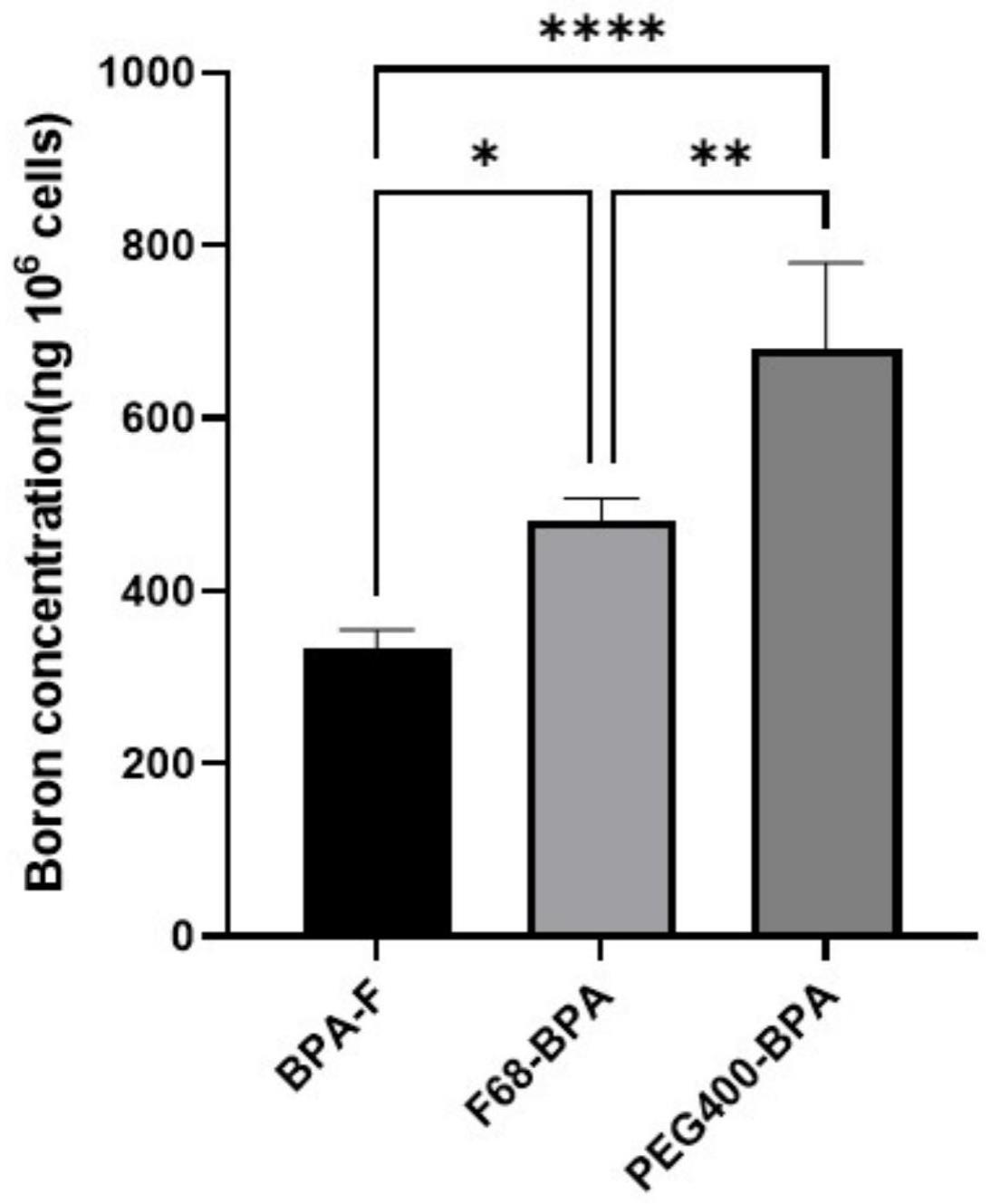
4、目前批准临床应用的硼俘获剂主要有4-硼-l-苯丙氨酸bpa(boronophenylalanine)和多面体硼烷bsh(sodium borocaptate)。bsh虽单位分子荷硼量高,但肿瘤细胞亲和力和穿透力均不如bpa,bpa分子结构有含1个b原子的苯丙氨酸骨架,对l型氨基酸转运蛋白1(lat1)具有高亲和力,因此其主要可以通过在许多癌细胞上过表达的lat1氨基酸转运蛋白识别,从而允许有效的细胞内化。在氨基酸需求量大的肿瘤组织细胞上体现出天然的靶向能力,但由于含硼量低,水溶性差和保留时间短等也制约了其临床应用。bpa胞内短保留的一个可能解释是包括lat1在内的氨基酸转运蛋白的反端口机制。当lat1将细胞外底物(例如bpa)导入细胞质时,它也输出细胞内底物,以类似的方式,如果细胞外bpa浓度降低,细胞内bpa应与细胞外氨基酸交换。根据这种可能的机制,有研究证明了与高分子复合后的bpa制剂能够抑制这种外排,从而增加瘤内蓄积量和保留时间。
5、传统硼俘获剂肿瘤定向分布有限,体内清除快,开发能增加肿瘤分布的硼俘获剂,将会进一步促进bnct肿瘤治疗效果,具有重要科学研究意义和应用前景。
6、鉴于bpa临床给药剂量较大的现实需求、及其自身溶解度较差的特点,本研究前期工作中,考察了包括囊泡、脂质体、胶束、包合物以及乳剂等多种剂型和相关辅料用于bpa的体内递送,但bpa增溶效果及其肿瘤摄取均不理想。在已报导的一些专利中,有使用氨基修饰的聚乙二醇与含羧基的苯硼酸衍生物通过反应形成酰胺键,用于糖蛋白的聚乙二醇化,或使用聚乙二醇对含苯硼酸衍生物的纳米制剂如脂质体,二氧化硅纳米粒等进行修饰,提高其体内长循环效果。我们的研究发现,采用基于聚乙二醇(polyethylene glycol,peg)的辅料如聚乙二醇(peg)、吐温、泊洛沙姆、脂肪醇聚氧乙烯醚(aeo)、聚氧乙烯氢化蓖麻油、聚氧乙烯烷基醚等,可与bpa在内的苯硼酸衍生物的硼酸酯(-b(oh)2)结构形成可逆接合的复合物,增加了bpa的溶解性,且与化学接合相比,制备简单,可解离释药,且稳定性、载硼量、以及肿瘤摄取能力均较高,有望实现bnct中的较为理想的硼递送。
技术实现思路
1、本发明提供了一种可增加瘤内硼蓄积量的含硼制剂的制备方法,所得含硼制剂可增加肿瘤内硼分布和蓄积,进而可极大促进bnct疗效。本发明将具有肿瘤靶向性的苯硼酸衍生物与含聚氧乙烯链段(其中n代表重复单元-och2ch2-的数量)的高分子化合物复合,能促进硼药被肿瘤细胞摄取并减少硼药的外排,从而增加瘤内硼蓄积量。
2、本发明提供的第一种可增加瘤内硼蓄积量的含硼制剂的制备方法:将苯硼酸衍生物溶解于ph=2~6的熔融态或液态的含聚氧乙烯链段的高分子化合物中,然后加入超纯水混合,期间维持ph在2~6,得到所述含硼制剂。
3、本发明提供的第二种可增加瘤内硼蓄积量的含硼制剂的制备方法:将苯硼酸衍生物与含聚氧乙烯链段的高分子化合物溶于极性溶剂中,旋转蒸发挥去极性溶剂,所述苯硼酸衍生物溶解于所述高分子化合物中或与所述高分子化合物共同形成薄膜,加入超纯水稀释或水化,调节ph至2~8(优选2~6),得到所述含硼制剂。所述极性溶剂可包括甲醇、乙醇、二甲亚砜、n,n-二甲基甲酰胺中的至少一种。
4、本发明提供的第三种可增加瘤内硼蓄积量的含硼制剂的制备方法:将苯硼酸衍生物与含聚氧乙烯链段的高分子化合物溶于有机溶剂中,所得混合液转移至透析袋中,使用ph=2~7的水溶液作为介质透析,除去有机溶剂,收集透析袋内液加入超纯水稀释,调节ph至2~8(优选2~5),得到所述含硼制剂。所述有机溶剂可包括甲醇、乙醇、二甲亚砜、n,n-二甲基甲酰胺中的至少一种。
5、本发明所述的苯硼酸衍生物具有如下所示结构:
6、
7、其中,r表示苯环上任选的一个或多个取代基,所述取代基可为无,或者,可独立地选自取代或未取代的c1~c18烃基、-or1、卤素、硝基、羟基、氨基、羧基、醛基、酯基或杂环基,r1可为取代或未取代的c1~c18烃基,所述烃基上的取代基可为卤素、硝基、羟基、氨基、羧基、醛基、酯基或杂环基,所述杂环基中的杂原子可为o、n或s,所述杂环基可为3~6元环。
8、进一步的,本发明所述的苯硼酸衍生物可为4-硼-l-苯丙氨酸。
9、本发明所述含聚氧乙烯链段的高分子化合物的重均分子量为300~100000g/mol,例如可以为300~20000g/mol。
10、本发明所述含硼制剂中苯硼酸衍生物的质量百分含量可为0.1%~25%。
11、本发明所述苯硼酸衍生物与所述含聚氧乙烯链段的高分子化合物的质量比可为1:2~100。
12、在一实施例中,本发明所述含硼制剂中,水的体积同所述所述与所述含聚氧乙烯链段的高分子化合物的总体积之比不小于15:1,可使含硼制剂保持长期稳定。
13、本发明所述含聚氧乙烯链段的高分子化合物可包括聚乙二醇、吐温、泊洛沙姆、脂肪醇聚氧乙烯醚、聚氧乙烯氢化蓖麻油、聚氧乙烯烷基醚中的一种或多种。
14、本发明还提供了所述的制备方法制备得到的含硼制剂。
15、本发明还提供了所述的含硼制剂在制备硼中子俘获治疗药物中的应用。
16、作为一个总的发明构思,本发明还提供了一种硼中子俘获治疗药物,包括所述的含硼制剂和药学上可接受的药用辅料;
17、所述含硼制剂含有10b。
18、所述药用辅料可以有作为增溶剂、表面活性剂、絮凝剂等用途。
19、所述药用辅料可包括磷脂、多糖、单糖、苯甲醇、柠檬酸钠中的至少一种。
20、本发明提供的含硼制剂、硼中子俘获治疗药物可以通过注射途径给药,另外本领域技术人员可参照现有硼中子俘获治疗的给药剂量确定给药剂量,并根据个体情况的进行不同浓度的稀释。
21、本发明含硼制剂、硼中子俘获治疗药物可制备成能够根据需要稀释的注射用溶液、纳米粒、混悬剂等,制备方法简单,方便重复与实现,易于推广。本发明含硼制剂、硼中子俘获治疗药物保留了所述苯硼酸衍生物的肿瘤靶向性并减少其入胞后被外排,显示出较佳的肿瘤细胞摄取量,是可以应用于硼中子俘获治疗的增加肿瘤部位硼蓄积量的新型硼俘获剂。
22、在本发明中,所述含聚氧乙烯链段的高分子化合物可以与所述苯硼酸衍生物中的硼酸酯键接合从而增加所述苯硼酸衍生物的溶解度,且一定程度上保持体内循环稳定性,使单次静脉给药后,通过增加肿瘤部位的硼摄取量,提升硼中子俘获治疗的效果。
23、本发明与现有技术相比,有益效果有:
24、(1)制备的含硼制剂,制法简单,载药量与大部分bnct硼递送剂相比更高;
25、(2)制备的含硼制剂,稳定性好,可根据需要方便调整给药剂量;
26、(3)制备的含硼制剂通过将小分子苯硼酸衍生物与含聚氧乙烯链段的高分子化合物复合,保留了所述苯硼酸衍生物的肿瘤靶向性,并避免被摄取入胞后再被转运出胞,增加肿瘤细胞硼摄取量;
27、(3)制备的含硼制剂,可以增加肿瘤部位硼分布,可有望实现单次注射后达到bnct治疗要求进行后续中子照射;
28、(4)制备的含硼制剂,生物相容性良好,进一步修饰可增强体内循环稳定性和靶组织趋向性。
- 还没有人留言评论。精彩留言会获得点赞!