一种PTT/铁死亡/CDT协同治疗的纳米光诊疗试剂、制备方法及应用与流程
本发明属于药物,具体涉及一种ptt/铁死亡/cdt协同治疗的纳米光诊疗试及其在肿瘤诊疗方面的应用;本发明还提供了制备所述ptt/铁死亡/cdt协同治疗的纳米光诊疗试剂的方法。
背景技术:
1、在探索癌症治疗策略的过程中,具有非侵入性和患者耐受性,并且能够靶向杀伤肿瘤细胞而不损伤其他正常细胞是治疗恶性肿瘤的理想目标。光热治疗(photothermaltherapy,ptt)是一种新兴的治疗方法,其一般由光引发,尤其是近红外光(near-infraredlight,nir)能够穿透深层组织,在光照条件下可以选择性杀死肿瘤细胞,并且不引起正常组织损伤。ptt可以通两方面来进行精准治疗:一是合成特定结构的光治疗药物,使它能够靶向定位肿瘤;另一方面控制光照范围大小,只照射病变部位,从而不造成正常组织的损伤。这种双重选择性的光治疗可以有效减少传统的化疗和放疗方法带来的全身毒性。
2、由于近红外二区(nir-ii)光热材料具有更深的组织穿透能力,因此,受到越来越多的关注。近年来开发的nir-ii光热材料可分为无机材料和有机材料。无机材料,诸如单壁碳纳米管(swnts)、量子点(qds)、金属材料等等,有着良好的光热转换效率和光稳定性等,但生物降解性差导致的潜在细胞毒性阻碍了它们的临床应用。与无机材料相比,有机材料具有易合成、结构可控、生物相容性好、易代谢等优点而备受关注。
3、目前较多研究所采用的光热材料是有机荧光探针吲哚菁绿(indocyanine green,icg),它是目前唯一被美国食品药品监督管理局(food and drug administration,fda)批准可用于临床的荧光造影剂,但由于它结构稳定性差、不能特异性靶向肿瘤等显著缺点,限制了其进一步的临床应用。所以开发新型稳定、多功能的nir-ii光热材料是目前光学治疗研究的重点和难点。
4、此外,在进行传统ptt时,高温会促使周围的组织烧伤,带来不可愈合的现象。所以,根据相关认证机构推荐的治疗温度为40~45℃,但这又会促发细胞的热休克蛋白(heatshock protein,hsp)上调和降低光热治疗肿瘤的能力。hsp70表达上调可以抑制肿瘤细胞的凋亡,抑制hsp70的表达可以增加肿瘤细胞对热疗的敏感性。槲皮素(qu)具有抑制肿瘤细胞hsp70合成的作用,而且同时能抗增生、抗肿瘤和抑制生物大分子合成,是一种潜在的肿瘤化疗药物;然而由于槲皮素在水中的溶解度较低,限制了其在临床上的应用。
5、化学动力学疗法(chemodynamic therapy,cdt),是一类基于铁基芬顿反应的新型肿瘤治疗技术,其通过铁基芬顿反应将h2o2转化为毒性更高的·oh引起肿瘤细胞内氧化应激反应导致细胞凋亡;但是cdt作用的发挥也受tme中h2o2含量有限和还原性物质多等条件的限制。为了增强cdt的治疗效果,研究者开发出了大量多功能、多疗法的递送系统。
6、目前,肿瘤细胞的耐药性问题引起了广泛关注,单一性的治疗体系已不能满足目前癌症治疗的需求,因此,结合多种治疗手段,开发一种不仅克服小分子药物难溶于水的缺点,并且可实现肿瘤温和ptt协同铁死亡和化学动力疗法相互联合促进细胞凋亡的治疗方法,是有重要意义的。
技术实现思路
1、鉴于此,本发明的目的是在于提供一种ptt/铁死亡/cdt协同治疗的纳米光诊疗试剂,以及它们的制备方法和应用,与目前单一性能的试剂不同,本发明中的纳米光诊疗试剂fe(iii)-qu/cj nps集优秀的ptt、铁死亡和cdt于一身,结合荧光成像和pai,能够实现诊疗一体化。
2、具体而言,本发明提供了一种ptt/铁死亡/cdt协同治疗的纳米光诊疗试剂,其包含由化合物cro-jul和络合物fe(iii)-qu制备的纳米颗粒fe(iii)-qu/cj nps;
3、所述化合物cro-jul为
4、所述络合物fe(iii)-qu是槲皮素和铁离子通过配位键形成的络合物。
5、在本发明的一些具体实施方案中,所述化合物cro-jul和所述络合物fe(iii)-qu的摩尔比为1:1。
6、在本发明的一些具体实施方案中,所述化合物cro-jul按照如下反应路线进行反应制备:
7、
8、在本发明的一些具体实施方案中,所述化合物cro-jul具体制备步骤如下:将强电子给体久洛尼啶与强电子受体克酮酸在甲苯和正丁醇的体系中,合成具有d-a-d结构的化合物cro-jul;
9、所述强电子给体久洛尼啶与强电子受体克酮酸的物质的量比大于或等于2:1。
10、在本发明的一些具体实施方案中,所述化合物cro-jul具体制备步骤中强电子给体久洛尼啶与强电子受体克酮酸的物质的量比等于3:1。
11、在本发明的一些具体实施方案中,所述化合物cro-jul具体制备步骤如下:将强电子给体久洛尼啶与强电子受体克酮酸在甲苯和正丁醇的体系中,室温搅拌一定时间,然后加热回流反应一定时间,减压蒸馏去除溶剂,冷却至室温后,过滤得到黑棕色固体,然后用溶剂洗涤,干燥得到结构的化合物cro-jul;
12、所述强电子给体久洛尼啶与强电子受体克酮酸的物质的量比大于或等于2:1。
13、在本发明的一些具体实施方案中,所述化合物cro-jul的制备步骤中的室温搅拌时间为20min,加热温度为147℃-153℃,反应时间为2h。
14、在本发明的一些具体实施方案中,所述化合物cro-jul的制备步骤中的溶剂洗涤为正己烷、乙醚和乙醇洗涤。
15、在本发明的一些具体实施方案中,所述络合物fe(iii)-qu制备步骤如下:在不断搅拌下将fecl3乙醇溶液滴加到槲皮素乙醇溶液中,搅拌均匀,调节ph至碱性,反应一定时间,静置冷却后过滤,离心分离,溶剂洗涤,烘干得产品。
16、在本发明的一些具体实施方案中,所述络合物fe(iii)-qu制备步骤如下:在不断搅拌下将fecl3乙醇溶液滴加到槲皮素乙醇溶液中,搅拌均匀,调节ph至8.5-9.5,反应一定时间,静置冷却后过滤,离心分离,溶剂洗涤,烘干得产品。
17、在本发明的一些具体实施方案中,所述络合物fe(iii)-qu制备步骤中的溶剂洗涤为无水乙醇洗涤。
18、在本发明的一些具体实施方案中,所述络合物fe(iii)-qu制备步骤如下:在不断搅拌下按一定比例将0.5mol/l fecl3乙醇溶液滴加到0.5mol/l槲皮素乙醇溶液中,搅拌均匀,用5%naoh乙醇溶液调节ph至碱性,反应70min,静置冷却后过滤,3000r/min离心分离,无水乙醇洗涤2次,烘干得产品。
19、在本发明的一些具体实施方案中,所述络合物fe(iii)-qu制备步骤如下:在不断搅拌下按一定比例将0.5mol/l fecl3乙醇溶液滴加到0.5mol/l槲皮素乙醇溶液中,搅拌均匀,用5%naoh乙醇溶液调节ph至8.5-9.5,反应70min,静置冷却后过滤,3000r/min离心分离,无水乙醇洗涤2次,烘干得产品。
20、在本发明的一些具体实施方案中,所述纳米颗粒fe(iii)-qu/cj nps制备步骤如下:分别取一定量的cro-jul、fe(iii)-qu和peg,cro-jul用dmso溶解,fe(iii)-qu和peg用pbs溶解,分别将cro-jul和fe(iii)-qu溶液逐滴加入到peg溶液中,并不断搅拌;制得的溶液除去溶剂,通过超声降低粒径,制备得纳米颗粒fe(iii)-qu/cj nps。
21、在本发明的一些具体实施方案中,分别取物质的量比为1:1:2的cro-jul、fe(iii)-qu、peg,然后cro-jul用dmso溶解,fe(iii)-qu和peg用pbs溶解,分别将cro-jul和fe(iii)-qu溶液逐滴加入到peg溶液中,并不断搅拌,制得的溶液通过旋蒸除去溶剂,通过超声降低粒径,制备得纳米颗粒fe(iii)-qu/cj nps。
22、本发明还提供了一种ptt/铁死亡/cdt协同治疗的纳米光诊疗试剂的制备方法,包括如下制备步骤:
23、cro-jul的合成:将一定量的久洛尼啶与克酮酸加入甲苯和正丁醇的体系中,室温搅拌一定时间后,加热回流反应,反应结束后,分离提出得化合物cro-jul;
24、fe(iii)-qu的合成:在不断搅拌下将fecl3乙醇溶液滴加到槲皮素乙醇溶液中,搅拌均匀,调节ph至碱性,反应一定时间,静置冷却后过滤,离心分离,无水乙醇洗涤,烘干得fe(iii)-qu。
25、fe(iii)-qu/cj nps的合成:
26、分别取一定量的cro-jul、fe(iii)-qu和peg,cro-jul用dmso溶解,fe(iii)-qu和peg用pbs溶解,分别将cro-jul和fe(iii)-qu溶液逐滴加入到peg溶液中,并不断搅拌;制得的溶液除去溶剂,通过超声降低粒径,制备得纳米颗粒fe(iii)-qu/cj nps。
27、在本发明的一些具体实施方案中,所述久洛尼啶与克酮酸的物质的量比大于等于2:1;所述fecl3和槲皮素的物质的量比为1:1;所述cro-jul、fe(iii)-qu和peg的物质的量比为1:1:2。
28、在本发明的一些具体实施方案中,ptt/铁死亡/cdt协同治疗的纳米光诊疗试剂的制备方法,包括如下制备步骤:
29、cro-jul的合成:将物质的量比为3:1的久洛尼啶与克酮酸加入甲苯和正丁醇的体系中,室温搅拌一定时间后,加热回流反应,反应结束后,分离提出得化合物cro-jul;
30、fe(iii)-qu的合成:在不断搅拌下按物质量比1:1的比例将0.5mol/l fecl3乙醇溶液滴加到0.5mol/l槲皮素乙醇溶液中,搅拌均匀,用5%naoh乙醇溶液调节ph至碱性,反应70min,静置冷却后过滤,3000r/min离心分离,无水乙醇洗涤2次,烘干得fe(iii)-qu;
31、fe(iii)-qu/cj nps的合成:分别取摩尔比为1:1:2的cro-jul、fe(iii)-qu和peg,cro-jul用dmso溶解,fe(iii)-qu和peg用pbs溶解,分别将cro-jul和fe(iii)-qu溶液逐滴加入到peg溶液中,并不断搅拌;制得的溶液通过旋蒸除去溶剂,通过超声降低粒径,制备得纳米颗粒fe(iii)-qu/cj nps。
32、本发明还提供了一种应用于生物成像、肿瘤治疗和肿瘤诊疗一体化的组合物,其包含上述纳米光诊疗试剂或上述制备方法制备的纳米光诊疗试剂。
33、本发明还提供了上述纳米光诊疗试剂或上述制备方法制备的纳米光诊疗试剂在生物成像、肿瘤治疗、肿瘤诊疗一体化中的应用。
34、本发明还提供了上述纳米光诊疗试剂在制备肿瘤治疗药物中的应用。
35、本发明还提供了上述纳米光诊疗试剂在制备抗人咽部鳞状癌肿瘤治疗药物中的应用。
36、本发明相对于现有技术具有如下的显著优点及效果:
37、1.在nir-ii光响应纳米材料中,无机纳米材料,例如金纳米颗粒、等离子金属簇、碳纳米管等,长期使用的生物相容性不明确;而一些小分子光敏剂,例如吲哚箐绿(icg)、二氢卟吩e6(ce6)等,稳定性较差,激光照射之后衰减明显。本发明中的光热材料cro-jul属于d-a-d共轭体系化合物,有着易合成制备、光稳定性好等优点。
38、2.槲皮素与铁离子的络合物,不仅用槲皮素克服了温和光热治疗带来的热休克蛋白上调,促进了光热疗效,并且fe(iii)在体内进行铁死亡和化学动力,实现联合疗法,达到联合增强的细胞凋亡作用。
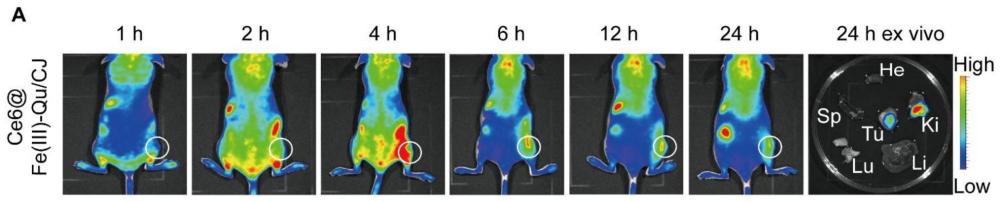
39、3.目前大多光热材料仅限于在nir-i光区间激发,由于光的穿透深度与波长相关,波长越长,穿透深度越深,受生物组织的散射干扰更小,因此在nir-i光激发往往只能治疗浅表肿瘤,而对于一些深处的肿瘤效果不佳;本发明中的纳米光诊疗试剂fe(iii)-qu/cjnps在nir-ii窗口有着广泛的吸收,能被nir-ii光激发,fe(iii)-qu/cj nps在980nm激光下激发,有利于光热治疗深层肿瘤,同时具有高效的生物组织穿透力,可以获得高分辨率和高对比度的肿瘤组织光声成像,在体内动物实验中表现出较好的生物相容性,因此,激光穿透更深,在nir-ii窗口进行ptt可以治疗体内更深的肿瘤,改善治疗结果。
40、4.与目前仅有单一性能的材料不同,本发明中的纳米颗粒fe(iii)-qu/cj nps集优秀的ptt、铁死亡和cdt于一身,结合荧光成像和pai实现诊疗一体化。
- 还没有人留言评论。精彩留言会获得点赞!