一种蚕丝蛋白生物膜及其制备方法与应用与流程
本技术涉及有机高分子聚合物材料,具体涉及一种蚕丝蛋白生物膜及其制备方法与应用。
背景技术:
1、骨组织是人体内具有一定自愈能力的组织,小范围的缺损通常可以自愈,但较大范围的缺损如临界骨缺损则无法实现自我修复。外伤、肿瘤、感染等因素可使骨组织出现超出自愈能力范围的骨缺损。引导性骨再生(gbr)技术是目前临床上常用的治疗方法之一。在骨增量手术中,由于软组织的生长速度较骨组织快,为维持一定的成骨空间,具有屏障功能和空间维持能力的gbr膜发挥着不可或缺的功能。与传统的不可降解gbr膜相比,可降解gbr膜具有不需二次手术取出,减少患者痛苦的独特优势。bio-gide胶原膜是目前临床应用最为广泛的可降解gbr膜,但其在湿态条件下机械性能较差,且其胶原成分来源于人或动物,不仅造价昂贵,还可能造成某些疾病的传播,并且在植入后降解速度过快,影响其在植入部位稳定发挥屏障功能,使其在实际的临床应用中具有一定的局限性。
2、蚕丝蛋白材料是人类最早利用开发的天然蛋白质材料之一。蚕丝蛋白为蚕丝的主要构成材料(约占蚕丝质量的70%),是具有现代科技特点的一种绿色生物基材料。相比于其它蛋白质材料和有机聚合物材料,蚕丝蛋白具有独特而优异的生物、光学和机械性能,包括无人体排斥反应、人体可吸收、溶解和降解速率可调控、高力学强度、来源广泛等,因而在诸多新的前沿领域中扮演着重要的角色。国内外学者对蚕丝蛋白生物膜进行了大量的研究,发现蚕丝蛋白生物膜的力学性能及屏障能力主要与蚕丝蛋白生物膜的比表面积、表面微结构以及温度、ph、丝素浓度、离子键和有机溶剂(甘油、乙醇等)等因素密切相关。然而,目前的蚕丝蛋白生物膜在力学性能、制备方法等方面存在诸多限制,如何针对不同组织面的不同功能需求进行梯度功能设计以获得无交联剂、兼具生物安全性、优良力学性能和屏障能力并有利于细胞黏附的蚕丝蛋白生物膜仍是该领域内的技术难点。
技术实现思路
1、基于现有技术存在的缺陷,本技术的目的在于提供一种蚕丝蛋白生物膜及其制备方法与应用,该蚕丝蛋白生物膜具有结构梯度和功能梯度,其第一蚕丝蛋白膜(即致密层)可抵抗细菌及细胞黏附,并提供足够的力学强度以满足gbr技术临床使用的需要;第二蚕丝蛋白膜(即疏松层)利于细胞黏附,在第一和第二蚕丝蛋白膜的共同作用下,该蚕丝蛋白生物膜能有效治疗骨缺损。
2、为了达到上述目的,第一方面本技术提供了一种蚕丝蛋白生物膜,包括第一蚕丝蛋白膜和第二蚕丝蛋白膜;
3、所述第一蚕丝蛋白膜无孔;
4、所述第二蚕丝蛋白膜具有多孔结构;
5、所述第二蚕丝蛋白膜设置在所述第一蚕丝蛋白膜一面上;
6、所述第一蚕丝蛋白膜和所述第二蚕丝蛋白膜中的蚕丝蛋白均不溶于水。
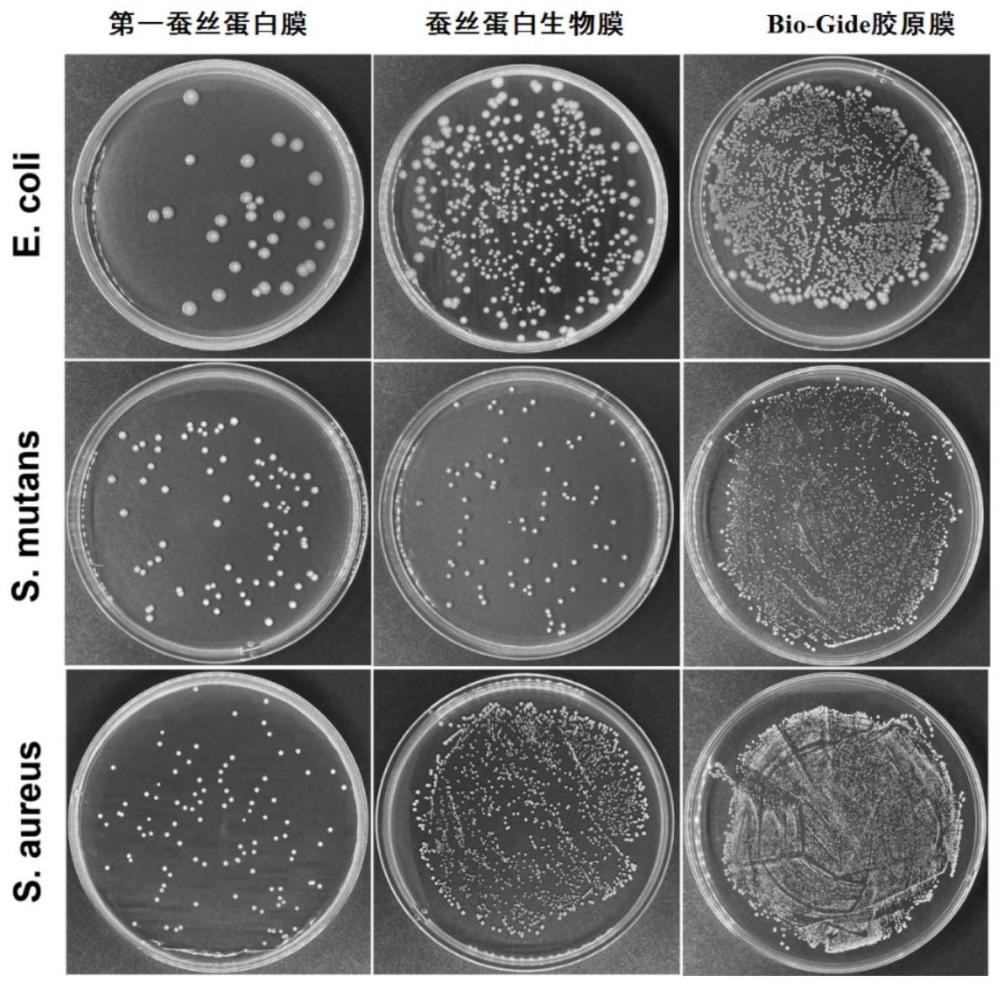
7、上述蚕丝蛋白生物膜具有结构梯度和功能梯度,具体而言,其包括两层不同结构的蚕丝蛋白膜,其中第一蚕丝蛋白膜为致密膜,利用扫描电子显微镜(sem)观察其不具有孔洞结构,其具有屏障功能,可以抵抗细菌及细胞黏附,并提供足够的力学强度以满足gbr技术临床使用的需要;第二蚕丝蛋白膜为疏松膜,利用扫描电子显微镜(sem)观察其具有多孔结构,具有一定的可湿性,有利于细胞黏附。当上述蚕丝蛋白生物膜用于骨缺损修复时,第一蚕丝蛋白膜朝向骨组织面,可在很大程度上降低外侧的细胞及细菌在其表面的附着,以防止或减弱它们对内侧微环境的干扰;第二蚕丝蛋白膜朝向软组织面,有利于内侧细胞的黏附。在第一蚕丝蛋白膜和第二蚕丝蛋白膜共同作用下,上述蚕丝蛋白生物膜能够有效修复骨缺损。
8、在一些实施例中,所述蚕丝蛋白生物膜满足以下条件中的至少一条:
9、a)所述第一蚕丝蛋白膜的厚度为50~500μm;
10、b)所述第二蚕丝蛋白膜的厚度为10~1000μm;
11、c)所述第一蚕丝蛋白膜和所述第二蚕丝蛋白膜的面积均为0.1~1000cm2;
12、d)所述第二蚕丝蛋白膜中包含药物。
13、优选所述第一蚕丝蛋白膜的厚度在50~500μm范围内,如50μm、80μm、100μm、200μm、300μm、400μm、500μm或以上任意两个数值形成的范围,以使兼顾力学强度满足手术需要和合适的体内降解时间,在1年以内。
14、优选所述第二蚕丝蛋白膜的厚度在10~1000μm范围内,如10μm、50μm、100μm、200μm、300μm、400μm、500μm、600μm、700μm、800μm、900μm、1000μm或以上任意两个数值形成的范围,以使表面粗糙度、液体浸润量等性能满足实际临床需求,同时当所述第二蚕丝蛋白膜负载药物时,还使药物负载和缓释时间满足临床使用需求在手术后3个月内持续缓释。
15、根据手术覆盖面积大小,选择适宜的所述第一蚕丝蛋白膜和所述第二蚕丝蛋白膜的面积。在一些实施例中,选择它们的面积在0.1~1000cm2范围内,如0.1cm2、1cm2、10cm2、50cm2、100cm2、200cm2、300cm2、400cm2、500cm2、600cm2、700cm2、800cm2、900cm2、1000cm2或以上任意两个数值形成的范围。所述第一蚕丝蛋白膜和所述第二蚕丝蛋白膜的面积可以相同,也可以不同。这里的面积均是指单面面积,下同。
16、当所述第二蚕丝蛋白膜中包含药物时,该蚕丝蛋白膜相当于药物载体,能实现药物的缓释,进一步促进骨缺损的修复。其中,第二蚕丝蛋白膜中的药物可选择具有促进骨生长功能、以及抗炎抑菌的药物,如细胞因子bmp-2、青霉素等。
17、第二方面,本发明提供了一种所述蚕丝蛋白生物膜的制备方法,其包括以下步骤:
18、(1)将蚕丝蛋白水溶液浇铸或者涂布成膜,得到蚕丝蛋白单层膜;
19、(2)对所述蚕丝蛋白单层膜进行真空-水蒸气处理,得到第一蚕丝蛋白膜;
20、(3)将蚕丝蛋白水溶液涂布在所述第一蚕丝蛋白膜的一面上,冷冻,干燥,再进行真空-水蒸气处理,即得蚕丝蛋白生物膜。
21、步骤(3)中所用蚕丝蛋白水溶液中可以添加药物,也可以不添加药物。当其添加药物时,所得第二蚕丝蛋白膜中负载有药物,能够实现药物的缓释,进一步促进骨修复。
22、上述制备方法在制备第一蚕丝蛋白膜和第二蚕丝蛋白膜时都进行了真空-水蒸气处理,以使蚕丝蛋白发生交联而不溶于水,从而确保所得蚕丝蛋白生物膜在湿润条件下仍具有较好的机械性能。相比步骤(2)用热交联(如未利用水蒸气的真空或非真空加热处理等)替代真空-水蒸气处理所得蚕丝蛋白生物膜,上述制备方法所得蚕丝蛋白生物膜具有更好的机械性能,如拉伸强度更高,这可能是因为在真空-水蒸气处理过程中蚕丝蛋白单层膜中水分不易挥发,所得第一蚕丝蛋白膜无孔,而热交联过程中蚕丝蛋白单层膜中水分挥发较快,使所得第一蚕丝蛋白膜出现孔洞,导致其机械性能较差。相比步骤(2)和(3)中添加交联剂的交联方式,真空-水蒸气处理所得蚕丝蛋白生物膜成分更简单,更加安全。另外,步骤(3)中所用蚕丝蛋白水溶液中添加药物时,相比热交联、添加交联剂等交联方式,真空-水蒸气处理更有利于药物活性的保持,避免其失活。上述制备方法制备过程简单,便于工业化生产。
23、在一实施例中,步骤(1)中,成膜条件如下:环境温度为0℃~35℃,环境湿度为10%~90%。通过控制环境的温度和湿度在上述范围内,以使蚕丝蛋白水溶液在成膜过程中,水分缓慢挥发,避免所得第一蚕丝蛋白膜出现孔洞。其中,环境温度可选择0℃、5℃、10℃、15℃、20℃、25℃、30℃、35℃或以上任意两个数值形成的范围;环境湿度可选择10%、20%、30%、40%、50%、60%、70%、80%、90%或以上任意两个数值形成的范围。
24、在一实施例中,步骤(2)和步骤(3)中,真空-水蒸气处理条件均如下:压强为0~20kpa,温度为1℃~50℃,湿度为80%~100%,时间为1~72h。其中,真空度可选择1kpa、5kpa、10kpa、15kpa、20kpa或以上任意两个数值形成的范围;交联时间可选择1h、5h、10h、20h、30h、40h、50h、60h、70h、72h或以上任意两个数值形成的范围。
25、在一实施例中,步骤(1)和步骤(3)中,所用蚕丝蛋白水溶液中蚕丝蛋白的质量分数均为1%~10%,如1%、3%、5%、7%、10%或以上任意两个数值形成的范围,以获得良好的成膜平整度。为获得更好的成膜平整度,选择步骤(1)和步骤(3)中所用蚕丝蛋白水溶液中蚕丝蛋白的质量分数均为5%~8%。
26、步骤(3)中的涂布方式无具体限制,作为一个示例,涂布方式可选择刮涂法、刷涂法及喷涂法等。
27、在一实施例中,步骤(3)中,在涂布和冷冻之间进行静置处理,其中静置处理的时间为2min~5h,如2min、10min、20min、40min、1h、2h、3h、4h、5h或以上任意两个数值形成的范围。通过静置处理,使溶液分布更均匀,避免大气泡和局部溶液量过多。
28、在一实施例中,在步骤(3)中的冷冻过程中,冰晶沿垂直且背离所述第一蚕丝蛋白膜的方向生长,冰晶会首先在接触的低温材料界面形成,然后进一步生长。
29、在一实施例中,所述制备方法满足以下条件中的至少一条:
30、a)步骤(3)中,所述冷冻的条件如下:冷冻温度为-20~-196℃,冷冻时间为1~72h。
31、b)步骤(3)中,所述干燥的方式为冷冻干燥。
32、将蚕丝蛋白水溶液涂布在所述第一蚕丝蛋白膜的一面上后进行冷冻处理,有利于其形成多孔结构。作为一个示例,步骤(3)中,所述冷冻的条件如下:冷冻温度为-20~-196℃,冷冻时间为1~72h,其中,冷冻温度可选择-20℃、-50℃、-100℃、-150℃、-196℃或以上任意两个数值形成的范围;冷冻时间可选择1h、5h、10h、20h、30h、40h、50h、60h、70h、72h或以上任意两个数值形成的范围。
33、相比其他干燥方式,步骤(3)中干燥方式选择冷冻干燥,冷冻干燥可以保持蚕丝蛋白在干燥过程中分子结构不发生较大变化。作为一个示例,冷冻干燥温度可选择-60~0℃,压强可选择0~0.05mpa;冷冻干燥时间可选择1~72h。
34、在一实施例中,步骤(1)和步骤(3)中所用蚕丝蛋白水溶液的制备方法均包括以下步骤:
35、(i)将蚕茧置于碱液中加热以进行脱胶,得到蚕丝;
36、(ii)将所得蚕丝用水进行洗涤,干燥,得到干燥的蚕丝;
37、(iii)将所得干燥的蚕丝浸没于锂盐溶液中进行加热,得到蚕丝蛋白与锂盐的混合液;
38、(iv)将所得蚕丝蛋白与锂盐的混合液装入透析袋中,置于水中透析;
39、(v)透析后,将所述透析袋中的液体进行固液分离,得到蚕丝蛋白水溶液。
40、作为一个示例,步骤(i)中所用蚕茧选择为去除蚕蛹的蚕茧壳,其中,蚕茧壳既可以是整体开口的蚕茧壳,也可以是剪碎的蚕茧壳,如剪碎成条形、方形或其他形状,剪碎的蚕茧壳的面积可选择为1mm21000mm2,如1mm2、10mm2、50mm2、100mm2、200mm2、300mm2、400mm2、500mm2、600mm2、700mm2、800mm2、900mm2、1000mm2或以上任意两个数值形成的范围。
41、作为一个示例,步骤(i)中的加热条件为:加热温度为50℃~121℃,加热压强为0.1mpa~2mpa,加热时间为1s~1000h,其中加热温度可选择为50℃、60℃、70℃、80℃、90℃、100℃、110℃、121℃或以上任意两个数值形成的范围;加热压强可选择为0.1mpa、0.5mpa、1mpa、1.5mpa、2mpa或以上任意两个数值形成的范围;加热时间可选择为1s、1min、1h、100h、500h、1000h或以上任意两个数值形成的范围。加热方式无具体限制,如可选择为电炉加热、高压锅加热等。
42、作为一个示例,步骤(ii)中洗涤所用水为去离子水或超纯水。
43、作为一个示例,步骤(ii)中洗涤为浸泡,如搅拌浸泡、静置浸泡,其中,搅拌浸泡的搅拌方式为机械搅拌或磁力搅拌,搅拌速度为1r/min~2000r/min;单次洗涤过程中,蚕丝和水质量比为1∶10~1∶1000,时间为1s~200h,每次洗涤后取出蚕丝并挤干,洗涤重复次数为1~50次。
44、作为一个示例,步骤(ii)中干燥方式为自然风干或加热通风干燥,其中,加热通风干燥的加热温度为40℃~100℃,干燥时间为0.1h~100h。
45、作为一个示例,步骤(ⅲ)中所用锂盐溶液为libr或者liscn溶液,其中锂盐浓度为0.01g/ml~2g/ml,干燥的蚕丝与锂盐溶液的比例为(1~100)g∶100ml。
46、作为一个示例,步骤(ⅲ)中的加热条件为:加热温度为20℃~100℃,加热时间为0.1h~100h。
47、作为一个示例,步骤(iv)中所用透析袋规格为10~10000000da,透析方式为静置透析或磁力搅拌透析,其中,透析过程中换水的时间间隔为0.1h~100h,每次所换水的体积为1ml~1000l,换水次数为8-10次;当采用磁力搅拌透析时,搅拌速度为1r/min~2000r/min。
48、作为一个示例,步骤(v)中固液分离的方式为离心分离,离心分离的转速为1r/min~40000r/min,时间为1s~10h,离心时的温度为-3℃~10℃。
49、第三方面,本技术还提供了所述蚕丝蛋白生物膜或所述制备方法制得的蚕丝蛋白生物膜在制备引导骨再生膜中应用。
50、相比现有技术,本技术的有益效果在于:
51、(1)本技术蚕丝蛋白生物膜包括致密的第一蚕丝蛋白膜和多孔的第二蚕丝蛋白膜,其中第一蚕丝蛋白膜可在很大程度上降低外侧的细胞及细菌在其表面的附着,以防止或减弱它们对内侧微环境的干扰;第二蚕丝蛋白膜粗糙多孔,具有一定的可湿性,有利于内侧细胞的黏附,在第一蚕丝蛋白膜和第二蚕丝蛋白膜共同作用下,该蚕丝蛋白生物膜能有效治疗骨缺损。
52、(2)本技术蚕丝蛋白生物膜具有良好的屏障功能、力学性能和生物兼容性,且制备方法简单,便于工业化生产与推广应用。
53、(3)本技术蚕丝蛋白生物膜可用于负载药物,以将药物和生物活性物质复合实现封装,作为药物缓释体系实现药物的缓慢释放,可广泛应用于生物屏障膜及药物可控缓释膜等方向。
- 还没有人留言评论。精彩留言会获得点赞!