一种USP5抑制剂在制备抗病毒药物中的用途的制作方法
本发明涉及一种usp5抑制剂在制备抗病毒药物中的用途,属于生物医药。
背景技术:
1、病毒感染性疾病一直严重威胁着人类的健康与生命安全。天然免疫是机体抵抗病毒入侵的第一道防线,病毒感染机体后,模式识别受体(pattern-recognition receptor,prr)识别入侵病原的核酸,激活下游接头分子,诱导i型干扰素(ifn-i)、干扰素刺激基因(isgs)和炎性细胞因子的表达,从而激活机体抗病毒免疫防御机制,抑制病毒的入侵和复制。细胞质内有两类重要的核酸识别受体/接头物分子:一类负责识别dna病毒核酸,如cgas-sting信号轴;另一类负责识别rna病毒核酸,如rig-i/mda5-mavs信号轴。这些核酸识别受体-接头物分子是宿主细胞识别病毒后触发抗病毒天然免疫的先决条件,因此其活性受到严密调控[1]。
2、非锚定泛素(unanchored ubiquitin)是一类细胞内游离的泛素分子,近年来越来越多的研究发现,非锚定泛素作为第二信使,直接参与多个免疫调控关键分子如rig-i/mda5-mavs的活性调节[2-4]。我们的前期研究首次发现,非锚定泛素作为细胞内源性激动剂,直接活化抗dna病毒的关键分子sting,促进机体抗病毒免疫。usp5(ubiquitin specificprotease 5)又叫异肽酶t(isopeptidase t,isot),是目前哺乳动物细胞中公认的特异降解非锚定泛素的去泛素化酶(deubiquitinase,dub)[5-7]。
3、usp5与多种肿瘤的发生发展有关,其抑制剂也被广泛应用于干扰多种肿瘤的形成。而在抗病毒天然免疫的应答过程中,目前尚无usp5特异性激动剂或抑制剂有效用于感染性疾病尤其是dna病毒感染性疾病的研究报道。已有多种usp5的抑制剂被开发出来,可以有效抑制usp5的活性。如pr-619可以靶向usp5[8],已应用于多种疾病模型的研究中。在神经细胞里,usp5抑制剂pr-619处理会引起神经细胞内蛋白质聚集体形成,可能与神经退行性疾病的发生有关[9]。在肿瘤研究方面,pr-619具有抑制多种肿瘤细胞的功能。pr-619可以有效抑制膀胱尿路上皮癌(urothelial carcinoma,uc),并增强顺铂诱导的uc的细胞毒性[10]。pr-619与pd1抗体联合用药,更高效地抑制结肠癌的形成,对于常规免疫疗法不敏感的患者,具有良好的应用前景[11]。pr-619通过减少细胞增殖和内质网应激相关的细胞凋亡抑制人软骨肉瘤形成[12]。对于食管癌pr-619亦具有良好的抑制作用[13]。但是pr-619通过靶向usp5对于治疗病毒感染性疾病特别是dna病毒感染性疾病的效果,目前尚无充分明确的实验证据。usp5通过znf_ubp结构域特异识别非锚定多聚泛素链的游离c端双甘氨酸(gg)基序,从泛素链的近端即c端逐一移除泛素分子。新近开发出来的小分子抑制剂,如compound21,针对usp5的znf_ubp结构域设计,可特异抑制usp5活性,阻碍底物分子上的非锚定泛素的清除[14]。目前尚无compound 21应用于任何疾病研究的报道,对于宿主抗病毒天然免疫的调控也未有任何研究数据。
4、usp5的dub活性受到抑制,可以促进底物分子上非锚定泛素的积累,从而活化相应底物分子。而这些底物分子包括sting、rig-i、mda5、mavs等,在抗病毒免疫信号转导过程中均是最为核心的分子,对于dna或rna病毒感染引起的抗病毒天然免疫至关重要。制备usp5抑制剂类药物用于调控机体的抗病毒免疫反应,对于病毒感染性疾病的预防和治疗将具有重要价值和意义。
5、引用文献:
6、[1]j.wu,z.j.chen,innate immune sensing and signaling of cytosolicnucleic acids,annu rev immunol,32(2014)461-488.
7、[2]w.zeng,l.sun,x.jiang,x.chen,f.hou,a.adhikari,m.xu,z.j.chen,reconstitution of the rig-i pathway reveals a signaling role of unanchoredpolyubiquitin chains in innate immunity,cell,141(2010)315-330.
8、[3]b.song,y.chen,x.liu,f.yuan,e.y.j.tan,y.lei,n.song,y.han,b.d.pascal,p.r.griffin,c.luo,b.wu,d.luo,j.zheng,ordered assembly of thecytosolic rna-sensing mda5-mavs signaling complex via binding to unanchoredk63-linked poly-ubiquitin chains,immunity,54(2021)2218-2230e2215.
9、[4]f.liu,w.zhuang,b.song,y.yang,j.liu,y.zheng,b.liu,j.zheng,w.zhao,c.gao,mavs-loaded unanchored lys63-linked polyubiquitin chains activate therig-i-mavs signaling cascade,cell mol immunol,(2023).
10、[5]j.r.blount,s.l.johnson,s.v.todi,unanchored ubiquitin chains,revisited,front cell dev biol,8(2020)582361.
11、[6]s.dayal,a.sparks,j.jacob,n.allende-vega,d.p.lane,m.k.saville,suppression of the deubiquitinating enzyme usp5 causes the accumulation ofunanchored polyubiquitin and the activation of p53,the journal of biologicalchemistry,284(2009)5030-5041.
12、[7]d.scott,j.strachan,v.g.krishna,b.shaw,d.j.tooth,m.s.searle,n.j.oldham,r.layfield,method for the purification of endogenous unanchoredpolyubiquitin chains,methods in molecular biology,1449(2016)203-213.
13、[8]m.altun,h.b.kramer,l.i.willems,j.l.mcdermott,c.a.leach,s.j.goldenberg,k.g.kumar,r.konietzny,r.fischer,e.kogan,m.m.mackeen,j.mcgouran,s.v.khoronenkova,j.l.parsons,g.l.dianov,b.nicholson,b.m.kessler,activity-basedchemical proteomics accelerates inhibitor development fordeubiquitylating enzymes,chembiol,18(2011)1401-1412.
14、[9]v.seiberlich,o.goldbaum,v.zhukareva,c.richter-landsberg,the smallmoleculeinhibitor pr-619 of deubiquitinating enzymes affects the microtubulenetwork and causesprotein aggregate formation in neural cells:implicationsfor neurodegenerative diseases,biochimica et biophysica acta,1823(2012)2057-2068.
15、[10]f.s.hsu,w.c.lin,k.l.kuo,y.l.chiu,c.h.hsu,s.m.liao,j.r.dong,s.h.liu,s.c.chang,s.p.yang,y.t.chen,r.j.chang,k.h.huang,pr-619,a generalinhibitor ofdeubiquitylating enzymes,diminishes cisplatin resistance inurothelial carcinoma cellsthrough the suppression of c-myc:an in vitro and invivo study,international journal ofmolecular sciences,22(2021).
16、[11]j.wu,c.liu,t.wang,h.liu,b.wei,deubiquitinase inhibitor pr-619potentiatescolon cancer immunotherapy by inducing ferroptosis,immunology,170(2023)439-451.
17、[12]w.c.lin,y.l.chiu,k.l.kuo,p.m.chow,c.h.hsu,s.m.liao,j.r.dong,s.c.chang,s.h.liu,t.j.liu,f.s.hsu,k.c.wang,y.c.lin,c.c.chang,k.y.huang,anti-tumoreffects of deubiquitinating enzyme inhibitor pr-619 in humanchondrosarcoma throughreduced cell proliferation and endoplasmic reticulumstress-related apoptosis,am j cancer res,13(2023)3055-3066.
18、[13]l.wang,m.li,b.sha,x.hu,y.sun,m.zhu,y.xu,p.li,y.wang,y.guo,j.li,j.shi,p.li,t.hu,p.chen,inhibition of deubiquitination by pr-619 inducesapoptosis andautophagy via ubi-protein aggregation-activated er stress inoesophageal squamous cellcarcinoma,cell prolif,54(2021)e12919.
19、[14]mandeep k.mann,ivan franzoni,renato ferreira de freitas,wolframtempel,scott houliston,leanna smith,masoud vedadi,cheryl h.arrowsmith,rachelj.harding,and matthieu schapira,discovery of small molecule antagonists ofthe usp5 zinc finger ubiquitin-binding domain,j.med.chem.,(2019)62,10144-10155.
技术实现思路
1、发明要解决的问题
2、usp5在抗病毒方面的功能尚不明确,并且在病毒感染性疾病方面,usp5抑制剂,例如pr-619、compound 21,是否可以通过增加抗病毒天然免疫信号通路关键分子上的非锚定泛素链,增进宿主的抗病毒能力,目前也尚未有研究。
3、用于解决问题的方案
4、本发明中的体内、体外实验结果都显示,usp5可以降解sting上的非锚定泛素,从而抑制sting介导的抗病毒免疫反应,加剧病毒感染机体。因此,usp5可以作为一个新的免疫调控靶点,用于病毒感染性疾病的预防与治疗。此外,鉴于非锚定泛素可以活化多个抗病毒关键分子,usp5抑制剂可以抑制多个底物分子上的非锚定泛素降解过程,其作用将具有多靶点性和高效性,对于病毒感染性疾病,尤其是多靶点活化的复杂病因的感染性疾病,usp5抑制剂将具有更为广泛、更加高效的应用价值。
5、本发明旨在提供靶向usp5的抑制剂在制备预防和/或治疗病毒感染或病毒感染相关疾病和/或病症的产品中的用途,通过抑制usp5活性,促进抗病毒免疫调控关键分子的非锚定泛素化水平的积累与活化,增强宿主细胞抗病毒天然免疫,实现预防和/或治疗病毒感染性疾病的目的。
6、本发明所要解决的技术问题通过以下技术方案予以实现:
7、[1].靶向usp5的抑制剂在制备用于预防和/或治疗病毒感染或与病毒感染相关的疾病和/或病症的产品中的用途;
8、优选地,所述病毒为dna病毒;
9、更优选地,所述病毒为疱疹病毒(hsv-1)或痘苗病毒(vacv)。
10、[2].根据[1]所述的用途,其中,所述靶向usp5的抑制剂包括核酸、多肽、核糖核蛋白复合体和小分子抑制剂中的至少一种;
11、任选地,所述核酸包括反义rna分子和rna干扰分子中的至少一种;
12、任选地,所述多肽包括抗体或其抗原结合片段、人工锌指核酸酶和转录激活因子样效应物核酸酶中的至少一种;
13、任选地,所述核糖核蛋白复合体包括crispr/cas9系统。
14、[3].根据[1]或[2]所述的用途,其中,所述靶向usp5的抑制剂包括小分子抑制剂,优选地,所述靶向usp5的抑制剂为pr-619和/或compound 21。
15、[4].根据[1]~[3]任一项所述的用途,其中,所述预防和/或治疗病毒感染包括(a1)~(a3)中至少一项:
16、(a1)保护宿主防止病毒的感染;
17、(a2)增强宿主对病毒感染的抵抗作用;
18、(a3)降低因病毒感染引发的宿主的组织器官损伤。
19、[5].根据[4]所述的用途,其中,所述宿主为可受到病毒感染的动物。
20、[6].根据[5]所述的用途,其中,所述宿主包括哺乳动物。
21、[7].根据[6]所述的用途,其中,所述哺乳动物包括小鼠、大鼠、豚鼠、牛、羊、猫,狗、马、兔、猪、猴和人。
22、[8].根据[1]~[7]任一项所述的用途,其中,所述与病毒感染相关的疾病和/或症状为选自下组中的一种或多种:
23、(b1)感染引起的病理损伤;
24、(b2)感染后细胞因子产生不足;
25、(b3)病毒感染导致的炎症性疾病。
26、[9].根据[8]所述的用途,其中,所述病理损伤包括心脏、胃部、肝脏、脾脏、肺部、脑部、肠道和/或肾脏的病理损伤;
27、可选地,所述细胞因子包括白细胞介素、干扰素、肿瘤坏死因子、集落刺激因子、趋化因子和/或生长因子;
28、可选地,所述炎症疾病包括自身免疫性疾病;
29、任选地,所述炎症疾病包括炎症性肠病、类风湿性关节炎、系统性红斑狼疮、慢性肾炎、结核病和/或慢性胃肠道疾病。
30、[10].靶向usp5的抑制剂在制备sting活化剂中的用途,所述靶向usp5的抑制剂包括核酸、多肽、核糖核蛋白复合体和小分子抑制剂中的至少一种;
31、任选地,所述核酸包括反义rna分子和rna干扰分子中的至少一种;
32、任选地,所述多肽包括抗体或其抗原结合片段、人工锌指核酸酶和转录激活因子样效应物核酸酶中的至少一种;
33、任选地,所述核糖核蛋白复合体包括crispr/cas9系统;
34、任选地,所述小分子抑制剂包括pr-619和/或compound 21。
35、发明的效果
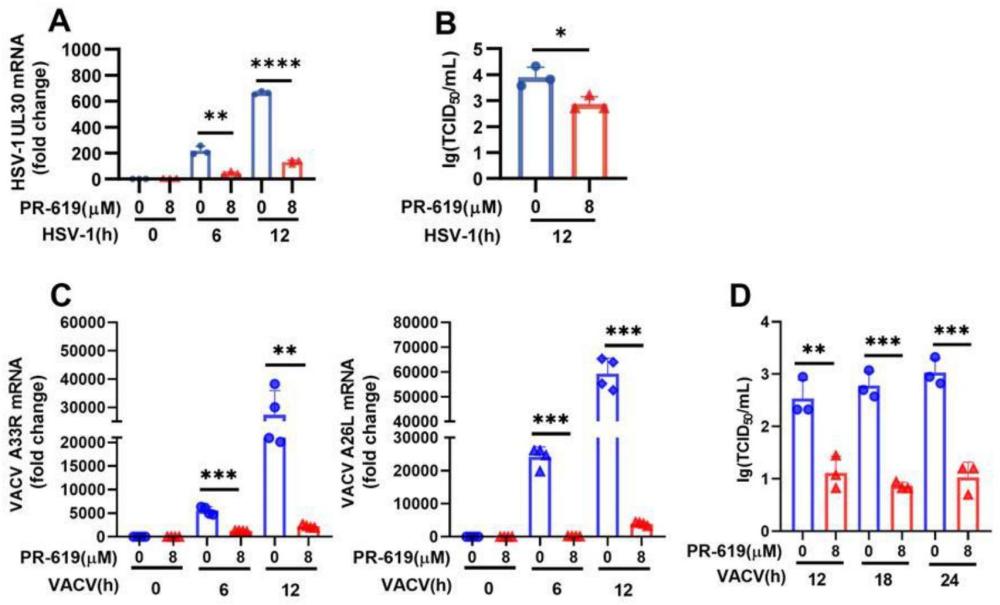
36、本发明发现了抑制usp5基因的表达可以促进细胞中sting信号的活化、增强sting和tbk1的磷酸化、促进下游ifn-i信号通路的活化和isgs的产生,从而引发抗病毒免疫反应,对抗病毒感染。进一步地,本发明提供了靶向usp5的抑制剂、并提供了所述靶向usp5的抑制剂在制备用于预防和/或治疗病毒感染或与病毒感染相关的疾病和/或病症的产品中的用途,利用所述靶向usp5的抑制剂处理细胞,在安全剂量范围内,能较为显著地增强宿主细胞抗病毒免疫反应,且还能增强宿主细胞抵抗病毒感染的能力,降低病毒载量。
- 还没有人留言评论。精彩留言会获得点赞!