一种纳米药物共负载谷氨酰胺和谷氨酰胺转运体抑制剂的用药方法及其抗肿瘤的应用
本发明属于生物医药材料,尤其涉及一种纳米药物共负载谷氨酰胺和谷氨酰胺转运体抑制剂的用药方法及其抗肿瘤的应用。
背景技术:
1、谷氨酰胺是一种天然氨基酸,是一个条件必需氨基酸,也是人体内含量最高的自由氨基酸,其与细胞物质能量代谢的各个环节密不可分。谷氨酰胺既可以为蛋白、氨基酸和核酸的合成提供碳源和氮源,又可以参与氧化磷酸化释放能量,并且在细胞营养信号传导中有着十分重要的作用。相较于正常细胞,肿瘤细胞对谷氨酰胺获取、转化和代谢等行为表现出极大的异质性,这归结于克氏大鼠肉瘤病毒癌基因同源物(kras)等癌变驱动基因突变而导致的谷氨酰胺代谢重编程。具体表现包括:增加谷氨酰胺的摄取、上调基于谷氨酰胺的物质合成、上调与谷氨酰胺相关的抗氧化代谢、增强谷氨酰胺代谢途径的营养信号传导和借助谷氨酰胺形成特异性的肿瘤微环境等。因此,谷氨酰胺代谢重排是肿瘤的发生和发展的重要影响因素,并且影响着肿瘤的扩散、侵染和转移。此外,近期研究表明,谷氨酰胺利于临床肿瘤治疗中的肿瘤细胞的凋亡耐药和免疫逃逸。正是由于谷氨酰胺有着如此重要的作用,多种肿瘤细胞对谷氨酰胺的需求量大幅上调,肿瘤细胞中谷氨酰胺的需求量是其他氨基酸的数十倍,多种肿瘤细胞存在着谷氨酰胺成瘾的现象。
2、肿瘤细胞的谷氨酰胺供应途径有内源性的谷氨酰胺的合成和外源性的谷氨酰胺的摄取。由于有限的胞内营养物质,外源性的谷氨酰胺的摄取是主要的供应途径,该途径进一步可分为通过内吞作用摄取细胞外含谷氨酰胺的物质和通过氨基酸转运体摄取分子谷氨酰胺。为了适应营养水平多变的肿瘤微环境,肿瘤细胞的两条谷氨酰胺供应途径存在互补,当某一供应途径无法满足谷氨酰胺代谢需求时,另一途径可适应性上调增加谷氨酰胺的摄入。同时,为了满足高水平的谷氨酰胺供应需求,外源性谷氨酰胺的摄取的两条途径肿瘤细胞中都被大幅上调,在临床治疗中,肿瘤细胞上调的谷氨酰胺供应途径也逐步成为一个用药靶点。
3、一方面,在内吞作用摄取细胞外含谷氨酰胺的物质中,肿瘤细胞内吞行为增强并产生了特异性巨胞饮内吞,这种上调内吞摄取谷氨酰胺等营养物质的行为在临床治疗中已成为一种可行的药物递送策略。以谷氨酰胺为基础的小分子药物类、聚谷氨酰胺类、谷氨酰胺组装体、含谷氨酰胺多肽和蛋白类纳米药物在肿瘤细胞中存在着的摄取偏好,并被广泛应用于肿瘤的诊断和治疗。但在肿瘤治疗中的纳米药物递送效率的探究中,包括以谷氨酰胺为基础的纳米药物在内的多数纳米药物,其递送效率仍处于极低的水平,相关纳米药物的递送效率仍有待提高。而考察纳米药物的临床给药方式,在静脉给药、口服给药、经皮给药、涂敷和灌注等多种给药方式中,肿瘤细胞对纳米药物的摄取是必不可少的一个环节,提高纳米药物的摄取效率将十分利于纳米药物疗效的提高。因此,仍需要开发一种简易、普适且高效的用药策略来提高纳米药物摄取效率。
4、另一方面,在转运体摄取分子谷氨酰胺中,肿瘤细胞细胞膜表面过表达谷氨酰胺转运体摄取细胞外的小分子谷氨酰胺,包括丙氨酸-丝氨酸-半胱氨酸转运体2(asct2)、l型氨基酸转运体1(lat1)、na+-偶联中性氨基酸转运体(snats)和氨基酸转运体b0,+(atb0,+)。其中,asct2是主要的谷氨酰胺转运体,包括v9302、l-γ-谷氨酰-(对硝基苯胺)(gpna)、s-苄基-l-半胱氨酸(bzlcys)和o-苄基-l-丝氨酸(bzlser)在内的asct2抑制剂,其可在药理学上阻断asct2,限制谷氨酰胺分子摄取,从而阻断谷氨酰胺物质能量代谢、增大胞内氧化应激、抑制癌细胞生长和增殖以实现谷氨酰胺饥饿治疗。但截至目前,肿瘤治疗中仍没有谷氨酰胺转运体抑制剂获批进入临床用药,这归结于肿瘤细胞完善的谷氨酰胺饥饿适应机制,包括增加谷氨酰胺合成,利用葡萄糖等营养物质替代使用和转变谷氨酰胺获取方式等。因此,目前仍需优化谷氨酰胺转运体抑制剂用药策略以增强其肿瘤治疗效果。
5、为避免上述技术问题,确有必要提供一种纳米药物共负载谷氨酰胺和谷氨酰胺转运体抑制剂的用药方法及其抗肿瘤的应用以克服现有技术中的所述缺陷。
技术实现思路
1、本发明的目的在于提供一种纳米药物共负载谷氨酰胺和谷氨酰胺转运体抑制剂的用药方法及其抗肿瘤的应用,旨在解决上述技术问题。
2、本发明选择一种fe/谷氨酰胺超分子自组装纳米药物作为谷氨酰胺纳米药物模型,纳米药物制备原料为fecl3·6h2o和谷氨酰胺,进一步选取多种谷氨酰胺转运体抑制剂,包括v-9302、l-γ-谷氨酰对硝基苯胺(gpna)、s-苄基-l-半胱氨酸(bzlcys)、o-苄基-l-丝氨酸(bzlser)、雷洛昔芬、他莫昔芬、2-氨基双环-(2,2,1)-庚烷-2-羧酸(bch)、jph203以及α-(甲基氨基)异丁酸(meaib)。首先将fecl3·6h2o和谷氨酰胺配制成一定浓度的水溶液,依照谷氨酰胺转运体抑制剂的水/油溶性配置成一定浓度的水/二甲基亚砜溶液,随后将fecl3、谷氨酰胺和谷氨酰胺转运体抑制剂溶液加入一定体积的水中,室温搅拌一定时间,fe经水解自组装可形成feooh纳米颗粒,而谷氨酰胺和谷氨酰胺转运体抑制剂中的羧基和氨基可与fe3+配位进而共组装,借此得到共负载谷氨酰胺和谷氨酰胺转运体抑制剂的纳米药物。该纳米药物为梭形,具有核壳结构,核以feooh为主,壳层以fe3+/谷氨酰胺/谷氨酰胺转运体抑制剂的配位复合物为主。v-9302的结构式如下图式所示:
3、
4、gpna的结构式如下图式所示:
5、
6、bzlcys的结构式如下图式所示:
7、
8、bzlser的结构式如下图式所示:
9、
10、雷洛昔芬的结构式的如下图式所示:
11、
12、他莫昔芬的结构式的如下图式所示:
13、
14、bch的结构式如下图式所示:
15、
16、jph203的结构式如下图式所示:
17、
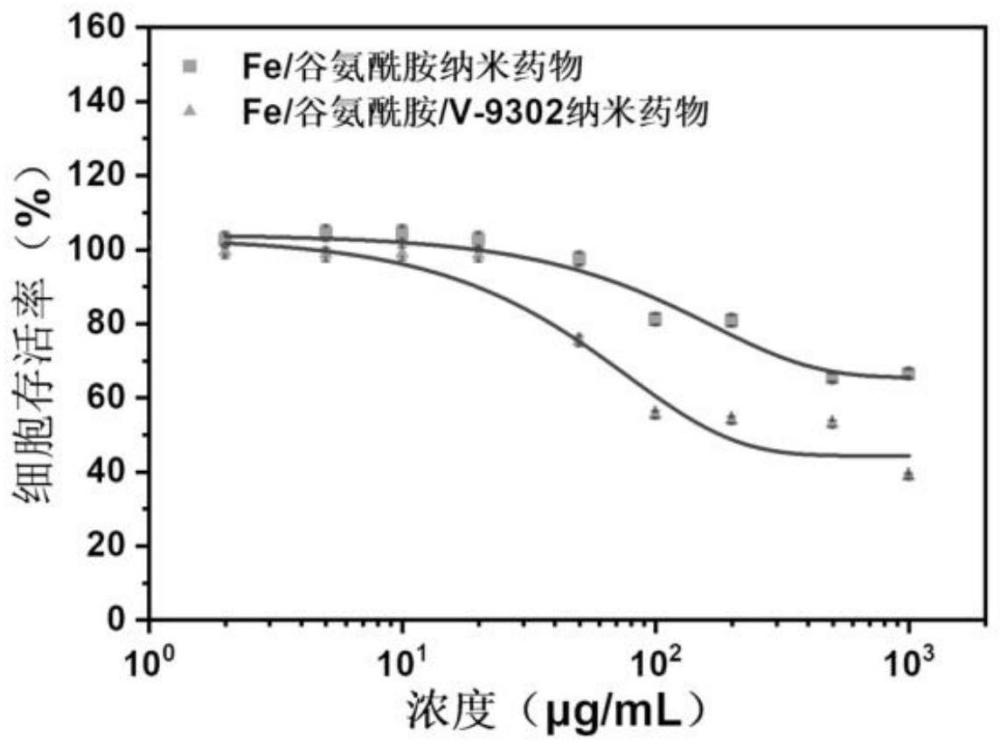
18、meaib的结构式如下图式所示:
19、
20、含谷氨酰胺的纳米药物可被谷氨酰胺成瘾的肿瘤细胞识别为一种谷氨酰胺营养源,进而被内吞摄取供应谷氨酰胺代谢,这使得基于谷氨酰胺大幅纳米药物本身即可被肿瘤细胞特异性高效摄取。而在含谷氨酰胺的纳米药物上负载谷氨酰胺转运体抑制剂的用药策略是在此基础上的进一步提升与改进。纳米药物被肿瘤细胞摄取之后,纳米药物响应性释放谷氨酰胺转运体抑制剂阻断细胞膜上过表达的谷氨酰胺转运体,由此限制谷氨酰胺分子的摄取而引起肿瘤细胞胞内谷氨酰胺的匮乏,谷氨酰胺的匮乏引发的谷氨酰胺代谢压力引导肿瘤细胞代谢转变增加含谷氨酰胺纳米药物摄取,后续摄取的纳米药物进一步再一次释放谷氨酰胺转运体抑制剂并发挥促摄取作用,由此循环往复实现了纳米药物的自促进高效摄取。
21、该用药策略在提高了含谷氨酰胺纳米药物的摄取效率的同时,进一步可使谷氨酰胺转运体抑制剂作为一种货物,借助前述的循环性的自促进摄取实现抑制剂在肿瘤细胞中的高效累积,弥补了谷氨酰胺转运体抑制剂因其水溶性差而导致的利用率低的劣势。此外,该策略适用于各种含谷氨酰胺的纳米药物和谷氨酰胺转运体抑制剂,同时在多种谷氨酰胺成瘾的肿瘤中效果显著,为生物医学领域中广泛使用的纳米药物的利用率的提升提供了一种可行的方法。
22、相较于现有技术,本发明的有益效果如下:
23、(1)本发明提出的自促摄取用药策略适用于多种谷氨酰胺成瘾的癌症肿瘤的治疗,包括:胰腺癌、肺癌、结直肠癌、肝癌、胃癌等;
24、(2)本发明提出的自促摄取用药策略适用于多种含谷氨酰胺纳米药物,包括聚谷氨酰胺类、谷氨酰胺组装体、含谷氨酰胺多肽和蛋白类纳米药物等;
25、(3)本发明提出的自促摄取用药策略大幅提高了含谷氨酰胺纳米药物摄取效率,肿瘤细胞对纳米药物摄取量提高2-10倍;
26、(4)本发明提出的自促摄取用药策略提高了纳米药物的肿瘤治疗效果,降低了纳米药物对肿瘤细胞增殖的半抑制浓度,增强了纳米药物诱发肿瘤细胞凋亡、坏死、铁死亡和焦亡的能力。
- 还没有人留言评论。精彩留言会获得点赞!