一种近红外光触发可降解的双重响应纳米载药系统及其制备方法和应用
本发明属于药物制剂领域,特别涉及一种近红外光触发可降解的双重响应纳米载药系统及其制备方法和应用。
背景技术:
1、血栓是指在受伤的血管中产生的凝结物,主要成分为聚集的活化血小板、交联纤维蛋白和嵌入的红细胞,由凝血和纤维蛋白溶解之间的动态平衡调节。当平衡被打破时,病理性血栓形成并阻断血流,导致致命的房室综合征、中风和深静脉血栓形成。目前,血栓引起的急性心脑血管疾病死亡人数已经超过了肿瘤。因此,快速有效清除血栓,使血管通畅,恢复血液供应,是血栓性疾病治疗的关键。目前主要的治疗方法为药物溶栓。临床常用的溶栓药物主要为纤溶酶原激活剂,如链激酶、尿激酶、阿替普酶等。但该类药物具有靶向性差、出血风险高、生物利用度差、半衰期短和治疗窗窄等问题。
2、近年来,靶向控释纳米递药系统和光热疗法的发展为治疗血栓提供了新思路。血栓部位阻断了血流,红细胞供氧不足,乳酸增多,微环境呈弱酸性。此外,血栓部位存在活化的血小板、丰富的凝血酶等。这些微环境特征为实现溶栓药物在血栓部位的靶向控释提供了条件。光热疗法通过光能和热能的转换,实现光敏物质在血栓部位的局部产热,加速血凝块的分解,从而实现物理溶栓。综上,溶栓药物和光热疗法相结合可显著提高血栓溶解效率。因而设计一种由近红外光触发的靶向控释纳米溶栓系统可达到精准递药、高效溶栓的效果,同时还可增强溶栓药物的靶向性,降低出血风险,提高溶栓安全性
技术实现思路
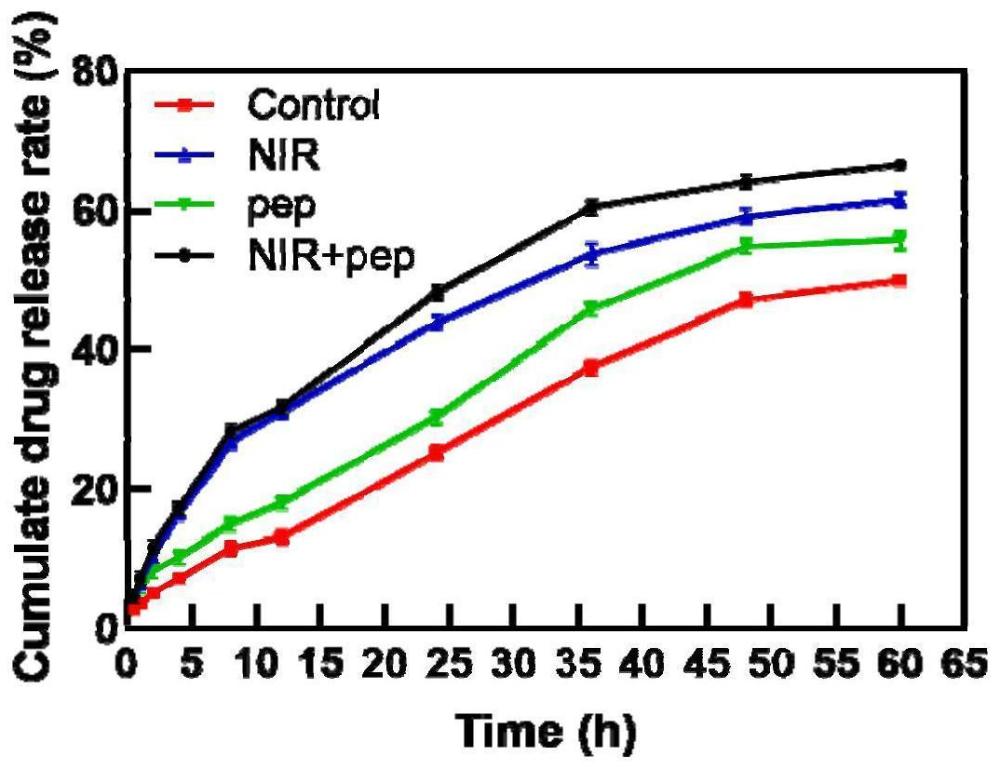
1、本发明设计了一种近红外光触发可降解的双重响应纳米载药系统,该纳米载药系统可有效解决临床溶栓面临的溶栓效率低、出血风险大及血管再栓塞问题,实现其在抗血栓药物中的应用。该纳米载药系统具有凝血酶、光热双重响应控制释药的特点。
2、为实现上述目的,本发明的技术方案是:
3、一种近红外光触发可降解的双重响应纳米载药系统,所述纳米载药系统包括热敏脂质体,所述热敏脂质体的亲水空腔包封载药纳米粒、疏水层负载近红外响应的光热转换分子和凝血酶响应肽,热敏脂质体的表面含有血小板靶向肽。
4、所述热敏脂质体采用dppc(二棕榈酰磷脂酰胆碱)、胆固醇、dspe-mpeg2000(二硬脂酰基磷脂酰乙醇胺-聚乙二醇2000)制备而成。
5、当该纳米载药系统进入血液循环后,血小板靶向肽主动靶向血栓部位活化血小板,在光照下,热敏脂质体疏水层的光热转换分子将光能转为热能,热敏脂质体吸收热量破裂。同时,凝血酶响应肽响应血栓微环境断裂,促进脂质体裂解更为彻底,从而充分释放载药纳米粒。载药纳米粒到达血栓深部,缓慢释放溶栓药物发挥溶栓作用。
6、具体的,所述载药纳米粒通过功能化的pamam负载溶栓药物制备而成,载药纳米粒到达血栓深部溶栓后,游离在血栓部位的pamam功能化载体可进一步防止血小板聚集,从而达到血栓的攻防一体化治疗。pamam是一种树状结构的聚酰胺大分子聚合物,其结构固定规整,由中心向外对称发散并高度分支,有着极好的几何对称性。因其内部具有空腔结构而成为优良的纳米药物载体。但其表面大量带正电荷的氨基基团则会引起细胞毒性,若对其表面的氨基基团加以修饰,降低正电荷数量将有利于提高生物安全性。将精氨酸功能化的pamam用作纳米载体,因其自身带正电,可与带负电的溶栓药物如尿激酶进行静电吸附载药,到达血栓部位后缓慢释放药物。此外,药物溶解血栓的同时游离载体还可以抑制活化血小板聚集,防止血管栓塞,达到攻防一体化溶栓效果。
7、所述光热转换分子为可响应近红外光照射的吲哚菁绿(icg);icg作为光热转换分子,同时具有荧光特性,疏水层负载有icg的热敏脂质体,利用icg成像特点,在适当的时间点,进行近红外光照射,icg转变光能为热能,引起脂质体爆破,可释放出包封的载药纳米粒,实现光热响应性释药,此外icg释放出的热能还可起到辅助溶栓的作用。
8、所述凝血酶响应肽为sdk(c12)sdslvprgsk(c12)ds,含lvprgs序列肽为凝血酶响应肽(pep),可被凝血酶特异性切割。
9、所述血小板靶向肽为crgd肽。环状crgd序列肽为血小板靶向肽,可与活化血小板表面的gpⅱb/ⅲa受体特异性结合,将其作为靶头通过peg连接在脂质体表面以发挥主动靶向血栓的作用。
10、上述纳米载药系统的制备方法,包括以下步骤:
11、(1)制备载药纳米粒。
12、a:精氨酸功能化pamam(pa)的合成:
13、将boc-arg(tos)-oh(叔丁氧羰基-甲苯磺酰基-精氨酸)与edc(1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐)和hobt(1-羟基苯并三唑)在无水dmf(二甲基甲酰胺)和无水dmso(二甲基亚砜)的混合物中反应,氮气下放置1~2h。将上述混合物逐滴添加到含有pamam的水溶液中。搅拌反应36~72h后,透析,冻干,得到pamam-boc-arg(tos)-oh。其中,boc-arg(tos)-oh:edc:hobt:pamam的质量比为64:150:150:40,无水dmf和无水dmso的体积比为2.7:1。
14、接下来,将盐酸二氧六环溶液在氮气下用冰水浴冷却。加入上一步反应得到的pamam-boc-arg(tos)-oh,移去冰浴,搅拌0.5~1h。反应混合液高温真空旋转蒸发浓缩,无水乙醚清洗,过滤收集,得到精氨酸功能化pamam。
15、b:载药纳米粒(pa/uk)的制备:
16、将uk(尿激酶)和pa(uk和pa的质量比为1:2)溶于tris-hcl缓冲液(0.01mol/l、ph7.4)中,搅拌后静置2~3h,离心后,收集沉淀,缓冲液重悬沉淀后冻干即得pa/uk纳米颗粒。
17、(2)纳米载药系统(pa/uk@icplipo)的制备。
18、将负载凝血酶响应肽和血小板靶向肽的热敏脂质体(dppc(二棕榈酰磷脂酰胆碱):胆固醇:dspe-mpeg2000(二硬脂酰基磷脂酰乙醇胺-聚乙二醇2000):dspe-mpeg2000-crgd(二硬脂酰基磷脂酰乙醇胺-聚乙二醇2000-rgd环肽):pep(凝血酶响应肽)(质量比=12:6:2:1:1))和icg(吲哚菁绿)溶解在氯仿中。除去有机溶剂,形成薄膜,并与pa/uk(0.5~1mg/ml)分散液在45~55℃下水合,水合后超声分散,在4℃下离心,以除去较大粒径的脂质体。将上清溶液加入1000kda透析袋中,放入pbs缓冲液(ph为7.4)中透析6~12h,得到pa/uk@icplipo。其中,负载凝血酶响应肽和血小板靶向肽的热敏脂质体与icg的质量比为80:1。
19、上述近红外光触发可降解的双重响应纳米载药系统可在制备抗血栓药物中应用。所述的药物为注射剂或冻干粉针。
20、与现有技术相比,本发明具有以下有益技术效果:
21、(1)本发明纳米载药系统能够通过血小板靶向肽如crgd肽靶向血栓部位活化血小板,降低溶栓药物如尿激酶给药量的同时提高了血栓部位有效药物浓度,降低了全身出血等严重不良反应,提高了溶栓的安全性;
22、(2)本发明纳米载药系统能够在血栓部位实现凝血酶、光热双重响应为一体,精准控制药物释放,快速溶解血栓。
23、(3)本发明纳米载药系统能够到达血栓深层,光热辅助溶栓,双管齐下,提高治疗效果。
24、(4)本发明纳米载药系统在血栓部位释放出溶栓药物进行溶栓,而且采用功能化pamam作为载药纳米粒的载体时,游离的功能化pamam载体则能够抑制血小板聚集,防止血管再栓塞,达到血栓的攻防一体化治疗效果。
25、(5)本发明纳米载药系统的制备方法简单,原料丰富,易生产制备。
- 还没有人留言评论。精彩留言会获得点赞!