有机电致发光装置的制作方法
有机电致发光装置
1.相关申请的交叉引用
2.本技术要求于2021年9月16日在韩国知识产权局提交的韩国专利申请第10-2021-0123929号的优先权和权益,其全部内容通过引用并入本文。
技术领域
3.本公开涉及用作发射层材料的稠合多环化合物和包括其的有机电致发光装置。
背景技术:
4.有机电致发光显示器作为图像显示设备的积极开发正在继续。与液晶显示器等相反,有机电致发光显示器是所谓的自发光显示设备,其中分别从第一电极和第二电极注入的空穴和电子在发射层中复合,使得发射层中包括有机化合物的发光材料发射光以实现显示。
5.在将有机电致发光装置应用于显示设备时,需要具有低驱动电压、高发光效率和长寿命期的有机电致发光装置,并且要求持续开发能够稳定实现这些特性的用于有机电致发光装置的材料。
6.为了实施高效的有机电致发光装置,正在开发利用三重态能量的磷光发射或利用其中通过三重态激子的碰撞产生单重态激子的三重态-三重态湮灭(tta)的延迟荧光发射的相关技术,以及利用延迟荧光现象的热激活延迟荧光(tadf)材料。
7.要理解,该背景技术章节部分地旨在提供用于理解该技术的有用的背景。然而,该背景技术章节也可包括在本文中公开的主题的对应有效申请日之前不是相关领域的技术人员已知或理解的部分的想法、概念或认知。
技术实现要素:
8.本公开提供了具有增加的发光效率的有机电致发光装置。
9.本公开提供了能够增加有机电致发光装置的发光效率的稠合多环化合物。
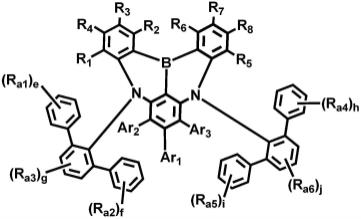
10.实施方式提供了有机电致发光装置,该有机电致发光装置可包括第一电极、面向第一电极的第二电极以及设置在第一电极和第二电极之间的发射层,发射层可以包括空穴传输第一主体、不同于空穴传输第一主体的电子传输第二主体和发光掺杂剂,并且发光掺杂剂可包括由式1表示的稠合多环化合物。
11.[式1]
[0012][0013]
在式1中,ar1至ar3可各自独立地为氢原子、氘原子、取代的或未取代的甲硅烷基、取代的或未取代的具有1至20个碳原子的烷基、取代的或未取代的具有6至60个成环碳原子的芳基或者取代的或未取代的具有2至60个成环碳原子的杂芳基;r1至r8可各自独立地为氢原子、氘原子、卤原子、氰基、取代的或未取代的甲硅烷基、取代的或未取代的胺基、取代的或未取代的氧基、取代的或未取代的具有1至20个碳原子的烷基、取代的或未取代的具有6至60个成环碳原子的芳基或者取代的或未取代的具有2至60个成环碳原子的杂芳基;r
a1
至r
a6
可各自独立地为氢原子、氘原子、卤原子、氰基、取代的或未取代的甲硅烷基、取代的或未取代的胺基、取代的或未取代的氧基、取代的或未取代的具有1至20个碳原子的烷基、取代的或未取代的具有6至60个成环碳原子的芳基或者取代的或未取代的具有2至60个成环碳原子的杂芳基,或者可与相邻基团结合以形成环;e、f、h和i可各自独立地为选自0至5的整数;并且g和j可各自独立地为选自0至3的整数,并且r1至r8中的至少一个可为由式2表示的基团。
[0014]
[式2]
[0015][0016]
在式2中,r9和r
10
可各自独立地为氢原子、氘原子、卤原子、氰基、取代的或未取代的甲硅烷基、取代的或未取代的胺基、取代的或未取代的氧基、取代的或未取代的具有1至20个碳原子的烷基、取代的或未取代的具有6至60个成环碳原子的芳基或者取代的或未取代的具有2至60个成环碳原子的杂芳基,或者可与相邻基团结合以形成环;a和b可各自独立地为选自0至5的整数;并且-*表示与相邻原子的结合位置。
[0017]
在实施方式中,由式1表示的稠合多环化合物可具有等于或大于约80%的光致发光量子产率(plqy)。
[0018]
在实施方式中,由式1表示的稠合多环化合物可由式3-1至式3-3中的任一个表示。
[0019]
[式3-1]
[0020][0021]
[式3-2]
[0022][0023]
[式3-3]
[0024][0025]
在式3-1至式3-3中,r
11
和r
12
可各自独立地为氢原子、氘原子、卤原子、氰基、取代的或未取代的甲硅烷基、取代的或未取代的胺基、取代的或未取代的氧基、取代的或未取代
的具有1至20个碳原子的烷基、取代的或未取代的具有6至60个成环碳原子的芳基或者取代的或未取代的具有2至60个成环碳原子的杂芳基,或者可与相邻基团结合以形成环;c和d可各自独立地为选自0至5的整数;并且ar1至ar3、r1至r
10
、r
a1
至r
a6
、a、b以及e至j与式1和式2中限定的相同。
[0026]
在实施方式中,ar1至ar3可各自独立地为氢原子或氘原子。
[0027]
在实施方式中,ar1可为取代的或未取代的具有6至60个成环碳原子的芳基或者取代的或未取代的具有2至60个成环碳原子的杂芳基,并且ar2和ar3可各自独立地为氢原子或氘原子。
[0028]
在实施方式中,ar1可为取代的或未取代的具有1至20个碳原子的烷基,并且ar2和ar3可各自独立地为氢原子或氘原子。
[0029]
在实施方式中,ar1可为取代的或未取代的具有1至20个碳原子的甲硅烷基,并且ar2和ar3可各自独立地为氢原子或氘原子。
[0030]
在实施方式中,由式3-1表示的稠合多环化合物可由式5表示。
[0031]
[式5]
[0032][0033]
在式5中,r
21
可为氢原子、氘原子、卤原子、取代的或未取代的胺基、取代的或未取代的甲硅烷基、取代的或未取代的具有1至20个碳原子的烷基、取代的或未取代的具有6至60个成环碳原子的芳基或者取代的或未取代的具有2至60个成环碳原子的杂芳基,或者可与相邻基团结合以形成环;k可为选自0至5的整数;并且r1至r3、r5至r7、r9至r
12
、r
a1
至r
a6
以及a至j与式3-1中限定的相同。
[0034]
在实施方式中,由式3-2表示的稠合多环化合物可由式6-1或式6-2表示。
[0035]
[式6-1]
[0036][0037]
[式6-2]
[0038][0039]
在式6-1和式6-2中,r
b1
和r
b2
可各自独立地为氢原子、氘原子、卤原子、取代的或未取代的胺基、取代的或未取代的甲硅烷基、取代的或未取代的具有1至20个碳原子的烷基、取代的或未取代的具有6至60个成环碳原子的芳基或者取代的或未取代的具有2至60个成环碳原子的杂芳基,或者可与相邻基团结合以形成环;m和n可各自独立地为选自0至5的整数,并且ar1至ar3、r1至r3、r5至r
10
、r
a1
至r
a6
、a、b以及e至j与式3-2中限定的相同。
[0040]
在实施方式中,由式1表示的稠合多环化合物可包括选自化合物组1中的至少一种,其在以下解释。
[0041]
在实施方式中,空穴传输第一主体和电子传输第二主体可各自独立地由式e表示。
[0042]
[式e]
[0043][0044]
在式e中,a0可为选自0至10的整数;la可为直接连接、取代的或未取代的具有6至30个成环碳原子的亚芳基或者取代的或未取代的具有2至30个成环碳原子的亚杂芳基;a1至a5可各自独立地为n或c(ri),并且ra至ri可各自独立地为氢原子、氘原子、取代的或未取代的胺基、取代的或未取代的硫基、取代的或未取代的氧基、取代的或未取代的具有1至20个碳原子的烷基、取代的或未取代的具有2至20个碳原子的烯基、取代的或未取代的具有6至30个成环碳原子的芳基或者取代的或未取代的具有2至30个成环碳原子的杂芳基,或者可与相邻基团结合以形成环。
[0045]
在实施方式中,由式e表示的空穴传输第一主体可包括选自化合物组ht中的至少一种,其在以下解释。
[0046]
在实施方式中,由式e表示的电子传输第二主体可包括选自化合物组et中的至少一种,其在以下解释。
[0047]
在实施方式中,发射层可进一步包括包含有机金属络合物的敏化剂。
[0048]
在实施方式中,有机金属络合物可由式m-b表示。
[0049]
[式m-b]
[0050][0051]
在式m-b中,q1至q4可各自独立地为c或n;c1至c4可各自独立地为取代的或未取代的具有5至30个成环碳原子的烃环或者取代的或未取代的具有2至30个成环碳原子的杂环;l
21
至l
24
可各自独立地为直接连接、*-o-*、*-s-*、取代的或未取代的具有1至20个碳原子的二价烷基、取代的或未取代的具有6至30个成环碳原子的亚芳基或者取代的或未取代的具有2至30个成环碳原子的亚杂芳基;e1至e4可各自独立地为0或1;r
31
至r
39
可各自独立地为氢原子、氘原子、卤原子、氰基、取代的或未取代的
胺基、取代的或未取代的具有1至20个碳原子的烷基、取代的或未取代的具有6至30个成环碳原子的芳基或者取代的或未取代的具有2至30个成环碳原子的杂芳基,或者可与相邻基团结合以形成环;d1至d4可各自独立地为选自0至4的整数,并且-*表示与相邻原子的结合位置。
[0052]
在实施方式中,由式m-b表示的有机金属络合物可包括选自化合物组ps中的至少一种,其在以下解释。
[0053]
实施方式提供了有机电致发光装置,该有机电致发光装置可包括第一电极、面向第一电极的第二电极以及设置在第一电极和第二电极之间并包括主体和发光掺杂剂的发射层,其中发光掺杂剂可包括由式1表示的稠合多环化合物,并且主体可由式e-1表示。
[0054]
[式1]
[0055][0056]
在式1中,ar1至ar3可各自独立地为氢原子、氘原子、取代的或未取代的甲硅烷基、取代的或未取代的具有1至20个碳原子的烷基、取代的或未取代的具有6至60个成环碳原子的芳基或者取代的或未取代的具有2至60个成环碳原子的杂芳基;r1至r8可各自独立地为氢原子、氘原子、卤原子、氰基、取代的或未取代的甲硅烷基、取代的或未取代的胺基、取代的或未取代的氧基、取代的或未取代的具有1至20个碳原子的烷基、取代的或未取代的具有6至60个成环碳原子的芳基或者取代的或未取代的具有2至60个成环碳原子的杂芳基;r
a1
至r
a6
可各自独立地为氢原子、氘原子、卤原子、氰基、取代的或未取代的甲硅烷基、取代的或未取代的胺基、取代的或未取代的氧基、取代的或未取代的具有1至20个碳原子的烷基、取代的或未取代的具有6至60个成环碳原子的芳基或者取代的或未取代的具有2至60个成环碳原子的杂芳基,或者可与相邻基团结合以形成环;e、f、h和i可各自独立地为选自0至5的整数;并且g和j可各自独立地为选自0至3的整数;并且r1至r8中的至少一个可为由式2表示的基团。
[0057]
[式2]
[0058][0059]
在式2中,r9和r
10
可各自独立地为氢原子、氘原子、卤原子、氰基、取代的或未取代
的甲硅烷基、取代的或未取代的胺基、取代的或未取代的氧基、取代的或未取代的具有1至20个碳原子的烷基、取代的或未取代的具有6至60个成环碳原子的芳基或者取代的或未取代的具有2至60个成环碳原子的杂芳基,或者可与相邻基团结合以形成环;a和b可各自独立地为选自0至5的整数,并且-*表示与相邻原子的结合位置。
[0060]
[式e-1]
[0061][0062]
在式e-1中,n1和n2可各自独立地为选自0至5的整数;并且r
31
至r
40
可各自独立地为氢原子、氘原子、卤原子、取代的或未取代的甲硅烷基、取代的或未取代的硫基、取代的或未取代的氧基、取代的或未取代的具有1至10个碳原子的烷基、取代的或未取代的具有2至10个碳原子的烯基、取代的或未取代的具有6至30个成环碳原子的芳基或者取代的或未取代的具有2至30个成环碳原子的杂芳基,或者可与相邻基团结合以形成环。
[0063]
在实施方式中,发射层可发射蓝光。
[0064]
在实施方式中,发射层可包括在厚度方向上堆叠的第一子发射层和第二子发射层,并且第一子发射层和第二子发射层中的至少一个可包括发光掺杂剂。
附图说明
[0065]
包括所附附图以提供对实施方式的进一步理解,并且所附附图被并入且构成本说明书的一部分。附图阐释了本公开的实施方式及其原理。通过参考所附附图详细地描述本公开的实施方式,本公开的上述和其他方面和特征将变得更显而易见,在所附附图中:
[0066]
图1为根据实施方式的显示设备的平面图;
[0067]
图2为根据实施方式的显示设备的示意性横截面图;
[0068]
图3为阐释根据实施方式的有机电致发光装置的示意性横截面图;
[0069]
图4为阐释根据实施方式的有机电致发光装置的示意性横截面图;
[0070]
图5为阐释根据实施方式的有机电致发光装置的示意性横截面图;
[0071]
图6为阐释根据实施方式的有机电致发光装置的示意性横截面图;
[0072]
图7为根据实施方式的显示设备的示意性横截面图;
[0073]
图8为根据实施方式的显示设备的示意性横截面图;
[0074]
图9a示出根据实施方式的稠合多环化合物的分子轨道图;
[0075]
图9b示出根据实施方式的稠合多环化合物的分子轨道图;
[0076]
图10a示出根据实施方式的稠合多环化合物的三维结构图;
[0077]
图10b示出根据实施方式的稠合多环化合物的三维结构图;并且
[0078]
图10c示出根据实施方式的稠合多环化合物的三维结构图。
具体实施方式
[0079]
现将参考其中示出了实施方式的所附附图在下文中更充分地描述本公开。然而,本公开可体现为不同的形式并且不应解释为限于本文陈述的实施方式。相反,提供这些实施方式使得本公开将是透彻的和完整的,并且将向本领域技术人员充分地传达本公开的范围。
[0080]
在附图中,为了便于描述和为了清楚起见,可放大元件的大小、厚度、比例和尺寸。相同的附图标记通篇指相同的元件。
[0081]
在说明书中,将理解,当元件(或区、层、部分等)被称为“在”另一元件(或区、层、部分等)“上”,“连接至”或“联接至”另一元件(或区、层、部分等)时,它可直接在另一元件(或区、层、部分等)上,直接连接至或直接联接至另一元件(或区、层、部分等),或在它们之间可存在一个或多个居间元件。在类似的意义上,当元件(或区、层、部分等)被描述为“覆盖”另一元件(或区、层、部分等)时,它可直接覆盖另一元件(或区、层、部分等),或在它们之间可存在一个或多个居间元件。
[0082]
在说明书中,当元件“直接在”另一元件“上”,“直接连接至”或“直接联接至”另一元件时,不存在居间元件。例如,“直接在
……
上”可意指设置两个层或两个元件而在它们之间没有另外的元件比如粘附元件。
[0083]
如本文中使用的,以单数形式使用的表述,比如“一个(a)”、“一个(an)”和“所述”旨在也包括复数形式,除非上下文另外清楚地指示。
[0084]
如本文中使用的,术语“和/或”包括一个或多个相关列举项目的任何和所有组合。例如,“a和/或b”可理解为意指“a,b,或a和b”。术语“和”和“或”可以以连接意义或分离意义使用,并且可理解为等同于“和/或”。
[0085]
术语
“……
中的至少一个”旨在包括“选自
……
的组中的至少一个”的含义,用于其含义和解释的目的。例如,“a和b中的至少一个”可理解为意指“a,b,或a和b”。当在要素的列表之后时,术语
“……
中的至少一个”修饰整个要素列表,而不修饰列表的单个要素。
[0086]
将理解,尽管术语第一、第二等可在本文中用于描述各种元件,但是这些元件不应受这些术语的限制。这些术语仅用于区分一个元件与另一元件。因此,在不背离本公开教导的情况下,第一元件可称为第二元件。类似地,在不背离本公开的范围的情况下,第二元件可称为第一元件。
[0087]
为了便于描述,可在本文中使用空间相对术语“下面”、“之下”、“下”、“上面”或“上”等,以描述如附图中阐释的一个元件或组件和另一元件或组件之间的关系。将理解,空间相对术语旨在囊括除了附图中描绘的定向之外的使用或操作中的装置的不同定向。例如,在将附图中阐释的装置翻转的情况下,位于另一装置“下面”或“之下”的装置可放置在另一装置“上面”。因此,阐释性术语“下面”可包括下和上的两种位置。该装置也可在其他方向上定向,并且因此可根据定向而不同地解释空间相对术语。
[0088]
如本文中使用的术语“约”或“近似”包括叙述值并且意指在由本领域普通技术人员考虑所讨论的测量和与所阐述的量的测量相关的误差(即测量系统的限制)而确定的所阐述的值的可接受偏差范围内。例如,“约”可意指在叙述值的一个或多个标准偏差内,或在
叙述值的
±
20%、
±
10%或
±
5%的范围内。
[0089]
应理解,术语“包括(comprise)”、“包括(comprising)”、“包含(include)”、“包含(including)”、“具有(have)”、“具有(having)”、“含有(contains)”和“含有(containing)”等旨在指定叙述的特征、整数、步骤、操作、元件、组件或其组合在本公开中的存在,但是不排除一个或多个其他特征、整数、步骤、操作、元件、组件或其组合的存在或添加。
[0090]
除非本文另外限定或暗示,否则使用的所有术语(包括技术术语和科技术语)具有与本公开所属领域的技术人员通常理解的含义相同的含义。将进一步理解,术语,比如在常用的词典中定义的那些,应解释为具有与它们在相关领域的语境中的含义一致的含义,并且不应以理想的或过于正式的意义解释,除非在说明书中清楚地定义。
[0091]
下文中,将参考所附附图描述根据实施方式的有机电致发光装置。
[0092]
图1为示出实施方式的显示设备dd的平面图。图2为根据实施方式的显示设备dd的示意性横截面图。图2为示出沿着图1的线i-i'截取的一部分的示意性横截面图。
[0093]
显示设备dd可包括显示面板dp和设置在显示面板dp上的光学层pp。显示面板dp可包括有机电致发光装置ed-1、ed-2和ed-3。显示设备dd可包括多个有机电致发光装置ed-1、ed-2和ed-3。光学层pp可设置在显示面板dp上以控制外部光在显示面板dp处反射的光。光学层pp可包括,例如,偏振层或滤色器层。尽管未在附图中示出,但是在实施方式中,可从显示设备dd省略光学层pp。
[0094]
基底基板bl可设置在光学层pp上。基底基板bl可提供基底表面,光学层pp设置在该基底表面上。基底基板bl可为玻璃基板、金属基板、塑料基板等。然而,实施方式不限于此,并且基底基板bl可包括无机层、有机层或复合材料层。尽管未在附图中示出,但是在实施方式中,可省略基底基板bl。
[0095]
根据实施方式的显示设备dd可进一步包括填充层(未示出)。填充层(未示出)可设置在显示元件层dp-ed和基底基板bl之间。填充层(未示出)可为有机层。填充层(未示出)可包括丙烯酸类树脂、硅酮类树脂和环氧类树脂中的至少一种。
[0096]
显示面板dp可包括基底层bs,提供在基底层bs上的电路层dp-cl,以及显示元件层dp-ed。显示元件层dp-ed可包括像素限定膜pdl,设置在像素限定膜pdl之间的有机电致发光装置ed-1、ed-2和ed-3,以及设置在有机电致发光装置ed-1、ed-2和ed-3上的封装层tfe。
[0097]
基底层bs可提供基底表面,显示元件层dp-ed设置在该基底表面上。基底层bs可为玻璃基板、金属基板、塑料基板等。然而,实施方式不限于此,并且基底层bs可包括无机层、有机层或复合材料层。
[0098]
在实施方式中,电路层dp-cl可设置在基底层bs上,并且电路层dp-cl可包括晶体管(未示出)。晶体管(未示出)可各自包括控制电极、输入电极和输出电极。例如,电路层dp-cl可包括用于驱动显示元件层dp-ed的有机电致发光装置ed-1、ed-2和ed-3的开关晶体管和驱动晶体管。
[0099]
有机电致发光装置ed-1、ed-2和ed-3可各自具有根据图3至图6的实施方式的有机电致发光装置ed的结构,其将在后面描述。有机电致发光装置ed-1、ed-2和ed-3可各自包括第一电极el1,空穴传输区htr,发射层eml-r、eml-g和eml-b,电子传输区etr,以及第二电极el2。
[0100]
图2阐释了这样的实施方式,其中有机电致发光装置ed-1、ed-2和ed-3的发射层
eml-r、eml-g和eml-b设置在像素限定膜pdl中限定的开口oh中,并且空穴传输区htr、电子传输区etr和第二电极el2各自被提供为用于所有的有机电致发光装置ed-1、ed-2和ed-3的公共层。然而,实施方式不限于此,并且尽管未在图2中示出,但是在实施方式中,空穴传输区htr和电子传输区etr可各自被图案化并被提供在像素限定膜pdl中限定的开口oh内侧。例如,在实施方式中,有机电致发光装置ed-1、ed-2和ed-3的空穴传输区htr,发射层eml-r、eml-g和eml-b,以及电子传输区etr等可各自通过喷墨印刷方法被图案化并且被提供。
[0101]
封装层tfe可覆盖有机电致发光装置ed-1、ed-2和ed-3。封装层tfe可密封显示元件层dp-ed的元件(比如有机电致发光装置ed-1、ed-2和ed-3)。封装层tfe可为薄膜封装层。封装层tfe可为单层,或多层的堆叠。封装层tfe可包括至少一个绝缘层。根据实施方式的封装层tfe可包括至少一个无机膜(在下文中,封装无机膜)。根据实施方式的封装层tfe可包括至少一个有机膜(在下文中,封装有机膜)和至少一个封装无机膜。
[0102]
封装无机膜可保护显示元件层dp-ed免受水分和/或氧气的影响,并且封装有机膜可保护显示元件层dp-ed免受异物比如灰尘颗粒的影响。封装无机膜可包括氮化硅、氧氮化硅、氧化硅、氧化钛或氧化铝,但不限于此。封装有机膜可包括丙烯酸类化合物、环氧类化合物等。封装有机膜可包括可光聚合的有机材料,而没有限制。
[0103]
封装层tfe可设置在第二电极el2上并且可设置成填充开口oh。
[0104]
参考图1和图2,显示设备dd可包括非发光区npxa以及发光区pxa-r、pxa-g和pxa-b。发光区pxa-r、pxa-g和pxa-b可各自为发射从有机电致发光装置ed-1、ed-2和ed-3中的每一个产生的光的区。发光区pxa-r、pxa-g和pxa-b可在平面图中彼此间隔开。
[0105]
发光区pxa-r、pxa-g和pxa-b中的每一个可为由像素限定膜pdl分开的区。非发光区npxa可为在相邻的发光区pxa-r、pxa-g和pxa-b之间的区并且可对应于像素限定膜pdl。例如,在实施方式中,发光区pxa-r、pxa-g和pxa-b中的每一个可对应于像素。像素限定膜pdl可分开有机电致发光装置ed-1、ed-2和ed-3。有机电致发光装置ed-1、ed-2和ed-3的发射层eml-r、eml-g和eml-b可设置在像素限定膜pdl中限定的开口oh中并且彼此分开。
[0106]
发光区pxa-r、pxa-g和pxa-b可根据从有机电致发光装置ed-1、ed-2和ed-3产生的光的颜色而分组。在图1和图2中示出的实施方式的显示设备dd中,阐释了发射红光、绿光和蓝光的三个发光区pxa-r、pxa-g和pxa-b。例如,实施方式的显示设备dd可包括彼此不同的红色发光区pxa-r、绿色发光区pxa-g和蓝色发光区pxa-b。
[0107]
在根据实施方式的显示设备dd中,有机电致发光装置ed-1、ed-2和ed-3可发射具有不同波长范围的光。例如,在实施方式中,显示设备dd可包括发射红光的第一有机电致发光装置ed-1、发射绿光的第二发光装置ed-2和发射蓝光的第三发光装置ed-3。例如,显示设备dd的红色发光区pxa-r、绿色发光区pxa-g和蓝色发光区pxa-b可分别对应于第一有机电致发光装置ed-1、第二有机电致发光装置ed-2和第三有机电致发光装置ed-3。
[0108]
然而,实施方式不限于此,并且第一至第三有机电致发光装置ed-1、ed-2和ed-3可发射相同波长范围内的光,或其中至少一个可发射不同波长范围内的光。例如,第一至第三有机电致发光装置ed-1、ed-2和ed-3可均发射蓝光。
[0109]
根据实施方式的显示设备dd中的发光区pxa-r、pxa-g和pxa-b可布置成条纹配置。参考图1,红色发光区pxa-r、绿色发光区pxa-g和蓝色发光区pxa-b可沿着第二方向轴dr2布置。红色发光区pxa-r、绿色发光区pxa-g和蓝色发光区pxa-b可沿着第一方向轴dr1轮流交
替布置。
[0110]
图1和图2阐释了发光区pxa-r、pxa-g和pxa-b在尺寸上都相同,但是实施方式不限于此。发光区pxa-r、pxa-g和pxa-b可根据发射光的波长范围而在尺寸上彼此不同。发光区pxa-r、pxa-g和pxa-b的面积可为由第一方向轴dr1和第二方向轴dr2限定的平面图中的面积。
[0111]
发光区pxa-r、pxa-g和pxa-b的布置不限于图1中示出的布置,并且红色发光区pxa-r、绿色发光区pxa-g和蓝色发光区pxa-b布置的顺序可根据显示设备dd所需的显示质量特性以各种组合提供。例如,发光区pxa-r、pxa-g和pxa-b可以以pentile
tm
配置或以菱形配置布置。
[0112]
在实施方式中,发光区pxa-r、pxa-g和pxa-b中的每一个的面积可在尺寸上彼此不同。例如,在实施方式中,绿色发光区pxa-g的面积可小于蓝色发光区pxa-b的面积,但是实施方式不限于此。
[0113]
下文中,图3至6各自为阐释根据实施方式的有机电致发光装置的示意性横截面图。在实施方式的有机电致发光装置ed中,第一电极el1和第二电极el2设置成面向彼此,并且有机层可设置在第一电极el1和第二电极el2之间。有机层可包括空穴传输区htr、发射层eml和电子传输区etr。例如,根据实施方式的有机电致发光装置ed可包括以该顺序堆叠的第一电极el1、空穴传输区htr、发射层eml、电子传输区etr和第二电极el2。
[0114]
根据实施方式的有机电致发光装置ed可在设置在第一电极el1和第二电极el2之间的有机层中的至少一个有机层中包括实施方式的稠合多环化合物(其将在后面描述)。例如,根据实施方式的有机电致发光装置ed可在设置在第一电极el1和第二电极el2之间的发射层eml中包括实施方式的稠合多环化合物(其将在后面描述)。然而,实施方式不限于此,并且根据实施方式的有机电致发光装置ed可不仅在发射层eml中,而且在包括在空穴传输区htr和电子传输区etr中的至少一个有机层中(发射层eml、空穴传输区htr和电子传输区etr在设置在第一电极el1和第二电极el2之间的有机层中),或者在设置在第二电极el2上的封盖层cpl中包括根据实施方式的稠合多环化合物(其将在后面描述)。
[0115]
与图3相比,图4阐释了实施方式的有机电致发光装置ed的示意性横截面图,其中空穴传输区htr包括空穴注入层hil和空穴传输层htl,并且电子传输区etr包括电子注入层eil和电子传输层etl。与图3相比,图5阐释了实施方式的有机电致发光装置ed的示意性横截面图,其中空穴传输区htr包括空穴注入层hil、空穴传输层htl和电子阻挡层ebl,并且电子传输区etr包括电子注入层eil、电子传输层etl和空穴阻挡层hbl。与图4相比,图6阐释了包括设置在第二电极el2上的封盖层cpl的实施方式的有机电致发光装置ed的示意性横截面图。
[0116]
下文中,在实施方式的有机电致发光装置ed的描述中,根据实施方式的稠合多环化合物(其将在后面描述)包括在发射层eml中,但实施方式不限于此,并且根据实施方式的稠合多环化合物(其将在后面描述)可包括在空穴传输区htr、电子传输区etr或封盖层cpl中。
[0117]
第一电极el1具有导电性。第一电极el1可由金属材料、金属合金或导电化合物形成。第一电极el1可为阳极或阴极。然而,实施方式不限于此。例如,第一电极el1可为像素电极。第一电极el1可为透射电极、透反射电极或反射电极。当第一电极el1为透射电极时,第
一电极el1可包括透明金属氧化物,比如氧化铟锡(ito)、氧化铟锌(izo)、氧化锌(zno)或氧化铟锡锌(itzo)。当第一电极el1为透反射电极或反射电极时,第一电极el1可包括ag、mg、cu、al、pt、pd、au、ni、nd、ir、cr、li、ca、lif、mo、ti、w、其化合物或其混合物(例如,ag和mg的混合物),或具有多层结构的材料比如lif/ca或lif/al。在另一实施方式中,第一电极el1可具有多层结构,该多层结构包括由上述材料形成的反射膜或透反射膜,和由氧化铟锡(ito)、氧化铟锌(izo)、氧化锌(zno)、氧化铟锡锌(itzo)等形成的透明导电膜。例如,第一电极el1可具有ito/ag/ito的三层结构,然而,实施方式不限于此,并且第一电极el1可包括上述金属材料,选自上述金属材料中的两种或更多种金属材料的组合,或上述金属材料的氧化物。第一电极el1可具有约至约的范围内的厚度。例如,第一电极el1可具有至约的范围内的厚度。
[0118]
空穴传输区htr提供在第一电极el1上。空穴传输区htr可包括空穴注入层hil、空穴传输层htl、缓冲层(未示出)、发光辅助层(未示出)和电子阻挡层ebl中的至少一个。空穴传输区htr可具有,例如,约至约的范围内的厚度。
[0119]
空穴传输区htr可为由单种材料形成的单层结构,由不同材料形成的单层结构,或具有由不同材料形成的多个层的多层结构。
[0120]
例如,空穴传输区htr可具有由空穴注入层hil或空穴传输层htl形成的单层结构,或由空穴注入材料和空穴传输材料形成的单层结构。例如,空穴传输区htr可具有由不同材料形成的单层结构,或者其中空穴注入层hil/空穴传输层htl、空穴注入层hil/空穴传输层htl/缓冲层(未示出)、空穴注入层hil/缓冲层(未示出)、空穴传输层htl/缓冲层(未示出)、或空穴注入层hil/空穴传输层htl/电子阻挡层ebl从第一电极el1以其各自叙述的顺序堆叠的结构,但是实施方式不限于此。
[0121]
空穴传输区htr可使用各种方法比如真空沉积方法、旋涂方法、浇铸方法、朗缪尔-布罗基特(lb)方法、喷墨印刷方法、激光印刷方法和激光诱导热成像(liti)方法形成。
[0122]
空穴传输区htr可包括由式h-1表示的化合物。
[0123]
[式h-1]
[0124][0125]
在式h-1中,l1和l2可各自独立地为直接连接、取代的或未取代的具有6至30个成环碳原子的亚芳基或者取代的或未取代的具有2至30个成环碳原子的亚杂芳基。在式h-1中,x和y可各自独立地为选自0至10的整数。当x或y为2或更大时,多个l1基团和多个l2基团可各自独立地为取代的或未取代的具有6至30个成环碳原子的亚芳基或者取代的或未取代的具有2至30个成环碳原子的亚杂芳基。
[0126]
在式h-1中,ara至arc可各自独立地为取代的或未取代的具有6至30个成环碳原子的芳基或者取代的或未取代的具有2至30个成环碳原子的杂芳基。
[0127]
在实施方式中,由式h-1表示的化合物可为单胺化合物。然而,实施方式不限于此,
并且由式h-1表示的化合物可为二胺化合物,其中ara至arc中的至少一个包括胺基作为取代基。
[0128]
在实施方式中,l1和l2可各自独立地为直接连接或者取代的或未取代的亚苯基。
[0129]
在实施方式中,ara至arc中的至少一个可为取代的或未取代的芴基、取代的或未取代的咔唑基或者取代的或未取代的二苯并呋喃基。
[0130]
在实施方式中,在式h-1中,arc可为取代的或未取代的具有6至30个成环碳原子的芳基。
[0131]
在实施方式中,由式h-1表示的化合物可为咔唑类化合物,其中ara和arb中的至少一个可包括取代或未取代的咔唑基。在实施方式中,由式h-1表示的化合物可为芴类化合物,其中ara和arb中的至少一个可包括取代的或未取代的芴基。
[0132]
由式h-1表示的化合物可为选自化合物组h中的任一种。然而,化合物组h中列举的化合物仅作为示例呈示,并且由式h-1表示的化合物不限于化合物组h中列举的化合物。
[0133]
[化合物组h]
[0134]
[0135][0136]
空穴传输区htr可包括酞菁化合物比如酞菁铜、n,n'-二苯基-n,n'-双-[4-(苯基-间甲苯基-氨基)-苯基]-联苯-4,4'-二胺(dntpd)、4,4',4
″‑
[三(3-甲基苯基)苯基氨基]三苯胺(m-mtdata)、4,4',4
″‑
三(n,n-二苯基氨基)三苯胺(tdata)、4,4',4
″‑
三(n-(2-萘基)-n-苯基氨基)-三苯胺(2-tnata)、聚(3,4-乙撑二氧噻吩)/聚(4-苯乙烯磺酸盐)(pedot/pss)、聚苯胺/十二烷基苯磺酸(pani/dbsa)、聚苯胺/樟脑磺酸(pani/csa)、聚苯胺/聚(4-苯乙烯磺酸盐)(pani/pss)、n,n'-二(萘-l-基)-n,n'-二苯基-联苯胺(npd)、含三苯胺的聚醚酮(tpapek)、4-异丙基-4'-甲基二苯基碘鎓四(五氟苯基)硼酸盐、二吡嗪并[2,3-f:2',3'-h]喹喔啉-2,3,6,7,10,11-六甲腈(hat-cn)等。
[0137]
空穴传输区htr可包括咔唑类衍生物比如n-苯基咔唑和聚乙烯咔唑、芴类衍生物、n,n'-双(3-甲基苯基)-n,n'-二苯基-[1,1'-联苯]-4,4'-二胺(tpd)、三苯胺类衍生物比如4,4',4
″‑
三(n-咔唑基)三苯胺(tcta)、n,n'-二(萘-1-基)-n,n'-二苯基-联苯胺(npb)、4,4'-亚环己基双[n,n-双(4-甲基苯基)苯胺](tapc)、4,4'-双[n,n'-(3-甲苯基)氨基]-3,3'-二甲基联苯(hmtpd)、1,3-双(n-咔唑基)苯(mcp)等。
[0138]
空穴传输区htr可包括9-(4-叔丁基苯基)-3,6-双(三苯基甲硅烷基)-9h-咔唑(czsi)、9-苯基-9h-3,9'-联咔唑(ccp)、1,3-双(1,8-二甲基-9h-咔唑-9-基)苯(mdcp)等。
[0139]
空穴传输区htr可在空穴注入层hil、空穴传输层htl和电子阻挡层ebl中的至少一个中包括上述空穴传输区htr的化合物。
[0140]
空穴传输区htr可具有约至约的范围内的厚度。例如,空穴传输区htr可具有约至约的范围内的厚度。当空穴传输区htr包括空穴注入层hil时,空穴注入层hil可具有,例如,约至约的范围内的厚度。当空穴传输区htr包括空穴传
输层htl时,空穴传输层htl可具有约至约的范围内的厚度。当空穴传输区htr包括电子阻挡层ebl时,电子阻挡层ebl可具有,例如,约至约的范围内的厚度。当空穴传输区htr、空穴注入层hil、空穴传输层htl和电子阻挡层ebl的厚度满足上述范围时,可在不显著增加驱动电压的情况下获得令人满意的空穴传输性质。
[0141]
除了上述材料之外,空穴传输区htr可进一步包括电荷产生材料以增加导电性。电荷产生材料可均匀或不均匀分散于空穴传输区htr中。电荷产生材料可为,例如,p-掺杂剂。p-掺杂剂可包括卤化金属化合物、醌衍生物、金属氧化物和含氰基化合物中的至少一种,但不限于此。例如,p-掺杂剂可包括卤化金属化合物比如cui和rbi,醌衍生物比如四氰基醌二甲烷(tcnq)和2,3,5,6-四氟-7,7,8,8-四氰基醌二甲烷(f4-tcnq),金属氧化物比如氧化钨和氧化钼,含氰基化合物比如二吡嗪并[2,3-f:2',3'-h]喹喔啉-2,3,6,7,10,11-六甲腈(hat-cn)和4-[[2,3-双[氰基-(4-氰基-2,3,5,6-四氟苯基)亚甲基]亚环丙基]-氰基甲基]-2,3,5,6-四氟苯甲腈(ndp9)等,但不限于此。
[0142]
如上所述,除了空穴注入层hil和空穴传输层htl之外,空穴传输区htr可进一步包括缓冲层(未示出)和电子阻挡层ebl中的至少一个。缓冲层(未示出)可根据从发射层eml发射的光的波长来补偿共振距离,并且因此可增加发光效率。可包括于空穴传输区htr中的材料可用作包括于缓冲层(未示出)中的材料。电子阻挡层ebl可防止电子从电子传输区etr注入到空穴传输区htr。
[0143]
发射层eml提供在空穴传输区htr上。发射层eml可具有约至约至约的范围内的厚度。例如,发射层eml可具有约至约的范围内的厚度。发射层eml可为由单种材料形成的单层结构,由不同材料形成的单层结构,或具有由不同材料形成的多个层的多层结构。
[0144]
根据实施方式的有机电致发光装置ed可在发射层eml中包括实施方式的稠合多环化合物。
[0145]
在描述中,术语“取代的或未取代的”可意指基团或部分未被取代或被选自由下述组成的组中的至少一个取代基取代:氘原子、卤原子、氰基、硝基、胺基、甲硅烷基、氧基、硫基、亚磺酰基、磺酰基、羰基、硼基、氧化膦基、硫化膦基、烷基、烯基、炔基、烷氧基、烃环基、芳基和杂环基。以上列举的取代基中的每一个本身可为被取代的或未被取代的。例如,联苯可解释为芳基,或可解释为被苯基取代的苯基。
[0146]
在描述中,术语“与相邻基团结合以形成环”可意指基团与相邻基团结合以形成取代的或未取代的烃环,或者取代的或未取代的杂环。烃环可为脂族烃环或芳族烃环。杂环可为脂族杂环或芳族杂环。通过与相邻基团结合的基团形成的环可为单环或多环。通过彼此结合的相邻基团形成的环本身可与另一环结合以形成螺结构。
[0147]
在描述中,术语“相邻基团”可意指取代与被对应取代基取代的原子直接连接的原子的取代基,取代被对应取代基取代的原子的另一取代基,或空间上位于与对应取代基最接近的位置处的取代基。例如,在1,2-二甲基苯中,两个甲基可解释为彼此的“相邻基团”,并且在1,1-二乙基环戊烷中,两个乙基可解释为彼此的“相邻基团”。
[0148]
在描述中,卤原子的示例可包括氟原子、氯原子、溴原子或碘原子。
[0149]
在描述中,烷基可为直链、支链或环状类型。烷基中碳原子的数量可为1至50、1至30、1至20、1至10或1至6。烷基的示例可包括甲基、乙基、正丙基、异丙基、正丁基、仲丁基、叔
丁基、异丁基、2-乙基丁基、3,3-二甲基丁基、正戊基、异戊基、新戊基、叔戊基、环戊基、1-甲基戊基、3-甲基戊基、2-乙基戊基、4-甲基-2-戊基、正己基、1-甲基己基、2-乙基己基、2-丁基己基、环己基、4-甲基环己基、4-叔丁基环己基、正庚基、1-甲基庚基、2,2-二甲基庚基、2-乙基庚基、2-丁基庚基、正辛基、叔辛基、2-乙基辛基、2-丁基辛基、2-己基辛基、3,7-二甲基辛基、环辛基、正壬基、正癸基、金刚烷基、2-乙基癸基、2-丁基癸基、2-己基癸基、2-辛基癸基、正十一烷基、正十二烷基、2-乙基十二烷基、2-丁基十二烷基、2-己基十二烷基、2-辛基十二烷基、正十三烷基、正十四烷基、正十五烷基、正十六烷基、2-乙基十六烷基、2-丁基十六烷基、2-己基十六烷基、2-辛基十六烷基、正十七烷基、正十八烷基、正十九烷基、正二十烷基、2-乙基二十烷基、2-丁基二十烷基、2-己基二十烷基、2-辛基二十烷基、正二十一烷基、正二十二烷基、正二十三烷基、正二十四烷基、正二十五烷基、正二十六烷基、正二十七烷基、正二十八烷基、正二十九烷基、正三十烷基、三苯基甲基、2-苯基异丙基、1,2,3,4-四氢化萘基等,但不限于此。
[0150]
在描述中,烯基可为在具有2个或更多个碳原子的烷基的中间或末端包括至少一个碳-碳双键的烃基。烯基可为直链或支链。烯基中碳原子的数量没有特别限制,但是可为2至30、2至20或2至10。烯基的示例可包括乙烯基、1-丁烯基、1-戊烯基、1,3-丁二烯基、苯乙烯基、苯乙烯基乙烯基等,但不限于此。
[0151]
在描述中,炔基可为在具有2个或更多个碳原子的烷基的中间或末端包括至少一个碳-碳三键的烃基。炔基可为直链或支链。炔基中碳原子的数量没有特别限制,但是可为2至30、2至20或2至10。炔基的示例可包括乙炔基、丙炔基等,但不限于此。
[0152]
在描述中,烃环可为衍生自脂族烃环或芳族烃环的官能团或取代基。烃环中成环碳原子的数量可为5至60、5至30或5至20。
[0153]
在描述中,芳基可为衍生自芳族烃环的官能团或取代基。芳基可为单环芳基或多环芳基。芳基中成环碳原子的数量可为6至60、6至30、6至20或6至15。芳基的示例可包括苯基、萘基、芴基、蒽基、菲基、联苯基、三联苯基、四联苯基、五联苯基、六联苯基、三亚苯基、芘基、苯并荧蒽基、1,2-苯并菲基等,但不限于此。
[0154]
在描述中,芴基可被取代,并且两个取代基可彼此结合以形成螺结构。取代的芴基的示例如下。然而,实施方式不限于此。
[0155][0156]
在描述中,杂环基可为衍生自含有b、o、n、p、si、se、te和s中的至少一个作为杂原子的环的官能团或取代基。杂环基可为脂族杂环基或芳族杂环基。芳族杂环基可为杂芳基。脂族杂环基和芳族杂环基可各自独立地为单环或多环。
[0157]
在描述中,杂环基可含有b、o、n、p、si、se、te和s中的至少一个作为杂原子。当杂环基含有两个或更多个杂原子时,两个或更多个杂原子可彼此相同或不同。杂环基可为单环杂环基或多环杂环基,并且杂环基可为杂芳基。杂环基中成环碳原子的数量可为2至30、2至20或2至10。
[0158]
在描述中,脂族杂环基可含有b、o、n、p、si、se、te和s中的至少一个作为杂原子。脂
族杂环基中成环碳原子的数量可为2至60、2至30、2至20或2至10。脂族杂环基的示例可包括环氧乙烷基、硫杂丙环基、吡咯烷基、哌啶基、四氢呋喃基、四氢噻吩基、噻烷基、四氢吡喃基、1,4-二噁烷基等,但不限于此。
[0159]
在描述中,杂芳基可包括b、o、n、p、si、se、te和s中的至少一个作为杂原子。当杂芳基含有两个或更多个杂原子时,两个或更多个杂原子可彼此相同或不同。杂芳基可为单环杂芳基或多环杂芳基。杂芳基中成环碳原子的数量可为2至60、2至30、2至20或2至10。杂芳基的示例可包括噻吩基、呋喃基、吡咯基、咪唑基、三唑基、吡啶基、联吡啶基、嘧啶基、吡嗪基、三嗪基、吖啶基、哒嗪基、喹啉基、喹唑啉基、喹喔啉基、吩噁嗪基、酞嗪基、吡啶并嘧啶基、吡啶并吡嗪基、吡嗪并吡嗪基、异喹啉基、吲哚基、咔唑基、n-芳基咔唑基、n-杂芳基咔唑基、n-烷基咔唑基、苯并噁唑基、苯并咪唑基、苯并噻唑基、苯并咔唑基、苯并噻吩基、二苯并噻吩基、噻吩并噻吩基、苯并呋喃基、菲咯啉基、噻唑基、异噁唑基、噁唑基、噁二唑基、噻二唑基、吩噻嗪基、二苯并噻咯基、二苯并呋喃基等,但不限于此。
[0160]
在描述中,芳基的上述描述可应用于亚芳基,不同的是亚芳基为二价基团。杂芳基的上述描述可应用于亚杂芳基,不同的是亚杂芳基为二价基团。
[0161]
在描述中,甲硅烷基可为烷基甲硅烷基或芳基甲硅烷基。甲硅烷基的示例可包括三甲基甲硅烷基、三乙基甲硅烷基、叔丁基二甲基甲硅烷基、乙烯基二甲基甲硅烷基、丙基二甲基甲硅烷基、三苯基甲硅烷基、二苯基甲硅烷基、苯基甲硅烷基等,但不限于此。
[0162]
在描述中,硼基可为烷基硼基或芳基硼基。硼基的示例可包括二甲基硼基、二乙基硼基、叔丁基甲基硼基、二苯基硼基、苯基硼基等,但不限于此。
[0163]
在描述中,胺基中碳原子的数量没有特别限制,但是可为1至30。胺基可为-nh2、烷基胺基、芳基胺基或杂芳基胺基。胺基的示例可包括甲基胺基、二甲基胺基、苯基胺基、二苯胺基、萘基胺基、9-甲基-蒽基胺基等,但不限于此。
[0164]
在描述中,烷基的示例可包括烷氧基、烷硫基、烷基亚磺酰基、烷基磺酰基、烷基芳基、烷基胺基、烷基硼基、烷基氧化膦基、烷基硫化膦基和烷基甲硅烷基。
[0165]
在描述中,芳基的示例可包括芳氧基、芳硫基、芳基亚磺酰基、芳基磺酰基、芳基胺基、芳基硼基、芳基氧化膦基、芳基硫化膦基和芳基甲硅烷基。
[0166]
在描述中,氧基可意指以上烷基或芳基与氧原子结合。氧基可包括烷氧基和芳氧基。烷氧基可为直链、支链或环状链。烷氧基的碳数没有特别限制,但是可为例如1至30、1至20或1至10。氧基的示例可包括甲氧基、乙氧基、正丙氧基、异丙氧基、丁氧基、戊氧基、己氧基、辛氧基、壬氧基、癸氧基、苄氧基等。然而,本发明构思的实施方式不限于此。
[0167]
在描述中,硫基可意指以上烷基或芳基与硫原子结合。硫基可包括烷硫基和芳硫基。硫基的碳数没有特别限制,但是可为例如1至30、1至20或1至10。硫基的示例包括甲基硫基、乙基硫基、丙基硫基、戊基硫基、己基硫基、辛基硫基、十二烷基硫基、环戊基硫基、环己基硫基、苯基硫基、萘基硫基等,而没有限制。
[0168]
在描述中,亚磺酰基可意指以上烷基或芳基与-s(=o)-结合。亚磺酰基的碳原子数没有特别限制,但是可为1至30、1至20或1至10。亚磺酰基可包括烷基亚磺酰基和芳基亚磺酰基。例如,亚磺酰基可具有以下结构,但不限于此。
[0169][0170]
在描述中,磺酰基可意指以上烷基或芳基与-s(=o)
2-结合。磺酰基的碳原子数没有特别限制,但是可为1至30、1至20或1至10。磺酰基可包括烷基磺酰基和芳基磺酰基。例如,磺酰基可具有以下结构,但不限于此。
[0171][0172]
在描述中,羰基的碳数没有特别限制,但是碳数可为1至40、1至30或1至20。
[0173]
例如,羰基可具有以下结构,但不限于此。
[0174][0175]
在描述中,氧化膦基可意指以上烷基或芳基与-p(=o)-结合。氧化膦基的碳原子数没有特别限制,但是可为1至30、1至20或1至10。氧化膦基可包括烷基氧化膦基和芳基氧化膦基。例如,氧化膦基可具有以下结构,但不限于此。
[0176][0177]
在描述中,硫化膦基可意指以上烷基或芳基与-p(=s)-结合。硫化膦基的碳原子数没有特别限制,但是可为1至30、1至20或1至10。硫化膦基可包括烷基硫化膦基和芳基硫化膦基。例如,硫化膦基可具有以下结构,但不限于此。
[0178][0179]
在描述中,-*表示与相邻原子的结合位置。
[0180]
实施方式的稠合多环化合物可由式1表示。
[0181]
[式1]
[0182]
[0183]
在式1中,ar1至ar3可各自独立地为氢原子、氘原子、取代的或未取代的甲硅烷基、取代的或未取代的具有1至20个碳原子的烷基、取代的或未取代的具有6至60个成环碳原子的芳基或者取代的或未取代的具有2至60个成环碳原子的杂芳基。
[0184]
在式1中,r1至r8可各自独立地为氢原子、氘原子、卤原子、氰基、取代的或未取代的甲硅烷基、取代的或未取代的胺基、取代的或未取代的氧基、取代的或未取代的具有1至20个碳原子的烷基、取代的或未取代的具有6至60个成环碳原子的芳基或者取代的或未取代的具有2至60个成环碳原子的杂芳基。
[0185]
在式1中,r
a1
至r
a6
可各自独立地为氢原子、氘原子、卤原子、氰基、取代的或未取代的甲硅烷基、取代的或未取代的胺基、取代的或未取代的氧基、取代的或未取代的具有1至20个碳原子的烷基、取代的或未取代的具有6至60个成环碳原子的芳基或者取代的或未取代的具有2至60个成环碳原子的杂芳基,或者可与相邻基团结合以形成环。
[0186]
在式1中,e、f、h和i可各自独立地为选自0至5的整数。当e为2或更大时,多个r
a1
基团可彼此相同或不同。当f为2或更大时,多个r
a2
基团可彼此相同或不同。当h为2或更大时,多个r
a4
基团可彼此相同或不同。当i为2或更大时,多个r
a5
基团可彼此相同或不同。
[0187]
在式1中,g和j可各自独立地为选自0至3的整数。当g为2或更大时,多个r
a3
基团可彼此相同或不同,并当j为2或更大时,多个r
a6
基团可彼此相同或不同。
[0188]
在式1中,r1至r8中的至少一个可为由式2表示的基团。
[0189]
[式2]
[0190][0191]
在式2中,r9和r
10
可各自独立地为氢原子、氘原子、卤原子、氰基、取代的或未取代的甲硅烷基、取代的或未取代的胺基、取代的或未取代的氧基、取代的或未取代的具有1至20个碳原子的烷基、取代的或未取代的具有6至60个成环碳原子的芳基或者取代的或未取代的具有2至60个成环碳原子的杂芳基,或者可与相邻基团结合以形成环。
[0192]
在式2中,a和b可各自独立地为选自0至5的整数。当a为2或更大时,多个r9基团可彼此相同或不同,并且当b为2或更大时,多个r
10
基团可彼此相同或不同。
[0193]
在实施方式中,式1的r1至r8中的任一个可为由式2表示的基团,或者式1的r1至r4中的任一个和式1的r5至r8中的任一个可各自独立地为由式2表示的基团。
[0194]
在实施方式中,由式1表示的稠合多环化合物可具有等于或大于约80%的光致发光量子产率(plqy)。
[0195]
在实施方式中,由式1表示的稠合多环化合物可由式3-1至式3-3中的任一个表示。
[0196]
[式3-1]
[0197][0198]
[式3-2]
[0199][0200]
[式3-3]
[0201][0202]
在式3-1至式3-3中,r
11
和r
12
可各自独立地为氢原子、氘原子、卤原子、氰基、取代的或未取代的甲硅烷基、取代的或未取代的胺基、取代的或未取代的氧基、取代的或未取代
的具有1至20个碳原子的烷基、取代的或未取代的具有6至60个成环碳原子的芳基或者取代的或未取代的具有2至60个成环碳原子的杂芳基,或者可与相邻基团结合以形成环。
[0203]
在式3-1至式3-3中,c和d可各自独立地为选自0至5的整数。当c为2或更大时,多个r
11
基团可彼此相同或不同,并且当d为2或更大时,多个r
12
基团可彼此相同或不同。
[0204]
在式3-1至式3-3中,ar1至ar3、r1至r
10
、r
a1
至r
a6
、a、b以及e至j与式1和式2中限定的相同。
[0205]
在实施方式中,由式1表示的稠合多环化合物可由式4表示。
[0206]
[式4]
[0207][0208]
在式4中,r
11
和r
12
可各自独立地为氢原子、氘原子、卤原子、氰基、取代的或未取代的甲硅烷基、取代的或未取代的胺基、取代的或未取代的氧基、取代的或未取代的具有1至20个碳原子的烷基、取代的或未取代的具有6至60个成环碳原子的芳基或者取代的或未取代的具有2至60个成环碳原子的杂芳基,或者可与相邻基团结合以形成环。
[0209]
在式4中,a'至d'可各自独立地为选自0至4的整数。当a'为2或更大时,多个r9基团可彼此相同或不同,并且当b'为2或更大时,多个r
10
基团可彼此相同或不同。当c'为2或更大时,多个r
11
基团可彼此相同或不同,并且当d'为2或更大时,多个r
12
基团可彼此相同或不同。
[0210]
在式4中,ar1至ar3、r1至r3、r5至r7、r9、r
10
、r
a1
至r
a6
以及e至j与式1和式2中限定的相同。
[0211]
在实施方式的稠合多环化合物中,ar1至ar3可各自独立地为氢原子或氘原子。
[0212]
在实施方式的稠合多环化合物中,ar1可为取代的或未取代的具有6至60个成环碳原子的芳基或者取代的或未取代的具有2至60个成环碳原子的杂芳基,并且ar2和ar3可各自独立地为氢原子或氘原子。
[0213]
在实施方式的稠合多环化合物中,ar1可为取代的或未取代的具有1至20个碳原子的烷基,并且ar2和ar3可各自独立地为氢原子或氘原子。
[0214]
在实施方式的稠合多环化合物中,ar1可为取代的或未取代的具有1至20个碳原子的甲硅烷基,并且ar2和ar3可各自独立地为氢原子或氘原子。
[0215]
在实施方式中,由式3-1表示的稠合多环化合物可由式5表示。
[0216]
[式5]
[0217][0218]
在式5中,r
21
可为氢原子、氘原子、卤原子、取代的或未取代的胺基、取代的或未取代的甲硅烷基、取代的或未取代的具有1至20个碳原子的烷基、取代的或未取代的具有6至60个成环碳原子的芳基或者取代的或未取代的具有2至60个成环碳原子的杂芳基,或者可与相邻基团结合以形成环,
[0219]
在式5中,k可为选自0至5的整数。当k为2或更大时,多个r
21
基团可彼此相同或不同。
[0220]
在式5中,r1至r3、r5至r7、r9至r
12
、r
a1
至r
a6
以及a至j与式3-1中限定的相同。
[0221]
在实施方式中,由式3-2表示的稠合多环化合物可由式6-1或式6-2表示。
[0222]
[式6-1]
[0223][0224]
[式6-2]
[0225][0226]
在式6-1和式6-2中,r
b1
和r
b2
可各自独立地为氢原子、氘原子、卤原子、取代的或未取代的胺基、取代的或未取代的甲硅烷基、取代的或未取代的具有1至20个碳原子的烷基、取代的或未取代的具有6至60个成环碳原子的芳基或者取代的或未取代的具有2至60个成环碳原子的杂芳基,或者可与相邻基团结合以形成环。
[0227]
在式6-1和式6-2中,m和n可各自独立地为选自0至5的整数。当m为2或更大时,多个r
b1
基团可彼此相同或不同,并且当n为2或更大时,多个r
b2
基团可彼此相同或不同。
[0228]
在式6-1和式6-2中,ar1至ar3、r1至r3、r5至r
10
、r
a1
至r
a6
、a、b以及e至j与式3-2中限定的相同。
[0229]
实施方式的稠合多环化合物可为选自化合物组1中的任一种。根据实施方式的有机电致发光装置ed的发射层eml可包括选自化合物组1中的至少一种。
[0230]
[化合物组1]
[0231]
[0232]
[0233]
[0234]
[0235]
[0236]
[0237]
[0238]
[0239]
[0240][0241][0242]
由式1表示的实施方式的稠合多环化合物可为热激活延迟荧光发射材料。由式1表
示的实施方式的稠合多环化合物可用作发光掺杂剂材料。例如,由式1表示的实施方式的稠合多环化合物可为最低三重态激发能级(t1水平)和最低单重态激发能级(s1水平)之间的差
△est
等于或小于约0.2ev的热激活延迟荧光掺杂剂。然而,实施方式不限于此,并且由式1表示的实施方式的稠合多环化合物可为磷光发光材料。由式1表示的实施方式的稠合多环化合物可为磷光掺杂剂。
[0243]
由式1表示的实施方式的稠合多环化合物可为发射蓝光的材料。蓝光可指,例如,约430nm至约490nm的波长范围内的光。例如,由式1表示的实施方式的稠合多环化合物可为蓝色热激活延迟荧光(tadf)掺杂剂。然而,实施方式不限于此,并且当实施方式的稠合多环化合物用作发光材料时,由式1表示的稠合多环化合物可用作发射各个波长范围内的光的掺杂剂材料,比如红色发光掺杂剂或绿色发光掺杂剂。在另一实施方式中,由式1表示的实施方式的稠合多环化合物可为主体或荧光掺杂剂。
[0244]
如本文中提供的由式1表示的稠合多环化合物可用于根据实施方式的有机电致发光装置ed中,以增加有机电致发光装置ed的发光效率和寿命期。例如,如本文中提供的由式1表示的稠合多环化合物可用于根据实施方式的有机电致发光装置ed的发射层eml中,以增加有机电致发光装置ed的发光效率和寿命期。
[0245]
在根据实施方式的有机电致发光装置ed中,发射层eml进一步包括第一主体和第二主体。在实施方式中,第一主体和第二主体可彼此不同。在实施方式中,第一主体可为空穴传输第一主体,并且第二主体可为电子传输第二主体。
[0246]
在实施方式中,空穴传输第一主体和电子传输第二主体可各自独立地由式e表示。
[0247]
[式e]
[0248][0249]
在式e中,a0可为选自0至10的整数;并且la可为直接连接、取代的或未取代的具有6至30个成环碳原子的亚芳基或者取代的或未取代的具有2至30个成环碳原子的亚杂芳基。当a0为2或更大时,多个la基团可各自独立地为取代的或未取代的具有6至30个成环碳原子的亚芳基或者取代的或未取代的具有2至30个成环碳原子的亚杂芳基。
[0250]
在式e中,a1至a5可各自独立地为n或c(ri)。在式e中,ra至ri可各自独立地为氢原子、氘原子、取代的或未取代的胺基、取代的或未取代的硫基、取代的或未取代的氧基、取代的或未取代的具有1至20个碳原子的烷基、取代的或未取代的具有2至20个碳原子的烯基、取代的或未取代的具有6至30个成环碳原子的芳基或者取代的或未取代的具有2至30个成环碳原子的杂芳基,或者可与相邻基团结合以形成环。ra至ri可与相邻基团结合以形成烃环或含有n、o、s等作为成环原子的杂环。
[0251]
在式e中,a1至a5中的两个或三个可为n,并且a1至a5中的其余基团可为c(ri)。
[0252]
根据实施方式的有机电致发光装置ed在发射层eml中可包括选自化合物组ht中的至少一种作为空穴传输第一主体。
[0253]
[化合物组ht]
[0254]
[0255]
[0256][0257]
根据实施方式的有机电致发光装置ed在发射层eml中可包括选自化合物组et中的至少一种作为电子传输第二主体。
[0258]
[化合物组et]
[0259]
[0260][0261]
在实施方式的有机电致发光装置ed中,发射层eml可进一步包括敏化剂。在实施方式中,敏化剂可包括有机金属络合物。包括在发射层eml中的敏化剂可用作辅助掺杂剂,并且可为磷光敏化剂。在根据实施方式的有机电致发光装置ed中,包括在发射层eml中的敏化剂可将能量转移至发光掺杂剂以增加发光掺杂剂发射荧光的速率。
[0262]
根据实施方式的有机金属络合物可由式m-b表示。
[0263]
[式m-b]
[0264][0265]
在式m-b中,q1至q4可各自独立地为c或n;并且c1至c4可各自独立地为取代的或未取代的具有5至30个成环碳原子的烃环或者取代的或未取代的具有2至30个成环碳原子的
杂环。在式m-b中,l
21
至l
24
可各自独立地为直接连接、*-o-*、*-s-*、取代的或未取代的具有1至20个碳原子的二价烷基、取代的或未取代的具有6至30个成环碳原子的亚芳基或者取代的或未取代的具有2至30个成环碳原子的亚杂芳基;并且e1至e4可各自独立地为0或1。在式m-b中,r
31
至r
39
可各自独立地为氢原子、氘原子、卤原子、氰基、取代的或未取代的胺基、取代的或未取代的具有1至20个碳原子的烷基、取代的或未取代的具有6至30个成环碳原子的芳基或者取代的或未取代的具有2至30个成环碳原子的杂芳基,或者可与相邻基团结合以形成环;并且d1至d4可各自独立地为选自0至4的整数。
[0266]
在实施方式中,由式m-b表示的有机金属络合物可包括选自化合物组ps中的至少一种。
[0267]
[化合物组ps]
[0268]
[0269][0270][0271]
在化合物组ps中,r、r
38
和r
39
可各自独立地为氢原子、氘原子、卤原子、氰基、取代
的或未取代的胺基、取代的或未取代的具有1至20个碳原子的烷基、取代的或未取代的具有6至30个成环碳原子的芳基或者取代的或未取代的具有2至30个成环碳原子的杂芳基。
[0272]
根据实施方式的有机电致发光装置ed可包括多个发射层eml。多个发射层eml可被依次堆叠并提供,并且作为示例,包括多个发射层eml的有机电致发光装置ed可发射白光。包括多个发射层eml的有机电致发光装置ed可为具有串联结构的有机电致发光装置。当有机电致发光装置ed包括多个发射层eml时,至少一个发射层eml可包括如上所述的根据实施方式的稠合多环化合物。
[0273]
在实施方式的有机电致发光装置ed中,发射层eml可包括蒽衍生物、芘衍生物、荧蒽衍生物、1,2-苯并菲衍生物、二氢苯并蒽衍生物或三亚苯衍生物。例如,发射层eml可包括蒽衍生物或芘衍生物。
[0274]
发射层eml可进一步包括主体和掺杂剂,并且发射层eml可包括由式e-1表示的化合物。由式e-1表示的化合物可用作荧光主体材料。
[0275]
[式e-1]
[0276][0277]
在式e-1中,r
31
至r
40
可各自独立地为氢原子、氘原子、卤原子、取代的或未取代的甲硅烷基、取代的或未取代的硫基、取代的或未取代的氧基、取代的或未取代的具有1至10个碳原子的烷基、取代的或未取代的具有2至10个碳原子的烯基、取代的或未取代的具有6至30个成环碳原子的芳基或者取代的或未取代的具有2至30个成环碳原子的杂芳基,或者可与相邻基团结合以形成环。例如,r
31
至r
40
可与相邻基团结合以形成饱和烃环、不饱和烃环、饱和杂环或不饱和杂环。
[0278]
在式e-1中,n1和n2可各自独立地为选自0至5的整数。
[0279]
由式e-1表示的化合物可为选自化合物e1至e20中的任一种。
[0280]
[0281][0282]
在实施方式中,发射层eml可进一步包括由式e-2b表示的化合物。由式e-2b表示的化合物可用作荧光主体材料。
[0283]
[式e-2b]
[0284][0285]
在式e-2b中,cbz1和cbz2可各自独立地为取代的或未取代的具有6至60个成环碳原子的芳基、取代的或未取代的具有2至60个成环碳原子的杂芳基。例如,cbz1和cbz2可各自独立地为未取代的咔唑基或被具有6至30个成环碳原子的芳基取代的咔唑基。在式e-2b中,lb可为直接连接、取代的或未取代的具有6至30个成环碳原子的亚芳基或者取代的或未取代的具有2至30个成环碳原子的亚杂芳基。在式e-2b中,b可为选自0至10的整数,并且当b为2或更大时,多个lb基团可各自独立地为取代的或未取代的具有6至30个成环碳原子的亚芳基或者取代的或未取代的具有2至30个成环碳原子的亚杂芳基。
[0286]
由式e-2b表示的化合物可为选自化合物组e-2中的任一种。然而,化合物组e-2中列举的化合物仅作为示例呈示,并且由式e-2b表示的化合物不限于化合物组e-2中列举的化合物。
[0287]
[化合物组e-2]
[0288]
[0289][0290]
[0291]
发射层eml可进一步包括相关领域的材料作为主体材料。例如,发射层eml可包括双[2-(二苯基膦基)苯基]醚氧化物(dpepo)、4,4'-双(n-咔唑基)-1,1'-联苯(cbp)、1,3-双(n-咔唑基)苯(mcp)、2,8-双(二苯基磷酰基)二苯并呋喃(ppf)、4,4',4"-三(n-咔唑基)-三苯胺(tcta)和1,3,5-三(1-苯基-1h-苯并[d]咪唑-2-基)苯(tpbi)中的至少一种作为主体材料。然而,实施方式不限于此,例如,三(8-羟基喹啉)铝(alq3)、9,10-二(萘-2-基)蒽(adn)、3-叔丁基-9,10-二(萘-2-基)蒽(tbadn)、二苯乙烯芳烃(dsa)、4,4'-双(9-咔唑基)-2,2'-二甲基-联苯(cdbp)、2-甲基-9,10-双(萘-2-基)蒽(madn)、六苯基环三磷腈(cp1)、1,4-双(三苯基甲硅烷基)苯(ugh2)、六苯基环三硅氧烷(dpsio3)、八苯基环四硅氧烷(dpsio4)等可用作主体材料。
[0292]
发射层eml可包括由式m-a表示的化合物。由式m-a表示的化合物可用作磷光掺杂剂材料。
[0293]
[式m-a]
[0294][0295]
在式m-a中,y1至y4和z1至z4可各自独立地为c(r1)或n,且r1至r4可各自独立地为氢原子、氘原子、取代的或未取代的胺基、取代的或未取代的硫基、取代的或未取代的氧基、取代的或未取代的具有1至20个碳原子的烷基、取代的或未取代的具有2至20个碳原子的烯基、取代的或未取代的具有6至30个成环碳原子的芳基或者取代的或未取代的具有2至30个成环碳原子的杂芳基,或者可与相邻基团结合以形成环。在式m-a中,m可为0或1,且n可为2或3。在式m-a中,当m为0时,n可为3,且当m为1时,n可为2。
[0296]
由式m-a表示的化合物可用作磷光掺杂剂。
[0297]
由式m-a表示的化合物可为选自化合物m-a1至m-a25中的任一种。然而,化合物m-a1至m-a25仅为示例,并且由式m-a表示的化合物不限于化合物m-a1至m-a25。
[0298]
[0299]
[0300][0301]
化合物m-a1和m-a2可用作红色掺杂剂材料并且化合物m-a3至m-a7可用作绿色掺杂剂材料。
[0302]
发射层eml可包括由式f-a和式f-b中的任一个表示的化合物。由式f-a或式f-b表示的化合物可用作荧光掺杂剂材料。
[0303]
[式f-a]
[0304][0305]
在式f-a中,ra至rj中的两个可各自独立地被由*-nar1ar2表示的基团取代。ra至rj中未被由*-nar1ar2表示的基团取代的其余基团可各自独立地为氢原子、氘原子、卤原子、氰基、取代的或未取代的胺基、取代的或未取代的具有1至20个碳原子的烷基、取代的或未取代的具有6至30个成环碳原子的芳基或者取代的或未取代的具有2至30个成环碳原子的杂芳基。
[0306]
在由*-nar1ar2表示的基团中,ar1和ar2可各自独立地为取代的或未取代的具有6至30个成环碳原子的芳基或者取代的或未取代的具有2至30个成环碳原子的杂芳基。例如,ar1和ar2中的至少一个可各自独立地为含有o或s作为成环原子的杂芳基。
[0307]
[式f-b]
[0308][0309]
在式f-b中,ra和rb可各自独立地为氢原子、氘原子、取代的或未取代的具有1至20个碳原子的烷基、取代的或未取代的具有2至20个碳原子的烯基、取代的或未取代的具有6至30个成环碳原子的芳基或者取代的或未取代的具有2至30个成环碳原子的杂芳基,或者可与相邻基团结合以形成环。在式f-b中,ar1至ar4可各自独立地为取代的或未取代的具有6至30个成环碳原子的芳基或者取代的或未取代的具有2至30个成环碳原子的杂芳基。
[0310]
在式f-b中,u和v可各自独立地为取代的或未取代的具有5至30个成环碳原子的烃环或者取代的或未取代的具有2至30个成环碳原子的杂环。
[0311]
在式f-b中,由u和v表示的环的数量可各自独立地为0或1。例如,在式f-b中,当u或v的数量为1时,在由u或v指示的部分可存在稠环,并且当u或v的数量为0时,在由u或v指示的部分可不存在稠环。当u的数量为0且v的数量为1时,或当u的数量为1且v的数量为0时,式f-b的具有芴核的稠环可为具有四个环的环状化合物。当u和v的数量均为0时,式f-b的具有芴核的稠环可为具有三个环的环状化合物。当u和v的数量均为1时,式f-b的具有芴核的稠环可为具有五个环的环状化合物。
[0312]
在图3至图6中示出的实施方式的有机电致发光装置ed中,电子传输区etr提供在发射层eml上。电子传输区etr可包括空穴阻挡层hbl、电子传输层etl和电子注入层eil中的至少一个,但是实施方式不限于此。
[0313]
电子传输区etr可为由单种材料形成的单层结构,由不同材料形成的单层结构,或具有由不同材料形成的多个层的多层结构。
[0314]
例如,电子传输区etr可具有电子注入层eil或电子传输层etl的单层结构,或可具有由电子注入材料和电子传输材料形成的单层结构。在其他实施方式中,电子传输区etr可具有由不同材料形成的单层结构,或可具有其中电子传输层etl/电子注入层eil,或空穴阻挡层hbl/电子传输层etl/电子注入层eil从发射层eml以其各自叙述的顺序堆叠的结构,但是实施方式不限于此。电子传输区etr可具有,例如,约至约的范围内的厚度。
[0315]
电子传输区etr可使用各种方法比如真空沉积方法、旋涂方法、浇铸方法、朗缪尔-布罗基特(lb)方法、喷墨印刷方法、激光印刷方法、激光诱导热成像(liti)方法等形成。
[0316]
当电子传输区etr包括电子传输层etl时,电子传输区etr可包括蒽类化合物。然而,实施方式不限于此,并且电子传输区etr可包括,例如,三(8-羟基喹啉)铝(alq3)、1,3,5-三[(3-吡啶基)-苯-3-基]苯、2,4,6-三(3`'-(吡啶-3-基)联苯-3-基)-1,3,5-三嗪、2-(4-(n-苯基苯并咪唑-1-基)苯基)-9,10-二萘基蒽、1,3,5-三(1-苯基-1h-苯并[d]咪唑-2-基)苯(tpbi)、2,9-二甲基-4,7-二苯基-1,10-菲咯啉(bcp)、4,7-二苯基-1,10-菲咯啉(bphen)、3-(4-联苯基)-4-苯基-5-叔丁基苯基-1,2,4-三唑(taz)、4-(萘-1-基)-3,5-二苯基-4h-1,2,4-三唑(ntaz)、2-(4-联苯基)-5-(4-叔丁基苯基)-1,3,4-噁二唑(
t
bu-pbd)、双(2-甲基-8-羟基喹啉-n1,o8)-(1,1'-联苯-4-羟基)铝(balq)、双(苯并喹啉-10-羟基)铍(bebq2)、9,10-二(萘-2-基)蒽(adn)、1,3-双[3,5-二(吡啶-3-基)苯基]苯(bmpyphb)、二苯
基[4-(三苯基甲硅烷基)苯基]氧化膦(tspo1)或其混合物。
[0317]
例如,电子传输区etr可包括由式et-1表示的化合物。
[0318]
[式et-1]
[0319][0320]
在式et-1中,x1至x3中的至少一个可为n且x1至x3中的其余基团可为c(ra)。ra可为氢原子、氘原子、取代的或未取代的具有1至20个碳原子的烷基、取代的或未取代的具有6至30个成环碳原子的芳基或者取代的或未取代的具有2至30个成环碳原子的杂芳基。在式et-1中,ar1至ar3可各自独立地为氢原子、氘原子、取代的或未取代的具有1至20个碳原子的烷基、取代的或未取代的具有6至30个成环碳原子的芳基或者取代的或未取代的具有2至30个成环碳原子的杂芳基。
[0321]
在式et-1中,a至c可各自独立地为选自0至10的整数。在式et-1中,l1至l3可各自独立地为直接连接、取代的或未取代的具有6至30个成环碳原子的亚芳基或者取代的或未取代的具有2至30个成环碳原子的亚杂芳基。当a至c为2或更大时,l1至l3可各自独立地为取代的或未取代的具有6至30个成环碳原子的亚芳基或者取代的或未取代的具有2至30个成环碳原子的亚杂芳基。
[0322]
电子传输区etr可包括化合物et1至et36中的至少一种。
[0323]
[0324]
[0325][0326]
电子传输区etr可包括卤化金属比如lif、nacl、csf、rbcl、rbi、cul或ki,镧系金属比如yb,或卤化金属和镧系金属的共沉积材料。例如,电子传输区etr可包括ki:yb、rbi:yb、lif:yb等作为共沉积材料。电子传输区etr可包括金属氧化物比如li2o和bao,或8-羟基-喹啉锂(liq)等,但是实施方式不限于此。电子传输区etr也可由电子传输材料和绝缘有机金属盐的混合物材料形成。绝缘有机金属盐可为能带隙等于或大于约4ev的材料。例如,绝缘有机金属盐可包括金属乙酸盐、金属苯甲酸盐、金属乙酰乙酸盐、金属乙酰丙酮酸盐或金属硬脂酸盐。
[0327]
除了上述材料之外,电子传输区etr可进一步包括,例如,2,9-二甲基-4,7-二苯基-1,10-菲咯啉(bcp)和4,7-二苯基-1,10-菲咯啉(bphen)中的至少一个,但是实施方式不限于此。
[0328]
电子传输区etr可在电子注入层eil、电子传输层etl和空穴阻挡层hbl中的至少一个中包括上述电子传输区etr的化合物。
[0329]
当电子传输区etr包括电子传输层etl时,电子传输层etl可具有约至约的范围内的厚度。例如,电子传输层etl可具有约至约的范围内的厚度。当电子传输层etl的厚度满足上述范围时,可在不显著增加驱动电压的情况下获得令人满意的电子传输性质。当电子传输区etr包括电子注入层eil时,电子注入层eil可具有约至约的范围内的厚度。例如,电子注入层eil可具有约至约的范围内的厚度。当电子注入层eil的厚度满足上述范围时,可在不显著增加驱动电压的情况下获得令人满意的电子注入性质。
[0330]
第二电极el2提供在电子传输区etr上。第二电极el2可为公共电极。第二电极el2可为阴极或阳极,但是实施方式不限于此。例如,当第一电极el1为阳极时,第二电极el2可为阴极,并且当第一电极el1为阴极时,第二电极el2可为阳极。
[0331]
第二电极el2可为透射电极、透反射电极或反射电极。当第二电极el2为透射电极时,第二电极el2可由透明金属氧化物(例如,氧化铟锡(ito)、氧化铟锌(izo)、氧化锌(zno)、氧化铟锡锌(itzo)等)形成。
[0332]
当第二电极el2为透反射电极或反射电极时,第二电极el2可包括ag、mg、cu、al、pt、pd、au、ni、nd、ir、cr、li、ca、lif、mo、ti、yb、其化合物或其混合物(例如,agmg、agyb或mgyb),或具有多层结构的材料比如lif/ca或lif/al。在另一实施方式中,第二电极el2可具有多层结构,该多层结构包括由上述材料形成的反射膜或透反射膜,和由氧化铟锡(ito)、氧化铟锌(izo)、氧化锌(zno)、氧化铟锡锌(itzo)等形成的透明导电膜。
[0333]
尽管未在附图中示出,但是第二电极el2可电连接至辅助电极。当第二电极el2电连接至辅助电极时,第二电极el2的电阻可降低。
[0334]
在实施方式中,有机电致发光装置ed可进一步包括设置在第二电极el2上的封盖层cpl。封盖层cpl可为多层或单层。
[0335]
在实施方式中,封盖层cpl可包括有机层或无机层。例如,当封盖层cpl包括无机材料时,无机材料可包括碱金属化合物比如lif,碱土金属化合物比如mgf2,sion,sin
x
,sioy等。
[0336]
例如,当封盖层cpl包括有机材料时,有机材料可包括2,2'-二甲基-n,n'-二[(1-萘基)-n,n'-二苯基]-1,1'-联苯-4,4'-二胺(α-npd)、npb、tpd、m-mtdata、alq3、cupc、n4,n4,n4',n4'-四(联苯-4-基)联苯-4,4'-二胺(tpd15)、4,4',4"-三(n-咔唑基)三苯胺(tcta)等,或可包括环氧树脂,或丙烯酸酯比如甲基丙烯酸酯。然而,实施方式不限于此,并且封盖层cpl可包括化合物p1至p5中的至少一种。
[0337][0338][0339]
封盖层cpl可具有等于或大于约1.6的折射率。例如,相对于约550nm至约660nm的波长范围内的光,封盖层cpl可具有等于或大于约1.6的折射率。
[0340]
图7和图8各自为根据实施方式的显示设备的示意性横截面图。下文中,在参考图7和图8描述根据实施方式的显示设备时,将不再描述与对图1至图6的解释重叠的内容,并且将描述区别。
[0341]
参考图7,根据实施方式的显示设备dd可包括:具有显示元件层dp-ed的显示面板dp,设置在显示面板dp上的光控制层ccl,和滤色器层cfl。
[0342]
在图7中阐释的实施方式中,显示面板dp可包括基底层bs,提供在基底层bs上的电路层dp-cl,和显示元件层dp-ed,并且显示元件层dp-ed可包括有机电致发光装置ed。
[0343]
有机电致发光装置ed可包括第一电极el1、设置在第一电极el1上的空穴传输区htr、设置在空穴传输区htr上的发射层eml、设置在发射层eml上的电子传输区etr和设置在电子传输区etr上的第二电极el2。图7中阐释的有机电致发光装置ed的结构可与如上所述的图3至图6的有机电致发光装置ed的结构相同。
[0344]
参考图7,发射层eml可设置在像素限定膜pdl中限定的开口oh中。例如,由像素限
定膜pdl分开且对应地提供给发光区pxa-r、pxa-g和pxa-b中的每一个的发射层eml可发射在相同的波长范围内的光。在实施方式的显示设备dd中,发射层eml可发射蓝光。尽管未在附图中示出,但是在实施方式中,发射层eml可被提供为遍及发光区pxa-r、pxa-g和pxa-b的公共层。
[0345]
光控制层ccl可设置在显示面板dp上。光控制层ccl可包括光转换体。光转换体可为量子点或磷光体。光转换体可转换所提供的光的波长并且可发射所得的光。例如,光控制层ccl可为含有量子点或磷光体的层。
[0346]
量子点可为第ii-vi族化合物、第iii-vi族化合物、第i-iii-vi族化合物、第iii-v族化合物、第iv-vi族化合物、第iv族元素、第iv族化合物或其组合。
[0347]
第ii-vi族化合物可选自:选自由cdse、cdte、cds、zns、znse、znte、zno、hgs、hgse、hgte、mgse、mgs及其混合物组成的组中的二元化合物;选自由cdses、cdsete、cdste、znses、znsete、znste、hgses、hgsete、hgste、cdzns、cdznse、cdznte、cdhgs、cdhgse、cdhgte、hgzns、hgznse、hgznte、mgznse、mgzns及其混合物组成的组中的三元化合物;选自由cdznses、cdznsete、cdznste、cdhgses、cdhgsete、cdhgste、hgznses、hgznsete、hgznste及其混合物组成的组中的四元化合物;或其任何组合。
[0348]
第iii-vi族化合物可包括:二元化合物比如in2s3和in2se3;三元化合物比如ingas3和ingase3;或其任何组合。
[0349]
第i-iii-vi族化合物可包括:选自由agins、agins2、cuins、cuins2、aggas2、cugas2、cugao2、aggao2、agalo2或其任何混合物组成的组中的三元化合物;四元化合物比如agingas2和cuingas2;或其任何组合。
[0350]
第iii-v族化合物可选自:选自由gan、gap、gaas、gasb、aln、alp、alas、alsb、inn、inp、inas、insb及其混合物组成的组中的二元化合物;选自由ganp、ganas、gansb、gapas、gapsb、alnp、alnas、alnsb、alpas、alpsb、ingap、inalp、innp、innas、innsb、inpas、inpsb及其混合物组成的组中的三元化合物;选自由gaalnp、gaalnas、gaalnsb、gaalpas、gaalpsb、gainnp、gainnas、gainnsb、gainpas、gainpsb、inalnp、inalnas、inalnsb、inalpas、inalpsb及其混合物组成的组中的四元化合物;或其任何组合。第iii-v族化合物可进一步包括第ii族金属。例如,可选择inznp等作为第iii-ii-v族化合物。
[0351]
第iv-vi族化合物可选自:选自由sns、snse、snte、pbs、pbse、pbte及其混合物组成的组中的二元化合物;选自由snses、snsete、snste、pbses、pbsete、pbste、snpbs、snpbse、snpbte及其混合物组成的组中的三元化合物;选自由snpbsse、snpbsete、snpbste及其混合物组成的组中的四元化合物;或其任何组合。第iv族元素可选自由si、ge及其混合物组成的组。第iv族化合物可为选自由sic、sige及其混合物组成的组中的二元化合物。
[0352]
二元化合物、三元化合物或四元化合物可以以均匀的浓度分布存在于颗粒中,或可以以部分不同的浓度分布存在于颗粒中。在实施方式中,量子点可具有其中量子点围绕另一量子点的核/壳结构。具有核/壳结构的量子点可在核和壳之间的界面具有其中壳中存在的元素的浓度向核的中心降低的浓度梯度。
[0353]
在实施方式中,量子点可具有上述的核/壳结构,其包括具有纳米晶体的核和围绕核的壳。量子点的壳可用作保护层,其防止核的化学变性以便保持半导体性质,并且/或者可用作充电层,其赋予量子点电泳性质。壳可为单层或多层。量子点的壳的示例可包括金属
氧化物或非金属氧化物、半导体化合物或其组合。
[0354]
例如,金属氧化物或非金属氧化物可为二元化合物比如sio2、al2o3、tio2、zno、mno、mn2o3、mn3o4、cuo、feo、fe2o3、fe3o4、coo、co3o4、nio,或三元化合物比如mgal2o4、cofe2o4、nife2o4和comn2o4,但是实施方式不限于此。
[0355]
半导体化合物可为,例如,cds、cdse、cdte、zns、znse、znte、znses、zntes、gaas、gap、gasb、hgs、hgse、hgte、inas、inp、ingap、insb、alas、alp、alsb等,但是实施方式不限于此。
[0356]
量子点可具有等于或小于约45nm的发光波长光谱的半峰全宽(fwhm)。例如,量子点可具有等于或小于约40nm的发光波长光谱的fwhm。例如,量子点可具有等于或小于约30nm的发光波长光谱的fwhm。颜色纯度或颜色再现性可在以上范围内增强。通过这样的量子点发射的光可在所有方向上发射,从而可改善宽视角。
[0357]
量子点的形式没有特别限制,只要它是相关领域中使用的形式。例如,量子点可具有球形形状、锥体形状、多臂形状或立方体形状,或者量子点可为纳米颗粒、纳米管、纳米线、纳米纤维、纳米板等的形式。
[0358]
量子点可根据其颗粒尺寸控制发射光的颜色,并且因此,量子点可具有各种发射光的颜色,比如蓝色、红色、绿色等。
[0359]
光控制层ccl可包括光控制单元ccp1、ccp2和ccp3。光控制单元ccp1、ccp2和ccp3可彼此间隔开。
[0360]
参考图7,分隔图案bmp可设置在彼此间隔开的光控制单元ccp1、ccp2和ccp3之间,但是实施方式不限于此。在图7中,示出分隔图案bmp,使得其不与光控制单元ccp1、ccp2和ccp3重叠,但是光控制单元ccp1、ccp2和ccp3的边缘可与分隔图案bmp的至少一部分重叠。
[0361]
光控制层ccl可包括:第一光控制单元ccp1,其包括用于将从有机电致发光装置ed提供的第一颜色光转换为第二颜色光的第一量子点qd1;第二光控制单元ccp2,其包括用于将从有机电致发光装置ed提供的第一颜色光转换为第三颜色光的第二量子点qd2;和透射从有机电致发光装置ed提供的第一颜色光的第三光控制单元ccp3。
[0362]
在实施方式中,第一光控制单元ccp1可提供作为第二颜色光的红光,并且第二光控制单元ccp2可提供作为第三颜色光的绿光。第三光控制单元ccp3可透射并且提供作为从有机电致发光装置ed提供的第一颜色光的蓝光。例如,第一量子点qd1可为红色量子点,并且第二量子点qd2可为绿色量子点。以上提供的关于量子点的相同描述可应用于量子点qd1和qd2。
[0363]
光控制层ccl可进一步包括散射体sp。第一光控制单元ccp1可包括第一量子点qd1和散射体sp,第二光控制单元ccp2可包括第二量子点qd2和散射体sp,并且第三光控制单元ccp3可不包括量子点,但是可包括散射体sp。
[0364]
散射体sp可为无机颗粒。例如,散射体sp可包括tio2、zno、al2o3、sio2和中空二氧化硅中的至少一种。散射体sp可包括tio2、zno、al2o3、sio2和中空二氧化硅中的任一种,或可为选自tio2、zno、al2o3、sio2和中空二氧化硅中的两种或更多种材料的混合物。
[0365]
第一光控制单元ccp1、第二光控制单元ccp2和第三光控制单元ccp3可各自包括用于分散量子点qd1和qd2以及散射体sp的基础树脂br1、br2和br3。在实施方式中,第一光控制单元ccp1可包括分散在第一基础树脂br1中的第一量子点qd1和散射体sp,第二光控制单
元ccp2可包括分散在第二基础树脂br2中的第二量子点qd2和散射体sp,并且第三光控制单元ccp3可包括分散在第三基础树脂br3中的散射体sp。基础树脂br1、br2和br3可各自为其中分散有量子点qd1和qd2以及散射体sp的介质,并且可由可通常称为粘结剂的各种树脂组合物形成。例如,基础树脂br1、br2和br3可各自独立地为丙烯酸类树脂、氨基甲酸乙酯类树脂、硅酮类树脂、环氧类树脂等。基础树脂br1、br2和br3可各自为透明树脂。在实施方式中,第一基础树脂br1、第二基础树脂br2和第三基础树脂br3可各自彼此相同或不同。
[0366]
光控制层ccl可包括隔离层bfl1。隔离层bfl1可防止引入水分和/或氧气(在下文中,称为“水分/氧气”)。隔离层bfl1可设置在光控制单元ccp1、ccp2和ccp3上以防止光控制单元ccp1、ccp2和ccp3暴露于水分/氧气。隔离层bfl1可覆盖光控制单元ccp1、ccp2和ccp3。隔离层bfl2可提供在光控制单元ccp1、ccp2和ccp3与滤色器cf1、cf2和cf3之间。
[0367]
隔离层bfl1和bfl2可各自包括至少一个无机层。例如,隔离层bfl1和bfl2可各自由无机材料形成。例如,隔离层bfl1和bfl2可各自独立地包括氮化硅、氮化铝、氮化锆、氮化钛、氮化铪、氮化钽、氧化硅、氧化铝、氧化钛、氧化锡、氧化铈、氮氧化硅和/或其中确保透光度的金属薄膜等。隔离层bfl1和bfl2可各自进一步包括有机膜。隔离层bfl1和bfl2可由单层或多层形成。
[0368]
在实施方式的显示设备dd中,滤色器层cfl可设置在光控制层ccl上。在实施方式中,滤色器层cfl可直接设置在光控制层ccl上。例如,可省略隔离层bfl2。
[0369]
滤色器层cfl可包括阻光单元bm以及滤色器cf1、cf2和cf3。例如,滤色器层cfl可包括透射第二颜色光的第一滤色器cf1、透射第三颜色光的第二滤色器cf2和透射第一颜色光的第三滤色器cf3。例如,第一滤色器cf1可为红色滤色器,第二滤色器cf2可为绿色滤色器,并且第三滤色器cf3可为蓝色滤色器。滤色器cf1、cf2和cf3可各自包括聚合物光敏树脂、颜料和/或染料。第一滤色器cf1可包括红色颜料或红色染料,第二滤色器cf2可包括绿色颜料或绿色染料,并且第三滤色器cf3可包括蓝色颜料或蓝色染料。然而,实施方式不限于此,并且第三滤色器cf3可不包括颜料或染料。第三滤色器cf3可包括聚合物光敏树脂并且可不包括颜料或染料。第三滤色器cf3可为透明的。第三滤色器cf3可由透明光敏树脂形成。
[0370]
在实施方式中,第一滤色器cf1和第二滤色器cf2可各自为黄色滤色器。第一滤色器cf1和第二滤色器cf2可彼此不分开,并且可作为单一体提供。
[0371]
阻光单元bm可为黑色矩阵。阻光单元bm可包括各自包含黑色颜料或黑色染料的有机阻光材料或无机阻光材料。阻光单元bm可防止光渗漏并且可区分相邻滤色器cf1、cf2和cf3之间的边界。在实施方式中,阻光单元bm可由蓝色滤色器形成。
[0372]
第一至第三滤色器cf1、cf2和cf3可分别对应于红色发光区pxa-r、绿色发光区pxa-g和蓝色发光区pxa-b进行设置。
[0373]
基底基板bl可设置在滤色器层cfl上。基底基板bl可提供基底表面,在该基底表面上设置滤色器层cfl和光控制层ccl。基底基板bl可为玻璃基板、金属基板、塑料基板等。然而,实施方式不限于此,并且基底基板bl可包括无机层、有机层或复合材料层。尽管未在附图中示出,但是在实施方式中,可省略基底基板bl。
[0374]
图8为示出根据实施方式的显示设备的一部分的示意性横截面图。图8示出了对应于图7中的显示面板dp的一部分的另一实施方式的示意性横截面图。在实施方式的显示设
备dd-td中,有机电致发光装置ed-bt可包括发光结构ol-b1、ol-b2和ol-b3。有机电致发光装置ed-bt可包括面向彼此的第一电极el1和第二电极el2,以及通过在第一电极el1和第二电极el2之间在厚度方向上堆叠而提供的发光结构ol-b1、ol-b2和ol-b3。发光结构ol-b1、ol-b2和ol-b3可各自包括发射层eml(图7)以及其间设置有发射层eml(图7)的空穴传输区htr和电子传输区etr。发光结构ol-b1、ol-b2和ol-b3中的每一个的发射层中的至少一个可包括主体和由式1表示的稠合多环化合物作为发光掺杂剂。在发光结构ol-b1、ol-b2和ol-b3中的发射层中的每一个中,可存在多于一个的主体。
[0375]
包括在发光结构ol-b1、ol-b2和ol-b3中的任一个中的发射层(在下文中,称为第一子发射层)和包括在另一发光结构中的发射层(在下文中,称为第二子发射层)中的至少一个可包括主体和根据实施方式的稠合多环化合物。例如,第一子发射层和第二子发射层中的至少一个可包括主体和根据实施方式的稠合多环化合物。
[0376]
例如,根据实施方式的显示设备dd-td中包括的有机电致发光装置ed-bt可为具有包括多个发射层eml的串联结构的有机电致发光装置。
[0377]
在图8中阐释的实施方式中,从发光结构ol-b1、ol-b2和ol-b3中的每一个发射的光可均为蓝光。然而,实施方式不限于此,并且从发光结构ol-b1、ol-b2和ol-b3中的每一个发射的光的波长范围可彼此不同。例如,包括发射不同波长范围内的光的发光结构ol-b1、ol-b2和ol-b3的有机电致发光装置ed-bt可发射白光。
[0378]
电荷生成层cgl1和cgl2可设置在相邻发光结构ol-b1、ol-b2和ol-b3之间。电荷生成层cgl1和cgl2可各自独立地包括p-型电荷生成层和/或n-型电荷生成层。
[0379]
图9a和图9b各自示出根据实施方式的稠合多环化合物的分子轨道图。图9a示出化合物53的最高占据分子轨道(homo),并且图9b示出化合物53的最低占据分子轨道(lumo)。
[0380]
参考图9a和图9b,可以看出,分子轨道彼此不重叠并且独立存在,并且即使在具有三维结构的取代基(例如,邻三联苯基)的存在下,在五环稠环中仍保持多重共振。包括在由式1表示的稠合多环化合物中的五环稠环可包括两个氮原子和一个硼原子作为成环原子。
[0381]
可以看出,分子轨道(即轨道)未被邻三联苯基占据。邻三联苯基防止由式1表示的稠合多环化合物的分子间相互作用(例如,电子和/或空穴转移,德克斯特能量转移),并且不用于传递激子,并且因此,可以在五环稠环中维持多重共振。在其中邻三联苯基结合到五环稠环的两侧上的氮原子的由式1表示的稠合多环化合物中,可以防止劣化。邻三联苯基结合到两侧上的氮原子的事实可以防止激子在五环稠环中累积,或者可以防止由于极化子引起的劣化。因此,包括由式1表示的稠合多环化合物的有机电致发光装置可以具有增加的寿命期。
[0382]
图10a至图10c各自示出根据实施方式的稠合多环化合物的三维结构图。图10a至图10c中示出的三维结构为化合物1的结构。
[0383]
参考图10a,p1至p5示为包括在根据实施方式的稠合多环化合物中的五环稠环。在图10a中,cb1和cb2各自指示氮原子和结合到氮原子的取代基之间的结合位置。例如,cb1和cb2各自指示化合物1中的氮原子和邻三联苯基之间的结合位置。
[0384]
在图10b和图10c中,cp指示包括在化合物1中的五环稠环。在图10b和图10c中,tp1和tp2各自为结合到五环稠环的邻三联苯基。
[0385]
参考图10a至图10c,可以看出,包括在化合物1中的五环稠环具有被邻三联苯基包
围的结构。化合物1包括其中邻三联苯基垂直于包括五环稠环的平面的结构,并且因此当用作有机电致发光装置的掺杂剂时,可与主体间隔开最大距离。例如,当包括取代基(比如邻三联苯基)的实施方式的稠合多环化合物用作用于有机电致发光装置的掺杂剂时,可防止与主体的分子间相互作用。由于邻三联苯基结合到五环稠环的两侧上的氮原子,并且因此防止分子间相互作用的事实,包括实施方式的稠合多环化合物的有机电致发光装置可展示增加的寿命期。
[0386]
当五环稠环中不包括邻三联苯基时,由于分子间相互作用,可发生德克斯特能量转移。德克斯特能量转移是通过邻三苯基未结合到五环稠环的区引起的,导致稠环的劣化。
[0387]
根据实施方式的稠合多环化合物可具有这样的结构,其中与包括在五环稠环中的氮原子结合的取代基围绕五环稠环。因此,在实施方式的稠合多环化合物中,可防止分子间相互作用,并且因此可不发生德克斯特能量转移。
[0388]
在下文中,参考实施例和比较例,将描述根据实施方式的稠合多环化合物和根据实施方式的有机电致发光装置。以下示出的实施例仅作为用于理解本公开的阐释提供,并且其范围不限于此。
[0389]
[实施例]
[0390]
1、稠合多环化合物的合成
[0391]
将通过描述合成化合物1、4、26、37、53、62、64、69、79、84、95、103和114的工艺作为示例来详细地描述合成根据实施方式的稠合多环化合物的工艺。下文中将描述的合成稠合多环化合物的工艺作为示例提供,并且因此合成根据实施方式的稠合多环化合物的工艺不限于以下实施例。
[0392]
(1)化合物1的合成
[0393]
根据实施方式的化合物1可通过例如以下反应来合成。
[0394]
[反应式1]
[0395][0396]
1)中间体1-a的合成
[0397]
在氩气氛中,在2l烧瓶中,将1-溴-3,5-二氯苯(10g,44mmol)、苯基硼酸(6.5g,35mmol)、pd(pph3)4(1.5g,1.3mmol)、碳酸钾(18g,132mmol)溶解在300ml甲苯和60ml水中,并将混合物在110℃回流搅拌12小时。冷却后,通过用乙酸乙酯和水萃取来分离有机层,用mgso4干燥,并过滤。收集有机层,并在减压下除去溶剂,并且将ch2cl2和己烷用作展开剂以将所得产物通过使用硅胶的柱色谱法纯化并分离,从而得到中间体1-a(无色液体,7.8g,
75%)。通过esi-lcms和1h-nmr确认所得无色液体为中间体1-a。
[0398]
esi-lcms:[m+h]
+
:c
12
h8cl2,222.0012。
[0399]1h-nmr(400mhz,cdcl3):7.85(s,2h),7.72(d,2h),7.71(s,1h),7.45(m,3h)。
[0400]
2)中间体1-b的合成
[0401]
在氩气氛中,在2l烧瓶中,将中间体1-a(7.5g,33mmol)、[1,1':3',1
″‑
三联苯]-2'-胺(17g,69mmol)、pd2dba3(1.5g,1.6mmol)、三叔丁基膦(1.5ml,3.2mmol)和叔丁醇钠(stb)(9.5g,99mmol)溶解在300ml的邻二甲苯中,并将混合物在140℃搅拌6小时。冷却后,通过用乙酸乙酯和水萃取来分离有机层,用mgso4干燥,并过滤。收集有机层,并在减压下除去溶剂,并且将ch2cl2和己烷用作展开剂以将所得产物通过使用硅胶的柱色谱法纯化并分离,从而得到中间体1-b(无色液体,14g,68%)。通过esi-lcms确认所得无色液体为中间体1-b。
[0402]
esi-lcms:[m+h]
+
:c
48h36
n2,640.2821。
[0403]
(3)中间体1-c的合成
[0404]
在氩气氛中,在2l烧瓶中,将中间体1-b(14g,21mmol)、1-溴-3-碘苯(31g,109mmol)、pd2dba3(1.0g,1.1mmol)、三叔丁基膦(1.0ml,1.1mmol)和叔丁醇钠(6.0g,63mmol)溶解在200ml的邻二甲苯中,并将混合物在160℃搅拌26小时。冷却后,通过用乙酸乙酯和水萃取来分离有机层,用mgso4干燥,并过滤。收集有机层,并在减压下除去溶剂,并且将ch2cl2和己烷用作展开剂以将所得产物通过使用硅胶的柱色谱法纯化并分离,从而得到中间体1-c(白色固体,10g,51%)。通过esi-lcms确认所得白色固体为中间体1-c。
[0405]
esi-lcms:[m+h]
+
:c
60h42
n2br2,948.1417。
[0406]
4)中间体1-d的合成
[0407]
在氩气氛中,将中间体1-c(10g,10.5mmol)放置于2l烧瓶中,并溶解在500ml的邻二氯苯(odcb)中。使用冰水容器将bbr3(1.5当量)缓慢降至0℃,并在温度升至140℃时,将所得产物搅拌12小时。冷却后,通过用ch2cl2和水萃取来分离有机层,用mgso4干燥,并过滤。收集有机层,并在减压下除去溶剂,并且将ch2cl2和己烷用作展开剂以将所得产物通过使用硅胶的柱色谱法纯化并分离,从而得到中间体1-d(黄色固体,1g,10%)。通过esi-lcms确认所得黄色固体为中间体1-d。
[0408]
esi-lcms:[m+h]
+
:c
60h39
n2bbr2,956.1612。
[0409]
5)化合物1的合成
[0410]
在氩气氛中,在1l烧瓶中,将中间体1-d(1g,1mmol)、二苯胺(0.34g,2mmol)、pd2dba3(0.05g,0.05mmol)、三叔丁基膦(0.05ml,0.1mmol)和叔丁醇钠(0.3g,3mmol)溶解在20ml的邻二甲苯中,并将混合物在140℃搅拌12小时。冷却后,通过用乙酸乙酯和水萃取来分离有机层,用mgso4干燥,并过滤。收集有机层,并在减压下除去溶剂,并且将ch2cl2和己烷用作展开剂以将所得产物通过使用硅胶的柱色谱法纯化并分离,从而得到化合物1(黄色固体,0.7g,65%)。通过esi-lcms和1h-nmr确认所得黄色固体为化合物1。
[0411]
esi-lcms:[m+h]
+
:c
84h59
n4b,1134.4812。
[0412]1h-nmr(400mhz,cdcl3):8.84(d,2h),8.20(d,4h),7.41(m,17h),7.24(m,8h),7.12(m,20h),6.93(s,2h),6.84(d,2h),6.71(s,2h)。
[0413]
(2)化合物4的合成
[0414]
根据实施方式的化合物4可通过例如以下反应来合成。
[0415]
[反应式2]
[0416][0417]
在氩气氛中,在1l烧瓶中,将中间体1-d(1g,1mmol)、3,6-二叔丁基咔唑(0.56g,2mmol)、pd2dba3(0.05g,0.05mmol)、三叔丁基膦(0.05ml,0.1mmol)和叔丁醇钠(0.3g,3mmol)溶解在20ml的邻二甲苯中,并将混合物在140℃搅拌12小时。冷却后,通过用乙酸乙酯和水萃取来分离有机层,用mgso4干燥,并过滤。收集有机层,并在减压下除去溶剂,并且将ch2cl2和己烷用作展开剂以将所得产物通过使用硅胶的柱色谱法纯化并分离,从而得到化合物4(黄色固体,1g,68%)。通过esi-lcms和1h-nmr确认所得黄色固体为化合物4。
[0418]
esi-lcms:[m+h]
+
:c
100h87
n4b,1354.6971。
[0419]1h-nmr(400mhz,cdcl3):8.84(d,2h),8.75(s,4h),8.23(d,4h),7.86(d,4h),7.75(d,2h),7.39(m,19h),7.23(s,2h),7.11(d,4h),6.95(s,2h),1.43(s,36h)。
[0420]
(3)化合物26的合成
[0421]
根据实施方式的化合物26可通过例如以下反应来合成。
[0422]
[反应式3]
[0423][0424]
在氩气氛中,在1l烧瓶中,将中间体1-d(1g,1mmol)、3-氰基-6-叔丁基咔唑(0.5g,2mmol)、pd2dba3(0.05g,0.05mmol)、三叔丁基膦(0.05ml,0.1mmol)和叔丁醇钠(0.3g,3mmol)溶解在20ml的邻二甲苯中,并将混合物在140℃搅拌12小时。冷却后,通过用乙酸乙酯和水萃取来分离有机层,用mgso4干燥,并过滤。收集有机层,并在减压下除去溶剂,并且将ch2cl2和己烷用作展开剂以将所得产物通过使用硅胶的柱色谱法纯化并分离,从而得到化合物26(黄色固体,1g,68%)。通过esi-lcms和1h-nmr确认所得黄色固体为化合物26。
[0425]
esi-lcms:[m+h]
+
:c
94h69
n6b,1292.5715。
[0426]1h-nmr(400mhz,cdcl3):8.95(d,2h),8.88(s,2h),8.21(d,4h),8.12(d,2h),7.81(s,2h),7.75(d,2h),7.62(d,2h),7.50(m,17h),7.43(s,2h),7.35(m,8h),6.93(m,2h),1.45(s,18h)。
[0427]
(4)化合物37的合成
[0428]
根据实施方式的化合物37可通过例如以下反应来合成。
[0429]
[反应式4]
[0430][0431]
在氩气氛中,在1l烧瓶中,将中间体1-d(1g,1mmol)、3,6-二三甲基甲硅烷基咔唑(0.6g,2mmol)、pd2dba3(0.05g,0.05mmol)、三叔丁基膦(0.05ml,0.1mmol)和叔丁醇钠(0.3g,3mmol)溶解在20ml的邻二甲苯中,并将混合物在140℃搅拌12小时。冷却后,通过用乙酸乙酯和水萃取来分离有机层,用mgso4干燥,并过滤。收集有机层,并在减压下除去溶剂,并且将ch2cl2和己烷用作展开剂以将所得产物通过使用硅胶的柱色谱法纯化并分离,从而得到化合物37(黄色固体,1.1g,76%)。通过esi-lcms和1h-nmr确认所得黄色固体为化合物37。
[0432]
esi-lcms:[m+h]
+
:c
96h87
n4bsi4,1419.6112。
[0433]1h-nmr(400mhz,cdcl3):8.68(d,2h),8.20(d,4h),7.92(d,4h),7.77(s,4h),7.56(d,4h),7.44(m,19h),7.30(d,4h),7.23(s,2h),7.43(s,2h),7.08(m,8h),6.95(d,2h),0.45(s,36h)。
[0434]
(5)化合物53的合成
[0435]
根据实施方式的化合物53可通过例如以下反应来合成。
[0436]
[反应式5]
[0437]
[0438]
1)中间体53-a的合成
[0439]
在氩气氛中,在2l烧瓶中,1,3-二溴-5-甲氧基苯(50g,188mmol)、[1,1':3',1
″‑
三联苯]-2'-胺(97g,395mmol)、pd2dba3(8.6g,9.4mmol)、三叔丁基膦(8.6ml,19.2mmol)和叔丁醇钠(54g,564mmol)溶解在20ml的邻二甲苯中,并将混合物在140℃搅拌12小时。冷却后,通过用乙酸乙酯和水萃取来分离有机层,用mgso4干燥,并过滤。收集有机层,并在减压下除去溶剂,并且将ch2cl2和己烷用作展开剂以将所得产物通过使用硅胶的柱色谱法纯化并分离,从而得到中间体53-a(白色固体,85g,76%)。通过esi-lcms确认所得白色固体为中间体53-a。
[0440]
esi-lcms:[m+h]
+
:c
43h34
n2o,594.2787。
[0441]
2)中间体53-b的合成
[0442]
在氩气氛中,在2l烧瓶中,将中间体53-a(85g,142mmol)、1-溴-3-碘苯(200g,710mmol)、pd2dba3(13g,14.2mmol)、三叔丁基膦(13ml,28.4mmol)和叔丁醇钠(41g,426mmol)溶解在1l的邻二甲苯中,并将混合物在160℃回流搅拌12小时。冷却后,通过用乙酸乙酯和水萃取来分离有机层,用mgso4干燥,并过滤。收集有机层,并在减压下除去溶剂,并且将ch2cl2和己烷用作展开剂以将所得产物通过使用硅胶的柱色谱法纯化并分离,从而得到中间体53-b(白色固体,68g,53%)。通过esi-lcms确认所得白色固体为中间体53-b。
[0443]
esi-lcms:[m+h]
+
:c
55h40
n2obr2,904.1512。
[0444]
3)中间体53-c的合成
[0445]
在氩气氛中,在2l烧瓶中,将中间体53-b(85g,142mmol)溶解在1l的邻二氯苯中,并使用冰水容器冷却至0℃。缓慢逐滴添加bbr3(5当量),并在温度升至室温时,将所得产物搅拌3小时。在使用薄层色谱法(tlc)确认中间体53-b被完全消耗之后,将温度升至140℃并将所得产物搅拌12小时。冷却后,通过用乙酸乙酯和水萃取来分离有机层,用mgso4干燥,并过滤。收集有机层,并在减压下除去溶剂,并且将ch2cl2和己烷用作展开剂以将所得产物通过使用硅胶的柱色谱法纯化并分离,从而得到中间体53-c(黄色固体,16g,12%)。通过esi-lcms确认所得黄色固体为中间体53-c。
[0446]
esi-lcms:[m+h]
+
:c
54h35
n2obbr2,896.1107。
[0447]
4)中间体53-d的合成
[0448]
在氩气氛中,在2l烧瓶中,将中间体53-c(16g,18mmol)溶解在200ml的ch2cl2中,并且向其逐滴添加吡啶(1.2当量),并使用冰水容器将混合物冷却至0℃。缓慢逐滴添加三氟甲磺酸酐(1.5当量),并在温度升至室温时,将所得产物搅拌3小时。通过用乙酸乙酯和水萃取来分离有机层,用mgso4干燥,并过滤。收集有机层,并在减压下除去溶剂,并且将ch2cl2和己烷用作展开剂以将所得产物通过使用硅胶的柱色谱法纯化并分离,从而得到中间体53-d(黄色固体,15g,81%)。通过esi-lcms确认所得黄色固体为中间体53-d。
[0449]
esi-lcms:[m+h]
+
:c
55h34
n2o3bsf3br2,1028.0711。
[0450]
5)中间体53-e的合成
[0451]
在氩气氛中,在2l烧瓶中,将中间体53-d(15g,15mmol)、二苯并[b,d]呋喃-2-基硼酸(5g,23mmol)、碳酸钾(6.2g,45mmol)、pd(pph3)4(0.52g,0.45mmol)溶解在200ml的甲苯和50ml的水中,并将混合物在110℃回流搅拌12小时。通过用乙酸乙酯和水萃取来分离有机层,用mgso4干燥,并过滤。收集有机层,并在减压下除去溶剂,并且将ch2cl2和己烷用作展开
剂以将所得产物通过使用硅胶的柱色谱法纯化并分离,从而得到中间体53-e(黄色固体,11g,76%)。通过esi-lcms确认所得黄色固体为中间体53-e。
[0452]
esi-lcms:[m+h]
+
:c
66h41
n2obbr2,1046.1727。
[0453]
6)化合物53的合成
[0454]
在氩气氛中,在1l烧瓶中,将中间体53-e(1g,1mmol)、咔唑(0.33g,2mmol)、pd2dba3(0.05g,0.05mmol)、三叔丁基膦(0.05ml,0.1mmol)和叔丁醇钠(0.3g,3mmol)溶解在20ml的邻二甲苯中,并将混合物在140℃搅拌12小时。冷却后,通过用乙酸乙酯和水萃取来分离有机层,用mgso4干燥,并过滤。收集有机层,并在减压下除去溶剂,并且将ch2cl2和己烷用作展开剂以将所得产物通过使用硅胶的柱色谱法纯化并分离,从而得到化合物53(黄色固体,0.75g,62%)。通过esi-lcms和1h-nmr确认所得黄色固体为化合物53。
[0455]
esi-lcms:[m+h]
+
:c
90h57
n4bo,1220.4612。
[0456]1h-nmr(400mhz,cdcl3):8.92(d,2h),8.55(d,4h),7.94(d,4h),7.81(m,4h),7.56(t,4h),7.43(m,14h),7.32(m,8h),7.20(s,2h),6.93(s,2h)。
[0457]
(6)化合物62的合成
[0458]
根据实施方式的化合物62可通过例如以下反应来合成。
[0459]
[反应式6]
[0460]
[0461]
1)中间体62-a的合成
[0462]
在氩气氛中,在2l烧瓶中,将1,3-二氯-5-溴苯(20g,88mmol)、d-5-苯基-硼酸(17g,132mmol)、pd(pph3)4(3.1g,2.6mmol)、碳酸钾(36g,264mmol)溶解在600ml的甲苯和150ml的水中,并将混合物在110℃回流搅拌12小时。冷却后,通过用乙酸乙酯和水萃取来分离有机层,用mgso4干燥,并过滤。收集有机层,并在减压下除去溶剂,并且将ch2cl2和己烷用作展开剂以将所得产物通过使用硅胶的柱色谱法纯化并分离,从而得到中间体62-a(无色液体,13g,65%)。通过esi-lcms确认所得无色液体为中间体62-a。
[0463]
esi-lcms:[m+h]
+
:c
12
h3cl2d5,227.0312。
[0464]
2)中间体62-b的合成
[0465]
在氩气氛中,在2l烧瓶中,将中间体62-a(13g,57mmol)、[1,1':3',1
″‑
三联苯]-d13-2'-胺(31g,119mmol)、pd2dba3(2.6g,2.9mmol)、三叔丁基膦(2.6ml,5.8mmol)和叔丁醇钠(16g,171mmol)溶解在500ml的邻二甲苯中,并将混合物在140℃搅拌12小时。冷却后,通过用乙酸乙酯和水萃取来分离有机层,用mgso4干燥,并过滤。收集有机层,并在减压下除去溶剂,并且将ch2cl2和己烷用作展开剂以将所得产物通过使用硅胶的柱色谱法纯化并分离,从而得到中间体62-b(白色固体,30g,78%)。通过esi-lcms确认所得白色固体为中间体62-b。
[0466]
esi-lcms:[m+h]
+
:c
48
h5n2d
31
,671.4812。
[0467]
3)中间体62-c的合成
[0468]
在氩气氛中,在2l烧瓶中,将中间体62-b(30g,44mmol)、1-溴-3-碘苯(63g,223mmol)、pd2dba3(4.0g,4.4mmol)、三叔丁基膦(4.0ml,8.8mmol)和叔丁醇钠(13g,132mmol)溶解在500ml的邻二甲苯中,并将混合物在160℃回流搅拌24小时。冷却后,通过用乙酸乙酯和水萃取来分离有机层,用mgso4干燥,并过滤。收集有机层,并在减压下除去溶剂,并且将ch2cl2和己烷用作展开剂以将所得产物通过使用硅胶的柱色谱法纯化并分离,从而得到中间体62-c(白色固体,22g,51%)。通过esi-lcms确认所得白色固体为中间体62-c。
[0469]
esi-lcms:[m+h]
+
:c
60h11
n2d
31
br2,979.3701。
[0470]
4)中间体62-d的合成
[0471]
在氩气氛中,将中间体62-c(20g,20mmol)放置于2l烧瓶中,并溶解在500ml的邻二氯苯中。使用冰水容器将bbr3(1.5当量)缓慢降至0℃,并在温度升至140℃时,将所得产物搅拌12小时。冷却后,通过用ch2cl2和水萃取来分离有机层,用mgso4干燥,并过滤。收集有机层,并在减压下除去溶剂,并且将ch2cl2和己烷用作展开剂以将所得产物通过使用硅胶的柱色谱法纯化并分离,从而得到中间体62-d(黄色固体,1.5g,8%)。通过esi-lcms确认所得黄色固体为中间体62-d。
[0472]
esi-lcms:[m+h]
+
:c
60
h8n2bbr2d
31
,987.3517。
[0473]
5)化合物62的合成
[0474]
在氩气氛中,在1l烧瓶中,将中间体62-d(1g,1mmol)、9h-咔唑-1,2,3,4,5,6,7,8-d8(0.35g,2mmol)、pd2dba3(0.05g,0.05mmol)、三叔丁基膦(0.05ml,0.1mmol)和叔丁醇钠(0.3g,3mmol)溶解在20ml的邻二甲苯中,并将混合物在140℃搅拌12小时。冷却后,通过用乙酸乙酯和水萃取来分离有机层,用mgso4干燥,并过滤。收集有机层,并在减压下除去溶剂,并且将ch2cl2和己烷用作展开剂以将所得产物通过使用硅胶的柱色谱法纯化并分离,从
而得到化合物62(黄色固体,0.73g,62%)。通过esi-lcms和1h-nmr确认所得黄色固体为化合物62。
[0475]
esi-lcms:[m+h]
+
:c
84
h8n4bd
47
,1177.7575。
[0476]1h-nmr(400mhz,cdcl3):8.84(d,2h),8.20(d,4h),7.41(m,17h),7.24(m,8h),7.12(m,20h),6.93(s,2h),6.84(d,2h),6.71(s,2h)。
[0477]
(7)化合物64的合成
[0478]
根据实施方式的化合物64可通过例如以下反应来合成。
[0479]
[反应式7]
[0480][0481]
1)中间体64-a的合成
[0482]
在氩气氛中,在2l烧瓶中,将中间体62-a(10g,88mmol)、[1,1':3',1
″‑
三联苯]-2'-胺(45g,184mmol)、pd2dba3(4.0g,4.4mmol)、三叔丁基膦(4.0ml,8.8mmol)和叔丁醇钠(26g,264mmol)溶解在1l的邻二甲苯中,并将混合物在140℃搅拌6小时。冷却后,通过用乙酸乙酯和水萃取来分离有机层,用mgso4干燥,并过滤。收集有机层,并在减压下除去溶剂,并且将ch2cl2和己烷用作展开剂以将所得产物通过使用硅胶的柱色谱法纯化并分离,从而得到中间体64-a(白色固体,37.5g,66%)。通过esi-lcms确认所得白色固体为中间体64-a。
[0483]
esi-lcms:[m+h]
+
:c
48h31
n2d5,645.3212。
[0484]
2)中间体64-b的合成
[0485]
在氩气氛中,在2l烧瓶中,将中间体64-a(35g,54mmol)、1-溴-3-碘苯(77g,270mmol)、pd2dba3(5.0g,5.4mmol)、三叔丁基膦(5.0ml,10.8mmol)和叔丁醇钠(16g,162mmol)溶解在500ml的邻二甲苯中,并将混合物在160℃回流搅拌24小时。冷却后,通过用乙酸乙酯和水萃取来分离有机层,用mgso4干燥,并过滤。收集有机层,并在减压下除去溶剂,并且将ch2cl2和己烷用作展开剂以将所得产物通过使用硅胶的柱色谱法纯化并分离,从而得到中间体64-b(白色固体,24.7g,48%)。通过esi-lcms确认所得白色固体为中间体64-b。
[0486]
esi-lcms:[m+h]
+
:c
60h37
n2d5br2,953.1991。
[0487]
3)中间体64-c的合成
[0488]
在氩气氛中,将中间体64-b(24g,25mmol)放置于2l烧瓶中,并溶解在500ml的邻二氯苯中。使用冰水容器将bbr3(1.5当量)缓慢降至0℃,并在温度升至140℃时,将所得产物
搅拌12小时。冷却后,通过用ch2cl2和水萃取来分离有机层,用mgso4干燥,并过滤。收集有机层,并在减压下除去溶剂,并且将ch2cl2和己烷用作展开剂以将所得产物通过使用硅胶的柱色谱法纯化并分离,从而得到中间体64-c(黄色固体,1.6g,7%)。通过esi-lcms确认所得黄色固体为中间体64-c。
[0489]
esi-lcms:[m+h]
+
:c
60h34
n2bbr2d5,961.1887。
[0490]
4)化合物64的合成
[0491]
在氩气氛中,在1l烧瓶中,将中间体64-c(1g,1mmol)、n-苯基芘-1-胺(0.59g,2mmol)、pd2dba3(0.05g,0.05mmol)、三叔丁基膦(0.05ml,0.1mmol)和叔丁醇钠(0.3g,3mmol)溶解在20ml的邻二甲苯中,并将混合物在140℃搅拌12小时。冷却后,通过用乙酸乙酯和水萃取来分离有机层,用mgso4干燥,并过滤。收集有机层,并在减压下除去溶剂,并且将ch2cl2和己烷用作展开剂以将所得产物通过使用硅胶的柱色谱法纯化并分离,从而得到化合物64(黄色固体,1.06g,77%)。通过esi-lcms和1h-nmr确认所得黄色固体为化合物64。
[0492]
esi-lcms:[m+h]
+
:c
104h62
n4bd5,1387.5858。
[0493]1h-nmr(400mhz,cdcl3):9.12(d,2h),8.31(d,2h),8.20(d,4h),8.10(m,10h),7.92(d,2h),7.60(d,4h),7.34(m,14h),7.24(t,4h),7.00(m,16h),6.83(d,2h),6.68(s,2h)。
[0494]
(8)化合物69的合成
[0495]
根据实施方式的化合物69可通过例如以下反应来合成。
[0496]
[反应式8]
[0497][0498]
在氩气氛中,在1l烧瓶中,将中间体64-c(1g,1mmol)、1-氯-9h-咔唑(0.4g,2mmol)、pd2dba3(0.05g,0.05mmol)、三叔丁基膦(0.05ml,0.1mmol)和叔丁醇钠(0.3g,3mmol)溶解在20ml的邻二甲苯中,并将混合物在140℃搅拌12小时。冷却后,通过用乙酸乙酯和水萃取来分离有机层,用mgso4干燥,并过滤。收集有机层,并在减压下除去溶剂,并且将ch2cl2和己烷用作展开剂以将所得产物通过使用硅胶的柱色谱法纯化并分离,从而得到化合物69(黄色固体,1.01g,79%)。通过esi-lcms和1h-nmr确认所得黄色固体为化合物69。
[0499]
esi-lcms:[m+h]
+
:c
84h46
n4bd5,1131.4517。
[0500]1h-nmr(400mhz,cdcl3):9.22(d,2h),8.29(d,2h),8.19(d,4h),7.95(d,4h),7.58(d,2h),7.43(m,16h),7.20(m,4h),7.05(m,8h),6.93(s,2h)。
[0501]
(9)化合物79的合成
[0502]
根据实施方式的化合物79可通过例如以下反应来合成。
[0503]
[反应式9]
[0504][0505]
1)中间体79-a的合成
[0506]
在氩气氛中,在2l烧瓶中,将中间体53-d(10g,9.7mmol)、(4-(蒽-9-基)苯基)硼酸(4.3g,14.5mmol)、pd(pph3)4(0.3g,0.3mmol)、碳酸钾(40g,291mmol)溶解在800ml的甲苯和200ml的水中,并将混合物在110℃回流搅拌12小时。冷却后,通过用乙酸乙酯和水萃取来分离有机层,用mgso4干燥,并过滤。收集有机层,并在减压下除去溶剂,并且将ch2cl2和己烷用作展开剂以将所得产物通过使用硅胶的柱色谱法纯化并分离,从而得到中间体79-a(白色固体,8g,73%)。通过esi-lcms确认所得白色固体为中间体79-a。
[0507]
esi-lcms:[m+h]
+
:c
74h47
br2n2b,1132.1722。
[0508]
2)化合物79的合成
[0509]
在氩气氛中,在1l烧瓶中,将中间体79-a(1.14g,1mmol)、咔唑(0.34g,2mmol),pd2dba3(0.05g,0.05mmol)、三叔丁基膦(0.05ml,0.1mmol)和叔丁醇钠(0.3g,3mmol)溶解在20ml的邻二甲苯中,并将混合物在140℃搅拌12小时。冷却后,通过用乙酸乙酯和水萃取来分离有机层,用mgso4干燥,并过滤。收集有机层,并在减压下除去溶剂,并且将ch2cl2和己烷用作展开剂以将所得产物通过使用硅胶的柱色谱法纯化并分离,从而得到化合物79(黄色固体,0.86g,83%)。通过esi-lcms和1h-nmr确认所得黄色固体为化合物79。
[0510]
esi-lcms:[m+h]
+
:c
98h63
n4b,1306.5007。
[0511]1h-nmr(400mhz,cdcl3):8.87(d,2h),8.55(d,2h),8.39(s,1h),8.21(d,6h),8.03(d,2h),7.94(d,4h),7.53(t,4h),7.42(d,2h),7.35(m,18h),7.24(m,4h),7.09(m,12h),7.01(s,2h)。
[0512]
(10)化合物84的合成
[0513]
根据实施方式的化合物84可通过例如以下反应来合成。
[0514]
[反应式10]
[0515][0516]
1)中间体84-a的合成
[0517]
在氩气氛中,在1l烧瓶中,将1,3-二溴-5-(叔丁基)苯(10g,34mmol)、[1,1':3',1″‑
三联苯]-2'-胺(17g,68mmol)、pd2dba3(1.55g,1.7mmol)、三叔丁基膦(1.6ml,3.4mmol)和叔丁醇钠(9.5g,102mmol)溶解在400ml的邻二甲苯中,并将混合物在140℃搅拌12小时。冷却后,通过用乙酸乙酯和水萃取来分离有机层,用mgso4干燥,并过滤。收集有机层,并在减压下除去溶剂,并且将ch2cl2和己烷用作展开剂以将所得产物通过使用硅胶的柱色谱法纯化并分离,从而得到中间体84-a(白色固体,16g,77%)。通过esi-lcms确认所得白色固体为中间体84-a。
[0518]
esi-lcms:[m+h]
+
:c
46h40
n2,620.3232。
[0519]
2)中间体84-b的合成
[0520]
在氩气氛中,在1l烧瓶中,将中间体84-a(16g,25mmol)、1-碘-3-溴苯(35g,125mmol)、pd2dba3(2.2g,2.5mmol)、三叔丁基膦(2.3ml,5.0mmol)和叔丁醇钠(9.5g,102mmol)溶解在250ml的邻二甲苯中,并将混合物在160℃搅拌24小时。冷却后,通过用乙酸乙酯和水萃取来分离有机层,用mgso4干燥,并过滤。收集有机层,并在减压下除去溶剂,并且将ch2cl2和己烷用作展开剂以将所得产物通过使用硅胶的柱色谱法纯化并分离,从而得到中间体84-b(白色固体,10g,46%)。通过esi-lcms确认所得白色固体为中间体84-b。
[0521]
esi-lcms:[m+h]
+
:c
58h46
n2br2,928.1997。
[0522]
3)中间体84-c的合成
[0523]
在氩气氛中,将中间体84-b(10g,10.7mmol)放置于1l烧瓶中,并溶解在200ml的邻二氯苯中。将混合溶液冷却至0℃,并且向其缓慢逐滴添加bbr3(5当量),并在温度升至180℃时,将所得产物搅拌24小时。冷却后,添加三乙胺至完全反应,并在减压下除去溶剂。将ch2cl2和己烷用作展开剂以将所得产物通过使用硅胶的柱色谱法纯化并分离,从而得到中间体84-c(黄色固体,1.1g,11%)。通过esi-lcms确认所得黄色固体为中间体84-c。
[0524]
esi-lcms:[m+h]
+
:c
58h43
n2bbr2,936.1889。
[0525]
4)化合物84的合成
[0526]
在氩气氛中,在1l烧瓶中,将中间体84-c(1g,1mmol)、3,6-二叔丁基咔唑(0.66g,2mmol)、pd2dba3(0.05g,0.05mmol)、三叔丁基膦(0.05ml,0.1mmol)和叔丁醇钠(0.3g,3mmol)溶解在20ml的邻二甲苯中,并将混合物在140℃搅拌12小时。冷却后,通过用乙酸乙酯和水萃取来分离有机层,用mgso4干燥,并过滤。收集有机层,并在减压下除去溶剂,并且将ch2cl2和己烷用作展开剂以将所得产物通过使用硅胶的柱色谱法纯化并分离,从而得到化合物84(黄色固体,1.1g,78%)。通过esi-lcms和1h-nmr确认所得黄色固体为化合物84。
[0527]
esi-lcms:[m+h]
+
:c
98h91
n4b,1334.7473。
[0528]1h-nmr(400mhz,cdcl3):8.92(d,2h),8.36(s,4h),8.20(d,4h),7.69(d,8h),7.43(m,12h),7.12(m,10h),1.43(s,36h),1.32(s,9h)。
[0529]
(11)化合物95的合成
[0530]
根据实施方式的化合物95可通过例如以下反应来合成。
[0531]
[反应式11]
[0532][0533]
1)中间体95-a的合成
[0534]
在氩气氛中,在1l烧瓶中,将1,2,3-三溴苯(10g,32mmol)、[1,1':3',1
″‑
三联苯]-2'-胺(17g,68mmol)、pd2dba3(1.55g,1.7mmol)、三叔丁基膦(1.6ml,3.4mmol)和叔丁醇钠(9.5g,102mmol)溶解在400ml的邻二甲苯中,并将混合物在140℃搅拌12小时。冷却后,通过用乙酸乙酯和水萃取来分离有机层,用mgso4干燥,并过滤。收集有机层,并在减压下除去溶剂,并且将ch2cl2和己烷用作展开剂以将所得产物通过使用硅胶的柱色谱法纯化并分离,从而得到中间体95-a(白色固体,16.3g,82%)。通过esi-lcms确认所得白色固体为中间体95-a。
[0535]
esi-lcms:[m+h]
+
:c
42h31
n2br,642.1721。
[0536]
2)中间体95-b的合成
[0537]
在氩气氛中,在1l烧瓶中,将中间体95-a(16g,25mmol)、1-碘-3-氯苯(35g,125mmol)、pd2dba3(2.2g,2.5mmol)、三叔丁基膦(2.3ml,5.0mmol)和叔丁醇钠(9.5g,102mmol)溶解在250ml的邻二甲苯中,并将混合物在160℃搅拌24小时。冷却后,通过用乙酸乙酯和水萃取来分离有机层,用mgso4干燥,并过滤。收集有机层,并在减压下除去溶剂,并且将ch2cl2和己烷用作展开剂以将所得产物通过使用硅胶的柱色谱法纯化并分离,从而得到中间体95-b(白色固体,12g,51%)。通过esi-lcms确认所得白色固体为中间体95-b。
[0538]
esi-lcms:[m+h]
+
:c
54h37
n2br3,951.0991。
[0539]
3)中间体95-c的合成
[0540]
在氩气氛中,将中间体95-b(12g,12.5mmol)放置于1l烧瓶中,并溶解在250ml的thf中。将混合溶液冷却至-78℃并且缓慢逐滴添加n-buli(1.2当量)。在温度升至室温时,将所得产物搅拌3小时,并再冷却至-40℃,并且缓慢逐滴添加bbr3(5当量)。在将温度缓慢升至室温后将所得产物搅拌30分钟之后,向其添加二异丙基乙胺,将温度升至80c,并且将混合物搅拌24小时。冷却后,在减压下除去溶剂,并且将ch2cl2和己烷用作展开剂以将所得产物通过使用硅胶的柱色谱法纯化并分离,从而得到中间体95-c(黄色固体,0.99g,10%)。通过esi-lcms确认所得黄色固体为中间体95-c。
[0541]
esi-lcms:[m+h]
+
:c
54h35
n2bbr2,881.1239。
[0542]
4)化合物95的合成
[0543]
在氩气氛中,在1l烧瓶中,将中间体95-c(0.9g,1mmol)、6-(叔丁基)-9h-咔唑-3-腈(0.5g,2mmol)、pd2dba3(0.05g,0.05mmol)、三叔丁基膦(0.05ml,0.1mmol)和叔丁醇钠(0.3g,3mmol)溶解在20ml的邻二甲苯中,并将混合物在140℃搅拌12小时。冷却后,通过用乙酸乙酯和水萃取来分离有机层,用mgso4干燥,并过滤。收集有机层,并在减压下除去溶
剂,并且将ch2cl2和己烷用作展开剂以将所得产物通过使用硅胶的柱色谱法纯化并分离,从而得到化合物95(黄色固体,0.79g,65%)。通过esi-lcms和1h-nmr确认所得黄色固体为化合物95。
[0544]
esi-lcms:[m+h]
+
:c
98h91
n6b,1217.5434。
[0545]1h-nmr(400mhz,cdcl3):9.43(d,2h),8.95(s,2h),8.31(d,4h),7.86(d,8h),7.43(m,19h),7.11(m,10h),6.83(d,2h),1.43(s,18h)。
[0546]
(12)化合物103的合成
[0547]
根据实施方式的化合物103可通过例如以下反应来合成。
[0548]
[反应式12]
[0549][0550]
1)中间体103-a的合成
[0551]
在氩气氛中,在1l烧瓶中,将3,5-二叔丁基-1-溴苯(10g,37mmol)、3,5-二氯-1-硼酸(14g,74mmol)、pd(pph3)4(1.3g,1.1mmol)、碳酸钾(15g,111mmol)溶解在400ml的甲苯和150ml的水中,并将混合物在110℃回流搅拌12小时。冷却后,通过用乙酸乙酯和水萃取来分离有机层,用mgso4干燥,并过滤。收集有机层,并在减压下除去溶剂,并且将ch2cl2和己烷用作展开剂以将所得产物通过使用硅胶的柱色谱法纯化并分离,从而得到中间体103-a(白色固体,7.8g,63%)。通过esi-lcms确认所得白色固体为中间体103-a。
[0552]
esi-lcms:[m+h]
+
:c
20h24
cl2,334.1231。
[0553]
2)中间体103-b的合成
[0554]
在氩气氛中,在1l烧瓶中,将中间体103-a(7.5g,22mmol)、[1,1':3',1
″‑
三联苯]-2'-胺(12g,44mmol)、pd2dba3(1.55g,1.7mmol)、三叔丁基膦(1.6ml,3.4mmol)和叔丁醇钠(9.5g,102mmol)溶解在400ml的邻二甲苯中,并将混合物在140℃搅拌12小时。冷却后,通过用乙酸乙酯和水萃取来分离有机层,用mgso4干燥,并过滤。收集有机层,并在减压下除去溶剂,并且将ch2cl2和己烷用作展开剂以将所得产物通过使用硅胶的柱色谱法纯化并分离,从
而得到中间体103-b(白色固体,13.5g,83%)。通过esi-lcms确认所得白色固体为中间体103-b。
[0555]
esi-lcms:[m+h]
+
:c
56h52
n2,752.4119。
[0556]
3)中间体103-c的合成
[0557]
在氩气氛中,在1l烧瓶中,将中间体103-b(13g,17mmol)、1-碘-3-氯苯(5g,17mmol)、pd2dba3(0.77g,0.9mmol)、三叔丁基膦(0.8ml,1.8mmol)和叔丁醇钠(5g,51mmol)溶解在200ml的邻二甲苯中,并将混合物在160℃搅拌24小时。冷却后,通过用乙酸乙酯和水萃取来分离有机层,用mgso4干燥,并过滤。收集有机层,并在减压下除去溶剂,并且将ch2cl2和己烷用作展开剂以将所得产物通过使用硅胶的柱色谱法纯化并分离,从而得到中间体103-c(白色固体,8.6g,56%)。通过esi-lcms确认所得白色固体为中间体103-c。
[0558]
esi-lcms:[m+h]
+
:c
62h55
n2br,906.3535。
[0559]
4)中间体103-d的合成
[0560]
在氩气氛中,在1l烧瓶中,将化合物103-c(8g,8.8mmol)、3,5-二叔丁基-4'-碘-1,1'-联苯(4g,10mmol)、pd2dba3(0.45g,0.5mmol)、三叔丁基膦(0.5ml,1mmol)和叔丁醇钠(2.9g,30mmol)溶解在200ml的邻二甲苯中,并将混合物在160℃搅拌24小时。冷却后,通过用乙酸乙酯和水萃取来分离有机层,用mgso4干燥,并过滤。收集有机层,并在减压下除去溶剂,并且将ch2cl2和己烷用作展开剂以将所得产物通过使用硅胶的柱色谱法纯化并分离,从而得到中间体103-d(白色固体,8.6g,56%)。通过esi-lcms确认所得白色固体为中间体103-d。
[0561]
esi-lcms:[m+h]
+
:c
82h79
n2br,1170.5434。
[0562]
5)中间体103-e的合成
[0563]
在氩气氛中,将化合物103-d(8g,7mmol)放置于1l烧瓶中,并溶解在160ml的邻二氯苯中。将混合溶液冷却至0℃,并且向其缓慢逐滴添加bbr3(5当量),并在温度升至180℃时,将所得产物搅拌24小时。冷却后,添加三乙胺至完全反应,并在减压下除去溶剂。将ch2cl2和己烷用作展开剂以将所得产物通过使用硅胶的柱色谱法纯化并分离,从而得到中间体103-e(黄色固体,0.96g,12%)。通过esi-lcms确认所得黄色固体为中间体103-e。
[0564]
esi-lcms:[m+h]
+
:c
82h76
n2bbr,1178.5331。
[0565]
6)化合物103的合成
[0566]
在氩气氛中,在1l烧瓶中,将中间体103-e(1.2g,1mmol)、3,6-二叔丁基咔唑(0.66g,2mmol)、pd2dba3(0.05g,0.05mmol)、三叔丁基膦(0.05ml,0.1mmol)和叔丁醇钠(0.3g,3mmol)溶解在20ml的邻二甲苯中,并将混合物在140℃搅拌12小时。冷却后,通过用乙酸乙酯和水萃取来分离有机层,用mgso4干燥,并过滤。收集有机层,并在减压下除去溶剂,并且将ch2cl2和己烷用作展开剂以将所得产物通过使用硅胶的柱色谱法纯化并分离,从而得到化合物103(黄色固体,1g,74%)。通过esi-lcms和1h-nmr确认所得黄色固体为化合物103。
[0567]
esi-lcms:[m+h]
+
:c
102h100
n3b,1377.7991。
[0568]1h-nmr(400mhz,cdcl3):9.12(d,2h),8.92(s,2h),8.36(s,2h),8.20(d,4h),7.86(d,1h),7.73(s,4h),7.55(s,3h),7.43(m,17h),7.23(m,2h),7.08(m,9h),6.89(s,2h),1.43(s,18h),1.32(s,18h),1.22(s,18h)。
[0569]
(13)化合物114的合成
[0570]
根据实施方式的化合物114可通过例如以下反应来合成。
[0571]
[反应式13]
[0572][0573]
1)中间体114-a的合成
[0574]
在氩气氛中,在1l烧瓶中,将中间体53-e(1g,1mmol)、咔唑(0.14g,1mmol)、pd2dba3(0.05g,0.05mmol)、三叔丁基膦(0.05ml,0.1mmol)和叔丁醇钠(0.3g,3mmol)溶解在20ml的邻二甲苯中,并将混合物在140℃搅拌12小时。冷却后,通过用乙酸乙酯和水萃取来分离有机层,用mgso4干燥,并过滤。收集有机层,并在减压下除去溶剂,并且将ch2cl2和己烷用作展开剂以将所得产物通过使用硅胶的柱色谱法纯化并分离,从而得到中间体114-a(黄色固体,0.6g,62%)。通过esi-lcms确认所得黄色固体为中间体114-a。
[0575]
esi-lcms:[m+h]
+
:c
78h49
n3bobr,1133.3221。
[0576]
2)化合物114的合成
[0577]
在氩气氛中,在1l烧瓶中,将中间体114-a(0.6g,0.5mmol)、二苯并呋喃-2-基硼酸(0.22g,1mmol)、pd(pph3)4(0.02g,0.02mmol)和碳酸钾(0.2g,1.5mmol)溶解在10ml的甲苯和3ml的水中,并将混合物在110℃回流搅拌12小时。冷却后,通过用乙酸乙酯和水萃取来分离有机层,用mgso4干燥,并过滤。收集有机层,并在减压下除去溶剂,并且将ch2cl2和己烷用作展开剂以将所得产物通过使用硅胶的柱色谱法纯化并分离,从而得到化合物114(黄色固体,0.5g,81%)。通过esi-lcms和1h-nmr确认所得黄色固体为化合物114。
[0578]
esi-lcms:[m+h]
+
:c
90h56
n3bo2,1221.4537。
[0579]1h-nmr(400mhz,cdcl3):8.84(d,2h),8.55(d,4h),8.21(m,4h),7.88(m,8h),7.53(m,14h),7.42(m,22h),6.81(s,2h)。
[0580]
2、稠合多环化合物的物理性质的评估
[0581]
测量了表1中的实施例化合物和比较例化合物的各种物理性质。在室温下测量了通过将每一种化合物沉积在基板上形成的膜的发光光谱。结果在表1中示出。
[0582]
在表1中,使用来自zive lab的sp2电化学工作站设备的smart manager软件测量homo能级和lumo能级。λ
吸收
使用labsolution uv-vis软件来测量,该labsolution uv-vis软件带有安装在shimadzu的uv-1800紫外/可见扫描分光光度计设备上的氘/钨-卤素光源和硅光电二极管。λ
发射
、λ
膜
和四分之一最大值全宽度(fwqm)使用fluoressence软件来测量,该fluoressence软件带有安装在horiba的fluoromax+光谱仪上的氙光源和单色仪。通过提供甲苯作为溶剂在溶液状态下测量fwqm。光致发光量子产率(plqy)使用plqy测量软件来测量,该plqy测量软件带有氙光源、单色仪、光子多通道分析仪和安装在hamamatsu的quantaurus qy绝对pl量子产率光谱仪上的积分球。使用hamamatsu的瞬态荧光寿命光谱仪(其上安装有条纹相机)、plp-10激光二极管(m10306,激发源)和激光控制面板程序来测量化合物的寿命期(τ,寿命),并使用拟合:u8167程序在分析模式下进行分析。斯托克斯位移
指示吸收能量时的最大波长与发射能量时的最大波长之间的差。
[0583]
(实施例化合物)
[0584][0585][0586]
(比较例化合物)
[0587][0588]
[表1]
[0589]
[0590][0591]
参考表1,可以看出,与比较例化合物c-1至比较例化合物c-4相比,化合物1、4、26、37、53、62、64、69、79、84、95、103和114具有令人满意的光致发光量子产率(plqy)。可以看出,化合物1、4、26、37、53、62、64、69、79、84、95、103和114具有等于或大于80%的光致发光量子产率(plqy)。可以看出,化合物1、4、26、37、53、62、64、69、79、84、95、103和114具有在约10nm至约13nm的范围内的根据斯托克斯位移的波长差。化合物1、4、26、37、53、62、64、69、79、84、95、103和114是根据实施方式的稠合多环化合物。
[0592]
3、包括稠合多环化合物的有机电致发光装置的制造和评估
[0593]
使用以下方法制造根据实施方式的有机电致发光装置,该有机电致发光装置在发射层中包括实施例化合物和比较例化合物。
[0594]
(1)有机电致发光装置1的制造
[0595]
作为第一电极,将具有在其上形成的ito电极的玻璃基板(康宁公司,15ω/cm2,)切割成约50mm x 50mm x 0.7mm的尺寸,分别使用异丙醇和纯水进行5分钟的超声波清洗和30分钟的紫外线照射,并暴露于臭氧进行清洁,以安装在真空沉积设备上。
[0596]
在第一电极上,通过沉积npd来形成具有的厚度的空穴注入层,并且在空穴注入层上,通过沉积h-1-19来形成具有的厚度的空穴传输层,并在空穴传输层上,通过沉积czsi来形成具有的厚度的电子阻挡层。
[0597]
将其中第一主体ht和第二主体et以1:1的比例混合的主体化合物(如表2中所示)和实施例化合物或比较例化合物以97:3的重量比共沉积在电子阻挡层上,以形成具有的厚度的发射层。
[0598]
在发射层上,通过沉积tspo1来形成具有的厚度的空穴阻挡层。在空穴阻挡层上,通过沉积tpbi来形成具有的厚度的电子传输层。在电子传输层上,通过沉积lif来形成具有的厚度的电子注入层。在电子注入层上,通过沉积al来形成具有的厚度的第二电极。在第二电极上,通过沉积化合物p4来形成具有的厚度的封盖层,以制造有机电致发光装置。以下示出用于制造有机电致发光装置的化合物。
[0599]
表2示出对实施例1至实施例9以及比较例1至比较例4的有机电致发光装置的评估结果。在实施例和比较例的特性评估结果中,使用keithley mu 236和亮度计pr650测量在
1,000cd/m2的电流密度下的驱动电压(v)、发光效率(cd/a)和发光颜色,并且测量亮度相对于初始亮度达到95%所花费的时间作为寿命t
95
,并且相对于比较例1计算相对寿命,即寿命比(t
95
),并且示出每个的结果。
[0600]
(2)有机电致发光装置2的制造
[0601]
有机电致发光装置2以与有机电致发光装置1的制造中基本相同的方式制造,只是将其中第一主体ht和第二主体et以1:1的比例混合的主体化合物、敏化剂ps2和实施例化合物或比较例化合物以85∶14∶1的重量比共沉积,以在电子阻挡层上形成具有的厚度的发射层(如表3至表5和表7中所示)。
[0602]
表3至表5和表7示出实施例10至实施例21、实施例3-1、比较例5至比较例16、比较例3-1至比较例3-4的有机电致发光装置的评估结果,它们以与有机电致发光装置1的制造中基本相同的方式测量。然而,对于表3中的寿命t
95
,计算了相对于比较例5的相对寿命,并且示出每个的结果。对于表4中的寿命t
95
,计算了相对于比较例9的相对寿命,并示出每个的结果。对于表5中的寿命t
95
,计算了相对于比较例13的相对寿命,并示出每个的结果。对于表7中的寿命t
95
,计算了相对于比较例3-3的相对寿命,并示出每个的结果。
[0603]
(3)有机电致发光装置3的制造
[0604]
有机电致发光装置3以与有机电致发光装置1的制造中基本相同的方式制造,只是将其中混合ht-1和et-1的主体化合物、敏化剂ps1和实施例化合物或比较例化合物以85∶14∶1的重量比共沉积,以在电子阻挡层上形成具有的厚度的发射层(如表6中所示)。
[0605]
表6示出实施例2-1至实施例2-5和比较例2-1至比较例2-10的有机电致发光装置的评估结果,其以与有机电致发光装置1的制造中基本相同的方式测量。然而,对于表6中的寿命t
95
,计算了相对于比较例2-1的相对寿命,并示出每个的结果。
[0606]
(4)有机电致发光装置4的制造
[0607]
实施例4-1至实施例4-9和比较例4-1至比较例4-6的有机电致发光装置通过以下方法制造。作为第一电极,将具有的厚度的al安装在真空沉积设备中。在第一电极上,通过沉积npd来形成具有的厚度的空穴注入层,并且在空穴注入层上,通过沉积h-1-19来形成具有的厚度的空穴传输层,并且在空穴传输层上,通过沉积czsi来形成具有的厚度的电子阻挡层。
[0608]
将如表8中所示的主体化合物和掺杂剂化合物以97:3的重量比共沉积在电子阻挡层上,以形成具有的厚度的发射层。作为主体化合物,使用蒽类化合物e20,并且作为掺杂剂化合物,使用实施例化合物或比较例化合物。
[0609]
在发射层上,通过沉积tspo1来形成具有的厚度的空穴阻挡层。在空穴阻挡层上,通过沉积tpbi来形成具有的厚度的电子传输层。在电子传输层上,通过沉积lif来形成具有的厚度的电子注入层。将具有在其上形成的ito电极的玻璃基板(康宁,15ω/cm2,)切割成约50mm x 50mm x 0.7mm的尺寸,分别使用异丙醇和纯水进行5分钟的超声波清洗和30分钟的紫外线照射,并暴露于臭氧中进行清洁,并提供在电子注入层上。在ito电极上,通过沉积化合物p4来形成具有的厚度的封盖层,以制造有机电致发光装置。
[0610][0611]
[0612]
[表2]
[0613][0614]
[表3]
[0615][0616][0617]
[表4]
[0618][0619]
[表5]
[0620][0621][0622]
[表6]
[0623][0624]
[表7]
[0625]
[0626][0627]
表2至表7中的“前表面发光效率”意指当发光层中产生的大部分光朝向封装层时的光效率。表2至表7中的“q.e”意指外部量子效率。表2至表7中的“cie(x,y)”表示cie颜色坐标。参考表2至表7的结果,可以看出,与有机电致发光装置的比较例相比,使用根据实施方式的稠合多环化合物作为发射层材料的有机电致发光装置的实施例展示较低的驱动电压值,以及相对较高的发光效率和寿命。
[0628]
由于芳族环形成稠环,实施例化合物通过多重共振展示tadf特性。实施例化合物包括结合到两个氮原子的邻三联苯基,以具有等于或小于0.2ev的三重态-单重态能量值,并且能够通过risc(反向系间跨越)机制将三重态激子快速转换为单重态激子。在硼的对位引入芳胺基可导致多重共振,将实施例化合物的发射波长位移到更长的波长,并因此大大改善摩尔吸收系数,以利于敏化剂的福斯特共振能量转移(fret)。因此,实施例的有机电致发光装置可展示大于或等于比较例的有机电致发光装置的发光效率和寿命的发光效率和寿命。
[0629]
根据实施方式的稠合多环化合物也可用作荧光掺杂剂。例如,当多环取代基(比如萘基、蒽基或芘基)结合到包含在稠合多环化合物中的五环稠环时,三重态激子可具有减少的密度。因此,包括实施方式的稠合多环化合物的有机电致发光装置可展示长寿命。
[0630]
在根据实施方式的稠合多环化合物中,通过引入在两侧上、邻位处具有取代基的芳基,其分子形状被制成球形,并且因此分子-分子相互作用可以最小程度地发生,并且可以防止德克斯特能量转移。因此,可以实现有机电致发光装置的长寿命。另一方面,可以看出,在经常发生分子-分子相互作用的间位或对位处引入其中具有取代基的芳基的比较例化合物c-5和c-6可以具有趋向于天蓝色的较长发光波长,并且有机电致发光装置的寿命减少。
[0631]
参考表3的结果,可以看出,相对于表2中实施例的有机电致发光装置,在发射层中包括敏化剂导致相对高的发光效率。
[0632]
[表8]
[0633][0634]
表8中的“后表面发光效率”意指当发光层中产生的大部分光朝向电路层时的光效率。表8中的“q.e”意指外部量子效率。表8中的“cie(x,y)”表示cie颜色坐标。参考表8,可以看出,与比较例4-1至比较例4-6的有机电致发光装置相比,实施例4-1至实施例4-9的有机电致发光装置具有令人满意的寿命期。可以看出,与比较例4-1的有机电致发光装置相比,实施例4-1至实施例4-9的有机电致发光装置具有令人满意的发光效率。实施例4-1至实施例4-9的有机电致发光装置与比较例4-1的有机电致发光装置相比具有更窄的四分之一最大值全宽度,指示令人满意的颜色纯度。实施例4-1至实施例4-9的有机电致发光装置分别包括化合物1、4、26、37、53、62、64、69和79,并且化合物1、4、26、37、53、62、64、69和79是根据实施方式的稠合多环化合物,并且用作荧光掺杂剂。因此,包括实施方式的稠合多环化合物的有机电致发光装置可展示增加的寿命期。包括实施方式的稠合多环化合物的有机电致发光装置可展示令人满意的颜色纯度。实施方式的有机电致发光装置包括实施方式的稠合多环化合物,并且因此可以展示增加的发光效率。实施方式的有机电致发光装置包括实施方式的稠合多环化合物作为发射层材料,并且因此可在蓝光波长范围内实现高发光效率。
[0635]
实施方式的有机电致发光装置可展示低驱动电压和高发光效率的改善的装置特性。
[0636]
实施方式的稠合多环化合物包含在有机电致发光装置的发射层中,并且因此可有助于有机电致发光装置的高发光效率。
[0637]
本文已经公开了实施方式,并且尽管使用了术语,但是它们仅在一般性和描述性的意义上被使用和解释,而不是为了限制的目的。在一些情况下,如本领域普通技术人员将显而易见的,结合实施方式描述的特征、特性和/或元件可以单独使用或者与结合其他实施
方式描述的特征、特性和/或元件结合使用,除非另外具体指示。因此,本领域普通技术人员将会理解,在不脱离所附权利要求中陈述的本公开的精神和范围的情况下,可以进行形式和细节上的各种改变。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1