一种锂元素的萃取溶剂及其萃取方法与流程
本发明涉一种锂元素萃取分离方法。属于湿法金属冶金技术领域。
背景技术:
随着锂电池的高速发展和应用,锂及其化合物在化工,医药,电子等工业领域的应用日益广泛。锂元素的用量大幅增加。我国的锂资源主要存在于盐湖中,锂富集后具有镁锂比高、杂质多等特点。由于镁与锂的性质相似,不易分离。
公开日为1987年11月04日,公开号为cn87103431a的中国发明专利申请公开了“一种从含锂卤水中提取无水氯化锂的方法。用磷酸三丁酯作萃取剂,络合剂可在萃取液中循环使用。可从卤水中直接提取氯化锂”技术方案,取得了“本发明无三废污染,经济效益显著,每吨氯化锂可获利八千至一万元左右”技术效果。
公开日为2013年10月16日,公开号为cn102275956a的中国发明专利申请公开了“一种从高镁锂比盐湖卤水中提取碳酸锂的方法。该方法经过萃取、洗涤、反萃的步骤,得到组成为nacl和licl的反萃液或nh4cl和licl的反萃液,然后通入co2或加入na2co3,控制ph值和动力学条件,得到纳米级或微米级li2co3产品”技术方案,取得了“步骤简单,对设备要求低,原料来源广,适于工业化生产”技术效果。
公开日为2017年03月22日,公开号为cn106521159a的中国发明专利申请公开了“一种基于含fe(iii)的萃取体系萃取卤水中锂回收并循环利用fe(iii)的方法。针对传统的含fe(iii)萃取体系在萃锂过程中存在反萃酸度高、fe(iii)回收困难、多级连续萃取效果差等问题,本方法将fe(iii)负载于有机萃取体系,然后以该含fe(iii)的萃取体系对卤水中锂进行萃取,并采用naoh溶液对萃取后的富锂有机相进行反萃。针对fe(iii)的综合回收利用,先将fe(iii)全转化为fe(oh)3并分离后,再用酸转化为fe(iii)溶液,并用于萃锂有机相进行萃取后实现循环使用”技术方案,取得了“操作简单、有机相萃取性能稳定、能实现连续多级萃取等优点,成功解决了传统酸反萃过程中酸度高和fe(iii)的循环使用问题,具有广阔的应用前景”技术效果。
以上现有技术由于萃取及反萃过程获得的萃余液及反萃液中不同程度地含有+3价铁元素,都需要进一步分离回收+3价铁元素,存在必须不断向有机相添加协萃剂氯化铁及fe(oh)3分离回收不便等缺陷。
技术实现要素:
本发明的目的在于克服上述现有技术的缺陷,简单有效且环保地分离回收锂元素。
本发明一种锂元素的萃取溶剂,包括中性含磷萃取剂及协萃剂氯化铁、辅助萃取剂,所述辅助萃取剂在锂元素的萃取溶剂中具有保持和稳定氯化铁的作用。
本发明一种锂元素的萃取溶剂优选技术方案之一,所述中性含磷萃取剂为甲基膦酸二戊酯、甲基膦酸二甲庚酯、磷酸三丁酯、磷酸三辛酯等,以及它们的异构体中至少一种。
本发明一种锂元素的萃取溶剂再一优选技术方案,所述辅助萃取剂为酸性含磷萃取剂、胺类萃取剂、螯类萃取剂、中性含氧萃取剂、中性含氮萃取剂、取代酰胺类萃取剂中至少一种。
本发明一种锂元素的萃取溶剂再一优选技术方案,所述胺类萃取剂为三烷基胺和/或三辛胺及其异构体等;所述螯类萃取剂为8-羟基喹啉和/或2-羟基-5-辛基二苯甲酮肟(n510);所述中性含氧萃取剂为甲基异丁基酮;所述中性含氮萃取剂为n,n-二正烷基乙酰胺和/或n-苯基-n-辛基乙酰胺。
本发明一种锂元素的萃取溶剂再一优选技术方案,所述酸性萃取剂为膦酸单(2-乙基己基)酯、膦酸二(2-乙基己基)酯、2-乙基膦酸单(2-乙基己基)酯、苯基膦酸(2-乙基己基)酯、二(2-乙基己基)磷酸、二(2,4,4-三甲基戊基)次膦酸、环烷酸等中至少一种。
本发明一种锂元素的萃取溶剂再一优选技术方案,还包含稀释剂,所述稀释剂为煤油、正己烷、辛醇中至少一种。
本发明一种锂元素的萃取溶剂再一优选技术方案,按体积比,0<(辅助萃取剂/中性含磷萃取剂)<40%。
本发明一种锂元素的萃取溶剂再一优选技术方案,按摩尔比,协萃剂在萃取溶剂中的比例为0<(协萃剂/中性含磷萃取剂)≤0.5,优选0.1<(协萃剂/中性含磷萃取剂)<0.4。
本发明一种锂元素的萃取溶剂再一优选技术方案,所述协萃剂的浓度为10-25g/l。
本发明还提供一种锂元素的萃取方法,包括下述步骤,
步骤一,萃取:将含锂溶液与锂元素的萃取溶剂混合得到负载有机相;
步骤二,反萃:将负载有机相与反萃剂混合,得到锂元素的萃取溶剂及含锂元素的溶液;
所述锂元素的萃取溶剂包括萃取剂及协萃剂、辅助萃取剂,所述萃取剂为中性含磷萃取剂,所述协萃剂为氯化铁,所述辅助萃取剂为酸性含磷萃取剂、胺类萃取剂、螯类萃取剂、中性含氧萃取剂、中性含氮萃取剂中至少一种。
本发明一种锂元素的萃取方法优选技术方案之一,所述反萃剂为水、酸和/或可溶性盐溶液。
本发明一种锂元素的萃取方法再一优选技术方案,在步骤一之前还包括锂元素的萃取溶剂制备步骤:将萃取剂与辅助萃取剂、协萃剂混合,获得锂元素的萃取溶剂。
本发明一种锂元素的萃取方法再一优选技术方案,还包括在步骤二之前用酸和/或反萃液对负载有机相进行洗涤的步骤。
本发明一种锂元素的萃取方法再一优选技术方案,还包括将反萃液与沉淀剂混合的步骤,得到锂元素盐。
本发明一种锂元素的萃取方法再一优选技术方案,还包括将得到的锂元素盐制备成金属锂或其它锂元素制品。
本发明一种锂元素的萃取分离方法一优选技术方案,步骤二之前用酸和/或反萃液对负载有机相进行洗涤的步骤中所述酸为盐酸。依步骤二获得锂元素盐的不同,也可以选用硫酸、草酸等至少一种。
本发明一种锂元素的萃取分离方法一优选技术方案,含锂溶液中还包括助萃盐,所述助萃盐为钙、镁、亚铁、钴、镍、锰、稀土元素的盐中至少一种。
本发明还提供一种含锂元素的溶液的使用方法,将含锂元素的溶液制备成锂元素化合物或金属锂、锂合金等其它锂元素制品,所述含锂元素的溶液采用用于萃取分离锂元素的萃取溶剂或萃取分离锂元素的萃取方法制备锂元素产品的方法制备。
本发明一种含锂元素的溶液的使用方法优选技术方案之一,将含锂元素的溶液制备成锂电池。
本发明具有以下优点:
1加入辅助萃取剂后,锂元素的萃取溶剂中氯化铁的稳定性大大提高。反萃液中铁等氯化铁引入的杂质少,氯化铁在萃取体系中循环使用,节约资源。并且避免了因补充氯化铁向萃取体系带入新其它的杂质,有利于减少锂产品中的铁等杂质,提高锂产品品质。
2锂元素的萃取溶剂及其萃取分离方法适用性广,可以从碳酸锂等生产废水中回收锂元素,也可以用于从高镁锂比卤水等高杂质、复杂原料中提取锂元素。特别适用于从我国卤水中提取锂元素,有利于解决我国锂资源品位低、分离难度大、污染重、成本高的现状。萃取剂萃取锂元素的针对性强。
3可以在现有锂萃取生产线直接应用,投资少,成本低,分相快,使用方便、安全、可靠,便于工业化生产。
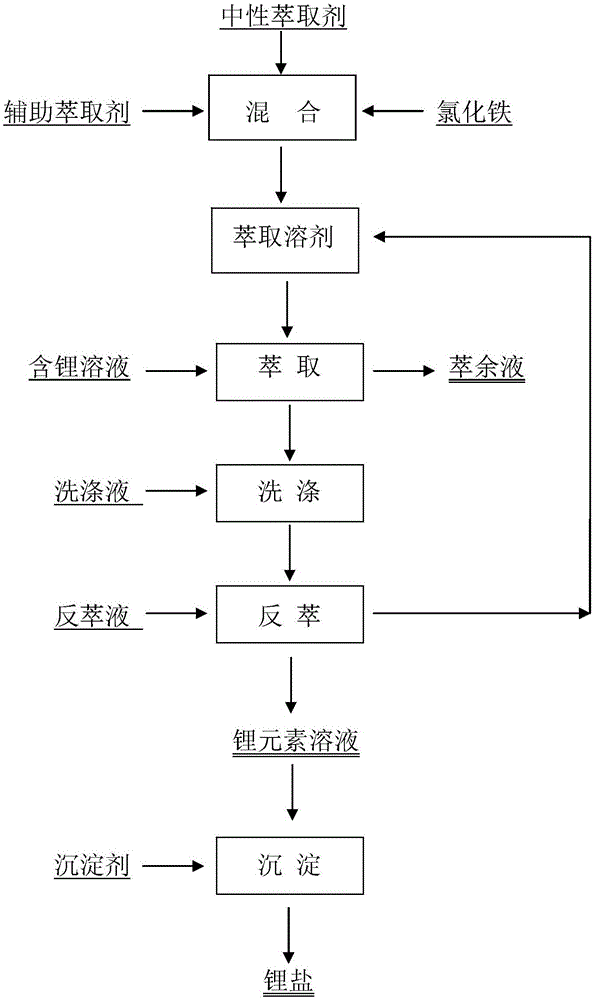
附图说明
图1是本发明工艺流程示意图。
具体实施方式
以下通过实施例更详细地说明本发明。
对比例一
(1)萃取有机相制备:将160ml磷酸三丁酯与40ml磺化煤油混合获得200ml有机相a,再与氯化铁溶液混合,澄清分离水相获得有机相b,所述有机相b中fe3+的含量为20g/l。
(2)第一次萃取:取含锂溶液100ml(其中licl=7.29g/l,nacl=141.41g/l)与200ml有机相b混合,静置分相获得200ml负载有机相c和100ml萃余液a,经检测萃余液a中li+=0.49g/l,fe3+=9.13g/l,na+=50.69g/l。
(3)第一次反萃:
1.用水反萃:将50ml水与100ml负载有机相c混合,静止澄清分相获得100ml有机相d1和50ml反萃液a1,反萃液a1中li+=0.71g/l,fe3+=26.22g/l,na+=4.91g/l,钠锂比(质量比,下同)为6.92。相对于含锂溶液,反萃液中锂元素得到了富集,但也增加了铁元素杂质。
2.用酸反萃:用50ml4.5n的盐酸代替水与100ml负载有机相c混合,静止澄清分相获得100ml有机相d2和50ml反萃液a2,反萃液a2中li+=0.71g/l,fe3+=0.017g/l,na+=4.90g/l,钠锂比为6.9。相对于含锂溶液,反萃液中锂元素得到了富集。虽然也增加了铁元素杂质,但铁元素杂质含量较用水反萃少。
经过第一次萃取及用水反萃,有机相b中铁的损失率为88.38%。
经过第一次萃取及用酸反萃,有机相b中铁的损失率为22.87%。
(4)第二次萃取和反萃:
1.取前述含锂溶液50ml与100ml有机相d1混合,分相后获得负载100ml有机相e1和50ml萃余液b1。经检测萃余液b1中li+=1.18g/l,fe3+=1.23g/l,na+=53.7g/l。再将50ml水与100ml负载有机相e混合,分相后获得100ml有机相f1和50ml反萃液b1,反萃液b1中li+=0.018g/l,fe3+=2.56g/l,na+=1.3g/l。由于有机相d1中协萃剂氯化铁含量少,锂萃取率大幅下降,反萃液b1中的钠锂比为72.2,已超过了含锂溶液的钠锂比。经过有机相d1对含锂溶液的萃取及反萃,含锂溶液中的钠离子在有机相及反萃液中得到了富集。
2.取前述含锂溶液50ml与100ml有机相d2混合,分相后获得100ml负载有机相e2和50ml萃余液b2。经检测萃余液b2中li+=0.89g/l,fe3+=7.13g/l,na+=53.11g/l。再将50ml4.5n的盐酸与100ml负载有机相e2混合,分相后获得100ml有机相f2和50ml反萃液b2,反萃液b2中li+=0.31g/l,fe3+=0.015g/l,na+=2.49g/l。由于有机相d2中协萃剂氯化铁含量少,锂萃取率下降明显,但较有机相d1高,反萃液b2中的钠锂比为8.02。
以上试验说明,单独用磷酸三丁酯作萃取剂并用氯化铁作协萃剂萃取锂元素时,有机相中的氯化铁易进入萃余液和反萃液而大量损失,且随氯化铁的损失有机相的萃取及分离能力和性质均发生大幅变化。另一方面反萃后获得的锂元素溶液中含有大量的铁元素,需要另行分离这些铁元素才能得到洁净的锂元素。由于有机相d1、d2中氯化铁含量低,对锂的萃取效率大幅下降,有机相d1萃取富集和分离锂元素的能力基本丧失。经第二次萃取及反萃后有机相d1中的铁再次损失81.51%;有机相d2中的铁再次损失23.16%。为了维持对锂元素的萃取效率,有机相d1及d2须补铁后再次进行萃取作业。有机相d1及d2补铁作业的控制水平要求较高。
实施例一
(1)锂元素的萃取溶剂制备:将80ml磷酸三丁酯与32ml三烷基胺、20ml磺化煤油及氯化铁溶液混合,获得132ml待用的锂元素的萃取溶剂(有机相b)。所述有机相b中fe3+的含量为15g/l。
(2)第一次萃取:取对比例一所述含锂溶液50ml与132ml有机相b混合。静置30min分相获得负载有机相c和50ml萃余液a。经检测萃余液a中li+=0.58g/l,fe3+=0.52g/l,na+=51.93g/l。
(3)第一次反萃:将50ml水与负载有机相c混合,静止30min澄清分相获得有机相d和反萃液a,反萃液a中li+=0.62g/l,fe3+=1.02g/l,na+=3.67g/l,钠锂比为5.92。
(4)第二次萃取和反萃:取对比例一所述含锂溶液50ml与有机相d混合,静置30min分相获得负载有机相e和50ml萃余液b,经检测萃余液b中li+=0.59g/l,fe3+=0.29g/l,na+=53.17g/l。将50ml水与负载有机相e混合,静止30min后澄清分相获得有机相f和反萃液b50ml,反萃液b中li+=0.61g/l,fe3+=0.65g/l,na+=2.43g/l。该有机相d未补铁进行萃取时,锂萃取率相对于有机相b’略有下降。经过第二次萃取及反萃,有机相d中铁的总损失率为2.44%。反萃液b中的钠锂比为3.98。
在对比例一的有机相b中加入三烷基胺后,经过第一次萃取及水反萃的有机相中fe3+损失率为3.85%,锂与钠的分离效率得到提高。用有机相d进行第二次萃取时萃取率略有下降,但锂与钠的分离效率进一步得到提高。相对于对比例一,在对比例一萃取剂中添加三烷基胺后,一方面锂元素的萃取溶剂中的氯化铁损失大幅减小,钠锂比下降明显,锂与钠的分离效率提高;另一方面反萃后获得的锂元素溶液中铁元素的量大幅下降。
实施例二
(1)锂元素的萃取溶剂制备:将实施例一中的32ml三烷基胺用2-乙基已基膦酸单(2-乙基己基)酯和三烷基胺各16ml代替,获得fe3+含量为15g/l的有机相b。
(2)萃取:取对比例一所述含锂溶液50ml,与132ml有机相b混合。静置10min分相获得负载有机相c及50ml萃余液,分相时间较实施例一短,经检测萃余液中li+=0.56g/l,fe3+=0.32g/l。
(3)反萃:将5n盐酸10ml与负载有机相c混合,静止10min澄清分相获得空白有机相d和反萃液。测得反萃液中li+=3.14g/l,fe3+=0.035g/l,na+=11.3g/l。钠锂比为3.6。
在对比例一的有机相b中加入三烷基胺及2-乙基膦酸单(2-乙基己基)酯后,经过一次萃取及反萃的空白有机相中fe3+损失率为0.82%。相对于对比例一和实施例一,一方面有机相中的氯化铁损失进一步减小,另一方面反萃后获得的锂元素溶液中铁元素少,再者有机相的分相速度明显加快,锂钠分离效果更好。用酸反萃可以降低有机相中铁的损耗及反萃液中杂质铁的含量。
实施例三
(1)锂元素的萃取溶剂制备:将80ml磷酸三丁酯与2-乙基已基膦酸单(2-乙基己基)酯32ml、20ml磺化煤油及氯化铁溶液混合,获得132ml待用的锂元素的萃取溶剂(有机相b)。所述有机相b中fe3+的含量为15g/l。
(2)萃取:取含锂溶液50ml(其中licl=7.89g/l,nacl=154.14g/l,mgcl2=7.84g/l)与132ml有机相b混合。静置5min分相获得负载有机相c及50ml萃余液。经检测萃余液中li+=0.57g/l,fe3+=0.29g/l,mg2+=1.96g/l,na+=58g/l。
(3)反萃:5n将盐酸10ml与负载有机相c混合,静置5min分相获得空白有机相d和反萃液,反萃液中li+=3.61g/l,fe3+=0.028g/l,mg2+=0.018g/l,na+=12.8g/l。钠锂比为3.54。
在对比例一的有机相b中单独加入2-乙基已基膦酸单(2-乙基己基)酯后,经过一次萃取及反萃的有机相b’中fe3+损失率为0.739%,保持和稳定有机相中氯化铁含量的能力强;反萃液中含铁量低。分相速度快。
本实施例制备的锂元素的萃取溶剂基本不萃取镁,含锂溶液中存在镁元素有助于提高锂元素的萃取分离效率。分相速度快。
实施例四
(1)萃取:取含锂溶液50ml(其中licl=7.89g/l,nacl=154.14g/l,mgcl2=110.75g/l)与实施例三制备的有机相b132ml混合。静置5min分相获得负载有机相c及50ml萃余液。经检测萃余液中li+=0.45g/l,fe3+=0.0685g/l,mg2+=27.96g/l,na+=57.86g/l。
(2)反萃:5n将盐酸10ml与负载有机相c混合,静置5min分相获得空白有机相d和反萃液,反萃液中li+=4.23g/l,fe3+=0.014g/l,mg2+=0.018g/l,na+=13.8g/l。钠锂比为3.26。
随着含锂溶液中镁离子浓度的增加,有助于进一步降低有机相中铁损失率和提高锂的萃取率、锂钠分离效率,杂质减少;有机相中fe3+损失减少;有机相b中fe3+损失率为0.178%,保持和稳定有机相中氯化铁含量的能力强;反萃液中含铁量更低。分相速度快。含锂溶液中镁离子为助萃盐,起到提高锂的萃取率、锂钠分离效率和保持稳定有机相中铁含量的作用。有机相b基本不萃取mg2+。
本实施例的有机相基本不萃取镁,随含锂溶液中二价镁离子浓度提高,助萃作用更明显。因此,本实施例适于从我国高镁锂比卤水中萃取分离锂元素。
实施例五
(1)萃取:取含锂溶液50ml(其中licl=7.77g/l,nacl=128.7g/l,mgcl2=276.13g/l)与实施例三制备的有机相b132ml混合。静置3min分相获得负载有机相c及50ml萃余液。经检测萃余液中li+=0.21g/l,fe3+=<0.001g/l,mg2+=69.74g/l,na+=47.57g/l。
(3)反萃:5n将盐酸10ml与负载有机相c混合,静置5min分相获得空白有机相d和反萃液,反萃液中li+=5.33g/l,fe3+=0.015g/l,mg2+=0.014g/l,na+=15.1g/l。钠锂比为2.83。
随着含锂溶液中镁离子浓度的增加,锂离子的萃取率及锂钠分离效率均得到明显提高,萃液中锂离子浓度相应得到提高,锂元素的萃取溶剂中氯化铁损失极少。因此,本实施例特别适用于从我国高镁锂比卤水中萃取分离锂元素。
实施例六
(1)萃取:将含锂溶液50ml(licl=7.95g/l,nacl=151.59g/l,fecl2=105.3g/l)先后用实施例三制备的有机相b132ml进行二级萃取,获得负载有机相c1及c2。经检测50ml萃余液中li+=0.083g/l,fe3+=0.13g/l,na+=55.57g/l,fe2+=46.21g/l。
(2)反萃:将6n盐酸10ml先后与负载有机相c1、c2混合,静止澄清分相获得空白有机相c和反萃液,反萃液中li+=5.89g/l,fe3+=0.02g/l,fe2+=0.6g/l,na+=20.1g/l,反萃液中fe3+含量低。
经过二级萃取,锂元素的收率大幅提高。含锂溶液中存在一定量二价铁离子时同样有助于降低有机相中铁损失率和提高锂的萃取率,以及提高锂钠分离效率,起到助萃盐的作用。本实施例有机相对二价铁离子基本不萃取。二价铁离子同样具有助萃作用。
实施例七
(1)锂元素的萃取溶剂制备:按体积比磷酸三丁酯:甲基磷酸二甲庚脂:膦酸二(2-乙基己基)酯:磺化煤油:正己烷=20:20:12:5:5及氯化铁溶液混合,获得含铁量为5.6g/l的有机相b。
(2)萃取:取含锂溶液50ml(其中licl=8.2g/l,nacl=144.41g/l,cocl2=67.31g/l,nicl2=64.18g/l,mncl2=55.9g/l)分别用100ml有机相b进行4次萃取,得到4份负载有机相,经检测50ml萃余液中,li+<1mg/l,fe3+=0.11g/l,na+=51g/l,co2+=30.55g/l,ni2+=29.13g/l,mn2+=24.40g/l。锂的收率提高且有机相中铁损失率下降,有机相中fe3+的损失少。
(3)反萃:将5.5n盐酸10ml依次与各负载有机相分别混合,分相获得空白有机相c和反萃液,反萃液中li+=6.62g/l,na+=22.51g/l,fe3+=0.017g/l,co2+=0.042g/l,ni2+=0.029g/l,mn2+=0.053g/l。有机相中铁的总损失非常低,有机相无需补铁。co2+、ni2+、mn2+盐起到助萃盐的作用。
本实施例中用甲基磷酸二甲庚脂代替一半磷酸三丁酯后,锂元素的萃取溶剂对锂元素的萃取率更高,有机相中铁的总损失率低,锂元素的萃取溶剂无需补铁就可以重复进行锂离子与钠离子、钴离子、镍离子、锰离子等的萃取分离。反萃液中锂元素含量高,含铁等杂质少。
实施例八
(1)锂元素的萃取溶剂制备:将80ml磷酸三丁酯与2-乙基已基膦酸单(2-乙基己基)酯4ml、16ml磺化煤油及氯化铁溶液混合,获得100ml待用的锂元素的萃取溶剂(有机相b)。所述有机相b中fe3+的含量为25g/l。
(2)萃取:取含锂溶液50ml(其中licl=7.29g/l,nacl=141.41g/l)与100ml有机相b混合,静置分相获得100ml负载有机相c和100ml萃余液a,经检测萃余液a中li+=0.51g/l,fe3+=7.39g/l,na+=50.78g/l。
(3)反萃:将50ml10%的氯化铵溶液与负载有机相c混合,静止澄清分相获得有机相d和反萃液a,反萃液a中li+=0.60g/l,fe3+=1.13g/l,na+=3.57g/l,钠锂比为5.95。
实施例九
(1)锂元素的萃取溶剂制备:将80ml磷酸三丁酯与2-乙基已基膦酸单(2-乙基己基)酯34ml、20ml磺化煤油及氯化铁溶液混合,获得134ml待用的锂元素的萃取溶剂(有机相b)。所述有机相b中fe3+的含量为32.5g/l。
(2)萃取:取含锂溶液50ml(其中licl=7.29g/l,nacl=141.41g/l)与134ml有机相b混合,静置分相获得154ml负载有机相c和100ml萃余液a,经检测萃余液a中li+=0.53g/l,fe3+=0.18g/l,na+=50.67g/l。
(3)反萃:将50ml10%的氯化铵溶液与负载有机相c混合,静止澄清分相获得有机相d和反萃液a,反萃液a中li+=0.59g/l,fe3+=0.93g/l,na+=3.62g/l,钠锂比为6.13。
实施例十
(1)锂元素的萃取溶剂制备:按体积比三辛烷基叔胺:磺化煤油:磷酸三丁酯:磷酸三辛酯=1:4:10:5与氯化铁溶液混合获得含fe3+8g/l的萃取溶剂。
(2)萃取:按流量比萃取溶剂:含锂溶液=2:1进行10级逆流萃取,得到负载有机相和萃余液;所述含锂溶液中li+=1.98g/l,mg2+=40.23g/l,na+=107.94g/l,k+=18.17g/lcl-=297.47.79g/l,so42-=20.5g/l;
(3)洗涤:按流量比负载有机相:盐酸=10:1进行12级逆流洗涤得到净化有机相,所述盐酸浓度为0.6n;
(4)反萃:按流量比净化有机相:盐酸=20:1进行6级逆流反萃得到空白有机相和氯化锂溶液,所述盐酸浓度为3n。
(5)沉淀:将氯化锂溶液用碳酸氢钠沉淀,得到碳酸锂,碳酸锂含量为98.69%(重量,下同)、fe<0.0002%、ca=0.0007%、cl=0.0011%、na=0.013%。
经检测萃余液中锂含量0.079g/l,反萃液氯化锂溶液锂含量为19.4g/l,mg2+=0.05g/l,k+=0.17g/l,na+=0.11g/l,fe=0.017g/l。镁盐起到助萃盐的作用。
实施例十一
(1)锂元素的萃取溶剂制备:按体积比2-乙基已基膦酸单(2-乙基己基)酯:磺化煤油:磷酸三丁酯=4:5:20混合得到空白有机相,再与氯化铁溶液混合获得含铁16g/l的萃取溶剂。
(2)萃取:按流量比有机相:含锂卤水=2:1进行10级逆流萃取,得到负载有机相和萃余液;所述含锂卤水其中li+=3.06g/l,mg2+=49.23g/l、na+=100.97g/l,k+=24.74g/lcl-=310.79g/l,so42-=38.5g/l;
(3)洗涤:按流量比负载有机相:反萃液=25:1进行6级逆流洗涤得到净化有机相;
(4)反萃:按流量比净化有机相:硫酸=10:1进行6级逆流反萃得到空白有机相和硫酸锂溶液,所述硫酸浓度为2n。
(5)沉淀:将硫酸锂溶液用碳酸氢钠沉淀,得到碳酸锂,碳酸锂含量为98.69%(重量,下同)、fe<0.0002%、ca=0.0005%、na=0.015%,so42-=0.042%。
含锂卤水中的镁盐等为助萃盐。
萃取分离后获得的氯化锂、硫酸锂或碳酸锂等均可以制成氧化锂、氢氧化锂、磷酸铁锂及其它锂盐等锂化合物,还可以进一步制备成金属锂或锂电池等。
经检测萃余液中锂含量0.067g/l。硫酸锂溶液含量为li+=9.26g/l、mg2+=0.07g/l、k+=0.19g/lna+=0.13g/l。
最后需要说明的是,以上实施例仅是本发明所列举的几种优选方式,本领域技术人员应理解,本发明实施方式并不限于以上几种。任何在本发明的基础上所作的等效变换,均应属于本发明的范畴。
- 还没有人留言评论。精彩留言会获得点赞!