低碳排放的氧化镁生产的制作方法
本技术领域总体上涉及由碳酸镁生产氧化镁,更特别地涉及将氧化镁生产与二氧化碳封存集成,以及含镁的超镁铁岩如蛇纹石的用途。
背景技术:
氧化镁(mgo)是耐火材料行业中最普遍的主要材料。其通常通过煅烧源自天然沉积物或卤水沉淀的菱镁矿(mgco3)来生产。煅烧途径是目前使用最多的,尽管它导致各种环境挑战。
在氧化镁生产期间进行的脱碳产生的co2以及相关的能量需求是成问题的。虽然能量效率和替代来源的使用可以减少二氧化碳排放,但超过50%的工艺排放来自工艺本身。
地球各地的天然菱镁矿沉积物是基于数千年来发生的自然地质过程永久捕获并安全储存的大型二氧化碳天然储藏。遗憾的是,这些材料也是各种工业中使用的mgo生产的主要来源,这导致将这种co2返回到大气中,从而有助于全球变暖。
存在对克服已知的氧化镁生产方法的缺点中的至少一些的技术的需求。
技术实现要素:
在一些实施方式中,提供一种生产氧化镁的方法,包括:使含co2排放物与含镁材料接触以生产碳酸镁;将碳酸镁进行煅烧以生产co2副产物和氧化镁;和,再循环至少一部分co2副产物用以接触所述含镁材料以生产所述碳酸镁。
在一些实施方式中,所述接触的步骤还包括:提供含水浆料形式的所述含镁材料,并使所述含co2排放物和所述co2副产物与所述含水浆料接触。
在一些实施方式中,所述方法包括:在所述接触步骤中,生产含可沉淀碳酸盐且基本不含沉淀的碱土金属碳酸盐的负载碳酸盐的浆料;将所述负载碳酸盐的浆料分离为水相和固相,所述水相含可沉淀碳酸盐;将所述碳酸镁从所述水相中沉淀出来;以及将所述碳酸镁从所述水相中分离出来。
在一些实施方式中,所述含co2排放物包括来自氧化镁生产设施的燃烧气体。在一些实施方式中,所述燃烧气体源自所述煅烧步骤。所述燃烧气体可以源自与所述含co2排放物接触之前的含镁材料的热活化步骤。在一些实施方式中,用于接触所述含镁材料的所述co2仅从所述氧化镁生产设施获得。
在一些实施方式中,所述含co2排放物包括来自独立排放源的排放物。
在一些实施方式中,所述方法包括将所述含镁材料在与所述含co2排放物接触之前进行热活化预处理。在一些实施方式中,所述热活化预处理进行的温度为约600至700摄氏度。在一些实施方式中,所述热活化预处理进行的时长为约20至60分钟。在一些实施方式中,将源自所述热活化预处理的co2供应至所述接触步骤。
在一些实施方式中,将所述含镁材料与包括多个co2源物流的co2进料物流接触。所述方法还包括控制所述co2进料物流中每个co2源物流的相对量。根据压力、温度和/或所述co2源物流的组成进行所述控制。在一些实施方式中,所述co2进料物流还包括源自另外的氧化镁生产线的co2。在一些实施方式中,所述另外的氧化镁生产线包括常规生产线。
在一些实施方式中,所述含镁材料包括蛇纹石或源自蛇纹岩或其变体。在一些实施方式中,所述含镁材料源自天然矿物材料。在一些实施方式中,所述含镁材料源自玄武岩、橄榄岩、蛇纹石化橄榄岩、蛇绿岩、镁铁质岩、超镁铁岩、贵橄榄石、辉石、橄榄石、蛇纹石、含氧化镁矿物和/或水镁石中的至少一种。
在一些实施方式中,将所述含镁材料在碳酸化之前进行预处理以生产含镁颗粒材料,并且所述含镁颗粒材料的镁含量在约1wt%和约35wt%之间。在一些实施方式中,所述镁含量在约10wt%与约30wt%之间。
在一些实施方式中,所述含镁材料源自工业副产物材料。所述工业副产物材料包括炼钢炉渣和/或炼钢废氧化镁砖。
在一些实施方式中,所述含镁材料源自采矿残余物。所述采矿残余物包括页硅酸盐采矿残余物和/或温石棉采矿残余物。
在一些实施方式中,所述接触步骤包括:使所述co2与所述含镁材料以基本上干燥的形式在至少一个碳酸化单元中在约200℃与约500℃之间的碳酸化温度下和约1bar与约20bar之间的碳酸化压力下接触,以将其碳酸化,产生碳酸镁和贫co2气体。
在一些实施方式中,所述方法包括将所述含镁材料在碳酸化之前进行尺寸减小以及磁性部分的除去。
在一些实施方式中,所述方法包括:研磨起始材料以提供约200微米与约1000微米之间的粒径,以产生尺寸化材料;从所述尺寸化材料中除去所述磁性部分以产生非磁性部分;和研磨所述非磁性部分以产生粒径至多75微米的所述含镁材料。
在一些实施方式中,所述煅烧在间接加热煅烧单元中进行。所述煅烧可以在直接加热煅烧单元中进行。
在一些实施方式中,所述方法包括控制与所述含镁材料接触的所述含co2气体的至少一种性质。所述控制可以包括调节用于接触所述含镁材料的所述含co2排放物和所述co2副产物的相对量。可以进行所述控制以控制与含镁材料接触的含co2气体的气体压力、气体温度和/或co2含量。
在一些实施方式中,上述方法包括任一种如本文所述的碳酸镁生产方法的一个或多个特征。
在一些实施方式中,提供一种生产氧化镁的方法,包括:使含co2气体与含镁材料接触以生产碳酸镁;将所述碳酸镁进行煅烧以产生co2副产物和氧化镁;和,再循环至少一部分co2副产物作为所述含co2气体的至少一部分,用以接触所述含镁材料以产生所述碳酸镁。该方法可包括上述或本文所述的一个或多个特征。
在一些实施方式中,提供一种生产氧化镁的方法,包括:将含co2气体与含水浆料中的含镁材料接触;从所述含水浆料中回收沉淀的碳酸镁;以及对所述沉淀的碳酸镁进行煅烧以产生co2副产物和氧化镁。该方法可包括上述或本文所述的一个或多个特征。
在一些实施方式中,所述碳酸镁包括水碳镁石或由水碳镁石组成。
在一些实施方式中,提供一种氧化镁生产系统,包括:
至少一个碳酸化单元,其具有:
气体入口,其用于接收含co2气体,
浆料入口,其用于接收包括含镁材料的含水浆料,
碳酸化容器,其用于用co2对所述含水浆料的至少一部分镁进行碳酸化以产生贫co2气体和包含可沉淀碳酸镁的负载碳酸盐的浆料,
浆料出口,其用于释放所述包含可沉淀碳酸镁的负载碳酸盐的浆料,和
气体出口,其用于释放所述贫co2气体;
分离单元,其具有:
浆料入口,其用于接收来自所述至少一个碳酸化单元的浆料出口的所述包含可沉淀碳酸镁的负载碳酸盐的浆料,
分离腔室,其用于将所述包含可沉淀碳酸镁的负载碳酸盐的浆料分离为固相和包含所述可沉淀碳酸镁的水相,和
液体出口,其用于释放所述水相,和
沉淀单元,其具有:
浆料入口,其用于接收来自所述分离单元的所述液体出口的所述包含所述可沉淀碳酸镁的所述水相,
沉淀腔室,其用于沉淀所述碳酸镁并形成沉淀浆料,和
液体出口,其用于释放所述沉淀浆料;
煅烧单元,其用于接收至少一部分所述碳酸镁,产生煅烧后的氧化镁材料和co2副产物流。
在一些实施方式中,所述系统包括co2收集与供应系统,其用于收集所述co2副产物流,并将所述co2副产物流作为至少部分所述含co2气体供应至所述碳酸化单元。
在一些实施方式中,所述系统包括至少一个如权利要求1至39中任一项所述或如本文所述或所示的附加特征。
在一些实施方式中,提供了页硅酸盐采矿残余物用于从工业排放物中封存二氧化碳并生产氧化镁的用途。
在一些实施方式中,提供了沉淀的碳酸镁用于通过煅烧生产氧化镁的用途,所述沉淀的碳酸镁源自含镁材料对co2排放物的封存。
在一些实施方式中,提供了沉淀的水碳镁石用于通过煅烧生产氧化镁的用途。
在一些实施方式中,提供了一种生产氧化镁的方法,包括将由沉淀的水碳镁石组成的碳酸镁供应至煅烧单元,并煅烧所述沉淀的水碳镁石以生产氧化镁。
在一些实施方式中,提供了一种氧化镁产品,其通过煅烧沉淀的碳酸镁而生产,所述沉淀的碳酸镁源自使湿的或干的形式的含镁材料与来自工业排放物的二氧化碳在碳酸化单元中接触以形成负载碳酸盐的浆料,并在沉淀单元中从负载碳酸盐的浆料沉淀出碳酸钙或碳酸镁。
在一些实施方式中,所述沉淀的碳酸镁由水碳镁石组成。
在一些实施方式中,所述方法包括回收来自煅烧的co2副产物流;并使所述含co2副产物进行除水以产生经处理的co2副产物流,再使所述经处理的co2副产物流与所述含镁材料接触。
在一些实施方式中,所述含镁材料包括蒸发盐。在一些实施方式中,所述蒸发盐源自蒸发单元。在一些实施方式中,所述蒸发盐包括氯化镁盐。在一些实施方式中,所述蒸发盐包括硫化镁盐。在一些实施方式中,所述蒸发盐包括碳酸镁盐。在一些实施方式中,将所述蒸发盐在碳酸化之前进行预处理。
应注意,上文或本文中描述的一个或多个特征可与上文或本文中所述的方法、系统、用途和/或产品进行组合。
附图说明
结合以下附图表示并将进一步理解本技术的一些实施方案、方面和实施方式。
图1是湿式碳酸化的工艺流程图。
图2是碳酸化单元的示意图。
图3是湿式碳酸化的工艺流程图。
图4是具有再循环方案的湿式碳酸化的工艺步骤的示意图。
图5是具有三个不同反应时间的湿式碳酸化的溶解镁量-温度图。
图6是具有三个不同浆料密度的含水浆料的溶解镁量-温度图。
图7是不同浆料密度的含水浆料的湿式碳酸化的co2去除率-气/液比(glr)图。
图8是湿式碳酸化的co2去除率-时间图。
图9是连续模式的湿式碳酸化的co2流速-时间图,图中示出在3.4bar和42ml/min下的co2去除效率。
图10是示出在直接干燥气体固体碳酸化中温度和压力对co2去除百分比的共同作用的响应曲面图。
图11是在258℃的温度和5.6atm的压力下气/固碳酸化10min内的压力-时间图。
图12是一种生产mgo的方法的示意图。
图13是用于生产mgo并集成了另一种工业烟气的co2排放物捕获的方法的示意图。
图14是说明双线mgo生产操作的过程图,该操作可适用于例如现有mgo生产设施的潜在改进。
虽然将结合示例实施方案描述本发明,但是应理解,这并不意在将本发明的范围限制于这些实施方案。相反,其旨在涵盖所有可能包括在权利要求限定范围中的备选方案、修改和等同方案。
具体实施方式
本文描述了用于生产氧化镁和利用co2排放物和副产物流的不同技术。在一些实施方式中,这些技术促进了由含镁材料(例如源自蛇纹岩的那些)的蛇纹岩碳酸化的低二氧化碳氧化镁生产。
氧化镁生产概述
参考图12和13阐述了将蛇纹岩转化为氧化镁的整个过程。也可以使用其他含镁材料。
蛇纹岩可以由废物或残渣提供或作为矿石进行提取。进行蛇纹岩碳酸化,并且其可以包括以下进一步描述的一种或多种特征,产生用于氧化镁生产方法中的相对高质量的碳酸镁物流,其一些实例在本文中可称为水碳镁石。应注意,源自蛇纹岩或类似的含镁材料碳酸化的各种形式的菱镁矿都可以用作氧化镁生产原料,包括水合形式的菱镁矿,如球碳镁石(mg5(co3)4(oh)2·5h2o)、水菱镁矿(mg5(co3)4(oh)2·4h2o)、其他水合形式的水合碳酸镁及其组合。
通过碳酸化操作提供的水碳镁石或其他菱镁矿材料可用作通过煅烧生产氧化镁的原料。煅烧导致产生co2副产物,其可以全部或部分地用于进一步产生菱镁矿(例如水碳镁石)然后产生氧化镁。
碳酸化步骤中使用的co2可以源自一个独立的工业过程,以含co2排放物的形式(例如,来自烃的燃烧)源自氧化镁生产工艺,和/或源自煅烧步骤的至少一部分co2副产物流。碳酸化步骤可以在氧化镁生产场所进行,特别是当用于碳酸化的co2唯一地来自氧化镁生产场所时。或者,碳酸化步骤可以在场外工业排放装置进行,特别是当用于碳酸化的co2来自排放装置时。
氧化镁终产品可以根据所需的特性和加工条件而变化,加工条件可以通过调节诸如煅烧时间和温度的煅烧参数来获得。
参照图12,在步骤1期间,可以将蛇纹岩破碎并研磨,以达到约200μm-1000μm、300-700μm、400-600μm或约500μm的粒径。然后可以通过物理处理除去磁性部分。可以使用不同的磁分离技术。磁性部分主要由赤铁矿/磁铁矿/铬铁矿组成,并构成一种可以进一步处理并销售的附加值产品。可以对非磁性部分进行进一步的尺寸减小,以获得粒度为至多75μm、至多50μm、至多40μm或至多30μm的含镁颗粒材料。第二尺寸减小步骤强化了随后的碳酸化步骤。
在步骤2中,将非磁性蛇纹岩热活化。热活化可以在约600-700℃的温度下进行约20-60分钟。可以收集与热活化相关的co2排放物以用于步骤3中。
然后将热活化后的蛇纹岩用作碳酸化步骤(步骤3)的进料。这里,使热活化后的蛇纹岩与co2物流反应,在某些情况下,co2物流可以是来自步骤2和步骤4的气体物流。co2气体组成可以变化,例如,5%至30%。根据工艺的阶段(例如,启动、稳态、关闭等),进料至碳酸化单元的气体中的co2含量可以变化。例如,在启动期间,co2含量可以对应于例如约5%至7%的燃烧气体含量,而在稳态操作期间,co2含量可以对应于包括燃烧气体和再循环的co2副产物气体这两者的co2气体源的混合物,因此可以在更高,在25%至30%的范围内。还应注意,在一些情况下,如果使用相对纯的co2,则co2气体含量可以高得多,例如在50%至100%的范围内,对于将在下面进一步讨论的某些方案可能是这种情形。
仍然参考步骤3,步骤3的第一副产物材料是无定形硅酸盐相,其可以用作填充材料。步骤3的第二产物是碳酸镁,其可以供应给后续处理。
在步骤4中,对碳酸镁进行煅烧以产生氧化镁。在一些实施方式中,将来自煅烧的所有co2副产物排放物转而供入步骤3。
现在转到图13,低co2的氧化镁生产可与工业现场的co2捕集装置相联。在这种情形下,向前述方案中增加第二碳酸化站点(步骤5)。通过该途径,可以增加氧化镁的产量,并且可以减少来自另一个工业装置的二氧化碳排放物。
在一些实施方式中,该方法有助于从含镁材料(例如基于蛇纹石(mg3si2o5(oh)4的岩石)获得的低碳氧化镁的生产。co2与矿物结构中所含的镁反应时,转化为碳酸盐。根据最近的研究,开发了一种使用蛇纹岩的方法来处理工业烟气,其有利于经济地减少二氧化碳排放物以及生产具有非常高纯度水平的水碳镁石。这种水碳镁石又可以用作原料进行进一步处理,以便有利地通过煅烧生产氧化镁。此外,蛇纹岩的碳酸化和菱镁矿的脱碳两者可以在单个工业场所进行,以抵消源自菱镁矿焙烧的二氧化碳排放物。结果是其中二氧化碳以循环工艺再循环而未释放到大气中的氧化镁生产操作,这提供了低碳排放和高纯度氧化镁产品。
一方面,当使用天然菱镁矿沉积物作为进料时,本文所述技术可利于生产氧化镁而不向大气排放大量co2。另一方面,本文所述技术可利于整合来自菱镁矿煅烧的co2排放物,以由蛇纹岩碳酸化生产更多的氧化镁。另一方面,本文所述技术可利于由利用从另一个工业场所排放的工业co2通过蛇纹岩碳酸化生产的菱镁矿来生产氧化镁。
参考图14,应注意,氧化镁生产设施可以包括两条或更多条线,每条线都产生mgo输出物流。在图14中有两条线,其中一条线是常规线,其接收来自天然沉积物的进料以用于煅烧,第二条线可以是新型的或改装的,如图所示包括蛇纹石或类似材料作为碳酸化-沉淀的进料并将所得的mgco3进料至煅烧以产生源自蛇纹石的mgo。在这种多线工艺中产生各种co2物流,并且应注意可以将一种或多种该co2物流用在碳酸化步骤中。
co2物流可以通过co2收集系统来收集,该系统可包括管道、压缩机(根据需要,取决于压力条件)、容器、阀门、冷凝器、颗粒过滤器、用于加热或冷却气体的热交换器,和/或控制单元。根据不同的含co2物流的可得性和性质(例如压力、温度、co2含量),可以调节收集系统和进料至碳酸化单元的co2的输入。co2收集与供应系统也可以是相对简单的组件,其将煅烧单元的气体出口流体连接至碳酸化单元的气体入口。在某些情况下,将含co2气体直接供应至碳酸化装置,而没有任何实质性的介入单元;在这种情况下,可以提供煅烧和碳酸化单元的操作条件以促进两个单元之间的直接co2供应。此外,当潜在的co2过多时,可能有储存单元,其保存来自一个或多个所选来源的co2。
co2收集与供应系统可以具有各种配置。在某些情况下,co2收集与供应系统是气密的,以抑制co2泄漏。co2收集与供应系统可包括与煅烧单元流体连通的收集管线和与碳酸化单元流体连通的co2进料管线。此外,可以有一个或多个压缩机和/或热交换器作为co2收集与供应系统的一部分,以在所需的温度和压力下将co2供应至碳酸化单元。
在一些实施方式中,煅烧单元为直接加热的煅烧单元或间接加热的煅烧单元。对于直接加热的煅烧,所得的含co2的副产物流为混合气体物流,其包括来自菱镁矿的脱碳与燃料的燃烧这两者的co2以及其他气体组分。来自直接加热的煅烧单元的co2副产物流可具有高于燃烧排放物的co2含量,因此其用于进料至碳酸化单元时可优于co2排放物。对于间接加热的煅烧,含co2的副产物流主要是来自菱镁矿脱碳的二氧化碳,由于其最高达100%的二氧化碳含量,其用于进料至碳酸化单元时可优于其他co2物流(例如co2排放物、来自另一条线的直接加热煅烧的含co2的副产物流等),以为碳酸化反应和较小的设备尺寸(例如容器、管道等)提供较大的驱动力。
此外,可以基于较高压力选择在碳酸化单元中使用的含co2的物流以促进碳酸化反应。来自燃烧排放源的co2的物流可具有相对低的压力,而来自煅烧的co2物流可具有较高的压力并因此可选择性地用于碳酸化步骤。例如,随着该工艺从启动到正常运行,越来越大量的来自煅烧的co2可用于碳酸化。
在一些实施方式中,供应至煅烧的碳酸镁进料由从本文所述碳酸化-沉淀方法获得的水碳镁石组成。通过将具有预定水合状态的水碳镁石提供至煅烧,可以改善煅烧步骤期间的控制和操纵。例如,将水碳镁石提供至煅烧时,可能存在基于已知的水碳镁石的水合状态的预定热量,而源自天然沉积物的碳酸镁可包括水合材料的复杂混合物,其脱水焓很难一致地确定。
封存co2以生产碳酸镁并与生产氧化镁集成的可选技术
各种任选的技术可以与上述氧化镁生产实施方式结合使用,以封存二氧化碳并生产用于氧化镁生产的碱土金属碳酸盐。
一方面,结合mgo生产工艺,提供了一种通过生产碱土金属碳酸盐从含二氧化碳的气体中化学封存二氧化碳的方法。含二氧化碳的气体可以产自工业排放物,并且根据排放物源自的工业过程而具有不同的二氧化碳浓度。
在一些任选的方面,结合mgo生产工艺,提供了一种利用镁或钙的硅酸盐通过煅烧从含有二氧化碳的工业排放物中化学封存二氧化碳的方法,优选利用硅酸镁或其他含镁材料以提供镁源。在一些方面,可以通过利用含钙材料的碳酸化来执行含二氧化碳的工业排放物的二氧化碳化学封存,以进行用于生产cao的类似生产方法。
迄今为止的大部分研究都是使用含100%二氧化碳的气体进行的,这意味着来自工业设施的烟囱中的二氧化碳在用碳酸化处理之前必须首先使用单独的技术进行浓缩。这意味着较昂贵的工艺。2011年,碳捕获与封存(ccs)试验装置在英国的一个燃煤设施启动。专家们估计,产生的能量中有16%到40%最终可能被用来捕获和储存碳。这相当于1亿美元的发电厂,成本在1600万到4000万美元之间。
本发明的实施方案可以通过提供所产生的能量值的0至10%的利润或成本来增加经济可行性。
在一些任选的方面,含二氧化碳的气体可以有利地为从工厂产生时就直接被用的气体排放物。例如,对于水泥厂,可使用含有18.2%co2、4.11%o2和77.69%n2的气体。任选地,源自工业排放物的含二氧化碳的气体可具有约1%至约30%的二氧化碳浓度。
本发明的实施方案还可实现由含碱土金属的材料生产有价值的碱土金属碳酸盐。
应理解,含碱土金属的材料可以是天然材料,其可以包括但不限于含碱土金属的矿物和含碱土金属的岩石。例如,含碱土金属的材料可包括蛇纹石或蛇纹岩。任选地,含碱土金属的材料可包括含碱土金属的岩石,如砂岩、花岗岩、斜长岩、玄武岩、蛇纹岩、橄榄岩、蛇纹石化橄榄岩、蛇绿岩、镁铁质岩和超镁铁岩(含镁和铁矿物)、含多于10%辉石和橄榄石的岩石,或其组合。任选地,含碱土金属的材料还可包括页硅酸盐。进一步任选地,含碱土金属的材料可包括含碱土金属的矿物,例如硅酸钙、硅酸镁、长石、斜长石(中长石)、橄榄石(橄榄石砂)、辉石(顽辉石橄榄石砂)、橄榄石、蛇纹石(如含绿藻石、温石棉、利蛇纹石的矿物族)、硅灰石、氧化钙(cao)、氧化镁或方镁石(mgo)、水镁石(mg(oh)2)、镁铁质和超镁铁矿物(含镁和铁)或其组合。
在一些实施方式中,用作进料的含镁材料可包括含镁蒸发物。蒸发盐是由水溶液蒸发形成的沉淀矿物的沉积性矿床。在某些情形下,蒸发盐材料可含高的镁浓度。蒸发盐可包括含镁颗粒材料,其处于相对活性的条件下,部分原因是其小粒径。蒸发盐可以从各种工业中使用的蒸发单元获得。或者,蒸发盐可以从通过前海或盐水湖的蒸发而形成的天然岩石获得。蒸发盐可包括氯化物、硫酸盐和/或碳酸盐的各种镁盐形式的镁,如光卤石(kmgcl3·6h2o)、钾盐镁矾(kmg(so4)cl·3h2o)、硫酸镁石(mgso4·h2o)、无水钾镁矾(k2mg2(so4)3)、杂卤石(k2ca2mg(so4)6·h2o)和菱镁矿(mgco3)。根据蒸发盐材料的化学性质和物理结构,可以使用热学和/或化学步骤对其进行预处理,形成预处理后的含镁材料,用于碳酸化步骤。
含碱土金属的材料也可以源自各种工业废物或残余物,如炉渣、水泥废料、采矿加工废物和矿物加工废物,这些废物可以在不需要从地质构造中开采的情况下获得。任选地,炉渣可包括炼钢炉渣、炼钢废mgo砖或其组合。任选地,水泥废料可包括回转窑灰(ckd,lkd)、废水泥、废弃混凝土、建筑和拆除废物、带有骨料的混凝土、混凝土砖、混凝土、红砖或其组合。任选地,采矿和矿物加工废物可包括页硅酸盐采矿残余物、温石棉采矿残余物、蛇纹石(在含矿石的岩石基质中)或其组合。
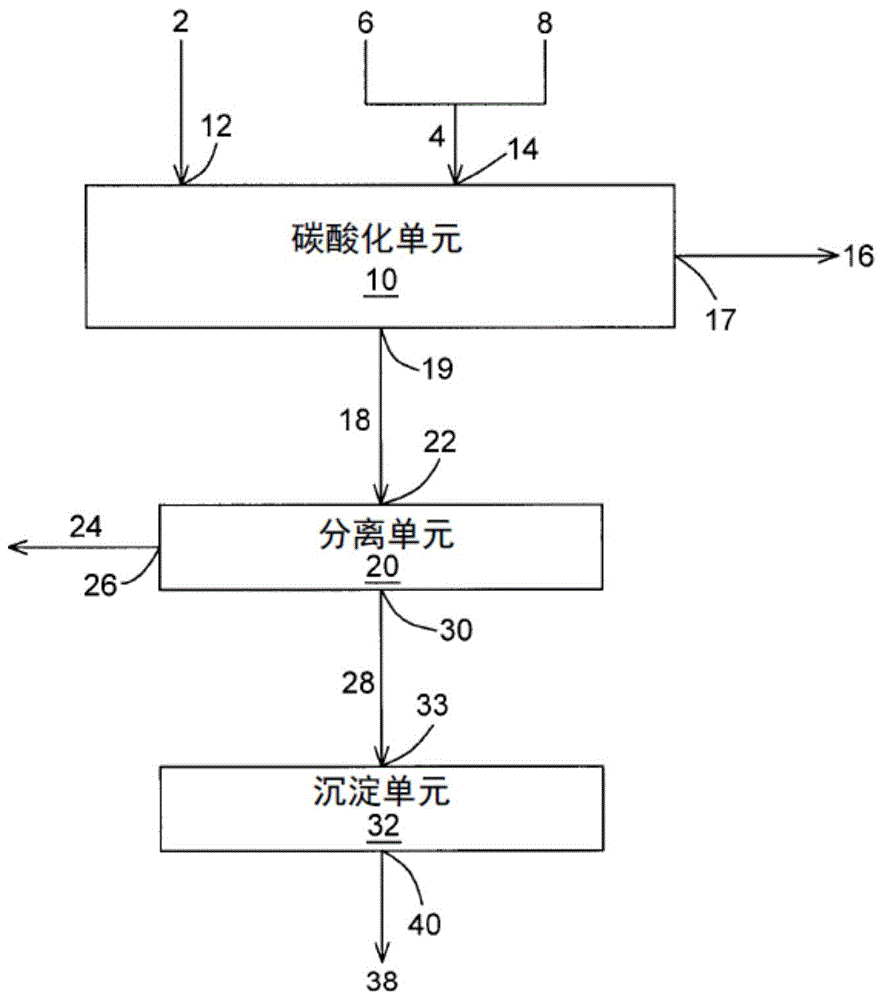
参照图1,在一些实施方式中,本方法包括将含二氧化碳的气体2和包括含碱土金属的材料6与水8的含水浆料4供应至碳酸化单元10的步骤。碳酸化单元10可包括用于接收含二氧化碳的气体2的气体入口12和用于接收含水浆料4的浆料入口14。本方法然后包括使含二氧化碳的气体2和含水浆料4在碳酸化单元10中接触以进行至少一部分碱土金属的碳酸化的步骤。产生贫二氧化碳的气体16和包括可沉淀碳酸盐的部分负载碳酸盐的浆料18。本方法还可包括通过气体出口17从碳酸化单元10中除去贫二氧化碳的气体16并通过浆料出口19除去负载碳酸盐的浆料18的步骤。在一些实施方式中,负载碳酸盐的浆料在碳酸化单元10内以及从中释放出来时基本不含沉淀的碳酸盐。然后将负载碳酸盐的浆料18在分离单元20中分离成固相24和包含可沉淀碳酸盐的水相28,并分别通过固体出口26和液体出口30从分离单元20中释放出来。在一些实施方式中,水相28在分离单元20内以及从中释放出来时基本不含沉淀的碳酸盐。然后可将水相28通过液体入口33供应至沉淀单元32。本方法可包括在沉淀单元32中将水相28的至少一部分可沉淀碳酸盐沉淀成碱土金属碳酸盐,从而产生包含碱土金属碳酸盐的沉淀浆料38,将其经由浆料出口40从沉淀单元32释放。
应理解,包括含碱土金属的材料6的含水浆料4可在供应至碳酸化单元10之前形成,如图2所示,但也可通过将含碱土金属的材料6和水8单独供应至碳酸化单元10而在碳酸化单元10中直接形成。
在一些任选的方面,本方法还可包括搅拌碳酸化单元中的含水浆料以增强含二氧化碳的气体和含碱土金属的材料之间的接触的步骤。可通过机械搅拌器来确保搅拌,如搅拌速度为约400rpm至约800rpm、任选约500rpm至约650rpm的搅拌桨。应理解,搅拌步骤不限于机械搅拌,并且可包括各种已知和合适的搅拌技术,例如气体流化。
在其他任选的方面,本方法还可包括搅拌沉淀单元中的水相以增强碱土金属碳酸盐的沉淀。
在一些任选的方面,可将含碱土金属的材料与水混合,以获得具有在25g/l与300g/l之间的浆料密度(也称为每升浆料的总固体的质量浓度)的含水浆料。低浆料密度可能有利于碱土金属在含水浆料中的溶解。实施例2中示出了含水浆料的密度对二氧化碳去除效率的影响。
在一些任选的方面,本方法可包括热预处理含碱土的材料以进行脱羟基化。含碱土的材料可能实际上包括不期望的水,其通过热预处理至少部分地被去除。在热预处理期间,水被蒸发并且含碱土金属的材料的晶体结构可变成更具化学活性的结构,从而允许碱土金属更好地溶解在水相中。任选地,本方法可包括在约10分钟至约60分钟的预处理时间内,在约500℃至约800℃的预处理温度下加热含碱土金属的材料。任选地,预处理温度可以在约600℃和约700℃之间,预处理时间可以在约15分钟和约40分钟之间。任选地,预处理温度可以足够低以避免含碱土金属的材料的重结晶。实施例3中示出了热预处理对二氧化碳去除效率的影响。
在一些任选的方面,本方法可包括破碎和/或研磨含碱土金属的材料,以增强与含二氧化碳的气体接触的有效表面,并有利于碱土金属的碳酸化。任选地,可以将含碱土金属的材料破碎和/或研磨,使得材料颗粒的平均尺寸在约10μm和约45μm之间,并且使得至少约90%的固体颗粒具有在约0μm和约75μm之间的粒径。任选地,破碎和/或研磨步骤可以在热预处理步骤之前进行,因为通过使用尺寸减小后的材料颗粒可有利于脱羟基化。
参照图3,本方法可包括在破碎/研磨单元42中破碎和/或研磨含碱土金属的材料6,以减小含碱土金属的材料颗粒的尺寸。然后将破碎和/或研磨后材料6供应至热预处理单元44,用于将其进行如上所述的脱羟基化。可将水8和预处理后的材料6分别地供应至碳酸化单元10,以在碳酸化单元10内形成含水浆料,其用于与供应的含二氧化碳的气体2接触,以产生包含可沉淀碳酸盐的含水浆料18和贫二氧化碳气体16。将含水浆料18供应至分离单元20,以将其分离成含有可沉淀碳酸盐的水相28和固相24。可将固相24的至少一部分25作为碱土金属材料6的至少一部分再循环至破碎/研磨单元42。将至少一部分含有可沉淀碳酸盐的水相28供应至沉淀单元32以沉淀碱土金属碳酸盐并产生沉淀浆料38。可将沉淀浆料38供应至第二分离单元46以将其分离成碱土金属碳酸盐物流50和液体物流48。可将液体流48的至少一部分作为水8的至少一部分再循环至碳酸化单元10。
在一些任选的方面,沉淀碱土金属碳酸盐的步骤可以在约20℃与约80℃之间的沉淀温度下进行,并且在搅拌或不搅拌的情况下,沉淀时间在约0.5小时与约12小时之间。
在一些任选的方面,根据本发明方法生产的碱土金属碳酸盐的沉淀物具有90-99.9%的纯度。
在一些任选的方面,可将含二氧化碳的气体连续供应至碳酸化单元,同时保持一定的或所需的二氧化碳去除效率(参见实施例5)。任选地,该方法可以根据一系列分批操作来操作,包括将物流再循环以增加固体材料碳酸化率(参见实施例6)。例如,可以进行再循环方法方案,使得相同部分的碱土金属材料在沉淀成碱土金属碳酸盐之前将接触几部分含二氧化碳的气体。
在一些任选的方面,本方法可包括再循环从负载碳酸盐的浆料中分离出的固相,以产生新一部分的含水浆料,用于在碳酸化单元中与含二氧化碳的气体接触。应注意,再循环(recycling)在本文中也可称为循环(recirculating)。
图4示出了根据本发明的任选实施方案的与不同液体和固体物流的循环相关的各步骤的方法示意图。实际上可以将多个物流再循环至碳酸化单元,同时将含二氧化碳的气体连续地或以分批模式供应至碳酸化单元。
分批模式供气
在一些任选的方面,可将含二氧化碳的气体通过几个含二氧化碳的气体部分供应至碳酸化单元。
步骤1:
使第一部分含二氧化碳的气体(称为“气体1”)在特定时间内在碳酸化单元中与由“固体1”和“液体”的组合产生的含水浆料接触。例如,含水浆料可具有150g/l的含碱土金属的材料的质量浓度,并且含水浆料可以在30分钟内与每个含二氧化碳的气体部分接触。
在每个30分钟的接触步骤之后,将生成的负载碳酸盐的浆料分离成固相和水相。应注意,第一部分气体“气体1”可以作为两个子部分提供,例如使得符合压力限制。因此,可以在碳酸化单元中连续提供两个子部分的气体,每个子部分与固体接触15分钟。
含二氧化碳的气体和贫二氧化碳气体之间的质量平衡表明,在每个30分钟的接触步骤后,处理最多5.91gco2/l的气体(1.64gc/l的气体)。
步骤2:
然后将水相供应至沉淀单元,并且一旦碱土金属碳酸盐已充分沉淀,将沉淀浆料分离成固体物流和含水物流。
步骤3:
然后将含水物流作为“液体”再循环到碳酸化单元中。
将上述三个步骤1至3重复两次以接触第二和第三部分含二氧化碳的气体(称为“气体2”和“气体3”)。
在与“气体2”和“气体3”接触后,将固相“固体1”干燥、研磨并在前述预处理单元中加热。
将步骤1至3用研磨和加热后的固相“固体1”再进行三次,以依次接触“气体4”、“气体5”和“气体6”。在已接触六个含二氧化碳的气体部分(“气体1”至“气体6”)之后,固相达到其反应性极限。
然后可以用新的含碱土金属材料部分重复上述所有方法步骤。
连续模式供气
在一些其他任选方面,可将含二氧化碳的气流连续供应至碳酸化单元。在分批模式中,要控制的关键参数是一个部分的含二氧化碳的气体的接触时间。或者,在连续模式中,要控制的关键参数是含水浆料中溶解的二氧化碳的量。
根据上述分批模式操作的例子,在每个30分钟的接触步骤之后,处理最多5.91gco2/l的气体(1.64gc/l的气体)。考虑到所有处理后的二氧化碳都溶解在含水浆料中,溶解的二氧化碳的最大浓度不应超过约5.0gc/l。高于该值可能发生反应器内的沉淀。
因此,在连续模式中,一旦在含水浆料中测量到5.0gc/l的溶解二氧化碳浓度,将含水浆料从碳酸化单元中除去并将其分离成固相和水相。然后将水相供应至沉淀单元。
任选地,根据沉淀单元中碱土金属碳酸盐的沉淀速率,可以向水相供应一定体积的水,以便随着这些步骤保持循环水相中的低的溶解二氧化碳浓度。
例如,一旦处理后的二氧化碳的累积量已达到16.04gco2/l的气体(4.4gc/l的气体),可将分离出的固相在进一步再循环之前进行干燥、研磨并加热。
因此,可以按照与上述相同的方案连续地再次执行步骤1至3,以便达到全部系列的三个步骤1至3的约27.28gco2/l气体(7.47gc/l气体)的处理后的二氧化碳的累积量。然后,可使用新一部分的含碱土金属的固体。
应理解,各个方法、方法、系统、用途和材料的上述方面中的任何一个可以与其任何其它方面组合,除非两个方面由于它们的相互排他性而明显不能组合。例如,本文的上下文和/或附图中所述的方法的各种操作步骤可与本文中出现的或根据所附权利要求所述的任何方法、系统或用途的说明组合。
还应理解,在本文的任何示例、表格和说明中所获得和/或描述的各参数值可以被认为是最大值、最小值或中间值,并且可以从如本文或附图和权利要求中所述的这些最大值、最小值或中间值导出各种范围。
在一些实施方式中,mgo生产方法包括用于生产碳酸镁和从含二氧化碳的气体中封存二氧化碳的以上方法。该方法可包括:使含二氧化碳的气体与包括含碱土金属的材料的含水浆料在碳酸化单元中接触,用以将至少一部分碱土金属碳酸化以产生贫二氧化碳的气体和负载碳酸盐的的浆料,负载碳酸盐的浆料包括可沉淀碳酸盐并基本上不含沉淀的碱土金属碳酸盐;将负载碳酸盐的浆料从碳酸化单元中除去,并将负载碳酸盐的浆料分离成包括可沉淀碳酸盐的水相和固相;将水相供应至沉淀单元,并在沉淀单元中沉淀碱土金属碳酸盐,以产生沉淀浆料。
在一些实施方式中,水相可包括可沉淀碳酸盐,并且可基本上不含沉淀的碱土金属碳酸盐。
在一些实施方式中,该方法还可包括在碳酸化单元中的接触步骤期间搅拌包括含碱土金属材料的含水浆料的步骤。任选地,该方法还可包括在沉淀单元中沉淀碱土金属碳酸盐的步骤期间搅拌水相的步骤。
在一些实施方式中,该方法还可包括在接触步骤之前将含碱土金属的材料与水混合以将碱土金属离子溶解在水相中并形成含水浆料的步骤。
在一些实施方式中,该方法还可包括与接触步骤同时进行的将含碱土金属的材料与水混合的步骤,以将碱土金属离子溶解在水相中并在碳酸化单元内形成含水浆料。
任选地,可以进行混合步骤以形成按每升含水浆料的总固体克数计的质量浓度为25g/l至300g/l的含水浆料。
在一些实施方式中,该方法还可包括将沉淀浆料分离成包括碱土金属碳酸盐的固体物流和含水物流。
在一些实施方式中,该方法还可包括干燥包括碱土金属碳酸盐的固体物流。
在一些实施方式中,该方法还可包括将至少一部分含水物流再循环到碳酸化单元中。
在一些实施方式中,该方法还可包括将至少一部分固相作为含碱土金属材料的至少一部分再循环到碳酸化单元中,用于与含二氧化碳的气体接触。
在一些实施方式中,该方法还可包括将含碱土金属的材料进行热预处理使其脱羟基,以产生预处理后的含碱土金属的材料,用于与含二氧化碳的气体接触。任选地,热预处理含碱土金属的材料的步骤可包括在约10分钟至约60分钟的预处理时间内在约500℃至约800℃的温度下加热含碱土金属的材料。任选地,该温度可以在约600℃和约700℃之间,该预处理时间可以在约15分钟和约40分钟之间。
在一些实施方式中,该方法还可包括在与含二氧化碳的气体接触的步骤之前破碎和/或研磨含土碱金属的材料。任选地,破碎和/或研磨步骤可在热预处理含碱土金属的材料的步骤之前进行。进一步任选地,可以进行破碎和/或研磨步骤以获得具有约10μm至约45μm的平均粒径的固体颗粒,以获得90%的粒径在约0μm与约75μm之间的固体颗粒。
在一些实施方式中,含二氧化碳的气体可源自工业排放物并可具有1%与30%之间的二氧化碳浓度。
在一些实施方式中,该方法还可包括控制碳酸化单元中的碳酸化温度、搅拌速度和碳酸化压力中的至少一个。
任选地,在碳酸化单元中接触的步骤可以在约10℃与约40℃之间的碳酸化温度下进行。任选地,该碳酸化温度可以在约20℃至约30℃之间。
任选地,在碳酸化单元中接触的步骤可以在约1bar与约20bar之间的碳酸化压力下进行。任选地,碳酸化压力可以在约2bar与约12bar之间。
任选地,碳酸化单元中的搅拌速度可以在约400rpm与约800rpm之间,并且进一步任选地在约500rpm与约650rpm之间。
在一些实施方式中,沉淀步骤可在约20℃与约80℃之间的沉淀温度下进行约0.5小时与约12小时之间的沉淀时间。任选地,沉淀步骤可包括搅拌水相。
在一些实施方式中,含碱土金属的材料可包括砂岩、花岗岩、斜长岩、玄武岩、蛇纹岩、橄榄岩、蛇纹石化橄榄岩、蛇绿岩、镁铁质和超镁铁岩、含有超过10%的辉石与贵橄榄石的岩石、硅酸钙、硅酸镁、长石、斜长石、贵橄榄石、辉石、橄榄石、蛇纹石、硅灰石、氧化钙、氧化镁、水镁石、镁铁矿和超镁铁矿、炼钢炉渣、炼钢废mgo砖、回转窑尘(ckd,lkd)、废水泥,废弃混凝土、建筑和拆除废物、带有骨料的混凝土、混凝土砖、混凝土、红砖、页硅酸盐采矿残余物和温石棉采矿残余物中的至少一种。
在一些实施方式中,碱土金属可包括钙或镁。
在一些实施方式中,该方法还可包括将含二氧化碳的气体连续供应至碳酸化单元。任选地,该方法可包括控制或管理在碳酸化单元中产生的负载碳酸盐的浆料中溶解二氧化碳的最大量,选择溶解二氧化碳的最大量以减少或避免碳酸化单元中碱土金属碳酸盐的沉淀。任选地,溶解的二氧化碳的最大量可以是至多5g/l。
在一些实施方式中,含二氧化碳的气体可包括多个含二氧化碳的气体部分,该方法包括:将至少一个含二氧化碳的气体部分供应至碳酸化单元;使含水浆料在碳酸化单元中与至少一个含二氧化碳的气体部分接触,以生产负载碳酸盐的浆料;将负载碳酸盐的浆料从碳酸化单元中除去,并将负载碳酸盐的浆料分离成含有可沉淀碳酸盐的水相和固相;将固相再循环至碳酸化单元并将水供应至碳酸化单元,以形成新一部分的含水浆料;使所述新一部分的含水浆料与另一个含二氧化碳的气体部分接触,以生产负载碳酸盐的浆料。
在一些实施方式中,可将含二氧化碳的气体以多个含二氧化碳的气体部分供应至碳酸化单元,该方法包括:使含水浆料在碳酸化单元中与至少一个含二氧化碳的气体部分接触以生产负载碳酸盐的浆料;将负载碳酸盐的浆料从碳酸化单元中除去,并将负载碳酸盐的浆料分离成包括可沉淀碳酸盐的水相和固相;将包括可沉淀碳酸盐的水相供应至沉淀单元,在沉淀单元中沉淀碱土金属碳酸盐以产生沉淀浆料,并将沉淀浆料分离成包括碱土金属碳酸盐的固体物流和含水物流;将固相和含水物流再循环至碳酸化单元以产生新一部分的含水浆料,并使所述新一部分的含水浆料与另一个含二氧化碳的气体部分接触,以产生负载碳酸盐的浆料。
任选地,该方法可包括将水供应到碳酸化单元,作为新一部分的含水浆料的补充物流。
在一些实施方式中,在碳酸化单元中接触的步骤可以进行最大的气体接触时间,控制或管理最大气体接触时间以减少或避免碳酸化单元中碱土金属碳酸盐的沉淀。任选地,最大气体接触时间可在约1分钟与约60分钟之间。
在一些实施方式中,该方法还可包括在再循环至碳酸化单元的步骤之前破碎和/或研磨固相以产生新一部分的含水浆料。
在一些实施方式中,提供了从含二氧化碳的气体中封存二氧化碳的方法。该方法包括:使含二氧化碳的气体与包括含镁材料的含水浆料在碳酸化单元中在约10℃与约40℃之间的碳酸化温度和约1bar与约20bar之间的碳酸化压力下接触以进行至少一部分镁的碳酸化,产生贫二氧化碳的气体和负载碳酸盐的浆料,负载碳酸盐的浆料包括可沉淀碳酸盐并且基本上不含沉淀的碳酸镁。
在一些实施方式中,该方法可包括:将负载碳酸盐的浆料从碳酸化单元中除去并将负载碳酸盐的浆料分离成固相和含有可沉淀碳酸盐并且基本上不含沉淀的碳酸镁的水相;将水相供应至沉淀单元并在沉淀单元中沉淀碳酸镁以产生包括沉淀的碳酸镁的沉淀浆料。
在一些实施方式中,该方法还可包括将沉淀浆料分离成包括沉淀的碳酸镁的固体物流和含水物流。
在一些实施方式中,提供了一种用于从含二氧化碳的气体中封存二氧化碳的方法,该方法包括使含二氧化碳的气体与基本上干燥形式的含碱土金属的材料在至少一个碳酸化单元中在约200℃和约500℃之间的碳酸化温度下并在约1巴和约20巴之间的碳酸化压力下接触,用于其碳酸化以产生碳酸盐和贫二氧化碳的气体。
在一些实施方式中,提供了一种通过使工业排放物与湿的或干的形式的硅酸镁材料接触来从工业排放物中封存二氧化碳的方法,以产生贫二氧化碳的气体和碳酸化的硅酸镁材料。
在一些实施方式中,提供了一种制造碱土金属碳酸盐的方法,该方法包括:接触阶段,其中使包含二氧化碳的工业排放物与包括含碱土金属材料的含水浆料接触以产生贫二氧化碳的气体和基本上不含沉淀的碱土金属碳酸盐的碱土金属碳酸盐物流;沉淀阶段,其中将碱土金属碳酸盐从碱土金属碳酸盐物流中沉淀出来,从而产生沉淀浆料;和分离步骤,其中将沉淀浆料分离成沉淀的碱土金属碳酸盐和水相。
在一些实施方式中,提供了一种制备碱土金属碳酸盐的方法,该方法包括:接触阶段,其中使包括二氧化碳的工业排放物与包括含碱土金属材料的含水浆料接触,以产生贫二氧化碳的气体和碱土金属碳酸盐物流,碱土金属碳酸盐物流包括可沉淀碳酸盐并且基本上不含沉淀的碱土金属碳酸盐;第一分离阶段,其中将碱土金属碳酸盐物流分离成固相和含有可沉淀碳酸盐并且基本上不含沉淀的碱土金属碳酸盐的水相;再循环阶段,其中将固相作为至少一部分含碱土金属的材料再循环至碳酸化阶段;沉淀阶段,其中将碱土金属碳酸盐从水相中沉淀出来,从而产生包括沉淀的碱土金属碳酸盐的沉淀浆料;和分离阶段,其中将沉淀浆料分离成沉淀的碱土金属碳酸盐和水相。
在一些实施方式中,提供了二氧化碳封存系统,用于从含二氧化碳的气体中封存二氧化碳。该系统包括:至少一个碳酸化单元,其具有:气体入口,其用于接收含二氧化碳的气体,浆料入口,其用于接收包括含碱土金属材料的含水浆料,碳酸化容器,其用于用二氧化碳将含水浆料的至少一部分碱土金属进行碳酸化以产生贫二氧化碳气体和包括可沉淀碳酸盐并且基本不含沉淀的碱土金属盐酸盐的负载碳酸盐的浆料,浆料出口,其用于释放包括可沉淀碳酸盐的负载碳酸盐的浆料,和气体出口,其用于释放贫二氧化碳的气体;分离单元,其具有:浆料入口,其用于接收来自至少一个碳酸化单元的浆料出口的包括可沉淀碳酸盐的负载碳酸镁的浆料,分离腔室,其用于将包括可沉淀碳酸盐的负载碳酸盐的浆料分离为固相和包括可沉淀碳酸盐且基本不含沉淀的碱土金属碳酸盐的水相,液体出口,其用于释放水相,和固体出口,其用于释放固相;和沉淀单元,其具有:浆料入口,其用于接收来自分离单元的液体出口的包括可沉淀碳酸盐的水相,沉淀腔室,其用于沉淀碱土金属碳酸盐并形成沉淀浆料,和液体出口,其用于释放沉淀浆料。
在一些实施方式中,提供了含水浆料形式的含镁材料的用途,用于在约20℃与约30℃之间的温度和约2bar与约12bar之间的压力下从含二氧化碳的气体接触并封存二氧化碳,以形成碳酸镁。
在一些实施方式中,提供了页硅酸盐开采残余物用于从工业排放物中封存二氧化碳并生产碳酸镁的用途。任选地,页硅酸盐开采残余物包括利蛇纹石、叶蛇纹石、水镁石、氧化铁、氧化铬和温石棉中的至少一种。
在一些实施方式中,提供沉淀的碳酸钙或碳酸镁(pcc或pmc),其通过使含钙或镁的材料以湿的形式与来自工业排放物的二氧化碳在碳酸化单元中接触以形成负载碳酸盐的浆料,并在沉淀单元中从负载碳酸盐的浆料沉淀出碳酸钙或碳酸镁而生产。
在一些实施方式中,提供沉淀的碳酸钙或碳酸镁(pcc或pmc),其包含至少95wt%的干燥形式或水合形式的碳酸钙或碳酸镁。
还应注意,煅烧废气中较高的co2含量对于碳酸化反应是优选的,并且将提高整个工艺效率。在某些情形中可以进行煅烧以获得更高的co2含量,例如通过在一定的操作条件下运行煅烧单元并使用一定的反应物。例如,在一些实施方式中,可以运行煅烧单元以通过确保所使用的天然气或其他可燃物的完全燃烧来增加排放物中的co2浓度,这可包括提供过量的预热后的空气以促进完全燃烧并减少可燃物的消耗。可以相应地控制空气的进料速率,并且可以适当地密封煅烧单元以将可能稀释系统的其他气体的引入最小化。另外,煅烧单元可以通过增加气体进料中的氧含量来运行,从而降低空气中将存在的其他气体组分的浓度。可以提供氧气水平和/或可以以其他方式运行煅烧单元,使得所得排放物的co2含量高于进料至碳酸化单元的烟气的co2含量。以这种方式,co2从煅烧到碳酸化步骤中的再循环可以增加co2浓度,从而提高整体性能。在一些示例中,再循环的排放物的co2浓度可比烟气中的co2浓度大至少1%、2%、5%、10%、15%、20%、25%、30%、40%或50%。
在一些实施方式中,本方法包括使含co2的物流与含镁材料接触以产生碳酸镁;对碳酸镁进行煅烧以产生含co2的气体副产物和氧化镁,该含co2的气体副产物具有比含co2的物流更高的co2浓度;并且将至少一部分含co2的气体副产物再循环用于接触含镁材料以产生碳酸镁。含co2的物流可来自第一排放源,并且可以是烟气(例如,来自发电厂或另一排放源)。例如,含co2的物流可具有10wt%至20wt%的co2含量。含co2的气体副产物可具有较高的co2含量,其可高出几个百分点(例如,12wt%至22wt%的co2)或可高出相当多(例如,30wt%、40wt%、50wt%或甚至接近100wt%的co2)。
应注意,优选的操作是提供含co2的气体副产物,其co2含量比含co2的物流的co2含量高一定比例(例如,10%至50%)。例如,含co2的物流可具有约15wt%的co2含量,而含co2的气体副产物可具有约18wt%的co2含量(其高出20%)。这可以在没有用纯氧操作煅烧单元的额外费用的情况下实现,而是使用对煅烧单元的操作参数的控制。
然而,应注意,在替代实施方案中,该方法可以操作为使得再循环的含co2的气体副产物与进料到碳酸化步骤中的初始的含co2烟气相比具有较低的co2浓度,或者通常类似的co2含量。当在两气体物流中看到相对可变的co2含量时,可以修改相对比例以获得进料至碳酸化单元的恒定co2含量,或者可以将这两种物流供应至碳酸化而不进行浓度控制,从而导致反应气体中可变的co2含量。还应注意,两种含co2的物流可以通过不同的进料入口或相同的进料入口进料至相同的碳酸化容器,或者它们可以进料到不同的碳酸化容器,或其组合。
实施例及实验
实验1:温石棉采矿残余物的湿碳酸化
采用由利蛇纹石、叶蛇纹石、水镁石、铁氧化物、铬氧化物和低含量温石棉组成的温石棉采矿残余物进行第一系列实验,以优化约7g的样品量、粒度低于75μm、浆料密度为15%(每升液体150g固体的量)下的湿式碳酸化的条件。温度和反应持续时间分别保持稳定在25℃和6h。可变参数是压力、nacl和nahco3含量以及是否为经热处理的样品。基于co2去除百分比和形成的固体碳酸盐百分比(因变量)将它们优化。各种条件及所得结果在表1中给出。
从该表中可以看出,10.2atm的压力和经热处理的样品可以实现最高达87%的co2去除率。co2去除率似乎与nacl含量无关,并且略微依赖于溶液中的nahco3含量,而热预处理是必要的。在这些条件下进行6h,24%的样品已经碳酸化。
表1第一组测定和结果的box-benkhen矩阵(t=25℃,t=6h)
在优化条件下碳酸化6小时的持续时间非常长,进行更短反应时间的碳酸化测定,以验证湿式碳酸化率的时间依赖性。该试验条件和结果呈现在表2中。温度保持恒定在25℃,浆料密度保持恒定在15%。
表2经热处理的样品湿式碳酸化30分钟的实验条件和结果
30min的反应时间后获得co2的82%的去除率。
实验2-蛇纹岩的湿式碳酸化
本实验描述了本方法在15分钟内处理一批含18.2%二氧化碳的气体的可行性。气液比(glr)固定在300%,这表示含二氧化碳的气体体积为225ml,水体积为75ml。所得含水浆料的固体材料浓度为15wt%。将反应温度设定为环境温度(18-25℃)。施加10.5bar的压力,其表示在20℃下0.78g的co2量。一旦达到该压力,关闭反应器的所有阀门并发生反应15分钟。然后通过袋子对所得的贫二氧化碳气体进行取样。通过co2分析仪测量该贫二氧化碳气体中的二氧化碳浓度。过滤所得水性浆料,取样进行分析。
如表3可见,在环境温度下在10.5bar下反应15分钟显示出88±1%的co2去除效率。
表3:10.5bar下反应15分钟的二氧化碳质量平衡(测试数量=3)
实验3-蛇纹岩在湿式碳酸化前的热预处理的优化
进行另一系列实验以显示含碱土金属材料的热预处理有利于从含二氧化碳气体中良好地除去二氧化碳。
将基于蛇纹岩的采矿残余物用作含碱土金属材料。首先,根据粒度将残余物破碎,然后研磨。使用粒径小于45μm(平均粒径10μm)的样品获得最佳结果。为了获得化学反应性材料,必须进一步预处理该基于蛇纹岩的采矿残余物以使蛇纹岩脱羟基。通过从矿物的各种晶体结构中除去水,改变了样品的化学结构,从而降低了结合能。众所周知,水合硅酸盐的热活化有助于浸滤之前的化学活化。(nagamori等,(1980)activationofmagnesiainserpentinebycalcinationandthechemicalutilizationofasbestostailings–areview.cimbulletin73,第144-156页)
根据浸溶于水(烧杯)中之后的镁浓度进行热预处理的优化。参考图5和6,已经研究了温度和预处理时间以及在600rpm搅拌下在水中提取30分钟期间的浆料密度的影响。根据热重分析,在650℃观察到所研究样品的主要失重。关于热活化的论文表明,在650℃下处理30分钟后获得最佳结果,失重约10%。
实验4-湿式碳酸化的反应参数的优化
已经进行了另一系列实验以优化反应参数,包括碳酸化压力、反应时间、气/液比(glr)和含水浆料的浆料密度。为了提高气态二氧化碳在水中的溶解度,将反应温度设为室温(18-25℃),因为在较低温度下溶解度增加。压力是关键的工艺参数,因为它影响引入反应器中的二氧化碳的量。
用特性与水泥厂烟气相当的含二氧化碳气体进行该实验。其组成分别为18.2%co2、4.11%o2和77.69%n2。反应在购自parrinstrumentcompany,molineilusa的300ml搅拌反应器中实现。
压力
对压力效应的测试表明,在低压下操作不影响反应效率。实际上,降低压力导致在反应器中引入少量二氧化碳。对于分批实验,为了保持引入反应器中的一定量的二氧化碳,将压力设定为10.5bar。
glr和浆料密度
通过一组实验确定诸如气/液比(glr)和浆料密度的参数,反应时间为30分钟。降低glr不会影响从烟气中去除二氧化碳,但会减少引入反应器中的二氧化碳量。另一方面,当浆料密度设定为5%时,处理的烟气的量较低。为了增加处理的气体量,用连续批次的气体实现关于glr和浆料密度的实验。
由于目的是形成具有再售潜力的碱土金属碳酸盐,因此使最纯的终产品成为可能是重要的。glr为100%且浆料密度为15%的实验表明,在反应器内沉淀了大量的碳酸盐。然而,可能期望使碳酸盐沉淀在反应器外部,以便容易地分离可沉淀碳酸盐,然后获得具有约95%的高纯度的碳酸盐。图7表明,含水浆料的浆料密度为15%且glr为300%时,出现了良好的co2去除率和溶液中高浓度的镁。
一旦反应的主要参数确定,反应时间就减少了。
反应时间
进行了一系列实验以减少反应时间。图8示出了二氧化碳去除结果。对于5分钟的反应时间,去除率为56%,对于10分钟的反应时间,去除率为83%。在15分钟内实现了与30分钟时观察到的相同的效率。然而,存在于溶液中的镁的量乘以1.45,分别为30分钟时的341mg/l和15分钟时的495mg/l。15分钟的停留时间对于工业应用是合理的并且提供更好的镁溶解效率。
实验5-连续操作下蛇纹岩的湿式碳酸化
在连续条件下实现了实验。目的是确认在温和的压力和温度条件下反应的可行性。用质量流量控制器调节含二氧化碳气体的流速。通过设定为所需压力的压力计来控制反应器中的压力。实验在3.4bar下进行,含二氧化碳气体的流速为42ml/min(7.64mlco2/min)。参考图9,在约50min的平衡阶段之后,观察到在130min期间二氧化碳去除的效率保持恒定在98%以上。然后,效率呈线性趋势下降。最终,反应的二氧化碳总量为引入的3.19gco2中的2.61gco2。与引入反应器的材料的初始镁含量相比,镁的总浸出率为50.8%。
实验6-循环方案
循环方案基于用经循环的固体物流和液体物流处理多个“批次”的含二氧化碳的气体。在与实施例2中限定的相同条件下对一系列6批气体进行了实验。术语“批次”在本文中定义为225ml气体(0.78gco2)在10.5bar下在600rpm的搅拌下反应15min。
含水浆料由75ml水中的15%固体组成,并与两批含二氧化碳气体接触,然后过滤成固相和水相。将相同的经过滤的固相再次混合在75ml“新”水(或循环水)中,以接触另外两批含二氧化碳气体。对共计6批含二氧化碳气体重复该操作。每次过滤后,将富含溶解镁和二氧化碳的经过滤的水性物流供入沉淀器中以沉淀碳酸镁。
沉淀条件设定为40℃,300rpm搅拌。将经过滤的固相在接触6批含二氧化碳气体之后进行研磨并加热,以进一步改善镁的浸滤。然后,将经处理的固相在反应器中循环,以接触另外6批含二氧化碳气体。
因此,总共12批含二氧化碳气体用相同的固相进行了处理。在接触两批含二氧化碳气体后过滤水相,并在接触两批含二氧化碳气体后使用新的水。
结果总结在表4中。假定水相中所含的所有镁都沉淀了,则与12批气体接触后固体材料的碳酸化率为64%。
实验7-干式气-固碳酸化
实施例7描述了根据本发明可选实施方案的干式气-固碳酸化实验。
在这一系列实验中,含碱土金属的材料是来自塞特福德矿区(thetfordmines)的温石棉采矿残余物,直接采自残余物输送机的出口。将温石棉残余物破碎并研磨至约50微米的小粒径。该反应在parrinstrumentcompany的微型平台顶部反应器4560(minibenchtopreactor4560)中进行。在该反应之后,将气体取样于配备有开/关阀的3.8l的tedlar袋中。用co2,quantekinstruments,906型测量出口气体中的二氧化碳浓度。
对直接干式气固碳酸化具有显著影响的不同参数的优化用常规单次单一变量法和统计响应曲面法两者进行。
使用常规单一变量法对参数的优化
进行了一系列实验,以通过常规单次单一变量法优化最适合直接干式气-固碳酸化的条件。基于co2去除百分比(因变量)优化在不同温度和压力下的碳酸化表现。评估了初始的、非磁性(non-mag)的和经热处理的样品的优化条件。表5中给出了每种样品的优化条件。
表5用不同类型的样品进行直接干式气-固碳酸化的优化条件
将直接干式碳酸化的操作条件优化为在5atm的压力、200℃的温度下持续6h。用初始经热处理的(在630℃下30min,并研磨)样品获得36.8%的最大co2去除率。
用box-behnken设计对参数的优化
所选独立变量是温度(x1)、压力(x2)和时间(x3),所选独立响应变量是co2去除率y1(%)和压力变量y2(kpa)。由于去除co2是本实验中的关键因素,因此本研究的重点是co2去除百分比。因此,选择co2去除百分比作为该模型中的主要响应曲面。所有试验均使用25g经热处理的(630℃,30min)样品。
图10示出了co2去除率(%)的响应曲面图,并且从图中可以清楚地看出,co2去除率(%)在低压且高温区域处于其最大值。最佳条件和优化值的验证在表6中列出。通过anova来分析预测的co2去除率(%)响应曲面的二次回归参数的方差分析。
30.56的模型f值和小于0.050的低概率值“prob>f”意味着模型有重要意义。多元回归系数的值(r2=0.9752)表明,仅2.5%的总变差不能用经验模型来解释。该模型可以解释97.5%的响应变化率。发现co2去除率(%)的r2(0.9752)与调整后的r2值(0.9433)合理地一致。预测的r2(0.70)与调整后的r2合理地一致。
获得了使用box-behnken设计进行直接干式气-固碳酸化的优化条件,即在258℃、5.6atm下进行310min。在上述条件下预测co2去除率为40.1%。
模型的验证表明co2去除率为37%,接近预测值。
表6响应曲面模型(rsm)的验证实验
*由模型所选的变量的最佳值。
**根据模型的每个响应的预测值。
还在由响应曲面法所得的优化条件下对原始和非磁性样品进行了碳酸化研究。该实验和结果在表7中给出,表中表明在优化条件下三种类型样品的co2去除率(%)在接近的范围内。这表明样品的预处理对co2去除率(%)没有任何显著影响。
表7由不同类型样品在响应曲面法所确定的优化条件下进行直接干式气-固碳酸化的实验条件和结果
由于在优化条件下碳酸化的持续时间非常长,为310min,因此进行较短反应时间的碳酸化测定,以验证干式碳酸化率的时间依赖性。实验和结果呈现于表8中。
表8原始样品在优化的温度和压力下持续15min进行直接干式碳酸化的实验条件和结果
从结果发现,大百分比的反应发生在碳酸化反应的初始阶段。该反应在258℃、5.53atm下15min内实现了约36%的co2去除率。这表明碳酸化的主要百分比发生在一定时限内,此后反应可能变得较为不重要。图11中给出的压力变化曲线支持上述说法。在最初几分钟内压力的突然降低表明反应在初始时快速发生,然后变得非常缓慢或恒定的压力降低表明了碳酸化发生得非常缓慢或达到平衡。加入co2气体混合物后压力和温度立即升高可能是由于反应的放热特性。一定时间后反应速率的降低可能是由于产物层的形成,这可能进一步阻碍co2的向内扩散和水的向外扩散。较小的表面更新率也可以降低碳酸化率,其可以通过充分混合以增加颗粒磨耗和磨损的速率来增加。
实验8-co2去除效率的比较
已经进行了实验以比较各种含碱土金属材料的湿式和干式碳酸化的co2去除效率。
湿式碳酸化的结果示于表9中,干式碳酸化的结果示于表10中。
表9在环境温度、p=10.5bar下15min内150g/l固体的湿式碳酸化
表10:在t=258℃、p=4bar下30min内1.5g固体的干式碳酸化
实验8:氧化镁生产
以下结果说明了与常规方法相比本文所述的氧化镁生产方法的益处。基于使用蛇纹岩碳酸化过程所得的实验数据进行的技术模拟获得以下数据。假设来自整个mgco3煅烧过程的co2损失为零。基于总过程能量需求(碳酸化+煅烧=1139kwh/t固体)并使用反应式1的化学计量来计算煅烧co2副产物排放物。不考虑co2等效排放物(来自其他温室气体),并且co2排放物被认为是在本体系中的主要排放物。
基于情形2,每年179000tmgo的产量可以处理来自工业排放源的184000tco2,并可得到87000tco2排放物。相比之下,遵循常规工艺的类似的mgo生产将产生263000tco2。因此,co2减排量为176000tco2(263000-87000),提供每年360000tco2(176000+184000)的总节省。
确定9-排放物对比
由mgco3煅烧过程产生的co2排放物可包括10%至23%的co2。利用本文所述的技术,使用mg硅酸盐从烟气(例如18.2%co2)生产mgco3,证实了其与所述的mgo生产相关co2排放物的适用性。例如,煅烧排放物可包括与烟气类似的co2含量,因此碳酸化步骤可利用烟气和煅烧排放物两者作为co2源,并具有足够的操作表现一致性。
实验10-碳酸盐煅烧
这涉及将由本文所述技术生产的水碳镁石(mgco3·3h2o)在950℃下煅烧成氧化镁(mgo)。mgco3·3h2o在沉淀步骤(步骤32)期间产生。实验在电加热实验室规模的回转窑中进行。该窑的内径和长度分别为44.45和1000mm。通过在0.18g/min的恒定速率下加热5.0g材料进料来实现煅烧。控制面板将窑的速度设定为3rpm。加热引起的质量损失为68%。这突出了水碳镁石分解为mgo,同时失去co2和h2o。
- 还没有人留言评论。精彩留言会获得点赞!