一种从锂矿石中提取锂盐的方法与流程
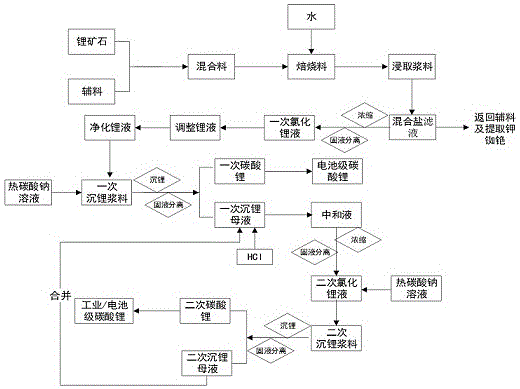
本发明涉及一种提取锂盐的工艺方法,适用于以锂矿石为原料提取制备锂盐,属于稀有金属提炼
技术领域:
。
背景技术:
:锂盐尤其是碳酸锂广泛应用于玻璃、陶瓷、润滑剂等领域,在高新
技术领域:
如锂电池、核能、航空航天等领域也有广泛的应用。尤其是近年来新能源汽车行业、大规模能量存储设备、3c设备、可穿戴设备等迅速发展下,全球市场对碳酸锂的需求量正在逐年增加。全球锂资源可分为矿石和卤水资源,其中矿石资源主要是锂辉石、锂云母、磷锂铝石、锂长石。我国主要富产锂辉石和锂云母,但锂辉石主要分布于四川阿坝、甘孜州一带,交通不便,开采较为困难;我国工业使用的优质锂辉石主要进口自澳大利亚和非洲,长期受制于他国。我国还有丰富的锂云母,其中江西宜春钽铌矿伴生锂云母、铷、铯的多金属矿床是世界上已知的最大伴生云母矿床,其氧化锂含量为3~4.5%,具有较好的工业应用价值。硫酸法是目前从锂辉石中提取锂盐的主要工业化生产方法。专利cn102701239b一种从锂辉石提锂制备单水氢氧化锂的方法;专利cn107915240a一种硫酸法生产电池级碳酸锂的方法均为硫酸法。目前从锂云母中提锂的方法主要有硫酸法、石灰石法、压煮法、盐酸法、复盐法、一步氯化焙烧法等。其中石灰石法应用最早,但物料流通量大、能耗高、收率低,已逐渐被淘汰。硫酸浸取法为目前比较广泛使用的工业化生产方法,专利cn101186968a硫酸法锂云母提锂工艺中精硫酸锂溶液的生产方法是硫酸法的代表工艺,其工艺流程如下:浸出一冷却析矾一除酸一除铝一除杂一除钙,得到精硫酸锂溶液,其中分离钾钠铷铯采用冷冻法。硫酸法的主要缺点是①浸取时硫酸需要大量过量,铝元素被大量进出,导致中和渣量大,生产效率低;②浸取时间长,需要8h以上,能耗高;③浸取时,氢氟酸挥发,对设备腐蚀极为严重,对环境也不友好。此外,硫酸复盐工艺也逐渐被使用。中国陶瓷工业(2018年6月)文献锂云母制备碳酸锂工艺的研究报道了将锂云母:硫酸钾:硫酸钠:氧化钙=20:7:3:1时,其转化率可达97%,锂云母:硫酸钠:氧化钙=40:15:4时,转化率达到95%。硫酸盐法的优点是前期焙烧转化率较高,但硫酸钠、硫酸钾易和硫酸锂在溶液中生成复盐,导致后期收率和效率降低。技术实现要素:本发明所要解决的技术问题是:提供了一种从锂矿石中提取锂盐工艺方法,使用氯化复盐焙烧法来提取锂盐;焙烧时矿物中的锂、钠、钾、铷、铯均被反应且反应率高;提取过程中酸碱消耗量较低、副产物可重复利用或综合利用;所得产品品质稳定,其中达到电池级产品指标要求的占比92%以上;工艺流程短,易于实现工业化;其中的氟被固定,对环境友好;分离采用物理法使锂与钾、钠、铷、铯分离,物料消耗少,能耗低。总体工艺简单、实用性强、成本低、副产物少,综合效益高,易于实现工业化生产。本发明从锂矿石中提取锂盐的技术方案是:(1)将锂矿石与辅料混合,得到混合料;所述辅料为氧化钙(或碳酸钙或氢氧化钙)、氯化钙与氯化钠(或氯化钾)中的1~4种混合,其重量比例为锂矿石:氧化钙(或氢氧化钙或碳酸钙):氯化钙:氯化钠(或氯化钾)=100:(0~30):(30~120):(0~50);其中,当氧化钙与碳酸钙、氢氧化钙混合使用时,三者为任意重量比例;当氯化钠与氯化钾混合使用时,两者为任意重量比例;(2)将步骤(1)所得混合料于700~1050℃进行焙烧反应,得到焙烧料;(3)将步骤(2)所得焙烧料冷却,按固液重量比为1:(1~2)加入浸取水,搅拌反应使可溶性锂钠钾铷铯盐浸出,得到含混合盐溶液和硅铝酸盐固体的浸取浆料;(4)将步骤(3)所得浸取浆料进行固液分离,得到硅铝酸盐固体滤渣和混合盐溶液,硅铝酸盐固体滤渣另行处理;(5)将步骤(4)所得混合盐滤液进行浓缩,浓缩至氯化锂浓度为120~600g/l,得到浓缩液并析出大部分钠钾铷铯等固体杂质,得到浓缩液;(6)将步骤(5)所得浓缩液进行固液分离,去除固体杂质,得到一次氯化锂液;所得固体为钠钾铷铯混合盐,另行处理;(7)将步骤(6)所得一次氯化锂液调整锂浓度至20~40g/l,得到调整锂液;(8)将步骤(7)所得调整锂液含按残余金属杂质(二价及以上)量加入碳酸钠和氢氧化钠并过滤,得到净化锂液;(9)将步骤(8)所得净化锂液,按残余钙含量加入edta,与热碳酸钠溶液混合,得到一次碳酸锂沉淀和含氯化钠、少量氯化锂的一次沉锂浆料。反应方程式如下:2licl+na2co3=li2co3+2nacl(1)(10)将步骤(9)所得一次沉锂浆料进行固液分离,得到一次碳酸锂和含氯化钠、少量氯化锂的一次沉锂母液;(11)将步骤(10)所得一次碳酸锂进行洗涤、干燥和细磨,可得电池级碳酸锂。洗水返回步骤(3)做浸取水用;(12)将步骤(10)所得一次沉锂母液以盐酸中和,得到中和液。反应方程式如下:na2co3+2hcl=2nacl+h2o+co2↑(2)li2co3+2hcl=2nacl+h2o+co2↑(3)(13)将步骤(12)所得中和液蒸发浓缩,析出大部分钠钾铷铯盐,并固液分离,得到二次氯化锂液;(14)将步骤(13)所得二次浓缩液与碳酸钠热溶液混合,得到碳酸锂沉淀和含氯化钠、少量氯化锂的二次沉锂浆料,反应方程式同式(1);(15)将步骤(14)所得二次沉锂浆料进行固液分离,得到二次碳酸锂和含氯化钠、少量氯化锂的二次沉锂母液;(16)将步骤(15)所得二次碳酸锂进行洗涤、干燥和细磨,可得电池级或工业级碳酸锂,洗水返回步骤(3)做浸取水用;(17)将步骤(15)所得二次沉锂母液,并入步骤(10)的一次沉锂母液中,以下重复步骤(12)~(16),形成闭路循环。本发明的主要特点是:1、焙烧反应时同时提取了锂、钾、铷、铯,效率高,综合利用率高。锂辉石中,除了里锂以外,还含有少量的钠、钾、铷、铯。锂云母中,除了锂以外,还含有大约是锂含量2倍的钾,钾是农业生产所必需的营养元素;此外还含有1%左右的铷及0.35%左右的铯,均具有很高的工业利用价值。本发明利用锂矿石易于和氯化盐反应,并生成溶解度很高的氯化锂、氯化钾、氯化铷、氯化铯,极易以水提取,洗涤容易,硅铝酸盐渣中夹带极少。2、分离氯化锂与氯化钠、氯化钾、氯化铷、氯化铯的方法巧妙。巧妙利用在氯化锂浓度较高的情况下,氯化钠、氯化钾、氯化铷、氯化铯溶解度会降低的同离子效应,将浸出混合盐溶液浓缩至一定浓度,即可将大部分的氯化钠、氯化钾、氯化铷、氯化铯析出,且锂损很小,相对于硫酸锂易与硫酸钠、硫酸钾形成复盐而夹带许多锂,大幅度提高了收率。3、可一步沉淀法制得电池级碳酸锂。相对于传统的硫酸法而言,其中的钾分离不完全。尤其是以锂云母为原料制得的碳酸锂,其中产品中的钾含量通常高达0.01%以上,而电池级产品对钾的要求是0.001%,超标了10倍,因此只能做工业级销售,仅因为一个指标不合格,其价格相差了20%,既浪费了原料,又大幅度降低了厂商的经济效益。有些工厂进行氢化提纯,既增加了成本,富集的钾也很难处理,会大幅度减少一次收率。以锂辉石为原料制得的氯化锂,其钾含量通常在0.15%以上,难以用常规方法除去。本发明通过热析工艺分离了大部分钾,使溶液中的钾含量很低,可以通过一步沉淀法制得电池级碳酸锂,工艺流程短,生产成本低。4、复盐辅料简单易得,辅料可重复循环使用。本发明所使用的氧化钙、氢氧化钙、碳酸钙、氯化钙、氯化钠、氯化钾、盐酸、碳酸钠、氢氧化钠均为工业常见产品,价格低廉。其中氯化钠、氯化钾为本发明的副产物,可直接返回前工序使用。5、收率高。对锂含量为1.44%(折氧化锂3.1%)的锂云母和锂含量为2.79%(折氧化锂6.0%)的锂辉石而言,其中硅铝酸盐渣带氧化锂可低至0.2%以下,浸出率达到93%以上;混合盐中带锂可低至0.1%以下,总收率为90%以上。6、工艺流程简单,易于实现工业化生产。整个工艺流程短,浸出率高、回收率高;不使用价格昂贵的辅料;采用物理法分离主要复盐杂质,不使用有机物;对原料要求低,即可处理低锂含量的锂云母,也可处理高锂含量的锂辉石;易于实现工业化生产。本发明的有益效果是:1、能有效处理各种高低含量的锂矿石,实验室对氧化锂含量3.1~7.5%的锂矿进行了实验,结果表明均有较好的浸出率,锂的浸出率≥96%、铷、铯、钾的浸出率≥97%。2、综合利用率高。除了提取锂以外,对钾、铷、铯也可进行回收,提锂尾矿也有很好的综合利用的价值。具备较好的经济效益和社会效益。3、易于实现工业化生产。所用原辅料均为厂家工业化产品,售价低、易采购;工艺流程短、除杂效率高,易于实现产业化。附图说明图1是本发明从锂矿石中提取锂盐的工艺流程图。具体实施方式以下通过具体实施方式对本发明作进一步的详细描述,但并不限制本发明,本领域技术人员根据本发明作出各种改变和替换,只要不脱离本发明的精神,均应属于本发明所附权利要求的范围。以下是具体实施例。所述实施例以制备碳酸锂为目标,其中的过程产品为含杂质的氯化锂,此氯化锂可进一步纯化处理,制备工业级或更高纯度的氯化锂。实施例1(1)称取氧化锂含量为7.5%的锂辉石5000g,加入氯化钙4800g,混合均匀;于1050℃焙烧60min,得到焙烧料;取出,冷却至室温后,加入12000ml水,搅拌30min,过滤,得到滤液和滤渣。表1锂辉石数据,%li/li2okrbcs3.49/7.500.350.100.035表2滤液数据,g/llinak14.521.031.44表3滤渣数据,%likrbcs锂渣0.070.030.00150.0007浸出率99.0791.4398.5098.00(2)将步骤(1)所得滤液进行浓缩,将所得浓缩进行固液分离,液数据如下:表4浓缩液数据,g/lliclnakrbcs4003.0220.162.21.9(3)所得浓缩液可进一步除杂,制备电解用氯化锂。(4)将步骤(2)所得浓缩液调整至锂含量为27g/l,按残余二价级以上金属阳离子含量加入略微过量的碳酸钠和氢氧化钠,过滤分离二价及以上金属阳离子沉淀,得到净化锂液。(5)将净化锂液与热的碳酸钠溶液混合,固液分离,得到一次碳酸锂沉淀与沉锂母液。一次碳酸锂经洗涤,可得到电池级碳酸碳酸锂。表5一次碳酸锂数据,%li2co3nakcamgfe99.850.0140.00030.00070.00010.0002also42-cl-sirb酸不溶物0.0001未检出0.00070.0050.0003<0.0050(6)将步骤(5)所得沉锂母液加盐酸中和,得到中和液。将中和液蒸发浓缩浓缩至锂含量为20g/l左右,固液分离得到二次氯化锂液和固体混合盐,混合固体盐经洗涤后另行处理。(7)将步骤(6)所得二次氯化锂液与热的碳酸钠溶液混合,得到二次碳酸锂与二次沉锂母液。二次碳酸锂经洗涤、干燥,可得电池级或工业级碳酸锂。(8)将步骤(6)所得二次沉锂母液与一次沉锂母液合并,以盐酸中和,以下同步骤(6)、(7),形成笔录循环。实施例2(1)称取氧化锂含量为6.0%的细磨β锂辉石2000g,加入2400g氯化钙、1000g氯化钠、氯化钾混合盐,混合均匀;于920℃焙烧20min,得到焙烧料;取出,冷却至室温后,加入4000ml水,搅拌30min,过滤,得到滤液和滤渣。表6锂辉石数据,%li/li2okrbcs2.79/6.000.400.100.035表7滤液数据,g/llinak13.8849.1166.85表8滤渣数据,%li2co3nakcamgfe99.850.0140.00030.00070.00010.0002also42-cl-sirb酸不溶物0.0001未检出0.00070.0050.0003<0.0050(2)将步骤(1)所得滤液进行浓缩,将所得浓缩进行固液分离,液数据如下:表9浓缩液数据,g/lliclnakrbcs6002.0215.312.011.83(3)将步骤(2)所得浓缩液调整至锂含量为22g/l,按残余二价级以上金属阳离子含量加入略微过量的碳酸钠和氢氧化钠,过滤分离二价及以上金属阳离子沉淀,得到净化锂液。(4)将净化锂液与热的碳酸钠溶液混合,固液分离,得到一次碳酸锂沉淀与沉锂母液。一次碳酸锂经洗涤,可得到电池级碳酸碳酸锂。表10一次碳酸锂数据,%li2co3nakcamgfe99.850.0140.00030.00070.00010.0002also42-cl-sirb酸不溶物0.0001未检出0.00070.0050.0003<0.0050(5)以下步骤同实施例1步骤(6)~(8)。实施例3(1)称取氧化锂含量为5.3%的细磨锂辉石6000g,加入碳酸钙500g、3600g氯化钙、2000g氯化钠,混合均匀;于990℃焙烧60min,得到焙烧料;取出,冷却至室温后,加入15l水,搅拌30min,过滤,得到滤液和滤渣。表11锂辉石数据,%li/li2okrbcs2.46/5.300.700.090.031表12滤液数据,g/llinak9.7152.682.75表13滤渣数据,%likrbcs锂渣0.110.040.00270.0011浸出率95.5394.2997.0096.45(2)将步骤(1)所得滤液进行浓缩,将所得浓缩进行固液分离,液数据如下:表14浓缩液数据,g/lliclnakrbcs5002.0215.312.011.83(3)将步骤(2)所得浓缩液调整至锂含量为22g/l,按残余二价级以上金属阳离子含量加入略微过量的碳酸钠和氢氧化钠,过滤分离二价及以上金属阳离子沉淀,得到净化锂液。(4)将净化锂液与热的碳酸钠溶液混合,固液分离,得到一次碳酸锂沉淀与沉锂母液。一次碳酸锂经洗涤,可得到电池级碳酸碳酸锂。表15一次碳酸锂数据,%li2co3nakcamgfe99.890.0140.00010.00070.00010.0002also42-cl-sirb酸不溶物0.0001未检出0.00070.00050.0002<0.0050(5)以下步骤同实施例1步骤(6)~(8)。实施例4(1)称取氧化锂含量为4.5%的锂云母10kg,加入1kg氧化钙、3kg氯化钙、2kg氯化钠,混合均匀;于700℃焙烧40min,得到焙烧料;取出,冷却至室温后,加入20l水,搅拌60min,过滤,得到滤液和滤渣。表16锂辉石数据,%li/li2okrbcs2.09/4.510.711.000.35表17滤液数据,g/llinak9.3538.7747.88表18滤渣数据,%likrbcs锂渣0.090.350.00410.0018浸出率95.6996.7399.5999.48(2)将步骤(1)所得滤液进行浓缩,将所得浓缩进行固液分离,液数据如下:表19浓缩液数据,g/lliclnakrbcs2507.0219.92.112.05(3)将步骤(2)所得浓缩液调整至锂含量为40g/l,按残余二价级以上金属阳离子含量加入略微过量的碳酸钠和氢氧化钠,过滤分离二价及以上金属阳离子沉淀,得到净化锂液。(4)将净化锂液与热的碳酸钠溶液混合,固液分离,得到一次碳酸锂沉淀与沉锂母液。一次碳酸锂经洗涤,可得到电池级碳酸碳酸锂。表20一次碳酸锂数据,%li2co3nakcamgfe99.660.0140.00070.00070.00010.0002also42-cl-sirb酸不溶物0.0001未检出0.00110.00050.0006<0.0050(5)以下步骤同实施例1步骤(6)~(8)。实施例5(1)称取氧化锂含量为3.9%的锂云母20kg,加入6kg氢氧化钙、14kg氯化钙、5kg氯化钠、氯化钾的混合盐,混合均匀;于920℃焙烧60min,得到焙烧料;取出,冷却至室温后,加入40l水,搅拌40min,过滤,得到滤液和滤渣。表21锂辉石数据,%li/li2okrbcs1.81/3.99.770.970.36表22滤液数据,g/llinak9.0147.7651.33表23滤渣数据,%likrbcs锂渣0.110.410.00550.0023浸出率93.9295.8099.4399.36(2)将步骤(1)所得滤液进行浓缩,将所得浓缩进行固液分离,液数据如下:表24浓缩液数据,g/lliclnakrbcs12045.7271.094.981.77(3)将步骤(2)所得浓缩液调整至锂含量为30g/l,按残余二价级以上金属阳离子含量加入略微过量的碳酸钠和氢氧化钠,过滤分离二价及以上金属阳离子沉淀,得到净化锂液。(4)将净化锂液与热的碳酸钠溶液混合,固液分离,得到一次碳酸锂沉淀与沉锂母液。一次碳酸锂经洗涤,可得到电池级碳酸碳酸锂。表25一次碳酸锂数据,%li2co3nakcamgfe99.580.0140.00090.00110.00010.0002also42-cl-sirb酸不溶物0.0001未检出0.00130.00050.0011<0.0050(5)以下步骤同实施例1步骤(6)~(8)。实施例6(1)称取氧化锂含量为3.1%的锂云母300kg,加入120kg氯化钙,60kg氯化钠、氯化钾的混合盐,混合均匀;于950℃焙烧40min,得到焙烧料;取出,冷却至室温后,加入500l水,搅拌40min,过滤,得到滤液和滤渣。表26锂辉石数据,%li/li2okrbcs1.44/3.99.941.060.34表27滤液数据,g/llinak8.6145.3161.77表28滤渣数据,%li2co3nakcamgfe99.580.0140.00090.00110.00010.0002also42-cl-sirb酸不溶物0.0001未检出0.00130.00050.0011<0.0050(2)将步骤(1)所得滤液进行浓缩,将所得浓缩进行固液分离,液数据如下:表29浓缩液数据,g/lliclnakrbcs2507.1420.113.012.73(3)将步骤(2)所得浓缩液调整至锂含量为35g/l,按残余二价级以上金属阳离子含量加入略微过量的碳酸钠和氢氧化钠,过滤分离二价及以上金属阳离子沉淀,得到净化锂液。(4)将净化锂液与热的碳酸钠溶液混合,固液分离,得到一次碳酸锂沉淀与沉锂母液。一次碳酸锂经洗涤,可得到电池级碳酸碳酸锂。表30一次碳酸锂数据,%li2co3nakcamgfe99.750.0150.00080.00080.00010.0002also42-cl-sirb酸不溶物0.0001未检出0.00120.00050.0005<0.0050(5)以下步骤同实施例1步骤(6)~(8)。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1