一种类水滑石化合物及其制备方法和在除砷中的应用
1.本发明属于废水处理技术领域,涉及一种去除废水中砷的方法,具体涉及一种类水滑石及其制备方法和在除砷中的应用。
背景技术:
2.进入21世纪以来,为实现人类社会的可持续发展,对新能源的开发和应用逐渐引起世界各国的重视。锂电池因其能量密度高、充放电时间短、工作温度范围宽等优势,现已成为新能源开发的重点项目,锂电池生产亦得到了飞速发展;然而在锂电行业发展的同时也产生了大量生产废水。
3.根据现有技术的相关报道,在锂电池正极材料三元前驱体的生产过程中,会产生如三元浓水、三元淡水和原料洗涤水等工业废水。在锂电池正极材料生产的工业废水中,三元浓水具有重金属含量高、氨氮浓度大、含盐量高和碱度大等特点,是生态环境的直接威胁;洗涤水中重金属和氨氮浓度较低,但其有害重金属总量大;此外,在生产过程中,大量镍、钴、锰等重金属离子以多途径迁移进入废水,若能妥善处理将极大缓解其对环境的污染,同时,金属资源能得到有效回收利用。
4.现有技术中,锂电池废水资源化处理的研究报道较少。
5.申请号为201820051358.0的中国实用新型专利申请公开了一种锂电正极三元前驱体废水处理装置,在其公开的处理锂电池正极三元前驱体废水的方法中,对镍、钴、锰等重金属的处理主要是基于加药、调碱等方法,使镍、钴、锰离子生成沉淀再通过过滤除去;该技术使废水中的镍钴锰资源流失,产生大量的危废。
6.申请号为201810368700.4的中国发明专利申请公开了一种去除废水中砷酸根离子的吸附剂,具体涉及将镁铁二元水滑石作吸附剂去除废水中砷酸根的应用,吸附量可达415mg/g;但此方法需要额外添加金属盐制备类水滑石吸附剂,不经济且易造成二次污染。
7.砷污染对环境和人体健康存在巨大威胁,到目前为止,尚未见到利用锂电池废水组分直接制备类水滑石去除砷的方法的相关报道。
8.综上所述,如何将锂电池废水进行适当简单处理后用于污染治理,同时发挥多种金属共存的优势,实现以废治废,是本领域亟待解决的技术难题,也是目前锂电池废水资源化的发展趋势。
技术实现要素:
9.针对现有技术存在的不足,本发明提供了一种类水滑石及其制备方法和在除砷中的应用。
10.本发明采用如下技术方案:
11.本发明一方面提供了一种类水滑石化合物的制备方法,包括,向含有ni
2+
、co
2+
和mn
2+
的重金属废水中加入碱性沉淀剂,混匀后进行水热反应,分离取沉淀即得。
12.其中,所述重金属废水中(ni
2+
+co
2+
):mn
2+
的摩尔比为(0.5
‑
5):1,且所述碱性沉淀
剂的加入量为控制反应体系的ph大于8。
13.具体地,将重金属废水中(ni
2+
+co
2+
):mn
2+
的摩尔比控制为(0.5
‑
5):1,才能得到单一晶相的类水滑石,且只有当反应体系的ph大于8,才能获得镍钴锰类水滑石化合物。
14.在上述技术方案中,所述碱性沉淀剂为氢氧化钠、碳酸钠、环六亚甲基四胺和尿素中的一种或多种,优选为尿素。
15.具体地,当碱性沉淀剂为尿素时,所制备得到的类水滑石晶粒尺寸较大,内部结构较规整,且具有三维分层的结构。
16.在上述技术方案中,所述重金属废水为生产锂电池正极材料中的三元浓水、三元淡水和原料洗涤水中的一种或多种。
17.具体地,在上述技术方案中,所述水热反应的温度为80
‑
200℃,优选为100
‑
150℃。
18.具体地,当水热反应的温度过低(小于80℃),无法反应生成镍钴锰类水滑石;同时,当水热反应的温度过高(大于200℃),也不可能反应生成镍钴锰类水滑石。
19.具体地,在上述技术方案中,所述水热反应的时间为8
‑
28h,优选为18
‑
23h。
20.在一个具体实施方式中,所述碱性沉淀剂为尿素;且以物质的量计,所述尿素的加入量为重金属废水中ni
2+
、co
2+
和mn
2+
的总和的3
‑
3.5倍,优选为3.3倍。
21.具体地,尿素水解释放的氨提供金属离子沉淀所需的碱,不同摩尔比尿素水解的ph值不同,而ph直接影响类水滑石的制备及重金属的去除率;当尿素的加入量为重金属废水中ni
2+
、co
2+
和mn
2+
的总和的3
‑
3.5倍时,所制备的类水滑石结晶度高,晶型好。
22.在另一个具体实施方式中,所述制备方法包括,向含有ni
2+
、co
2+
和mn
2+
的重金属废水中加入尿素,剧烈搅拌12
‑
18min后,将得到的澄清溶液转移至水热釜中,密封后置于80
‑
120℃的烘箱中水热反应8
‑
28h,反应完成后冷却至室温,取沉淀物用去离子水洗涤,最后在75
‑
85℃下干燥10
‑
15h,即得。
23.本发明另一方面提供了上述制备方法制备得到的类水滑石化合物。
24.具体地,所述类水滑石化合物为层状结构。
25.本发明又一方面提供了上述制备方法或类水滑石化合物在除砷中的应用。
26.具体地,所述应用包括,将含砷废水的ph调整为3
‑
11,随后加入所述类水滑石化合物,在25
‑
35℃下恒温震荡反应,吸附去除。
27.优选地,在上述技术方案中,所述类水滑石化合物的加入量为0.1
‑
2g/l。
28.进一步优选地,在上述技术方案中,所述反应的时间为15
‑
30h,优选20
‑
25h。
29.本发明的优点:
30.(1)本申请利用锂电池废水组分直接制备类水滑石去除砷,将锂电池废水采用尿素水热法进行水热处理,反应后形成具有层状结构的类水滑石化合物,用于含砷废水的处理,该方法一举两得,不仅能将锂电池废水中的重金属予以资源化利用,而且还可以进一步以废治废,实现砷的去除;
31.(2)本申请所采用的方法利用锂电池废水组分直接制备的类水滑石由于表面缺陷多、金属分散,mn的掺入显著降低了体系的带隙,使得层板活性显著提升,表层充满了活性金属位点,在处理含砷废水领域具有意料不到的吸附效果;
32.(3)本申请所采用的方法经济、环保、实用,实际应用前景广阔,在环境治理领域具有十分重要的现实意义。
附图说明
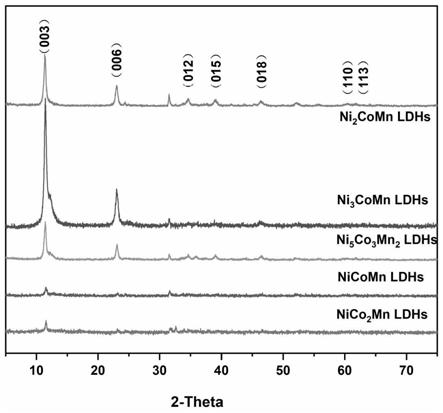
33.图1为根据本发明实施例1中一种利用锂电池废水组分直接制备得到不同金属比类水滑石的xrd图;
34.图2为本发明实施例1中一种利用锂电池废水组分直接制备得到不同金属比类水滑石的原液中ni、co、mn去除率对比图;
35.图3为本发明实施例1中一种利用锂电池废水组分直接制备得到不同金属比类水滑石的砷的吸附容量对比图;
36.图4为本发明实施例2中一种利用锂电池废水组分直接制备得到不同水热温度类水滑石的原液中ni、co、mn去除率对比图;
37.图5为本发明实施例2中一种利用锂电池废水组分直接制备得到不同水热温度类水滑石的砷的吸附容量对比图;
38.图6为本发明实施例3中一种利用锂电池废水组分直接制备得到不同水热时间类水滑石的原液中ni、co、mn去除率对比图;
39.图7为本发明实施例3中一种利用锂电池废水组分直接制备得到不同水热时间类水滑石的砷的吸附容量对比图;
40.图8为本发明实施例4中一种利用锂电池废水直接制备得到类水滑石的砷的吸附等温线图;
41.图9为本发明实施例4中在最优条件下制备的类水滑石的sem图;
42.图10为本发明实施例4中在最优条件下制备的类水滑石的氮气吸附、解吸等温线及孔径分布曲线;
43.图11为本发明实施例4中在最优条件下制备的类水滑石的o1s光谱。
具体实施方式
44.下面结合附图和实施例,对本发明的具体实施方式作进一步详细描述。以下实施例用于说明本发明,但不用来限制本发明的保护范围,本发明的保护范围以权利要求书为准。若未特别指明,本发明实施例中所用的实验试剂和材料等均可市售获得。若未具体指明,本发明实施例中所用的技术手段均为本领域技术人员所熟知的常规手段。
45.实施例1
46.本实施例1对比了不同金属比例对形成镍钴锰类水滑石处理锂电池废水中ni、co、mn及含砷废水的影响,具体过程如下:
47.称取一定量niso4·
6h2o、coso4·
7h2o、mnso4·
h2o和co(nh2)2溶于50ml去离子水中配置成混合盐溶液,改变ni、co、mn的摩尔比分别为n(ni
2+
):n(co
2+
):n(mn
2+
)=3:1:1、1:2:1、1:1:1、2:1:1和5:3:2,其中,以物质的量计,所述尿素的加入量为重金属废水中ni
2+
、co
2+
和mn
2+
的总和的3.3倍;混合溶液在磁力搅拌器下剧烈搅拌15min后,将澄清的溶液转移到水热釜中,放入烘箱在120℃下恒温晶化24h,将水热釜取出冷却至室温后所得沉淀物用去离子水洗涤,所得沉淀物在80℃烘箱中真空干燥得到不同金属比例的ldhs。
48.使用icp
‑
oes检测水热合成不同金属比例ldhs后溶液中残余的ni、co、mn含量,计算ni、co、mn的去除率。
49.将将制备的ldhs投入含砷溶液,使用icp
‑
oes检测反应平衡后砷的浓度,计算吸附
容量。
50.图1
‑
3分别为不同金属比类水滑石的xrd图、不同金属比类水滑石的原液中ni、co、mn去除率对比图和不同金属比类水滑石的砷的吸附容量对比图。
51.从图1可以看出,ldhs在2θ为11.36
°
、22.04
°
、34.68
°
、39.12
°
、46.32
°
、60.50
°
和61.76
°
处都有尖锐的特征峰,这些峰分别对应(003)、(006)、(012)、(015)、(018)、(110)和(113)晶面,与层状双氢氧化物特征衍射峰相符,表明成功地制备出了三金属层状双氢氧化物含nicomn的ldhs,且(003)晶面说明层状结构的存在。
52.实施例2
53.本实施例2对比了不同水热温度对形成镍钴锰类水滑石处理锂电池废水中ni、co、mn及含砷废水的影响,具体过程如下:
54.称取一定量niso4·
6h2o、coso4·
7h2o、mnso4·
h2o和co(nh2)2溶于溶于50ml去离子水中配置成混合盐溶液,其中n(ni
2+
):n(co
2+
):n(mn
2+
)=1:2:1,以物质的量计,所述尿素的加入量为重金属废水中ni
2+
、co
2+
和mn
2+
的总和的3.3倍;混合溶液在磁力搅拌器下剧烈搅拌15min后,将澄清的溶液转移到水热釜中,放入烘箱分别在80℃、90℃、100℃、120℃、150℃、180℃、200℃温度下恒温晶化24h,将水热釜取出冷却至室温后所得沉淀物用去离子水洗涤,所得沉淀物在80℃烘箱中真空干燥得到不同水热温度的nico2mn ldhs。
55.使用icp
‑
oes检测水热合成不同水热温度ldhs后溶液中残余的ni、co、mn含量,计算ni、co、mn的去除率。
56.将制备的ldhs投入含砷溶液,使用icp
‑
oes检测反应平衡后砷的浓度,计算吸附容量。
57.图4
‑
5分别为不同水热温度类水滑石的原液中ni、co、mn去除率对比图和砷的吸附容量对比图。
58.实施例3
59.本实施例3对比了不同水热时间对形成镍钴锰类水滑石处理锂电池废水中ni、co、mn及含砷废水的影响,具体过程如下:
60.称取一定量niso4·
6h2o、coso4·
7h2o、mnso4·
h2o和co(nh2)2溶于50ml去离子水中配置成混合盐溶液,其中n(ni
2+
):n(co
2+
):n(mn
2+
)=1:2:1,以物质的量计,所述尿素的加入量为重金属废水中ni
2+
、co
2+
和mn
2+
的总和的3.3倍;混合溶液在磁力搅拌器下剧烈搅拌15min后,将澄清的溶液转移到水热釜中,放入烘箱在100℃下分别恒温晶化8h、12h、16h、20h、24h、28h。将水热釜取出冷却至室温后所得沉淀物用去离子水洗涤,所得沉淀物在80℃烘箱中真空干燥得到不同水热时间的nico2mn ldhs。
61.使用icp
‑
oes检测水热合成不同水热时间ldhs后溶液中残余的ni、co、mn含量,计算ni、co、mn的去除率。
62.将制备的ldhs投入含砷溶液,使用icp
‑
oes检测反应平衡后砷的浓度,计算吸附容量。
63.图6
‑
7分别为不同水热时间类水滑石的原液中ni、co、mn去除率对比图和砷的吸附容量对比图。
64.对比图2
‑
7可以发现,该方法对ni、co、mn的去除率受摩尔比的影响较小,受水热温度及时间的影响较大,高温长时间有利于ni、co、mn的去除,而低温短时间有利于砷的去除。
65.实施例4
66.本实施例4测试了在最优条件下(n(ni
2+
):n(co
2+
):n(mn
2+
)=1:2:1,水热温度为100℃,水热时间20h)制备的镍钴锰类水滑石处理含砷废水的吸附等温线,具体过程如下:
67.取初始浓度为10
‑
1000mg/l的含砷溶液25ml于锥形瓶中,加入0.025g吸附剂,使用0.1mol
·
l
‑1naoh或0.1mol
·
l
‑1hcl调节溶液ph为5.0
±
0.1,分别在30℃,40℃及50℃条件下恒温振荡反应24h,转速为150r
·
min
‑1,用孔径为0.45um的微孔滤膜过滤,测定溶液中砷的平衡浓度。
68.图8是本发明实施例4利用锂电池废水直接制备类水滑石对砷的吸附等温线对比图;根据langmuir模型计算出nico2mn ldhs对砷在30℃、40℃和50℃条件下的最大平衡吸附量分别为:407.23、454.04和518.78mg/g。
69.如下所示,表1所示为nico2mn ldhs吸附砷的等温吸附模型相关参数,表2所示为nico2mn ldhs的孔结构参数。
70.表1 nico2mn ldhs吸附砷的等温吸附模型相关参数
[0071][0072]
表2 nico2mn ldhs的孔结构参数
[0073][0074]
分析上述结果可以看出,freundlich模型的相关系数较高,说明freundlich模型比langmuir模型更能拟合吸附数据,吸附过程为多层吸附;根据langmuir模型计算出nico2mn ldhs对砷在30℃、40℃和50℃条件下的最大平衡吸附量为分别为:407.23、454.04和518.78mg/g,略大于实验结果值;此外,随着温度升高,吸附量增加,说明nico2mn ldhs对砷的吸附为吸热反应;根据freundlich模型拟合计算出不同温度的n值均大于1,说明nico2mn ldhs对砷的吸附容易进行,且发生化学吸附过程。
[0075]
图9为本发明实施例4在最优条件下制备的nico2mn ldhs的sem图;从sem图可以看出有大量的孔富集,表面缺陷多,说明表层充满了活性金属位点,有利于砷的吸附。
[0076]
图10为本发明实施例4在最优条件下制备的nico2mn ldhs的氮气吸附、解吸等温线及孔径分布曲线;从孔径分布曲线可以看出所有的孔都为介孔,说明具有内部孔的存在。ldhs的比表面积较大,能够提供足够多的活性位点,因此吸附砷的性能较好。
[0077]
图11为本发明实施例4在最优条件下制备的nico2mn ldhs的o1s光谱;从o1s光谱图可以看出nico2mn ldhs在530.61ev、531.27ev、532.09ev分别对应了晶格氧m
‑
o、羟基
‑
oh和吸附水h2o。吸附砷后在531.2ev位置出现了as
‑
o特征峰,说明配位效果好。
[0078]
对比例1
[0079]
本对比例提供了本发明实施例3制备的nico2mn ldhs与liet al.(environmental science and pollution research,2019,26(12):12014
‑
12024)利用共沉淀法制备mgmnal ldhs对砷的不同吸附量。liet al.在氮气气氛下,通过剧烈搅拌,将mgcl2·
6h2o、mncl2·
4h2o、alcl3·
6h2o(mg:mn:al摩尔比=2.9:1.1:2)的混合溶液缓缓滴加到nacl溶液中。通过调整naoh溶液滴速,使反应溶液ph维持在9.5
±
0.2。70℃老化48h后,离心分离;制备的mgmnal ldhs对砷的吸附量为166.94mg g
‑1。
[0080]
以上的实施例仅仅是对本发明的具体实施方式进行描述,并非对本发明的范围进行限定,本领域技术人员在现有技术的基础上还可做多种修改和变化,在不脱离本发明设计精神的前提下,本领域普通工程技术人员对本发明的技术方案作出的各种变型和改进,均应落入本发明的权利要求书确定的保护范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1