用于强化玻璃制品的盐浴组合物,使用所述盐浴组合物强化玻璃制品的方法及由此强化的玻璃制品与流程
用于强化玻璃制品的盐浴组合物,使用所述盐浴组合物强化玻璃制品的方法及由此强化的玻璃制品
1.相关申请的交叉参考
2.本技术根据35 u.s.c
§
120要求2019年7月31日提交的系列号为62/880,969的美国临时申请的优先权权益,本文以该申请的内容为基础并通过引用将其全文纳入本文。
技术领域
3.本说明书一般涉及用于对玻璃制品进行化学强化的方法,更具体而言,本说明书涉及在该强化期间使用的盐浴组合物及由此强化的玻璃制品。
背景技术:
4.回火或强化玻璃可以用于各种应用。例如,由于强化玻璃的物理耐久性和抗破裂性,其可以用于消费电子器件,例如,智能手机和平板电脑。强化玻璃也可以用于药物包装。在这样的应用中,除了物理耐久性之外,玻璃的化学耐久性对于防止药物包装件的内容物污染也是重要的。然而,常规的强化过程(例如,常规的离子交换过程)可能降低玻璃的化学耐久性。这可能至少部分地是由于用于离子交换的熔融盐浴降解和/或分解所致。
5.因此,需要替代性的盐浴组合物来强化玻璃制品。
技术实现要素:
6.根据第1个方面,一种对包含第一碱金属阳离子的含碱玻璃制品进行强化的方法包括:使至少一部分的玻璃制品与熔融盐浴接触,所述熔融盐浴包含0.1重量%至3重量%的纳米颗粒和至少一种碱金属盐,所述至少一种碱金属盐包含第二碱金属阳离子。所述纳米颗粒包括准金属氧化物纳米颗粒和金属氧化物纳米颗粒中的至少一种。第二碱金属阳离子的原子半径大于第一碱金属阳离子的原子半径。所述方法还包括:维持所述至少一部分的玻璃制品与熔融盐浴接触以允许玻璃制品中的第一碱金属阳离子与熔融盐浴的第二碱金属阳离子交换。所述方法还包括:除去所述至少一部分玻璃制品与熔融盐浴的接触,以产生经强化的玻璃制品。经强化的玻璃制品的表面耐水解性滴定体积小于1.5ml。
7.第2个方面包括第1个方面的方法,其中,熔融盐浴包含nano3和kno3中的至少一种。
8.第3个方面包括第1或第2个方面中的任一方面的方法,其中,纳米颗粒包含sio2、al2o3、tio2、beo,或者sio2、al2o3、tio2和beo中的两种或更多种的组合。
9.第4个方面包括第1-3个方面中的任一方面的方法,其中,金属氧化物纳米颗粒的平均表面积为300m2/g至600m2/g。
10.第5个方面包括第1-4个方面中的任一方面的方法,其中,纳米颗粒的平均粒度为1nm至25nm。
11.第6个方面包括第1-5个方面中的任一方面的方法,其中,熔融盐浴的ph为6至8。
12.第7个方面包括第1-6个方面中的任一方面的方法,其中,所述玻璃制品是玻璃药物包装件。
13.第8个方面包括第1-7个方面中的任一方面的方法,其中,所述玻璃制品是玻璃小瓶。
14.第9个方面包括第1-8个方面中的任一方面的方法,其中,盐浴的温度为350℃至500℃。
15.第10个方面包括第1-9个方面中的任一方面的方法,其还包括:对经强化的玻璃制品进行洗涤以移除至少一部分的金属氧化物纳米颗粒。
16.根据第11个方面,一种用于对包含第一碱金属阳离子的含碱玻璃制品进行强化的盐浴系统包括盐浴,所述盐浴包含0.1重量%至3重量%的纳米颗粒和至少一种碱金属盐,所述至少一种碱金属盐包含第二碱金属阳离子。所述纳米颗粒包括准金属氧化物纳米颗粒和金属氧化物纳米颗粒中的至少一种。第二碱金属阳离子的原子半径大于第一碱金属阳离子的原子半径。所述至少一种碱金属盐能够分解成碱金属亚硝酸盐、碱金属氧化物或碱金属氢氧化物中的至少一种。纳米颗粒能够与所述碱金属亚硝酸盐、碱金属氧化物或碱金属氢氧化物中的至少一种主动反应,以形成不与玻璃制品表面相互作用的产物。
17.第12个方面包括第11个方面的系统,其中,碱金属盐包括nano3、kno3、rbno3、csno3或其任何组合。
18.第13个方面包括第11或第12个方面中的任一方面的方法,其中,纳米颗粒包含sio2、al2o3、tio2、beo、或者它们的任何组合。
19.第14个方面包括第11-13个方面中的任一方面的系统,其中,碱金属阳离子包含kno3,并且所述至少一种碱金属氧化物纳米颗粒包含sio2。
20.第15个方面包括第14个方面的系统,其中,至少一部分的kno3分解成kno2、k2o或koh中的至少一种。
21.第16个方面包括第15个方面的系统,其中,至少一部分的sio2与所述kno2、k2o或koh中的至少一种反应以形成k2sio3。
22.第17个方面包括第11-16个方面中的任一方面的系统,其中,纳米颗粒的平均表面积为300m2/g至600m2/g。
23.第18个方面包括第11-17个方面中的任一方面的系统,其中,纳米颗粒的平均粒度为1nm至25nm。
24.第19个方面包括第11-18个方面中的任一方面的系统,其中,纳米颗粒包含至少90重量%的金属氧化物纳米颗粒和准金属氧化物纳米颗粒中的至少一种。
25.第20个方面包括第11-19个方面中的任一方面的系统,其中,所述盐浴的ph为6至8。
26.第21个方面包括第11-20个方面中的任一方面的系统,其中,盐浴的温度为350℃至500℃。
27.第22个方面包括第11-21个方面中的任一方面的系统,其中,所述盐浴还包括至少一种碱土金属阳离子,并且所述纳米颗粒能够与所述至少一种碱土金属阳离子主动反应以形成不沉积在玻璃制品表面上的产物。
28.在以下的具体实施方式中将阐述本文所述的组合物、方法和制品的其他特征和优点,其中的部分特征和优点对本领域的技术人员而言,根据所作描述就容易看出,或者通过实施包括以下具体实施方式、权利要求书以及附图在内的本文所述的实施方式而被认识。
29.应理解,前述的一般性描述和下文的具体实施方式都描述了各个实施方式且都旨在提供用于理解所要求保护的主题的性质和特性的总体评述或框架。包括的附图提供了对各个实施方式的进一步理解,附图并入本说明书中并构成说明书的一部分。附图例示了本文所描述的各个实施方式,并且与说明书一起用于解释所要求保护的主题的原理和操作。
附图说明
30.图1a示意性描绘了常规离子交换过程;
31.图1b示意性描绘了常规离子交换过程;
32.图2图示了在约22℃的温度下,在约60分钟的持续时间内,包含氢氧化钾和二氧化硅纳米颗粒的溶液的ph和电导率;
33.图3图示了在约50℃的温度下,在约30分钟的持续时间内,包含氢氧化钾和二氧化硅纳米颗粒的溶液的ph和电导率;
34.图4图示了在约80℃的温度下,在约5分钟的持续时间内,包含氢氧化钾和二氧化硅纳米颗粒的溶液的ph和电导率;以及
35.图5图示了氢氧化钾和二氧化硅纳米颗粒的反应动力学的阿累尼乌斯(arrhenius)图。
具体实施方式
36.本文所述的实施方式涉及用于使离子交换过程中使用的盐浴中的分解产物浓度最小化以延长盐浴寿命并维持经强化的含碱玻璃制品随着时间的化学耐久性的系统和方法。所述方法一般包括:使具有第一碱金属阳离子的含碱玻璃制品的至少一部分与熔融盐浴接触,所述熔融盐浴包含0.1重量%至3重量%的纳米颗粒和至少一种碱金属盐,所述至少一种碱金属盐具有第二碱金属阳离子,该第二碱金属阳离子的原子半径大于第一碱金属阳离子的原子半径。所述纳米颗粒可以包括准金属氧化物纳米颗粒和金属氧化物纳米颗粒中的至少一种。所述方法还可以包括:维持该至少一部分的玻璃制品与熔融盐浴接触以允许第一碱金属阳离子与熔融盐浴的第二碱金属阳离子交换。进一步地,所述方法可以包括:除去该至少一部分玻璃制品与熔融盐浴的接触,以产生经强化的玻璃制品。经强化的玻璃制品的表面耐水解性滴定体积可以小于1.5ml。本文将具体参照附图对系统和方法的各个实施方式进行描述。
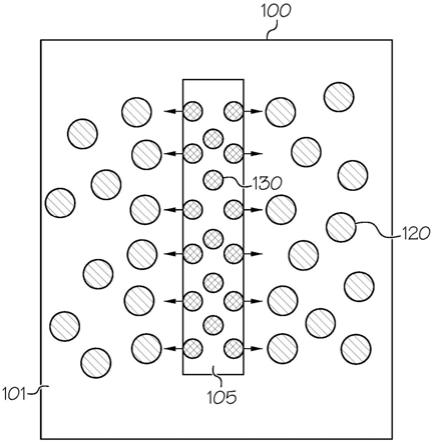
37.本文中,范围可以表示为从“约”一个具体值开始和/或至“约”另一个具体值终止。表述这样的范围时,另一种实施方式包括自所述一个具体值始和/或至所述另一具体值止。类似地,用先行词“约”将数值表示为近似值时,应理解该具体值构成另一个实施方式。还应理解的是,每个范围的端点值在与另一个端点值相结合以及独立于另一个端点值的情况下都是有意义的。
38.本文所用的方向术语,例如上、下、左、右、前、后、顶、底,仅仅是参照绘制的附图而言,并不用来暗示绝对的取向。
39.除非另有明确说明,否则本文所述的任何方法不应理解为其步骤需要按具体顺序进行,或者要求使任何设备具有特定取向。因此,如果方法权利要求没有实际叙述其步骤要遵循的顺序,或者任何设备权利要求没有实际叙述各组件的顺序或取向,或者权利要求书
或说明书中没有另外具体陈述步骤限于具体顺序,或者没有叙述设备组件的具体顺序或取向,那么在任何方面都不应推断顺序或取向。这适用于解释上的任何可能的非表达性基础,包括:涉及步骤安排的逻辑问题、操作流程、组件的顺序或组件的取向问题;由语法组织或标点派生的明显含义问题和说明书中描述的实施方式的数量或类型问题。
40.除非另有规定,否则如本文所用的术语“离子交换浴”、“盐浴”和“熔融盐浴”是等同术语,并且是指用于实现与玻璃(或玻璃陶瓷)制品的离子交换过程的溶液或介质,在离子交换过程中,玻璃制品表面内的阳离子被盐浴中存在的阳离子替换或交换。应理解,盐浴可以包括至少一种碱金属盐,例如硝酸钾(kno3)和/或硝酸钠(nano3),其可以通过热被液化或者其他方式加热到基本为液相。
41.除非另有规定,否则如本文所用的术语“基材”和“制品”是等同术语,其是指具有任何形状或形式的玻璃材料,包括但不限于片材、小瓶、三维玻璃制品等。
42.除非另有规定,否则如本文所用的术语“阳离子”和“离子”被认为是等同术语。术语“阳离子”和“离子”可以指一种或多种阳离子。虽然在实施方式中使用钾阳离子和钠阳离子,但应理解,本公开不限于这些种类。本公开的范围还包括其他金属盐和离子,尤其是碱金属的阳离子和盐,以及其他一价金属的阳离子和盐。
43.如本文所用的术语“化学耐久性”是指玻璃组合物暴露于规定的化学条件后耐降解的能力。具体来说,本文所述的玻璃制品的化学耐久性根据usp《660》“containers
–
glass(容器——玻璃)”的“surface glass test(表面玻璃测试)”,在水中评估。
44.如本文所用,单数形式的“一个”、“一种”和“该/所述”包括复数指代对象,除非文本中另有明确说明。因此,例如,提到的“一种”部件包括具有两种或更多种这类部件的方面,除非文本中有另外的明确表示。
45.首先参考图1a和1b,其示意性描绘了常规的离子交换过程。图1a和1b所示的离子交换过程包括将玻璃制品105浸没(图1a)在盐浴100中。在实施方式中,玻璃制品105可以包括硅酸盐玻璃,例如硼硅酸盐玻璃或铝硅酸盐玻璃,如美国药典(usp)《660》“containers
–
glass(容器——玻璃)”中详述的,所述玻璃符合i型玻璃标准。i型玻璃一般具有相对较高的耐水解性和相对较高的耐热冲击性。在实施方式中,玻璃制品105可以包括如usp《660》中详述的iii型玻璃。iii型玻璃是钠钙二氧化硅玻璃。iii型玻璃具有中等耐水解性。在实施方式中,玻璃制品105可以包括如usp《660》中详述的ii型玻璃。ii型玻璃是在表面处理中暴露过,以改进玻璃耐水解性的iii型玻璃。
46.玻璃制品105可以包含相对较小的阳离子130,例如,碱金属阳离子(例如li
+
和/或na
+
阳离子),并且盐浴100可以包括处于高温的熔融盐101,该熔融盐101包含较大的阳离子120(即,相对于玻璃制品的阳离子130而言)。也就是说,较大的阳离子120可以具有比较小的阳离子130的原子半径大的原子半径。较大的碱金属阳离子120例如可以包括已经从盐浴100中存在的kno3和/或nano3中解离出来的诸如k
+
和/或na
+
阳离子之类的碱金属阳离子。玻璃制品105内的较小的阳离子130从玻璃制品105扩散到盐浴100中,同时,来自盐浴100的较大的阳离子120替换玻璃制品105中的较小的阳离子130。这种较大的阳离子120替代(图1b)玻璃制品105中的较小的阳离子130在玻璃制品105的表面处产生了表面压缩应力(cs),其延伸到压缩深度(doc),并因此提高了玻璃制品105的抗破裂性。
47.已经发现,在离子交换过程期间,盐浴中存在的碱金属盐可以分解成碱金属亚硝
酸盐和/或碱金属氧化物。以下方程式指示了碱金属硝酸盐分解成碱金属亚硝酸盐:
48.mno3→
mno2+1/2o2[m:li、na或k]
[0049]
碱金属硝酸盐和碱金属亚硝酸盐均可以进一步分解成碱金属氧化物,如以下方程式所指示的:
[0050]
mno3或mno2→
m2o+o2+n2(或no
x
)[m:li、na或k]
[0051]
例如,在盐浴中使用kno3盐的情况中,已经发现,kno3在高于约400℃的浴温下分解成两种主要的分解产物:亚硝酸钾(kno2)和氧化钾(k2o)。在盐浴中使用nano3盐的情况中,已经确定,nano3在比kno3低的温度下(即,低于约400℃的温度)可以分解成nano2和na2o。类似地,在盐浴中使用lino3盐的情况中,已经确定,lino3在甚至比nano3低的温度下可以分解成lino2和li2o。
[0052]
已经确定,盐浴中存在碱金属氧化物(例如k2o)可能使在其中处理的玻璃制品的性质变差。具体地,已经发现,在离子交换过程期间,盐浴中的碱金属氧化物蚀刻玻璃制品的表面,这是由于盐浴中的碱金属氧化物水解形成碱金属氢氧化物[例如,氢氧化钾(koh)]所致。蚀刻使玻璃制品的表面变差,进而可能不利地影响玻璃制品的化学耐久性。
[0053]
例如,玻璃制品可以是玻璃药物包装件,例如,玻璃小瓶等。已经发现,在高的过程温度下,例如,在大于或等于约800℃的温度下对玻璃药物包装件进行离子交换降低了玻璃药物包装件在水中的耐降解性(即,表面耐水解性或shr),这通过usp《660》测试标准来确定。一般采用较高的离子交换过程温度以减少用于实现特定的压缩深度和/或表面压缩应力的离子交换过程时间,由此提高生产吞吐量和制造效率。然而,玻璃制品的shr变差可能使得必须采用较低的离子交换过程温度,由此降低了生产吞吐量和制造效率。
[0054]
本文所述的盐浴组合物及使用该盐浴组合物的方法可以用于防止玻璃制品的表面耐水解性因离子交换过程而变差,由此扩展了盐浴的可用温度范围并提高了生产吞吐量和制造效率。
[0055]
具体地,本公开的方法包括含有纳米颗粒的盐浴组合物,所述纳米颗粒例如准金属氧化物或金属氧化物纳米颗粒。纳米颗粒与熔融盐的分解产物反应,产生了非反应性产物,由此减少或减轻了在其中处理的玻璃制品表面的蚀刻,进而减轻了玻璃制品的表面耐水解性的变差。
[0056]
在本文所述的实施方式中,包含第一碱金属阳离子的玻璃制品可以通过采用熔融盐浴的离子交换过程得到强化。在实施方式中,使至少一部分的玻璃制品与熔融盐浴的熔融盐接触。如本文中所使用的,术语“接触”可以包括浸没、或至少部分浸没在熔融盐浴中。玻璃制品可以与熔融盐浴接触一定的处理时间,该处理时间足以在玻璃制品表面处建立表面压缩应力,并且该表面压缩应力延伸到压缩深度。在实施方式中,玻璃制品可以与熔融盐浴接触约20分钟至约20小时的处理时间。例如,玻璃制品可以与熔融盐浴接触下述处理时间:约20分钟至约15小时,约20分钟至约10小时,约20分钟至约5小时,约20分钟至约1小时,约1小时至约20小时,约1小时至约15小时,约1小时至约10小时,约1小时至约5小时,约5小时至约20小时,约5小时至约15小时,约5小时至约10小时,约10小时至约20小时,约10小时至约15小时,或约15小时至约20小时。
[0057]
在实施方式中,所述盐浴组合物包括碱金属盐,该碱金属盐包含与玻璃制品的第一碱金属阳离子不同的第二碱金属阳离子。在实施方式中,碱金属盐例如可以是碱金属硝
酸盐。在本文所述的实施方式中,碱金属盐中的第二碱金属阳离子的原子半径大于玻璃制品的第一碱金属阳离子的原子半径。例如但非限制,在实施方式中,第一碱金属阳离子可以为li
+
并且第二碱金属阳离子可以为k
+
和/或na
+
。替代或附加地,第一碱金属阳离子可以为na
+
并且第二碱金属阳离子可以为k
+
。
[0058]
碱金属盐的相对较大的阳离子可以容易地与包含在玻璃制品内的相对较小的阳离子交换并替代该相对较小的阳离子。较小的碱金属阳离子从玻璃制品扩散到盐浴的碱金属盐中,同时,来自盐浴的碱金属盐的较大的碱金属阳离子扩散到玻璃制品中并且替代(即,交换)玻璃制品中的较小的阳离子。这种较大的碱金属阳离子取代玻璃制品中的较小的碱金属阳离子在玻璃制品的表面处产生了表面压缩应力层,其延伸到压缩深度,增加了玻璃制品在机械损伤(例如,刮擦、磨损等)后的抗破裂性。
[0059]
在实施方式中,盐浴组合物可以包含kno3和nano3中的至少一种。在一些实施方式中,盐浴可以包含kno3和nano3的组合。在实施方式中,盐浴组合物中的kno3和nano3的浓度可以基于玻璃制品的组成来平衡,以使提供的离子交换既增加了离子交换过程后玻璃制品表面处的表面压缩应力,又增加了离子交换过程后的压缩深度。在实施方式中,基于盐浴组合物的总浓度计,盐浴组合物包含比nano3大的kno3浓度。在实施方式中,盐浴组合物可以包含约5重量%kno3至约95重量%kno3。例如,盐浴组合物可以包含约45重量%kno3至约50重量%kno3,或约75重量%kno3至约95重量%kno3。在实施方式中,盐浴组合物可以包含约5重量%nano3至约95重量%nano3。例如,盐浴组合物可以包含约50重量%nano3至约55重量%nano3,或约5重量%nano3至约25重量%nano3。为了在玻璃制品中实现深的压缩深度,盐浴组合物可以包括较大浓度的nano3,并且可以将玻璃制品保持在盐浴组合物中较长的处理时间以实现较深的压缩深度。
[0060]
在实施方式中,盐浴组合物可以被加热到一定的高温,该高温足以产生熔融盐浴并由此促进离子交换过程。在实施方式中,可以将盐浴组合物加热到350℃至500℃的温度。例如,可以将盐浴组合物加热到下述温度:350℃至475℃,350℃至450℃,350℃至425℃,350℃至400℃,350℃至375℃,375℃至500℃,375℃至475℃,375℃至450℃,375℃至425℃,375℃至400℃,400℃至500℃,400℃至475℃,400℃至450℃,400℃至425℃,425℃至500℃,425℃至475℃,425℃至450℃,450℃至500℃,450℃至475℃,或475℃至500℃。然而,如果熔融盐浴的温度过高,则可能难以充分控制离子交换过程,并且盐浴中的碱金属盐的降解速率可能增加。
[0061]
如本文所述,在离子交换过程期间,碱金属盐可能分解。碱金属盐的分解速率可随着熔融盐浴的温度升高而增加。在实施方式中,碱金属盐可分解成碱金属亚硝酸盐、碱金属氧化物、碱金属氢氧化物或其组合。例如,存在于熔融盐浴中的kno3可以分解成kno2、k2o、koh或其组合。这种分解可以由碱金属盐直接发生(例如,kno3还原成kno2),或者间接发生(例如,kno3或kno2还原成k2o,并且k2o接着水解成koh)。
[0062]
如本文所述,碱金属亚硝酸盐的分解产物可与玻璃制品的表面相互作用。例如,碱金属氢氧化物(例如koh)可以腐蚀或蚀刻玻璃制品的表面,进而可降低玻璃制品的化学耐久性。特别地,该腐蚀或蚀刻可降低玻璃制品的表面耐水解性(shr)。具有低shr的玻璃在水或水性溶液中可降解。在玻璃制品用作玻璃药物包装件,例如玻璃容器、玻璃小瓶、玻璃安瓿等的情况中,玻璃的降解可影响玻璃药物包装件的内容物的效用。如本文所述,玻璃制品
表面的shr可以通过usp《660》标准中详述的surface glass test(表面玻璃测试)来测量。shr是玻璃表面的化学耐久性的量度,其与玻璃组分在测试溶液中的溶解性相关。根据usp《660》,归类为i型玻璃的玻璃具有高的耐水解性(例如,给定3-5ml的填充体积,表面玻璃测试得到小于或等于1.3ml的滴定体积),这使得它们适于容纳大多数肠胃外组合物和非肠胃外组合物。
[0063]
如usp《660》标准中详述的,shr可以通过下述来确定:用无二氧化碳的水或纯净水填充玻璃小瓶或由玻璃制品组成的容器。然后使填充的小瓶在约121℃下经受约1小时的高压釜循环。接着在甲基红的存在下,通过弱盐酸(例如,0.01m hcl)将得到的小瓶内的浸出液滴定至中性。每100ml浸出液的滴定剂体积用于确定玻璃制品的shr。一般来说,较大的滴定剂体积对应于较差的化学耐久性(即,浸出液包含较多的玻璃释放的玻璃组分,因此需要较多的滴定剂来补偿由于玻璃组分存在所导致的ph改变)。
[0064]
在经强化的玻璃制品中可期望低的滴定剂体积和/或高的化学耐久性。一般来说,小于1.5ml的滴定剂体积对于i型玻璃是期望的。然而,如上文所述,分解产物(例如碱金属氢氧化物)存在于用于离子交换的熔融盐浴中可腐蚀和/或蚀刻玻璃制品的表面。这种蚀刻可导致滴定剂体积增加,这对应于化学耐久性降低。通常,经强化的玻璃制品的滴定剂体积将根据经历离子交换所花的时间而增加。也就是说,玻璃制品与熔融盐浴接触得越久,滴定剂体积越大。例如,经历约3小时离子交换的玻璃制品可得到约0.9ml的滴定剂体积,而经历约10小时离子交换的玻璃制品可得到约1.1ml的滴定剂体积。
[0065]
通常,在盐浴组合物中包含可以与熔融盐的分解产物反应的添加剂,以最大程度地减少或消除经强化的玻璃制品的化学耐久性的任何降低。然而,出于各种因素,例如,在熔融盐浴内循环不佳,高的活化能,或者产生不期望的产物,许多常规添加剂产生了不一致的结果。另外,一些常规添加剂可能难以获得满足强化玻璃生产需求所需的足够数量。
[0066]
对此,所述盐浴组合物包括纳米颗粒,以减轻在盐浴中经受离子交换的玻璃制品的shr的变差。在实施方式中,所述纳米颗粒可以包括准金属氧化物纳米颗粒、金属氧化物纳米颗粒或其组合。例如,纳米颗粒可以包括二氧化硅(sio2)纳米颗粒、氧化铝(al2o3)纳米颗粒、二氧化钛(tio2)纳米颗粒、氧化铍(beo)纳米颗粒、或其各种组合中的至少一种。纳米颗粒可以基于它们与碱金属盐的分解产物的反应性来选择。例如,二氧化硅纳米颗粒可以与熔融盐浴中存在的koh反应形成硅酸钾(k2sio3)和水。类似地,氧化铝纳米颗粒可以与熔融盐浴中存在的氢氧化钠(naoh)反应形成铝酸钠(naalo2)和水。也就是说,纳米颗粒与碱金属盐的分解产物反应并且形成不与玻璃制品反应(例如,不蚀刻或腐蚀玻璃制品)的产物。纳米颗粒的存在可以降低熔融盐浴中的分解产物的浓度,并因此减少分解产物与玻璃制品表面之间的相互作用。由此,当与在常规熔融盐浴(即,不包括纳米颗粒的熔融盐浴)中经受离子交换的玻璃制品比较时,在熔融盐浴中包含纳米颗粒可以增加经强化的玻璃制品的化学耐久性。
[0067]
在实施方式中,所述纳米颗粒还可以防止不期望的碱金属阳离子沉积在玻璃制品表面上。如上文所述,在离子交换过程期间,玻璃制品可以将第一碱金属阳离子释放到熔融盐浴中。例如,在离子交换期间,na
1+
阳离子或li
1+
阳离子可以从玻璃制品释放。然而,随着离子交换进展以及释放的阳离子浓度升高,所释放的阳离子可沉积在玻璃制品的表面上。这可能抑制存在于熔融盐浴中的第二碱金属阳离子进入玻璃制品。在实施方式中,纳米颗
粒可以将碱金属阳离子结合到纳米颗粒的表面,并且防止碱金属阳离子移动通过整个盐浴。由此,所述纳米颗粒可以防止所释放的第一碱金属阳离子沉积在玻璃制品表面上,从而提高了离子交换过程的效率。
[0068]
在一些实施方式中,所述纳米颗粒还可以防止不期望的杂质(例如,碱土金属阳离子)沉积在玻璃制品表面上。碱土金属阳离子(例如ca
2+
和/或mg
2+
)可以作为杂质存在于盐浴中。这些碱土金属阳离子可造成在玻璃制品表面上形成钙和/或镁层。该层可阻止碱金属阳离子释放和/或进入玻璃制品,从而抑制了离子交换过程。结果,盐浴中存在碱土金属阳离子可降低经强化的玻璃制品的线性热膨胀系数(cte)。在实施方式中,纳米颗粒可以与碱土金属阳离子反应形成碱土金属硅酸盐,例如,硅酸钙(casio3),并且防止在玻璃制品表面上形成层。由此,所述纳米颗粒可以防止杂质抑制离子交换过程并增加经强化的玻璃制品的cte。
[0069]
在实施方式中,所述纳米颗粒也可以提高盐浴的热导率。不囿于任何特定理论,认为盐浴的热导率的这种增加可以改进盐浴的温度均匀性,并因此改进在其中进行的离子交换过程的均匀性。也就是说,在玻璃制品中赋予的压缩应力在整个玻璃制品表面上可以相似或相同。这种均匀的离子交换过程可以减少或防止薄玻璃制品中的翘曲,所述翘曲可以因为不对称的压缩应力而发生。
[0070]
所述盐浴组合物可以包括一定量的纳米颗粒,其足以有效地降低熔融盐浴中的所述至少一种分解产物的浓度。在实施方式中,所述盐浴组合物可以包含约0.1重量%至约3.0重量%的纳米颗粒。例如,所述盐浴组合物可以包含约0.1重量%至约2.5重量%,约0.1重量%至约2.0重量%,约0.1重量%至约1.5重量%,约0.1重量%至约1.0重量%,约0.1重量%至约0.5重量%,约0.5重量%至约3.0重量%,约0.5重量%至约2.5重量%,约0.5重量%至约2.0重量%,约0.5重量%至约1.5重量%,约0.5重量%至约1.0重量%,约1.0重量%至约3.0重量%,约1.0重量%至约2.5重量%,约1.0重量%至约2.0重量%,约1.0重量%至约1.5重量%,约1.5重量%至约3.0重量%,约1.5重量%至约2.5重量%,约1.5重量%至约2.0重量%,约2.0重量%至约3.0重量%,约2.0重量%至约2.5重量%,或约2.5重量%至约3.0重量%。当盐浴组合物包含更少的纳米颗粒(即,小于约0.1重量%)时,熔融盐浴中的纳米颗粒的可获得性可能不足以与分解产物有效地相互作用。相较之下,当盐浴组合物包含更多的纳米颗粒(即,大于约3.0重量%)时,过量的纳米颗粒可能干扰离子交换过程。
[0071]
纳米颗粒与至少一种分解产物之间反应的反应速率常数(k)可足以有效地降低所述至少一种分解产物在熔融盐浴中的浓度。反应的反应速率常数(k)对反应速率进行了定量,因此,较大的反应速率常数(k)可以指示纳米颗粒有更大的能力与熔融盐浴中的至少一种分解产物反应。也就是说,较大的反应速率常数(k)可以与纳米颗粒减少分解产物与玻璃制品表面之间的相互作用的能力相关。在实施方式中,纳米颗粒与至少一种分解产物之间反应的反应速率常数(k)可以为约0.5至约12。例如,纳米颗粒与至少一种分解产物之间反应的反应速率常数(k)可以为约0.5至约10,约0.5至约8,约0.5至约6,约0.5至约4,约0.5至约2,约2至约12,约2至约10,约2至约8,约2至约6,约2至约4,约4至约12,约4至约10,约4至约8,约4至约6,约6至约12,约6至约10,约6至约8,约8至约12,约8至约10,或约10至约12。当反应速率常数(k)不充分高(即,大于或等于0.5)时,分解产物的浓度可能不被有效地降低,
因此,玻璃制品的化学耐久性可能降低。
[0072]
在实施方式中,盐浴组合物的纳米颗粒包括至少300m2/g的平均表面积,如通过布鲁诺-埃梅特-特勒(brunauer
–
emmett
–
teller,bet)方法所测量的。例如,盐浴组合物的纳米颗粒可以包括下述平均表面积:约300m2/g至约600m2/g,约300m2/g至约550m2/g,约300m2/g至约500m2/g,约300m2/g至约450m2/g,约300m2/g至约400m2/g,约300m2/g至约350m2/g,约350m2/g至约600m2/g,约350m2/g至约550m2/g,约350m2/g至约500m2/g,约350m2/g至约450m2/g,约350m2/g至约400m2/g,约400m2/g至约600m2/g,约400m2/g至约550m2/g,约400m2/g至约500m2/g,约400m2/g至约450m2/g,约450m2/g至约600m2/g,约450m2/g至约550m2/g,约450m2/g至约500m2/g,约500m2/g至约600m2/g,约500m2/g至约550m2/g,或约550m2/g至约600m2/g。如本文所述,碱金属氧化物纳米颗粒的表面积可以与纳米颗粒和熔融盐浴的分解产物之间反应的反应速率常数(k)直接相关。也就是说,纳米颗粒的表面积越大,与存在于熔融盐浴中的分解产物反应的潜力越大。这可以允许在使用更少的纳米颗粒的同时,更好地控制盐浴组合物的性质并增加玻璃制品的化学耐久性。
[0073]
在实施方式中,盐浴组合物的纳米颗粒可以具有约1nm至约25nm的平均粒度,如通过布鲁诺-埃梅特-特勒(brunauer
–
emmett
–
teller,bet)方法所测量的。例如,盐浴组合物的纳米颗粒的平均粒度可以为约1nm至约20nm,约1nm至约15nm,约1nm至约10nm,约1nm至约5nm,约1nm至约2.5nm,约2.5nm至约25nm,约2.5nm至约20nm,约2.5nm至约15nm,from 2.5nm至约10nm,约2.5nm至约5nm,约5nm至约25nm,约5nm至约20nm,约5nm至约15nm,约5nm至约10nm,约10nm至约25nm,约10nm至约20nm,约10nm至约15nm,约15nm至约25nm,约15nm至约20nm,或约20nm至约25nm。当纳米颗粒具有较小的平均粒度(即,小于约1nm)时,纳米颗粒的平均表面积和反应速率常数(k)可减小,使得与分解产物相互作用的能力减小。另外,当纳米颗粒具有较大的平均粒度(即,大于约25nm)时,纳米颗粒在熔融盐浴中的浮力可减小。这可导致纳米颗粒沉到熔融盐浴的底部并且减少与熔融盐浴中的分解产物的可能的相互作用和反应。
[0074]
在实施方式中,盐浴组合物的纳米颗粒可以具有高的纯度,使得基于纳米颗粒的总重量计,纳米颗粒包含大于90重量%的金属氧化物或准金属氧化物纳米颗粒。例如,基于纳米颗粒的总重量计,盐浴组合物的纳米颗粒可以包含约90重量%至约99.9重量%,约90重量%至约99.5重量%,约90重量%至约99重量%,约90重量%至约95重量%,约95重量%至约99.9重量%,约95重量%至约99.5重量%,约95重量%至约99重量%,约99重量%至约99.9重量%,约99重量%至约99.5重量%,或约99.5重量%至约99.9重量%的金属氧化物或准金属氧化物纳米颗粒。当纳米颗粒不具有足够高的纯度时,污染物可被引入到盐浴组合物中,这可不利地影响经强化的玻璃制品的品质。
[0075]
在实施方式中,包含纳米颗粒的熔融盐浴的ph为6至8。例如,包含纳米颗粒的熔融盐浴的ph可以为约6至约7.5,约6至约7,约6至约6.5,约6.5至约8,约6.5至约7.5,约6.5至约7,约7至约8,约7至约7.5,或约7.5至约8。如上文所述,碱金属氢氧化物(例如,氢氧化钾)可蚀刻玻璃制品的表面,降低化学耐久性。然而,在实施方式中,存在于熔融盐浴中的金属氧化物纳米颗粒可以与碱金属硝酸盐的分解产物反应。这可降低存在于熔融盐浴中的碱金属氢氧化物的浓度。也就是说,金属氧化物纳米颗粒在熔融盐浴中可以起到ph缓冲剂的作用。结果,熔融盐浴的ph可以是强化过程期间可能发生的蚀刻的程度的可靠指征。例如,碱
性ph(即,大于7的ph)可以指示在熔融盐浴中有较高的氢氧化钾浓度以及有蚀刻增加的可能性。酸性ph(即,小于7的ph)可以指示在熔融盐浴中有减小的氢氧化钾浓度以及蚀刻可能性减小。
[0076]
在实施方式中,在离子交换过程后,去除玻璃制品与熔融盐浴的接触。经历了离子交换的所得玻璃制品在其表面处可以具有压缩应力,该压缩应力延伸到压缩深度。压缩应力和压缩深度增加了玻璃制品在机械损伤后的抗破裂性,因此,在离子交换过程后,玻璃制品可以是经强化的玻璃制品。然而,由于如上所述在熔融盐浴中存在金属氧化物纳米颗粒,因此经强化的玻璃制品可以保留或者甚至展现出改进的化学耐久性,如离子交换后的shr滴定剂体积所指示的。因此,在实施方式中,经强化的玻璃制品的shr滴定剂体积可以小于1.5ml,小于或等于1.4ml,小于或等于1.3ml,小于或等于1.2ml,小于或等于1.1ml,小于或等于1ml,小于或等于0.9ml,小于或等于0.8ml,小于或等于0.7ml,小于或等于0.6ml,小于或等于0.5ml,小于或等于0.4ml,小于或等于0.3ml,小于或等于0.2ml,或者甚至小于或等于0.1ml。
[0077]
在实施方式中,在去除接触后,可以清洗或洗涤经强化的玻璃制品。具体而言,如上文所述,离子交换过程可以导致碱金属阳离子沉积在玻璃制品表面上。离子交换过程还可以导致金属氧化物纳米颗粒也沉积在玻璃制品表面上。经强化的玻璃制品的洗涤可以去除至少一部分的碱金属阳离子和/或碱金属氧化物纳米颗粒。这可以使玻璃制品进一步准备好用于期望的应用,例如,药物包装。
[0078]
经受本文所述的离子交换过程的玻璃制品和盐浴组合物可以具有各种形式。例如,玻璃制品可以是玻璃板、玻璃片、玻璃管、玻璃容器等。在实施方式中,玻璃制品可以是玻璃药物包装件或药物容器,其用于容纳药物组合物,例如液体、粉末等。例如,本文所述的玻璃制品可以是药筒、注射器、安瓿、瓶子、罐子、烧瓶、管形瓶、管子、烧杯、小瓶等。
[0079]
实施例
[0080]
下述实施例例示了本公开的一个或多个特征。应理解,这些实施例不旨在以任何方式限制本公开或所附权利要求书的范围。
[0081]
实施例1
[0082]
为了观察金属氧化物纳米颗粒中和氢氧化钾的能力,将0.06g平均粒度为约7nm的sio2纳米颗粒溶解在1l的0.001m koh溶液中。然后将溶液加热到约22℃并以400rpm搅拌,同时每5分钟监测并记录溶液的电导率和ph。图2图示了结果。
[0083]
如图2所示的结果所示,在氢氧化钾溶液中包含二氧化硅纳米颗粒使得溶液电导率和ph均平稳下降。如图所示,ph下降与电导率下降直接相关。不囿于任何特定理论,认为溶液的电导率和ph均下降可以是因为随着二氧化硅纳米颗粒与氢氧化钾反应,溶液中的钾(k
+
)和氢氧根(oh-)离子减少或消除所致。在1小时内,溶液的电导率从约225μs/cm下降到约175μs/cm。类似地,溶液的ph从约11.05下降到约10.85。该电导率下降指示了纳米颗粒能够降低溶液中的游离离子浓度。也就是说,纳米颗粒能够与熔融盐浴中存在的离子反应或结合。类似地,该ph降低指示了纳米颗粒可以有效地中和熔融盐浴中的氢氧化钾,减轻氢氧化钾与玻璃制品表面之间的相互作用,并且减少对化学耐久性的潜在不利影响。
[0084]
实施例2
[0085]
在约50℃的温度下再次进行如实施例1所述的程序。每5分钟监测并记录溶液的电导率和ph。图3图示了结果。
[0086]
如图3所示的结果所示,在氢氧化钾溶液中包含二氧化硅纳米颗粒使得溶液电导率和ph均平稳下降。在30分钟的过程内,溶液的电导率从约250μs/cm下降到约175μs/cm。类似地,溶液的ph从约10.50下降到约9.95。该电导率下降指示了纳米颗粒能够降低溶液中的游离离子浓度。也就是说,纳米颗粒能够与熔融盐浴中存在的离子反应或结合。类似地,该ph降低指示了纳米颗粒可以有效地中和熔融盐浴中的氢氧化钾,减轻氢氧化钾与玻璃制品表面之间的相互作用,并且减少对化学耐久性的潜在不利影响。
[0087]
实施例3
[0088]
在约80℃的温度下再次进行如实施例1所述的程序。每60秒监测并记录溶液的电导率和ph。图4图示了结果。
[0089]
如图4所示的结果所示,在氢氧化钾溶液中包含二氧化硅纳米颗粒使得溶液电导率和ph均平稳下降。在5分钟的过程内,溶液的电导率从约300μs/cm下降到约250μs/cm。类似地,溶液的ph从约10.49下降到约10.37。该电导率下降指示了纳米颗粒能够降低溶液中的游离离子浓度。也就是说,纳米颗粒能够与熔融盐浴中存在的离子反应或结合。类似地,该ph降低指示了纳米颗粒可以有效地中和熔融盐浴中的氢氧化钾,减轻氢氧化钾与玻璃制品表面之间的相互作用,并且减少对化学耐久性的潜在不利影响。
[0090]
实施例4
[0091]
利用实施例1-3的结果,使用电导率测量值的斜率来确定在这三个实施例的各个温度下,二氧化硅纳米颗粒与氢氧化钾之间的反应速率常数(k)。结果在图5中作为阿累尼乌斯图示出。即,图5描绘了相对于温度(以开尔文计)倒数(1/t)绘制的反应速率常数的对数(ln(k))。
[0092]
如图5所示,二氧化硅纳米颗粒与氢氧化钾反应的速率随着温度的升高相对成比例地增加。在约22℃的温度下,反应速率常数为约0.75。在约50℃的温度下,反应速率常数增加到约2.0。在约80℃的温度下,反应速率又增加到约11.25。该反应速率常数(k)指示纳米颗粒可以一定的速率与熔融盐浴的分解产物反应,该速率足以充分地中和存在于熔融盐浴中的碱并且减轻碱与玻璃制品表面之间的相互作用,从而减少对化学耐久性的潜在不利影响。另外,反应速率常数(k)随着温度而增加指示了纳米颗粒在中和碱方面的作用可以随着溶液温度升高而增强。就这点而言,这指示了纳米颗粒在熔融盐浴的高温下可以有效地降低所述碱的浓度,并因此相比于常规方法更加有效地精确控制熔融盐浴的ph。
[0093]
本领域的技术人员显而易见的是,可以在不偏离要求专利权的主题的精神和范围的情况下,对本文所述的实施方式进行各种修改和变动。因此,本说明书旨在覆盖本文所述的各个实施方式的修改和变动,只要这些修改和变动在所附权利要求书及其等同内容的范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1