一种硫化镉量子点的制备方法及应用
本发明涉及量子点的制备和应用领域,具体涉及一种可以同时用于检测cu2+、hg2+和mg2+的硫化镉量子点的制备方法及应用。
背景技术:
铜、汞和镁在冶金,化工,建材等领域有着很广泛的应用,但是也会不可避免地造成重金属危害。其中,危害最大的是汞,汞作为最严重的重金属污染物之一,一旦通过皮肤或呼吸道被吸收,就会对人体的中枢神经系统、消化系统和肾脏等造成威胁。铜虽是人体不可缺少的金属元素之一,但是血液中铜过多,会导致白血病、淋巴瘤、肝腹水、肝硬化等疾病。镁离子是细胞中最丰富的二价阳离子之一,在酶驱动的生化反应、细胞增殖和稳定dna构象中发挥重要作用,但镁过量会引起胃痛、呕吐、水泻、虚脱等中毒症状。因此,如何实现实际样品中微量cu2+、hg2+和mg2+的高效、灵敏测定是特别重要的研究课题。
一般检测金属离子的方法有:原子吸收光谱法,原子发射光谱法,电感耦合离子体质谱法等。然而,这些方法需要复杂的样品处理,仪器成本较高,耗时长。
另外,荧光分析法因其快速、简单、灵敏、选择性好和成本低等优点,引起了分析科学家的兴趣。在荧光分析法中,探针的选择是分析过程中一个关键的因素,作为一种半导体纳米材料,硫化镉量子点在分析检测、生物成像、免疫分析和光催化等领域具有广泛的应用。在过去十多年里,量子点发展比较迅速,硫化镉量子点合成方法也在不断丰富,根据合成方法的不同,一般可以分为有机相合成法和水相合成法两种。量子点的水相合成与许多其他有机溶剂相比,具有以下优点:(1)合成过程中水溶性配体的易功能化在量子点表面使得量子点的水溶性较好,适用于生物应用;(2)使用低毒的有机小分子,并降低反应温度,这有利于规模化生产。因此,量子点的水相合成已成为常规有机相合成方法的替代方法。
但是现有的量子点的水相合成一般是采用水热合成的方式进行合成,反应温度较高且对反应条件要求苛刻,生产成本较高,且制备得到的硫化镉量子点往往仅能用于一种金属离子的检测,且检测灵敏度也较低。
技术实现要素:
本发明针对现有技术中存在的技术问题,提供一种硫化镉量子点及其制备方法,该硫化镉量子点可以用于检测cu2+、hg2+和mg2+三种离子,且检出限低。
本发明的目的之一在于提供一种硫化镉量子点,所述硫化镉量子点由cdcl2·2.5h2o、硫脲和na2s·9h2o制备得到,其最大紫外吸收波长在350~400nm处,uv照射下产生黄色荧光。
本发明的目的之二在于提供上述硫化镉量子点的制备方法,包括以下步骤:制备含有cdcl2和硫脲的cd/硫脲前体液;将cd/硫脲前体液与稳定剂混合并调节ph至碱性;向调节至碱性的混合溶液中添加na2s,混合,即得。
作为一种优选地实施方式,cd/硫脲前体液中cdcl2与硫脲的质量比为(1.5~2.8):1。
作为另一种优选地实施方式,cd/硫脲前体液中cdcl2与硫脲的质量比为(1.8~2.5):1。
作为另一种优选地实施方式,cd/硫脲前体液中cdcl2与硫脲的质量比为2:1。
作为另一种优选地实施方式,cd/硫脲前体液中硫脲的质量百分数为0.05~0.15%。
作为另一种优选地实施方式,cd/硫脲前体液中硫脲的质量百分数为0.1%。
作为另一种优选地实施方式,na2s与硫脲的质量比为(0.3~0.6):1;
作为另一种优选地实施方式,na2s与硫脲的质量比为(0.4~0.5):1。
作为另一种优选地实施方式,所述稳定剂为巯基乙酸稳定剂。
作为另一种优选地实施方式,所述稳定剂为体积百分比为0.15~0.25%的巯基乙酸溶液。
作为另一种优选地实施方式,所述硫化镉量子点的制备方法,包括以下步骤:将cdcl2·2.5h2o和硫脲按照质量比(2.5~3):1的比例溶解于超纯水中,得到硫脲质量百分数为0.05~0.15%的cd/硫脲前体液;将cd/硫脲前体液与体积百分数为0.15~0.25%的巯基乙酸溶液混合,调节ph至8.0~11.5,加入na2s·9h2o,混合30min,即得,其中na2s·9h2o与硫脲的质量比为(1.4~1.6):1。
本发明的目的之三在于提供上述硫化镉量子点在检测cu2+、hg2+和mg2+中的应用。
作为另一种优选地实施方式,在检测时,采用谷胱甘肽作为荧光增强剂。
作为另一种优选地实施方式,当单独检测cu2+时,采用naf和nh4oh作为掩蔽剂;当单独检测hg2+时,采ddtc和naf作为掩蔽剂;当单独检测mg2+时,采用8-羟基喹啉和pan作为掩蔽剂。
作为另一种优选地实施方式,在检测时,谷胱甘肽的的浓度为0.16mmoll-1;在检测时,所用的平衡液为氯化钠溶液;所述氯化钠溶液的浓度为4mgml-1。
本发明所制备得到的氯化镉量子点,可以用于检测cu2+、hg2+和mg2+三种离子,且检出限低,无需任何样品分离或前处理技术。另外,本发明基于谷胱甘肽(gsh)增强cdsqds荧光进一步构建了一个简单而有效的荧光传感器(gsh-cdsqds),在cu2+、hg2+和mg2+的分别作用下,荧光传感器在365nm波长光激发下,黄色荧光的cdsqds(λem=505nm)作为检测信号分别随着cu2+、hg2+和mg2+的浓度改变呈线性猝灭关系,成功地建立了谷胱甘肽增强cdsqds荧光传感器,能简单、灵敏、选择性地测定cu2+、hg2+和mg2+三种金属离子的新方法。相比于不加gsh,cdsqds只对mg2+和cu2+有检测荧光响应,而hg2+没有响应,说明gsh不仅能增强cdsqds的荧光强度,而且能影响其对hg2+的识别选择性,显示出本法的特色。为实现单一金属离子的准确检测,检测hg2+时,采用ddtc和naf来掩蔽al3+、mg2+和cu2+的干扰;检测cu2+时,采用naf和nh4oh来掩蔽al3+、mg2+和hg2+;检测mg2+时,采用8-羟基喹啉和pan来掩蔽al3+、hg2+和cu2+。本法具有良好的选择性和灵敏度,已分别成功应用于水和饮品中cu2+、hg2+和mg2+的检测,cu2+、hg2+和mg2+的检出限分别为0.22、5.8和1.6ngml-1。本发明所提供的高效荧光传感器可用于检测水和饮品中的cu2+、hg2+和mg2+,具有极大的推广应用价值。
附图说明
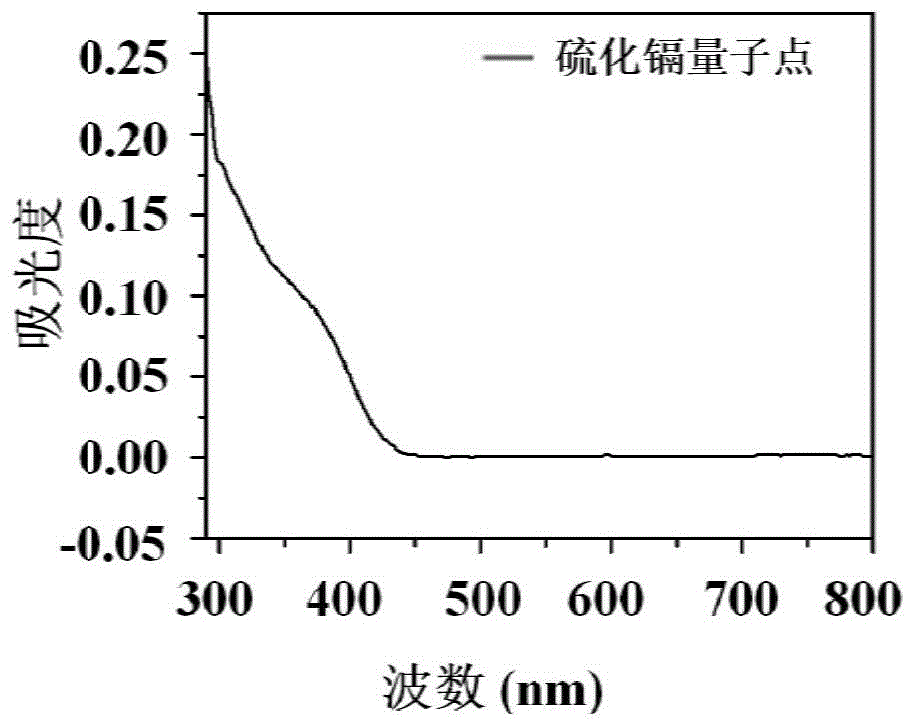
图1为cdsqds的紫外光谱图样;
图2为cdsqds的荧光光谱图样;
图3为cdsqds的红外光谱图样;
图4为cdsqds的透射电镜图样;
图5为cdsqds的zeta电势图样;
图6为cdsqds的edx能谱图样;
图7为不同氨基酸多肽对cdsqds荧光强度的影响;
图8为不同浓度的谷胱甘肽对cdsqds荧光强度的影响;
图9为不同浓度nacl对cdsqds和gsh-cdsqds荧光强度的影响;
图10为不同物质对gsh-cdsqds荧光强度的影响;
图11为干扰离子的掩蔽图,其中a为检测cu2+时的掩蔽图、b为检测hg2+时的掩蔽图、c为检测mg2+时的掩蔽图;
图12为时间对cu2+、hg2+和mg2+与gsh-cdsqds反应的影响;
图13为不同浓度的cu2+、hg2+和mg2+对gsh-cdsqds荧光强度的影响,其中a为cu2+对gsh-cdsqds荧光强度的影响、b为hg2+对gsh-cdsqds荧光强度的影响、c为mg2+对gsh-cdsqds荧光强度的影响;
图14中(a),(b),(c)为在293.15k、303.15k和313.15k条件下,不同浓度的cu2+、hg2+和mg2+与gsh-cdsqds相互作用5min的stern-volmer曲线(f0/f);(d),(e),(f)为在365nm激发下,分别加入cu2+、hg2+和mg2+前后的gsh-cdsqds的荧光寿命衰减曲线。
具体实施方式
以下结合具体实施方式对本发明的原理和特征进行描述,所举实例只用于解释本发明,并非用于限定本发明的范围。除非另有定义,本文所使用的所有技术和科学术语均属于本发明的技术领域的技术人员通常理解的含义。本文中在本发明的说明书中所使用的术语只是为了描述具体的实施例的目的,不是旨在于限制本发明。
本发明提供一种硫化镉量子点,该硫化镉量子点由cdcl2、硫脲和na2s制备得到,其最大紫外吸收波长在350~400nm处,uv照射下产生黄色荧光。
本发明还提供了上述硫化镉量子点的制备方法,具体包括以下步骤:
制备含有cdcl2和硫脲的cd/硫脲前体液;
将cd/硫脲前体液与稳定剂混合并调节ph至碱性;
向调节至碱性的混合溶液中添加na2s,混合,即得。
其中,cd/硫脲前体液中cdcl2与硫脲的质量比为(1.5~2.8):1,优选地为(1.8~2.5):1,其中,当控制cd/硫脲前体液中cdcl2与硫脲的质量比为2:1时,制备得到的硫化镉量子点检测效果最佳。需要说明的是:在合成的过程中,需要严格控制硫脲的用量,硫脲偏多或者偏少,制备得到的量子点荧光强度均会发生显著下降。
cd/硫脲前体液中硫脲的质量百分数为0.05~0.15%,优选地为0.1%。
na2s与硫脲的质量比为(0.3~0.6):1,优选地为(0.4~0.5):1。研究发现,本申请所述的量子点在合成过程中,若没有na2s,则得到的量子点就没有荧光,na2s是本申请所述的硫化镉量子点合成的关键因素。na2s与硫脲的质量比偏大或者偏小,均会显著的影响合成后的量子点的荧光强度。
当所用的稳定剂为巯基乙酸稳定剂,巯基乙酸稳定剂中巯基乙酸的体积百分比为0.15~0.25%。
实施例1
a、在14ml超纯水中混合0.04gcdcl2·2.5h2o和0.015g硫脲,形成cd/硫脲前体液,在20ml水中加入38μl巯基乙酸(tga),然后将两者混合,用1moll-1naoh调节混合溶液ph到10.5,再分别加入0.005g、0.01g、0.02g、0.03g、0.04g、0.06g、0.08g、0.1gna2s·9h2o,搅拌30min,即得合成后的cds量子点。
b、在14ml超纯水中混合0.04gcdcl2·2.5h2o和硫脲,形成cd/硫脲前体液,在20ml水中加入38μl巯基乙酸(tga),然后将两者混合,用1moll-1naoh调节混合溶液ph到10.5,再加入0.02gna2s·9h2o,搅拌30min,即得合成后的cds量子点,其中硫脲的用量分别为0.005g、0.01g、0.015g、0.022g。
对实施例1中a、b两种合成方法中合成的的cds量子点进行表征,并研究其特征,具体操作如下:将所得产物分别用uv-vis吸收光谱、荧光光谱、ftir光谱、透射电子显微镜(tem)、zeta电势和edx光谱进行表征。结果发现合成后的量子点均与下述表征结果相似或相同:
从图1的紫外光谱图样和图2的荧光光谱图样分析可知:合成的cdsqds的最大激发波长为365nm,最大发射波长为505nm。cdsqds显著的紫外吸收出现在350-400nm处,并且与激发光谱有很多重叠。此外,合成的cdsqds样品溶液在日光下呈淡黄色,在uv照射下产生强烈的黄色发光(见图2),表明合成的cdsqds具有良好的水分散性和高荧光性。
红外光谱仪对tga和tga-cdsqds的表征结果如图3所示:在3283cm-1,1721cm-1和2600~2500cm-1处的峰分别代表o-h,c=o和s-h的伸缩振动峰。然而,图3-cdsqds中,在2600~2500cm-1处的s-h特征吸收峰消失了,在1700cm-1处的c=o特征吸收峰向短波方向移动,说明tga和cdsqds已经通过金属硫键结合。
从图4的透射电镜图可知:所合成的cdsqds是尺寸均一的球形,直径平均约为2.5nm。zeta电势对cdsqds的电负性组成检测结果如图5所示:cdsqds带负电。edx光谱对cdsqds的元素组成鉴定结果如图6所示:cdsqds中含有s、cd、c、o和n元素。
实施例1中a、b两种合成方法中合成的cds量子点的荧光强度结果如下表1所示:
表1不同合成方法合成的cds量子点的荧光强度结果比较
发明人经过大量的研究发现,na2s是cdsqds合成的关键因素,没有na2s合成的产物就没有荧光,当na2s·9h2o的用量控制在0.02g,产生的量子点的荧光强度最佳。硫脲是获得cdsqds的另一种重要还原剂,当硫脲的用量为0.015g时,制备得到的量子点的荧光强度最佳。
实施例2cdsqds荧光强度影响因素的探究
(1)氨基酸多肽对cdsqds荧光强度的影响
在50μlcdsqds溶液中分别加入100μl甘氨酸(gly)、酪氨酸(tyr)、天冬氨酸(asp)、胱氨酸(cys-cys)、色氨酸(try)、l-半胱氨酸(cys)(10-5molml-1)和20μl谷胱甘肽(gsh)(4×10-5molml-1)标准溶液,用双重蒸馏水定容至5.0ml。在室温下静置5min,用荧光光度计记录所得到溶液的荧光强度(λex=365nm)。测试结果如图7所示,谷胱甘肽对cdsqds的荧光强度增强明显,在谷胱甘肽(gsh)存在下,cdsqds的荧光强度可以提高1.4倍。
进一步探究不同浓度的gsh对cdsqds荧光强度的影响:在50μlcdsqds溶液中分别加入5、10、15、20、25、62.5、125、250、500、750、1250μl谷胱甘肽(gsh)(4×10-5molml-1)标准溶液,用双重蒸馏水定容至5.0ml。在室温下静置5min,用荧光光度计记录所得到溶液的荧光强度(λex=365nm)。测试结果如图8所示,随着gsh浓度的增加,cdsqds荧光强度逐渐增加,在浓度为0.16mmoll-1时达到最高。因此,选择0.16mmoll-1gsh为最优条件。
(2)平衡液对cdsqds荧光强度的影响
分别研究了br、pbs,tris-hcl、hepes缓冲液和nacl溶液对cdsqds荧光强度的影响,结果发现当采用br、pbs、tris-hcl、hepes缓冲液作为平衡液时,该体系无法进行汞离子的检测。
进一步考查了nacl(0~5mgml-1)浓度对cdsqds和gsh-cdsqds的荧光强度的影响:
在50μlcdsqds溶液中分别加入50、100、150、200、250μlnacl(100mgml-1)溶液,用双重蒸馏水定容至5.0ml。在室温下静置5min,用荧光光度计记录所得到溶液的荧光强度(λex=365nm)。
在50μlcdsqds和20μl0.04moll-1gsh混合溶液中分别加入50、100、150、200、250μlnacl(100mgml-1)溶液,用双重蒸馏水定容至5.0ml。在室温下静置5min,用荧光光度计记录所得到溶液的荧光强度(λex=365nm)。
测试结果如图9所示,nacl在4mgml-1时,两个体系的荧光强度差值达到最大,综合考虑,nacl在4mgml-1时的溶液被选为最佳条件。
(3)除了灵敏度,一个理想的传感器的另一种决定性参数是选择性。在最优化条件下,分别研究了ba2+、zn2+、ag+、ca2+、co2+、cr3+、cr6+、na+、fe3+、mn2+、pb2+、k+、al3+、hg2+、cu2+和mg2+对gsh-cdsqds荧光强度的影响:
50μlcdsqds、20μl0.04moll-1gsh、200μl4mgml-1nacl溶液(ph6.0)在室温下混合5min。随后,在上述混合溶液中分别加入200μl的ba2+、zn2+、ag+、ca2+、co2+、cr3+、cr6+、na+、fe3+、mn2+、pb2+、k+、al3+、hg2+、cu2+和mg2+(10-6gml-1)标准溶液,用双重蒸馏水定容至5.0ml。在室温下静置5min,用荧光光度计记录所得溶液的荧光强度(λex=365nm)。
结果如图10所示(f0表示传感器初始的荧光强度,f表示加入猝灭物质到传感器后的荧光强度)。很明显,al3+、cu2+、hg2+和mg2+能有效的猝灭gsh-cdsqds的荧光强度,表明此传感器对al3+、cu2+、hg2+和mg2+表现出良好的选择性,电子转移可以解释这些现象。gsh-cdsqds的荧光光谱红移现象可以说明在gsh-cdsqds和cu2+、hg2+和mg2+之间发生电子转移,改变了量子点的发光中心。gsh-cdsqds被al3+、cu2+和hg2+离子猝灭的另一个原因可能是由于cu2+、hg2+离子与gsh的硫基相互作用和al3+与gsh的羧基和氨基络合作用。随着al3+、cu2+和hg2+离子的结合,gsh可能从量子点表面发生移位,从而在量子点表面产生缺陷,导致cdsqds荧光猝灭。(4)由于检测al3+不能成线性,只能将其掩蔽,为了能实现分别准确检测cu2+、hg2+和mg2+,当检测其中一种金属离子时,使用掩蔽剂消除其他三种金属离子对检测的干扰。
检测cu2+时,先加入200μl10-6gml-1al3+、mg2+,然后加入50μl10-4molml-1naf,超声5min,再加入200μl10-6gml-1hg2+,55μl10-4molml-1nh4oh超声5min,最后加入200μl10-6gml-1cu2+,50μlcdsqds,20μl0.04moll-1gsh,200μl4mgml-1nacl溶液(ph6.0)用双重蒸馏水定容至5.0ml。在室温下静置5min,用荧光光度计记录所得到溶液的荧光强度(λex=365nm)。
检测hg2+时,先加入200μl10-6gml-1al3+、mg2+,然后加入50μl10-4molml-1naf,超声5min,再加入200μl10-6gml-1cu2+,200μl10-5gml-1ddtc超声5min,最后加入200μl10-6gml-1hg2+,50μlcdsqds,20μl0.04moll-1gsh,200μl4mgml-1nacl溶液(ph6.0)用双重蒸馏水定容至5.0ml。在室温下静置5min,用荧光光度计记录所得到溶液的荧光强度(λex=365nm)。
检测mg2+时,先加入200μl10-6gml-1al3+,然后加入250μl10-5gml-18-羟基喹啉,超声5min,再加入200μl10-6gml-1hg2+和cu2+,250μl10-5gml-1pan超声5min,最后加入200μl10-6gml-1mg2+,50μlcdsqds,20μl0.04moll-1gsh,200μl4mgml-1nacl溶液(ph6.0)用双重蒸馏水定容至5.0ml。在室温下静置5min,用荧光光度计记录所得到溶液的荧光强度(λex=365nm)。
测试结果如图11所示。检测cu2+时,采用naf和nh4oh来掩蔽al3+,mg2+和hg2+;检测hg2+时,采用ddtc和naf来掩蔽al3+、mg2+和cu2+的干扰;检测mg2+时,采用8-羟基喹啉和pan来掩蔽al3+、hg2+和cu2+;检测其中任何一种离子时,可以利用掩蔽剂消除其他离子的干扰,因此可以实现对单一金属离子的准确检测。这表明,gsh-cdsqds是一种有效检测cu2+、hg2+和mg2+的荧光传感器。
(5)考虑分析速度,在最优条件下测gsh-cdsqds传感器与cu2+,hg2+和mg2+的反应时间。具体地操作步骤为:
50μlcdsqds、20μl0.04moll-1gsh、200μl4mgml-1nacl溶液(ph6.0)在室温下混合5min。随后,在上述混合溶液中分别加入200μl的hg2+、cu2+和mg2+(10-6gml-1)标准溶液,用双重蒸馏水定容至5.0ml。放入荧光光度计,用荧光光度计记录所得到溶液1.0-15.0min的荧光强度(λex=365nm)。
测试结果如图12所示,从图12可以看出,cu2+、hg2+和mg2+存在时,传感器的荧光强度比在1.0-15.0min内基本保持不变,表明cu2+、hg2+和mg2+对gsh-cdsqds传感器的响应较快,综合选择5.0min为反应时间。
实施例3cdsqds的应用
本实施例提供了一种用于检测cu2+,hg2+和mg2+的荧光传感器对cu2+、hg2+和mg2+定量检测的应用,包括以下步骤:
(1)gsh-cdsqds用于cu2+的检测
50μlcdsqds、20μl0.04moll-1gsh、200μl4mgml-1nacl溶液(ph6.0)在室温下混合5min。随后,在上述混合溶液中分别加入0、5.00、20.0、30.0、40.0、50.0、100、150、200、250、300、350、400、450μlcu2+(10-6gml-1)标准溶液,用双重蒸馏水定容至5.0ml,超声5min后,在365nm光激发下,用荧光分光光度计检测所有标准样品的荧光光谱(如图13a),根据标准溶液样品的浓度与荧光光谱的关系建立标准工作直线,实验结果见下表1。
(2)gsh-cdsqds用于hg2+的检测
50μlcdsqds、20μl0.04moll-1gsh、200μl4mgml-1nacl溶液(ph6.0)在室温下混合5min。随后,在上述混合溶液中分别加入0、40.0、62.5、75.0、100、150、200、250、300、350、400μlhg2+(10-6gml-1)标准溶液,用双重蒸馏水定容至5.0ml,超声5min后,在365nm光激发下,用荧光分光光度计检测所有标准样品的荧光光谱(如图13b),根据标准溶液样品的浓度与荧光光谱的关系建立标准工作直线,实验结果见下表1。
(3)gsh-cdsqds用于mg2+的检测
50μlcdsqds、20μl0.04moll-1gsh、200μl4mgml-1nacl溶液(ph6.0)在室温下混合5min。随后,在上述混合溶液中分别加入0、30.0、50.0、62.5、75.0、100、150、200、250、300、350、400μlmg2+(10-6gml-1)标准溶液,用双重蒸馏水定容至5.0ml,超声5min后,在365nm光激发下,用荧光分光光度计检测所有标准样品的荧光光谱(如图13c),根据标准溶液样品的浓度与荧光光谱的关系建立标准工作直线,实验结果见下表2。
表2mg2+、hg2+和cu2+标准溶液工作曲线
(4)gsh-cdsqds荧光传感器对样品溶液中cu2+、hg2+和mg2+含量的检测
取黄石市湖北师范大学自来水10ml,将水样置于10000rpm的离心机中离心15min,再将上层清液用直径为0.45μm微孔膜过滤,得到的滤液待用;取1.0ml的滤液,检测cu2+时,加入50μl10-4molml-1naf和55μl10-4molml-1nh4oh来掩蔽al3+、mg2+和hg2+;检测hg2+时,采用200μl10-5gml-1ddtc和50μl10-4molml-1naf来掩蔽al3+、mg2+和cu2+;检测mg2+时,采用250μl10-5gml-18-羟基喹啉和250μl10-5gml-1pan来掩蔽al3+、hg2+和cu2+,再向其中加入50μlcdsqds,20μl0.04moll-1gsh,200μl4mgml-1nacl溶液,再用去离子水定容至5.0ml,在365nm激发波长下,用荧光分光光度计检测所有样品溶液的荧光光谱,根据步骤(1),(2)和(3)中得到的cu2+,hg2+和mg2+标准工作直线,经检测本实施例的自来水中cu2+和mg2+的含量为1.20ngml-1和7.08ngml-1,hg2+的含量检测不出来,低于检测限。
本实施例的gsh-cdsqds荧光传感器也可以用于检测菊花茶汤和红酒中hg2+和cu2+含量和用于检测菊花茶汤和紫菜汤中mg2+含量,红酒样品处理方法与自来水相同,称取2.3g的菊花茶叶,浸泡在30ml煮沸的双重蒸馏水(95℃)中5min,通过0.45μm滤膜过滤。收集茶汤。称取1.6g的干紫菜,紫菜处理方法与自来水相同,收集紫菜汤。取100μl的红酒,菊花茶和紫菜汤上层清液,先分别加入对应的掩蔽剂后超声处理,再分别向其中加入50μlcdsqds,20μl0.04moll-1gsh,200μl4mgml-1nacl溶液,在365nm激发波长下,用荧光分光光度计检测样品溶液的荧光光谱,据步骤(1),(2)和(3)中得到的cu2+,hg2+和mg2+标准工作直线,经检测本实施例的红酒中cu2+的含量为2.93ngml-1,hg2+的含量检测不出来,低于检测限。菊花茶汤中cu2+的含量为1.95ngml-1,mg2+的含量6.45ngml-1,hg2+的含量检测不出来,低于检测限。紫菜汤中mg2+的含量6.69ngml-1。
实施例4gsh-cdsqds的验证
gsh-cdsqds荧光传感器对cu2+、hg2+和mg2+的含量检测结果的准确度验证,将实施例3中的自来水样、红酒样品、菊花茶样品和紫菜样品均进行了加标回收试验,试验结果见下表3:
表3加标回收实验结果
表2的结果表明,cu2+的回收率为97.1-110%,hg2+的回收率为92.6-108.7%,mg2+的回收率为94.7-107.8%,试验结果具有较好的准确度。基于上述结果,说明gsh-cdsqds荧光传感器可以很好的应用于cu2+,hg2+和mg2+的含量检测。
实施例5温度对猝灭过程的影响
探讨温度对猝灭过程的影响,在不同的温度下(293.15、303.15、313.15k)加入一系列浓度的cu2+、hg2+和mg2+时gsh-cdsqds的荧光强度。图14a,b和c中stern-volmer方程(f0/f=1+ksvc)的结果表明f0/f分别在293.15、303.15、313.15k的温度下与[cu2+],[hg2+]和[mg2+]很好地线性拟合,并且ksv随着温度的升高而增加,这表明动态猝灭在猝灭过程中起主要作用。
测定gsh-cdsqds的荧光寿命(τ0,τ)加入或不加入cu2+、hg2+和mg2+。图14d、e、f中的结果告诉我们,在存在cu2+、hg2+和mg2+的情况下,荧光寿命会缩短,进一步表明是动态猝灭过程。
以上所述仅为本发明的较佳实施例,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!