用于产生氧化铝和锂盐的方法与流程
1.本发明涉及一种用于从通过锂辉石矿石或精矿的煅烧形成的贝塔或β-锂辉石产生氧化铝和锂盐的方法。
背景技术:
2.以下对背景技术的讨论仅旨在促进对本发明的理解。讨论不是承认或认可所提及的任何材料在申请的优先权日是或曾经是公知常识的一部分。
3.有一系列方法可用于产生用于电池的高纯度锂盐。用于电池的主要锂盐包括一水合氢氧化锂和碳酸锂。
4.一种常用的方法是硫酸浸出,其中锂矿石诸如锂辉石被煅烧和/或焙烧并浸出以形成硫酸锂溶液,然后通过沉淀对硫酸锂溶液进行处理以得到一水合氢氧化锂或碳酸锂。虽然这个方法很有效,可以提取90%或更多的锂,但它也有缺点。需要大量的石灰或其他中和剂诸如氢氧化钠或苛性钠来中和过量的硫酸,并且该方法还会产生大量硫酸钠。
5.处理锂辉石的替代方法包括氯化焙烧、氢氟酸浸出和碳酸钠浸出。然而,这些方法受到复杂性和/或有毒试剂使用的影响。
6.kuang等人,extraction of lithium fromβ-spodumene using sodium sulphate solution,hydrometallurgy,177,(2018),49-56公开了一种通过用硫酸钠(锂盐沉淀方法的副产物)浸出从β-锂辉石中提取锂的闭环方法。使用两种类型的添加剂(cao和naoh)在150至230℃的温度范围内提高提取效果。添加cao时锂提取效率记录为93.30%,添加naoh时锂提取效率记录为90.70%。
7.澳大利亚专利号2010341402公开了一种用于产生碳酸锂的方法,所述方法包括使β-锂辉石硫酸化的步骤,以及使硫酸化的β-锂辉石进入浸出步骤,所述浸出步骤包括使β-锂辉石与硫酸钠溶液在浸出罐中接触。在处理以除去杂质诸如ca和mg以及结晶后产生碳酸锂。由于该方法涉及锂辉石的硫酸化,它包括硫酸焙烧方法的至少一些缺陷。
8.中国专利申请号107815557a公开了一种用于通过在塞式反应器中与硫酸钠接触而从β-锂辉石提取锂的方法。塞式反应器中没有机械搅拌装置。
9.本发明寻求改善现有技术的锂提取方法,以及通过有效使用试剂和从锂辉石矿石产生锂和其他价特别是氧化铝来提高锂提取行业的经济性的方式,锂辉石矿石本质为硅酸铝锂,还含有铝和硅。
技术实现要素:
10.在一个实施方案中,本发明提供了一种用于产生氧化铝和锂盐的方法,所述方法包括以下步骤:
11.(a)煅烧α锂辉石矿石或精矿,以产生β锂辉石;以及
12.(b)(i)在压力下用碱性溶液浸出来自煅烧步骤(a)的β锂辉石;或者
13.(ii)用至少硫酸钠使β锂辉石硫酸化,并且浸出所述硫酸化的β锂辉石
14.以产生含锂溶液和沸石残渣,其中处理所述含锂溶液以获得纯化的锂盐,并且处理所述沸石残渣以获得氧化铝。
15.煅烧步骤有利地避免了仅用硫酸进行硫酸化,采用碱性浸出作为选项,而不是酸浸出方案。用于浸出步骤的优选的碱性溶液理想地选自碱化的硫酸钠溶液(在这种情况下通常不是硫酸浸出方法的副产物)和碳酸钠。还优选地将其他碱引入碳酸钠溶液以提高浸出效率。所述其他碱的选项包括naoh和cao,其中naoh在所述步骤中受到青睐——虽然与较低的锂提取率存在一些关联——因为它避免了将ca杂质引入所述方法和除去ca杂质的必要的纯化步骤。这简化了所述方法。有利地,与碱化的无水硫酸钠相比,芒硝(na2so4.10h2o)可以优先地用作芒硝溶液,特别是对于芒硝从氢氧化锂产生步骤再循环而言,如下文所述,芒硝可以已经在碱性ph范围内,从而减少了对碱添加的要求并且提供了成本优点。
16.浸出理想地是具有选定粒度分布的β-锂辉石(β-锂辉石)的水热合成,β-锂辉石可以在煅烧后研磨,以实现优选地小于100μm的选定粒度分布。
17.浸出优选地在5-45巴优选地10-20巴的压力和100-300℃优选地150-230℃的温度下进行。固体密度优选地在10-30%的范围内,并且停留时间优选地在2-12小时(h),优选地2-6小时的范围内。理想地,在碱性硫酸钠浸出中,其中硫酸钠与碱诸如naoh混合,硫酸钠以β-锂辉石重量的25重量%至60重量%提供,并且naoh助熔剂以β-锂辉石重量的2至10重量%提供。
18.一种替代方案将涉及用固体硫酸钠使β锂辉石硫酸化,所述固体硫酸钠可以与另一种硫酸盐或酸诸如硫酸混合,以产生固体硫酸锂,然后固体硫酸锂可以通过水溶液(例如酸性水溶液或水)浸出到硫酸锂溶液中。
19.所述方法将锂盐的产生与氧化铝优选地高纯度氧化铝(hpa)的产生相结合。所述方法还可以允许回收沸石材料,诸如羟基方钠石或方沸石或二氧化硅。这些产物具有价值,可用于一系列应用,虽然需要进行如下文所述的进一步处理以提高价值。
20.所述方法可以包括产生任何所期望的锂盐的另外步骤,其中氢氧化锂和碳酸锂是最优选的。所述方法包括纯化来自所述浸出步骤的所述含锂溶液的步骤,这可以需要在一个或多个纯化步骤之前进行浓缩以除去杂质诸如铁、硅、钙、钾和镁。优选地,钙不是作为锂盐产生的添加杂质而有意引入的——例如通过避免使用cao作为中和剂。优选的浓缩操作涉及蒸发。优选的纯化操作包括离子交换,优选地在纯化操作之前进行精细过滤以提高离子交换效率。然而,单元操作的这些实例并非旨在限制并且沉淀可以例如用作纯化操作。
21.所述方法可以产生氢氧化锂溶液作为中间体,如果需要,来自浸出步骤(b)的初始含锂溶液与碱优选地氢氧化钠(以避免钙杂质的引入)反应,以产生氢氧化锂。氢氧化锂溶液通过一个或多个结晶步骤方便地纯化,以产生一水合氢氧化锂作为可用于锂离子电池(lib)制造的最终产物。如果要形成碳酸锂作为最终产物,则所述中间体氢氧化锂溶液通过碳酸化诸如通过二氧化碳处理。
22.当在所述浸出步骤中使用硫酸钠的碱性溶液时,硫酸钠可以通过使所述硫酸锂浸出溶液与氢氧化钠接触以产生氢氧化锂溶液和硫酸钠来再生。硫酸钠可以是结晶的,包括作为芒硝(naso4.10h2o),并且溶解于水或碱性溶液中(如果需要,来自锂盐产生步骤的回收的芒硝溶液可以已经在可接受的碱性ph范围内),以在所述浸出步骤中重复使用。
23.如上文所讨论,所述浸出步骤(b)产生沸石残渣诸如方沸石和/或羟基方钠石,它
们在冷却至环境温度或更高的温度后通过增稠或其他分离操作来分离。虽然这种沸石残渣作为最终产物可以具有一定的价值,但是期望进一步处理分离的沸石残渣以产生氧化铝,优选地高纯度氧化铝,作为高价值产物。
24.方便地,处理含铝沸石残渣以形成氯化铝,优选地呈六水合铝(alcl3.6h2o或ach)的形式。这可以通过在单步或多步氯化方法中直接用盐酸或其他含氯化物浸出剂溶液浸出所述沸石残渣来实现,从而产生富含固体二氧化硅的副产物和ach的溶液。所述浸出溶液中的硅水平应足够低以避免凝胶形成。优选地,这种浸出涉及多步酸浸出方案,无论是单独使用盐酸还是在一个或多个初始阶段使用另一种酸诸如硫酸。一个有利的方案将涉及两个酸浸出步骤,第一步涉及用盐酸或硫酸浸出所述沸石残渣。在方便的中间体中和步骤后,方便地使用石灰或氢氧化钙作为中和剂,虽然由于作为杂质的钠的更可能的行为,氢氧化钠是次优选的替代物,第二酸浸出步骤用盐酸进行以形成ach溶液。来自中间体中和的固体理想地被有效分离,例如在离心机中分离,以限制保留在被引导至所述第二酸浸出步骤的所述固体中的杂质。
25.如果需要,在其他处理步骤诸如上文所述的其他处理步骤之前,所述沸石残渣的处理可以包括初始离子交换步骤,例如其中合适的化合物诸如铵化合物(例如氯化铵、硫酸铵、硝酸铵、氢氧化铵或碳酸铵)的水溶液可以接触所述沸石残渣。在该实例中,然后离子交换的沸石残渣可以被加热以除去过量的氨和吸附的水分,其中处理氨以使离子交换溶液再生。这种离子交换步骤可以需要在压力下进行。
26.来自酸浸出或其他ach产生步骤的ach溶液理想地被结晶以回收ach。为了实现所需的ach纯度,理想地进行多步结晶方法——方便地涉及两个或三个ach结晶步骤,这些ach结晶步骤由中间体再溶解步骤分开——以提供用于高纯度氧化铝产生的高纯度的纯化ach中间体或前体。
27.然后ach,优选地呈如上文所述的纯化形式,可以直接在1000-1600℃,优选地在1200-1300℃下煅烧,以产生所需规格例如99.99%或4n规格的高纯度氧化铝。优选地,ach首先在较低温度下,优选地在750-1150℃范围内焙烧,以在煅烧之前形成无定形或γ相氧化铝,所述氧化铝形成所期望的α相氧化铝hpa。
28.作为将氯化物腐蚀风险引入煅烧炉的直接煅烧的替代方案,ach可以溶解于水,优选地高纯度水(例如去离子水、蒸馏水、超纯水(》18.5'ω是所期望的)或类似的纯化的水流)中,中和以形成勃姆石(alooh)。中和可以涉及任何方便的碱;然而氢氧化铵或nh3/h2o溶液是特别优选的,其中中和的氯化铵产物是可销售的。氯化铵可以与勃姆石形成分离,可能需要更长的时间,例如12至24小时。然后将勃姆石分离并方便地焙烧以形成无定形或γ-氧化铝,然后按照如上文所述的商业化所需的规格进行煅烧以形成高纯度氧化铝(α-氧化铝相)。这可以形成本发明的另一个实施方案,所述实施方案提供将六水合氯化铝(ach)转化为α相氧化铝的方法,所述方法包括以下步骤:
29.(a)将ach溶解于水中;
30.(b)用碱性溶液中和所述ach溶液以形成勃姆石(alooh);
31.(c)分离所述勃姆石;
32.(d)焙烧所述勃姆石以形成无定形或γ-氧化铝相的氧化铝;以及
33.(e)煅烧步骤(d)获得的所述氧化铝以形成高纯度氧化铝(α-氧化铝相)。
34.如果需要,产生用于商业化的高纯度氧化铝规格可以涉及在产生所述高纯度氧化铝之后的洗涤和碾磨步骤。
35.本文所述的方法以减少或避免废物产生的有效方式使锂辉石矿石能够被处理以产生最终价值产物,包括氧化铝和锂盐以及其他潜在的最终产物,包括一系列沸石诸如羟基方钠石或方沸石,并且提供试剂再生和重复使用的闭环方法。
附图说明
36.如上文所述的用于产生氧化铝和锂盐的方法的另外的特征在下文对其若干非限制性实施方案的描述中得到更充分的描述。该描述仅出于举例说明本发明的目的而包括在内。它不应被理解为对上述本发明的广泛概述、公开或描述的限制。描述将参照附图进行,其中:
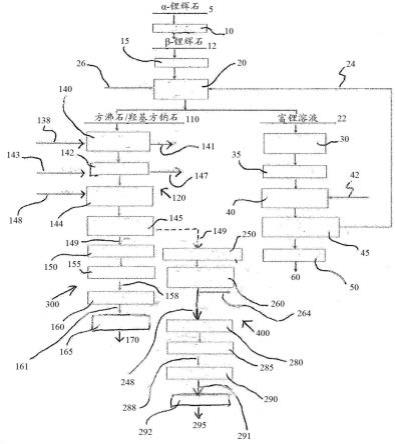
37.图1是根据本发明的第一实施方案的用于产生氧化铝和锂盐的方法的流程图。
38.图2是根据本发明的第二实施方案的用于产生氧化铝和锂盐的方法的流程图。
具体实施方式
39.参见图1和2,α-锂辉石矿石5被开采和浓缩,并被送入煅烧步骤10以转化为β-锂辉石12,β-锂辉石是一种更易于浸出的矿物。煅烧步骤10,也称为焙烧,可以在锂提取领域已知类型的旋转窑或闪速煅烧炉中在1000-1100℃的温度下进行。应避免温度高于1400℃,因为高温可以导致烧结和熔化问题,从而使煅烧无效。
40.在煅烧步骤10之后,将β-锂辉石12在碾磨步骤15中碾磨至选定粒度分布,然后用硫酸钠的碱性溶液以及硫酸钠和氢氧化钠的混合物浸出。例如,选定粒度分布是80%通过53μm,优选地38μm。
41.浸出步骤20在压力下在常规设计的搅拌高压釜中进行。例如,方法条件是温度190℃、压力13巴、固体密度22%和停留时间3小时。在此处,硫酸钠被用作输入试剂,而不是作为硫酸浸出的副产物。虽然可以使用ph值为7的无水硫酸钠溶液进行浸出,但是使用碱性硫酸钠溶液可以实现更高的浸出效率和锂提取。为此,将氢氧化钠(naoh)26与芒硝(na2so4.10h2o)溶液混合引入高压釜中,由于lioh转化步骤40的性质,芒硝溶液已经在如下文所述的碱性范围内,从而减少了对naoh添加的要求并且提供了成本优点。如果需要,可以将另外的硫酸钠与流26一起引入高压釜中。一种替代方案是石灰添加,但是这将在浸出液中引入杂质元素ca,并且这将需要在产生目标锂盐(此处是氢氧化锂)之前从浸出产生含硫酸锂的富液22中除去。例如,在浸出开始时浸出溶液中的β-锂辉石:na2so4:naoh的目标比率为1:0.30:0.02。
42.浸出步骤20的反应方案为:
43.2β-lialsi2o6(s)+na2so4(aq)+2h2o
‑‑→
2naalsi2o6.h2o(s)+li2so4(aq)
44.该方法是一种产生至少氧化铝和氢氧化锂的综合方法,因此比氢氧化锂的单独产生所达到的锂辉石矿石处理的经济性有所提高。因此,该方法包括如下文所述的用于产生氢氧化锂和高纯度氧化铝的处理方案。
45.氢氧化锂的产生
46.浸出步骤20产生含有杂质(诸如铁、镁、钙、硅、钾和钠)的富硫酸锂溶液(pls)22。
将硫酸锂溶液通过过滤与浸出残渣分离,并且进行进一步处理步骤,以产生氢氧化锂和再生硫酸钠24,从而在浸出步骤20中重复使用。
47.首先,在蒸发步骤30中通过蒸发将具有相对低li浓度(例如,7g/l(虽然表示从β-锂辉石回收96%的li))的硫酸锂溶液浓缩至10-15g/l li的目标。然后在精细过滤(未显示)之后在离子交换步骤35中处理浓缩的硫酸锂溶液,所述处理通过与本领域已知的合适类型的离子交换树脂接触来进行,以除去约300-400ppm的上文所述的杂质元素。
48.然后在lioh转化步骤40中形成氢氧化锂溶液,所述形成通过使硫酸锂溶液与氢氧化钠42反应来进行,以形成氢氧化锂溶液和硫酸钠,所述硫酸钠在结晶步骤45中结晶为十水合硫酸钠(芒硝),以便在如上文所述的浸出步骤20中再循环以重复用作浸出溶液24。由于在lioh转化步骤40中使用氢氧化钠,从而在芒硝中产生氢氧化钠残留物,因此这种溶液在碱性ph值范围内。
49.然后,按照常规规范,使氢氧化锂溶液在结晶阶段50经历多个结晶步骤,以获得高纯度一水合氢氧化锂60,以作为lib电池制造的一个选项。
50.在高纯度氧化铝产生中作为中间体的六水合氯化铝的产生
51.形成上文所述的硫酸锂溶液的浸出步骤20也产生沸石残渣110,所述沸石残渣基本上包含羟基方钠石和/或方沸石,但是含有杂质。虽然沸石浸出残渣110具有一些价值,例如在水泥和陶瓷行业中,但是希望进行如下文所述的另外的处理步骤,以产生通常具有显著更高价值的高纯度氧化铝。
52.如果需要,沸石残渣110通过离子交换以类似于澳大利亚专利申请号2018406693中描述的方式处理,该专利申请的内容据此以引用的方式并入本文,然后进行氯化方法120,所述氯化方法方便地包括酸浸出方法,目的是产生中高纯度的氧化铝产物,即六水合三氯化铝(alcl3.6h2o)或ach。ach可以在涉及用盐酸对沸石残渣进行的单步浸出的方法中产生,或者优选地在涉及盐酸浸出和中和步骤的多步方法中产生。下文描述这两种模式。
53.在任一模式中,使沸石残渣110在盐酸中再浆化。
54.实施例1利用中间体中和的多步盐酸浸出
55.参见图1,将来自浸出步骤20的过滤沸石残渣110的浆液在初级浸出步骤140中在搅拌罐式反应器中用盐酸(hcl)138直接浸出,方法条件为:10-20%沸石残渣固体密度;干固体/hcl溶液的比率从1:2.5至1:5,温度:室温至90℃(虽然更高的温度会减少浸出时间)以及停留时间3小时至24小时。初级浸出步骤140产生含氯化铝溶液,并且通过过滤和逆流洗涤回收富含二氧化硅的副产物141滤饼。在一个替代性实施方案中,初级浸出步骤140可以用硫酸而不是盐酸进行。
56.将来自初级浸出步骤140的浸出液引导至中和步骤142,该中和步骤涉及通过将石灰或熟石灰143添加至搅拌罐式反应器中进行中和。中和步骤142的目的是分离含铝和钠的流。在中和步骤142期间,al
3+
以白色氢氧化铝(al(oh)3)沉淀,而钠以氯化钠保留在浸出液中。al(oh)3使用常规过滤器或离心机从浸出液中过滤出来,然后再浆化并用去离子水洗涤三次以除去夹带的na
+
。将来自中和步骤142的液体作为富含nacl和cacl2的废液147处理。这些盐可以通过喷雾干燥来回收,以产生低价值的混合盐产物和可以回收用作工艺用水的水。恢复步骤避免了对环境的压力。
57.洗涤的al(oh)3在与用于初级hcl浸出步骤140的方法条件相似的方法条件下,在
搅拌罐式反应器中用hcl 148进行次级hcl浸出步骤144。产生ach溶液,ach在结晶阶段145中结晶、再溶解和再结晶(在涉及两个结晶步骤的方法中),以形成准备好用于处理以产生如下文所述的高纯度氧化铝的纯ach。ach的结晶通过已知方法用hcl气体饱和ach溶液来实现,由于反应的放热性质,结晶混合物保持在40-80℃的温度范围内,以提供最佳沉淀条件。ach的纯度通过两个结晶步骤来提高,其中来自第一结晶步骤的ach重新溶解于去离子水或稀hcl中,然后通过hcl气体饱和再沉淀,并且在与第一结晶步骤相同的条件下结晶。
58.实施例2通向ach的单步盐酸路线
59.或者,如图2所示,ach可以在单个盐酸浸出步骤140中产生,在该实施例中,通过使沸石残渣110与hcl 138在含有32g/l al的溶液中反应,al回收率为85%。例如,方法条件涉及36重量%hcl,在室温下,反应持续时间为一小时,固体密度为10%至25%。使用搅拌罐式反应器。在较高的hcl浓度下,ach的溶解度会降低。在较低的hcl浓度下,提取也可以成功,虽然需要大量hcl以使ach溶液饱和以使ach沉淀出来。提取也可以在较低温度下进行,例如在室温下。
60.单步法的盐酸浸出步骤仅需要稍微过量至化学计量的盐酸,以用于形成ach的反应。也就是说,残渣中每一摩尔当量的铝仅添加约3摩尔当量的hcl。通过过滤或离心将酸浸出液140a与富含二氧化硅的酸浸出残渣141分离,同时对固体和液体组分进行另外的处理步骤。
61.为了从来自酸浸出步骤140的酸浸出液中沉淀ach,在结晶阶段145中通过已知方法用hcl气体饱和浸出液,并且由于反应的放热性质,混合物保持冷却以提供用于沉淀的最佳条件。ach的纯度可以通过以下方式来提高:用水或稀hcl重新溶解并用hcl气体重新沉淀,直至达到所期望的ach纯度。在本实施例中使用三个结晶阶段,而不是实施例1的两个结晶阶段。如果被证明是可取的,则可以包括用36%hcl洗涤产物。
62.高纯度氧化铝的产生
63.然后可以将纯化的六水合氯化铝(ach)149(如实施例1或2所述产生)在第一方法300中在焙烧步骤150中焙烧,然后进行焙烧步骤155以产生高纯度氧化铝(hpa,α-氧化铝)158,然后将高纯度氧化铝在洗涤步骤160中洗涤并且在碾磨步骤165中碾磨,以产生商业化所需规格的hpa 170,通常最低纯度水平为99.99%或4n。洗涤步骤160涉及用超纯水(》18.5’ω)洗涤,进行三个洗涤步骤,以除去任何残留的污染物,诸如在焙烧或煅烧步骤150和155期间引入的碱金属。将洗涤的hpa 161过滤和干燥并在碾磨步骤165中研磨至所需的尺寸,例如1μm。然后将产物hpa 170包装和销售。
64.在焙烧步骤150中,ach晶体在相对较低温度下分解成无定形或γ-氧化铝和hcl气体。使hcl气体再循环到结晶阶段145。由于氯化物的腐蚀性质,尤其是在超过1100℃的高温下,氯化物被认为是对任何煅烧炉的威胁。因此,必须在焙烧步骤150期间除去尽可能多的氯化物并且制备用于煅烧方法的低氯化物氧化铝。焙烧氧化铝(无定形或γ-氧化铝)的煅烧会产生hpa,它是一种α相氧化铝。
65.对于焙烧ach,在该实施方案中使用固定炉,虽然可以使用利用垂直炉(例如,在炼钢的酸再生步骤中使用的酸回收反应器的类型)的其他技术,诸如喷雾焙烧,所述炉配备有排气系统,用于除去在高温下ach分解反应产生的hcl气体和水。不回收hcl,虽然在其他实施方案中这是一个选项。在焙烧期间,将ach晶体装入由熔融石英制成的坩埚中并缓慢加热
至700℃,并维持该温度1小时。然后将焙烧的氧化铝在1250℃下煅烧1小时以便能够完成从无定形氧化铝至α相的转化。
66.如上文所述,由于氯化物的腐蚀性质,氯化物的存在是对煅烧炉的威胁。为了解决这个问题,hpa可以通过如虚线149所示的替代方法400由纯化的ach 149产生,虽然分流使得一些ach 149经历hpa产生方法300,而另一些ach 149经历hpa产生方法400是可能的,其中纯化的ach 149首先在溶解阶段230用超纯水溶解,以在连续搅拌下实现1m al浓度。然后将溶液加热至100℃。
67.然后在中和阶段260添加氢氧化铵溶液,以中和具有5至8的目标ph的含ach液体,从而初始沉淀氯化铵264,所述氯化铵是分离的和可能可销售的,并且最终形成勃姆石(alooh)。勃姆石的形成可以需要搅拌12至24小时。勃姆石248例如通过过滤、洗涤和干燥来分离。然后在焙烧步骤280将勃姆石248加热至500℃,以形成无定形或γ-氧化铝,然后将无定形或γ-氧化铝在煅烧步骤285中在1250℃的温度下煅烧一小时,以形成作为α相氧化铝288的hpa。
68.然后在洗涤步骤290洗涤hpa 288并且在碾磨步骤292碾磨,以产生商业化所需规格的hpa 295,通常最低纯度水平为99.99%或4n。洗涤步骤290涉及用超纯水(》18.5’ω)洗涤,进行三个洗涤步骤,以除去任何残留的污染物,诸如在焙烧或煅烧步骤280和285期间引入的碱金属。将洗涤的hpa 291过滤和干燥并在碾磨步骤292中研磨至所需的尺寸,例如1μm。将洗涤的hpa 291过滤和干燥并在碾磨步骤292中研磨至所需的尺寸,例如1μm。然后将产物hpa 295包装和销售。
69.如本文所述的方法具有通过将锂盐和高纯度氧化铝的产生相结合来提高锂提取操作的有效性的显著潜力。同时,通过再循环试剂以最大限度地降低成本和基本上除去废物,可以实现另外的商业有益效果。
70.对本文所述的用于产生氧化铝和锂盐的方法的修改和变化对于本公开的技术人员读者而言可以是显而易见的。这些修改和变化被认为在本发明的范围内。
71.在整个说明书中,除非上下文另有要求,否则词语“包括”或变体诸如“包含”或“含有”将被理解为暗示包含指定的整数或整数组,但是不排除任何其他整数或整数组。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1