制备水反应性的硫化物材料的方法与流程
制备水反应性的硫化物材料的方法
1.相关申请
2.本技术要求2020年2月17日提交的美国临时专利申请第62/977,505号和2021年1月22日提交的美国临时专利申请第63/140,624号的优先权,其每一者以全文引用的方式并入本公开的本文中。
技术领域
3.本文中所描述的各种实施例是关于制造碱金属硫化物化合物的领域,其可用于固态一次和二次电化学电池、电极和电极材料、电解质和电解质组合物。
技术实现要素:
4.在实施例中,一种用于产生水反应性的金属硫化物化合物的方法包括以下步骤:在为高溶解度碱金属硫化物和低溶解度副产物提供有差别的溶解度的极性有机溶剂中溶解基本上无水的碱金属盐和基本上无水的硫化物化合物,且形成无水的溶液;引起形成溶解于极性溶剂中的高溶解度碱金属硫化物的上清液和低溶解度副产物的沉淀物的化学反应;从上清液分离低溶解度副产物,从上清液蒸发极性溶剂,且执行最终热处理以隔离碱金属硫化物。
附图说明
5.可通过参考结合下文简要描述的图式进行的以下详细描述来理解本公开。
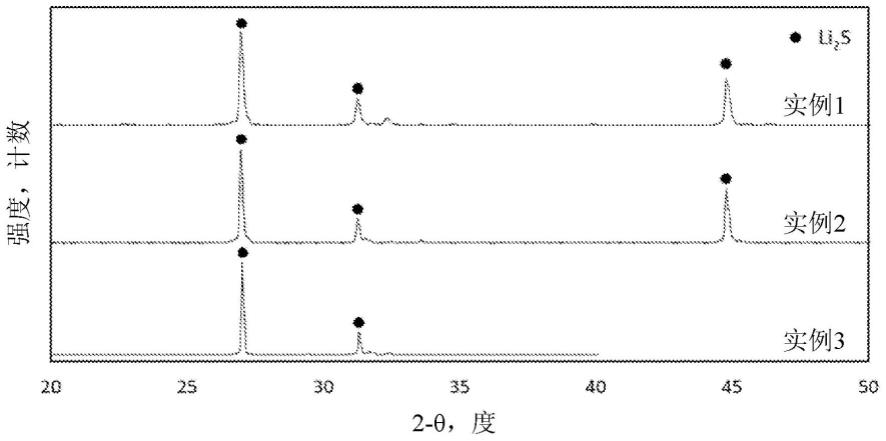
6.图1是指在实例1、实例2和实例3中合成的硫化锂(li2s)的x射线衍射图。
7.图2是指在实例4和5中合成的硫化锂(li2s)的x射线衍射图。
8.图3到图7分别是指在实例6到实例10中合成的硫化锂(li2s)的x射线衍射图。
具体实施方式
9.在以下描述中,提供了具体细节以赋予对本发明的各种实施例的透彻理解。在已阅读和理解本发明的说明书、权利要求书和图式时,然而,所属领域的技术人员将理解可在不遵守本文中所阐述的具体细节中的一些的情况下实践本发明的一些实施例。此外,为了避免混淆本发明,未详细公开在本文中所描述的各种实施例中找到应用的一些众所周知的方法、工艺、装置和系统。
10.碱金属硫化物如硫化锂-li2s是一类重要的材料,可用于固态一次和二次电化学电池、电极和电极材料、电解质和电解质组合物以及利用此类成分的最终较大系统,如计算机、无人机和电动车辆。如今,li2s最常见的用途是作为产生硫化物固态电解质的前体材料和锂硫电池的活性阴极材料。为了支持碱金属硫化物的持续增长的用途,本公开描述了使用可扩展的工艺产生更高纯度但成本更低的碱金属硫化物的进展。本文中所描述的工艺实现低成本、高纯度的金属硫化物,如li2s,这将第一次实现具有成本效益的硫化物基固体电解质、固态电池和固态电池供电的车辆。
11.由于其溶解性和自发水解的倾向,反应性和离子碱金属硫化物通常不作为天然存在的矿物质存在。用于合成碱金属硫化物的多种方法是已知的但通常会导致纯度和组成可变,或利用昂贵且有毒的材料和复杂的处理。已知的方法包含:在惰性或还原气氛中用有机化合物、碳或氢还原碱金属硫酸盐(mellor,a comprehensive treatise on inorganic and theoretical chemistry)。由于在不水解产物的情况下不良地混合和分离过量的碳,这一方法难以避免不反应的产物。smith(us3642436)教导了使碱金属与硫化氢或硫蒸气反应,但这一方法需要相对昂贵的li金属,且需要处理大量的作为高毒性和易燃气体的硫化氢。mehta(us6555078)教导了使锂盐与所要阴离子的钠盐在水溶液或半水溶液中反应,但这一工艺不适于水反应性的碱金属硫化物,因为其将引起所得材料的部分水解。barker(us8377411)教导了使用硫蒸气还原碱金属碳酸盐或氢氧化物的高温合成。这一方法的一个缺点是在所需高温下腐蚀处理设备。dawidowski(de102012208982)教导了使锂金属碱与硫化氢在有机溶剂中反应,但这一方法采用昂贵的锂有机化合物作为前体。
12.本发明呈现一种用于通过以下产生水反应性的金属硫化物材料的工艺:在基本上无水的有机极性溶剂中溶解基本上无水的碱金属盐和基本上无水的硫化物前体化合物,所述极性溶剂为基本上高溶解度碱金属硫化物和基本上低溶解度副产物提供有差别的溶解度,且形成高溶解度碱金属硫化物和低溶解度副产物的混合物;从混合物分离低溶解度副产物以隔离包含碱金属硫化物的上清液,且从碱金属硫化物分离极性溶剂以产生基本上不含水解碱金属副产物的碱金属硫化物。本发明提供一种用于产生高纯度碱金属硫化物或包括碱金属硫化物和碱金属盐的材料的低成本且可扩展的工艺。
13.在本发明的工艺中,碱金属盐可包含(但不限于)licl,且硫化物前体化合物可包含(但不限于)k2s和na2s。在用于产生li2s的示例性工艺中,licl和na2s与nacl作为副产物使用;然而,只要对应副产物氯化物具有低溶解度,可溶于极性溶剂中的任何一价阳离子的硫化物都可用来代替na2s。碱金属盐和硫化物化合物通常可呈粉末形式,以更易于溶解。可使用球磨或其它工艺将颗粒大小减小到适合于工艺的大小。碱金属盐和硫化物化合物基本上是无水的,其中含水量在0重量%到5重量%的范围内,优选地小于1重量%,更优选地小于0.1重量%且最优选地小于200ppm,而不会对本发明产生不利影响。类似地,极性有机溶剂应当基本上是无水的,其中含水量在0重量%到5重量%的范围内,优选地小于1重量%,更优选地小于0.1重量%且最优选地小于200ppm。水合程度可能影响水解,增加沉淀和分离步骤的复杂性并降低所得碱金属硫化物纯度。举例来说,理想的碱金属硫化物li2s极易溶于水且水解为lioh和h2s,这使副产物的纯化和萃取复杂化。加热干燥或真空处理可用于在使用前减少前体材料的水合。此外,在惰性气体和无水和/或真空条件下的处理可通过各种工艺步骤维持水合程度。
14.碱金属盐和硫化物化合物的粉末可单独或共同添加到极性溶剂中。粉末可在添加到极性溶剂中之前交替地混合在一起,或每种/任一种都可在将另一种材料添加到组合溶液中之前独立溶解到溶液中。准确的形态不限于粉末,且其自身可呈现为薄片、颗粒或甚至更粗的形态。示例性溶剂可包含例如(但不限于)醇,如乙醇、1-丙醇和1-丁醇。只要为高溶解度的碱金属硫化物和低溶解度副产物提供足够有差别的溶解度,且不参与与碱金属盐、硫化物化合物、碱金属硫化物和/或副产物的有害副反应,溶剂就不受特定限制。举例来说,li2s与nacl在乙醇中的溶解度的比至少为97:3,在1-丙醇中其至少为99:1,且在1-丁醇中
其至少为99.9:0.1。在下文论述的某些实施例中,na2s或li2s都不与极性溶剂发生显著程度的反应,且副产物nacl相对于碱金属硫化物在极性溶剂中具有显著地低的溶解度。
15.一方面,如果反应的产物(碱金属硫化物和副产物)在极性溶剂中具有基本上相似的溶解度,则所要碱金属硫化物产物将难以纯化。另一方面,如果处理温度过高,则在前体与所使用的溶剂之间可存在更多不合期望的副反应。另一方面,如果处理温度过低,则前体和碱金属硫化物的溶解度可能过低而不能产生所要产率。
16.只要组合允许合成所要碱金属硫化物,各种前体材料和极性溶剂的比例和量不受具体限制。比例和量也可以根据具体的合成条件而变化。举例来说,可能需要调整溶剂体积与个别前体量的比以抵消副反应或调整所得碱金属硫化物的所要纯度。只要量支持所要碱金属硫化物的合成,合成中所使用的溶剂的量不受限制。此外,多种溶剂可与所提到的化合物混合在一起。举例来说,非极性变性剂(如庚烷)可存在于醇中,只要其不会通过影响溶解度来干扰工艺。在这一步骤期间,也可添加额外的材料,如助溶剂或絮凝剂。
17.在另一实施例中,为了进一步改良所要碱金属硫化物的纯度,可在工艺期间的任何时间引入呈h2s或固体元素硫形式的硫源。在添加碱金属盐或硫化物前体材料之前,硫源可部分或完全溶解到极性和或非极性溶剂中。硫源可添加到含有碱金属盐的溶液中,添加到含有硫化物材料的溶液中,或两者都添加。当使用元素硫且将其添加到含有硫化物材料的溶液中时,可形成多硫化物,如na2s
x
,其中x大于1但小于或等于10。多硫化物可具有比材料的非多硫化物型式更大的溶解度(na2s5与na2s)。随着溶解度增加,与使用其非多硫化物对应物相比,可使用更少量的极性溶剂来达到所要的溶解。当在复分解反应期间存在元素硫时,元素硫可与新形成的硫化物材料如(但不限于)li2s
x
或lihs
x
形成多硫化物。在这一阶段形成的多硫化物可比其硫化物对应物(li2s8与li2s)具有更大的溶解度,且因此在所要金属硫化物与新形成的金属盐之间提供更大的溶解度分离。增加新形成的碱金属硫化物与非所要产物之间的溶解度差异允许减少极性溶剂的量和产生所要结果所需的非极性反溶剂的量。
18.副产物可在接近室温25℃下从溶液中自然沉淀,以形成含有高溶解度碱金属硫化物的上清液和低溶解度副产物的沉淀物。温度的调节,具体地说冷却可用于改变沉淀速率或推动低溶解度副产物的额外沉淀。可使用搅拌或其它混合来使溶液匀化,且只要其允许前体的适当匀化和反应以生成碱金属硫化物和副产物,混合时间不受具体限制。只要其允许适当的混合且不太高或太低以至于抑制碱金属硫化物的溶解度,混合温度不受具体限制。举例来说,可使用例如磁搅拌器或轴式混合器在约-50至120摄氏度的温度下完成适当的混合。这可作为分批工艺或作为由快速反应动力学帮助的持续工艺进行。此外,所要量的反溶剂如庚烷或其它非质子链烃可添加到溶液中以推动低溶解度副产物的额外沉淀。所使用的反溶剂应在7:1v/v非极性/醇到1:2v/v非极性/醇的范围内是基本上可混溶的,优选地至少3:1v/v非极性/醇,而不影响碱金属硫化物的溶解度。替代地,将额外量的离子化合物(如licl)添加到极性溶剂溶液中可进一步降低副产物(如nacl)的溶解度,从而代替对反溶剂的需要。licl或其它碱金属盐前体的总量可为化学计量的150%到85%,以便改良产物纯度和/或包含具有最终碱金属硫化物的一些量的碱金属盐。举例来说,将充分混合的li2s和licl组合的材料产物可用作用于产生包括li、s和cl的硫化物固体电解质的前体。
19.分离方法如离心、过滤或重力沉积可单独或组合使用以从混合物中分离低溶解度
副产物以隔离含有高溶解度碱金属硫化物的上清液。在一些实施例中,可在初始复分解之后执行过滤,随后用更大量的反溶剂和额外过滤来处理所得溶液/悬浮液。此外,可对冷却溶液执行分离,如过滤。
20.可通过蒸发极性溶剂、再结晶和/或在真空下加热来实现从上清液中分离极性溶剂以隔离基本上不含水解碱金属副产物的碱金属硫化物。可注意到,在这一阶段,所述材料可能看起来是干燥的,但可含有占总重量75%的溶剂。利用蒸发热量低的溶剂可能是有益的,这些溶剂使用较少能量来去除。此外,溶剂可回收并重复使用。
21.在分离出目标碱金属硫化物后,在存储或使用之前,可通过在惰性气氛(如氩气或氮气或在真空下持续预定时间段)中和温度下加热而去除残留的结合溶剂。温度范围不受限制,且例如可在25℃到900℃的范围内,更优选地200℃到700℃,最优选地350℃到500℃。
22.在另一实施例中,硫源的引入也可在目标碱金属硫化物的干燥或高温处理期间的任何时间发生。这样的例子包含(但不限于)在真空下在升高的温度下蒸发溶剂,且借助于将硫混合、掺合或研磨到新干燥的碱金属硫化物材料中来引入元素硫。所添加的硫的量可为碱金属硫化物的重量的100%或更少,更优选地碱金属硫化物的重量的50%或更少,更优选地碱金属硫化物的重量的10%或更少,更优选地碱金属硫化物的重量的7%或更少,且最优选地碱金属硫化物的重量的5%或更少。然后可将包括硫和碱金属硫化物的复合物加热到硫熔化或升华的所要温度,帮助去除溶剂并将任何含氧化合物转化为金属硫化物。
23.出于本公开的目的,术语“基本上”意味着处于接近某一参数的100%(包含100%)的状态。借助于实例,接近100%可横跨约80%到100%、约90%到100%或约95%到100%的范围。
24.一般来说,本发明的工艺通过使碱金属硫化物和金属盐溶解于脂肪醇和/或发生“双离子交换”的相似溶剂中来提供金属硫化物的低成本合成。最终结果为合成所要金属硫化物和一或多种副产物,这些副产物可通过适当选择溶剂或通过添加反溶剂(如但不限于非极性烃)然后过滤出不合期望的产物而过滤出。然后去除溶剂,留下所要纯度的金属硫化物作为产物。通用反应可由以下定义:
25.znsw+ymx
p-r-oh-》ymsw+znx
p-过滤-》ymsw26.专门用于产生li2s且包含反溶剂:
27.zns+limx
p-r-oh-》li2s+znx
p-r-r-》li2s+znx
p
—过滤-》li2s
28.na2s
(s)
+licl
(s)-r-oh-》li2s
(l)
+nacl
(l)-r-r-》li2s
(l)
+nacl
(s)-过滤-》li2s
(l)
29.使用乙醇(etoh):
30.na2s
(etoh)
+licl
(etoh)-》li2s
(etoh)
+nacl
(s)
+nacl
(etoh)-庚烷—》li2s
(etoh)
+nacl
(s)
31.li2s
(etoh)
+nacl
(s)
–
过滤—》li2s
(etoh)-去除etoh—》li2s
(s)
32.使用1-丙醇(proh)或具有比乙醇更长的碳链的(直链)醇:
33.na2s
(proh)
+licl
(proh)-》li2s
(pioh)
+nacl
(s)
–
过滤—》li2s
(pioh)
–
去除proh—》li2s
(s)
34.其中:
35.z=li、na、k、mg、ca、nh436.x=f、cl、br、i、so4、so3、no3、no237.y=li、na、k、ca、mg、ba、zn、al、cd、si、ge、fe
38.n=s的化合价电荷乘以w,全部除以z的化合价电荷
39.m=x的化合价电荷乘以p,全部除以y的化合价电荷
40.p=y的化合价电荷乘以m,全部除以x的化合价电荷
41.w=z的化合价电荷乘以n,全部除以s的化合价电荷
42.r=1与10个碳之间
43.实例
44.现在将用工作实例来说明本公开,且意图说明本公开的工作并且并不意图对本公开的范围限定任何限制。除非另外定义,否则本文中所使用的所有技术和科学术语具有与本公开所属领域中的普通技术人员通常所理解相同的含义。尽管与本文所描述的那些类似或等同的方法和材料可用于所公开的方法和组合物的实践,但本文中描述了示例性方法、装置和材料。
45.实例1
46.将1.0克无水na2s溶解于16克的无水乙醇中,其中水少于50ppm,且单独地将大约1.09克的无水licl(化学计量的量)溶解于6克的无水乙醇中,其中水少于50ppm。然后将licl溶液计量加入到持续搅拌的na2s溶液中。接近室温(25℃)时,立即发生沉淀。将混合物冷却到-25℃,然后以4000rpm离心10分钟,以便分离上清液,此时所述上清液在醇中大部分是li2s,且去除不溶的nacl副产物。此时,在真空下在200℃下使用旋转式蒸发器从上清液中去除大部分醇。在这一阶段,材料显然是干燥的,但含有大约15%的结合溶剂。将产物在氩气下在400℃下进一步热处理1小时。这一步骤用于去除残留的溶剂并将li2s烧结到微尺度。所得碱金属硫化物具有大约87%的纯度,且主要杂质为在大约32.3
°
处具有最高强度xrd峰值的氯氧化锂li3clo。氯化钠副产物以大约1.5%存在,由于冷却而低于室温溶解度。
47.实例2
48.将1.0克无水na2s溶解于16克的无水乙醇中,其中水少于50ppm,且单独地将大约1.06克的无水licl(不足化学计量的2.5%的量)溶解于6克的无水乙醇中,其中水少于50ppm。然后将licl溶液计量加入到持续搅拌的na2s溶液中。接近室温(25℃)时,立即发生沉淀。将混合物冷却到-25℃,然后以4000rpm离心10分钟,以便分离上清液,此时所述上清液在醇中大部分是li2s,且去除不溶的nacl副产物。此时,在真空下在200℃下使用旋转式蒸发器从上清液中去除大部分醇。在这一阶段,材料显然是干燥的,但含有大约15%的结合溶剂。将产物在氩气下在400℃下进一步热处理1小时。这一步骤用于去除残留的溶剂并将li2s烧结到微尺度。所得碱金属硫化物具有大约89%的纯度,且主要杂质为在大约33.5
°
处具有最高强度xrd峰值的氧化锂li2o。氯化钠副产物以大约2.1%存在。值得注意的是,与化学计量合成相比,氯氧化锂的量从7.7%减少到1.5%。
49.实例3
50.将1.0克无水na2s溶解于16克的无水乙醇中,且单独地将大约1.1克的无水licl溶解于6克的无水乙醇中。然后将licl溶液计量加入到持续搅拌的na2s溶液中。接近室温(25℃)时,立即发生沉淀。尽管nacl在乙醇中的溶解度很低,但由于过饱和,在这一阶段大约10wt.%的产物是nacl。向回收的上清液中添加60克的庚烷作为反溶剂,产生浑浊的悬浮液,所述悬浮液以2000rpm离心30分钟,以便分离上清液,此时所述上清液在醇中大部分是li2s,且去除不溶的nacl副产物。此时,在真空下在200℃下使用旋转式蒸发器从上清液中去除溶剂。一旦去除大部分溶剂,则将产物在氩气下在400℃下进一步热处理1h。这一步骤
用于完全干燥产物并将li2s烧结到微尺度。所得碱金属硫化物具有大于95%的纯度。
51.实例4
52.将1.0克无水na2s溶解于14克的无水1-丙醇中,且单独地将大约1.1克的无水licl溶解于10克的无水1-丙醇中。然后将licl溶液计量加入到持续搅拌的na2s溶液中。接近室温(25℃)时,立即发生沉淀。将混合物冷却到-25℃且然后以4000rpm离心40分钟,以便分离上清液,此时所述上清液在醇中大部分是li2s,且去除不溶的nacl副产物。此时,在真空下在200℃下使用旋转式蒸发器从上清液中去除醇。在这一阶段,材料显然是干燥的,但含有大约30%的结合溶剂。一旦已经去除大部分溶剂,则将产物在氩气下在400℃下进一步热处理1小时。这一步骤用于完全干燥产物并将li2s烧结到微尺度。所得碱金属硫化物具有大约81%的纯度。主要杂质为在30.1
°
和34.8
°
处具有峰值的氯化锂和在大约32.3
°
处具有最高强度xrd峰值的氯氧化锂li3clo。氯化钠副产物以大约0.1%存在。
53.实例5
54.将1.0克无水na2s溶解于14克的无水1-丙醇中,且单独地将大约1.06克的无水licl(不足化学计量的2.5%的量)溶解于10克的无水1-丙醇中。然后将licl溶液计量加入到持续搅拌的na2s溶液中。接近室温(25℃)时,立即发生沉淀。将混合物冷却到-25℃且然后以4000rpm离心40分钟,以便分离上清液,所述上清液在醇中大部分是li2s,且去除不溶的nacl副产物。此时,在真空下在200℃下使用旋转式蒸发器从上清液中去除大部分醇。在这一阶段,材料显然是干燥的,但含有大约30%的结合溶剂。一旦已经去除大部分溶剂,则将产物在氩气下在400℃下进一步热处理1小时。这一步骤用于完全干燥产物并将li2s烧结到微尺度。所得碱金属硫化物具有大约90%的纯度。主要杂质为在大约33.5
°
处具有最高强度xrd峰值的氧化锂和碳酸锂li2co3。氯化钠副产物以大约0.3%存在。值得注意的是,与化学计量合成相比,氯氧化锂的量显著减少。
55.实例6
56.将1.0克无水na2s溶解于19克的无水1-丁醇中,且单独地将大约1.1克的无水licl溶解于13克的无水1-丁醇中。然后将licl溶液计量加入到持续搅拌的na2s溶液中。接近室温(25℃)时,立即发生沉淀。以4000rpm将混合物离心50分钟,以便分离上清液,此时所述上清液在醇中大部分是li2s,且去除不溶的nacl副产物。此时,在30℃下使用旋转式蒸发器从上清液中去除醇。一旦已经去除大部分溶剂,则将产物在氩气下在400℃下处理1小时。这一步骤用于完全干燥产物并将li2s烧结到微尺度。所得碱金属硫化物具有大约90%的纯度。主要杂质为在大约33.5
°
处具有最高强度xrd峰值的氧化锂和碳酸锂li2co3。氯化钠副产物以大约0.3%存在。
57.实例7
58.将1.0克无水na2s溶解于12克的95.6%乙醇和4.4%水的混合物中。如us2,838,374中所公开,由于一些na2s形成不溶于醇的水合物,因此溶解是不完全的。单独地将大约1.09克的无水licl溶解于6克的95.6%乙醇中。然后将licl溶液计量加入到持续搅拌的na2s溶液中。接近室温(25℃)时,立即发生沉淀。以4000rpm将混合物离心10分钟,以便分离上清液,此时所述上清液在醇中大部分是li2s,且去除不溶的nacl副产物。此时,在真空下在200℃下使用旋转式蒸发器从上清液中去除大部分醇。在这一阶段,材料显然是干燥的,但含有大约15%的结合溶剂。将产物在氩气下在400℃下进一步热处理1小时。这一步骤用
于去除残留的溶剂并将li2s烧结到微尺度。所得碱金属硫化物具有大约68%的纯度,且主要杂质为14%的氢氧化锂、8%的氯化钠和9%的氧化锂。
59.实例8
60.将1.0克的无水na2s溶解于16克的无水乙醇中,且将大约1.1克的无水licl添加到na2s乙醇溶液中,同时持续搅拌溶液。接近室温(25℃)时,立即发生沉淀。将混合物冷却到-25℃且然后以4000rpm离心10分钟,以便分离上清液,此时所述上清液在醇中大部分是li2s,且去除不溶的nacl副产物。此时,在真空下在200℃下使用旋转式蒸发器从上清液中去除醇。一旦干燥产物,则在氩气下将混合物加热到400℃持续1小时。所得碱金属硫化物具有约90%的纯度。主要杂质为在大约32.3
°
处具有最高强度xrd峰值的5.7%的氯氧化锂li3clo。氯化钠副产物以大约1.3%存在。
61.实例9
62.将1.0克无水na2s溶解于10克的无水乙醇中,其中水少于50ppm,且单独地将大约1.06克的无水licl(不足化学计量的2.5%的量)溶解于6克的无水乙醇中,其中水少于50ppm。然后将licl溶液计量加入到持续搅拌的na2s溶液中。接近室温(25℃)时,立即发生沉淀。将混合物冷却到-25℃,然后以4000rpm离心10分钟,以便分离上清液,此时所述上清液在醇中大部分是li2s,且去除不溶的nacl副产物。此时,在真空下在200℃下使用旋转式蒸发器从上清液中去除大部分醇。在这一阶段,材料显然是干燥的,但含有大约15%的结合溶剂。使用研钵和研杵将产物与约0.03克的元素硫(5wt%)掺合,然后在氩气下在400℃下进一步热处理1小时。这一步骤用于去除残留的溶剂并将残留的杂质还原为硫化物。所得碱金属硫化物具有大约94%的纯度,且主要杂质为在大约31.8
°
处最高强度xrd峰值的碳酸锂。氯化钠副产物以大约1.1%存在。值得注意的是,氯氧化锂和氧化锂完全除去。
63.实例10
64.将与0.059克的元素硫(10wt%的预期li2s产率)混合的1.0克的无水na2s溶解于12克的无水乙醇中。溶液为黄色,指示聚硫化物的存在。单独地将大约1.2克的无水licl(超过化学计量的10%的量)溶解于6克的无水乙醇中。然后将licl溶液计量加入到持续搅拌的na2s
x
溶液中。接近室温(25℃)时,立即发生沉淀。以4000rpm将混合物离心10分钟,以便分离上清液,此时所述上清液大部分是li2s,在醇中具有过量的li2s,且去除不溶的nacl副产物。此时,在真空下在200℃下使用旋转式蒸发器从上清液中去除醇。一旦已经去除大部分溶剂且干燥产物,则在氩气下将混合物加热到400℃持续1小时。多硫化物歧化为li2s和游离硫,从而将存在的杂质还原为更多硫化物。所得碱金属硫化物具有86%的纯度。主要杂质为在大约30.1
°
和34.9
°
处具有最高强度xrd峰值的过量氯化锂前体,其以大约10.9%存在。
65.上文所描述的特征以及下文所要求的那些特征可在不脱离本发明的范围的情况下以不同方式组合。先前实例说明一些可能的非限制性组合。因此应注意,在上述描述所含有或在附图中所示的主题应以说明性而非限制性含义进行解释。上文所描述的实施例应被视为本发明的实例,而不是限制各种发明的范围。除了发明的前述实施例以外,查阅详细描述和附图将显示存在此类发明的其它实施例。因此,在本文中未明确阐述的发明的前述实施例的许多组合、排列、变化形式和修改将仍然落入此类发明的范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1