过渡金属掺杂的氧化钌纳米材料、其制备方法及用途
1.本发明属于无机先进纳米材料技术领域,具体涉及过渡金属掺杂的氧化钌纳米材料、其制备方法及用途。
背景技术:
2.为了实现能源的绿色、可持续发展,具有高热值和低污染的氢气是最理想的产品。水是唯一可用的无化石氢气来源,而电解水技术已成为连接清洁能源与可持续发展目标中提供氢气的最可行的方法之一。碱性电解水器(alk)和质子交换膜水电解器(pem)是通过电解水技术生产氢气的两种主流技术;而与碱性电解水器(alk)相比,质子交换膜水电解器(pem)具有产氢更纯,电流密度更大(>1a/cm2),能源效率更高(74%~87%)的优点。因此,质子交换膜水电解器(pem)被认为是最具发展前景的电解水制氢技术。
3.氧气进化反应(oer)在清洁能源技术中起着关键作用,包括通过水电解制氢、电化学或光电化学二氧化碳还原和用于生产清洁电力的可逆燃料电池。从本质上讲,oer的过程是一个四电子和四质子耦合的电化学反应,与her 相比,需要更高的能量(即更高的过电位)来克服动力学障碍。在过去的几十年里,大量的研究工作致力于设计和开发具有更好的电极动力学和稳定性的 oer电催化剂。目前,具有金红石结构的贵金属钌(ru)和铱(ir)氧化物是酸性介质中oer的两种最佳催化剂,但由于贵金属的价格日益增长且其地球丰度日益减少,使其很难大规模使用,很难满足未来对氢能的需求。
4.氧化钌(ruo2)作为酸性oer催化剂,活性极高;但由于工作介质的强酸性以及其高价氧化物ruo4的形成电位在酸性oer的工作电位范围内,使得酸性oer过程中伴随着钌的氧化,并且溶解在电解液中,最终导致钌的活性位点减少和催化剂的析氧反应性能的衰减。为了提高氧化钌基(ruo2)电催化剂的性能,有必要提高每个活性位点的内在性能,并增加其密度。过渡金属的加入可以通过改变氧化钌(ruo2)的高活性表面物质电子的配位环境,进一步改善其与含氧中间体(go*、goh*)的吸附来调整其固有的电化学性能。过渡金属的加入,在提升氧化钌(ruo2)基催化剂的活性与稳定性的同时,也减少了贵金属钌的使用。
5.为了解决以上问题并实现以上目标,提出本发明。
技术实现要素:
6.本发明采用水热法,制备出过渡金属掺杂的氧化钌纳米材料,其用作酸性析氧电极材料时表现出超高活性和较好的稳定性。
7.本发明公开过渡金属掺杂的氧化钌纳米材料,所述过渡金属掺杂的氧化钌纳米材料分子式为m
x
ru
1-xo2;
8.其中,m为过渡金属,所述过渡金属选自:cr、mn、ge、in、sn、sb、 nb、ti、zr、hf、w、mo、ta、pt中的一种。
9.优选地,所述过渡金属掺杂的氧化钌纳米材料中,所述过渡金属掺杂到氧化钌晶体内部,所述过渡金属代替了部分晶格中钌的位置且所述过渡金属在氧化钌晶体内部是均
匀分散的。
10.优选地,所述纳米颗粒尺寸为5~2000nm。
11.优选地,所述过渡金属掺杂的氧化钌纳米材料为表面粗糙的纳米颗粒。
12.优选地,所述过渡金属掺杂的氧化钌纳米材料中过渡金属和钌是均匀分散的。
13.优选地,所述过渡金属掺杂的氧化钌纳米材料中,过渡金属掺杂比例是 1%-50%,以所述过渡金属掺杂的氧化钌纳米材料中金属总摩尔份数为基准。过渡金属掺杂比例计算公式是:n过渡金属/(n过渡金属+n钌),其中n为摩尔份数。
14.本发明第二方面提供第一方面所述的过渡金属掺杂的氧化钌纳米材料的制备方法,所述制备方法为水热法,包括以下步骤:
15.步骤(1)、将可溶性过渡金属源依次加入含有可溶性钌源的溶液中得到混合物,将上述混合物充分搅拌后,加入含多个配点的聚合物,继续充分搅拌后,将混合物转移至水热釜中,于恒温烘箱内保温数小时后取出,自然冷却至室温,洗涤离心后,干燥,得到含过渡金属前驱体;
16.步骤(2)、将步骤(1)得到的过渡金属前驱体放入马弗炉中,升温到所需温度,保温数小时后,自然冷却后取出,得到粉末,即得所述的过渡金属掺杂的氧化钌纳米材料;
17.优选地,所述过渡金属源为过渡金属的氯化物、过渡金属的高价化合物、过渡金属的有机酯化物、过渡金属的羰基化合物、过渡金属的草酸盐中的一种或几种;
18.所述钌源为氯化钌、乙酰丙酮钌、羰基钌或者亚硝酰基硝酸合钌中的一种或几种;
19.所述含多个配点的聚合物为聚乙烯吡咯烷酮、聚乙烯醇、聚乙二醇、聚乙二胺、聚乳酸、聚吡啶和聚酰胺中的一种或几种。
20.含过渡金属源、钌源的溶液为水溶液或醇溶液,以实现过渡金属源和钌源的溶解。
21.优选地,所述可溶性铬源为重铬酸钾和氯化铬。
22.优选地,所述可溶性锰源为高锰酸钾和四水合氯化锰。
23.优选地,所述可溶性锗源为氯化锗。
24.优选地,所述可溶性铟源为氯化铟。
25.优选地,所述可溶性锡源为五水合四氯化锡。
26.优选地,所述可溶性锑源为氯化锑。
27.优选地,所述可溶性铌源为氯化铌、草酸铌、五氧化二铌中的一种。
28.优选地,所述可溶性钛源为氯化钛。
29.优选地,所述可溶性锆源为氯化锆。
30.优选地,所述可溶性铪源为氧化铪。
31.优选地,所述可溶性钨源为氧化钨。
32.优选地,所述可溶性钼源为氯化钼。
33.优选地,所述可溶性钽源为氯化钽。
34.优选地,所述可溶性铂源为氯铂酸。
35.优选地,在步骤(1)的混合物中,过渡金属源浓度为0.001~1mol/l;所述钌源浓度为0.1~1mol/l;所述聚合物的浓度为1~50g/l。
36.优选地,在步骤(1)中,恒温烘箱温度为100~180℃,时间为4~10h。
37.优选地,在步骤(2)中,所述升温的速率为1~10℃/min,所述所需温度为 300~
500℃,保温时间为3~5h。
38.本发明第三方面提供第一方面任一项所述的过渡金属掺杂的氧化钌纳米材料用于电极材料的用途。
39.优选地,所述过渡金属掺杂的氧化钌纳米材料用于酸性电解水析氧的阳极材料。
40.优选地,所述过渡金属掺杂的氧化钌纳米材料用于提高材料电解水反应的活性和稳定性。
41.相对于现有技术,本发明具有以下有益效果:
42.(1)本发明的过渡金属掺杂的氧化钌纳米材料,将过渡金属掺杂到氧化钌晶体内部,过渡金属在代替了部分晶格中钌的位置的同时,没有破坏氧化钌的本征结构,即依旧完美的保持了金红石相氧化钌的晶体结构。同时,过渡金属在材料内高度均匀分散,没有杂相氧化物的生成,从而使得活性位点钌被很好的调控,在酸性析氧反应过程中也保持一定的稳定。
43.(2)本发明的过渡金属掺杂的氧化钌纳米材料颗粒尺寸均一且合成方法简单。过渡金属掺杂的氧化钌纳米材料在进一步降低贵金属钌的用量的同时,在过渡金属掺杂后,由于过渡金属的引入造成ru-o键共价性减弱,使活性位点钌处于较低的价态,从而使得过渡金属掺杂氧化钌纳米材料应用于酸性电解水析氧阳极材料过程中表现出极高的活性和较好稳定性。
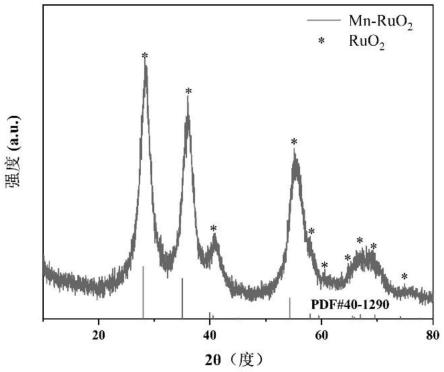
44.特别的,本发明的材料中,过渡金属元素的优势:1、在酸性电解液的稳定性测试过程中,催化剂不溶解,其在大电流密度的工作条件下,恒电流极化曲线依旧可以保持较长时间的稳定;2、锰、铬、锡等过渡金属的引入,造成ru
‑ꢀ
o键共价性减弱,其原因是:(1)在稳定性方面:锰、铬、锡等过渡金属元素,在制备过程中,锰、铬、锡等过渡金属处于高温高压的液体环境中或者采用其最高价化合物作为过渡金属源,使其处于被充分氧化的液体环境中,且其氧化物均具有很强的酸性稳定性,从而在酸性析氧过程中能够起到稳定地调控钌活性位点的作用,使得氧化钌的稳定性得到提升;
45.(2)在活性方面:氧化钌中的锰、铬、锡等过渡金属的掺杂可以调整钌活性位点的d带中心,降低反键的表面-吸附物状态,从而导致速率决定步骤的自由能降低,最终提高氧化钌的内在活性。而铁钴镍等价态较低且酸稳定性不好的过渡金属没有上述作用,通常是因为其低价态与氧化钌的四价不适配,从而造成氧缺陷,最终改变其析氧反应机理为晶格氧氧化机理,尽管提升了催化剂在酸性析氧反应的活性,但由于氧缺陷使得催化剂的稳定性不能保持。
46.(3)本发明的过渡金属掺杂的氧化钌纳米材料作为酸性电解水析氧阳极材料时,过渡金属的掺杂量在1at%~50at%(at%为金属摩尔份数百分比,以所述过渡金属掺杂的氧化钌纳米材料中金属总摩尔份数为基准)时,本征活性极高,具体从图10、图18、图25、图32、图33可以看出实施例1-18所得到的过渡金属掺杂的氧化钌纳米材料具有较好的电解水析氧性能,在10毫安每平方厘米的电流密度下过电位均低于商业二氧化钌的320毫伏。
47.(4)本发明的过渡金属掺杂的氧化钌纳米材料作为酸性电解水析氧阳极材料时,其在大电流密度200macm-2
工作条件下,恒电流极化曲线依旧可以保持稳定性80-100h,证明了过渡金属掺杂的氧化钌纳米材料具有较好的酸性析氧反应稳定性。
48.(5)本发明的制备方法为水热法。水热法为在密闭反应釜中进行简单的反应,再结
合空气焙烧条件下合成,成本低廉,方法简单,重复性好,得到的粉末纯度高、分散性好且利于环境净化,可以放大制备。本发明所述的制备方法,为合成高活性的电极材料提供了新思路。
49.(6)特别的,本发明的水热法,与金属阳离子配合形成复合物的是具有多齿配体的高分子聚合物。具有多个配点的高分子聚合物的加入,避免了可能形成的微粒团聚,有利于所掺杂的锰、铬、锡等过渡金属均匀分散在氧化钌的金红石晶格中,从而可以提升材料的活性和稳定性。
附图说明
50.图1为本发明实施例1的锰掺杂的氧化钌纳米材料扫描电镜示意图(sem);
51.图2为本发明实施例1的锰掺杂氧化钌纳米材料的x射线衍射图(xrd);
52.图3为本发明实施例1的锰掺杂的氧化钌纳米材料的元素分布图;
53.图4为本发明实施例2的铬掺杂的氧化钌纳米材料扫描电镜示意图(sem);
54.图5为本发明实施例2的铬掺杂的氧化钌纳米材料的x射线衍射图(xrd);
55.图6为本发明实施例2的铬掺杂的氧化钌纳米材料的元素分布图;
56.图7为本发明实施例3的锡掺杂的氧化钌纳米材料的扫描电镜图(sem);
57.图8为本发明实施例3的锡掺杂的氧化钌纳米材料的x射线衍射图(xrd);
58.图9为本发明实施例3的锡掺杂的氧化钌纳米材料的元素分布图;
59.图10为本发明实施例1-5所得的锰掺杂氧化钌纳米材料和商业氧化钌作为析氧阳极材料在0.5mol/l的h2so4溶液中的析氧反应的极化曲线图;其中a曲线为实施例1得到的锰掺杂氧化钌材料的极化曲线;b曲线为实施例2得到的锰掺杂氧化钌材料的极化曲线;c曲线为实施例3得到的锰掺杂氧化钌材料的极化曲线;d为实施例4得到的锰掺杂氧化钌材料的极化曲线;e为实施例5 得到的锰掺杂氧化钌材料的极化曲线;f为商业氧化钌的极化曲线;
60.图11为本发明实施例1、实施例4以及实施例5所得到的锰掺杂氧化钌材料在100毫安每平方厘米电流密度下得到的稳定性曲线;
61.图12为本发明实施例1、实施例4以及实施例5所得到的锰掺杂氧化钌材料在200毫安每平方厘米电流密度下得到的稳定性曲线;
62.图13为本发明实施例1、对比例1所得的锰掺杂氧化钌纳米材料和商业氧化钌作为析氧阳极材料在0.5mol/l的h2so4溶液中的析氧反应的极化曲线图;其中a曲线为实施例1得到的锰掺杂氧化钌材料的极化曲线;b曲线为对比例 1得到的锰掺杂氧化钌材料的极化曲线;c曲线为商业氧化钌的极化曲线;
63.图14为本发明对比例1所得到的锰掺杂氧化钌材料在100毫安每平方厘米电流密度下得到的稳定性曲线;
64.图15为本发明对比例1所得到的锰掺杂氧化钌材料在200毫安每平方厘米电流密度下得到的稳定性曲线;
65.图16为本发明实施例1、对比例2所得的锰掺杂氧化钌纳米材料和商业氧化钌作为析氧阳极材料在0.5mol/l的h2so4溶液中的析氧反应的极化曲线图;其中a曲线为对比例2得到的锰掺杂氧化钌材料的极化曲线;b曲线为实施例 1得到的锰掺杂氧化钌材料的极化曲线;c曲线为商业氧化钌的极化曲线;
66.图17为本发明对比例2所得到的锰掺杂氧化钌材料在50毫安每平方厘米电流密度下得到的稳定性曲线;
67.图18为本发明实施例6、对比例3所得的铬掺杂氧化钌纳米材料和商业氧化钌作为析氧阳极材料在0.5mol/l的h2so4溶液中的析氧反应的极化曲线图;其中a曲线为对比例3得到的铬掺杂氧化钌材料的极化曲线;b曲线为实施例 6得到的铬掺杂氧化钌材料的极化曲线;c曲线为商业氧化钌的极化曲线;
68.图19为本发明实施例6所得到的铬掺杂氧化钌材料在100毫安每平方厘米电流密度下得到的稳定性曲线;
69.图20为本发明实施例6所得到的铬掺杂氧化钌材料在200毫安每平方厘米电流密度下得到的稳定性曲线;
70.图21为本发明对比例3所得到的铬掺杂氧化钌材料在100毫安每平方厘米电流密度下得到的稳定性曲线;
71.图22为本发明对比例3所得到的铬掺杂氧化钌材料在200毫安每平方厘米电流密度下得到的稳定性曲线;
72.图23为本发明实施例6、对比例4所得的铬掺杂氧化钌纳米材料和商业氧化钌作为析氧阳极材料在0.5mol/l的h2so4溶液中的析氧反应的极化曲线图;其中a曲线为对比例4得到的铬掺杂氧化钌材料的极化曲线;b曲线为实施例 6得到的铬掺杂氧化钌材料的极化曲线;c曲线为商业氧化钌的极化曲线;
73.图24为本发明对比例4所得到的铬掺杂氧化钌材料在50毫安每平方厘米电流密度下得到的稳定性曲线;
74.图25为本发明实施例7、对比例5所得的锡掺杂氧化钌纳米材料和商业氧化钌作为析氧阳极材料在0.5mol/l的h2so4溶液中的析氧反应的极化曲线图;其中a曲线为实施例7得到的锡掺杂氧化钌材料的极化曲线;b曲线为对比例 5得到的锡掺杂氧化钌材料的极化曲线;c曲线为商业氧化钌的极化曲线;
75.图26为本发明实施例7所得到的锡掺杂氧化钌材料在100毫安每平方厘米电流密度下得到的稳定性曲线;
76.图27为本发明实施例7所得到的锡掺杂氧化钌材料在200毫安每平方厘米电流密度下得到的稳定性曲线;
77.图28为本发明对比例5所得到的锡掺杂氧化钌材料在100毫安每平方厘米电流密度下得到的稳定性曲线;
78.图29为本发明对比例5得到的锡掺杂氧化钌材料在200毫安每平方厘米电流密度下得到的稳定性曲线;
79.图30为本发明实施例7、对比例6所得的锡掺杂氧化钌纳米材料和商业氧化钌作为析氧阳极材料在0.5mol/l的h2so4溶液中的析氧反应的极化曲线图;其中a曲线为对比例6得到的锡掺杂氧化钌材料的极化曲线;b曲线为实施例 7得到的锡掺杂氧化钌材料的极化曲线;c曲线为商业氧化钌的极化曲线;
80.图31为本发明对比例6所得到的锡掺杂氧化钌材料在100毫安每平方厘米电流密度下得到的稳定性曲线;
81.图32为本发明实施例8-12所得到的过渡金属掺杂氧化钌纳米材料与商业氧化钌
作为析氧阳极材料在0.5mol/l的h2so4溶液中的析氧反应的极化曲线图;其中a曲线为实施例8得到的锗掺杂氧化钌材料的极化曲线;b曲线为实施例 9得到的铟掺杂氧化钌材料的极化曲线;c曲线为实施例10得到的锑掺杂氧化钌材料的极化曲线;d曲线为实施例11得到的铌掺杂氧化钌材料的极化曲线; e曲线为实施例12得到的钛掺杂氧化钌材料的极化曲线;f曲线为商业氧化钌的极化曲线;
82.图33为本发明实施例13-18所得到的过渡金属掺杂氧化钌纳米材料与商业氧化钌作为析氧阳极材料在0.5mol/l的h2so4溶液中的析氧反应的极化曲线图;其中a曲线为实施例13得到的锆掺杂氧化钌材料的极化曲线;b曲线为实施例 14得到的铪掺杂氧化钌材料的极化曲线;c曲线为实施例15得到的钨掺杂氧化钌材料的极化曲线;d曲线为实施例16得到的钼掺杂氧化钌材料的极化曲线; e曲线为实施例17得到的钽掺杂氧化钌材料的极化曲线;f曲线为实施例18得到的铂掺杂氧化钌材料的极化曲线;g曲线为商业氧化钌的极化曲线;
83.图34为本发明实施例8-12所得到的过渡金属掺杂氧化钌纳米材料在200 毫安每平方厘米的电流密度下得到的稳定性曲线。
84.图35为本发明实施例13-18所得到的过渡金属掺杂氧化钌纳米材料在200 毫安每平方厘米的电流密度下得到的稳定性曲线。
85.图36为本发明实施例19-23所得到的锰掺杂氧化钌纳米材料与商业氧化钌作为析氧阳极材料在0.5mol/l的h2so4溶液中的析氧反应的极化曲线图;其中 a曲线为实施例19得到的锰掺杂氧化钌材料的极化曲线;b曲线为实施例20 得到的锰掺杂氧化钌材料的极化曲线;c曲线为实施例21得到的锰掺杂氧化钌材料的极化曲线;d曲线为实施例22得到的锰掺杂氧化钌材料的极化曲线;e 曲线为实施例23得到的锰掺杂氧化钌材料的极化曲线;f曲线为商业氧化钌的极化曲线;
86.图37为本发明实施例19-23所得到的锰掺杂氧化钌纳米材料在200毫安每平方厘米的电流密度下得到的稳定性曲线。
87.图38为商业氧化钌在100毫安每平方厘米电流密度下的恒电流测试曲线。
具体实施方式
88.下面对本发明通过实施例作进一步说明,但不仅限于本实施例。实施例中未注明具体条件的实验方法,通常按照常规条件以及手册中所述的条件,或按照制造厂商所建议的条件所用的通用设备、材料、试剂等,如无特殊说明,均可从商业途径得到。以下实施例和对比例中所需要的原料均为市售。
89.以下实验中,均使用三电极体系测试本发明的过渡金属掺杂的氧化钌纳米材料的电解水析氧活性,得到极化曲线。三电极体系:参比电极为甘汞电极,对电极为铂片电极,工作电极为实施例所得到的过渡金属掺杂的氧化钌纳米材料。当需要进行对比时,工作电极使用下文中具体的其他材料作为对比。
90.以下实验中,均使用两电极体系测试本发明的过渡金属掺杂的氧化钌纳米材料的电解水析氧稳定性,得到稳定性曲线。两电极体系:阴极为铂片电极,阳极为实施例所得到的过渡金属掺杂的氧化钌纳米材料。当需要进行对比时,工作电极使用下文中具体的其他材料作为对比。
91.实施例1-水热法
92.一种锰掺杂氧化钌纳米材料的制备方法,包括以下步骤:
93.(1)、在烧杯中放入氯化钌的水溶液,随后依次加入超声均匀的高锰酸钾溶液、四水合氯化锰溶液,使得二价锰离子处于充分被氧化的液体环境中。待所有反应液添加完成,充分搅拌0.5h。控制烧杯中,氯化钌浓度为0.4mol/l,氯化锰的浓度为0.1mol/l。之后向该溶液中加入聚乙烯吡咯烷酮粉末,控制烧杯中聚乙烯吡咯烷酮的浓度为50g/l,继续搅拌1h后,得到颜色均一的锰-氧化钌溶液。
94.之后将烧杯中的反应液转移至水热釜中,置于鼓风烘箱中恒温180℃保温 10h。取出水热釜,自然冷却至室温后,将釜内反应液用去离子水、无水乙醇交替离心、洗涤数次后,放入80℃烘箱烘干,得到颜色均一的金属粉末前驱体。
95.(2)、将步骤(1)得到的金属粉末前驱体放入瓷舟中,然后将含有金属粉末前驱体的瓷舟放入马弗炉中;设置升温速率10℃/min,升温至400℃,保温3h 后自然冷却,即得到所述的锰掺杂的氧化钌纳米材料,其中锰的掺杂量是20%。锰掺杂量计算公式是:n锰/(n锰+n钌)=0.1/0.5=20%。对锰掺杂的氧化钌纳米材料进行表征:
96.所得到的锰掺杂氧化钌纳米材料的扫描电镜图参见附图1,其xrd谱图参见附图2。从图1可以看出锰掺杂的氧化钌纳米材料呈尺寸在70-200nm之间的球状颗粒,且表面粗糙。
97.得到的锰掺杂的氧化钌纳米材料的xrd谱图参见附图2。从图2可以看出锰掺杂氧化钌纳米材料表现了金红石相氧化钌的特征峰,且相比于金红石相氧化钌的标准卡片,锰掺杂氧化钌的衍射峰向高角度移动,且没有任何锰氧化物的衍射峰,表明锰元素成功掺杂如氧化钌的晶体内,没有分相产生。即所述锰掺杂氧化钌纳米材料中锰掺杂到氧化钌晶体内部代替了部分晶格中钌的位置。
98.因此,图2证明,材料的分子式是mn
x
ru
1-x
o2。
99.得到的锰掺杂氧化钌纳米材料的元素分布图如图3所示。从图3可以看出锰掺杂氧化钌纳米材料的元素分布均匀,表明锰在氧化钌晶体内部的均匀分散。因此,所述锰掺杂氧化钌纳米材料中锰和钌都是均匀分散的。
100.实施例2—水热法
101.参见实施例1中方法,将聚乙烯吡咯烷酮换为聚乙烯醇。控制烧杯中,氯化钌溶液的浓度为1mol/l,氯化锰溶液溶度为0.01mol/l,控制烧杯中聚乙烯醇的浓度为50g/l。所述马弗炉焙烧条件是:升温速率为10℃/min,保温温度为400℃,保温时间为3h。
102.锰掺杂的氧化钌纳米材料中锰的掺杂量是1%。锰掺杂量计算公式是:n锰 /(n锰+n钌)=0.01/(1+0.01)1=1%。
103.实施例3—水热法
104.参见实施例1中方法,将聚乙烯吡咯烷酮换为聚乙二胺。控制烧杯中,氯化钌溶液的浓度为1mol/l,氯化锰溶液溶度为1mol/l,控制烧杯中聚乙二胺的浓度为50g/l。所述马弗炉焙烧条件是:升温速率为10℃/min,保温温度为 400℃,保温时间为3h。
105.锰掺杂的氧化钌纳米材料中锰的掺杂量是50%。锰掺杂量计算公式是:n 锰/(n锰+n钌)=1/(1+1)=50%。
106.实施例4—水热法
107.参见实施例1中方法,控制烧杯中,氯化钌溶液的浓度为0.4mol/l,氯化锰溶液溶
度为0.1mol/l,控制烧杯中聚乙烯吡咯烷酮的浓度为1g/l。所述马弗炉焙烧条件是:升温速率为10℃/min,保温温度为400℃,保温时间为3h。
108.锰掺杂的氧化钌纳米材料中锰的掺杂量是20%。锰掺杂量计算公式是:n 锰/(n锰+n钌)=0.1/(0.4+0.1)=20%。
109.实施例5—水热法
110.参见实施例1中方法,将聚乙烯吡咯烷酮换为聚乳酸。控制烧杯中,氯化钌溶液的浓度为0.4mol/l,氯化锰溶液溶度为0.1mol/l,控制烧杯中聚乳酸的浓度为1g/l。所述马弗炉焙烧条件是:升温速率为10℃/min,保温温度为 400℃,保温时间为3h。
111.锰掺杂的氧化钌纳米材料中锰的掺杂量是20%。锰掺杂量计算公式是:n 锰/(n锰+n钌)=0.1/(0.4+0.1)20%。
112.对比例1—水热法
113.本领域技术人员一般认为配合物的存在可以促使过渡金属锰掺杂进入氧化钌晶格中,同时提高催化剂的稳定性。
114.本对比例以配合物柠檬酸铵为例,进行以下实验:
115.参考实施例1的制备方法,与实施例1的区别仅在于,用柠檬酸铵代替多配点的聚乙烯吡咯烷酮即:在反应液转移至水热釜前,在其中加入柠檬酸铵,控制柠檬酸铵的浓度为50g/l。后加入氨水调ph为中性。在搅拌过程中,将该柠檬酸铵溶液与反应液混合,充分搅拌后,即得到所述的锰掺杂的氧化钌纳米材料,其中锰的掺杂量是20%。锰掺杂量计算公式是:n锰/(n锰+n钌) =0.1/0.5=20%。
116.对比例2—水热法
117.本对比例以四水合氯化锰、高锰酸钾为例,进行以下实验:
118.参考实施例1的制备方法,与实施例1的区别仅在于,未加入多配点的聚乙烯吡咯烷酮,充分搅拌、反应后,即得到所述的锰掺杂的氧化钌纳米材料,其中锰的掺杂量是20%。锰掺杂量计算公式是:n锰/(n锰+n钌)=1/5=20%。
119.实施例6—水热法
120.一种铬掺杂氧化钌纳米材料的制备方法,包括以下步骤:
121.(1)、在烧杯中放入氯化钌的水溶液,随后依次加入超声均匀的重铬酸钾溶液、氯化铬溶液,使得三价铬离子处于充分被氧化的液体环境中。待所有反应液添加完成,充分搅拌0.5h。控制烧杯中,氯化钌浓度为0.4mol/l,氯化铬的浓度为0.1mol/l。之后向该溶液中加入聚乙烯吡咯烷酮粉末,控制烧杯中聚乙烯吡咯烷酮的浓度为50g/l,继续搅拌1h后,得到颜色均一的铬-氧化钌溶液。
122.之后将烧杯中的反应液转移至水热釜中,置于鼓风烘箱中恒温180℃保温 10h。取出水热釜,自然冷却至室温后,将釜内反应液用去离子水、无水乙醇交替离心、洗涤数次后,放入80℃烘箱烘干,得到颜色均一的金属粉末前驱体。
123.(2)、将步骤(1)得到的金属粉末前驱体放入瓷舟中,然后将含有金属粉末前驱体的瓷舟放入马弗炉中;设置升温速率10℃/min,升温至400℃,保温3h 后自然冷却,即得到所述的铬掺杂的氧化钌纳米材料,其中铬的掺杂量是20%。铬掺杂量计算公式是:n铬/(n铬+n钌)=0.1/0.5=20%。
124.对铬掺杂的氧化钌纳米材料进行表征:
125.所得到的铬掺杂氧化钌纳米材料的扫描电镜图参见附图4,其xrd谱图参见附图5。从图4可以看出铬掺杂的氧化钌纳米材料呈尺寸在70-200nm之间的球状颗粒,且表面较为粗糙。
126.得到的铬掺杂的氧化钌纳米材料的xrd谱图参见附图5。从图5可以看出铬掺杂氧化钌纳米材料表现了金红石相氧化钌的特征峰,且相比于金红石相氧化钌的标准卡片,铬掺杂氧化钌的衍射峰向高角度移动,且没有任何铬氧化物的衍射峰,表明铬元素成功掺杂到氧化钌的晶体内,没有分相产生。即所述铬掺杂氧化钌纳米材料中铬掺杂到氧化钌晶体内部代替了部分晶格中钌的位置。
127.因此,图5证明,材料的分子式是cr
x
ru
1-x
o2。
128.得到的铬掺杂氧化钌纳米材料的元素分布图如图6所示。从图6可以看出铬掺杂氧化钌纳米材料的元素分布均匀,表明铬在氧化钌晶体内部的均匀分散。因此,所述铬掺杂氧化钌纳米材料中铬和钌都是均匀分散的。
129.对比例3—水热法
130.本领域技术人员一般认为配合物的存在可以促使过渡金属铬掺杂进入氧化钌晶体中,同时提高催化剂的稳定性。
131.本对比例以配合物柠檬酸铵为例,进行以下实验:
132.参考实施例6的制备方法,与实施例6的区别仅在于,用柠檬酸铵代替多配点的聚乙烯吡咯烷酮即:在反应液转移至水热釜前,在其中加入柠檬酸铵,控制柠檬酸铵的浓度为50g/l。后加入氨水调ph为中性。在搅拌过程中,将该柠檬酸铵溶液与反应液混合,充分搅拌后,即得到所述的铬掺杂的氧化钌纳米材料,其中铬的掺杂量是20%。铬掺杂量计算公式是:n铬/(n铬+n钌) =1/5=20%。
133.对比例4—水热法
134.本对比例以氯化铬、重铬酸钾为例,进行以下实验:
135.参考实施例6的制备方法,与实施例6的区别仅在于,未加入多配点的聚乙烯吡咯烷酮,充分搅拌、反应后,即得到所述的铬掺杂的氧化钌纳米材料,其中铬的掺杂量是20%。铬掺杂量计算公式是:n铬/(n铬+n钌)=1/5=20%。
136.实施例7—水热法
137.一种锡掺杂氧化钌纳米材料的制备方法,包括以下步骤:
138.(1)、在烧杯中放入氯化钌的水溶液,随后加入超声均匀的五水合四氯化锡溶液;待所有反应液添加完成,烧杯置于超声中充分超声1h。控制烧杯中,氯化钌浓度为0.4mol/l,氯化锡的浓度为0.1mol/l。之后向该溶液中加入聚乙烯吡咯烷酮粉末,控制烧杯中聚乙烯吡咯烷酮的浓度为50g/l,继续搅拌1h后,得到颜色均一的锡-氧化钌溶液。
139.之后将烧杯中的反应液转移至水热釜中,置于鼓风烘箱中恒温180℃保温 10h。取出水热釜,自然冷却至室温后,将釜内反应液用去离子水、无水乙醇交替离心、洗涤数次后,放入80℃烘箱烘干,得到颜色均一的金属粉末前驱体。
140.(2)、将步骤(1)得到的金属粉末前驱体放入瓷舟中,然后将含有金属粉末前驱体的瓷舟放入马弗炉中;设置升温速率10℃/min,升温至400℃,保温3h 后自然冷却,即得到所述的锡掺杂的氧化钌纳米材料,其中锡的掺杂量是20%。锡掺杂量计算公式是:n锡/(n锡+n钌)=0.1/0.5=20%。
141.对锡掺杂的氧化钌纳米材料进行表征:
142.所得到的锡掺杂氧化钌纳米材料的扫描电镜图参见附图7,其xrd谱图参见附图8。从图7可以看出锡掺杂的氧化钌纳米材料呈尺寸在70-200nm之间的球状颗粒,且表面粗糙。
143.得到的锡掺杂的氧化钌纳米材料的xrd谱图参见附图8。从图8可以看出锡掺杂氧化钌纳米材料表现了金红石相氧化钌的特征峰,且相比于金红石相氧化钌的标准卡片,锡掺杂氧化钌的衍射峰向高角度移动,且没有任何锡氧化物的衍射峰,表明锡元素成功掺杂如氧化钌的晶体内,没有分相产生。即所述锡掺杂氧化钌纳米材料中锡掺杂到氧化钌晶体内部代替了部分晶格中钌的位置。
144.因此,图8证明,材料的分子式是sn
x
ru
1-x
o2。
145.得到的锡掺杂氧化钌纳米材料的元素分布图如图9所示。从图9可以看出锡掺杂氧化钌纳米材料的元素分布均匀,表明锡在氧化钌晶体内部的均匀分散。因此,所述锡掺杂氧化钌纳米材料中锡和钌都是均匀分散的。
146.对比例5—水热法
147.本领域技术人员一般认为配合物的存在可以促使过渡金属锡掺杂进入氧化钌晶体中,同时提高催化剂的稳定性。
148.本对比例以配合物柠檬酸铵为例,进行以下实验:
149.参考实施例7的制备方法,与实施例7的区别仅在于,用柠檬酸铵代替多配点的聚乙烯吡咯烷酮即:在反应液转移至水热釜前,在其中加入柠檬酸铵,控制柠檬酸铵的浓度为50g/l。后加入氨水调ph为中性。在搅拌过程中,将该柠檬酸铵溶液与反应液混合,充分搅拌后,即得到所述的锡掺杂的氧化钌纳米材料,其中锡的掺杂量是20%。锡掺杂量计算公式是:n锡/(n锡+n钌) =1/5=20%。
150.对比例6—水热法
151.本对比例以五水合四氯化锡为例,进行以下实验:
152.参考实施例7的制备方法,与实施例7的区别仅在于,未加入多配点的聚乙烯吡咯烷酮,充分搅拌、反应后,即得到所述的锡掺杂的氧化钌纳米材料,其中锡的掺杂量是20%。锡掺杂量计算公式是:n锡/(n锡+n钌)=1/5=20%。
153.实施例8—锗掺杂氧化钌
154.一种锗掺杂氧化钌纳米材料的制备方法,包括以下步骤:
155.(1)、在烧杯中放入氯化钌的水溶液,随后加入超声均匀的四氯化锗溶液;待所有反应液添加完成,机械搅拌1h。控制烧杯中,氯化钌浓度为0.4mol/l,氯化锗的浓度为0.1mol/l。之后向该溶液中加入聚乙烯吡咯烷酮粉末,控制烧杯中聚乙烯吡咯烷酮的浓度为50g/l,继续搅拌1h后,得到颜色均一的锗-氧化钌溶液。
156.之后将烧杯中的反应液转移至水热釜中,置于鼓风烘箱中恒温180℃保温 10h。取出水热釜,自然冷却至室温后,将釜内反应液用去离子水、无水乙醇交替离心、洗涤数次后,放入80℃烘箱烘干,得到颜色均一的金属粉末前驱体。
157.(2)、将步骤(1)得到的金属粉末前驱体放入瓷舟中,然后将含有金属粉末前驱体的瓷舟放入马弗炉中;设置升温速率10℃/min,升温至400℃,保温3h 后自然冷却,即得到所述的锗掺杂的氧化钌纳米材料,其中锗的掺杂量是20%。锗掺杂量计算公式是:n锗/(n锗+n钌)=0.1/0.5=20%。
158.实施例9—铟掺杂氧化钌
159.一种铟掺杂氧化钌纳米材料的制备方法,包括以下步骤:
160.(1)、在烧杯中放入氯化钌的水溶液,随后加入超声均匀的氯化铟溶液;待所有反应液添加完成,机械搅拌0.5h。控制烧杯中,氯化钌浓度为0.4mol/l,氯化铟的浓度为0.1mol/l。之后向该溶液中加入聚乙烯吡咯烷酮粉末,控制烧杯中聚乙烯吡咯烷酮的浓度为50g/l,继续搅拌1h后,得到颜色均一的铟-氧化钌溶液。
161.之后将烧杯内的反应液转移至水热釜中,置于鼓风烘箱中恒温180℃保温 10h。取出水热釜,自然冷却至室温后,将釜内反应液用去离子水、无水乙醇交替离心、洗涤数次后,放入80℃烘箱烘干,得到颜色均一的金属粉末前驱体。
162.(2)、将步骤(1)得到的金属粉末前驱体放入瓷舟中,然后将含有金属粉末前驱体的瓷舟放入马弗炉中;设置升温速率10℃/min,升温至400℃,保温3h 后自然冷却,即得到所述的铟掺杂的氧化钌纳米材料,其中铟的掺杂量是20%。铟掺杂量计算公式是:n铟/(n铟+n钌)=0.1/(0.1+0.4)=20%。
163.实施例10—锑掺杂氧化钌
164.一种锑掺杂氧化钌纳米材料的制备方法,包括以下步骤:
165.(1)、在烧杯中放入氯化钌的水溶液,随后加入超声均匀的三氯化锑溶液;待所有反应液添加完成,烧杯置于超声中充分超声1h。控制烧杯中,氯化钌浓度为0.4mol/l,氯化锑的浓度为0.1mol/l。之后向该溶液中加入聚乙烯吡咯烷酮粉末,控制烧杯中聚乙烯吡咯烷酮的浓度为50g/l,继续搅拌1h后,得到颜色均一的锑-氧化钌溶液。
166.之后将烧杯中的反应液转移至水热釜中,置于鼓风烘箱中恒温180℃保温 10h。取出水热釜,自然冷却至室温后,将釜内反应液用去离子水、无水乙醇交替离心、洗涤数次后,放入80℃烘箱烘干,得到颜色均一的金属粉末前驱体。
167.(2)、将步骤(1)得到的金属粉末前驱体放入瓷舟中,然后将含有金属粉末前驱体的瓷舟放入马弗炉中;设置升温速率10℃/min,升温至400℃,保温3h 后自然冷却,即得到所述的锑掺杂的氧化钌纳米材料,其中锑的掺杂量是20%。锑掺杂量计算公式是:n锑/(n锑+n钌)=0.1/(0.1+0.4)=20%。
168.实施例11—铌掺杂氧化钌
169.一种铌掺杂氧化钌纳米材料的制备方法,包括以下步骤:
170.(1)、在烧杯中放入氯化钌的水溶液,随后加入超声均匀的五氯化铌溶液;待所有反应液添加完成,烧杯置于超声中充分超声1h。控制烧杯中,氯化钌浓度为0.4mol/l,氯化铌的浓度为0.1mol/l。之后向该溶液中加入聚乙烯吡咯烷酮粉末,控制烧杯中聚乙烯吡咯烷酮的浓度为50g/l,继续搅拌1h后,得到颜色均一的铌-氧化钌溶液。
171.之后将烧杯中的反应液转移至水热釜中,置于鼓风烘箱中恒温180℃保温 10h。取出水热釜,自然冷却至室温后,将釜内反应液用去离子水、无水乙醇交替离心、洗涤数次后,放入80℃烘箱烘干,得到颜色均一的金属粉末前驱体。
172.(2)、将步骤(1)得到的金属粉末前驱体放入瓷舟中,然后将含有金属粉末前驱体的瓷舟放入马弗炉中;设置升温速率10℃/min,升温至400℃,保温3h 后自然冷却,即得到所述的铌掺杂的氧化钌纳米材料,其中铌的掺杂量是20%。铌掺杂量计算公式是:n铌/(n铌+n钌)=0.1/(0.1+0.4)=20%。
173.实施例12—钛掺杂氧化钌
174.一种钛掺杂氧化钌纳米材料的制备方法,包括以下步骤:
175.(1)、在烧杯中放入氯化钌的水溶液,随后加入超声均匀的氯化钛溶液;待所有反应液添加完成,烧杯置于超声中充分超声1h。控制烧杯中,氯化钌浓度为0.4mol/l,氯化钛的浓度为0.1mol/l。之后向该溶液中加入聚乙烯吡咯烷酮粉末,控制烧杯中聚乙烯吡咯烷酮的浓度为50g/l,继续搅拌1h后,得到颜色均一的钛-氧化钌溶液。
176.之后将烧杯中的反应液转移至水热釜中,置于鼓风烘箱中恒温180℃保温 10h。取出水热釜,自然冷却至室温后,将釜内反应液用去离子水、无水乙醇交替离心、洗涤数次后,放入80℃烘箱烘干,得到颜色均一的金属粉末前驱体。
177.(2)、将步骤(1)得到的金属粉末前驱体放入瓷舟中,然后将含有金属粉末前驱体的瓷舟放入马弗炉中;设置升温速率10℃/min,升温至400℃,保温3h 后自然冷却,即得到所述的钛掺杂的氧化钌纳米材料,其中钛的掺杂量是20%。钛掺杂量计算公式是:n钛/(n钛+n钌)=0.1/(0.1+0.4)=20%。
178.实施例13—锆掺杂氧化钌
179.一种锆掺杂氧化钌纳米材料的制备方法,包括以下步骤:
180.(1)、在烧杯中放入氯化钌的水溶液,随后加入超声均匀的氯化锆溶液;待所有反应液添加完成,烧杯置于超声中充分超声1h。控制烧杯中,氯化钌浓度为0.4mol/l,氯化锆的浓度为0.1mol/l。之后向该溶液中加入聚乙烯吡咯烷酮粉末,控制烧杯中聚乙烯吡咯烷酮的浓度为50g/l,继续搅拌1h后,得到颜色均一的锆-氧化钌溶液。
181.之后将烧杯中的反应液转移至水热釜中,置于鼓风烘箱中恒温180℃保温 10h。取出水热釜,自然冷却至室温后,将釜内反应液用去离子水、无水乙醇交替离心、洗涤数次后,放入80℃烘箱烘干,得到颜色均一的金属粉末前驱体。
182.(2)、将步骤(1)得到的金属粉末前驱体放入瓷舟中,然后将含有金属粉末前驱体的瓷舟放入马弗炉中;设置升温速率10℃/min,升温至400℃,保温3h 后自然冷却,即得到所述的锆掺杂的氧化钌纳米材料,其中锆的掺杂量是20%。锆掺杂量计算公式是:n锆/(n锆+n钌)=0.1/(0.1+0.4)=20%。
183.实施例14—铪掺杂氧化钌
184.一种铪掺杂氧化钌纳米材料的制备方法,包括以下步骤:
185.(1)、在烧杯中放入氯化钌的水溶液,随后加入超声均匀的氧化铪溶液;待所有反应液添加完成,机械搅拌0.5h。控制烧杯中,氯化钌浓度为0.4mol/l,氧化铪的浓度为0.1mol/l。之后向该溶液中加入聚乙烯吡咯烷酮粉末,控制烧杯中聚乙烯吡咯烷酮的浓度为50g/l,继续搅拌1h后,得到颜色均一的铪-氧化钌溶液。
186.之后将烧杯中的反应液转移至水热釜中,置于鼓风烘箱中恒温180℃保温 10h。取出水热釜,自然冷却至室温后,将釜内反应液用去离子水、无水乙醇交替离心、洗涤数次后,放入80℃烘箱烘干,得到颜色均一的金属粉末前驱体。
187.(2)、将步骤(1)得到的金属粉末前驱体放入瓷舟中,然后将含有金属粉末前驱体的瓷舟放入马弗炉中;设置升温速率10℃/min,升温至400℃,保温3h 后自然冷却,即得到所述的铪掺杂的氧化钌纳米材料,其中铪的掺杂量是20%。铪掺杂量计算公式是:n铪/(n铪+n钌)=0.1/(0.1+0.4)=20%。
188.实施例15—钨掺杂氧化钌
189.一种钨掺杂氧化钌纳米材料的制备方法,包括以下步骤:
190.(1)、在烧杯中放入氯化钌的水溶液,随后加入超声均匀的氧化钨溶液;待所有反应液添加完成,烧杯置于超声中充分超声1h。控制烧杯中,氯化钌浓度为0.4mol/l,氧化钨的浓度为0.1mol/l。之后向该溶液中加入聚乙烯吡咯烷酮粉末,控制烧杯中聚乙烯吡咯烷酮的浓度为50g/l,继续搅拌1h后,得到颜色均一的钨-氧化钌溶液。
191.之后将烧杯中的反应液转移至水热釜中,置于鼓风烘箱中恒温180℃保温 10h。取出水热釜,自然冷却至室温后,将釜内反应液用去离子水、无水乙醇交替离心、洗涤数次后,放入80℃烘箱烘干,得到颜色均一的金属粉末前驱体。
192.(2)、将步骤(1)得到的金属粉末前驱体放入瓷舟中,然后将含有金属粉末前驱体的瓷舟放入马弗炉中;设置升温速率10℃/min,升温至400℃,保温3h 后自然冷却,即得到所述的钨掺杂的氧化钌纳米材料,其中钨的掺杂量是20%。钨掺杂量计算公式是:n钨/(n钨+n钌)=20%。
193.实施例16—钼掺杂氧化钌
194.一种钼掺杂氧化钌纳米材料的制备方法,包括以下步骤:
195.(1)、在烧杯中放入氯化钌的水溶液,随后加入超声均匀的氯化钼溶液;待所有反应液添加完成,烧杯置于超声中充分超声1h。控制烧杯中,氯化钌浓度为0.4mol/l,氯化钼的浓度为0.1mol/l。之后向该溶液中加入聚乙烯吡咯烷酮粉末,控制烧杯中聚乙烯吡咯烷酮的浓度为50g/l,继续搅拌1h后,得到颜色均一的钼-氧化钌溶液。
196.之后将烧杯中的反应液转移至水热釜中,置于鼓风烘箱中恒温180℃保温 10h。取出水热釜,自然冷却至室温后,将釜内反应液用去离子水、无水乙醇交替离心、洗涤数次后,放入80℃烘箱烘干,得到颜色均一的金属粉末前驱体。
197.(2)、将步骤(1)得到的金属粉末前驱体放入瓷舟中,然后将含有金属粉末前驱体的瓷舟放入马弗炉中;设置升温速率10℃/min,升温至400℃,保温3h 后自然冷却,即得到所述的钼掺杂的氧化钌纳米材料,其中钼的掺杂量是20%。钼掺杂量计算公式是:n钼/(n钼+n钌)=20%。
198.实施例17—钽掺杂氧化钌
199.一种钽掺杂氧化钌纳米材料的制备方法,包括以下步骤:
200.(1)、在烧杯中放入氯化钌的水溶液,随后加入超声均匀的五氯化钽溶液;待所有反应液添加完成,烧杯置于超声中充分超声1h。控制烧杯中,氯化钌浓度为0.4mol/l,氯化钽的浓度为0.1mol/l。之后向该溶液中加入聚乙烯吡咯烷酮粉末,控制烧杯中聚乙烯吡咯烷酮的浓度为50g/l,继续搅拌1h后,得到颜色均一的钽-氧化钌溶液。
201.之后将烧杯中的反应液转移至水热釜中,置于鼓风烘箱中恒温180℃保温 10h。取出水热釜,自然冷却至室温后,将釜内反应液用去离子水、无水乙醇交替离心、洗涤数次后,放入80℃烘箱烘干,得到颜色均一的金属粉末前驱体。
202.(2)、将步骤(1)得到的金属粉末前驱体放入瓷舟中,然后将含有金属粉末前驱体的瓷舟放入马弗炉中;设置升温速率10℃/min,升温至400℃,保温3h 后自然冷却,即得到所述的钽掺杂的氧化钌纳米材料,其中钽的掺杂量是20%。钽掺杂量计算公式是:n钽/(n钽+n钌)=20%。
203.实施例18—铂掺杂氧化钌
204.一种铂掺杂氧化钌纳米材料的制备方法,包括以下步骤:
205.(1)、在烧杯中放入氯化钌的水溶液,随后加入超声均匀的氯铂酸溶液;待所有反应液添加完成,烧杯置于超声中充分超声1h。控制烧杯中,氯化钌浓度为0.4mol/l,氯铂酸的浓度为0.1mol/l。之后向该溶液中加入聚乙烯吡咯烷酮粉末,控制烧杯中聚乙烯吡咯烷酮的浓度为50g/l,继续搅拌1h后,得到颜色均一的铂-氧化钌溶液。
206.之后将烧杯中的反应液转移至水热釜中,置于鼓风烘箱中恒温180℃保温 10h。取出水热釜,自然冷却至室温后,将釜内反应液用去离子水、无水乙醇交替离心、洗涤数次后,放入80℃烘箱烘干,得到颜色均一的金属粉末前驱体。
207.(2)、将步骤(1)得到的金属粉末前驱体放入瓷舟中,然后将含有金属粉末前驱体的瓷舟放入马弗炉中;设置升温速率10℃/min,升温至400℃,保温3h 后自然冷却,即得到所述的钽掺杂的氧化钌纳米材料,其中铂的掺杂量是20%。钽掺杂量计算公式是:n铂/(n铂+n钌)=20%。
208.实施例19—锰掺杂氧化钌
209.参见实施例1中方法,控制烧杯中,氯化钌溶液的浓度为0.4mol/l,氯化锰溶液溶度为0.1mol/l,控制烧杯中聚乙烯吡咯烷酮的浓度为50g/l。所述烘箱反应条件是:保温温度100℃,保温时间4h;所述马弗炉焙烧条件是:升温速率为10℃/min,保温温度为400℃,保温时间为3h。
210.锰掺杂的氧化钌纳米材料中锰的掺杂量是20%。锰掺杂量计算公式是:n 锰/(n锰+n钌)=20%。
211.实施例20—锰掺杂氧化钌
212.参见实施例1中方法,控制烧杯中,氯化钌溶液的浓度为0.4mol/l,氯化锰溶液溶度为0.1mol/l,控制烧杯中聚乙烯吡咯烷酮的浓度为50g/l。所述烘箱反应条件是:保温温度180℃,保温时间4h;所述马弗炉焙烧条件是:升温速率为10℃/min,保温温度为400℃,保温时间为3h。
213.锰掺杂的氧化钌纳米材料中锰的掺杂量是20%。锰掺杂量计算公式是:n 锰/(n锰+n钌)=20%。
214.实施例21—锰掺杂氧化钌
215.参见实施例1中方法,控制烧杯中,氯化钌溶液的浓度为0.4mol/l,氯化锰溶液溶度为0.1mol/l,控制烧杯中聚乙烯吡咯烷酮的浓度为50g/l。所述烘箱反应条件是:保温温度100℃,保温时间10h;所述马弗炉焙烧条件是:升温速率为10℃/min,保温温度为400℃,保温时间为3h。
216.锰掺杂的氧化钌纳米材料中锰的掺杂量是20%。锰掺杂量计算公式是:n 锰/(n锰+n钌)=20%。
217.实施例22—锰掺杂氧化钌
218.参见实施例1中方法,控制烧杯中,氯化钌溶液的浓度为0.4mol/l,氯化锰溶液溶度为0.1mol/l,控制烧杯中聚乙烯吡咯烷酮的浓度为50g/l。所述烘箱反应条件是:保温温度180℃,保温时间10h;所述马弗炉焙烧条件是:升温速率为1℃/min,保温温度为300℃,保温时间为3h。
219.锰掺杂的氧化钌纳米材料中锰的掺杂量是20%。锰掺杂量计算公式是:n 锰/(n锰+n钌)=20%。
220.实施例23—锰掺杂氧化钌
221.参见实施例1中方法,控制烧杯中,氯化钌溶液的浓度为0.4mol/l,氯化锰溶液溶度为0.1mol/l,控制烧杯中聚乙烯吡咯烷酮的浓度为50g/l。所述烘箱反应条件是:保温温度180℃,保温时间10h;所述马弗炉焙烧条件是:升温速率为10℃/min,保温温度为500℃,保温时间为5h。
222.锰掺杂的氧化钌纳米材料中锰的掺杂量是20%。锰掺杂量计算公式是:n 锰/(n锰+n钌)=20%。
223.应用例1-活性测试
224.用三电极体系测试本发明的锰掺杂氧化钌纳米材料的电解水析氧性能:参比电极为甘汞电极,对电极为铂片电极,工作电极为实施例1-5所得到的锰掺杂氧化钌纳米材料以及商用氧化钌,在0.5mol/l的h2so4溶液中进行测试,得到的极化曲线如图10所示。
225.从图10可以看出实施例1-5所得到的锰掺杂氧化钌纳米材料具有较好的电解水析氧性能(图10的曲线a-e),明显优于商业氧化钌材料(图10的曲线f),在10毫安每平方厘米的电流密度下过电位分别为170毫伏、300毫伏、250毫伏、190毫伏、160毫伏,均低于商业氧化钌的320毫伏。
226.应用例2-稳定性测试
227.用两电极体系测试本发明的锰掺杂氧化钌纳米材料的电解水析氧反应的稳定性:阳极为实施例1、实施例4和实施例5所得到的锰掺杂氧化钌纳米材料或者商业氧化钌,阴极为铂片电极。
228.图11为本发明实施例1、实施例4和实施例5得到的锰掺杂氧化钌材料作为析氧阳极材料在0.5mol/l的h2so4溶液中,在100毫安每平方厘米电流密度下的稳定性曲线;图12为本发明实施例1、实施例4和实施例5得到的锰掺杂氧化钌材料为析氧阳极材料在0.5mol/l的h2so4溶液中,在200毫安每平方厘米电流密度下得到的稳定性曲线。
229.图11和图12可见,在100和200毫安每平方厘米的电流密度下分别保持 24小时与80-100小时,实施例1、实施例4和实施例5所得到的锰掺杂氧化钌纳米材料电流几乎不衰减,如图38所示,且该催化材料在大电流密度下的稳定性明显优于商业氧化钌;表明实施例1、实施例4以及实施例5得到的锰掺杂氧化钌纳米材料作为析氧反应阳极材料时,在大电流密度下具有较高的稳定性。
230.应用例3-活性测试
231.用三电极体系测试本发明的锰掺杂氧化钌纳米材料的电解水析氧性能:参比电极为甘汞电极,对电极为铂片电极,工作电极为实施例1、对比例1所得到的锰掺杂氧化钌纳米材料以及商用氧化钌,在0.5mol/l的h2so4溶液中进行测试,得到的极化曲线如图13所示。
232.从图13可以看出实施例1、对比例1所得到的锰掺杂氧化钌纳米材料具有较好的电解水析氧性能(图13的曲线a、b),明显优于商业氧化钌材料(图13的曲线c),在10毫安每平方厘米的电流密度下过电位分别为170毫伏、220毫伏,均低于商业氧化钌的320毫伏。
233.应用例4-稳定性测试
234.用两电极体系测试本发明的锰掺杂氧化钌纳米材料的电解水析氧反应的稳定性:
阳极为实施例1、对比例1所得到的锰掺杂氧化钌纳米材料或者商业氧化钌,阴极为铂片电极。
235.图14为本发明对比例1得到的锰掺杂氧化钌材料作为析氧阳极材料在0.5 mol/l的h2so4溶液中,在100毫安每平方厘米电流密度下的稳定性曲线;图 15为本发明对比例1得到的锰掺杂氧化钌材料为析氧阳极材料在0.5mol/l的 h2so4溶液中,在200毫安每平方厘米电流密度下得到的稳定性曲线。
236.图14和图15可见,在100和200毫安每平方厘米的电流密度下分别保持 24小时与100小时,对比例1所得到的锰掺杂氧化钌纳米材料在200毫安每平方厘米的大电流密度下,电流快速衰减;表明加入柠檬酸铵后所得的锰掺杂氧化钌纳米材料作为析氧反应阳极材料时,其在大电流密度下的稳定性不如实施例1得到的锰掺杂氧化钌纳米材料。
237.因此,本应用例发现,加入多配点高分子聚合物所形成的锰掺杂的氧化钌纳米材料作为析氧反应阳极材料时,与加入柠檬酸铵作为配合物所形成的锰掺杂的氧化钌纳米材料相比,活性和稳定性均有明显的提升。
238.应用例5-活性和稳定性测试
239.用三电极体系测试本发明的锰掺杂氧化钌纳米材料的电解水析氧性能:参比电极为甘汞电极,对电极为铂片电极,工作电极为实施例1、对比例2所得到的锰掺杂氧化钌纳米材料以及商用氧化钌,在0.5mol/l的h2so4溶液中进行测试,得到的极化曲线如图16所示。
240.用两电极体系测试本发明的锰掺杂氧化钌纳米材料的电解水析氧反应的稳定性:阳极为实施例1、对比例2所得到的锰掺杂氧化钌纳米材料或者商业氧化钌,阴极为铂片电极。
241.从图16可以看出实施例1、对比例2所得到的锰掺杂氧化钌纳米材料具有较好的电解水析氧性能(图16的曲线b、曲线a),明显优于商业氧化钌材料(图 16的曲线c),在10毫安每平方厘米的电流密度下过电位分别为170毫伏、190 毫伏,均低于商业氧化钌的320毫伏。实施例1得到的锰掺杂氧化钌纳米材料作为析氧反应阳极材料的电催化活性优于对比例2所得到的锰掺杂氧化钌纳米材料。
242.图17为本发明对比例2得到的锰掺杂氧化钌材料作为析氧阳极材料在0.5 mol/l的h2so4溶液中,在50毫安每平方厘米电流密度下的稳定性曲线;
243.图17可见,在50毫安每平方厘米的电流密度下保持半个小时,对比例2 所得到的锰掺杂氧化钌纳米材料的稳定性曲线在400秒内快速衰减,即该催化材料在较小电流密度下的稳定性极差;表明对比例2得到的锰掺杂氧化钌纳米材料作为析氧反应阳极材料时在大电流密度下的稳定性远不如实施例1得到的锰掺杂氧化钌纳米材料。这证明未加入多配点聚合物聚乙烯吡咯烷酮所制备得到的材料与实施例1相比,电催化活性和稳定性均大大降低。
244.因此,本应用例发现,加入多配点高分子聚合物所形成的锰掺杂的氧化钌纳米材料作为析氧反应阳极材料时,与未加入多配点高分子聚合物形成的锰掺杂的氧化钌纳米材料相比,电化学活性、稳定性均有明显的提升。
245.应用例6-活性测试
246.用三电极体系测试本发明的铬掺杂氧化钌纳米材料的电解水析氧性能:参比电极为甘汞电极,对电极为铂片电极,工作电极为实施例6、对比例3所得到的铬掺杂氧化钌纳米
材料以及商业二氧化钌,在0.5mol/l的h2so4溶液中进行测试,得到的极化曲线如图18所示。
247.从图18看出实施例6、对比例3制备的铬掺杂氧化钌纳米材料的析氧反应在10毫安每平方厘米的过电位均为180毫伏(图18的曲线a、曲线b),明显优于商业氧化钌材料(图18的曲线c)的320毫伏。实施例6与对比例3所得纳米材料的电化学活性相当。
248.应用例7-稳定性测试
249.用两电极体系测试本发明的铬掺杂氧化钌纳米材料的电解水析氧反应的稳定性:阳极为实施例6、对比例3所得到的铬掺杂氧化钌纳米材料或者商业氧化钌,阴极为铂片电极。
250.图19为本发明实施例6得到的铬掺杂氧化钌材料作为析氧阳极材料在0.5 mol/l的h2so4溶液中,在100毫安每平方厘米电流密度下的稳定性曲线;图 20为本发明实施例6得到的铬掺杂氧化钌材料作为析氧阳极材料在0.5mol/l的 h2so4溶液中,在200毫安每平方厘米电流密度下得到的稳定性曲线。
251.图19和图20可见,在100和200毫安每平方厘米的电流密度下分别保持 24小时与100小时,实施例6所得到的铬掺杂氧化钌纳米材料的电流几乎不衰减,如图38所示,且该催化材料在大电流密度下的稳定性明显优于商业氧化钌;表明实施例6得到的铬掺杂氧化钌纳米材料作为析氧反应阳极材料时,在大电流密度下具有较高的稳定性。
252.图21为实施本发明对比例3得到的铬掺杂氧化钌材料作为析氧阳极材料在 0.5mol/l的h2so4溶液中,在100毫安每平方厘米电流密度下的稳定性曲线;图22为本发明对比例3得到的铬掺杂氧化钌材料作作为析氧阳极材料在0.5 mol/l的h2so4溶液中,在200毫安每平方厘米电流密度下得到的稳定性曲线。
253.图21和图22可见,在100和200毫安每平方厘米的电流密度下分别保持 24小时与100小时,对比例3所得到的铬掺杂氧化钌纳米材料在200毫安每平方厘米的大电流密度下,电流快速衰减;表明加入柠檬酸铵后所得的铬掺杂氧化钌纳米材料作为析氧反应阳极材料时,其在大电流密度下的稳定性不如实施例6得到的铬掺杂氧化钌纳米材料。
254.因此,本应用例发现,加入多配点高分子聚合物所形成的铬掺杂的氧化钌纳米材料作为析氧反应阳极材料时,与加入柠檬酸铵作为配合物所形成的铬掺杂的氧化钌纳米材料相比,稳定性有明显的提升。
255.应用例8-活性和稳定性测试
256.用三电极体系测试本发明的铬掺杂氧化钌纳米材料的电解水析氧性能:参比电极为甘汞电极,对电极为铂片电极,工作电极为实施例6、对比例4所得到的铬掺杂氧化钌纳米材料以及商用氧化钌,在0.5mol/l的h2so4溶液中进行测试,得到的极化曲线如图23所示。
257.用两电极体系测试本发明的铬掺杂氧化钌纳米材料的电解水析氧反应的稳定性:阳极为实施例6、对比例4所得到的铬掺杂氧化钌纳米材料或者商业氧化钌,阴极为铂片电极。
258.从图23可以看出实施例6、对比例4所得到的铬掺杂氧化钌纳米材料具有较好的电解水析氧性能(图23的曲线b、曲线a),明显优于商业氧化钌材料(图 23的曲线c),在10毫安每平方厘米的电流密度下过电位均为170毫伏,均低于商业氧化钌的320毫伏。实施例6得到的铬掺杂氧化钌纳米材料作为析氧反应阳极材料的电催化活性与对比例4所得到的铬掺杂氧化钌纳米材料相当。
259.图24为本发明对比例4得到的铬掺杂氧化钌材料作为析氧阳极材料在0.5 mol/l的h2so4溶液中,在50毫安每平方厘米电流密度下的稳定性曲线;
260.图24可见,在50毫安每平方厘米的电流密度下保持半个小时,对比例4 所得到的铬掺杂氧化钌纳米材料,其稳定性曲线在80秒内快速衰减,即该催化材料在较小电流密度下的稳定性极差;表明对比例4得到的铬掺杂氧化钌纳米材料作为析氧反应阳极材料时在大电流密度下的稳定性远不如实施例6得到的铬掺杂氧化钌纳米材料。
261.因此,本应用例发现,加入多配点高分子聚合物所形成的铬掺杂的氧化钌纳米材料作为析氧反应阳极材料时,与未加入多配点高分子聚合物形成的锰掺杂的氧化钌纳米材料相比,稳定性有明显的提升。
262.应用例9-活性测试
263.用三电极体系测试本发明的锡掺杂氧化钌纳米材料的电解水析氧性能:参比电极为甘汞电极,对电极为铂片电极,工作电极为实施例7、对比例5所得到的锡掺杂氧化钌纳米材料以及商用氧化钌,在0.5mol/l的h2so4溶液中进行测试,得到的极化曲线如图25所示。
264.从图25可以看出实施例7所得到的锡掺杂氧化钌纳米材料具有较好的电解水析氧性能(图25的曲线a),明显优于对比例5所得到的锡掺杂氧化钌纳米材料(图25的曲线b)以及商业二氧化钌材料(图25的曲线c),在10毫安每平方厘米的电流密度下过电位为170毫伏,明显低于对比例5所得材料的220毫伏以及商业二氧化钌的320毫伏。证明实施例7得到的锡掺杂氧化钌的纳米材料比对比例5即含有柠檬酸铵的锡掺杂氧化钌的纳米材料以及商业氧化钌具有更好的析氧反应活性。
265.应用例10-稳定性测试
266.用两电极体系测试本发明的锡掺杂氧化钌纳米材料的电解水析氧反应的稳定性:阳极为实施例7所得到的锡掺杂氧化钌纳米材料或者商业氧化钌,阴极为铂片电极。
267.图26为本发明实施例7得到的锡掺杂氧化钌材料作为析氧阳极材料在0.5 mol/l的h2so4溶液中,在100毫安每平方厘米电流密度下的稳定性曲线;图 27为本发明实施例7得到的锡掺杂氧化钌材料作为析氧阳极材料在0.5mol/l的 h2so4溶液中,在200毫安每平方厘米电流密度下得到的稳定性曲线。
268.图26和图27可见,在100和200毫安每平方厘米的电流密度下分别保持 24小时与80小时,实施例7所得到的锡掺杂氧化钌纳米材料电流几乎不衰减,如图38所示,且该催化材料在大电流密度下的稳定性明显优于商业氧化钌;表明实施例7得到的锡掺杂氧化钌纳米材料作为析氧反应阳极材料时在大电流密度下具有较高的稳定性。
269.图28为本发明对比例5得到的锡掺杂氧化钌材料作为析氧阳极材料在0.5 mol/l的h2so4溶液中,在100毫安每平方厘米电流密度下的稳定性曲线;图 29为本发明对比例5得到的锡掺杂氧化钌材料作为析氧阳极材料在0.5mol/l的 h2so4溶液中,在200毫安每平方厘米电流密度下得到的稳定性曲线。
270.图28和图29可见,在100和200毫安每平方厘米的电流密度下分别保持 24小时与100小时,对比例5所得到的锡掺杂氧化钌纳米材料在200毫安每平方厘米的较大电流密度下,电流出现明显的衰减;如图36所示,但该催化材料在大电流密度下的稳定性明显优于商业氧化钌;表明加入柠檬酸铵后所得的锡掺杂氧化钌纳米材料作为析氧反应阳极材料时,在大电流密度下的稳定性优于商业氧化钌,但不如实施例7得到的锡掺杂氧化钌纳米材料。
271.因此,本应用例发现,加入多配点高分子聚合物所形成的锡掺杂的氧化钌纳米材料作为析氧反应阳极材料时,与加入柠檬酸铵作为配合物所形成的锡掺杂的氧化钌纳米材料相比,活性和稳定性均有明显的提升。
272.应用例11-活性和稳定性测试
273.用三电极体系测试本发明的锡掺杂氧化钌纳米材料的电解水析氧性能:参比电极为甘汞电极,对电极为铂片电极,工作电极为实施例7、对比例6所得到的锡掺杂氧化钌纳米材料以及商用氧化钌,在0.5mol/l的h2so4溶液中进行测试,得到的极化曲线如图30所示。
274.用两电极体系测试本发明的锡掺杂氧化钌纳米材料的电解水析氧反应的稳定性:阳极为实施例7、对比例6所得到的锡掺杂氧化钌纳米材料或者商业氧化钌,阴极为铂片电极。
275.从图30可以看出实施例7、对比例6所得到的锡掺杂氧化钌纳米材料具有较好的电解水析氧性能(图30的曲线b、曲线a),明显优于商业氧化钌材料(图 30的曲线c),在10毫安每平方厘米的电流密度下过电位分别为146毫伏、190 毫伏,均低于商业氧化钌的320毫伏。但实施例7得到的锡掺杂氧化钌纳米材料作为析氧反应阳极材料的电催化活性明显优于对比例6所得到的锡掺杂氧化钌纳米材料。
276.图31为本发明对比例6得到的锡掺杂氧化钌材料作为析氧阳极材料在0.5 mol/l的h2so4溶液中,在100毫安每平方厘米电流密度下的稳定性曲线;
277.图31可见,在100毫安每平方厘米的电流密度下保持24小时,对比例6 所得到的锡掺杂氧化钌纳米材料,其稳定性曲线在24小时内衰减了175毫伏,即该催化材料在较大电流密度下的稳定性极差;表明对比例6得到的锡掺杂氧化钌纳米材料作为析氧反应阳极材料时在大电流密度下的稳定性远不如实施例 7得到的锡掺杂氧化钌纳米材料。
278.因此,本应用例发现,加入多配点高分子聚合物所形成的锡掺杂的氧化钌纳米材料作为析氧反应阳极材料时,与未加入多配点高分子聚合物所形成的锡掺杂的氧化钌纳米材料相比,活性和稳定性均有明显的提升。
279.应用例12-活性和稳定性测试
280.用三电极体系测试本发明的锗、铟、锑、铌、钛、锆、铪、钨、钼、钽、铂掺杂氧化钌纳米材料的电解水析氧反应活性:参比电极为甘汞电极,对电极为铂片电极,工作电极为实施例8-18所得到的过渡金属掺杂氧化钌纳米材料及商业氧化钌。
281.用两电极体系测试发明的过渡金属掺杂氧化钌纳米材料的电解水析氧反应的稳定性:阳极为实施例8-18所得到的过渡金属掺杂氧化钌纳米材料或者商业氧化钌,阴极为铂片电极。
282.图32为实施例8-12所得到的过渡金属掺杂氧化钌材料在0.5mol/l的硫酸溶液中进行测试,得到的极化曲线。从图32看出,实施例8制备的锗掺杂氧化钌纳米材料析氧反应在10毫安每平方厘米时的过电位为180毫伏(图32的曲线a),实施例9制备的铟掺杂氧化钌纳米材料析氧反应在10毫安每平方厘米时的过电位为200毫伏(图32的曲线b),实施例10制备的锑掺杂氧化钌纳米材料析氧反应在10毫安每平方厘米时的过电位为180毫伏(图32的曲线 c),实施例11制备的铌掺杂氧化钌纳米材料析氧反应在10毫安每平方厘米时的过电位为180毫伏(图32的曲线d),实施例12制备的钛掺杂氧化钌纳米材料析氧反应在10毫安每平方厘米时的过电位为250毫伏(图32的曲线e),证明实施例8-12制备的过渡金属掺杂氧化
钌纳米材料的析氧反应活性明显优于商业氧化钌(图32的曲线f)。
283.图33为实施例13-18得到的过渡金属掺杂氧化钌材料在0.5mol/l的h2so4溶液中进行测试得到的极化曲线。实施例13制备的锆掺杂氧化钌纳米材料析氧反应在10毫安每平方厘米时的过电位为270毫伏(图33的曲线a),实施例 14制备的铪掺杂氧化钌纳米材料析氧反应在10毫安每平方厘米时的过电位为 270毫伏(图33的曲线b),实施例15制备的钨掺杂氧化钌纳米材料析氧反应在10毫安每平方厘米时的过电位为250毫伏(图33的曲线c),实施例16制备的钼掺杂氧化钌纳米材料析氧反应在10毫安每平方厘米时的过电位为240毫伏(图33的曲线d),实施例17制备的钽掺杂氧化钌纳米材料析氧反应在10 毫安每平方厘米时的过电位为220毫伏(图33的曲线e),实施例18制备的铂掺杂氧化钌纳米材料析氧反应在10毫安每平方厘米时的过电位为222毫伏 (图33的曲线f),证明实施例13-18制备的过渡金属掺杂氧化钌纳米材料的析氧反应活性明显优于商业氧化钌(图33的曲线g)。
284.图34为实施例8-12得到的过渡金属掺杂氧化钌材料在200毫安每平方厘米的电流密度下得到的稳定性曲线。a为实施例8制备的锗掺杂氧化钌的稳定性曲线,b为实施例9制备的铟掺杂氧化钌的稳定性曲线,c为实施例10制备的锑掺杂的氧化钌稳定性曲线,d为实施例11制备的铌掺杂氧化钌的稳定性曲线,e为实施例12制备的钛掺杂氧化钌的稳定性曲线。如图34可见,在200 毫安每平方厘米的电流密度下保持80小时,实施例8-12所得到的过渡金属掺杂氧化钌纳米材料电流几乎不衰减;与图38的商业氧化钌相比,其在100毫安每平方厘米电流密度下的稳定性测试中,稳定性曲线在测试1小时后衰减500 毫伏以上。表明以上过渡金属锗、铟、锑、铌、钛掺杂氧化钌纳米材料作为析氧反应阳极材料时在大电流密度下具有极高的稳定性。
285.图35为实施例13-18得到的过渡金属掺杂氧化钌材料在200毫安每平方厘米的电流密度下得到的稳定性曲线。a为实施例13制备的锆掺杂氧化钌的稳定性曲线,b为实施例14制备的铪掺杂氧化钌的稳定性曲线,c为实施例15制备的钨掺杂的氧化钌稳定性曲线,d为实施例16制备的钼掺杂氧化钌的稳定性曲线,e为实施例17制备的钽掺杂氧化钌的稳定性曲线,f为实施例18制备的铂掺杂氧化钌的稳定性曲线。如图35可见,在200毫安每平方厘米的电流密度下保持80小时,实施例13-18所得到的过渡金属掺杂氧化钌纳米材料电流几乎不衰减;与图38的商业氧化钌相比,其在100毫安每平方厘米电流密度下的稳定性测试中,稳定性曲线在测试1小时后衰减500毫伏以上。表明以上过渡金属锆、铪、钨、钼、钽、铂掺杂氧化钌纳米材料作为析氧反应阳极材料时在大电流密度下具有极高的稳定性。
286.应用例13-活性和稳定性测试
287.用三电极体系测试本发明的锰掺杂氧化钌纳米材料的电解水析氧反应活性:参比电极为甘汞电极,对电极为铂片电极,工作电极为实施例19-23所得到的锰掺杂氧化钌纳米材料及商业氧化钌。
288.用两电极体系测试本发明的锰掺杂氧化钌纳米材料的电解水析氧反应的稳定性:阳极为实施例19-23所得到的锰掺杂氧化钌纳米材料或者商业氧化钌,阴极为铂片电极。
289.图36为实施例19-23所得到的锰掺杂氧化钌材料在0.5mol/l的硫酸溶液中进行测试,得到的极化曲线。从图36看出,实施例19制备的锰掺杂氧化钌纳米材料析氧反应在10毫安每平方厘米时的过电位为310毫伏(图36的曲线 a),实施例20制备的锰掺杂氧化钌纳米材料析氧反应在10毫安每平方厘米时的过电位为220毫伏(图36的曲线b),实施例21制备的
锰掺杂氧化钌纳米材料析氧反应在10毫安每平方厘米时的过电位为220毫伏(图36的曲线 c),实施例22制备的锰掺杂氧化钌纳米材料析氧反应在10毫安每平方厘米时的过电位为200毫伏(图36的曲线d),实施例23制备的锰掺杂氧化钌纳米材料析氧反应在10毫安每平方厘米时的过电位为200毫伏(图36的曲线e),证明实施例19-23制备的锰掺杂氧化钌纳米材料的析氧反应活性明显优于商业氧化钌的320毫伏。(图32的曲线f)。
290.图37为实施例19-23得到的锰掺杂氧化钌材料在200毫安每平方厘米的电流密度下得到的稳定性曲线。a为实施例19制备的锰掺杂氧化钌的稳定性曲线, b为实施例20制备的锰掺杂氧化钌的稳定性曲线,c为实施例21制备的锰掺杂的氧化钌稳定性曲线,d为实施例22制备的锰掺杂氧化钌的稳定性曲线,e 为实施例23制备的锰掺杂氧化钌的稳定性曲线。如图37可见,在200毫安每平方厘米的电流密度下保持24小时,实施例19-23所得到的锰掺杂氧化钌纳米材料电流几乎不衰减;与图38的商业氧化钌相比,其在100毫安每平方厘米电流密度下的稳定性测试中,稳定性曲线在测试1小时后衰减500毫伏以上。表明以上过渡金属锰掺杂氧化钌纳米材料作为析氧反应阳极材料时在大电流密度下具有极高的稳定性。就实验条件而言,与应用例1、例2相比,步骤1与步骤2的最优反应条件为:烘箱保温温度180℃,保温时间10h;马弗炉升温速率:10℃/min,保温温度:400℃,保温时间:3h。
291.图10-图38说明本发明的过渡金属掺杂氧化钌纳米材料,在电解水过程中,作为析氧反应阳极材料的活性和稳定性优异,均优于商业氧化钌材料。
292.上述充分证明了通过加入具有多配点的高分子聚合物,结合简单的水热法以及焙烧,制备出过渡金属掺杂的氧化钌纳米材料,该类材料的表面均具有粗糙的纳米结构,高分子聚合物多齿配体的加入,大大提升了此类材料的电化学析氧反应活性及稳定性。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1