一种小盐芥液泡膜钠氢反向转运蛋白NHX1及其编码基因与应用的制作方法
本发明涉及植物蛋白及其编码基因与应用,特别是涉及一个来源于小盐芥的液泡膜钠氢反向转运蛋白NHX1及其编码基因,以及其在培育耐盐性提高的转基因植物中的应用。
背景技术:
盐胁迫是世界农业生产最重要的非生物逆境危害之一,盐渍土壤通常以钠盐、钙盐或镁盐为主,成为影响植物生长、导致粮食和经济作物减产的主要因素。世界上盐碱土的面积约有4亿公顷,占灌溉农田的1/3。盐碱地在中国分布广泛,现有盐碱地面积约0.4亿公顷。随着我国人口增加,耕地减少,盐碱地资源的开发利用有着极其重要的现实意义。而植物抗盐碱、耐干旱能力的提高和适宜在盐碱地上生长并具有较高经济和生态价值的植物种或品系的选育,则是利用盐碱地经济、有效的措施。对绝大多数农作物来说,大多数植物对盐碱、干旱的耐受性差,只能生长在氯化钠含量为0.3%以下的土壤上,土壤中过量的Na+会对植物体的正常的生长代谢产生毒害作用。因此如何在盐渍环境下提高作物产量就成为全世界农业生产中十分重要的问题。
植物的耐盐性是一个十分复杂的数量性状,其耐盐机制涉及从植株到器官、组织、生理生化直至分子的各个水平。各国的科学家也为此做了大量的工作,并取得了很多新进展,特别在利用高等模式植物拟南芥来研究植物的耐盐分子机理方面,使该领域的研究有了突破性的进展(Zhu JK.2002.Salt and drought stress singal transduction in plants.Annu.Rev.Plant Biol.53:1247-1273;Zhang ZL.2011.Arabidopsis Floral Initiator SKB1Confers High Salt Tolerance by Regulating Transcription and Pre-mRNA Splicing through Altering Histone H4R3and Small Nuclear Ribonucleoprotein LSM4Methylation.Plant Cell,23:396-411)。高等植物细胞可有多种途径感受外界环境中物化参数的变化,从而将胞外的信号变为胞内信号,通过系列的信号传导最后将胁迫信号传递至细胞核内,激活转录因子,而激活转录因子再作用于功能基因,启动逆境应答基因的表达从而提高植物的耐逆性。尽管研究者已从不同侧面开展了大量研究,但由于其机制十分复杂,植物抗盐中的许多重要问题仍有待探索。例如,植物抗盐的关键因子仍未找到;植物耐盐的分子机制并不十分清楚。
技术实现要素:
本发明人利用SSH(抑制差减杂交)与RACE(cDNA末端快速扩增)相结合的方法克隆了小盐芥的一个液泡膜钠氢反向转运蛋白(本文命名为NHX1)的编码基因,并测定了其DNA序列。并且发现通过转基因将其导入植株后,可明显改善转基因植株的耐盐性,而且这些性状可稳定遗传。
本发明第一方面提供小盐芥的一个液泡膜钠氢反向转运蛋白NHX1的编码基因(本文命名为ThNHX1),其序列为SEQ ID NO:2。
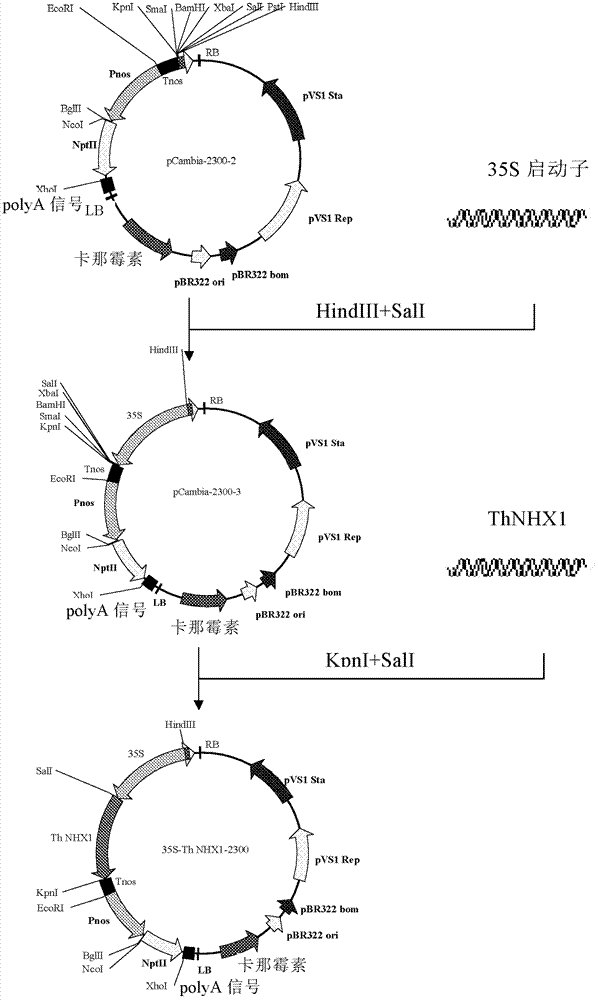
本发明第二方面提供一种重组表达载体,其含有本发明第一方面所述的基因,其是通过所述基因插入到一种表达载体而获得的,优选地,所述表达载体是pCAMBIA2300;并且所述基因的核苷酸序列与所述重组表达载体的表达控制序列可操作地连接;优选地,所述重组表达载体为附图2所示的35S-ThNHX1-2300载体。
本发明第三方面提供一种重组细胞,其含有本发明第一方面所述的基因或者本发明第二方面所述的重组表达载体;优选地,所述重组细胞为重组农杆菌细胞。
本发明第四方面提供一种改善植物耐盐性的方法,包括:将本发明第一方面所述基因或者本发明第二方面所述的重组表达载体导入植物或植物组织并使所述基因表达;优选地,所述植物是拟南芥。
本发明第五方面提供一种制备转基因植物的方法,包括:在有效产生植物的条件下培养含有本发明第一方面所述基因或者本发明第二方面所述的重组表达载体的植物或植物组织;优选地,所述植物是拟南芥。
本发明第六方面提供本发明第一方面所述的基因、本发明第二方面所述的重组表达载体或者本发明第三方面所述的重组细胞用于改善植物耐盐性以及用于植物育种的用途;优选地,所述植物是拟南芥。
本发明第七方面提供由本发明第一方面所述的基因编码的蛋白质,其氨基酸序列如SEQ ID NO:1所示。
附图说明
图1是NHX1基因的植物表达载体(35S-ThNHX1-2300)构建流程(图1a-1b)。
图2是NHX1基因的植物表达载体(35S-ThNHX1-2300)的质粒图。
图3是培养的供试植物拟南芥。
图4是ThNHX1转基因拟南芥的T1代植株的耐盐实验结果,T1a4表现出明显的耐盐性,T1a17、T1a19的结果与其类似,在此未示出。
图5为利用反转录PCR对T1代转基因烟草植株和非转基因对照植株中ThNHX1基因的转录水平进行分子水平检测的结果。M为DNALadder Marker(DL2000),1-4为不耐盐的对照拟南芥植株,13为质粒PCR阳性对照(35S-ThNHX1-2300质粒),5-12为耐盐T1代转基因拟南芥植株。
具体实施方式
提供以下实施例,以方便本领域技术人员更好地理解本发明。所述实施例仅出于示例性目的,并非意在限制本发明的范围。
下面实施例中提到的未注明来源的限制性内切酶均购自New England Biolabs公司。
实施例1.盐胁迫下小盐芥SSH文库构建:
具体方法为:
按照Clontech公司的PCR-selectTM cDNA Subtraction Kit试剂盒说明书所示的方法通过抑制差减杂交方法构建SSH文库(差减文库)。在实验过程中以生长过程中盐处理的小盐芥组织中提取的mRNA作为样本(Tester),以未处理的小盐芥组织中提取的mRNA作为对照(Driver)。具体步骤如下:
(1)供试材料:
小盐芥(Thellungiella halophila,购自中国内蒙古巴彦淖尔市乌兰布和沙漠绿色植物园盐生植物繁育中心)播种到灭菌的蛭石上,在22℃、光周期12小时光照/12小时黑暗(光强3000-4000Lx)条件下培养,每周浇1/2MS培养基(含有9.39mM KNO3,0.625mM KH2PO4,10.3mM NH4NO3,0.75mM MgSO4,1.5mM CaCl2,50μM KI,100μM H3BO3,100μM MnSO4,30μM ZnSO4,1μM Na2MoO4,0.1μM CoCl2,100μM Na2EDTA,100μM FeSO4)一次。当植株直径达到5-6cm时用于实验。
(2)材料处理:
将供试植株分为2组,每组4盆,每盆3株。第一组为对照组,正常地用1/2MS浇灌;第二组为盐处理组,浇灌含有300mM NaCl的1/2MS溶液,将两组植物在22℃、光周期12小时光照/12小时黑暗(光强3000-4000Lx)条件下培养处理10天,然后及时收集两组植株(用蒸馏水洗净根部),用液氮迅速冷冻后,于-70℃冰箱中保存。
(3)总RNA提取:
分别取对照组和盐处理组的小盐芥3.0g,用植物RNA提取试剂盒(购自Invitrogen)提取总RNA。用HITACHI公司的紫外分光光度计U-2001测定所得总RNA在260nm和280nm的吸光度值,OD260/OD280比值为1.8-2.0,表明总RNA纯度较高,用1.0%的琼脂糖凝胶电泳检测总RNA的完整性,28S条带的亮度约为18S条带的2倍,表明RNA的完整性良好。使用Qiagen公司的Oligotex mRNA纯化试剂盒(从总RNA中纯化polyA+RNA)分离mRNA。
(4)抑制差减杂交:
按Clontech公司的PCR-selectTM cDNA Subtraction Kit试剂盒说明书所示的方法进行抑制差减杂交。先将Driver mRNA和Tester mRNA分别反转录,得到双链cDNA,再以2μg Tester cDNA和2μg Driver cDNA作为起始材料进行差减杂交。在37℃水浴下分别将Tester cDNA和Driver cDNA用Rsa I酶切1.5小时,然后将酶切后的Tester cDNA分成两等份,连接上不同的接头,而Driver cDNA不连接头。两种连有不同接头的Tester cDNA分别与过量的Driver混合,进行第一次正向差减杂交。将两种第一次正向差减杂交的产物混合,再与新变性的Driver cDNA进行第二次正向差减杂交,通过两次抑制性PCR扩增富集差异表达基因的片段(PCR进行前,第二次正向差减杂交产物进行末端补平)。
(5)差减文库的构建与初步筛选、克隆、鉴定
依照pGEM-T Easy试剂盒(购自Promega)的说明书,将所述第二次正向差减杂交cDNA片段的第二次抑制性PCR扩增产物(使用QIAquick PCR Purification Kit纯化,购自Qiagen)与pGEM-T Easy载体连接,其具体步骤如下:在200μl PCR管中依次加入下列成分:纯化第二次PCR产物3μl、2×T4连接酶缓冲液5μl、pGEM-T Easy载体1μl、T4DNA连接酶1μl,于4℃连接过夜。然后取10μl连接反应产物,加入到100μl感受态大肠杆菌JM109(购自TAKARA)中,冰浴30分钟、42℃热休克60秒、冰浴2分钟,另加250μl LB液体培养基(含有1%胰蛋白胨(Tryptone,购自OXOID)、0.5%酵母提取物(Yeast Extract,购自OXOID)和1%NaCl(购自国药))后置于37℃摇床中,以225rpm振荡培养30分钟,然后从中取200μl菌液接种于含50μg/ml氨苄青霉素的LB(同上)/X-gal(5-溴-4氯-3-吲哚-β-D-半乳糖苷)/IPTG(异丙基-β-D-硫代吡喃半乳糖苷)(X-gal/IPTG购自TAKARA)培养板上,37℃培育18小时。计数培养板中直径>1mm的清晰白色及蓝色菌落,随机挑取450个白色菌落(编号:Th-S001至Th-S450)。将所挑取白色菌落克隆接种于96孔细胞培养板(CORNING)中的含50μg/ml氨苄青霉素的LB液体培养基,37℃培养过夜后加甘油至甘油终浓度为20%(体积比),然后于-80℃保存备用。对所培养的菌落克隆以巢式PCR引物Primer 1和Primer 2R(来自Clontech公司的PCR-selectTM cDNA Subtraction Kit试剂盒)进行菌液PCR扩增验证,得到342个阳性克隆,然后将所有阳性克隆送英潍捷基(上海)贸易有限公司测序。
(6)差异克隆的cDNA测序分析:
将DNA测序结果去除载体和不明确序列及冗余的cDNA后,共得到301条有效表达序列标签(Expressed sequence tag,EST)(Unigene)。
实施例2小盐芥液泡膜钠氢反向转运蛋白基因ThNHX1的克隆
将所述鉴定的小盐芥SSH文库中来自菌落Th-S211的克隆子去掉冗余DNA后,序列为SEQ ID No:3,序列分析表明该序列编码的蛋白属于液泡膜钠氢反向转运蛋白。本文将SEQ ID No:3序列对应的全长编码基因命名为ThNHX1,其对应的蛋白命名为NHX1。
SEQ ID No:3:
ThNHX1全长编码基因的克隆
根据已经获得的SEQ ID No:3序列,设计如下两条特异性引物,作为3’RACE的5’端特异性引物。
ThNHX1GSP1:SEQ ID No:4:
TCTTCTGTGG CGTTTTAATG TC
ThNHX1GSP2:SEQ ID No:5:
TCACTTCAAG GCATGTGTTT GCA
实验步骤按试剂盒说明书操作(3’RACE System for Rapid Amplification of cDNA Ends试剂盒购自Invitrogen公司)。
用SEQ ID NO:4与通用引物AUAP(试剂盒自带),以盐处理组小盐芥提取的mRNA逆转录的cDNA为模板进行第一轮PCR扩增。具体步骤如下:
50μl PCR反应体系:5μl 10×Ex Buffer、3μl 2.5mM的dNTP、2.0μl mRNA反转录的cDNA、1.0μl Ex Taq(购自TAKARA)、10μM的引物SEQ ID NO:4和AUAP各2.0μl以及35μl双蒸水。PCR反应条件:94℃预变性5分钟,33个循环(94℃变性30秒,58℃退火30秒,72℃延伸1分钟),72℃延伸10分钟。
所得的PCR产物用双蒸水稀释50倍后取2.0μl作为模板,用SEQ ID NO:5与通用引物AUAP进行第二轮PCR扩增,具体步骤如下:
50μl PCR反应体系:5μl 10×Ex Buffer、3μl 2.5mM的dNTP、2.0μl稀释的第一轮PCR产物、1.0μl Ex Taq、10μM的引物SEQ ID NO:5和AUAP各2.0μl以及35μl的双蒸水。PCR反应条件:94℃预变性5分钟,33个循环(94℃变性30秒,58℃退火30秒,72℃延伸1分钟),72℃延伸10分钟。回收第二次PCR产物中片段约为800bp的条带(Gel Extraction Kit购自OMEGA),并将其连接于pGEM-T Easy载体,然后转化到大肠杆菌JM109感受态细胞中(具体方法同上),并在含50μg/mL氨苄青霉素的LB固体培养基上进行筛选。随机挑取10个白色菌落接种于含有50μg/ml氨苄青霉素的LB液体培养基中,37℃培养过夜后加甘油至终浓度20%(体积比),-80℃保存备用。用SEQ ID NO:5与通用引物AUAP进行菌液PCR扩增,得到6个阳性克隆,将4个阳性克隆送至英潍捷基(上海)贸易有限公司测序,获得该基因的cDNA的3’端。
根据已经获得的ThNHX1基因片段,设计如下三条特异性引物,作为5’RACE的3’端特异性引物。
ThNHX1GSP3:SEQ ID No:6:
AGTGATTCTT GAACTTTCTG TC
ThNHX1GSP4:SEQ ID No:7:
AACATATATG AAAGGTATGC CA
ThNHX1GSP5:SEQ ID No:8:
GATCGCGAGT TCACGTGTAG TTG
实验步骤按试剂盒说明书操作(5’RACE System for Rapid Amplification of cDNA Ends试剂盒购自Invitrogen公司)。
用SEQ ID NO:7与通用引物AAP(试剂盒自带),以盐处理组小盐芥提取的mRNA逆转录的cDNA(反转录引物SEQ ID NO:6)为模板进行第一轮PCR扩增,具体步骤如下:
50μl PCR反应体系:5μl 10×Ex Buffer、3μl 2.5mM的dNTP、2.0μl mRNA反转录的cDNA、1.0μl Ex Taq(购自TAKARA)、10μM的引物SEQ ID NO:7和AAP各2.0μl以及35μl的双蒸水。PCR反应条件:94℃预变性5分钟,33个循环(94℃变性30秒,55℃退火30秒,72℃延伸1分钟),72℃延伸10分钟。
所得的PCR产物用双蒸水稀释50倍后取2.0μl作为模板,用SEQ ID NO:8与引物AUAP进行第二轮PCR扩增,具体步骤如下:
50μl PCR反应体系:5μl 10×Ex Buffer、3μl 2.5mM的dNTP、2.0μl稀释的第一轮PCR产物、1.0μl Ex Taq、10μM的引物SEQ ID NO:8和AUAP各2.0μl以及35μl的双蒸水。PCR反应条件:94℃预变性5分钟,33个循环(94℃变性30秒,58℃退火30秒,72℃延伸1分钟),72℃延伸10分钟。回收第二次PCR产物中片段约为800bp的条带(Gel Extraction Kit购自OMEGA),并将其连接于pGEM-T Easy载体,然后转化到大肠杆菌JM109感受态细胞中(具体方法同上),并在含50μg/mL氨苄青霉素的LB固体培养基上进行筛选。随机挑取10个白色菌落接种于含有50μg/ml氨苄青霉素的LB液体培养基中,37℃培养过夜后加甘油至甘油终浓度为20%(体积比),-80℃保存备用。用SEQ ID NO:8与引物AUAP进行菌液PCR扩增(反应体系及反应条件同上),得到7个阳性克隆,选取其中4个克隆送至英潍捷基(上海)贸易有限公司测序,获得该基因的cDNA的5’端。所得的5’RACE产物克隆测序后,将其与3’RACE产物测序结果以及SEQ ID No:3序列进行拼接。获得ThNHX1全长cDNA序列SEQ ID No:9:
根据SEQ ID NO:9序列设计一对引物如下:
SEQ ID No:10:
ATGGGTGTTGGATT TACAGAGTT
SEQ ID No:11:
CTAGCATTCT GGTTGATTAT CTC
通过SEQ ID NO:10和SEQ ID NO:11来克隆ThNHX1全长编码基因。
采用TaKaRa的PrimeSTAR HS DNA聚合酶,以盐处理组小盐芥的cDNA为模板进行PCR反应。50μl PCR反应体系:10μl 5×PS Buffer、3μl 2.5mM的dNTP、2.0μl cDNA、1.0μl PrimeSTAR、10μM的引物SEQ ID NO:10和SEQ ID NO:11各2.0μl以及30μl的双蒸水。PCR反应条件:94℃预变性5分钟,33个循环(94℃变性30秒,58℃退火30秒,72℃延伸2分钟),72℃延伸10分钟。
PCR扩增产物加A尾:PCR产物中加入2.5倍体积的无水乙醇,-20℃放置10分钟,离心,去上清,晾干,然后用21μl双蒸水溶解。然后向其中加入2.5μl10×Ex Buffer、0.5μl 5mM的dATP、1.0μl Ex Taq。反应条件:70℃反应30分钟。将得到的约1600bp的DNA片段回收(Omega回收试剂盒),并将其连接至pGEM T-easy载体上(得到ThNHX1-pGEM质粒),然后转化大肠杆菌JM109感受态细胞中(方法同上),并在含50μg/mL氨苄青霉素的LB固体培养基上进行筛选。随机挑取10个白色菌落接种于含有50μg/ml氨苄青霉素的LB液体培养基中,37℃培养过夜后加甘油至终浓度20%(体积比),-80℃保存备用。用SEQ ID NO:10与SEQ ID NO:11进行菌液PCR扩增(反应体系及反应条件同上),得到5个阳性克隆,选取其中4个阳性克隆送至英潍捷基(上海)贸易有限公司测序,所得序列为SEQ ID NO:2,其编码的蛋白质的氨基酸序列为SEQ ID NO:1。
NHX1蛋白的氨基酸序列:SEQ ID NO:1
ThNHX1基因的核苷酸序列SEQ ID NO:2
实施例3ThNHX1基因的植物表达载体构建
选择植物双元表达载体pCAMBIA2300(购自北京鼎国昌盛生物技术有限责任公司)作为植物表达载体,用Pnos启动子替换NPTII基因含双增强子的35S启动子,以降低NPTII蛋白在植物中的表达。选择35S启动子及Tnos终止子分别作为ThNHX1基因的启动子和终止子,构建流程图如图1所示。
用引物SEQ ID NO:12和SEQ ID NO:13以植物表达载体pBI121(购自北京华夏远洋科技有限公司)为模板扩增Pnos,采用TaKaRa的PrimeSTAR HS DNA聚合酶。50μl PCR反应体系:10μl 5×PS Buffer、3μl 2.5mM的dNTP、1.0μl pBI121、1.0μl PrimeSTAR、10μM的引物SEQ ID NO:12和SEQ ID NO:13各2.0μl以及31μl的双蒸水。PCR反应条件:94℃预变性5分钟,33个循环(94℃变性30秒,56℃退火30秒,72℃延伸30秒),72℃延伸10分钟。通过EcoRI、BglII酶切将所得的PCR产物按试剂盒说明(Promega,T4连接酶试剂盒)连接到pCAMBIA2300获得pCAMBIA2300-1。
SEQ ID NO:12
GCACGAATTC ggcgggaaac gacaatctga
SEQ ID NO:13
ATCCAGATCTAGATCCGGTGCAGATTATTTG
用引物SEQ ID NO:14和SEQ ID NO:15以pBI121为模板扩增Tnos,采用TaKaRa的PrimeSTAR HS DNA聚合酶。50μl PCR反应体系:10μl 5×PS Buffer、3μl 2.5mM的dNTP、1.0μl pBI121、1.0μl PrimeSTAR、10μM的引物SEQ ID NO:14和SEQ ID NO:15各2.0μl以及31μl的双蒸水。PCR反应条件:94℃预变性5分钟,33个循环(94℃变性30秒,58℃退火30秒,72℃延伸30秒),72℃延伸10分钟。通过KpnI、EcoRI酶切将所得的PCR产物连接(Promega T4连接酶试剂盒)到pCAMBIA2300-1获得pCAMBIA2300-2。
SEQ ID NO:14:
AAGGGTAACGAATTTCCCCGATCGTTCAAA
SEQ ID NO:15:
TCAGAATTCCCAGTGAATTCCCGATCTAGTA
用引物SEQ ID NO:16和SEQ ID NO:17以pCAMBIA2300为模板扩增35S启动子。采用TaKaRa的PrimeSTAR HS DNA聚合酶。50μl PCR反应体系:10μl5×PS Buffer、3μl 2.5mM的dNTP、1.0μl pCAMBIA2300、1.0μl PrimeSTAR、10μM的引物SEQ ID NO:16和SEQ ID NO:17各2.0μl以及31μl双蒸水。PCR反应条件:94℃预变性5分钟,33个循环(94℃变性30秒,58℃退火30秒,72℃延伸30秒),72℃延伸10分钟。通过HindIII、SalI酶切将所得的PCR产物连接(连接方法同上)到pCAMBIA2300-2获得pCAMBIA2300-3。
SEQ ID NO:16:
ACTAAGCTTTAGAGCAGCTTGCCAACATGGTG
SEQ ID NO:17:
TGAGTCGACAGAGATAGATTTGTAGAGAGAGACT
用引物SEQ ID NO:18和SEQ ID NO:19扩增ThNHX1编码基因的全长序列(模板是实施例2所获得阳性ThNHX1-pGEM质粒),采用TaKaRa的PrimeSTAR HS DNA聚合酶。50μl PCR反应体系:10μl 5×PS Buffer、3μl 2.5mM的dNTP、1.0μl ThNHX1-pGEM、1.0μl PrimeSTAR、10μM的引物SEQ ID NO:18和SEQ ID NO:19各2.0μl以及31μl双蒸水。PCR反应条件:94℃预变性5分钟,33个循环(94℃变性30秒,58℃退火30秒,72℃延伸2分钟),72℃延伸10分钟。通过Sal I、Kpn I酶切将所得的PCR产物连接(连接方法同上)到pCAMBIA2300-3,获得植物表达载体35S-ThNHX1-2300(图2)。
SEQ ID NO:18
ACTGTCGACATGGGTGTTGGATT TACAGAGTTT
SEQ ID NO:19
ACTGGTACCCTAGCATTCT GGTTGATTAT CTCG
实施例4 35S-ThNHX1-2300表达载体转化农杆菌
农杆菌LBA4404(购自Biovector Science Lab,Inc)感受态细胞的制备:提前1-2天将农杆菌LBA4404在含50μg/ml利福平和50μg/ml链霉素的LB固体培养基上划单斑接种,28℃培养1至2天。挑取单菌落接种于5ml含50μg/ml利福平和50μg/ml链霉素的LB液体培养基中,28℃下摇动培养过夜(约12-16小时)至OD600值为0.4,形成种子菌液。取5ml培养活化后的菌液(1∶20的比例)接种于100ml含50μg/ml利福平和50μg/ml链霉素的LB液体培养基中,28℃摇动培养2-2.5小时至OD600=0.8。冰浴菌液10分钟,每隔3分钟摇匀一次,令所述细菌均匀进入休眠状态。于4℃下4000g离心10分钟,弃上清液;加入1ml冰预冷的10%(体积比)甘油重悬浮菌体,4℃下4000g离心10分钟,收集沉淀;用冰预冷的10%(体积比)甘油重复洗3-4次;然后加入适量冰预冷的10%(体积比)甘油重新悬浮细菌沉淀,即制得LBA4404感受态细胞,以40μl/管将其分装,于-70℃保存备用。
转化农杆菌:在冰上融化所述的LBA4404感受态细胞,向40μl的感受态细胞中加入1μl实施例3获得的质粒35S-ThNHX1-2300,混匀后冰浴约10分钟。将冰浴后的感受态细胞和35S-ThNHX1-2300质粒的混合物用移液枪转移到冰预冷的电击杯(购自Bio-Rad)中,轻敲使悬浮液到达电击杯底部,注意不要有气泡。将所述电击杯放到电击室的滑道上,推动滑道将电击杯放至电击室基座电极处。使用0.1cm规格的电击杯的时候,MicroPulser(购自Bio-Rad)的程序设置为“Agr”,电击一次。立即取出电击杯,加入28℃预热的200μl LB培养基。快速而轻柔的用移液枪将感受态细胞打匀。将悬浮液转入1.5ml的离心管,在28℃下225rpm摇动培养1小时。取100-200μl的菌液涂布于相应的抗性筛选培养基平板上(LB固体培养基,含50μg/ml利福平、50μg/ml链霉素、50μg/ml卡那霉素),28℃培养。筛选阳性转化克隆,并将其菌液于-70℃保存备用。
实施例5 受体材料拟南芥培养
选择吸水性好,土质松软的蛭石配合营养土(1∶1)作为拟南芥种植土壤。直径9cm的花盆,每盆播种20-30颗。播种以后在花盆上罩上薄膜,给植株的生长提供一个湿润的环境。恒温22℃,光照强度3500-4000lx,光照周期为12小时黑暗、12小时光照培养,每7天浇灌一次1/2MS,培养30天后,保留4-5棵植株,光照周期调整为8小时黑暗、16小时光照培养,待大部分植株都抽薹之后,在花序基部剪掉整个主苔,去其顶端优势,约1周后在腋芽部位长出4-6个新生侧苔,待侧苔花序形成花蕾并部分开花或形成1-2个角果时,便可用于转化(图3)。
实施例6 拟南芥花浸转化:
将实施例4获得的已转化表达载体的农杆菌菌液接种至含有10-50μg/ml卡那霉素(kan)的LB培养基中培养过夜,第二天早上按1∶50接种至含抗生素的新的LB培养基中(1L),培养约8个小时,农杆菌液OD600应当在1.0到1.2之间。室温5000rpm离心5分钟,弃上清,将农杆菌沉淀悬浮于渗透培养基里(1/2MS;5%蔗糖;用KOH调至pH5.7;0.02%Silwet L-77),使OD600在0.8左右。将实施例5制备的用于转化的拟南芥的上部缓缓、螺旋式浸入接种培养基内,轻轻顺时针晃荡,约2分钟,用透明塑料罩盖严以保持湿度,放入温室过夜。24小时后移去塑料透明罩,用水浇透。之后2-3周,保证植株水分充足。当植株停止开花,第一个果荚成熟变黄时,用纸袋套住,当纸袋内的所有果荚变黄后,停止浇水,1-2周干燥后取回实验室,进行转化子选择,同时取未经转化处理的拟南芥果荚作为对照。
实施例7 拟南芥阳性转化子的筛选:
种子消毒:先用70%乙醇浸泡10分钟,在上述处理时要不时地使种子悬浮;然后用无菌水洗四次,在这步处理时最好也不时地使种子悬浮。处理后的种子均匀涂布在含50μg/ml kan的1/2MS固体筛选培养基表面上春化2天(一块150mm直径的平皿最多播种1500棵),恒温22℃,光照强度3500-4000lx,光照周期为12小时黑暗、12小时光照培养,培养7-10天。根据生长状况判断是否为转基因种子。成功转入重组质粒的种子能够在抗性培养基上正常生长出4片以上真叶。非转基因种子不能正常生长,仅能长出2片子叶,根的生长也受到严重抑制,一般萌发10天以后死亡。转基因种子在MS+kan平板上萌发2周以后,将阳性植株转入土壤继续培养,转基因拟南芥用SEQ ID NO:18和SEQ ID NO:19做PCR检测,去除阴性植株,收集阳性植株种子,标号:T0a1-T0a25。
实施例8 过表达ThNHX1的转基因拟南芥T1代植株的种植
选择吸水性好,土质松软的蛭石配合营养土(1∶1)作为拟南芥种植土壤。T0a1-T0a20每个转化子播种2盆,对照拟南芥播种2盆,每盆播种20-30颗种子。播种以后在花盆上罩上薄膜,给植株的生长提供一个湿润的环境。恒温22℃,光照强度3500-4000lx,光照周期为12小时黑暗、12小时光照培养,每7天浇灌一次1/2MS,培养25天后,转基因拟南芥用SEQ ID NO:18和SEQ ID NO:19做PCR检测,去除阴性植株,保留12-14阳性棵苗,继续培养10天后,选取大小一致的转基因拟南芥、对照拟南芥做耐盐实验,每盆保留大小较一致的7-9棵苗。
实施例9 过表达ThNHX1的转基因拟南芥T1代植株的耐盐实验
转基因拟南芥、对照拟南芥各一盆不作处理,正常浇灌1/2MS,转基因拟南芥、对照拟南芥各一盆浇灌含有150Mm NaCl的1/2MS,恒温22℃,光照强度3500-4000lx,12小时光培养/12小时暗培养循环。10天后观察实验结果:T1代转基因植株(T0代转基因植株的种子长成的植株)的耐盐性鉴定表明,T1代转基因植株T1a4、T1a17、T1a19三个株系表现出明显的耐盐性(见图4,以T1a4例,T1a7、T1a19的结果与其类似,在此未示出)。
实施例10 在转录水平上验证ThNHX1基因的表达
实施例9中耐盐好的T1代转基因植株中随机选取8棵(分别属于上述三个耐盐株系),实施例9中对照植株随机选取4棵,各剪取盐处理14天的叶片0.05g,用植物RNA提取试剂盒(Invitrogen)提取总RNA。紫外分光光度测定所得总RNA在260nm和280nm的吸光度值,计算各个RNA浓度。依照Invitrogen反转录试剂盒SuperScript III Reverse Transcriptase所示方法进行反转录(1μg总RNA作为模板,反转录引物SEQ ID NO:11)。通过SEQ ID NO:10和SEQ ID NO:20(SEQ ID NO:20:ATTCCGAGGA TTGTGCTAGT GA)扩增ThNHX1,检测其转录情况。采用TaKaRa的PrimeSTAR HS DNA聚合酶,以上述反转录的cDNA为模板进行PCR反应。50μl PCR反应体系:10μl 5×PS Buffer、3μl 2.5mM的dNTP、2.0μl cDNA、1.0μl PrimeSTAR、10μM的引物SEQ ID NO:10和SEQ ID NO:20各2.0μl以及30μl的双蒸水。PCR反应条件:94℃预变性5分钟,32个循环(94℃变性30秒,58℃退火30秒,72℃延伸1分钟),72℃延伸10分钟。产物电泳结果如图5所示:M为DNA Ladder Marker(DL2000,购自深圳瑞真生物技术有限公司),1-4为不耐盐对照拟南芥植株,13为质粒PCR阳性对照(35S-ThNHX1-2300质粒),5-12为耐盐T1代转引物拟南芥植株。图中所示条带大小与阳性对照的大小一致(约为700bp)。结果表明,耐盐T1代转基因拟南芥植株中ThNHX1的转录较强,不耐盐对照拟南芥植株中没有ThNHX1的转录。
- 还没有人留言评论。精彩留言会获得点赞!