具有改进的颜色和产物可计量性的5和6碳多元醇的脱水环化中的膦酸催化剂的制作方法
本申请要求来自2014年4月10日提交的国际申请号PCT/US2014/033580的优先权权益,该国际申请的内容通过引用结合在此。
发明领域
本披露涉及双官能环状化合物以及用于它们的合成的工艺。特别地,本发明涉及衍生自5和6碳多元醇的还原布朗斯特酸催化脱水的环状化合物以及其中制备这些环状化合物的工艺。
背景
传统上,已经由石油衍生的原料制备了聚合物和商品化学品。然而,随着油贮迅速地耗尽并且伴随地变得更难以接近,从生物衍生的资源开发可再生或“绿色”替代材料的紧迫性已经是许多目前研究的先锋,特别地在对于常规石油衍生的对应物的商业上可行的替代物的作用上,或者用于产生如从化石、不可再生的源产生的相同材料。
对于此类材料的生物衍生的或可再生的替代原料的最丰富种类之一是碳水化合物。然而,碳水化合物通常不适合现在的高温工业方法。与具有低官能度的石油基、疏水的脂肪族或芳香族的原料相比,碳水化合物(如糖)是复杂的、多官能化的亲水材料。其结果是,研究人员已经寻求生产以下生物基化学品,这些生物基化学品源自碳水化合物,但是它们是较小高度官能化的,包括更稳定的双官能化合物,如2,5-呋喃二甲酸(FDCA)、乙酰丙酸、以及1,4:3,6-双脱水己糖醇。
1,4:3,6-双脱水己糖醇(在此还被称为异己糖醇)衍生自可再生资源如谷物基多糖以及通过它们的水解获得的糖。异己糖醇为一类衍生自相应的还原糖醇的脱水的二环呋喃二醇,例如,分别地D-山梨糖醇、D-甘露糖醇、以及D-艾杜糖醇被脱水并且被环化成A)异山梨醇、B)异甘露糖醇、以及C)异艾杜糖醇,它们的结构在方案1中说明。
方案1:异甘露糖醇A、异山梨醇B、和异艾杜糖醇C的结构。
通过常规技术(如使用硫酸)将糖醇脱水为异己糖醇典型地导致多种不令人希望的副产物的产生。此类副产物与所希望的异己糖醇以及其他呋喃衍生物的分离仍然是复杂的且昂贵的。此外,这些副产物呈现不令人希望的产率损失。因此,一种可以产生较少副产物以及较高产率的所希望产物、以及在组成可计量性上是较好的方法将是受欢迎的。
发明概述
本披露部分地描述了一种用于从5或6碳多元醇制备环状衍生物产物的方法。该方法涉及:使5或6碳多元醇与单独地或者与一种或多种其他酸催化剂组合的还原布朗斯特酸、在足以将该5或6碳多元醇转化为相应环状分子内脱水产物的温度和时间下发生反应,使得该糖醇的至少70%或75%被转化为相应环状脱水产物。该方法可进一步包括借助于至少色谱法、结晶、和蒸馏来纯化这些脱水产物。在该反应完成后立即、而不需要经受纯化或脱色操作,该反应产物混合物具有以下外观和不透明度,该外观和不透明度范围是从具有中棕色至浅蜜色的至少半透明到透明的、澄清的或接近水白色的液体(即,在无色和澄清度上接近水)。换言之,该反应产物混合物展现出相对于使用常规硫酸催化剂制备的反应产物更浅且更半透明的颜色。
在不同的实施例中,这些环状脱水产物包括1,4-脱水葡萄糖醇(1,4脱水山梨糖醇)、一种或多种2,5-脱水葡萄糖醇(2,5脱水山梨糖醇)、1,4:2,5-脱水甘露糖醇、1,4-脱水木糖醇、或1,4:3,6-双脱水己糖醇(如异山梨醇、异甘露糖醇、异艾杜糖醇或双-2,5-(羟甲基)-四氢呋喃(THF二醇))中的至少一种。在其中山梨糖醇、甘露糖醇或艾杜糖醇是该5或6碳多元醇的示例性实施例中,该产物混合物包括作为主要产物的异山梨醇、异甘露糖醇、或异艾杜糖醇以及作为次要产物的脱水山梨糖醇中的至少一种。在其中木糖醇是该5或6碳多元醇的实施例中,该主要反应产物是1,4-脱水木糖醇。在其中1,2,5,6己四醇是该5或6碳糖多元醇的实施例中,THF-二醇是该主要产物。
本发明方法的另外的特征和优点将披露于以下详细说明中。应理解的是上述概述以及以下详细说明和实例都仅代表本发明,并且旨在提供用于理解如所要求保护的本发明的综述。
附图简要说明
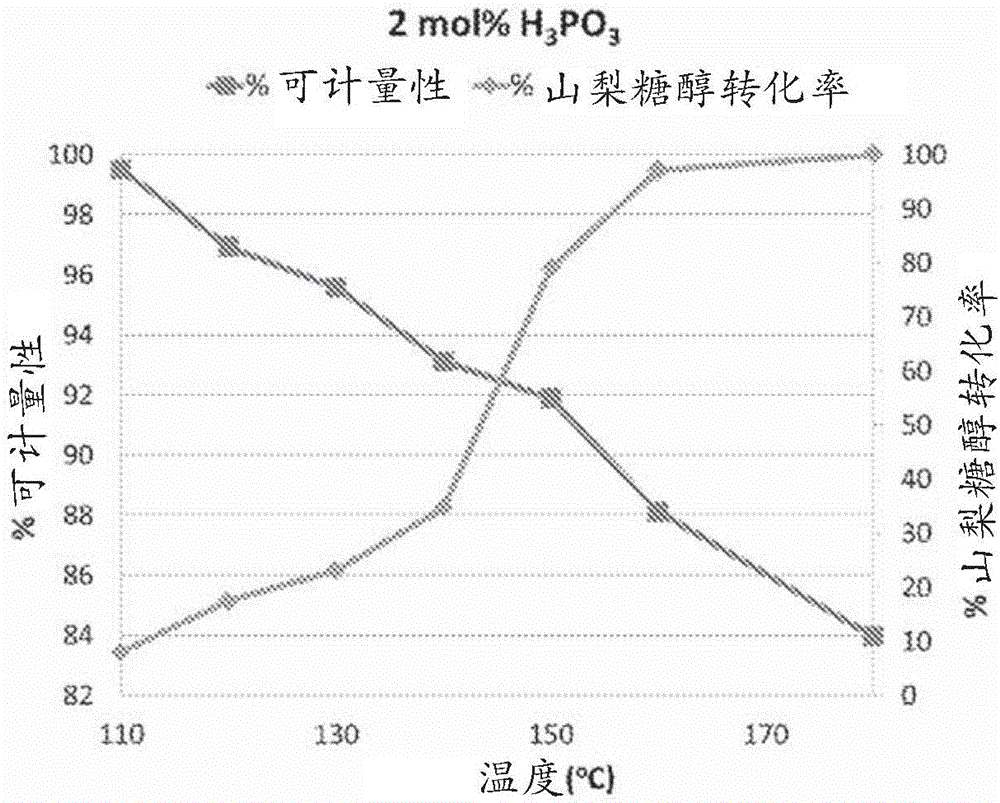
图1是一幅曲线图,该曲线图示出了使用膦酸(H3PO3)催化剂(2mol.%催化剂负载量)在不同反应温度下山梨糖醇转化率的相对百分比以及产物组成可计量性的百分比。
图2是一幅曲线图,该曲线图示出了使用膦酸催化剂(5mol.%催化剂负载量)在不同反应温度下山梨糖醇转化率的相对百分比以及产物组成可计量性的百分比。
图3是曲线图,该曲线图示出了使用膦酸催化剂(10mol.%催化剂负载量)在不同反应温度下山梨糖醇转化率的相对百分比以及产物组成可计量性的百分比。
图4是一幅曲线图,该曲线图示出了使用膦酸催化剂(13mol.%催化剂负载量)在不同反应温度下异山梨醇产率的相对百分比以及产物组成可计量性的百分比。
图5是一幅曲线图,该曲线图示出了使用膦酸催化剂(15mol.%催化剂负载量)在不同反应温度下异山梨醇产率的相对百分比以及产物组成可计量性的百分比。
图6是一幅曲线图,该曲线图示出了使用膦酸催化剂(20mol.%催化剂负载量)在不同反应温度下异山梨醇产率的相对百分比以及产物组成可计量性的百分比。
图7和8是出于比较的曲线图,这些曲线图示出了使用常规催化剂硫酸(H2SO4)分别在1.0mol.%和0.5mol.%催化剂负载量下在不同反应温度下山梨糖醇转化率的相对百分比以及产物组成可计量性的百分比。
图9是一幅照片,该照片示出了含有来自使用不同种类酸催化剂进行的山梨糖醇脱水的产物混合物的广口瓶,以及对于每种产物混合物各自的不透明度和颜色外观,从左至右各自的不透明度和颜色外观范围是从不透明的深棕色-黑色至半透明的蜜色至透明的浅黄色。如从左至右示出的,每种样品是使用A)常规硫酸(1mol.%H2SO4);B)0.5mol.%H2SO4;C)20mol.%H3PO3;D)10mol.%H3PO3;以及E)5mol.%H3PO3,各自在>5托的压力下在140℃下持续2h制备的产物。
图10是含有在本反应中使用的熔融的山梨糖醇原料的容器的照片。作为对比标准,该山梨糖醇具有主要透明的白色颜色。
图11是含有将山梨糖醇转化为异山梨醇的脱水反应的产物样品的三个瓶子的照片。从左至右,所使用的催化剂:A)0.1mol.%H2SO4;B)0.1mol.%Bi(OTf)3;和C)5mol.%H3PO3。该照片示出了相对于其他两种样品使用膦酸制备的样品的显著的产物颜色削减。
图12是比较样品的两个瓶子的照片,这些样品含有用对-TsOH(深色不透明颜色(左))和用10mol%H3PO3、120℃、3h(浅/澄清的透明的(右))制备的木糖醇至1,4-脱水木糖醇的脱水反应的产物。
图13是含有用10mol%H3PO3、140℃、3h的脱水反应的样品产物的瓶子的照片。
图14是含有用10mol%H3PO3、150℃、3h的脱水反应的样品产物的瓶子的照片。
图15A、15B、和15C是瓶子的照片,这些瓶子含有分别用20mol%H3PO3、140℃、2h,(15A),20mol%H3PO3、150℃、2h,(15B),以及10mol%H3PO3、150℃、3h,(15C)的脱水的样品产物。
图16A和16B是瓶子的照片,这些瓶子含有分别用1mol%H2SO4、110℃、3h,(16A),以及0.5mol%H2SO4、130℃、3h,(16B)脱水的对比样品产物。
发明的详细说明
I.发明说明
本披露描述了一种方法,该方法可以在由5或6碳多元醇的脱水反应制备的产物混合物中改进颜色并且增加组成可计量性。总体上,该方法涉及使5或6碳多元醇与还原布朗斯特酸催化剂在足以将该5或6碳多元醇转化为相应环状分子内脱水产物的温度和时间下发生反应。该酸催化剂在足以将基本上所有的该5或6碳多元醇转化为相应分子内脱水产物(例如,1,4-脱水葡萄糖醇(又常称为1,4脱水山梨糖醇)、一种或多种2,5-脱水葡萄糖醇(又常称为2,5脱水山梨糖醇)、1,4:2,5-脱水甘露糖醇、1,4-脱水木糖醇、或1,4:3,6-双脱水己糖醇)的温度下具有在约1与约3(±0.5)之间的pKa。该酸催化剂可以是单独地或者与2)路易斯酸、或3)固相酸催化剂组合的1)还原布朗斯特酸。
除了该脱水产物外,所产生的反应产物混合物可具有一种或多种缩聚产物。该反应产物混合物的组成的成分可计量为大于约70%或约75%的水平。在该反应完成后立即、而不必须经受随后的纯化或脱色操作,该反应产物混合物具有不透明度和颜色外观,该不透明度和颜色外观范围是从具有中棕色至浅蜜色的至少半透明或一直到透明的、澄清的或接近无色透明或水白色的液体。(参见例如,图9、11、和12。)换言之,该方法能够产生相对于常规反应体系更洁净的初始产物混合物,并且该初始产物混合物含有更可鉴别的组分以及更少混杂的聚合副产物。
在此描述的这些方法通过使用膦酸(H3PO3)(还被称为磷酸(phosphorus acid))进行5或6碳多元醇至它们相应环状衍生物的脱水来进行例示。不像先前已经用于使5或6碳多元醇脱水的磷酸(H3PO4)和其他布朗斯特酸如硫酸,膦酸具有较高的1.30的pKa并且还充当还原剂,其中随着反应混合物中另一种化学物种的还原,膦酸被氧化为磷酸。因此,膦酸是还原布朗斯特酸的实例。此类酸的还原电势允许它们用作还原剂和质子供体两者。还原酸的其他实例是具有式R(H2PO3)的膦酸(其中R是烷基或芳基部分)的有机衍生物、以及磺酸(H2SO3)和其相应有机衍生物。
尽管作为酸催化剂不进行广泛探索,我们已经发现还原布朗斯特酸如膦酸可以单独地或者与其他布朗斯特或路易斯酸催化剂组合使用用于以显著优点将5或6碳多元醇转化为其相应环状双官能衍生物材料。首先,用还原布朗斯特酸催化的反应可显著地减少不想要的颜色体的形成,这些不想要的颜色体引起由使用常规或普通布朗斯特酸催化剂如硫酸的反应制成的产物混合物的典型的深色着色。其次,还原布朗斯特酸催化剂可以增加该反应的产物组成可计量性(即,它可以将更多的该5或6碳多元醇转化为难下定义的环状衍生物),同时维持有利的转化活性水平。在操作方面,H3PO3的一些特定优点是它可以作为可以使该反应的更大控制成为可能的固体引入在反应中,并且具有比硫酸的pKa更高的pKa(约1),对于随后的下流纯化步骤该反应介质不需要用显著量的碱进行中和。较高的pKa还限制副产物形成的程度。因此,膦酸的使用向反应性和随后的纯化操作两者赋予优点。
这些特征可以通过减少或消除对于常常复杂且昂贵的纯化和/或脱色产物的下游操作的需要而导致制造成本节省。典型地,在将5或6碳多元醇制成为它们的相应脱水产物后,使该产物混合物经受一系列后反应纯化工艺。这些工艺可包括,例如,酸的急冷或中和、过滤、离子交换色谱法、以及去除残余颜色的碳抛光。这些步骤中的每一个可以是昂贵的且耗时的。在此描述的本发明催化剂系统和反应的优点是它可以最小化或消除这些步骤(例如,中和、盐处理、阳离子色谱法、以及减轻颜色的碳精制)中的一个或多个。尽管如此,虽然不要求,但该方法可进一步包括使用例如色谱法、结晶、或蒸馏来纯化这些脱水产物,以便实现更高品质或纯度的产物。
本发明方法的另一个有利的特征是将从至少80%至基本上所有的该5或6碳多元醇起始材料转化为相应分子内脱水产物的能力,同时将缩聚产物在该反应产物混合物中的相对浓度维持在低水平下(小于总产物的25%)。在某些实施例中,缩聚产物在该反应产物混合物中的相对浓度可以是小于约20%(例如,令人希望地在约15%、17%、或18%下)。该反应可以产生至少50%的脱水产物产率;典型地该产率是约75%-80%或更大。在某一有利的实施例中,该产率可以在约85%、88%或90%至约95%、98%、或99%之间的范围中。
如在所附照片(例如,图9-15A-C)中定性地示出的,根据本发明的实施例进行的反应显示了在这些样品中较浅的颜色。该反应产物混合物展现出相对于使用在≥0.1mol%的催化剂负载量下的常规酸催化剂如硫酸(图11、16A和16B)代替该还原膦酸催化剂持续相同时间和温度制备的反应产物,更浅且更半透明的颜色外观。我们相信这种现象起因于与使用硫酸(例如,在≥0.1mol.%的催化剂负载量下)制备的产物混合物相比,在该产物混合物中减少的颜色体形成和累积水平。
可以在各种不同5或6碳多元醇物种至它们相应产物的转化中使用膦酸催化剂。根据某些实施例,该5或6碳多元醇可以是,例如,山梨糖醇、甘露糖醇、艾杜糖醇、木糖醇、以及1,2,5,6-己四醇(HTO)。例如,借助于山梨糖醇至脱水山梨糖醇、然后至异山梨醇的分子内脱水环化将山梨糖醇转化为异山梨醇。在另一个实例中,木糖醇可以直接被脱水为1,4-脱水木糖醇。可替代地,HTO被脱水地环化为外消旋的THF二醇。
可以在相对于该5或6碳多元醇的浓度约1mol.%或2mol.%至约15mol.%或20mol.%、或者其中范围值的任何组合的催化剂负载量下使用膦酸。在某些其他实施例中,该膦酸是在相对于所述5或6碳多元醇的浓度在从约5mol.%或7mol.%至约10mol.%或13mol.%的范围中的催化剂负载量下。
该反应时间可以是最高达约3小时,但是典型地为了使颜色体形成最小化,这些反应时间是更短的,在约1至2小时之间。
该反应温度可以在从约100℃直到约180℃的范围中。典型地,该反应温度是在从约110℃或120℃至约150℃或160℃的范围内。
为了获得最佳的产物产率,在约5托至约100托的操作压力下在真空下进行该脱水反应。典型地,该操作压力是在约10托至约30托之间、优选在约12或15托至约20或25托之间。
1.组成可计量性
当5或6碳多元醇通过酸催化剂脱水时,一些不容易鉴别的副产物形成,意思是形成有不被鉴别为具体的环状脱水衍生物物种的产物(例如,不是异己糖醇或脱水山梨糖醇化合物)。这些难以鉴别的副产物包括聚合缩合物和颜色体,这两者将不想要的颜色和不透明度给予该反应混合物。如在此使用的“可计量性”是产物混合物的百分比的量度,该产物混合物可以被定量地鉴别为环状脱水衍生化合物之一并且因此排除不被鉴别为环状脱水产物的缩聚物、颜色体或其他物种(例如,呋喃化合物)。根据本发明方法的有利的特征,使用膦酸使5或6碳多元醇脱水导致具有高可计量性的产物混合物,尤其相对于硫酸催化的脱水。
图1-3示出了使用在不同催化剂负载量水平下的膦酸(H3PO3)催化剂在不同反应温度(x轴)下转化为某一反应产物的山梨糖醇的百分比(山梨糖醇转化率)(右y轴)以及被鉴别为可计量产物的那些产物的百分比(可计量性)(左y轴)。在每种情况下,该反应时间是三个小时。对应的山梨糖醇转化率和产物可计量性受到温度相反地影响。较高的温度导致较高的山梨糖醇转化率但是还导致较低的产物可计量性。例如,图1示出了对于使用2mol.%H3PO3催化剂在约110℃下的反应,该山梨糖醇转化率仅仅是约83%,而该产物可计量性是几乎100%;然而,在160℃的温度下,该转化率量是几乎100%,但是该产物可计量性下降至约88%。无论催化剂的负载率如何,这个整体趋势保持,如在图2和3中示出的。
图4、5、和6比较了在分别13mol.%、15mol.%、和29mol.%的膦酸催化剂负载量下、随着不同反应温度(x轴)异山梨醇的百分比产率(异山梨醇产率)(右y轴)以及被鉴别为是可计量组分的产物的百分比(可计量性)(左y轴)。在每种情况下,该反应时间是三个小时。像在图1-3中,相对于山梨糖醇转化率和产物可计量性,该异山梨醇的百分比产率和百分比产物可计量性是相反地相关的。异山梨醇产率倾向于随着上升温度增加,而产物可计量性减小。
在某些实施例中,该膦酸催化剂能够维持约60%的异山梨醇产率,同时伴随地使得能够实现接近完全的山梨糖醇转化率(>95%)。图1-3的膦酸催化反应显示了100%的山梨糖醇转化率。这些结果有利地与来自硫酸催化的图7和8的反应的类似结果(>93%山梨糖醇转化率)进行比较。
总的来说,该数据表明了可以控制或者调节时间、温度、以及催化剂负载量以使所希望的目标产率、产物可计量性、和颜色平衡且最优化。较高的催化剂负载量在相对低温下促进该5或6碳多元醇至其相应脱水产物的迅速转化,但是具有可计量性的损失。
例如,在相对低的水平催化剂(例如,图1中~2mol.%、或者图2中~5mol.%)下,该5或6碳多元醇转化率(同时是可接受的)可要求较高温度来帮助实现大于约50%-70%的更高转化率,同时维持良好的产物可计量性水平(≥85%)。在中等催化剂水平(例如,图3中~10mol.%至图4中~13mol.%或图5中~15mol.%)下,还可需要使用较高温度和较长反应时间。在高催化剂水平(例如,图6中~20mol.%)下,然而,较低温度或较短反应时间可帮助减少或最小化颜色体积增,同时维持异山梨醇产物的高产率。
该膦酸催化剂就产物可计量性和异山梨醇产率而言在功能上表现至少等于硫酸,如在图4和7的比较中分别呈现的。常规硫酸具有对于异山梨醇约60%-67%的最大产率、以及约75%-78%的产物可计量性。图4示出了以13mol.%H3PO3、150℃催化的反应实现了约86%的产物可计量性,该产物可计量性与在图7中描绘的1mol.%硫酸催化相比是约10%改进。
2.颜色减轻
在另一个方面,图9示出了分别对于硫酸(即,A)1mol.%;B)0.5mol.%)、以及膦酸(即,C)20mol.%;D)10mol.%;以及E)5mol.%)在不同催化剂负载量下制备的五种脱水产物混合物的并排比较。这些硫酸催化的样品的外观在颜色上是非常深色的(像黑焦油一样)且不透明的。这些膦酸催化的样品表现为中等至浅的颜色以及半透明至透明的。这些样品中的每一种的特写图示出于图11-16中。图10示出了含有熔融的山梨糖醇原料(具有半透明浅颜色)的容器,该原料充当对比基准。
表1呈现了来自在不同温度和时间下运行的、使用膦酸作为催化剂在不同负载量水平下的山梨糖醇脱水反应的数据汇总。
表1.
图13-15是示出了在表1中的一些相应样品的颜色减轻的图像。在图13中,该样品产物是来自使用10mol.%H3PO3、140℃、3小时的脱水反应。这种样品的颜色是透明的中等黄色。在图14中,该样品产物是用10mol.%H3PO3、150℃、3小时制备的。在较高温度的情况下,该颜色看起来更深,因为在该混合物较高部分的颜色体。
图15A、15B、和15C是分别用20mol.%H3PO3、140℃、2h,(15A),20mol.%H3PO3、150℃、2h,(15B),以及10mol.%H3PO3、150℃、3h,(15C)制备的一组样品脱水产物。该系列的照片说明了甚至在高催化剂负载量、高温度和延长的反应时间下,这些产物具有琥珀色至深蜜色,这比如在图16A和16B(分别用1mol.%H2SO4、110℃、3h,(16A)以及0.5mol.%H2SO4、130℃、3h,(16B))中用硫酸常规制备的样品的颜色显著地表现更好。甚至在低催化剂负载量和较低温度的情况下,该产物混合物在外观上是不透明的、深棕色至黑色。根据某些实施例,据信约10mol.%的膦酸在催化活性上相当于约1mol.%的硫酸。
3.糖醇
A.–山梨糖醇
本发明方法对于加工异己糖醇并且制备它们的脱水产物是有帮助的。确切地,该方法对于使用山梨糖醇的还原布朗斯特酸催化脱水以伴随的高产物可计量性和相伴的颜色体削减来产生脱水山梨糖醇和异山梨醇将是有价值的。
出于说明目的,表2汇总了根据本发明方法的实施例在不同反应条件下山梨糖醇的催化脱水反应的结果。在实例1-26中,这些脱水反应使用在范围从约2mol.%至约20mol.%的若干不同催化剂负载量水平下的膦酸(H3PO3)。这些反应是在约110℃至约180℃之间的不同温度下、在约2或3小时的时间段内进行。如这些结果示出,该膦酸催化的若干实例可以总体上产生良好的山梨糖醇至异山梨醇的转化率(例如,~65%-100%),连同对于该产物混合物改进的组成可计量性水平,这些转化率与如在对比实例1-10中示出的使用强布朗斯特酸如硫酸(H2SO4)作为催化剂的反应可比较。就产物可计量性和颜色衰减而言,膦酸催化剂还胜过耐水、强路易斯酸催化剂如三氟甲磺酸铋(Bi(OTf)3),如在对比实例11-13中呈现的。
膦酸展现出固有地还原能力和抗氧化剂行为。可以产生良好的转化率和产物可计量性两者的作为催化剂的膦酸的独特效用和显著性能特征示出于标记为具有抗氧化剂的还原酸的部分的实例1和2中。在这些样品中较高的异山梨醇产率和颜色减轻能力突出显示了膦酸作为还原剂当以较高酸浓度存在时的有益影响。
实例3和4比较了另一种抗氧化剂酸如抗坏血酸,该抗坏血酸具有的pKa值接近于膦酸的pKa值。这些实例示出了膦酸可以将山梨糖醇完全转化(100%),同时产生可接受量的异山梨醇,并且仍然维持约70%的组成可计量性,相比之下,关于这些参数,单独使用抗坏血酸的反应表现不好。虽然产物可计量性水平对于抗坏血酸单独样品是高的,但是不幸地这是相对低的山梨糖醇转化率和几乎没有异山梨醇产率的结果。
据信该膦酸作为用于脱水环化的催化剂并且作为帮助减轻在该产物中颜色发展的还原剂两者起作用。从附图中的实例和结果来看,用于这些脱水反应的操作条件的有利范围可以包括具有约2mol%或5mol%至约10mol%或20mol%(取决于反应时间和温度)的浓度的膦酸。对于最佳的反应结果应该平衡较长的持续时间和较高的温度。
某些参数从表2中的说明性实例中是可辨别的。总体上,在低温(例如,110℃-120℃)和中间反应时间(例如,~2-3h)下,较高浓度(即,15-20mol.%)的膦酸对于山梨糖醇转化率、产物可计量性、以及颜色减轻表现较好。在低浓度(例如,≤5%)的膦酸下,可能需要较高的反应温度(例如,>130℃)和/或延长的反应时间(>2h)以实现足够的山梨糖醇转化率,尽管产物可计量性改进并且颜色体削减总体上是并发的。在中间浓度(例如,6mol.%-10mol.%-13mol.%)的膦酸下,山梨糖醇转化率在较高温度(例如,140℃-150℃)下可以是显著的,尽管缩短反应时间以最大化产物可计量性并且减轻颜色体积增。在短反应时间(<2h)下,该反应不容易促进高的山梨糖醇转化率,但是颜色体形成是可忽略的。在中等至高温度(例如,~130℃-150℃)下,减少反应时间以便避免在产物组成可计量性和/或颜色体聚集上的下降。
具有催化剂负载量、温度、和时间的不同组合的某些实例展现出特别有利的结果。这表明了在组合的酸系统中的潜在改进。
表2.在不同条件下山梨糖醇的催化脱水反应的汇总。
*具有1000ppm的抗坏血酸
B.–甘露糖醇
在另一个实施例中,膦酸催化剂同样可以有助于用于从甘露糖醇制备异甘露糖醇的脱水反应,与来自制备异山梨醇的膦酸催化反应的有益结果一致(即,改进的可计量性和颜色体削减)。在用于制备异甘露糖醇的当前工艺下,该脱水环化反应是至少170℃(该前体甘露糖醇的熔融温度)进行。常规合成工艺使用强酸(例如,硫酸、磺酸、路易斯酸)催化剂产生了稀少的异甘露糖醇产率,其中相伴产生巨大量的聚合物或副产物。当根据本发明将膦酸应用于异甘露糖醇合成时,膦酸的催化活性足够强以进行脱水环化,但是足够弱以阻止聚合以及随后显著量的缩聚物的产生。
进一步地,膦酸展现出显著提高的异甘露糖醇产率和整体产物可计量性。方案2概述了使用常见布朗斯特酸H2SO4以及根据本发明还原布朗斯特酸H3PO3的甘露糖醇至异甘露糖醇的酸催化脱水环化。
方案2.
在类似的操作条件下,从该膦酸催化实现的异甘露糖醇的百分比产率(~60%-70%)显著大于(~2X-3X)源自该硫酸催化的产率(~20%-25%)。
可替代地,方案3示出了分别使用1)0.1-1mol.%对-TsOH、170℃、1-2h,以及2)5mol.%H3PO3、170℃、1-2h的甘露糖醇的脱水环化的对比示意图。对-甲苯磺酸(对-TsOH)催化反应的异甘露糖醇产率是约20%-28%,具有60%-72%的产物可计量性、并且具有深棕色、浑浊颜色。H3PO3介导的反应的异甘露糖醇产率是可比较的(约23%-41%下),但是该产物可计量性更大(73%-82%),并且该混合物示出了更浅的微红至橙色透明外观。
方案3.
表3汇总了使用两种酸催化剂在不同条件下的甘露糖醇脱水环化的一些结果。
该弱布朗斯特酸膦酸产生了与该强布朗斯特酸对-甲苯磺酸相当的异甘露糖醇产率。进一步地,膦酸示出了比对-甲苯磺酸显著更大的该产物混合物中的产物可计量性以及颜色体的减少。
C.-1,2,5,6-己四醇(HTO)
在另一个方面,本披露还描述了一种用于以与以上描述的工艺类似的方式制备呋喃脱水产物的工艺。特别地,该工艺涉及1,2,5,6-己四醇(HTO)至外消旋-THF-二醇的脱水环化。
在另一个实施例中,可以在1,2,5,6-己四醇(HTO)至THF-二醇的酸介导的环化中使用膦酸,例如描述于国际申请号:PCT/US2014/33580,“R-葡萄糖苷、糖醇、还原的糖醇、以及还原的糖醇的呋喃衍生物的合成(Synthesis of R-Glucosides,Sugar alcohols,Reduced Sugar Alcohols,and Furan Derivatives of Reduced Sugar Alcohols)”(其内容通过引用结合在此)中。还衍生自山梨糖醇氢解,1,2,5,6-HTO是用于通过闭环制备THF-二醇的替代多元醇起始材料。
图11是比较了由1,2,5,6-HTO制备的三种THF-二醇样品的照片。从左至右,这些样品是使用硫酸(一种常规催化剂)、三氟甲磺酸铋(一种三氟甲磺酸盐)(路易斯酸)、以及膦酸制备的。相对于三氟甲磺酸铋、或硫酸,在使用膦酸制成的样品中观察到显著程度的颜色减轻。该膦酸催化的样品是澄清的或接近水白色的(即,透明的且几乎或完全无色,像洁净的水),而在中间的该路易斯酸样品是半透明的但是仍然相当淡黄色的,并且硫酸样品是不透明的且棕黑色颜色。
D.–1,4-脱水木糖醇
在另一个实施例中,膦酸催化剂同样可以有助于用于从木糖醇制备1,4-脱水木糖醇的脱水反应,具有与来自山梨糖醇/甘露糖醇至异己糖醇的膦酸催化脱水类似的结果(即,改进的可计量性和颜色体削减)。为了诱导木糖醇的脱水环化,该反应至少130℃、并且在至少100托的真空下进行。强布朗斯特或路易斯酸(例如,硫酸、磺酸、路易斯酸)催化剂的使用产生了高转化率和极好的1,4-脱水木糖醇产率;然而,其中同时产生如在产物颜色上观察的相当大量的聚合物或副产物。当膦酸用于使木糖醇脱水地环化时,该酸强度足以诱导环化,但是不足以实现显著量的副产物的聚合和产生。进一步地,膦酸展现出显著提高的产率和产物可计量性。方案3概述了使用常见布朗斯特酸H2SO4和还原布朗斯特酸H3PO3的甘露糖醇至异甘露糖醇的酸催化脱水环化。
在图12的照片中,我们比较了使用两种不同催化剂进行的木糖醇脱水的结果。在每种样品中,根据方案4中示出的方程式使约100g木糖醇发生反应。
方案4.
该第一反应使用1mol.%对-TsOH(常规催化剂)、在140℃下、持续1h、在75托下。该第二反应使用5mol.%H3PO3、在150℃下、持续1h、在75托下。对于~92mol.%1,4-脱水木糖醇的产率,在每个反应中的木糖醇被完全转化(100%)。该用对-TsOH催化剂的反应产生了不透明的、深色着色的产物样品(左);而相比之下,该用H3PO3催化剂的反应制备了透明的、浅着色(几乎水白色)产物(右)。
II.实例
以下实例说明了根据本发明从一些代表性5或6碳多元醇制备环状脱水产物,以及用于减轻这些产物混合物的颜色并且改进其组成可计量性的相关有利的特性。
实例1:由膦酸或硫酸介导的山梨糖醇至异山梨醇的脱水
山梨糖醇脱水通用程序:向配备有PTFE涂覆的磁力搅拌棒的500mL、三颈圆底烧瓶中装入200g山梨糖醇(1.10mol)和2-20mol%膦酸。如下装配该烧瓶的颈:在左边将短路径冷凝器附接到100mL玻壳接收器上,在中心将套设的热电偶套管适配器螺纹连接到热电偶,并且在右边是磨口玻璃塞。将该混合物加热至在130℃与150℃之间的温度,在5与10托之间的真空下持续1-3小时。在完成之后,冷却该产物基质,断掉真空,并且测量产物和水(泡接收器)的重量。使用衍生方法化(-OH乙酰化)通过气体色谱法进行分析。
实例2:由膦酸或硫酸介导的甘露糖醇至异甘露糖醇的脱水
甘露糖醇脱水通用程序:向配备有PTFE涂覆的磁力搅拌棒的500mL、三颈圆底烧瓶中装入200g甘露糖醇(1.10mol)和5-10mol%膦酸。如下装配该烧瓶的颈:在左边将短路径冷凝器附接到100mL玻壳接收器上,在中心将套设的热电偶套管适配器螺纹连接到热电偶,并且在右边是磨口玻璃塞。将该混合物加热至150℃,在5与10托之间的真空下持续2-3小时。在完成之后,冷却该产物基质,断掉真空,并且测量产物和水(泡接收器)的重量。使用样品衍生化(-OH乙酰化)方法通过气体色谱法进行分析。
实例3:由膦酸或对甲苯磺酸介导的木糖醇至1,4-脱水木糖醇的脱水
实验的:向配备有PTFE涂覆的磁力搅拌棒的250mL、三颈圆底烧瓶中装入100g山梨糖醇(0.657mol)和5%膦酸或1mol%对-甲苯磺酸。如下装配该烧瓶的颈:在左边将短路径冷凝器附接到100mL玻壳接收器上,在中心将套设的热电偶套管适配器螺纹连接到热电偶,并且在右边是磨口玻璃塞。将该膦酸混合物加热至150℃的温度并且将该对-甲苯磺酸混合物加热至140℃,在5与10托之间的真空下持续1小时。在完成之后,冷却该产物基质,断掉真空,并且测量产物和水(泡接收器)的重量。使用衍生化(-OH乙酰化)方法通过气体色谱法进行分析,该分析披露了在每种产物混合物中大约91%mol的1,4-脱水木糖醇产率。
实例4:1,2,5,6-己四醇(HTO)至外消旋-bHMTHF的脱水
实验的:向配备有PTFE涂覆的磁力搅拌棒的500mL三颈圆底烧瓶中装入300g由~42wt.%1,2,5,6-己四醇(HTO)组成的中间相的灰白色油、以及3.44g膦酸(H3PO3,相对于HTO为5mol%)。将一个颈用磨口玻璃接头加盖,中心具有装配有热电偶的套设的热电偶套管适配器,并且最后将短路径冷凝器附接到干冰冷却的250mL梨形接收器上。在剧烈搅拌的同时,在真空(20托)下将该混合物加热至150℃持续4小时。在这个时间后,断掉该真空并且将残余的浅着色油冷却,并且称量,提供了3.06g。GC分析给予了95mol%的该HTO已经转化为bHMTHF,具有88%mol产率。
已总体地并借助于实例详细地描述了本发明。本领域的普通技术人员应理解,本发明不必然限于特定披露的实施例,而是在不脱离如由以下权利要求或其等效物(包括目前已知或有待开发的其他等效组分,它们可以在本发明的范围内使用)所定义的本发明的范围的情况下可以作出修改和变化。因此,除非变化另外脱离本发明的范围,否则这些变化应被解释为被包括在此。
- 还没有人留言评论。精彩留言会获得点赞!