一种厌氧菌体外动态药动学/药效学模型系统及构建方法与流程
本发明属抗菌药物体外药效学技术领域,涉及一种厌氧菌体外动态药动学/药效学模型系统及构建方法。
背景技术:
随着抗菌药物代谢动力学(pharmacokinetics, PK)和药效动力学(pharmacodynamics, PD) 的不断发展,PK/PD 研究在抗菌药物的药效学评价、给药方案的制定和优化以及降低细菌耐药性等方面的作用日趋重要。目前,抗菌药物的 PK/PD 体外研究方法已有很多,除了传统的抗菌药物体外药效学研究方法(最低抑菌浓度测定,静态杀菌曲线等)外,体外PK/PD 模型也在不断发展。所述抗菌药物体外PK/PD模型是指一类借助体外装置来模拟抗菌药物在人体内的药代动力学过程并在此过程中研究其药效变化的方法;该方法与传统的抗菌药物体外药效学研究方法相比,最大区别在于:其药物浓度是按照人体药代动力学规律变化的,而非恒定浓度,更符合药物在人体内的情况,且能维持72小时;同时还可设定单一或多段流速,可控性强,能完整模拟人体的单室或多室药代动力学行为过程。
目前,用于抗需氧菌研究的体外PK/PD模型已较为成熟,而针对抗厌氧菌研究的体外PK/PD模型还处于探索阶段。相对于需氧菌而言,抗厌氧菌PK/PD模型需要在维持整个装置的压力和中央室体积的稳定性以保证PK模拟的精确度和准确性,同时还需要维持良好的厌氧环境满足厌氧菌的生长条件以保证PD数据的可靠性。当前国内尚无此方面的报道,而在国外仅报道了简单的抗厌氧菌体外PK/PD模型,该模型只能模拟简单的一室模型,不能完整模拟人体的二相及多相室药代动力学行为过程,更不能实现程序化控制蠕动泵,且可持续时间也只有24小时。除此之外,相对于需氧菌而言,所述厌氧菌PK/PD模型的难点是不仅需要维持整个装置的压力和中央室体积的稳定性,保证PK模拟的精确度和准确性,同时还需要维持良好的厌氧环境,提供给细菌一个良好的生长环境,保证PD数据的可靠性。
本发明结合采用了厌氧箱耗氧和厌氧袋气体循环的两种方法确保了整个模型的外部环境与内部环境均达到非常好的厌氧条件;其中,结合电脑对模型流速的控制可实现对静脉给药的多种药动学过程的模拟,且可持续时间也延长到72小时;所述模型系统能够满足并可推广用于抗厌氧菌药物的体外PK/PD研究。
与本发明有关的参考文献:
1. Smirnova, M.V., et al., Concentration-response relationships as a basis for choice of the optimal endpoints of the antimicrobial effect: daptomycin and vancomycin pharmacodynamics with staphylococci in an in vitro dynamic model. Int J Antimicrob Agents, 2007, 29(2): 165-169.
2. Strukova, E.N., et al., Linezolid pharmacodynamics with Staphylococcus aureus in an in vitro dynamic model. Int J Antimicrob Agents, 2009, 33(3): 251-254.
3. Firsov, A.A., et al., Comparative pharmacodynamics and antimutant potentials of doripenem and imipenem with ciprofloxacin-resistant Pseudomonas aeruginosa in an in vitro model. Antimicrob Agents Chemother, 2012, 56(3): 1223-1228.
4. Yoshizawa K, Ikawa K, keda K, et al. Optimisation of imipenem regimens in patients with impARred renal function by pharmacokinetic-pharmacodynamic target attARnment analysis of plasma and urinary concentration data[J]. International journal of antimicrobial agents, 2012(40): 427-433.
5. Katsube T,Yano Y, Wajima T, et al. Pharmacokinetic/Pharmacodynamic Modeling and Simulation to Determine Effective Dosage Regimens for Doripenem[J]. Journal of pharmaceutical sciences, 2010(5):2483-2491.
6. Roberts, Jason A. Using PK/PD to Optimize Antibiotic Dosing for Critically Ill Patients[J]. Current pharmaceutical biotechnology, 2011(12): 2070-2079.
7. Nielsen, E.I. and L.E. Friberg, Pharmacokinetic-pharmacodynamic modeling of antibacterial drugs. Pharmacol Rev, 2013, 65(3): 1053-1090.
8. 史军. 药物动力学和药效动力学在抗菌药物新药开发和临床治疗上的应用. 中国临床药理学与治疗学, 2007, 12 (2): 121-133.
9. Hermsen, E.D., et al., Levofloxacin plus metronidazole administered once daily versus moxifloxacin monotherapy against a mixed infection of Escherichia coli and Bacteroides fragilis in an in vitro pharmacodynamic model. Antimicrob Agents Chemother, 2005, 49(2): 685-689.
10. Noel, A.R., K.E. Bowker and A.P. Macgowan, Pharmacodynamics of moxifloxacin against anaerobes studied in an in vitro pharmacokinetic model. Antimicrob Agents Chemother, 2005, 49(10): 4234-4239.
11. Peterson, M.L., et al., Pharmacodynamics of trovafloxacin and levofloxacin against Bacteroides fragilis in an in vitro pharmacodynamic model. Antimicrob Agents Chemother, 2002, 46(1): 203-210.。
技术实现要素:
本发明的目的是提供一种厌氧菌体外动态药动学/药效学模型系统,尤其是一种基于厌氧箱、厌氧袋和闭合气路循环方式的厌氧菌体外动态药动学/药效学模型系统,
本发明所述的模型系统主要由基本PK/PD系统、内部厌氧形成系统、外部厌氧形成系统和控制系统组成;
具体而言,本抗厌氧菌药物的体外动态药动学/药效学模型系统,其特征在于,主要由电脑1、厌氧箱2、厌氧袋3、中央室4、蠕动泵5、气路6、液路7、搅拌器8、搅拌子9、滤膜10、新鲜培液储存罐11和废液罐12组成;所述厌氧袋3、中央室4、蠕动泵5、气路6、液路7、搅拌器8、搅拌子9、滤膜10、新鲜培液储存罐11和废液罐12置于所述厌氧箱2内,所述电脑1连接、控制所述蠕动泵5;
所述厌氧袋3通过气路6分别与所述搅拌器8、新鲜培液储存罐11连通;中央室4与废液罐12、所述新鲜培液储存罐11与废液罐12均通过气路6连通;
所述中央室4与所述废液罐12均通过液路7连通;中央室4放置于搅拌器8上面,该中央室4内部放有一枚搅拌子9。
本发明中,中央室4与废液罐12连通的气路6上设有管阀ⅱ15,新鲜培液储存罐11与所述中央室4连通的液路7上设有蠕动泵5,中央室4与所述废液罐12连通的液路7上设有管阀ⅲ16,中央室4上设有给药/取样孔13、内底设有滤膜10。
本发明中,模型系统的组成包括:基本PK/PD系统、内部厌氧形成系统、外部厌氧形成系统和控制系统等四大系统,其中:
(1)基本PK/PD系统
基本PK/PD系统是模型的核心组成,其结构同常规需氧菌PK/PD体外模型主要由中央室(细菌培养与药动学模拟的容器)、新鲜培液储存罐、废液灌等通过液路7连接而成;所述管路上设有蠕动泵5可驱动培液由新鲜培液储存罐11流入中央室4,继而在压力平衡作用下培养液经出口流向废液灌12;所述中央室4置于所述搅拌器8上、其内设搅拌子9(为了充分混匀药物与细菌);
(2)内部厌氧形成系统
内部厌氧形成系统主要负责模型运行前对内部环境的充分厌氧化,其结构由所述厌氧袋3与各容器通过所述气路6连接形成闭合环路组成,环路在蠕动泵5作用下进行气体循环;其中,所述厌氧袋3消耗氧气形成厌氧环境的关键性作用,气体循环使得厌氧环境在整个体系均匀分布;
(3)外部厌氧形成系统
外部厌氧形成系统由所述厌氧箱2直接组成;所述厌氧箱2的温度为35℃,湿度为40% -60%,气体成分为80% N2、10% H2和10% CO2;其主要负责本发明所述模型运行前和运行过程中厌氧环境的维持;
(4)控制系统
所述模型系统的控制主要通过电脑1与数据线对系统中的蠕动泵5的转速进行实时或阶段性控制,进而达到对流入中央室内液体流速的控制,最终在中央室内实现对特定药动学过程的模拟;
本发明中,所述模型系统的整个体系(除电脑1外)均放置于所述厌氧箱2中以达到一定的温湿度环境与厌氧环境;
本发明中,所述模型系统通过所述厌氧袋3建立闭合的气路循环(达到消耗模型体系中氧气的目的);所述厌氧袋中的厌氧试剂可为具有氧气消耗特性的任意化学试剂;
本发明中,所述厌氧袋3在形体上应为囊袋形式且具有开口可用来填充厌氧剂,可通过夹闭密封;其形状可为任意形状,应有至少有两个与管路对接的接口;
本发明中,所述模型系统的组成材料均采用耐高温材料制备(避免负压、高温高压消毒对体系造成影响);此外,所述厌氧袋3采用软性材质制备,在所述模型的整个系统密闭性好的前提下,所述厌氧袋也可采用其他刚性容器(如:玻璃瓶、金属瓶、硬质有机材料瓶等);
本发明中,所述模型系统的整个体系运行前,可充分通过厌氧袋3和厌氧箱2制造厌氧环境,气体循环通过蠕动泵5驱动实现,气体循环过程中培养体系中氧气被消耗;
本发明中,所述蠕动泵5与电脑1通过数据线连接,其流速能够在软件控制下按照预设程序变化,进行分段调节,模拟单室或多室药代动力学;
本发明中,所述气体管路中的蠕动泵5可在整个闭合环路的任意管路段驱动,驱动方向可以是正向,也可以是反向。
本发明所述模型系统的管路系统中还涉及到3个管阀(管阀ⅰ14、管阀ⅱ15、管阀ⅲ16);其中,所述管阀ⅰ14、管阀ⅱ15在本发明所述模型系统内部厌氧环境形成中(即气体循环运行中)需要保持开放状态,所述管阀ⅲ16需保持在关闭状态下;在本发明所述模型即将运行前需将管阀ⅰ14、管阀ⅱ15关闭,将管阀ⅲ16打开,并在运行中一直保持各自状态。
本发明的模型系统使用方法如下:
(1)准备
检查各管路及所述中央室4的密闭性并将所述硅/胶管管路系统、中央室4、废液瓶12单独包裹;配置足量培养液到新鲜培液储存罐11,并在中央室4内放置搅拌子9一枚;将上述物件进行消毒处理;
(2)组装系统
设计并摆放所述搅拌器8位置,连接电源线、控制线及控制器,以保证搅拌器能够运行;将含有转子的营养液瓶放在搅拌器上,搅拌耗氧约6 h,待用;将消毒的物品及培养液放入厌氧室中,打开消毒的管路系统,将储液瓶和废液瓶上的瓶盖替换成具有管路连接的瓶盖,依次连接储液瓶与中央室4,连接中央室4与废液瓶12,最后连接废液瓶12与储液瓶,全程要求无菌操作;将硅胶管路的蠕动段安置在蠕动泵5的泵头,夹紧闭合;开启电源,将电脑1与蠕动泵5建立连接,使电脑控制蠕动泵;夹闭中央室4流出口端,打开蠕动泵5进行模型灌注,中央室4或者各个辅助室内达到设定液体后,关停蠕动泵5;
(3)形成厌氧环境
将所述蠕动泵5换至气体端,瓶口松开,开启流速,3 ml/min,循环约3小时,将所述整个装置的氧气通过厌氧箱2进行消耗;关闭蠕动泵5,在厌氧空瓶中放入一定量的厌氧袋3,拧紧各瓶盖及检查各接口封闭性,制造气体环路,单向液路;再次开启蠕动泵5,走气体流速过夜耗氧循环,2ml/min,循环约6小时;使所述整个装置处于一种无氧、气压稳定的状态;同时厌氧箱2维持外部的厌氧环境;厌氧结束后,需将先将所述管阀ⅰ14、管阀ⅱ15夹闭,然后打开、管阀ⅲ16;
(4)预培养
用新鲜肉汤制备培养过夜的受试菌,调成0.5麦氏浊度的菌液,吸取2mL该菌悬液接入中央室,预培养1h用于实验;所述新鲜培液储存罐11和中央室4的温度维持在35℃,肉汤均用磁力搅拌器8搅拌,以维持厌氧菌的生长;
(5)实验运行
预培养结束后加适量药物到中央室内同时开启所述蠕动泵5,所述蠕动泵5流速按设定方案变化;以所述蠕动泵5开启时间为0点,于各设定时间点(如:0h、2h、4h、6h、8h、10h、12h、24h、48h和72h)从中央室4内取样;
(6)数据采集与分析
采集样本分做两份,其中一份作合适的稀释度后,均匀涂布于布氏琼脂平板上,35℃孵育48h后,计算活菌菌落数;以不同时间点为横坐标,菌落数的常用对数为纵坐标,绘制杀菌曲线;另一份进行PK测定,绘制药时曲线,最后进行PK/PD分析。
本发明结合厌氧箱和厌氧袋气体耗氧两种方法确保了整个动态模型的外部环境与内部环境均达到非常好的厌氧条件,并结合电脑对模型的流速进行实时控制实现多种药动学过程的模拟(以左奥硝唑对脆弱拟杆菌的体外PK/PD研究为例,构建并验证了所述模型,成功模拟抗厌氧菌药物在人体内杀灭厌氧菌的动态PK/PD过程,且所述整个装置在长达72小时实验过程中,稳定、可控和结果可重复性);本发明所述模型系统适用于其他抗厌氧菌药物的体外PK/PD研究。
附图说明
图1为基于厌氧环境的体外药动学/药效学模型系统结构示意图;
其中,1为电脑、2为厌氧箱、3为厌氧袋、4为中央室、5为蠕动泵、6为气路(硅/橡胶管路)、7为液路(硅/橡胶管路)、8为搅拌器、9为搅拌子、10为滤膜、11为新鲜培液储存罐、12为废液罐、13为给药/取样孔、14为管阀ⅰ、15为管阀ⅱ、16为管阀ⅲ。
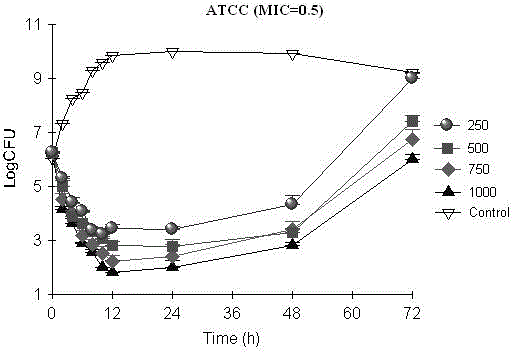
图2为左奥硝唑对三株脆弱拟杆菌的体外动态平均杀菌曲线。
图3为左奥硝唑体外PK模拟效果评价图,
其中,Act 实测值,按Mean±SD表示, n=9; Simu 二房室模型拟合效果(权重=1/C); Vivo 体内目标药时曲线;A和B分别为常数坐标和半对数坐标;图中标出给药剂量。
具体实施方式
以下通过实例进一步阐述本发明所涉及的模型系统体系及其使用方法。
实施例1
如图1所示,本厌氧菌体外动态药动学/药效学模型系统由基本PK/PD系统、内部厌氧形成系统、外部厌氧形成系统和控制系统等四大系统组成:主要由电脑1、厌氧箱2、厌氧袋3、中央室4、蠕动泵5、气路6、液路7、搅拌器8、搅拌子9、滤膜10、新鲜培液储存罐11和废液罐12组成;所述厌氧袋3、中央室4、蠕动泵5、气路6、液路7、搅拌器8、搅拌子9、滤膜10、新鲜培液储存罐11和废液罐12均置于所述厌氧箱2内,所述电脑1连接、控制所述蠕动泵5;
所述厌氧袋3通过气路6分别与所述搅拌器8、新鲜培液储存罐11连通;其中,与所述搅拌器8连通的气路6上设有蠕动泵5和管阀ⅰ14;
所述中央室4通过气路6与废液罐12连通,该段气路6上设有管阀ⅱ15;
所述新鲜培液储存罐11通过气路6与废液罐12连通;该新鲜培液储存罐11通过液路7与所述中央室4连通,该段液路7上设有蠕动泵5;
所述中央室4通过液路7与所述废液罐12连通,该段液路7上设有管阀ⅲ16;所述中央室4放置于搅拌器8上面,所述中央室4上设有给药/取样孔13,所述中央室4的内部放有一枚搅拌子9;该中央室4内底设有滤膜10。
本发明的模型系统中:
(1)基本PK/PD系统是模型的核心组成,其结构同常规需氧菌PK/PD体外模型主要由中央室(细菌培养与药动学模拟的容器)、新鲜培液储存罐、废液灌等通过液路7连接而成;所述管路上设有蠕动泵5可驱动培液由新鲜培液储存罐11流入中央室4,继而在压力平衡作用下培养液经出口流向废液灌12;所述中央室4置于所述搅拌器8上、其内设搅拌子9(为了充分混匀药物与细菌);
(2)内部厌氧形成系统主要负责模型运行前对内部环境的充分厌氧化,其结构由所述厌氧袋3与各容器通过所述气路6连接形成闭合环路组成,环路在蠕动泵5作用下进行气体循环;其中,所述厌氧袋3消耗氧气形成厌氧环境的关键性作用,气体循环使得厌氧环境在整个体系均匀分布;
(3)外部厌氧形成系统由所述厌氧箱2直接组成;所述厌氧箱2的温度为35℃,湿度为40% -60%,气体成分为80% N2、10% H2和10% CO2;其主要负责本发明所述模型运行前和运行过程中厌氧环境的维持;
(4)控制系统控制所述模型系统,主要通过电脑1与数据线对系统中的蠕动泵5的转速进行实时或阶段性控制,进而达到对流入中央室内液体流速的控制,最终在中央室内实现对特定药动学过程的模拟;
本发明所述模型的管路系统中还涉及到3个管阀(管阀ⅰ14、管阀ⅱ15、管阀ⅲ16);其中,所述管阀ⅰ14、管阀ⅱ15在本发明所述模型内部厌氧环境形成中(即气体循环运行中)需要保持开放状态,所述管阀ⅲ16需保持在关闭状态下;在本发明所述模型即将运行前需将管阀ⅰ14、管阀ⅱ15关闭,将管阀ⅲ16打开,并在运行中一直保持各自状态。
使用时,按如下方法和步骤:
(1)准备
检查各管路及所述中央室4的密闭性并将所述硅/胶管管路系统、中央室4、废液瓶12单独包裹;配置足量培养液到新鲜培液储存罐11,并在中央室4内放置搅拌子9一枚;将上述物件进行消毒处理;
(2)组装系统
提前设计并摆放好所述搅拌器8位置,连接好电源线、控制线及控制器,保证搅拌器能够运行;把含有转子的营养液瓶放在搅拌器上,搅拌耗氧约6 h,待用;把消毒好的物品及培养液放入厌氧室中,打开消毒后的管路系统,将储液瓶和废液瓶上的瓶盖替换成具有管路连接的瓶盖,依次连接储液瓶与中央室4,连接中央室4与废液瓶12,最后再连接废液瓶12与储液瓶,全程注意无菌操作;将硅胶管路的蠕动段安置在蠕动泵5的泵头,夹紧闭合;开启电源,将电脑1与蠕动泵5建立连接,用电脑控制蠕动泵;将中央室4流出口端夹闭,打开蠕动泵5进行模型灌注,中央室4或者各个辅助室内达到设定液体后,关停蠕动泵5;
(3)形成厌氧环境
将所述蠕动泵5换到气体端,瓶口松开,开启流速,3 ml/min,循环约3小时,将所述整个装置的氧气通过厌氧箱2进行消耗;关闭蠕动泵5,在厌氧空瓶中放入一定量的厌氧袋3,把所述各个瓶盖都拧紧,检查各个接口封闭性,制造气体环路,单向液路;再次开启蠕动泵5,走气体流速过夜耗氧循环,2ml/min,循环约6小时;使所述整个装置处于一种无氧、气压稳定的状态;同时厌氧箱2维持外部的厌氧环境;厌氧结束后,需将先将所述管阀ⅰ14、管阀ⅱ15夹闭,然后打开、管阀ⅲ16;
(4)预培养
用新鲜肉汤制备培养过夜的受试菌,调成0.5麦氏浊度的菌液,吸取2mL该菌悬液接入中央室,预培养1h即可用于实验研究;所述新鲜培液储存罐11和中央室4的温度维持在35℃,肉汤均用磁力搅拌器8搅拌,以维持厌氧菌的生长;
(5)实验运行
预培养结束后加适量药物到中央室内同时开启所述蠕动泵5,所述蠕动泵5流速按设定方案变化;以所述蠕动泵5开启时间为0点,于各设定时间点(如:0h、2h、4h、6h、8h、10h、12h、24h、48h和72h)从中央室4内取样;
(6)数据采集与分析
采集样本分做两份,一份作合适的稀释度后,均匀涂布于布氏琼脂平板上,35℃孵育48h后,计算活菌菌落数;以不同时间点为横坐标,菌落数的常用对数为纵坐标,绘制杀菌曲线;另一份进行PK测定,绘制药时曲线,最后进行PK/PD分析。
实施例2 研究左奥硝唑对脆弱拟杆菌的杀菌作用特点和体外PK/PD参数,
采用本发明所述的模型系统与使用方法;所涉及的细菌包括脆弱拟杆菌标准菌株(ATCC 25285)和2株临床株(13-W45-64和13-W45-69),其MIC分别为0.5 mg/L、0.5 mg/L和1 mg/L,起始细菌浓度为1×106 CFU/ml。
采用流速分段调节方法实现二房室药动学精确模拟;采用体外一室模型装置模拟左奥硝唑在人体内的单剂静滴药动学(模拟下降段,即静滴静束后部分),参照左奥硝唑在健康志愿者中单剂静脉滴注500mg,q12h和750mg,q24h药代动力学数据进行体外PK/PD模型中PK的模拟,单剂给药模拟250mg、500mg、750mg和1000mg;所述中央室4内初始液体体积(VC=200ml),计算获得中央室投药量、储液罐耗量及流速F;由于250mg、1000mg无实测药动学数据,且考虑到左奥硝唑PK参数(AUC和Cmax) 随剂量增加 (500mg和750mg)不成线性,故本节采用体内500mg组PK参数来实施体外PK模拟250mg(投药量减半),体内750mg组PK参数来实施体外PK模拟1000mg(投药量增加1/3);具体给药方法如表1所示;
表1 左奥硝唑体外PK模拟的方案设计参数汇总表
高温灭菌消毒后预先在中央室接入200mL的新鲜肉汤,关闭肉汤流出端,开启气体循环;先通过厌氧箱耗氧,约为3ml/min,循环3小时;再将厌氧袋接入形成环路,将其中一段管路嵌入蠕动泵,并开启蠕动泵进行气体循环耗氧,蠕动泵速度设为2ml/min,循环约6小时;关闭气体循环,用布氏肉汤制备新鲜培养过夜的受试菌,菌悬液浊度为0.5McFarland,用注射器将2mL菌悬液加入到200mL的肉汤中,使受中央室的受试菌浓度约1×106 CFU/ml,至Ruskinn厌氧箱35℃预培养1h;按指定的给药方案加药量,按相应的预设的模拟流速,分别模拟左奥硝唑750mg单剂给药,并用不加药的1×106 CFU/ml菌液同步培养作为对照;于设定时间点0,2, 4, 6, 8, 10, 12, 24,48,72h取样,作合适的稀释度后,均匀涂布于布氏琼脂平板上,35℃孵育48h后,计算活菌菌落数;以不同时间点为横坐标,菌落数的常用对数为纵坐标,绘制杀菌曲线(如图2所示),
药效学模型验证结果显示,脆弱拟杆菌生长对照在流速调控下的生长曲线基本符合正常生长速率,在6h细菌可达到快速生长阶段,10h中央室可略见浑浊;且由于新鲜肉汤的不断流入,动态模型比静态条件下能达到更好的生长高峰(LogCFU可达到1010 CFU/mL)(如图2所示);厌氧菌生长条件苛刻,是厌氧菌模型成败的关键,药动学模型验证实际操作中,模拟效果较优,液体等量进出,中央室体积的稳定,初步反映药动学模型参数的可靠性;
本实施例进一步进行了定量验证,左奥硝唑750mg组模拟的体外药时曲线显示,体外数值虽和体内数值有一定误差,但误差不大,相对偏差仅为±10%,均在可接受范围内(如图3所示);进行定量分析,左奥硝唑的二房室动力学参数如消除速率k10、V1、AUC、Cmax等的相对偏差均较小,均在±9%之间,通过了药动学验证;结果表明,本发明所述厌氧菌流速数控体外PK/PD模型系统可应用于左奥硝唑体外PK/PD的研究。
- 还没有人留言评论。精彩留言会获得点赞!