一种负调控植物对飞虱科昆虫的抗性的基因及其应用的制作方法
本发明属于植物学和基因工程领域,更具体地,本发明涉及一种负调控植物对飞虱科昆虫的抗性的基因及其应用。
背景技术:
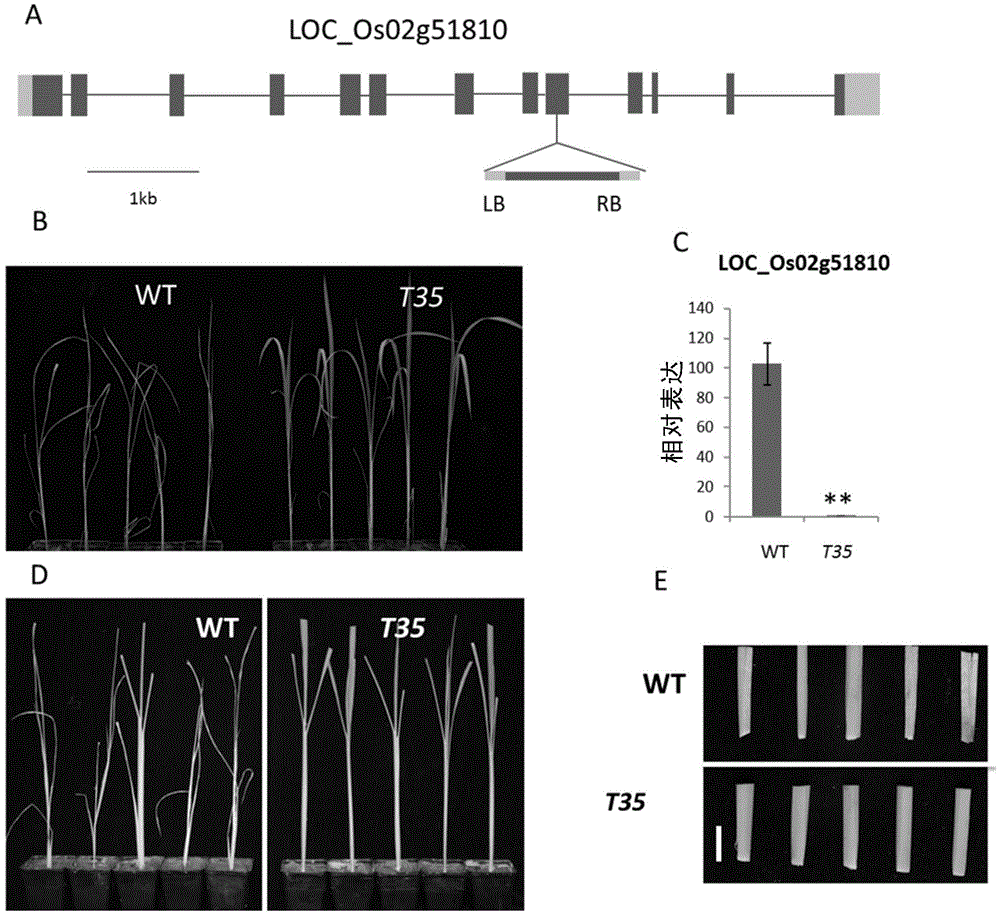
:植物在生长发育的过程中遭受着各种各样的植食性昆虫的威胁,所以植物需要一套非常复杂的防御体系来抵抗这些昆虫的侵害。植物的自身免疫被激活时,会启动先天免疫反应,激发一系列的生理生化反应和基因的表达,先天免疫反应包括细胞膜表面的模式识别受体激发的免疫反应(PTI)和植物专化性的抗性蛋白(R蛋白)识别受体,分泌效应蛋白激发的免疫反应(ETI)。植物的免疫反应被激发后,包括茉莉酸(JA),水杨酸(SA),H2O2等在植物体内编织起一个复杂的防御信号网络。除此之外,植物还拥有组成型防御体系,包括植物表面的蜡质、角质层、木质素等物理屏障。而构成这些防御网络的基本单元是植物中的基因,过表达或敲除某个基因可能会影响到其中的一些防御通路,从而显示出对昆虫抗性的增强或减弱。而在植物的功能基因组研究中,突变体对基因功能的阐释具有重要的作用,同样,突变体库也适用于研究植物对昆虫抗性方面的功能。目前,植物如禾本科植物对飞虱科昆虫抗性分子机制的研究还处于初级阶段,发掘飞虱科昆虫抗性相关的基因,增强对飞虱科昆虫抗性分子机制的了解,将有助于田间对于飞虱科昆虫的防治。技术实现要素:本发明的目的在于提供一种负调控植物对飞虱科昆虫的抗性的基因及其应用。在本发明的第一方面,提供一种提高植物抗虫性、降低植物株高、增加 植物分蘖或提高植物产量的方法,所述方法包括:下调植物体内TOM64多肽的表达或活性;所述的植物的基因组中具有TOM64基因。在一个优选例中,所述的下调植物体内TOM64多肽的表达或活性的方法包括:在植物的基因组中敲除或沉默TOM64基因;或将下调TOM64基因转录、多肽表达或多肽活性的下调剂转入植物中。在另一优选例中,所述的敲除或沉默TOM64基因是将外源片段插入在TOM64基因的第9个外显子中。在另一优选例中,所述的下调剂是特异性干扰TOM64基因表达的干扰分子。在另一优选例中,所述的干扰分子是TOM64基因或其转录本为抑制或沉默靶标的dsRNA、反义核酸、小干扰RNA、微小RNA,或能表达或形成所述dsRNA、反义核酸、小干扰RNA、微小RNA的构建物。在另一优选例中,所述的提高植物抗虫性是提高植物对于飞虱科昆虫的抗性。在另一优选例中,所述的植物包括:禾本科植物。在另一优选例中,所述的TOM64多肽选自下组:(a)如SEQIDNO:2氨基酸序列的蛋白;(b)将SEQIDNO:2氨基酸序列经过一个或多个(如1-30个;较佳地1-20个;更佳地1-10个;更佳地1-5个)氨基酸残基的取代、缺失或添加而形成的,且具有(a)蛋白功能的由(a)衍生的蛋白;或(c)与(a)限定的蛋白序列有70%(较佳地80%;更佳地90%;更佳地95%;更佳地98%;更佳地99%)以上同源性且具有(a)蛋白功能的由(a)衍生的蛋白。在另一优选例中,所述的TOM64的编码基因包含如下序列:SEQIDNO:1。在本发明的另一方面,提供一种降低TOM64基因表达或活性的物质的用途,用于提高植物的抗虫性,或用于降低植物株高,或用于增加植物分蘖,或用于提高植物产量,或用于提高植物组织中H2O2的含量;所述的植物的基因组中具有TOM64基因。在一个优选例中,所述的降低TOM64基因表达或活性的物质是特异性干 扰TOM64基因表达的干扰分子;较佳地,所述的干扰分子是TOM64基因或其转录本为抑制或沉默靶标的dsRNA、反义核酸、小干扰RNA、微小RNA,或能表达或形成所述dsRNA、反义核酸、小干扰RNA、微小RNA的构建物。本发明的其它方面由于本文的公开内容,对本领域的技术人员而言是显而易见的。附图说明图1、TAIL-PCR分离旁邻序列示意图。图2、抗虫突变体T35的插入位点及抗BPH单株鉴定。(A).突变体T35的T-DNA插入位点;(B).WT和T35苗期单株抗BPH鉴定(n=8,图为代表性植株);(C).荧光定量PCR检测T35中突变基因的表达,材料取自分蘖期叶鞘,数据为平均数±SD(n=3),t检验显示显著性差异(**P<0.01,与野生型相比);(D).WT和T35分蘖期单株抗BPH鉴定(n=8,图为代表性植株);(E).水稻抗BPH分蘖期单株鉴定茎部危害情况(n=8,标尺=1.5cm)。图3、TOM64多肽的结构及相关蛋白进化树分析。(A).TOM64多肽的结构;(B).不同植物中部分TOC64及TOM64的进化树分析。os-Oryzasativa(水稻),ob-Oryzabrachyantha(短药野生稻),bd-Brachypodiumdistachyon(二穗短柄草),zm-Zeamays(玉米),si-Setariaitalica(谷子),at-Arabidopsisthaliana(拟南芥),ps-Pisumsativum(豌豆),mt-Medicagotruncatula(苜蓿)。图4、tom64突变体的互补验证。(A).PCR鉴定互补转基因植株。(B).互补植株抗褐飞虱鉴定(n=3)。图5、水稻对褐飞虱的选择性(A)及产卵量(B)测定。数据为平均数(n=3),且用t检验检测显著性差异,与野生型相比都无显著性差异。图6、水稻对BPH的取食(A)、生长(B)和存活率(C)测定。数据为平均数±SD(A,n=5;B和C,n=3),t检验检测显著性差异(**P<0.01,对比WT)。(C)中突变体在各时间点于野生型无显著性差异。图7、水稻对BPH的耐害性测定。数据为平均数±SD(n=3),t检验检测显著性差异(**P<0.01,对比WT)。图8、TOM64多肽的亚细胞定位。图9、水稻组织H2O2含量的测定。数据为平均数±SD(n=3),t检验检测显著性差异(**P<0.01,对比WT)。图10、水稻抗BPH的抗性评价,数据为平均数±SD(n=10),ANOVA显著性差异分析,不同的字母代表差异显著(P<0.05)。图11、TOM64基因敲除后纯系对水稻产量相关性状的影响。数据为平均数±SD(n=3),t检验检测显著性差异(**P<0.01,对比WT)。(A)表明TOM64基因被敲除后水稻分蘖提前;(B)表明TOM64基因被敲除后造成水稻变矮;(C)是纯系水稻与野生型相比,有效分蘖率没有明显差异;(D)表明TOM64基因被敲除后会水稻的分蘖数量显著增多。具体实施方式本发明人经过深入的研究,发现线粒体外膜转运蛋白64(TOM64,TransloconattheOuterenvelopemembraneofMitochondriaprotein64)与植物对飞虱科昆虫的抗性密切相关,下调该基因可赋予植物对于飞虱科昆虫的抗性。因此,TOM64基因或调节TOM64基因的物质和方法可应用于实现植物品种的改良。如本文所用,所述的“植物”包括但不限于:十字花科植物、禾本科植 物。比如,所述的“植物”包括但不限于:十字花科鼠耳芥属如拟南芥,禾本科稻属植物如水稻,禾本科小麦属植物如小麦,禾本科玉米属植物如玉米等。如本文所用,所述的“飞虱科昆虫”包括但不限于:褐飞虱(Brownplanthopper,BPH),白背飞虱(whitebackplanthopper,WBPH)及灰飞虱(smallbrownplanthopper,SBPH)。在本发明中,“TOM64多肽(蛋白)”指具有SEQIDNO:2序列的多肽,还包括具有与TOM64多肽相同功能的、SEQIDNO:2序列的变异形式。这些变异形式包括(但并不限于):若干个(通常为1-50个,较佳地1-30个,更佳地1-20个,最佳地1-10个,还更佳如1-8个、1-5个)氨基酸的缺失、插入和/或取代,以及在C末端和/或N末端添加或缺失一个或数个(通常为20个以内,较佳地为10个以内,更佳地为5个以内)氨基酸。任何与所述的TOM64多肽同源性高(比如与SEQIDNO:2所示的序列的同源性为70%或更高;优选的,同源性为80%或更高;更优选的,同源性为90%或更高,如同源性95%,98%或99%)的、且具有TOM64多肽相同功能的蛋白也包括在本发明内。来源于水稻以外其它物种的与SEQIDNO:2所示的序列的同源性较高的TOM64多肽也包括在本发明中。本发明还涉及编码本发明TOM64多肽或其保守性变异多肽的多核苷酸序列。所述的多核苷酸可以是DNA形式或RNA形式。DNA形式包括cDNA、基因组DNA或人工合成的DNA。DNA可以是单链的或是双链的。DNA可以是编码链或非编码链。编码成熟多肽的编码区序列可以与SEQIDNO:1所示的编码区序列相同或者是简并的变异体。如本文所用,“简并的变异体”在本发明中是指编码具有SEQIDNO:2的蛋白质,但与SEQIDNO:1所示的编码区序列有差别的核酸序列。编码SEQIDNO:2的成熟多肽的多核苷酸包括:只编码成熟多肽的编码序列;成熟多肽的编码序列和各种附加编码序列;成熟多肽的编码序列(和任选的附加编码序列)以及非编码序列。应理解,虽然本发明的TOM64基因优选获自禾本科植物如水稻,但是获 自其它植物的与水稻TOM64基因高度同源(如具有70%以上,如80%,85%、90%、95%、甚至98%序列相同性)的其它基因也在本发明考虑的范围之内。比对序列相同性的方法和工具也是本领域周知的,例如BLAST。本发明涉及的TOM64基因在理论研究和植物改良中具有重要的应用价值。这个序列可以被应用于特定植物如水稻的抗虫性研究;并且,其还与调控植物的分蘖、株高、产量性状相关。本发明还涉及一种改良植物的方法,该方法包括调节所述植物中TOM64多肽的表达。一方面,本发明还提供了一种提高植物抗虫性、降低植物株高、增加植物分蘖、提高植物产量的方法,所述的方法包括:降低所述植物中TOM64多肽的表达(包括使TOM64多肽不表达或低表达)或活性。在得知了所述的TOM64多肽的用途后,可以采用本领域人员熟知的多种方法来调节所述的TOM64多肽的表达。比如可以采用本领域人员熟知的多种方法来降低TOM64多肽的表达或使之缺失表达,比如将携带反义TOM64基因的表达单位(比如表达载体或病毒等)递送到靶点上,使得细胞或植物组织不表达或降低表达TOM64多肽。作为本发明的一种实施方式,提供了一种降低植物中TOM64多肽的表达的方法,所述的方法包括:(1)将干扰TOM64基因表达的干扰分子转入植物细胞、组织、器官或种子,获得转化入所述干扰分子的植物细胞、组织、器官或种子;(2)将步骤(1)获得的转入了所述干扰分子的植物细胞、组织、器官或种子再生成植物。较佳地,所述方法还包括:(iii)选择出转入了所述载体的植物细胞、组织或器官;和(iv)将步骤(iii)中的植物细胞、组织或器官再生成植物。作为本发明的另一种实施方式,提供了一种降低植物中TOM64多肽的表达的方法,所述的方法包括:在植物的基因组中敲除或沉默TOM64基因。例如,所述的敲除或沉默TOM64基因可以是将外源片段插入在TOM64基因的外显子中。其它抑制TOM64基因或其同源基因表达的方法是本领域周知的。在本发明的实施例中,本发明人通过大规模突变体库的抗褐飞虱筛选,最终获得了抗性株系,进而鉴定分离了其突变基因,并对其中的一个抗虫突变体及其相关基因的功能进行了研究验证。经过田间及室内鉴定,本发明人发现一株水稻基因缺失突变体T35高抗褐飞虱。进一步分析后发现,该突变体编码TOM64基因。TOM64基因的沉默是由于T-DNA插入到该基因的第9个外显子部位,造成转录终止,从而导致该基因的沉默。抗虫机理分析表明,该基因的突变主要是提高了水稻对褐飞虱的耐受性。当将突变基因进行回复后,互补株系则失去了对飞虱科昆虫的抗性,进一步证明,只有当该基因的表达被沉默后可以提高水稻对飞虱科昆虫的抗性。亚细胞定位结果表明,该基因定位于线粒体,提高了水稻组织中的H2O2含量,从而提高了水稻对飞虱科昆虫的抗性。TOM64突变体对褐飞虱的抗性可以从原有的高感水平(7-9级),提高到中抗水平(3-5级)。下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件如J.萨姆布鲁克等编著,分子克隆实验指南,第三版,科学出版社,2002中所述的条件,或按照制造厂商所建议的条件。I.材料与方法1、植物材料的种植培养田间高通量抗虫筛选所用水稻(Oryzasativa)抗虫品种RHT(RathuHeenati)或IR56,感虫品种TN1(TaichungNative1);T-DNA插入突变体库的野生型为中花11(ZH11),突变体由中科院上海生命科学研究院植物分子遗传国家重点实验室提供。田间植物材料种植于在上海松江五厍农场,所有突变体材料种植于专门供试转基因植物材料的围墙内。2、所用质粒pCAMBIA2300:购自Cambia公司,其菌株抗性和植株抗性均为Kmr,用于构建突变体的互补(回复)载体。PA7-GFP:购自Promega公司,用于构建融合载体,研究基因的亚细胞定位。3、田间及室内抗虫鉴定提前一周整理好足够多的田间土地,分垄,每垄宽1.2m,长12m,垄间距30cm。将野生型、抗虫对照、感虫对照和突变体种子分装于可渗水的小袋中,催芽2-3天后,均匀的播种于打好线的垄地上,每个突变体播种10-15粒,突变体旁边分别种植抗虫对照(RHT或IR56)和感虫对照(TN1)。两周后观察长苗状况,每行突变体留至少3株单株水稻,避免多粒种子的植株合并在一起,每隔数日关注水稻的长势。田间不喷洒农药,任褐飞虱迁入繁殖,在水稻生长的各个时期观察各突变体的受害情况。若遇到褐飞虱较少的年份,待成株期时,将实验室培养的褐飞虱人工均匀的释放于供试田间。待TN1全部枯死,对突变体进行抗虫评价,评价标准见表1。抗性级别低于ZH11的突变体即为抗虫突变体,高于ZH11的突变体为感虫突变体。表1、水稻成株期对褐飞虱抗性鉴定评级标准抗性级别植株症状(TN1死亡时考察)抗性水平0植株生长健康,无叶片受害免疫(Im)1植株开始部分黄化高抗(HR)3多数植株变黄,部分植株明显黄化抗虫(R)5多数植株黄萎,少数枯死中抗(MR)7半数以上植株枯死中感(MS)9全部植株枯死感虫(S)4、水稻基因组DNA的提取使用CTAB法(2%CTAB,1.4MNaCl,20mMEDTA,100mM/LTris.HCl,PH8.0)。a)取水稻叶片放入1.5mL的离心管中,用液氮冷冻后用研磨机磨碎后加入600μL的CTAB抽提液。b)65℃加热45min(轻柔混匀)。c)加入等体积氯仿,混匀,室温静置10min。d)12000rpm,离心15min,取上清至新的EP管。e)加入等体积的异丙醇,混匀,-20℃沉淀30min。f)12000rpm离心10min,弃上清,70%乙醇洗涤沉淀两次。g)离心弃上清后,干燥,用适量的水溶解。h)1%琼脂糖凝胶电泳检测基因组DNA的完整性。5、突变体旁邻序列的获得(TAIL-PCR)用水稻叶片基因组DNA作为PCR模板,进行三轮PCR反应。第一轮PCR:以提取的基因组DNA为模板,使用T-DNA上的引物NTL1和随机引物。第二轮PCR:以第一轮PCR产物为模板,使用T-DNA上的NTL2引物和随机引物。第三轮PCR:以第二轮PCR产物为模板,使用T-DNA上的NTL3引物和随机引物(图1)。第三轮PCR产物用1%琼脂糖电泳检测,有条带的样品切胶回收后直接测序,或连接到克隆载体上再进行测序。测序结果先与T-DNA左边界序列比对,将比对正确的序列切除后,剩余序列在NCBI或水稻基因组网站(http://rice.plantbiology.msu.edu/index.shtml)上进行比对,确定插入位点。Tail-PCR程序见表1。6、T-DNA与表型的共分离选取突变体的杂合子的后代种子,催芽后播种,待水稻苗长至两叶一心时,各剪取2cm左右长的水稻叶片,提取DNA。用插入位点两侧以及T-DNA上的引物检测每株苗的纯、杂或无插入的状态。待水稻苗恢复3天,罩上塑料罩子,按照苗期单株鉴定的方法进行抗虫鉴定。根据抗虫鉴定的结果分析表型与T-DNA的共分离情况。7、突变体的互补验证(回复突变)选取目的基因起始密码子ATG上游2kb的自身启动子序列,与基因的 cDNA的编码序列一起插入pCAMBIA2300载体,启动子连入选用的酶切位点是KpnI和BamHI,编码序列的连接酶切位点是BamHI和XbaI。通过农杆菌介导的方法转化突变体的愈伤组织,由于突变体中T-DNA具有潮霉素抗性,故选用卡那抗性的转基因载体,并用卡那霉素筛选阳性转基因植株。得到的阳性转基因植株即为突变体的互补植株。苗期单株抗虫鉴定的方法鉴定互补植株能否回复突变体的表型。8、水稻对BPH的耐害性鉴定将待测品系(野生型和突变体)催芽后播种,每个小方盒内种植两株同品系的水稻苗,生长6周左右,选取生长一致的植株,去次生分蘖,恢复三天后罩上透明塑料罩子,每个罩子里面(两株苗)接种25头BPH的一龄若虫,对照植株也罩上透明塑料罩子,但不接虫。待感虫品种(WT)开始变为黄褐色时,取出并收集所有BPH,在60℃烘箱中干燥48h后,称取质量。同时,植株从小盒子里移出,洗净根部泥土,75℃烘箱中干燥60h后,称取质量。根据公式计算耐虫系数(TI):TI=[(Wc-Wt)/Wc]/BPH,其中,Wc为没有接虫的植株的干重,Wt为接虫后的植株的干重,BPH为在每株水稻苗上收集的BPH的干重。耐虫系数越低,水稻对BPH的耐害性越强。每组实验设三次重复。9、TOM64多肽的亚细胞定位(1)亚细胞定位载体的构建将TOM64基因去掉终止密码子的编码区序列通过XhoI和SpeI两个酶切位点连接到PA7-GFP载体中GFP的前面,形成PA7-TOM64-GFP的融合载体。(2)水稻原生质体的制备a)种子消毒及培养。ZH11种子在75%酒精中1min;然后用2.5%次氯酸钠洗20min;用无菌水至少清洗5次。播种在1/2MS固体培养基上,在12h/12h光照/黑暗,26℃环境下,发芽3天,暗下培养7天得到ZH11的黄化苗。b)剪刀截取40-60颗水稻幼苗的茎和叶鞘,握成一束,用锋利刀片切成0.5mm左右长条。c)剪切好的小条迅速转移至0.6M甘露醇(mannitol)中,暗下放置10min。d)弃去甘露醇,将小条块浸在酶消化液中,暗下,轻微震荡(60-80rpm)4-5hr。酶解液:1.5%CellulaseR-10,0.75%MacerozymeR-10,0.6Mmannitol,10mMMES.KOH(pH5.7),10mMCaCl2,0.1%BSA。e)酶消化之后,加入等体积的W5溶液,用手用力摇晃10s。W5溶液:154mMNaCl,125mMCaCl2,5mMKCl,2mMMES.KOHatpH5.7。f)将以上混合液通过40μm尼龙过滤膜过滤,至一圆底管;用W5溶液清洗滤膜上方的水稻小条块3-5次,过滤通过尼龙膜。g)吊桶式转头离心1500rpm,3min,收集原生体。h)用W5清洗一次原生质体,离心原生质体。i)用MMG溶液重悬。血细胞计数板计数约2×106细胞/mL。MMG溶液:0.4Mmannitol,15mMMgCl2,4mMMES.KOH(pH5.7)。j)FDA染色观察原生质体及其活力。(3)水稻原生质体的转化a)将5-10μg质粒与100μL原生体(约2×105个细胞)混合。b)加入110μl新配制的PEG溶液。混合液在室温、暗下放置10-20min。PEG溶液:40%(W/V)PEG4000,0.2Mmannitol,0.1MCaCl2。c)轻轻缓慢加入440μlW5溶液。轻轻翻转管子使之混匀。离心1500rpm,3min。收集原生质体。d)轻轻用1mlWI溶液重悬原生质体。WI溶液:0.5Mmannitol,20mMKCl,4mMMES(pH5.7)。e)将原生质体转移至六孔板。暗下在室温放置6-16h。(4)MitotrackerRed染色所用试剂为MitoRedCMXRos(Invitrogen,M7512),染色严格根据试剂说明书进行操作。10、水稻组织H2O2含量的测定水稻叶鞘样品在液氮中研磨至粉,称取0.3g样品于2ml离心管中,加1ml去离子水充分混匀,13600g离心10分钟,上清液即为待测样品。H2O2含量测定使用的是AmplexRedHydrogenPeroxide/PeroxidaseAssaykit(Invitrogen,A22188),根据试剂盒说明书进行测定。11、TOM64基因缺失对水稻产量性状的影响为了分析TOM64基因缺失对水稻产量性状的影响,本发明人通过对杂交后代进行分离筛选,获得了TOM64基因缺失的纯系种子,并种植在室内和田间,对其产量相关的性状进行了观察和测定。实施例1、水稻基因缺失突变体T35显示了对褐飞虱(BPH)较强的抗性本发明人从田间初步筛选到的水稻抗褐飞虱突变体中,挑选部分突变体进行了室内单株抗虫鉴定,发现有些突变体对褐飞虱并未显示出较好的抗性,但有一株编号T35的突变体(2012年田间鉴定褐飞虱抗性级别:3级),室内单株抗虫鉴定显示,无论是苗期还是分蘖期,相对于野生型ZH11,突变体T35都表现出非常强的抗性(图2B,D,E)。旁邻序列的分析显示,该突变体的T-DNA插入在水稻基因LOC_Os02g51580的第9个外显子中(该基因共有13个外显子)(图2A)。荧光定量PCR的分析结果显示,此基因在突变体中未检测到表达(图2C)。由此证明,该突变体是基因功能缺失突变体,突变体显示了对褐飞虱非常强的抗性。也即,该突变体是基因组中敲除了TOM64基因的植物。实施例2、T35突变基因编码水稻的TOM64多肽如前所述,T35突变体中缺失的基因由13个外显子和12个内含子组成,全长8864bp,其全长cDNA长度为2212bp(KOME登录号:AK069965)。该基因编码一个614个氨基酸的蛋白。其N端(氨基酸20-38)有一个跨膜结构域,中间是一个具有酰胺酶活性的功能域(氨基酸75-462),C端是一个三肽重复序列的TPR结构域(氨基酸532-564)(图3A)。这是植物特有的质体(叶绿体或线粒体)外膜转运分子TOC64(叶绿体)或TOM64(线粒体)的结构。通过BLASTP(Altschuletal.,1990)程序在NCBI蛋白数据库进行进一步的同源性分 析,本发明人在短药野生稻(Oryzabrachyantha),谷子(Setariaitalica),玉米(Zeamays)和拟南芥(Arabidopsisthaliana)等中都找到了该蛋白的同源蛋白,与水稻来源的该蛋白的同源率分别为89%,76%,74%和53%,证明该基因在单子叶植物中相对保守,与双子叶植物拟南芥中TOM64的同源性差异略大。对一些具有酰胺酶结构域的蛋白的进化树分析显示此类蛋白在叶绿体、线粒体和胞质中都有分布(图3B)。T35突变体中缺失的蛋白是水稻的线粒体外膜转运分子蛋白TOM64。TOM64基因的cDNA序列(SEQIDNO:1):ATGGACTCCTCGGCGCGATCGGGCGGCGGAGGCACCGGCGGGTACACCAGCACTCGCGTGTGGATGGTCGCGGGCGTCGCCATCGCCGGCGCCATCGTCTTCGTGGAGGCCGCGCGGCGCAGGCGCCGGTGGCTGCGGGACAGGTCCGAGGTTCCCCCCGATTTCGGCGCCTTCTGCTACCGCTTCGAGATCGCCCCGGCGCCGCAGCCTCCGCCTCCCGCCGCGCGCCAGCTACTCTCGGGCCTCACATTCGCGGCCAGCGACAACTTCGAGATCGAGGGCTATGTGGCTGGGTTTGGGAATCCGGACTGGAAGAGGACTCACAAGGCAGCCACGCGCACGGCGGTTCCTGTCACGATGCTGCAGAAGCAGGGGGGCACCTACGTTGGTAGCACAGTCATGGATGAGCTCGGATTTGGTGTTTCTGGAGGAAATTTACACAATGGAACACCAATCAACCCAGCATCTCCATCACTCTTCCCTGGTGGATCATGCAGTGGTTCTGCTGTGGCAGTTTCTGCACAACTTGTCGACTTTGCTCTTGGTACTGATACAACTGGTGATGTAAGAATTCCAGCATGCTTCTGTGGTGTACTTTGTTTCAAGTCCTCTCATGGGGTTGTATCTACTCTTGGGACCATTGCAAACTCTCAAAGTTTAGACACGATTGGATGGTTTGCACGAGATCCAAGTGTTCTGCATCGTGTTGGAGATGTTCTTTTACCAGCTGCTACAGGTGGGCTTACGCAAACAAGGCAGTTATTTTTTGCTGACGATTGCTTTCAGTTGCTGAAGGTCCCCAACGAGAAAACAGTAAATGTCATAGAAAATGCTATCCAGACATTACCAGGATATCAGCCACCTAAGCACATCAATATTGGTGAGTATATCAGTTCACATGTACCTAGCCTGAAGGATTTTTGTGAACCCACTGTGGAGATGCTCGAAGGAATGTCAGCCTTGAAAGCACTCTCAACAGTTATGCTGTTATTACAGAGATATGAATTCAAGACAAACCACGAGGATTGGGTTAATACTGTAAAACCCAAGCTTGGGCTTGATACCTCTACTCGTGTGCTACAAGCTGTCAATTCGAAAAGTGATAACATCAAATCTTTATACATTGTACGAAATGAATTGCGAGCTGCACTCAAGAATCTTTTAAAGGATACTGGAATTTTAGTTCTGCCAACCACAGCTGGATATCCTTTAAAGAGGAATGCAAGGCAAAGACTTTCACCTGGGTTTGAAGATAGAATGAGTGCATTTGTAGGCATTGCTACACTTTCAGGCTGCTGTCAGGCTGTGATTCCCTTAGGAAGTCACAATGATCATCCTATATCTCTTTCATTGCTAGCAGCACATGGATCAGACAAATTCCTTCTTCGCAATGTCTTGTATATGTTTTCTTCCATCAAAGAACAAGTCGTTTTGGCGTCCAAGTTGGTAACTGCACCAGTAATCAATAGAGATGCTGATTTTGGTGCAGCAGAGTTGTTGAAAGAGAAGGGAAATAGTGCTTTCAAAGGACGAAAATGGAGCAAGGCGGTTGAATTTTATTCTGATGCTATCAAATTGAATGGCACAAATGCAACATATTACAGCAATAGAGCAGCTGCCTATCTGGAACTTGGCCGTTATAAGCAAGCTGAAGCAGATTGTGAGCAGGCCTTACTCTTGGATAAAAAGAATGTTAAAGCATATCTACGACGAGGGATCGCAAGAGAAGCTGTTCTGAATCACCAAGAAGCTCTTCAAGATATCAGGCATGCTTTAGCTTTGGAGCCACAGAACAAAGCAGGCCTTTTGGCAGAGAGAAGGCTGCAGAAAAAACTAAGGTGATOM64多肽的氨基酸序列(SEQIDNO:2):MDSSARSGGGGTGGYTSTRVWMVAGVAIAGAIVFVEAARRRRRWLRDRSEVPPDFGAF CYRFEIAPAPQPPPPAARQLLSGLTFAASDNFEIEGYVAGFGNPDWKRTHKAATRTAVPVTMLQKQGGTYVGSTVMDELGFGVSGGNLHNGTPINPASPSLFPGGSCSGSAVAVSAQLVDFALGTDTTGDVRIPACFCGVLCFKSSHGVVSTLGTIANSQSLDTIGWFARDPSVLHRVGDVLLPAATGGLTQTRQLFFADDCFQLLKVPNEKTVNVIENAIQTLPGYQPPKHINIGEYISSHVPSLKDFCEPTVEMLEGMSALKALSTVMLLLQRYEFKTNHEDWVNTVKPKLGLDTSTRVLQAVNSKSDNIKSLYIVRNELRAALKNLLKDTGILVLPTTAGYPLKRNARQRLSPGFEDRMSAFVGIATLSGCCQAVIPLGSHNDHPISLSLLAAHGSDKFLLRNVLYMFSSIKEQVVLASKLVTAPVINRDADFGAAELLKEKGNSAFKGRKWSKAVEFYSDAIKLNGTNATYYSNRAAAYLELGRYKQAEADCEQALLLDKKNVKAYLRRGIAREAVLNHQEALQDIRHALALEPQNKAGLLAERRLQKKLR实施例3、TOM64基因对突变体遗传互补后的抗虫表型本发明人又进一步通过遗传互补实验对突变体的抗虫表型进行了验证。将TOM64基因的启动子连同其编码区连入pCAMBIA2300载体,通过农杆菌介导转化tom64突变体。通过RNA的检测,本发明人成功得到了三个独立的互补转基因水稻株系(R1,R2和R3)(图4A)。进一步的抗褐飞虱鉴定显示转入TOM64基因的互补转基因植株的抗性明显低于tom64突变体,与野生型相当(图4B),证明了此突变体抗BPH的表型是由于TOM64基因的缺失导致的。实施例4、tom64突变体的抗虫机制研究植物的抗虫性可以通过三个方面来实现:非嗜性(不选择性)、抗生性和耐虫性(耐害性)。在突变体tom64和野生型ZH11间的选择性测试结果显示,在释放褐飞虱1到96h的时间内,褐飞虱在野生型及突变体上的数目接近,且在每个时间点都无显著性差异(图5A)。另外,产卵量的测试结果显示褐飞虱在突变体上的产卵量比其在野生型中略有增多,但无显著性差异(图5B)。这说明突变体tom64对褐飞虱的抗性不是通过非嗜性来实现的。蜜露(褐飞虱排泄物)的排泄量可以提示褐飞虱的取食量。通过测定褐飞虱的蜜露排泄量,本发明人发现,在野生型水稻中取食的褐飞虱,其蜜露量明显多于褐飞虱取食突变体产生的蜜露量(图6A)。另外,相比野生型,突变体也显著抑制了褐飞虱的生长速率(图6B)。但是,对在不同植株上褐飞虱死亡率的测定却没有显著差异(图6C)。这些结果说明突变体tom64可以抑制褐飞虱的取食及生长,但TOM64的 缺失对褐飞虱不足以致死,由此说明,突变体抗褐飞虱在一定程度上是通过抗生性实现的。之前的表型鉴定显示突变体对褐飞虱的抗性相对于野生型有非常显著的提高。进一步的耐害性实验分析表明,tom64突变体的耐虫系数显著低于野生型ZH11的耐虫系数(图7),而耐虫系数越低,耐害性越强,证明突变体对褐飞虱的耐害性有了较明显的提高。综上抗虫机制的分析,证明突变体tom64对褐飞虱的抗性是通过抗生性和耐害性两方面同时发挥作用的。实施例5、TOM64基因的亚细胞定位亚细胞的定位对研究蛋白功能具有重要指导作用。拟南芥TOM64被发现特异定位于线粒体中。本发明人利用水稻PA7-TOM64-GFP融合蛋白的瞬时表达观察其亚细胞定位。将对照载体PA7-GFP和融合载体分别转化水稻原生质体,荧光共聚焦显微镜观察发现PA7-GFP在细胞膜以及胞质中泛在表达,而融合蛋白在胞质中随机分布(图8A)。进一步与线粒体的特异性染料Mitotracker共染,发现二者的荧光可以很好的共定位(图8B),证明水稻的TOM64多肽也是仅特异的定位于线粒体中,与预测一致。实施例6、TOM64基因的缺失提高了水稻组织H2O2的含量TOM64是线粒体外膜的转运分子,其缺失会影响一系列线粒体蛋白转运进入线粒体。而线粒体进行氧化呼吸作用,是植物产生活性氧的主要细胞器之一。本发明人在褐飞虱取食前后,分别测定了水稻叶鞘中H2O2的含量,结果发现,野生型水稻ZH11中H2O2的含量在褐飞虱取食前后没有明显变化,而突变体中H2O2的含量可在褐飞虱取食6h的时候被显著诱导(图9)。更重要的是,无论在褐飞虱取食前后,突变体tom64中H2O2的含量都要显著高于野生型中的含量(图9)。而H2O2是水稻抗性防御反应中的一个重要分子。这说明TOM64的缺失显著提高了水稻组织中H2O2的含量,提示由此提高了水稻对褐飞虱的抗性。实施例7、突变体及野生型对褐飞虱抗性的评价为了进一步验证水稻抗褐飞虱的表型,本发明人分别对野生型(wt)、突变体(mutant)、杂合突变体后代(Co-M,Co-WT,Co-H)以及三个互补的转基因株系(R1、R2、R3)进行了苗期室内的抗褐飞虱级别评价,当感虫对照TN1全部死亡时进行评价,评价标准为:0级为秧苗未被害;1级,第一叶部分发黄;3级,第一叶及第二叶部分发黄;5级,显著发黄,植株有些矮化;7级,植株萎缩或严重矮化;9级,植株死亡。结果显示,野生型ZH11、3个互补的转基因株系以及共分离的杂合体和野生型,它们的抗性级别都为7-9,突变体tom64以及共分离的纯和突变体的抗性级别为3-5,抗虫对照IR56的抗性级别为1-3(图10)。这些结果充分证明,TOM64基因的缺失在提高水稻对BPH抗性中起着关键的作用。实施例8、TOM64基因缺失对水稻产量性状的影响为了进一步确定TOM64基因缺失对水稻产量性状的影响,本发明人通过将突变体tom64自交的方式获得了TOM64基因缺失(即基因被敲除)的纯系,将其种植在室内和田间,并对其产量相关的性状进行了观察和测定。结果发现,TOM64基因被敲除后水稻分蘖提前(图11A),水稻植物明显变矮(图11B)。TOM64基因被敲除植株与野生型水稻相比,二者的有效分蘖率没有显著差异(图11C)。由于TOM64基因缺失的纯系全部分蘖数显著增多,因此,TOM64基因被敲除后水稻的有效分蘖数量显著增多。而且,本发明人比较发现,TOM64基因缺失的纯系水稻的千粒重和每穗的粒数没有显著差异,而分蘖数的增加促进了单株水稻的穗的增加,因此,敲除该基因对提高水稻产量具有作用。总结1、本发明证明tom64突变体提高了水稻对飞虱科昆虫(包括褐飞虱)的抗性。2、抗虫机理研究表明该基因突变抑制了飞虱科昆虫的取食量,从而提高了水稻对飞虱科昆虫的耐害性。3、TOM64基因缺失显著提高了水稻组织中H2O2的含量,因此提高了水 稻对飞虱科昆虫的抗性。4、tom64突变体对飞虱科昆虫的抗性可以从原始的高感水平(7-9级),提高到中等抗性水平(3-5级)。在本发明提及的所有文献都在本申请中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1