癌症疫苗组合物及其使用方法与流程
本发明涉及2014年7月18日提交的美国临时专利申请第62/026,246号,其通过引用全文纳入本文。引用通过EFS-WEB提交的序列表ASCII文本文件序列表,名称“41299-781-601-seqlist_ST25.txt”,大小:15.4kb,创建日期:2015年6月18日,其通过EFS-WEB与本发明电子提交,内容通过引用全文纳入本文。政府许可权利的声明本发明在国家卫生研究院(NIH)授予的资助号HHSN261-200533000CN01-CN-53300以及国家卫生研究院(NIH)授予的资助号KL2TR000421下由政府支持完成。政府对本发明拥有某些权利。
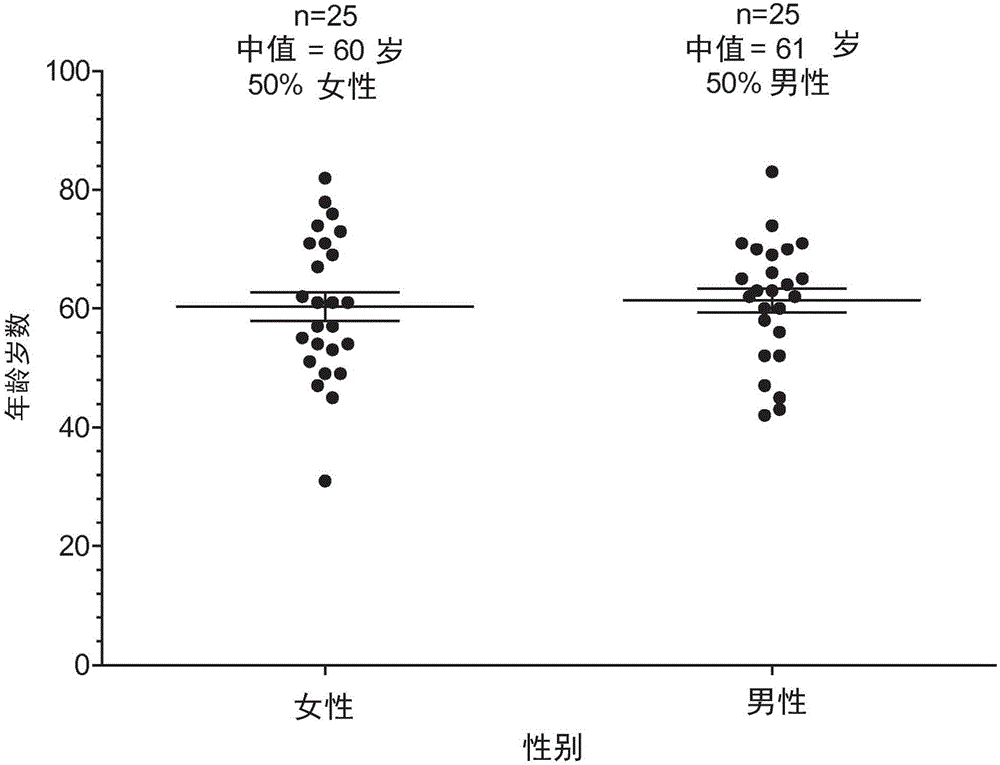
背景技术:
:传统上通过手术减少肿瘤重量和随后的化疗和/或放疗来完成癌症治疗。该策略减少肿瘤,并且在较早阶段,通常导致完全缓解。不幸的是,对更晚期肿瘤的预后在过去的50年间几乎没有变化,并且由于后续转移导致大量癌症相关死亡。需要新的预防性和治疗性处理来对抗日益增加的癌症。每年全世界有超过一百万人诊断出结直肠癌并且每年有超过700,000人死于结直肠癌。防止结直肠癌发展会对所有个体有显著的健康和经济益处。如果人们不再需要接受昂贵的癌症相关监控和治疗性介入,则将节约数十亿美元。需要预防和治疗结直肠癌的新方法。发明概述在一些方面中,本文所述的组合物包括,包含以下的组合物:第一质粒,其包含第一核苷酸序列,所述第一核苷酸序列编码由与结直肠癌相关的细胞所表达的第一抗原的第一表位;和第二核苷酸序列,所述第二核苷酸序列编码由与结直肠癌相关的细胞所表达的第二抗原的第二表位,其中所述第一核苷酸序列和所述第二核苷酸序列位于一个或多个质粒中。在一些方面中,本文所述的组合物包含,包含以下的组合物:包含第一核苷酸序列第一质粒,所述第一核苷酸序列编码第一抗原的第一表位,所述第一表位是选自CDC25B、COX2、EGFR、FASCIN1、IGF1R、PRL3、RCAS1和VCP的肽的部分,其中所述第一核苷酸序列位于质粒中。在其他方面中,本发明包括一种组合物,其包含:含第一核苷酸序列的第一质粒,所述第一核苷酸序列编码第一抗原的第一表位;和第二核苷酸序列,所述第二核苷酸序列编码第二抗原的第二表位,其中所述第一和第二表位独立选自CDC25B、COX2、EGFR、FASCIN1、IGF1R、PRL3、RCAS1和VCP,其中所述第一核苷酸序列和第二核苷酸序列位于一个或多个质粒中。在一些方面中,本文所述的组合物包含,包含以下的组合物:由与结直肠癌相关的细胞表达的第一抗原的第一表位;和由与结直肠癌相关的细胞表达的第二抗原的第二表位。在其他方面中,本发明包括一种组合物,其包含:至少第一抗原的第一表位,所述第一表位是选自CDC25B、COX2、EGFR、FASCIN1、IGF1R、PRL3、RCAS1和VCP的肽的部分。在其他方面中,本发明包括一种组合物,其包含:至少第一抗原的第一表位,至少第二抗原的第二表位,所述第一和第二表位独立选自CDC25B、COX2、EGFR、FASCIN1、IGF1R、PRL3、RCAS1和VCP。在一些方面,本文所述的组合物包括:一种包含分离并纯化的质粒和赋形剂的组合物,所述质粒包含编码多肽的核苷酸序列,其中所述核苷酸包含选自CDC25B、COX2、EGFR、FASCIN1、IGF1R、PRL3、RCAS1和VCP的多个表位。所述多个表位可包括与选自SEQIDNO:1-45的氨基酸序列有至少90%、至少95%、或至少99%序列相同性的一个或多个表位。所述多个表位包括与SEQIDNO:1-45的至少8个连续氨基酸有至少90%、至少95%、或至少99%序列相同性的一个或多个表位。多个表位为多个连续表位。连续表位还可包括一个或多个表位序列之间的接头。组合物还可包含其他分离并纯化的质粒,所述质粒包含编码其他多肽的其他核苷酸序列,其中所述其他多肽包含多个表位,包括与选自SEQIDNO:1-45的氨基酸序列含有至少90%、至少95%、或至少99%序列相同性的一个或多个表位。多肽和其他多肽的序列可以不同。组合物还可包含:包含第一核苷酸序列的第一质粒,所述第一核苷酸序列编码第一抗原的第一表位,所述第一表位是选自CDC25B、COX2、EGFR、FASCIN1、IGF1R、PRL3、RCAS1和VCP的肽的部分,其中所述第一核苷酸序列位于质粒中。组合物还可包含:含第一核苷酸序列的第一质粒,所述第一核苷酸序列编码第一抗原的第一表位;和第二核苷酸序列,所述第二核苷酸序列编码第二抗原的第二表位,其中所述第一和第二表位独立选自CDC25B、COX2、EGFR、FASCIN1、IGF1R、PRL3、RCAS1和VCP,其中所述第一核苷酸序列和第二核苷酸序列位于一个或多个质粒中。组合物可包含编码肽CDC25B的表位的核酸序列,其选自编码氨基酸序列的核苷酸序列,其中所述氨基酸序列与选自SEQIDNO:1-2的氨基酸序列有至少90%序列相同性。组合物可包含编码肽COX2的表位的核酸序列,其选自编码氨基酸序列的核苷酸序列,其中所述氨基酸序列与选自SEQIDNO:3-10的氨基酸序列有至少90%序列相同性。组合物可包含编码肽EGFR的表位的核酸序列,其选自编码氨基酸序列的核苷酸序列,其中所述氨基酸序列与选自SEQIDNO:11-13的氨基酸序列有至少90%序列相同性。组合物可包含编码肽FASCIN1的表位的核酸序列,其选自编码氨基酸序列的核苷酸序列,其中所述氨基酸序列与选自SEQIDNO:14-22的氨基酸序列有至少90%序列相同性。组合物可包含编码肽IGF1R的表位的核酸序列,其选自编码氨基酸序列的核苷酸序列,其中所述氨基酸序列与选自SEQIDNO:23-26的氨基酸序列有至少90%序列相同性。组合物可包含编码肽PRL3的表位的核酸序列,其选自编码氨基酸序列的核苷酸序列,其中所述氨基酸序列与选自SEQIDNO:27-31的氨基酸序列有至少90%序列相同性。组合物可包含编码肽RCAS1的表位的核酸序列,其选自编码氨基酸序列的核苷酸序列,其中所述氨基酸序列与选自SEQIDNO:32-36的氨基酸序列有至少90%序列相同性。组合物可包含编码肽VCP的表位的核酸序列,其选自编码氨基酸序列的核苷酸序列,其中所述氨基酸序列与选自SEQIDNO:37-45的氨基酸序列有至少90%序列相同性。组合物可包含独立选自CDC25B、COX2、EGFR、FASCIN1、IGF1R、PRL3、RCAS1和VCP的第一和第二表位。组合物还可包含至少一个其他表位,其中所述第一和第二表位和至少一个其他表位独立选自CDC25B、COX2、EGFR、FASCIN1、IGF1R、PRL3、RCAS1和VCP。组合物还可包含:包含第一核苷酸序列的第一质粒,所述第一核苷酸序列编码第一抗原的第一表位,所述第一表位是选自CDC25B、COX2和PRL3的肽的部分,其中所述第一核苷酸序列位于质粒中。组合物还可包含:含第一核苷酸序列的第一质粒,所述第一核苷酸序列编码第一抗原的第一表位;和第二核苷酸序列,所述第二核苷酸序列编码第二抗原的第二表位,其中所述第一和第二表位独立选自CDC25B、COX2和PRL3,其中所述第一核苷酸序列和第二核苷酸序列位于一个或多个质粒中。组合物可包含编码肽CDC25B的表位的核酸序列,其选自编码氨基酸序列的核苷酸序列,所述氨基酸序列与选自SEQIDNO:1-2的氨基酸序列有至少90%序列相同性。组合物可包含编码肽COX2的表位的核酸序列,其选自编码氨基酸序列的核苷酸序列,所述氨基酸序列与选自SEQIDNO:3-10的氨基酸序列有至少90%序列相同性。组合物可包含编码肽PRL3的表位的核酸序列,其选自编码氨基酸序列的核苷酸序列,其中所述氨基酸序列与选自SEQIDNO:27-31的氨基酸序列有至少90%序列相同性。组合物可包含独立选自CDC25B、COX2、EGFR、FASCIN1、IGF1R、PRL3、RCAS1和VCP的第一和第二表位。组合物还可包含至少一个其他表位,其中所述第一和第二表位和至少一个其他表位独立选自CDC25B、COX2、EGFR、FASCIN1、IGF1R、PRL3、RCAS1和VCP。第一和第二核酸序列可位于第一质粒上。第二核酸序列可位于第二质粒上。第一和第二核酸序列可纯化至至少70%纯。至少第一质粒可包含在药物组合物内。第一和第二核酸序列可位于第一质粒上并且被接头核酸序列分开。第一核酸序列可与第一质粒上的第二核酸序列相邻。组合物还可包含:至少第一抗原的第一表位,所述第一表位是选自CDC25B、COX2、EGFR、FASCIN1、IGF1R、PRL3、RCAS1和VCP的肽的部分。组合物还可包含:至少第一抗原的第一表位,和至少第二抗原的第二表位,所述第一和第二表位独立选自CDC25B、COX2、EGFR、FASCIN1、IGF1R、PRL3、RCAS1和VCP。肽CDC25B的至少第一表位可选自氨基酸序列,所述氨基酸序列与SEQIDNO:1-2的氨基酸序列有至少90%序列相同性。肽COX2的至少第一表位可选自氨基酸序列,所述氨基酸序列与SEQIDNO:3-10的氨基酸序列有至少90%序列相同性。肽EGFR的至少第一表位可选自氨基酸序列,所述氨基酸序列与SEQIDNO:11-13的氨基酸序列有至少90%序列相同性。肽FASCIN1的至少第一表位可选自氨基酸序列,所述氨基酸序列与SEQIDNO:14-22的氨基酸序列有至少90%序列相同性。肽IGF1R的至少第一表位可选自氨基酸序列,所述氨基酸序列与SEQIDNO:23-26的氨基酸序列有至少90%序列相同性。肽PRL3的至少第一表位可选自氨基酸序列,所述氨基酸序列与SEQIDNO:27-31的氨基酸序列有至少90%序列相同性。肽RCAS1的至少第一表位可选自氨基酸序列,所述氨基酸序列与SEQIDNO:32-36的氨基酸序列有至少90%序列相同性。肽VCP的至少第一表位可选自氨基酸序列,所述氨基酸序列与SEQIDNO:37-45的氨基酸序列有至少90%序列相同性。组合物可包含独立选自CDC25B、COX2、EGFR、FASCIN1、IGF1R、PRL3、RCAS1和VCP的第一和第二表位。组合物还可包含至少一个其他表位,其中所述第一和第二表位和至少一个其他表位独立选自CDC25B、COX2、EGFR、FASCIN1、IGF1R、PRL3、RCAS1和VCP。组合物可包含至少第一抗原的第一表位,所述第一表位是选自CDC25B、COX2和PRL3的肽的部分。组合物可包含:至少第一抗原的第一表位,和至少第二抗原的第二表位,所述第一和第二表位独立选自CDC25B、COX2和PRL3。肽CDC25B的至少第一表位可选自氨基酸序列,所述氨基酸序列与SEQIDNO:1-2的氨基酸序列有至少90%序列相同性。肽COX2的至少第一表位可选自氨基酸序列,所述氨基酸序列与SEQIDNO:3-10的氨基酸序列有至少90%序列相同性。肽PRL3的至少第一表位可选自氨基酸序列,所述氨基酸序列与SEQIDNO:27-31的氨基酸序列有至少90%序列相同性。组合物可包含独立选自CDC25B、COX2和PRL3的第一和第二表位。组合物还可包含至少一个其他表位,其中所述第一和第二表位和至少一个其他表位独立选自CDC25B、COX2和PRL3。组合物可给予对象。与结直肠癌关联的细胞可选自下组:表达非典型特征的结肠细胞,表达非典型特征的直肠细胞,前肿瘤性结肠细胞,前肿瘤性直肠细胞,结肠癌细胞,直肠癌细胞,前侵袭性结肠癌细胞,前侵袭性直肠癌细胞,结肠癌干细胞,直肠癌干细胞,上皮细胞,间充质细胞,基质细胞,及其组合。与非小细胞肺癌关联的细胞可选自下组:表达非典型特征的肺细胞,前肿瘤性肺细胞,肺癌细胞,前侵袭性肺癌细胞,肺癌干细胞,上皮细胞,间充质细胞,基质细胞,及其组合。组合物可有效引发对象中的免疫应答。组合物可有效消除对象中与结直肠癌、非小细胞肺癌或卵巢癌关联的多种细胞。组合物可用于阻止对象中与结直肠癌、非小细胞肺癌或卵巢癌关联的细胞的生长。免疫应答为1型免疫应答。至少第一表位可包含在药物组合物内。组合物还可包含药物运载体和/或佐剂。第一和第二表位的氨基酸序列被接头氨基酸序列分开。第一表位的氨基酸序列可与第二表位的氨基酸序列毗邻。免疫应答可表征为I型细胞因子产生与II型细胞因子产生之比大于1。免疫应答可表征为I型细胞因子产生与II型细胞因子产生之比小于1。免疫应答可表征为IFN-γ产生与IL-10产生之比大于1。免疫应答可表征为IFN-γ产生与IL-10产生之比小于1。佐剂可为GM-CSF。本文可包括治疗有需要的患者中结直肠癌或非小细胞肺癌的方法,所述方法包括给予所述对象本文所述的组合物。本文还可包括延长有需要的患者中结直肠癌或非小细胞肺癌的缓解期的方法,包括给予所述对象本文所述的组合物。可给予至少一剂量的组合物。组合物可通过皮下注射、皮内注射、肌内注射、静脉内注射、局部施用或吸入来给予。所述方法还可包括给予对象其他治疗剂。本文还包括一种分离并纯化的质粒,其包含编码与选自SEQIDNO:1-45的表位序列有至少70%序列相同性的多肽的至少一个核苷酸序列。所述至少一个核苷酸序列可编码与选自SEQIDNO:1-45的表位序列有至少80%、85%、90%、95%或99%序列相同性的多肽。所述至少一个核苷酸序列可编码与SEQIDNO:1-45的至少8个连续氨基酸有至少70%、80%、85%、90%、95%或99%序列相同性的多肽。质粒可为约50%、约60%、约70%、约80%、约90%或约100%纯。本文还提供含本文所述组合物的结直肠癌疫苗。疫苗可通过皮下注射、皮内注射、肌内注射、静脉内注射、局部施用或吸入来给予。疫苗可在其他治疗剂之前、之后或与之组合给予对象。本文还提供含本文所述组合物的非小细胞肺癌疫苗。疫苗可通过皮下注射、皮内注射、肌内注射、静脉内注射、局部施用或吸入来给予。疫苗可在其他治疗剂之前、之后或与之组合给予对象。通过引用纳入本说明书中提到的所有发表物、专利和专利申请通过引用纳入本文,就好像将各篇单独的发表物、专利或专利申请专门和单独地通过引用纳入本文那样。附图简要说明所附权利要求书中具体说明了本发明的新特征。参考以下说明和附图更好地理解本发明的特征和优点,这些详述列出利用本发明原理的说明性实施方式:图1显示结直肠癌患者年龄和性别统计。图2显示结直肠癌患者的阶段分布。图3显示正常供体年龄和性别统计。图4显示CDC25B的间接人ELISA结果。图5显示COX2的间接人ELISA结果。图6显示EGFR的间接人ELISA结果。图7显示FASCIN1的间接人ELISA结果。图8显示IGF1R的间接人ELISA结果。图9显示PRL3的间接人ELISA结果。图10显示RCAS1的间接人ELISA结果。图11显示VCP的间接人ELISA结果。图12显示CDC25B的校正的IFN-γ点/孔。图13显示COX2的校正的IFN-γ点/孔。图14显示FASCIN1的校正的IFN-γ点/孔。图15显示RCAS1的校正的IFN-γ点/孔。图16显示HIVp17、PHA、tt和CEF的校正的IFN-γ点/孔。图17表明CDC25B疫苗对APCmin小鼠中小肠肿瘤计数的功效。图18表明CDC25B疫苗对APCmin小鼠中结肠癌计数没有功效。图19表明COX2疫苗对APCmin小鼠中小肠肿瘤计数的功效。图20表明COX2疫苗对APCmin小鼠中结肠癌计数没有功效。图21表明CDC25B和COX2疫苗对APCmin小鼠中小肠肿瘤计数的功效。图22表明EGFR疫苗对APCmin小鼠中小肠肿瘤计数的功效。图23表明EGFR疫苗对APCmin小鼠中结肠癌计数没有功效。图24表明FASCIN1疫苗对APCmin小鼠中小肠肿瘤计数的功效。图25表明FASCIN1疫苗对APCmin小鼠中结肠癌计数没有功效。图26表明IGF1R疫苗对APCmin小鼠中小肠肿瘤计数的功效。图27表明IGF1R疫苗对APCmin小鼠中结肠癌计数没有功效。图28表明PRL3疫苗对APCmin小鼠中小肠肿瘤计数的功效。图29表明PRL3疫苗对APCmin小鼠中结肠癌计数没有功效。图30表明RCAS1疫苗对APCmin小鼠中小肠肿瘤计数的功效。图31表明RCAS1疫苗对APCmin小鼠中结肠癌计数没有功效。图32表明VCP疫苗对APCmin小鼠中小肠肿瘤计数的功效。图33表明VCP疫苗对APCmin小鼠中结肠癌计数的功效。图34表明MIX疫苗对APCmin小鼠中小肠肿瘤计数的功效。图35表明MIX疫苗对APCmin小鼠中结肠癌计数的功效。图36显示CDC25B、COX2和PRL3疫苗对APCmin小鼠存活的效果。图37显示CDC25B、COX2和PRL3疫苗的毒理学。图38显示用PRL3免疫的APCmin小鼠的ELISpot结果。图39显示用PRL3免疫的APCmin小鼠的ELISpot结果。图40显示CDC25B疫苗对AOM小鼠中结肠癌计数的功效。图41显示COX2疫苗对AOM小鼠中结肠癌计数的功效。图42显示EGFR疫苗对AOM小鼠中结肠癌计数的功效。图43显示FASCIN1疫苗对AOM小鼠中结肠癌计数没有功效。图44显示IGF1R疫苗对AOM小鼠中结肠癌计数没有功效。图45显示PRL3疫苗对AOM小鼠中结肠癌计数没有功效。图46显示RCAS1疫苗对AOM小鼠中结肠癌计数没有功效。图47显示VCP疫苗对AOM小鼠中结肠癌计数没有功效。图48显示MIX疫苗对AOM小鼠中结肠癌计数的功效。图49表示用CDC25B免疫的AOM小鼠的ELISpot结果。图50表示用PRL3免疫的AOM小鼠的ELISpot结果。图51表示用RCAS1免疫的AOM小鼠的ELISpot结果。图52表示用IGF1R免疫的AOM小鼠的ELISpot结果。图53表示用PRL3免疫的AOM小鼠的ELISpot结果。图54表示用RCAS1免疫的AOM小鼠的ELISpot结果。图55显示用CDC25B、COX2、FASCIN1和RCAS1免疫的AOM小鼠中的mRNA表达。图56显示用CDC25B、COX2、FASCIN1和RCAS1免疫的AOM小鼠中的蛋白质表达。图57显示用CDC25B免疫的MC-38小鼠的肿瘤体积。图58显示用COX2免疫的MC-38小鼠的肿瘤体积。图59显示用EGFR免疫的MC-38小鼠的肿瘤体积。图60显示用FASCIN1免疫的MC-38小鼠的肿瘤体积。图61显示用IGF1R免疫的MC-38小鼠的肿瘤体积。图62显示用PRL3免疫的MC-38小鼠的肿瘤体积。图63显示用PRL3免疫的MC-38小鼠的肿瘤体积。图64显示用PRL3免疫的MC-38小鼠的肿瘤体积。图65显示用RCAS1免疫的MC-38小鼠的肿瘤体积。图66显示用RCAS1免疫的MC-38小鼠的肿瘤体积。图67显示用RCAS1免疫的MC-38小鼠的肿瘤体积。图68显示用VCP免疫的MC-38小鼠的肿瘤体积。图69显示用MIX免疫的MC-38小鼠的肿瘤体积。图70表示用IGF1R免疫的MC-38小鼠的ELISpot结果。图71表示用PRL3免疫的MC-38小鼠的ELISpot结果。图72显示CDC25B免疫并且IgG、CD8和CD4消耗的MC-38小鼠的肿瘤体积。图73显示COX2免疫并且IgG、CD8和CD4消耗的MC-38小鼠的肿瘤体积。图74显示FASCIN1免疫并且IgG、CD8和CD4消耗的MC-38小鼠的肿瘤体积。图75显示本文所述肽的免疫评分结果。发明详述本发明提供癌症疫苗(例如结直肠癌、非小细胞肺癌或卵巢癌疫苗)组合物,用于阻止或治疗结直肠癌、非小细胞肺癌或卵巢癌。本发明还提供将癌症疫苗给予对象的方法。在一些方面,本文提供的组合物与本文提供的方法组合使用,阻止或治疗结直肠癌、非小细胞肺癌或卵巢癌。在一些情况中,组合物包括:编码癌症抗原(例如结直肠癌、非小细胞肺癌或卵巢癌抗原)的表位的核酸序列、含本文所述序列的质粒、佐剂、药物运载体和适于与药学组合物联用的惰性化学品,其中所述表位引发对象中的免疫应答。癌症抗原(例如结直肠癌、非小细胞肺癌或卵巢癌抗原)为患有或可能发展出结直肠癌、非小细胞肺癌或卵巢癌的对象中表达的任何抗原的至少一种。通常,癌抗原由癌细胞和/或组织例如癌干细胞所表达。例如,结直肠癌抗原由结直肠癌细胞和/或组织例如结直肠癌干细胞(CSC)所表达。结直肠癌CSC抑制自更新、不受控生长和药物抗性。在一些情况中,CSC表达蛋白质(例如,抗原),并且在一个方面,由CSC表达的蛋白质(例如,抗原)的水平上调(例如,相对于给定量增加表达)或下调(例如,相对于给定量降低表达)。在一些情况中,与正常组织或细胞相比由结直肠CSC上调的蛋白质参与结直肠癌的发展和/或进展。在一个方面,使用本文所述的组合物和方法来鉴定蛋白质并且靶向抗原表位。在一些情况中,癌抗原(例如结直肠癌、非小细胞肺癌或卵巢癌抗原)的一个表位用于组合物中。在其他情况中,癌抗原(例如结直肠癌、非小细胞肺癌或卵巢癌抗原)的超过一个表位用于组合物中。在其他情况中,在组合物中使用超过2种抗原,超过3种,超过4种,超过5种,超过6种,超过7种,超过8种,超过9种,超过10种,超过15种,超过20种,超过25种或超过30种癌抗原(例如结直肠癌、非小细胞肺癌或卵巢癌抗原)。在一些情况中,抗原相同。在其他情况中,抗原不同。在一些方面,本文所述癌症疫苗(例如结直肠癌、非小细胞肺癌或卵巢癌疫苗)的组合物经配置用于预防结直肠癌、非小细胞肺癌或卵巢癌。在一个方面,预防组合物消除具有蛋白质异常(例如上调)表达的细胞(例如结直肠CSC),以预防结直肠癌。在一些情况中,一个和/或多个表位在相同癌抗原上(例如结直肠癌、非小细胞肺癌或卵巢癌抗原)或一个和/或多个表位在不同癌抗原上(例如结直肠癌、非小细胞肺癌或卵巢癌抗原)。在一些情况中,癌抗原(例如结直肠癌、非小细胞肺癌或卵巢癌抗原)上的一个表位用于组合物中。在其他情况中,在组合物中使用癌抗原(例如结直肠癌、非小细胞肺癌或卵巢癌抗原)上的超过1种表位,癌抗原(例如结直肠癌、非小细胞肺癌或卵巢癌抗原)上的超过2种,超过3种,超过4种,超过5种,超过6种,超过7种,超过8种,超过9种,超过10种,超过15种,超过20种,超过25种或超过30种表位。在一些方面中,本文所述组合物和方法引发对象中的免疫应答。在一些方面中,免疫应答是针对组合物(例如,疫苗)中抗原的表位的免疫应答。疫苗装备对象的免疫系统,使得该免疫系统检测并破坏对象中含有疫苗的抗原的那些物质。在一些方面中,本文所述的组合物和方法引发对象中的1型(Th1)免疫应答。在一些情况中,Th1免疫应答包括由免疫细胞(例如,抗原特异性T细胞)亚组分泌炎性细胞因子(例如,IFNγ,TNFα)。在其他情况中,炎性细胞因子使另一亚型的免疫细胞(例如,细胞毒性T细胞)活化,其破坏对象中含有抗原的那些物质。在一些方面中,使用本文所述的筛选方法来鉴定来自肿瘤抗原的结合肽和表位,针对诱导Th1免疫应答筛选多种抗原的表位。在一个方面中,筛选方法鉴定来自至少一种肿瘤抗原的表位,所述表位引发针对癌抗原(例如,结直肠癌、非小细胞肺癌或卵巢癌抗原)的Th1应答(例如,引起Th1细胞因子分泌),并且还可包含例如结直肠CSC抗原。在一些情况中,用于本文所述的组合物和方法的表位和/或抗原被对象的免疫系统识别以引发Th1免疫应答并释放I型细胞因子。在一些方面中,通过表位和T细胞(更具体地,由T细胞表达的主要组织相容性复合物(MHC))之间的相互作用来引发Th1应答。在一个方面,表位和MHC受体的高亲合力结合刺激Th1应答。MHC受体是多种类型的MHC受体中的至少一种。在一些方面中,T细胞上的MHC受体在群中的个体之间变化。本发明组合物和方法中所用的表位和/或抗原可用于产生嵌合抗原受体(CAR)T细胞。工程改造的T细胞可表达抗体,例如单链可变片段(scFv),并可识别结直肠肿瘤细胞、非小细胞肺癌(NSCLC)细胞或卵巢癌细胞上本文所述的一个或多个表位。表达的抗体还可诱导肿瘤细胞的工程改造的免疫应答。有时,一个或多个表位选自CDC25B、COX2、EGFR、FASCIN1、IGF1R、PRL3、RCAS1或VCP。一个或多个表位可与SEQIDNO:1-45的至少8个连续氨基酸有至少90%、至少95%、或至少99%序列相同性。在一些情况中,工程改造的T细胞可表达抗体并可识别结直肠肿瘤细胞或NSCLC细胞上的选自CDC25B、COX2、EGFR、FASCIN1、IGF1R、PRL3、RCAS1或VCP的一个或多个表位。在其他情况中,工程改造的T细胞可表达抗体并可识别结直肠肿瘤细胞或NSCLC细胞上的与SEQIDNO:1-45的至少8个连续氨基酸有至少90%、至少95%、或至少99%序列相同性的一个或多个表位。本文所述组合物和方法中使用的表位和/或抗原可用作工程改造的T细胞受体(TCR)的合适靶标。在一些情况中,编码工程改造的T细胞受体的基因通过例如病毒递送方法引入T细胞并随后表达该工程改造的TCR。可识别本文所述的一个或多个表位的工程改造的TCR可用作基于工程改造的T细胞受体的治疗,包括自体和异体细胞治疗。如上所述,一个或多个表位选自CDC25B、COX2、EGFR、FASCIN1、IGF1R、PRL3、RCAS1或VCP。一个或多个表位可与SEQIDNO:1-45的至少8个连续氨基酸有至少90%、至少95%、或至少99%序列相同性。在一些情况中,工程改造的TCR可识别选自CDC25B、COX2、EGFR、FASCIN1、IGF1R、PRL3、RCAS1或VCP的一个或多个表位。在其他情况中,工程改造的TCR可识别与SEQIDNO:1-45的至少8个连续氨基酸有至少90%、至少95%、或至少99%序列相同性的一个或多个表位。在一些方面中,本文所述组合物包括除编码抗原表位的核酸之外的组分。在一些情况中,组合物包括至少一种佐剂。在一些情况中,组合物包括至少一种药物运载体。在一些情况中,组合物包括至少一种适于与药物组合物联用的惰性化学品。在一些情况中,组合物包括至少一种佐剂和至少一种药物运载体。在一些情况中,组合物包括至少一种佐剂和至少一种适用于药物组合物的惰性化学品。在一些情况中,组合物包括至少一种适于与药物组合物联用的惰性化学品和药物运载体。在一些情况中,组合物含有多种佐剂、多种药物运载体和多种适于与药物组合物联用的惰性化学品。在一些情况中,在组合物中使用一种佐剂。在其他情况中,在组合物中使用超过1种佐剂、超过2种佐剂、超过3种佐剂、超过4种佐剂、超过5种佐剂、超过6种佐剂、超过7种佐剂、超过8种佐剂、超过9种佐剂或超过10种佐剂。在一些情况中,在组合物中使用一种药物运载体。在其他情况中,在组合物中使用超过1种药物运载体、超过2种药物运载体、超过3种药物运载体、超过4种药物运载体、超过5种药物运载体、超过6种药物运载体、超过7种药物运载体、超过8种药物运载体、超过9种药物运载体或超过10种药物运载体。在一些情况中,在组合物中使用一种化学品。在其他情况中,在组合物中使用超过1种化学品、超过2种化学品、超过3种化学品、超过4种化学品、超过5种化学品、超过6种化学品、超过7种化学品、超过8种化学品、超过9种化学品或超过10种化学品。本文还公开将癌症疫苗(例如结直肠癌、非小细胞肺癌或卵巢癌疫苗)给予对象的方法。在一些情况中,该方法包括构建靶向这些抗原的基于质粒的疫苗并且确定给予疫苗是否是安全的、免疫原性的、并且有效预防结直肠癌、NSCLC或卵巢癌的发展。在一个方面中,组合物是基于多抗原Th1多表位质粒的疫苗。在一些情况中,该方法包括进行至少一次临床试验以确定患有结直肠癌、NSCLC或卵巢癌的对象中基于质粒的疫苗的安全性和免疫原性。在一个方面,抗原由结直肠CSC表达或与其相关,和/或将细胞从上皮细胞转变成间充质细胞(EMT)。在一些情况中,组合物的表位衍生自抗原,其中表位可引发对象中的Th1免疫应答。在一个方面,Th1免疫应答包括免疫细胞,通常为CD4+T细胞。在一些情况中,组合物是核酸(例如,基于质粒的疫苗),其包括编码超过一种抗原或抗原的超过一种(个)表位的核酸。在一些情况中,使用该方法来确定本文所述的组合物是否在多种生物体中预防癌症(例如结直肠癌、非小细胞肺癌或卵巢癌)发展,和在一个方面中,在使用遗传上相似的啮齿类(例如,小鼠),使用遗传上多样化的啮齿类(例如,小鼠)的癌症(例如,结直肠癌、非小细胞肺癌或卵巢癌)模型中,和在患有或未患有癌症(例如结直肠癌、非小细胞肺癌或卵巢癌)的对象中预防癌症(例如结直肠癌、非小细胞肺癌或卵巢癌)发展。抗原鉴定本文所述的组合物和方法包括鉴定和工程改造药物组合物(例如,疫苗)中的癌抗原(例如结直肠癌、非小细胞肺癌或卵巢癌抗原)。虽然本领域普通技术人员已知的任何技术都可用于鉴定由患有结直肠癌的对象表达的抗原,在一个方面中,使用本文所述的方法来鉴定合适抗原。在一些情况中,该方法包括筛选来自对象的血清。在一些情况中,筛选是抗体筛选。在一个方面,筛选的抗体是IgG抗体。在其他情况中,血清来自患有癌症(例如结直肠癌、NSCLC或卵巢癌)的对象。在其他情况中,血清来自未患有癌症的对象。在一些方面中,癌抗原(例如结直肠癌、非小细胞肺癌或卵巢癌抗原)是蛋白质的部分、肽的部分或聚氨基酸的部分。在一些情况中,该部分是蛋白质的百分比、肽的百分比或多氨基酸的百分比。在一些情况中,百分比小于蛋白质、肽或多氨基酸的1%、5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%或100%。在一些情况中,该部分位于蛋白质、肽或多氨基酸的C端处。在其他情况中,该部分位于蛋白质、肽或多氨基酸的C端附近。在一些方面中,C端附近的部分在总蛋白质、肽或多氨基酸长度上距离中点1%、5%、10%、15%、20%、25%、30%、35%、40%、45%、50%内。在一些情况中,该部分位于蛋白质、肽或多氨基酸的N端处。在其他情况中,该部分位于蛋白质、肽或多氨基酸的N端附近。在一些方面中,N端附近的部分在总蛋白质、肽或多氨基酸长度上距离中点1%、5%、10%、15%、20%、25%、30%、35%、40%、45%、50%内。在一些情况中,该部分位于蛋白质、肽或多氨基酸的中间附近。在其他情况中,该部分位于蛋白质、肽或多氨基酸的中间附近。在一些方面中,中间附近的部分在总蛋白质、肽或多氨基酸长度上距离末端1%、5%、10%、15%、20%、25%、30%、35%、40%、45%、50%内。在一些方面中,鉴定并筛选至少一种抗原作为本文所述的组合物(例如,疫苗)中的抗原的适用性。在一些情况中,鉴定并筛选一种抗原。在其他情况中,鉴定并筛选超过1种抗原、鉴定并筛选超过2种抗原、鉴定并筛选超过3种抗原、鉴定并筛选超过4种抗原、鉴定并筛选超过5种抗原、鉴定并筛选超过6种抗原、鉴定并筛选超过7种抗原、鉴定并筛选超过8种抗原、鉴定并筛选超过9种抗原、鉴定并筛选超过10种抗原、鉴定并筛选超过11种抗原、鉴定并筛选超过12种抗原、鉴定并筛选超过13种抗原、鉴定并筛选超过14种抗原、鉴定并筛选超过15种抗原、鉴定并筛选超过20种抗原、鉴定并筛选超过25种抗原、鉴定并筛选超过30种抗原、鉴定并筛选超过35种抗原、鉴定并筛选超过40种抗原、鉴定并筛选超过45种抗原、并且鉴定并筛选超过50种抗原的疫苗适用性。在一些方面中,使用本领域普通技术人员已知的筛选技术,筛选疫苗适用性的抗原衍生自在来自患有结直肠癌、NSCLC或卵巢癌的对象的血清中检测到针对其的免疫应答的任意蛋白质。在一些情况中,筛选是抗体筛选。虽然蛋白质是来自患有结直肠癌、NSCLC或卵巢癌的对象的血清中检测到的任意蛋白质,在一个方面中,抗原所衍生的蛋白质被分类为干细胞蛋白质和/或EMT蛋白质。在一个方面,干细胞/EMT蛋白质包括CDC25B、COX2、EGFR、FASCIN1、IGF1R、PRL3、RCAS1和VCP。在一些方面中,抗原在结直肠癌、NSCLC或卵巢癌对象中和没有结直肠癌、NSCLC或卵巢癌的对象中均具有免疫原性。抗原表位作图本文提供的组合物和方法包括对抗原内至少一种(个)表位进行作图,使得表位在给予对象时产生Th1免疫应答。在一些情况中,作为癌症疫苗(例如结直肠癌、非小细胞肺癌或卵巢癌疫苗)给予表位。虽然本领域普通技术人员已知的任意技术可用于鉴定引发由对象产生的Th1免疫应答的表位,仍然优选使用本文所述的方法。在一些情况中,表位是抗原的部分(例如,上述鉴定的)。在一个方面,表位是抗原性蛋白质的肽和/或抗原性蛋白质的部分。在一些情况中,表位是衍生自癌抗原(例如结直肠癌、非小细胞肺癌或卵巢癌抗原)的人白细胞抗原(HLA)I类表位。在一个方面,HLAI类表位包括结合至HLA-A、-B、和–C分子的表位。在一些情况中,表位是衍生自用于癌症疫苗(例如结直肠癌、非小细胞肺癌或卵巢癌疫苗)开发的癌抗原的II类表位。在一个方面,HLAII类表位包括结合至HLA-DP、-DM、-DOA、-DOB、-DQ和–DR分子的表位。在一些情况中,除了本文所述的方法以外,使用以下步骤来对表位作图,(1)通过至少一种HLA等位基因(例如,HLA-DR,即通用表位)确定表位是否结合MHC(例如,以高亲和性),(2)确定表位是否刺激IFN-g和/或IL-10分泌(例如,来自抗原特异性T-细胞),和(3)确定T-细胞是否可识别经抗原呈递细胞(APC)处理的肽(例如,表位),即是天然表位。在一些情况中,使用T细胞系。在一个方面,T细胞系是表位衍生的T-细胞系。在一些情况中,表位衍生自蛋白质(例如,重组蛋白质)。在其他情况中,蛋白质是天然蛋白质。在一些情况中,蛋白质经内源性加工。在其他情况中,蛋白质经外源性加工。在一些情况中,蛋白质经自体APC的内源性加工。在其他情况中,蛋白质经自体APC的外源性加工。在一些情况中,肽是从抗原作图的表位,并且使用本文所述的方法鉴定用于选择肽表位。在一些情况中,表位衍生自直接在基于肽的疫苗中使用的人蛋白质。在其他情况中,表位衍生自人蛋白质并且编码核酸序列整合到设计成在给药后诱导对象中表位表达的核酸构建体中。在一个方面,核酸构建体允许针对自蛋白质的特定组的待产生、扩增、减弱、抑制或消除的至少一种(个)表位的免疫应答。在一些情况中,肽或核酸构建体优化成基于蛋白质或质粒的免疫来诱导、扩增或产生Th1免疫应答。在一些情况中,表位是延伸的Th1表位。在其他情况中,肽或核酸构建体优化成基于蛋白质或质粒的免疫以在有此需要的对象(例如,人或动物)中抑制、减弱或消除致病性应答。在一些情况中,肽位于蛋白质、肽或多氨基酸的部分内,使得蛋白质、肽或多氨基酸刺激IFN-g分泌。在一些情况中,肽位于蛋白质、肽或多氨基酸的部分内,使得蛋白质、肽或多氨基酸刺激IL-10分泌。在一些情况中,肽刺激IFN-g分泌并刺激IL-10分泌。在一些情况中,调节包含肽的氨基酸,使得实现肽对IFN-g分泌的所需效果和/或肽对IL-10分泌的所需效果。在一些方面,调节同时刺激IFN-g和IL-10分泌的肽,使得肽的长度被缩短以消除刺激IL-10分泌的氨基酸,使得肽仅刺激IFN-g分泌。在一些情况中,在延伸的表位疫苗的疫苗组合物中包括鉴定的表位。在一些情况中,延伸的表位是40-80聚体肽。在一个方面,核酸序列或肽序列并列用于构建延伸的表位序列。在一些方面,在母蛋白质内选择的肽的并置(例如,互相10个氨基酸内)允许构建串联延伸的表位,其含有耐受性和/或抑制性表位。在一个方面,串联延伸的表位含有短的间插的<10个氨基酸的序列。在一些方面中,单独的这些肽和/或延伸的表位中的任意(体现为肽本身,或相应核酸构建体)或任意组合优化到基于蛋白质或质粒的免疫中,其将在有此需要的对象(动物或人)中特异性诱导、放大或产生保护性免疫应答,或者,将抑制、减弱或消除致病性应答。在一些情况中,表位是一定长度的氨基酸。在一些情况中,表位少于5个氨基酸、少于10个氨基酸、少于15个氨基酸、少于20个氨基酸、少于25个氨基酸、少于30个氨基酸、少于35个氨基酸、少于40个氨基酸、少于45个氨基酸、少于50个氨基酸、少于55个氨基酸、少于60个氨基酸、少于70个氨基酸、少于75个氨基酸、少于80个氨基酸、少于85个氨基酸、少于90个氨基酸、少于95个氨基酸、少于100个氨基酸、少于110个氨基酸、少于120个氨基酸、少于130个氨基酸、少于140个氨基酸、少于150个氨基酸、少于160个氨基酸、少于170个氨基酸、少于180个氨基酸、少于190个氨基酸、少于200个氨基酸、少于210个氨基酸、少于220个氨基酸、少于230个氨基酸、少于240个氨基酸、少于250个氨基酸、少于260个氨基酸、少于270个氨基酸、少于280个氨基酸、少于290个氨基酸、少于300个氨基酸、少于350个氨基酸、少于400个氨基酸、少于450个氨基酸或少于500个氨基酸。本文所述的组合物可包括,包含以下的组合物:包含第一核苷酸序列的第一质粒,所述第一核苷酸序列编码由与结直肠癌、NSCLC或卵巢癌相关的细胞表达的第一抗原的第一表位;和第二核苷酸序列,所述第二核苷酸序列编码由与结直肠癌、NSCLC或卵巢癌相关的细胞表达的第二抗原的第二表位,其中所述第一核苷酸序列和所述第二核苷酸序列位于一个或多个质粒中。在一些情况中,组合物包括编码来自以下蛋白质的表位的核酸:CDC25B、COX2、EGFR、FASCIN1、IGF1R、PRL3、RCAS1和VCP。在一些情况中,组合物包括包含以下的组合物:包含第一核苷酸序列的第一质粒,所述第一核苷酸序列编码第一抗原的第一表位,所述第一表位是选自CDC25B、COX2、EGFR、FASCIN1、IGF1R、PRL3、RCAS1和VCP的肽的部分,其中所述第一核苷酸序列位于质粒中。在其他情况中,组合物还可包括含以下的组合物:含第一核苷酸序列的第一质粒,所述第一核苷酸序列编码第一抗原的第一表位;和第二核苷酸序列,所述第二核苷酸序列编码第二抗原的第二表位,其中所述第一和第二表位独立选自CDC25B、COX2、EGFR、FASCIN1、IGF1R、PRL3、RCAS1和VCP,其中所述第一核苷酸序列和第二核苷酸序列位于一个或多个质粒中。在一些情况中,组合物包括编码来自以下蛋白质的表位的核酸:CDC25B、COX2、EGFR、FASCIN1、IGF1R、PRL3、RCAS1和VCP。在一些情况中,组合物包括编码肽CDC25B的表位的核酸序列,其选自:编码氨基酸序列的核苷酸序列,该氨基酸序列与氨基酸序列QAIQAASRIIRNEQFAIRRFQ(SEQIDNO:1)有至少90%序列相同性;和编码氨基酸序列的核苷酸序列,该氨基酸序列与氨基酸序列VDGKHQDLKYISPETMVALLTGK(SEQIDNO:2)有至少90%序列相同性。在一些情况中,组合物包括编码肽COX2的表位的核酸序列,其选自:编码氨基酸序列的核苷酸序列,该氨基酸序列与氨基酸序列FKGFWNVVNNIPFLRN(SEQIDNO:3)有至少90%序列相同性;编码氨基酸序列的核苷酸序列,该氨基酸序列与氨基酸序列GLVPGLMMYATIWLREH(SEQIDNO:4)有至少90%序列相同性;编码氨基酸序列的核苷酸序列,该氨基酸序列与氨基酸序列GEVGFQIINTASIQSLIC(SEQIDNO:5)有至少90%序列相同性;编码氨基酸序列的核苷酸序列,该氨基酸序列与氨基酸序列NAIMSYVLTSRSHLID(SEQIDNO:6)有至少90%序列相同性;编码氨基酸序列的核苷酸序列,该氨基酸序列与氨基酸序列HIYGETLARQRKLRLFKD(SEQIDNO:7)有至少90%序列相同性;编码氨基酸序列的核苷酸序列,该氨基酸序列与氨基酸序列LFQTSRLILIGETIKIVI(SEQIDNO:8)有至少90%序列相同性;编码氨基酸序列的核苷酸序列,该氨基酸序列与氨基酸序列QFQYQNRIAAEFNTLY(SEQIDNO:9)有至少90%序列相同性;和编码氨基酸序列的核苷酸序列,该氨基酸序列与氨基酸序列QQFIYNNSILLEHGITQFV(SEQIDNO:10)有至少90%序列相同性。在一些情况中,组合物包括编码肽EGFR的表位的核酸序列,其选自下组:编码氨基酸序列的核苷酸序列,该氨基酸序列与氨基酸序列SCVRACGADSYEMEEDGVRK(SEQIDNO:11)有至少90%序列相同性;编码氨基酸序列的核苷酸序列,该氨基酸序列与氨基酸序列NNTLVWKYADAGHVCHL(SEQIDNO:12)有至少90%序列相同性;和编码氨基酸序列的核苷酸序列,该氨基酸序列与氨基酸序列VWSYGVTVWELMTFGSKPY(SEQIDNO:13)有至少90%序列相同性。在一些情况中,组合物包括编码肽FASCIN1的表位的核酸序列,其选自:编码氨基酸序列的核苷酸序列,该氨基酸序列与氨基酸序列IAMHPQVNIYSVTRKRYAH(SEQIDNO:14)有至少90%序列相同性;编码氨基酸序列的核苷酸序列,该氨基酸序列与氨基酸序列TADHRFLRHDGRLVARPEPA(SEQIDNO:15)有至少90%序列相同性;编码氨基酸序列的核苷酸序列,该氨基酸序列与氨基酸序列NKYLTAEAFGFKVNASASSL(SEQIDNO:16)有至少90%序列相同性;编码氨基酸序列的核苷酸序列,该氨基酸序列与氨基酸序列ELFLMKLINRPIIVFRGEHGFIGCR(SEQIDNO:17)有至少90%序列相同性;编码氨基酸序列的核苷酸序列,该氨基酸序列与氨基酸序列VQIQFGLINCGNKYLT(SEQIDNO:18)有至少90%序列相同性;编码氨基酸序列的核苷酸序列,该氨基酸序列与氨基酸序列AVCLRSHLGRYLAADKD(SEQIDNO:19)有至少90%序列相同性;编码氨基酸序列的核苷酸序列,该氨基酸序列与氨基酸序列TGKYWTLTATGGVQST(SEQIDNO:20)有至少90%序列相同性;编码氨基酸序列的核苷酸序列,该氨基酸序列与氨基酸序列LFALEQSCAQVVLQAANERN(SEQIDNO:21)有至少90%序列相同性;和编码氨基酸序列的核苷酸序列,该氨基酸序列与氨基酸序列KDSTGKYWTVGSDSAVTS(SEQIDNO:22)有至少90%序列相同性。在一些情况中,组合物包括编码肽IGF1R的表位的核酸序列,其选自下组:编码氨基酸序列的核苷酸序列,该氨基酸序列与氨基酸序列VVTGYVKIRHSHALV(SEQIDNO:23)有至少90%序列相同性;编码氨基酸序列的核苷酸序列,该氨基酸序列与氨基酸序列TQYAVYVKAVTLTMV(SEQIDNO:24)有至少90%序列相同性;编码氨基酸序列的核苷酸序列,该氨基酸序列与氨基酸序列LVIMLYVFHRKRNNS(SEQIDNO:25)有至少90%序列相同性;和编码氨基酸序列的核苷酸序列,该氨基酸序列与氨基酸序列GMAYLNANKFVHRDL(SEQIDNO:26)有至少90%序列相同性。在一些情况中,组合物包括编码肽PRL3的表位的核酸序列,其选自下组:编码氨基酸序列的核苷酸序列,该氨基酸序列与氨基酸序列VSYKHMRFLITHNPTNATL(SEQIDNO:27)有至少90%序列相同性;编码氨基酸序列的核苷酸序列,该氨基酸序列与氨基酸序列FIEDLKKYGATTVVRVCEVTY(SEQIDNO:28)有至少90%序列相同性;编码氨基酸序列的核苷酸序列,该氨基酸序列与氨基酸序列PCVAGLGRAPVLVALALIES(SEQIDNO:29)有至少90%序列相同性;编码氨基酸序列的核苷酸序列,该氨基酸序列与氨基酸序列MKYEDAIQFIRQKRRGAIN(SEQIDNO:30)有至少90%序列相同性;和编码氨基酸序列的核苷酸序列,该氨基酸序列与氨基酸序列VEDWLSLVKAKFCEA(SEQIDNO:31)有至少90%序列相同性。在一些情况中,组合物包括编码肽RCAS1的表位的核酸序列,其选自下组:编码氨基酸序列的核苷酸序列,该氨基酸序列与氨基酸序列EPDYFKDMTPTIRKTQKIVI(SEQIDNO:32)有至少90%序列相同性;编码氨基酸序列的核苷酸序列,该氨基酸序列与氨基酸序列DYFKDMTPTIRKTQKIVIKKR(SEQIDNO:33)有至少90%序列相同性;编码氨基酸序列的核苷酸序列,该氨基酸序列与氨基酸序列LFKFCTCLATVFSFLKRLIC(SEQIDNO:34)有至少90%序列相同性;编码氨基酸序列的核苷酸序列,该氨基酸序列与氨基酸序列GFSSRLAATQDLPFIHQSSELGD(SEQIDNO:35)有至少90%序列相同性;和编码氨基酸序列的核苷酸序列,该氨基酸序列与氨基酸序列EEEDAAWQAEEVLRQQKLADR(SEQIDNO:36)有至少90%序列相同性。在一些情况中,组合物包括编码肽VCP的表位的核酸序列,其选自:编码氨基酸序列的核苷酸序列,该氨基酸序列与氨基酸序列IRMNRVVRNNLRVRLGDVISI(SEQIDNO:37)有至少90%序列相同性;编码氨基酸序列的核苷酸序列,该氨基酸序列与氨基酸序列LQLFRGDTVLLKGKKRR(SEQIDNO:38)有至少90%序列相同性;编码氨基酸序列的核苷酸序列,该氨基酸序列与氨基酸序列YFLEAYRPIRKGDIFLVRG(SEQIDNO:39)有至少90%序列相同性;编码氨基酸序列的核苷酸序列,该氨基酸序列与氨基酸序列VEFKVVETDPSPYCIVAPDT(SEQIDNO:40)有至少90%序列相同性;编码氨基酸序列的核苷酸序列,该氨基酸序列与氨基酸序列LRHPALFKAIGVKPPRGIL(SEQIDNO:41)有至少90%序列相同性;编码氨基酸序列的核苷酸序列,该氨基酸序列与氨基酸序列ETGAFFFLINGPEIMSK(SEQIDNO:42)有至少90%序列相同性;编码氨基酸序列的核苷酸序列,该氨基酸序列与氨基酸序列AVTMDDFRWALSQSNPS(SEQIDNO:43)有至少90%序列相同性;编码氨基酸序列的核苷酸序列,该氨基酸序列与氨基酸序列QRAHVIVMAATNRPNS(SEQIDNO:44)有至少90%序列相同性;和编码氨基酸序列的核苷酸序列,该氨基酸序列与氨基酸序列KNVFIIGATNRPDII(SEQIDNO:45)有至少90%序列相同性。在一些情况中,组合物包含独立选自CDC25B、COX2、EGFR、FASCIN1、IGF1R、PRL3、RCAS1和VCP的第一和第二表位。在一些情况中,组合物包含独立选自CDC25B、COX2、EGFR、FASCIN1、IGF1R、PRL3、RCAS1和VCP的第一、第二和第三表位。在一些情况中,组合物包含独立选自CDC25B、COX2、EGFR、FASCIN1、IGF1R、PRL3、RCAS1和VCP的第一、第二、第三和第四表位。在一些情况中,组合物包含独立选自CDC25B、COX2、EGFR、FASCIN1、IGF1R、PRL3、RCAS1和VCP的第一、第二、第三、第四和第五表位。在一些情况中,组合物包含独立选自CDC25B、COX2、EGFR、FASCIN1、IGF1R、PRL3、RCAS1和VCP的第一、第二、第三、第四、第五和第六表位。在一些情况中,组合物包含独立选自CDC25B、COX2、EGFR、FASCIN1、IGF1R、PRL3、RCAS1和VCP的第一、第二、第三、第四、第五、第六和第七表位。在一些情况中,组合物包含独立选自CDC25B、COX2、EGFR、FASCIN1、IGF1R、PRL3、RCAS1和VCP的第一、第二、第三、第四、第五、第六、第七和第八表位。本文所述的组合物可包括,包含以下的组合物:包含第一核苷酸序列的第一质粒,所述第一核苷酸序列编码由与癌症(例如结直肠癌、NSCLC或卵巢癌)相关的细胞表达的第一抗原的第一表位;和第二核苷酸序列,所述第二核苷酸序列编码由与癌症(例如结直肠癌、NSCLC或卵巢癌)相关的细胞表达的第二抗原的第二表位,其中所述第一核苷酸序列和所述第二核苷酸序列位于一个或多个质粒中。在一些情况中,组合物包括编码来自下述蛋白质的表位的核酸:CDC25B、COX2和PRL3。在一些情况中,组合物包括包含以下的组合物:包含第一核苷酸序列的第一质粒,所述第一核苷酸序列编码第一抗原的第一表位,所述第一表位是选自CDC25B、COX2和PRL3的肽的部分,其中所述第一核苷酸序列位于质粒中。在其他情况中,组合物包括含以下的组合物:含第一核苷酸序列的第一质粒,所述第一核苷酸序列编码第一抗原的第一表位;和第二核苷酸序列,所述第二核苷酸序列编码第二抗原的第二表位,其中所述第一和第二表位独立选自CDC25B、COX2和PRL3,其中所述第一核苷酸序列和第二核苷酸序列位于一个或多个质粒中。在一些情况中,组合物包括编码来自下述蛋白质的表位的核酸:CDC25B、COX2和PRL3。在一些情况中,组合物包括编码肽CDC25B的表位的核酸序列,其选自:编码氨基酸序列的核苷酸序列,该氨基酸序列与氨基酸序列QAIQAASRIIRNEQFAIRRFQ(SEQIDNO:1)有至少90%序列相同性;和编码氨基酸序列的核苷酸序列,该氨基酸序列与氨基酸序列VDGKHQDLKYISPETMVALLTGK(SEQIDNO:2)有至少90%序列相同性。在一些情况中,组合物包括编码肽COX2的表位的核酸序列,其选自:编码氨基酸序列的核苷酸序列,该氨基酸序列与氨基酸序列FKGFWNVVNNIPFLRN(SEQIDNO:3)有至少90%序列相同性;编码氨基酸序列的核苷酸序列,该氨基酸序列与氨基酸序列GLVPGLMMYATIWLREH(SEQIDNO:4)有至少90%序列相同性;编码氨基酸序列的核苷酸序列,该氨基酸序列与氨基酸序列GEVGFQIINTASIQSLIC(SEQIDNO:5)有至少90%序列相同性;编码氨基酸序列的核苷酸序列,该氨基酸序列与氨基酸序列NAIMSYVLTSRSHLID(SEQIDNO:6)有至少90%序列相同性;编码氨基酸序列的核苷酸序列,该氨基酸序列与氨基酸序列HIYGETLARQRKLRLFKD(SEQIDNO:7)有至少90%序列相同性;编码氨基酸序列的核苷酸序列,该氨基酸序列与氨基酸序列LFQTSRLILIGETIKIVI(SEQIDNO:8)有至少90%序列相同性;编码氨基酸序列的核苷酸序列,该氨基酸序列与氨基酸序列QFQYQNRIAAEFNTLY(SEQIDNO:9)有至少90%序列相同性;和编码氨基酸序列的核苷酸序列,该氨基酸序列与氨基酸序列QQFIYNNSILLEHGITQFV(SEQIDNO:10)有至少90%序列相同性。在一些情况中,组合物包括编码肽PRL3的表位的核酸序列,其选自下组:编码氨基酸序列的核苷酸序列,该氨基酸序列与氨基酸序列VSYKHMRFLITHNPTNATL(SEQIDNO:27)有至少90%序列相同性;编码氨基酸序列的核苷酸序列,该氨基酸序列与氨基酸序列FIEDLKKYGATTVVRVCEVTY(SEQIDNO:28)有至少90%序列相同性;编码氨基酸序列的核苷酸序列,该氨基酸序列与氨基酸序列PCVAGLGRAPVLVALALIES(SEQIDNO:29)有至少90%序列相同性;编码氨基酸序列的核苷酸序列,该氨基酸序列与氨基酸序列MKYEDAIQFIRQKRRGAIN(SEQIDNO:30)有至少90%序列相同性;和编码氨基酸序列的核苷酸序列,该氨基酸序列与氨基酸序列VEDWLSLVKAKFCEA(SEQIDNO:31)有至少90%序列相同性。在一些情况中,组合物包含独立选自CDC25B、COX2和PRL3的第一和第二表位。在一些情况中,组合物包含独立选自CDC25B、COX2和PRL3的第一、第二和第三表位。在一些情况中,组合物能够给予对象。在一些情况中,对象需要给予组合物。在一些情况中,组合物在对象中有效引发免疫应答。在一些情况中,组合物在对象中有效消除与结直肠癌、NSCLC或卵巢癌相关的多种细胞。在一些情况中,组合物用于阻止对象中与结直肠癌、NSCLC或卵巢癌相关的细胞的生长。在一些情况中,第一和第二核酸序列位于第一质粒上。在一些情况中,第二核酸序列位于第二质粒上。结直肠癌描述包含结肠癌和直肠癌的癌症。在一些情况中,与结直肠癌关联的细胞选自:表达非典型特征的结肠细胞,表达非典型特征的直肠细胞,前肿瘤性结肠细胞,前肿瘤性直肠细胞,结肠癌细胞,直肠癌细胞,前侵袭性结肠癌细胞,前侵袭性直肠癌细胞,结肠癌干细胞,直肠癌干细胞,上皮细胞,间充质细胞,基质细胞,或其组合。本文所述非小细胞肺癌包括选自下组的细胞:表达非典型特征的肺细胞,前肿瘤性肺细胞,肺癌细胞,前侵袭性肺癌细胞,肺癌干细胞,上皮细胞,间充质细胞,基质细胞,及其组合。在一些情况中,第一和第二核酸序列纯化至至少70%纯。第一和第二核酸序列可纯化至至少80%、90%、95%、99%、99.5%纯或更纯。在一些情况中,第一和第二核酸序列位于第一质粒上并且被接头核酸序列分开。在一些情况中,在第一质粒上,第一核酸序列与第二核酸序列毗邻。在一些情况中,在药物组合物中含有至少第一质粒。在一些情况中,在另外包含药物运载体的药物组合物中含有至少第一质粒。在一些情况中,在另外包含药物运载体和佐剂的药物组合物中含有至少第一质粒。在一些情况中,在另外包含佐剂的药物组合物中含有至少第一质粒。在一些情况中,组合物还包含佐剂和药学上可接受的运载体。在一些情况中,佐剂是GM-CSF。在一些情况中,对象选自:患有结直肠癌、NSCLC或卵巢癌的人;患有结直肠癌、NSCLC或卵巢癌的小鼠;或患有结直肠癌、NSCLC或卵巢癌的大鼠。在一些情况中,对象选自:没有结直肠癌、NSCLC或卵巢癌的人;没有结直肠癌、NSCLC或卵巢癌的小鼠;或没有结直肠癌、NSCLC或卵巢癌的大鼠。在一些情况中,免疫应答是1型免疫应答。在一些情况中,第一核酸序列是选自人、小鼠或大鼠的物种。在一些情况中,第二核酸序列是选自人、小鼠或大鼠的物种。在一些情况中,免疫应答表征为大于1的I型细胞因子产生与II型细胞因子产生之比。在一些情况中,免疫应答表征为小于1的I型细胞因子产生与II型细胞因子产生之比。在一些情况中,免疫应答表征为大于1的IFNγ产生与IL-10产生之比。在一些情况中,免疫应答表征为小于1的IFNγ产生与IL-10产生之比。在一些方面中,编码选自以下蛋白质的表位的核酸序列与本文所列的那些不同:CD105、HIF-1a、MDM2、Yb1、SOX-2、HER-2、IGFBP2、IGF-R1和CDH3。在一些情况中,与本文所述的那些有超过95%、90%、85%、80%、75%、70%、65%、60%、55%或超过50%同源的核酸序列用于本文所述的组合物中。在一些情况中,本文所述的组合物包含,包含以下的组合物:由与结直肠癌、NSCLC或卵巢癌相关的细胞表达的第一抗原的第一表位;和由与结直肠癌、NSCLC或卵巢癌相关的细胞表达的第二抗原的第二表位。在一些情况中,组合物包含:至少第一抗原的第一表位,所述第一表位是选自CDC25B、COX2、EGFR、FASCIN1、IGF1R、PRL3、RCAS1和VCP的肽的部分。在一些情况中,组合物包含:至少第一抗原的第一表位,至少第二抗原的第二表位,所述第一和第二表位独立选自CDC25B、COX2、EGFR、FASCIN1、IGF1R、PRL3、RCAS1和VCP。在一些情况中,肽CDC25B的表位选自:氨基酸序列,该氨基酸序列与氨基酸序列QAIQAASRIIRNEQFAIRRFQ(SEQIDNO:1)有至少90%序列相同性;和氨基酸序列,该氨基酸序列与氨基酸序列VDGKHQDLKYISPETMVALLTGK(SEQIDNO:2)有至少90%序列相同性。在一些情况中,肽COX2的表位选自:氨基酸序列,该氨基酸序列与氨基酸序列FKGFWNVVNNIPFLRN(SEQIDNO:3)有至少90%序列相同性;氨基酸序列,该氨基酸序列与氨基酸序列GLVPGLMMYATIWLREH(SEQIDNO:4)有至少90%序列相同性;氨基酸序列,该氨基酸序列与氨基酸序列GEVGFQIINTASIQSLIC(SEQIDNO:5)有至少90%序列相同性;氨基酸序列,该氨基酸序列与氨基酸序列NAIMSYVLTSRSHLID(SEQIDNO:6)有至少90%序列相同性;氨基酸序列,该氨基酸序列与氨基酸序列HIYGETLARQRKLRLFKD(SEQIDNO:7)有至少90%序列相同性;氨基酸序列,该氨基酸序列与氨基酸序列LFQTSRLILIGETIKIVI(SEQIDNO:8)有至少90%序列相同性;氨基酸序列,该氨基酸序列与氨基酸序列QFQYQNRIAAEFNTLY(SEQIDNO:9)有至少90%序列相同性;或氨基酸序列,该氨基酸序列与氨基酸序列QQFIYNNSILLEHGITQFV(SEQIDNO:10)有至少90%序列相同性。在一些情况中,肽EGFR的表位选自:氨基酸序列,该氨基酸序列与氨基酸序列SCVRACGADSYEMEEDGVRK(SEQIDNO:11)有至少90%序列相同性;氨基酸序列,该氨基酸序列与氨基酸序列NNTLVWKYADAGHVCHL(SEQIDNO:12)有至少90%序列相同性;和氨基酸序列,该氨基酸序列与氨基酸序列VWSYGVTVWELMTFGSKPY(SEQIDNO:13)有至少90%序列相同性。在一些情况中,肽FASCIN1的表位选自:氨基酸序列,该氨基酸序列与氨基酸序列IAMHPQVNIYSVTRKRYAH(SEQIDNO:14)有至少90%序列相同性;氨基酸序列,该氨基酸序列与氨基酸序列TADHRFLRHDGRLVARPEPA(SEQIDNO:15)有至少90%序列相同性;氨基酸序列,该氨基酸序列与氨基酸序列NKYLTAEAFGFKVNASASSL(SEQIDNO:16)有至少90%序列相同性;氨基酸序列,该氨基酸序列与氨基酸序列ELFLMKLINRPIIVFRGEHGFIGCR(SEQIDNO:17)有至少90%序列相同性;氨基酸序列,该氨基酸序列与氨基酸序列VQIQFGLINCGNKYLT(SEQIDNO:18)有至少90%序列相同性;氨基酸序列,该氨基酸序列与氨基酸序列AVCLRSHLGRYLAADKD(SEQIDNO:19)有至少90%序列相同性;氨基酸序列,该氨基酸序列与氨基酸序列TGKYWTLTATGGVQST(SEQIDNO:20)有至少90%序列相同性;氨基酸序列,该氨基酸序列与氨基酸序列LFALEQSCAQVVLQAANERN(SEQIDNO:21)有至少90%序列相同性;或氨基酸序列,该氨基酸序列与氨基酸序列KDSTGKYWTVGSDSAVTS(SEQIDNO:22)有至少90%序列相同性。在一些情况中,肽IGF1R的表位选自:氨基酸序列,该氨基酸序列与氨基酸序列VVTGYVKIRHSHALV(SEQIDNO:23)有至少90%序列相同性;氨基酸序列,该氨基酸序列与氨基酸序列TQYAVYVKAVTLTMV(SEQIDNO:24)有至少90%序列相同性;氨基酸序列,该氨基酸序列与氨基酸序列LVIMLYVFHRKRNNS(SEQIDNO:25)有至少90%序列相同性;和氨基酸序列,该氨基酸序列与氨基酸序列GMAYLNANKFVHRDL(SEQIDNO:26)有至少90%序列相同性。在一些情况中,肽PRL3的表位选自:氨基酸序列,该氨基酸序列与氨基酸序列VSYKHMRFLITHNPTNATL(SEQIDNO:27)有至少90%序列相同性;氨基酸序列,该氨基酸序列与氨基酸序列FIEDLKKYGATTVVRVCEVTY(SEQIDNO:28)有至少90%序列相同性;氨基酸序列,该氨基酸序列与氨基酸序列PCVAGLGRAPVLVALALIES(SEQIDNO:29)有至少90%序列相同性;氨基酸序列,该氨基酸序列与氨基酸序列MKYEDAIQFIRQKRRGAIN(SEQIDNO:30)有至少90%序列相同性;和氨基酸序列,该氨基酸序列与氨基酸序列VEDWLSLVKAKFCEA(SEQIDNO:31)有至少90%序列相同性。在一些情况中,肽RCAS1的表位选自:氨基酸序列,该氨基酸序列与氨基酸序列EPDYFKDMTPTIRKTQKIVI(SEQIDNO:32)有至少90%序列相同性;氨基酸序列,该氨基酸序列与氨基酸序列DYFKDMTPTIRKTQKIVIKKR(SEQIDNO:33)有至少90%序列相同性;氨基酸序列,该氨基酸序列与氨基酸序列LFKFCTCLATVFSFLKRLIC(SEQIDNO:34)有至少90%序列相同性;氨基酸序列,该氨基酸序列与氨基酸序列GFSSRLAATQDLPFIHQSSELGD(SEQIDNO:35)有至少90%序列相同性;和氨基酸序列,该氨基酸序列与氨基酸序列EEEDAAWQAEEVLRQQKLADR(SEQIDNO:36)有至少90%序列相同性。在一些情况中,肽VCP的表位选自:氨基酸序列,该氨基酸序列与氨基酸序列EIRMNRVVRNNLRVRLGDVISI(SEQIDNO:37)有至少90%序列相同性;氨基酸序列,该氨基酸序列与氨基酸序列LQLFRGDTVLLKGKKRR(SEQIDNO:38)有至少90%序列相同性;氨基酸序列,该氨基酸序列与氨基酸序列YFLEAYRPIRKGDIFLVRG(SEQIDNO:39)有至少90%序列相同性;氨基酸序列,该氨基酸序列与氨基酸序列VEFKVVETDPSPYCIVAPDT(SEQIDNO:40)有至少90%序列相同性;氨基酸序列,该氨基酸序列与氨基酸序列LRHPALFKAIGVKPPRGIL(SEQIDNO:41)有至少90%序列相同性;氨基酸序列,该氨基酸序列与氨基酸序列ETGAFFFLINGPEIMSK(SEQIDNO:42)有至少90%序列相同性;氨基酸序列,该氨基酸序列与氨基酸序列AVTMDDFRWALSQSNPS(SEQIDNO:43)有至少90%序列相同性;氨基酸序列,该氨基酸序列与氨基酸序列QRAHVIVMAATNRPNS(SEQIDNO:44)有至少90%序列相同性;或氨基酸序列,该氨基酸序列与氨基酸序列KNVFIIGATNRPDII(SEQIDNO:45)有至少90%序列相同性。在一些情况中,组合物包含独立选自CDC25B、COX2、EGFR、FASCIN1、IGF1R、PRL3、RCAS1和VCP的第一和第二表位。在一些情况中,组合物包含独立选自CDC25B、COX2、EGFR、FASCIN1、IGF1R、PRL3、RCAS1和VCP的第一、第二和第三表位。在一些情况中,组合物包含独立选自CDC25B、COX2、EGFR、FASCIN1、IGF1R、PRL3、RCAS1和VCP的第一、第二、第三和第四表位。在一些情况中,组合物包含独立选自CDC25B、COX2、EGFR、FASCIN1、IGF1R、PRL3、RCAS1和VCP的第一、第二、第三、第四和第五表位。在一些情况中,组合物包含独立选自CDC25B、COX2、EGFR、FASCIN1、IGF1R、PRL3、RCAS1和VCP的第一、第二、第三、第四、第五和第六表位。在一些情况中,组合物包含独立选自CDC25B、COX2、EGFR、FASCIN1、IGF1R、PRL3、RCAS1和VCP的第一、第二、第三、第四、第五、第六和第七表位。在一些情况中,组合物包含独立选自CDC25B、COX2、EGFR、FASCIN1、IGF1R、PRL3、RCAS1和VCP的第一、第二、第三、第四、第五、第六、第七和第八表位。在一些情况中,组合物包含:至少第一抗原的第一表位,所述第一表位是选自CDC25B、COX2和PRL3的肽的部分。在一些情况中,组合物包含:至少第一抗原的第一表位,至少第二抗原的第二表位,所述第一和第二表位独立选自CDC25B、COX2和PRL3。在一些情况中,肽CDC25B的表位选自:氨基酸序列,该氨基酸序列与氨基酸序列QAIQAASRIIRNEQFAIRRFQ(SEQIDNO:1)有至少90%序列相同性;和氨基酸序列,该氨基酸序列与氨基酸序列VDGKHQDLKYISPETMVALLTGK(SEQIDNO:2)有至少90%序列相同性。在一些情况中,肽COX2的表位选自:氨基酸序列,该氨基酸序列与氨基酸序列FKGFWNVVNNIPFLRN(SEQIDNO:3)有至少90%序列相同性;氨基酸序列,该氨基酸序列与氨基酸序列GLVPGLMMYATIWLREH(SEQIDNO:4)有至少90%序列相同性;氨基酸序列,该氨基酸序列与氨基酸序列GEVGFQIINTASIQSLIC(SEQIDNO:5)有至少90%序列相同性;氨基酸序列,该氨基酸序列与氨基酸序列NAIMSYVLTSRSHLID(SEQIDNO:6)有至少90%序列相同性;氨基酸序列,该氨基酸序列与氨基酸序列HIYGETLARQRKLRLFKD(SEQIDNO:7)有至少90%序列相同性;氨基酸序列,该氨基酸序列与氨基酸序列LFQTSRLILIGETIKIVI(SEQIDNO:8)有至少90%序列相同性;氨基酸序列,该氨基酸序列与氨基酸序列QFQYQNRIAAEFNTLY(SEQIDNO:9)有至少90%序列相同性;或氨基酸序列,该氨基酸序列与氨基酸序列QQFIYNNSILLEHGITQFV(SEQIDNO:10)有至少90%序列相同性。在一些情况中,肽PRL3的表位选自:氨基酸序列,该氨基酸序列与氨基酸序列VSYKHMRFLITHNPTNATL(SEQIDNO:27)有至少90%序列相同性;氨基酸序列,该氨基酸序列与氨基酸序列FIEDLKKYGATTVVRVCEVTY(SEQIDNO:28)有至少90%序列相同性;氨基酸序列,该氨基酸序列与氨基酸序列PCVAGLGRAPVLVALALIES(SEQIDNO:29)有至少90%序列相同性;氨基酸序列,该氨基酸序列与氨基酸序列MKYEDAIQFIRQKRRGAIN(SEQIDNO:30)有至少90%序列相同性;和氨基酸序列,该氨基酸序列与氨基酸序列VEDWLSLVKAKFCEA(SEQIDNO:31)有至少90%序列相同性。在一些情况中,组合物包含独立选自CDC25B、COX2和PRL3的第一和第二表位。在一些情况中,组合物包含独立选自CDC25B、COX2和PRL3的第一、第二和第三表位。来自以下蛋白质的表位的氨基酸序列可与本文所列的那些不同:CDC25B、COX2、EGFR、FASCIN1、IGF1R、PRL3、RCAS1和VCP。在一些情况中,与本文所述的那些超过95%、90%、85%、80%、75%、70%、65%、60%、55%或超过50%同源的氨基酸序列可用于本文所述的组合物中。在一些情况中,第一氨基酸序列选自下组物种:人、小鼠和大鼠。在一些情况中,第二氨基酸序列选自下组物种:人、小鼠和大鼠。在一些情况中,第一和第二核酸序列位于第一质粒上。在一些情况中,第二核酸序列位于第二质粒上。在一些情况中,第一和第二表位的氨基酸序列被接头氨基酸序列分开。在一些情况中,第一表位的氨基酸序列与第二表位的氨基酸序列毗邻。在一些情况中,免疫应答是1型免疫应答。在一些情况中,免疫应答表征为大于1的I型细胞因子产生与II型细胞因子产生之比。在一些情况中,免疫应答表征为小于1的I型细胞因子产生与II型细胞因子产生之比。在一些情况中,免疫应答表征为大于1的IFNγ产生与IL-10产生之比。在一些情况中,免疫应答表征为小于1的IFNγ产生与IL-10产生之比。在一些情况中,向对象给予组合物。在一些情况中,对象需要给予组合物。在一些情况中,组合物在对象中有效引发免疫应答。在一些情况中,组合物在对象中有效消除与结直肠癌、NSCLC或卵巢癌相关的多种细胞。在一些情况中,组合物用于预防对象中与结直肠癌、NSCLC或卵巢癌相关的细胞的生长。在一些情况中,对象选自:患有结直肠癌、NSCLC或卵巢癌的人;患有结直肠癌、NSCLC或卵巢癌的小鼠;和患有结直肠癌、NSCLC或卵巢癌的大鼠。在一些情况中,对象选自:没有结直肠癌、NSCLC或卵巢癌的人;没有结直肠癌、NSCLC或卵巢癌的小鼠;和没有结直肠癌、NSCLC或卵巢癌的大鼠。结直肠癌描述包含结肠癌和直肠癌的癌症。在一些情况中,与结直肠癌关联的细胞选自:表达非典型特征的结肠细胞,表达非典型特征的直肠细胞,前肿瘤性结肠细胞,前肿瘤性直肠细胞,结肠癌细胞,直肠癌细胞,前侵袭性结肠癌细胞,前侵袭性直肠癌细胞,结肠癌干细胞,直肠癌干细胞,上皮细胞,间充质细胞,基质细胞,或其组合。与非小细胞肺癌关联的细胞选自:表达非典型特征的肺细胞,前肿瘤性肺细胞,肺癌细胞,前侵袭性肺癌细胞,肺癌干细胞,上皮细胞,间充质细胞,基质细胞,及其组合。在一些情况中,在药物组合物中含有至少第一表位。在一些情况中,在另外包含药物运载体的药物组合物中含有至少第一表位。在一些情况中,在另外包含药物运载体和佐剂的药物组合物中含有至少第一表位。在一些情况中,在另外包含佐剂的药物组合物中含有至少第一表位。在一些情况中,组合物还包含佐剂和药物运载体。在一些情况中,佐剂是GM-CSF。在一些情况中,向对象给予组合物。在一些情况中,对象有此需要。在一些情况中,本文提供了用于在对象中预防癌症(例如结直肠癌、NSCLC或卵巢癌)的方法,使得该方法包括向对象给予本文所述的组合物。在一些情况中,本文提供了用于在对象中治疗癌症(例如结直肠癌、NSCLC或卵巢癌)的方法,使得该方法包括向对象给予本文所述的组合物。在一些情况中,给药还包括向对象递送至少一剂的本文所述的组合物。在一些情况中,给药还包括通过皮下注射、皮内注射、肌内注射、血管内注射、局部施涂或吸入向对象递送本文所述的组合物。在一些情况中,对象选自:患有癌症(例如结直肠癌、NSCLC或卵巢癌)的人;患有癌症(例如结直肠癌、NSCLC或卵巢癌)的小鼠;和患有癌症(例如结直肠癌、NSCLC或卵巢癌)的大鼠。在一些情况中,对象选自:没有癌症(例如结直肠癌、NSCLC或卵巢癌)的人;没有癌症(例如结直肠癌、NSCLC或卵巢癌)的小鼠;和没有癌症(例如结直肠癌、NSCLC或卵巢癌)的大鼠。本发明还提供了用于制备本文所述的组合物的试剂盒,该试剂盒包含用于制备组合物的说明书。本发明还提供了用于给予本文所述的组合物的试剂盒,该试剂盒包含用于给予组合物的说明书。用于药物组合物的质粒在一些情况中,表位衍生自直接在基于肽的疫苗中使用的人蛋白质。在其他情况中,表位衍生自人蛋白质并且编码表位的核酸序列整合到设计成在给药后诱导对象中表位表达的核酸构建体中。在一个方面,从核酸构建体编码的表位允许针对蛋白质(例如,自蛋白质)的特定组的待产生、扩增、减弱、抑制或消除的至少一种(个)表位的免疫应答。在一些情况中,肽或核酸构建体优化成基于蛋白质或质粒的免疫来诱导、扩增或产生Th1免疫应答。在一些情况中,表位是延伸的Th1表位。在其他情况中,肽或核酸构建体优化成基于蛋白质或质粒的免疫以在有此需要的对象(例如,人或动物)中抑制、减弱或消除致病性应答。在一些方面中,本文所述的组合物包括含有核酸序列的质粒以在给予组合物(例如,疫苗)之后在对象中表达至少一种(个)表位。可在本文所述的组合物中使用本领域普通技术人员已知的适用于表达核酸序列的药物应用的任意质粒主链(例如,载体)。在一些情况中,使用市售质粒主链。在一个方面,使用质粒pUMVC3。在一些情况中,在使用前,修饰、突变、工程改造或克隆市售质粒主链。在其他情况中,使用非市售质粒主链。在一些方面中,在插入至少一个表位的核酸序列之前,质粒主链的长度可小于约500bp、约1.0kB、约1.2kB、约1.4kB、约1.6kB、约1.8kB、约2.0kB、约2.2kB、约2.4kB、约2.6kB、约2.8kB、约3.0kB、约3.2kB、约3.4kB、约3.6kB、约3.8kB、约4.0kB、约4.2kB、约4.4kB、约4.6kB、约4.8kB、约5.0kB、约5.2kB、约5.4kB、约5.6kB、约5.8kB、约6.0kB、约6.2kB、约6.4kB、约6.6kB、约6.8kB、约7.0kB、约7.2kB、约7.4kB、约7.6kB、约7.8kB、约8.0kB、约8.2kB、约8.4kB、约8.6kB、约8.8kB、约9.0kB、约9.2kB、约9.4kB、约9.6kB、约9.8kB、约10.0kB、约10.2kB、约10.4kB、约10.6kB、约10.8kB、约11.0kB、约11.2kB、约11.4kB、约11.6kB、约11.8kB、约12.0kB、约12.2kB、约12.4kB、约12.6kB、约12.8kB、约13.0kB、约13.2kB、约13.4kB、约13.6kB、约13.8kB、约14kB、约14.5kB、约15kB、约15.5kB、约16kB、约16.5kB、约17kB、约17.5kB、约18kB、约18.5kB、约19kB、约19.5kB、约20kB、约30kB、约40kB、约50kB、约60kB、约70kB、约80kB、约90kB、约100kB、约110kB、约120kB、约130kB、约140kB、约150kB、约160kB、约170kB、约180kB、约190kB或约200kB。在一个方面中,在加入编码至少一个表位的核酸序列之前,质粒长度为约4kB。在一些情况中,本文所述的组合物包括一种质粒。在其他情况中,本文所述的组合物包括超过一种质粒。在一个方面,本文所述的组合物包括2种质粒、3种质粒、4种质粒、5种质粒、6种质粒、7种质粒、8种质粒、9种质粒、10种质粒、11种质粒、12种质粒、13种质粒、14种质粒、15种质粒、16种质粒、17种质粒、18种质粒、19种质粒、20种质粒或超过20种质粒。在一些情况中,编码质粒的至少一个表位的核酸是脱氧核糖核酸。在一个方面中,脱氧核糖核酸是单链、双链或互补链。在一些情况中,脱氧核糖核酸来自基因组、线粒体或质粒脱氧核糖核酸。在其他情况中,质粒的核酸是核糖核酸。在一个方面中,核糖核酸是单链或双链。在一些情况中,核糖核酸是微、反义、短发夹、小干扰、信使、转移、核糖体核糖核酸等。在一些情况中,质粒的核酸是脱氧核糖核酸的部分或核糖核酸的部分。编码质粒的至少一个表位的核酸衍生自任意物种,使得从核酸表达的表位在对象中产生免疫应答。在一些情况中,对象是啮齿类、非人灵长类或人。编码质粒的表位的核酸使用本领域技术人员已知的方法和技术分离自任意核酸来源。编码质粒的表位的核酸可使用本领域技术人员已知的方法和技术克隆到质粒主链中。在一些情况中,编码表位的核酸序列是对于对象而言的内源性核酸序列。在一个方面,人的CDC25B的核酸序列用于在人中表达CDC25B。在其他情况中,编码抗原性表位的核酸序列是对于对象而言的外源性核酸序列。在一个方面,非人的CDC25B的核酸序列用于在人中表达CDC25B。在一些情况中,用于表达抗原性表位的核酸序列是野生型核酸序列。在一个方面,物种基因组中天然产生的CDC25B的核酸序列用于在对象中表达CDC25B。在其他情况中,编码表位的核酸序列是合成核酸序列。在一个方面,物种基因组中天然产生的CDC25B的核酸序列用本领域技术人员已知的分子技术修饰并用于在对象中表达CDC25B。有时,用于表达CDC25B表位的核酸序列可编码多肽,其中多肽的序列与选自SEQIDNO:1-2的序列具有至少70%、75%、80%、85%、90%、95%、99%或100%相同性。用于表达CDC25B表位的核酸序列还可编码多肽,其中多肽的序列与SEQIDNO:1-2的至少8个氨基酸具有至少70%、75%、80%、85%、90%、95%、99%或100%相同性。在一些情况中,编码表位的核酸序列是对于对象而言的内源性核酸序列。在一个方面,人的COX2的核酸序列用于在人中表达COX2。在其他情况中,编码抗原性表位的核酸序列是对于对象而言的外源性核酸序列。在一个方面,非人的COX2的核酸序列用于在人中表达COX2。在一些情况中,用于表达抗原性表位的核酸序列是野生型核酸序列。在一个方面,物种基因组中天然产生的COX2的核酸序列用于在对象中表达COX2。在其他情况中,编码表位的核酸序列是合成核酸序列。在一个方面,物种基因组中天然产生的COX2的核酸序列用本领域技术人员已知的分子技术修饰并用于在对象中表达COX2。用于表达COX2表位的核酸序列可编码多肽,其中多肽的序列与选自SEQIDNO:3-10的序列具有至少70%、75%、80%、85%、90%、95%、99%或100%相同性。用于表达COX2表位的核酸序列还可编码多肽,其中多肽的序列与SEQIDNO:3-10的至少8个氨基酸具有至少70%、75%、80%、85%、90%、95%、99%或100%相同性。在一些情况中,编码表位的核酸序列是对于对象而言的内源性核酸序列。在一个方面,人的EGFR的核酸序列用于在人中表达EGFR。在其他情况中,编码抗原性表位的核酸序列是对于对象而言的外源性核酸序列。在一个方面,非人的EGFR的核酸序列用于在人中表达EGFR。在一些情况中,用于表达抗原性表位的核酸序列是野生型核酸序列。在一个方面,物种基因组中天然产生的EGFR的核酸序列用于在对象中表达EGFR。在其他情况中,编码表位的核酸序列是合成核酸序列。在一个方面,物种基因组中天然产生的EGFR的核酸序列用本领域技术人员已知的分子技术修饰并用于在对象中表达EGFR。用于表达EGFR表位的核酸序列可编码多肽,其中多肽的序列与选自SEQIDNO:11-13的序列具有至少70%、75%、80%、85%、90%、95%、99%或100%相同性。用于表达EGFR表位的核酸序列还可编码多肽,其中多肽的序列与SEQIDNO:11-13的至少8个氨基酸具有至少70%、75%、80%、85%、90%、95%、99%或100%相同性。在一些情况中,编码表位的核酸序列是对于对象而言的内源性核酸序列。在一个实施方式中,人的FASCIN1的核酸序列用于在人中表达FASCIN1。在其他情况中,编码抗原性表位的核酸序列是对于对象而言的外源性核酸序列。在一个方面,非人的FASCIN1的核酸序列用于在人中表达FASCIN1。在一些情况中,用于表达抗原性表位的核酸序列是野生型核酸序列。在一个方面,物种基因组中天然产生的FASCIN1的核酸序列用于在对象中表达FASCIN1。在其他情况中,编码表位的核酸序列是合成核酸序列。在一个方面,物种基因组中天然产生的FASCIN1的核酸序列用本领域技术人员已知的分子技术修饰并用于在对象中表达FASCIN1。用于表达FASCIN1表位的核酸序列可编码多肽,其中多肽的序列与选自SEQIDNO:14-22的序列具有至少70%、75%、80%、85%、90%、95%、99%或100%相同性。用于表达FASCIN1表位的核酸序列还可编码多肽,其中多肽的序列与SEQIDNO:14-22的至少8个氨基酸具有至少70%、75%、80%、85%、90%、95%、99%或100%相同性。在一些情况中,编码表位的核酸序列是对于对象而言的内源性核酸序列。在一个方面,人的IGF1R的核酸序列用于在人中表达IGF1R。在其他情况中,编码抗原性表位的核酸序列是对于对象而言的外源性核酸序列。在一个方面,非人的IGF1R的核酸序列用于在人中表达IGF1R。在一些情况中,用于表达抗原性表位的核酸序列是野生型核酸序列。在一个方面,物种基因组中天然产生的IGF1R的核酸序列用于在对象中表达IGF1R。在其他情况中,编码表位的核酸序列是合成核酸序列。在一个方面,物种基因组中天然产生的IGF1R的核酸序列用本领域技术人员已知的分子技术修饰并用于在对象中表达IGF1R。用于表达IGF1R表位的核酸序列可编码多肽,其中多肽的序列与选自SEQIDNO:23-26的序列具有至少70%、75%、80%、85%、90%、95%、99%或100%相同性。用于表达IGF1R表位的核酸序列还可编码多肽,其中多肽的序列与SEQIDNO:23-26的至少8个氨基酸具有至少70%、75%、80%、85%、90%、95%、99%或100%相同性。在一些情况中,编码表位的核酸序列是对于对象而言的内源性核酸序列。在一个方面,人的PRL3的核酸序列用于在人中表达PRL3。在其他情况中,编码抗原性表位的核酸序列是对于对象而言的外源性核酸序列。在一个方面,非人的PRL3的核酸序列用于在人中表达PRL3。在一些情况中,用于表达抗原性表位的核酸序列是野生型核酸序列。在一个方面,物种基因组中天然产生的PRL3的核酸序列用于在对象中表达PRL3。在其他情况中,编码表位的核酸序列是合成核酸序列。在一个方面,物种基因组中天然产生的PRL3的核酸序列用本领域技术人员已知的分子技术修饰并用于在对象中表达PRL3。用于表达PRL3表位的核酸序列可编码多肽,其中多肽的序列与选自SEQIDNO:27-31的序列具有至少70%、75%、80%、85%、90%、95%、99%或100%相同性。用于表达PRL3表位的核酸序列还可编码多肽,其中多肽的序列与SEQIDNO:27-31的至少8个氨基酸具有至少70%、75%、80%、85%、90%、95%、99%或100%相同性。在一些情况中,编码表位的核酸序列是对于对象而言的内源性核酸序列。在一个方面,人的RCAS1的核酸序列用于在人中表达RCAS1。在其他情况中,编码抗原性表位的核酸序列是对于对象而言的外源性核酸序列。在一个方面,非人的RCAS1的核酸序列用于在人中表达RCAS1。在一些情况中,用于表达抗原性表位的核酸序列是野生型核酸序列。在一个方面,物种基因组中天然产生的RCAS1的核酸序列用于在对象中表达RCAS1。在其他情况中,编码表位的核酸序列是合成核酸序列。在一个方面,物种基因组中天然产生的RCAS1的核酸序列用本领域技术人员已知的分子技术修饰并用于在对象中表达RCAS1。用于表达RCAS1表位的核酸序列可编码多肽,其中多肽的序列与选自SEQIDNO:32-36的序列具有至少70%、75%、80%、85%、90%、95%、99%或100%相同性。用于表达RCAS1表位的核酸序列还可编码多肽,其中多肽的序列与SEQIDNO:32-36的至少8个氨基酸具有至少70%、75%、80%、85%、90%、95%、99%或100%相同性。在一些情况中,编码表位的核酸序列是对于对象而言的内源性核酸序列。在一个方面,人的VCP的核酸序列用于在人中表达VCP。在其他情况中,编码抗原性表位的核酸序列是对于对象而言的外源性核酸序列。在一个方面,非人的VCP的核酸序列用于在人中表达VCP。在一些情况中,用于表达抗原性表位的核酸序列是野生型核酸序列。在一个方面,物种基因组中天然产生的VCP的核酸序列用于在对象中表达VCP。在其他情况中,编码表位的核酸序列是合成核酸序列。在一个方面,物种基因组中天然产生的VCP的核酸序列用本领域技术人员已知的分子技术修饰并用于在对象中表达VCP。用于表达VCP表位的核酸序列可编码多肽,其中多肽的序列与选自SEQIDNO:37-45的序列具有至少70%、75%、80%、85%、90%、95%、99%或100%相同性。用于表达VCP表位的核酸序列还可编码多肽,其中多肽的序列与SEQIDNO:37-45的至少8个氨基酸具有至少70%、75%、80%、85%、90%、95%、99%或100%相同性。本文所述的组合物可含有在单质粒主链上编码的短表位。在一些方面中,短表位可包含<40个氨基酸。在一些情况中,质粒主链编码一个短表位。在其他情况中,本文所述的质粒编码超过一个短表位。在一个方面中,本文所述的组合物编码2个短表位、3个短表位、4个短表位、5个短表位、6个短表位、7个短表位、8个短表位、9个短表位、10个短表位、11个短表位、12个短表位、13个短表位、14个短表位、15个短表位、16个短表位、17个短表位、18个短表位、19个短表位、20个短表位、或超过20个短表位。在一个方面中,质粒编码不超过6个短表位。在一些方面中,本文所述的组合物含有在单质粒主链上编码的延伸表位。在一些方面中,延伸表位可包含40-80个氨基酸。在一些情况中,质粒编码一个延伸表位。在其他情况中,组合物编码超过一个延伸表位。在一个方面,质粒编码2个延伸表位、3个延伸表位、4个延伸表位、5个延伸表位、6个延伸表位、7个延伸表位、8个延伸表位、9个延伸表位、10个延伸表位、11个延伸表位、12个延伸表位、13个延伸表位、14个延伸表位、15个延伸表位、16个延伸表位、17个延伸表位、18个延伸表位、19个延伸表位、20个延伸表位、或超过20个延伸表位。在一个方面中,质粒编码不超过4个延伸表位。本文所述的结直肠癌、NSCLC或卵巢癌疫苗的组合物可含有单质粒主链上的短表位和延伸表位。在一些情况中,质粒包含一个短表位。在其他情况中,本文所述的质粒的组合物包含超过一个短表位。在一个方面中,本文所述的质粒的组合物包含2个短表位、3个短表位、4个短表位、5个短表位、6个短表位、7个短表位、8个短表位、9个短表位、10个短表位、11个短表位、12个短表位、13个短表位、14个短表位、15个短表位、16个短表位、17个短表位、18个短表位、19个短表位、20个短表位、或超过20个短表位。质粒可编码一个延伸表位。本文所述组合物可编码多于一个延伸表位。在一个方面,本文所述组合物编码2个延伸表位、3个延伸表位、4个延伸表位、5个延伸表位、6个延伸表位、7个延伸表位、8个延伸表位、9个延伸表位、10个延伸表位、11个延伸表位、12个延伸表位、13个延伸表位、14个延伸表位、15个延伸表位、16个延伸表位、17个延伸表位、18个延伸表位、19个延伸表位、20个延伸表位、或超过20个延伸表位。在一些方面中,用于含有超过一种编码表位的序列的组合物的质粒在各表位序列之间含有间隔子。在一些方面中,间隔子包括含<10个氨基酸的间插氨基酸序列。在一些情况中,串联编码短表位的序列而不使用间隔子。在一些情况中,串联编码延伸表位的序列而不使用间隔子。在一些情况中,串联编码短表位的序列并使用间隔子。在一些情况中,串联编码延伸表位的序列并使用间隔子。可在本文所述的组合物中使用本领域普通技术人员已知的适用于表达核酸序列的药物应用的任意质粒主链(例如,载体)。载体可以是环状质粒或线性核酸。环状质粒或线性核酸能够引导特定核苷酸序列在合适对象细胞中表达。载体可具有与编码多肽的核苷酸序列可操作连接的启动子,其可操作地连接至终止信号。载体也可含有核苷酸序列的适当翻译所需的序列。包含感兴趣的核苷酸序列的载体可以是嵌合的,意味着其组分中的至少一种相对于其他组分中的至少一种是异源的。表达盒中的核苷酸序列的表达可处于组成型启动子或诱导性启动子的控制下,其可仅在宿主细胞接触一些特定外部刺激时引发转录。所述载体可为质粒。质粒可用于用编码多肽的核酸来转染细胞,其中转染的宿主细胞可在发生多肽表达的条件下培养并维持。质粒可包含核酸序列,其编码本文所述的多种多肽中的一种(个)或多种(个)。单一质粒可含有单一多肽的编码序列,或者超过一种多肽的编码序列。有时,质粒还可包含编码佐剂,如免疫刺激分子,如细胞因子的编码序列。质粒还可包含起始密码子,其可在编码序列的上游,和终止密码子,其可在编码序列的下游。起始密码子和终止密码子可在编码序列的框架中。质粒也可包含可操作连接至编码序列的启动子,和编码序列上游的增强子。增强子可以是人肌动蛋白、人肌球蛋白、人血红蛋白、人肌肉肌氨酸或病毒增强子如来自CMV、FMDV、RSV或EBV的增强子。美国专利号5,593,972、5,962,428和W094/016737中描述了多核苷酸功能增强子。质粒可适用于原核或真核表达。质粒可来自细菌(例如大肠杆菌(E.coli))、昆虫、酵母或哺乳动物来源。质粒还可用于无细胞表达系统。合适的细菌质粒可包括pSE420、pcDNAI、pcDNA3、pACYC177、pASK75、pBAD载体系列、pBADM载体系列、pET载体系列、pETM载体系列、pGEX载体系列、pHAT、pHAT2、pMal-c2、pMal-p2、pQE载体系列、pRSETA、pRSETB、pRSETC、pTrcHis2系列、pZA31-Luc、pZE21-MCS-1、pFLAGATS、pFLAGCTS、pFLAGMAC、pFLAGShift-12c、pTAC-MAT-1、pFLAGCTC、或pTAC-MAT-2。示例性昆虫质粒可包括MAXBACTM、pFastBac1、pFastBacDUAL、pFastBacET、pFastBacHTa、pFastBacHTb、pFastBacHTc、pFastBacM30a、pFastBactM30b、pFastBac、M30c、pVL1392、pVL1393、pVL1393M10、pVL1393M11、pVL1393M12、FLAG载体例如pPolh-FLAG1或pPolh-MAT2、或MAT载体例如pPolh-MAT1或pPolh-MAT2。酵母质粒可包括pYES2、pDESTTM14载体、pDESTTM15载体、pDESTTM17载体、pDESTTM24载体、pYES-DEST52载体、pBAD-DEST49目标载体、pAO815Pichia载体、pTEF1/Zeo、pYES2酵母载体、pYES2/CT酵母载体、pYES2/NTA、B、和C酵母载体、或pYES3/CT酵母载体。示例性哺乳动物质粒可包括pUMVC3、pVAXI、pCEP4、pREP4、pMCP-tag(m)、pTARGETTM、FreeStyleTM293系统、pFLAG-CMV3、pFLAG-Myc-CMV21、p3xFLAG-Myc-CMV25、pBICEP-CMV1、pBICEP-CMV2、或Expi293TM系统。用于无细胞系统的示例性质粒可包括pF25KICET7载体、pF3AWG(BYDV)载体、pTNTTM、或pCMVTNTTM载体。质粒也可包含调节序列,其也适于给予质粒的细胞中的基因表达。编码序列可包含密码子,其可允许在宿主细胞中更高效地转录编码序列。在一些示例中,载体是环状质粒,其可通过整合到细胞基因组中或存在于染色体外(例如,具有复制起点的自复制质粒)来转化靶细胞。示例性的载体包括pVAX、pcDNA3.0、或provax或任何其他能够表达编码抗原的DNA并且使细胞能够将序列翻译成被免疫系统识别的抗原的表达载体。基于核酸的疫苗可以是线性核酸疫苗,或线性表达盒(“LEC”),其能够通过电转被高效递送到对象中并且表达一种或多种本文所述的多肽。LEC可以是去除了磷酸主链的任意线性DNA。DNA可编码一种或多种本文所述的多肽。LEC可含有启动子、内含子、终止密码子和/或聚腺苷酸化信号。多肽的表达可受到启动子的控制。LEC可能不含有任何抗生素抗性基因和/或磷酸主链。LEC可能不含有与多肽表达不相关的其他核酸序列。LEC可衍生自能够被线性化的任何质粒。质粒可表达多肽。示例性的质粒包括pNP(PuertoRico/34)、pM2(NewCaledonia/99)、WLV009、pVAX、pcDNA3.0、或provax或任何其他能够表达编码抗原的DNA并且使细胞能够将序列翻译成被免疫系统识别的抗原的表达载体。组合物可以是基于质粒的疫苗,其含有短和延伸抗原性表位。在一个方面,使用4kB质粒主链(例如,pUMVC3或pNGVL3)来构建疫苗的一个或多个质粒。在一些方面中,质粒包含一个或多个抗生素抗性基因。在其他方面,质粒包含卡那霉素抗性基因、羧苄青霉素抗性基因、氨苄青霉素抗性基因、放线菌素D抗性基因、链霉素抗性基因、新霉素抗性基因、多粘菌素抗性基因或博来霉素抗性基因,或其组合。在一个方面,除了用于在细菌中选择和增殖的复制起点以外,pUMVC3含有卡那霉素抗性基因。在一些情况中,pUMVC3中的多克隆位点侧接真核转录控制元件以促进插入的序列(例如,基因盒)在真核细胞中的表达。在一个方面,插入序列是表位。在一个方面中,用质粒主链中Kozak共有翻译起始序列、终止密码子、和克隆位点来组装抗原性表位肽的核酸编码序列。可使用本领域普通技术人员已知的标准分子技术包括合成寡核苷酸、聚合酶链反应扩增、限制性内切核酸酶、和核酸连接酶(例如,DNA连接酶)来生成核酸(例如,DNA片段)并将核酸片段插入质粒载体主链中。在一些情况中,质粒含有编码至少一个标签的核酸序列。在一些情况中,标签被翻译成肽。本领域技术人员已知的标签的任意核酸序列可与本文所述的质粒联用。在一个方面,标签是具有3个组氨酸残基的组氨酸标签、具有4个组氨酸残基的组氨酸标签、具有5个组氨酸残基的组氨酸标签、或具有6个组氨酸残基的组氨酸标签等。在一些方面中,使用本领域技术人员已知的任意合适技术来确定标签在对象中的表达。在一些情况中,使用本领域普通技术人员已知的任意测序技术来对质粒进行测序,使得测序技术的结果提供对整个质粒的核苷酸水平解析。在一些方面中,组合物是多抗原癌症疫苗(例如结直肠癌、非小细胞肺癌或卵巢癌疫苗)。在一个方面,多抗原癌症疫苗(例如结直肠癌、非小细胞肺癌或卵巢癌疫苗)包含多种(个)抗原。在一些情况中,一种抗原的表达影响不同抗原的表达。在一些情况中,超过一种抗原的表达影响不同抗原的表达。在一些情况中,一种抗原的表达影响超过一种不同抗原的表达。在一些情况中,一种抗原的表达不影响不同抗原的表达。在一些情况中,超过一种抗原的表达不影响不同抗原的表达。在一些情况中,一种抗原的表达不影响超过一种不同抗原的表达。在一个方面,抗原性竞争限制了多抗原疫苗的免疫原性。在一些方面中,使用本领域普通技术人员已知的任意技术来确定在给予多抗原疫苗后引发的免疫应答是否是与单一抗原疫苗的各抗原相当的量级。在一个方面,ELISPOT(例如用于分泌IFN-γ)确定免疫应答的量级。在一些情况中,ELISPOT检测啮齿类、非人灵长类或人肽。核酸分离的核酸分子是从其天然环境取出(即经人工操作)的核酸分子,其天然环境是天然发现该核酸分子的基因组或染色体。因此,“分离”不一定反映核酸分子的纯化程度,但表明该分子不包含天然发现该核酸分子的完整基因组或完整染色体。分离的核酸分子可包含基因。包含基因的分离核酸分子不是包含这个基因的染色体片段,而包含与该基因有关的编码区和调控区,但不含同一染色体上天然发现的其它基因。分离核酸分子也可包含侧接(即在该序列的5'和/或3'末端侧接)其它核酸的特定核酸序列,所述其它核酸在天然情况下通常不侧接所述的特定核酸序列(即,异源序列)。分离的核酸分子可包括DNA、RNA(如mRNA),或者DNA或RNA的衍生物(如cDNA)。虽然术语“核酸分子”主要指代物理核酸分子并且术语“核酸序列”主要指代核酸分子上的核苷酸序列,但两个术语可互换使用,尤其是相对于能够编码蛋白质或蛋白质结构域的核酸分子,或核酸序列而言。分离的核酸分子可以是DNA,包括基因组和cDNA,RNA或杂交体,其中所述核酸可以含有脱氧核糖核苷酸和核糖核苷酸的组合,以及碱基的组合,包括尿嘧啶、腺嘌呤、胸腺嘧啶、胞嘧啶、鸟嘌呤、肌苷、黄嘌呤、次黄嘌呤、异胞嘧啶、和异鸟嘌呤。可通过化学合成方法或通过重组方法来获得核酸。虽然术语“核酸分子”主要指代物理核酸分子并且术语“核酸序列”主要指代核酸分子上的核苷酸序列,但两个术语可互换使用,尤其是相对于能够编码蛋白质或蛋白质结构域的核酸分子,或核酸序列而言。核酸分子可指代共价连接在一起的至少2个核苷酸。虽然在如下所述(例如,在引物和探针如标记探针的构建中)的一些情况中,本文所述的核酸可含有磷酸二酯键,但可包括可具有交替主链的核酸类似物,包括,例如,磷酰胺(Beaucage等,Tetrahedron49(10):1925(1993)及其参考文献;Letsinger,J.Org.Chem.35:3800(1970);Sprinzl等,Eur.J.Biochem.81:579(1977);Letsinger等,Nucl.AcidsRes.14:3487(1986);Sawai等,Chem.Lett.805(1984),Letsinger等,J.Am.Chem.Soc.110:4470(1988);和Pauwels等,ChemicaScripta26:141(1986)),硫代磷酸酯(Mag等,NucleicAcidsRes.19:1437(1991);和美国专利号5,644,048),二硫代磷酸酯(Briu等,J.Am.Chem.Soc.111:2321(1989)),O-甲基亚磷酰胺连接(参见Eckstein,《寡核苷酸和类似物:实践方法》(OligonucleotidesandAnalogues:APracticalApproach),牛津大学出版社),和肽核酸(在本文中也称为“PNA”)主链和连接(参见Egholm,J.Am.Chem.Soc.114:1895(1992);Meier等,Chem.Int.Ed.Engl.31:1008(1992);Nielsen,Nature,365:566(1993);Carlsson等5,644,048),二硫代磷酸酯(Briu等,J.Am.Chem.Soc.111:2321(1989)),O-甲基亚磷酰胺连接(参见Eckstein,《寡核苷酸和类似物:实践方法》(OligonucleotidesandAnalogues:APracticalApproach),牛津大学出版社),和肽核酸(在本文中也称为“PNA”)主链和连接(参见Egholm,J.Am.Chem.Soc.114:1895(1992);Meier等,Chem.Int.Ed.Engl.31:1008(1992);Nielsen,Nature,365:566(1993);Carlsson等,Nature380:207(1996),其全部通过引用纳入本文)。其他类似核酸包括具有双环结构的那些,包括锁核酸(在本文中也称为“LNA”),Koshkin等,J.Am.Chem.Soc.120.132523(1998);正电主链(Denpcy等,Proc.Natl.Acad.Sci.USA92:6097(1995));非离子型主链(美国专利号5,386,023,5,637,684,5,602,240,5,216,141和4,469,863;Kiedrowshi等,Angew.Chem.Intl.Ed.English30:423(1991);Letsinger等,J.Am.Chem.Soc.110:4470(1988);Letsinger等,Nucleoside&;Nucleotide13:1597(1994);第2章和第3章,ASCSymposiumSeries580,“《反义研究中的糖修饰》(CarbohydrateModificationsinAntisenseResearch)”,Y.S.Sanghui和P.DanCook编;Mesmaeker等,Bioorganic&MedicinalChem.Lett.4:395(1994);Jeffs等,J.BiomolecularNMR34:17(1994);TetrahedronLett.37:743(1996))和非核糖主链,包括美国专利号5,235,033和5,034,506中所述的那些,和第6章和第7章,ASCSymposiumSeries580,“《反义研究中的糖修饰》(CarbohydrateModificationsinAntisenseResearch)”,Y.S.Sanghui和P.DanCook编。含有一个或多个碳环糖的核酸也包括在核酸的定义中(参见Jenkins等,Chem.Soc.Rev.(1995),第169-176页)。几种核酸类似物描述于Rawls,C&ENews,1997年6月2日,第35页。“锁核酸”也包括在核酸类似物的定义中。LNA是一类核酸类似物,其中核糖环被连接2′-O原子与4′-C原子的亚甲基桥“锁定”。所有这些参考文献以参考的方式并入本文中。可进行核糖-磷酸酯主链的这些修饰以增加这类分子在生理环境中的稳定性和半衰期。例如,PNA:DNA和LNA-DNA杂交体可显示出更高的稳定性并因此可用于一些实施方式中。靶核酸可以是单链或双链的,如本文具体所示,或同时含有双链或单链序列的部分。根据应用,核酸可以是DNA(包括,例如,基因组DNA、线粒体DNA、和cDNA)、RNA(包括,例如,mRNA和rRNA)或杂交体,其中核酸含有脱氧核糖-核苷酸和核糖-核苷酸的任意组合,碱基的任意组合,包括尿嘧啶、腺嘌呤、胸腺嘧啶、胞嘧啶、鸟嘌呤、肌苷、次黄嘌呤、异胞嘧啶、和异鸟嘌呤等。重组核酸分子是包括编码本文所述的任意一种或多种蛋白质的任意核酸序列中的至少一种的分子,这些蛋白质可操作地连接到能够有效调节核酸分子在待转染的细胞中的表达的任何转录控制序列中的至少一种。虽然术语“核酸分子”主要指代物理核酸分子并且术语“核酸序列”主要指代核酸分子上的核苷酸序列,但两个术语可互换使用,尤其是相对于能够编码蛋白质的核酸分子,或核酸序列而言。另外,术语“重组分子”主要指可操作连接至转录控制序列的核酸分子,但可与给予动物的术语“核酸分子”互换使用。重组核酸分子包括重组载体,其是任意核酸序列,一般是异源序列,其可操作地连接至编码本发明的融合蛋白的分离的核酸分子,其能够使融合蛋白重组产生,并且其能够根据本发明将核酸分子递送到宿主细胞中。这种载体可含有未在自然发现与待插入载体的分离的核酸分子毗邻的核酸序列。该载体可以是真核或原核的RNA或DNA,并且优选在本发明中是病毒或质粒。重组载体可用于核酸分子的克隆、测序和/或操作,并且可用于递送这类分子(例如,在DNA组合物中或基于病毒载体的组合物中)。重组载体优选用于核酸分子的表达,并且也可称为表达载体。优选的重组载体能够在转染的宿主细胞中表达。在一些方面中,重组分子中包括核酸分子,其可操作地连接至含有调节序列如转录控制序列、翻译控制序列、复制起点、和其他调节序列的表达载体,这些调节序列与宿主细胞相容并且控制本发明的核酸分子的表达。在一个方面,重组分子包括可操作连接至一种或多种表达控制序列的核酸分子。术语“可操作连接”是指将核酸分子以使该分子在转染(即,转化、转导或转染)到宿主细胞中时表达的方式连接到表达控制序列。药物组合物在一些方面中,本发明的免疫原性组合物优选配制成疫苗用于对象的体内给药,使得它们赋予用于可接受的对象百分比的各抗原性组分优于血清保护标准的抗体效价。众所周知抗原的关联抗体效价,高于该效价就认为对象针对所述抗原发生血清转化,该类效价由诸如WHO的组织公布。在一些方面中,优选多于80%的具有统计学显著性的对象样品发生血清转化,更优选多于90%,更优选多于93%,最优选96-100%。在一些方面中,本发明的免疫原性组合物优选佐剂化。合适的佐剂包括铝盐,如氢氧化铝凝胶(alum)或磷酸铝,钙、铁或锌盐,或是酰化酪氨酸的不溶性悬浮液,或酰化糖,阳离子或阴离子衍生多糖,或聚磷腈。有时,佐剂可引发TH1-型应答。有时,佐剂可引发TH2-型应答。TH1-型应答可表征为产生细胞因子如IFN-γ,这与TH-2型应答相反,其可表征为产生细胞因子如IL-4、IL-5和IL-10。在一些方面中,选择佐剂经作为TH1型应答的优先诱导物,以协助细胞介导的免疫应答分支。合适的佐剂可包括刺激分子例如细胞因子。细胞因子的非限制性示例包括:CCL20、α-干扰素(IFN-α)、β-干扰素(IFN-β)、γ-干扰素、血小板衍生生长因子(PDGF)、TNFa、TNFp、粒细胞-巨噬细胞集落刺激因子(GM-CSF)、表皮生长因子(EGF)、皮肤T细胞虏获趋化因子(CTACK)、表皮胸腺-表达趋化因子(TECK)、粘膜-相关表皮趋化因子(MEC)、IL-12、IL-15、IL-28、MHC、CD80、CD86、IL-1、IL-2、IL-4、IL-5、IL-6、IL-10、IL-18、MCP-1、MIP-la、MIP-1-、IL-8、L-选择素、P-选择素、E-选择素、CD34、GlyCAM-1、MadCAM-1、LFA-1、VLA-1、Mac-1、pl50.95、PECAM、ICAM-1、ICAM-2、ICAM-3、CD2、LFA-3、M-CSF、G-CSF、IL-18的突变形式、CD40、CD40L、血管生长因子、成纤维细胞生长因子、IL-7、神经生长因子、血管表皮生长因子、Fas、TNF受体、Fit、Apo-1、p55、WSL-1、DR3、TRAMP、Apo-3、AIR、LARD、NGRF、DR4、DRS、KILLER、TRAIL-R2、TRICK2、DR6、胱冬酶ICE、Fos、c-jun、Sp-1、Ap-1、Ap-2、p38、p65Rel、MyD88、IRAK、TRAF6、IkB、失活NIK、SAPK、SAP-I、JNK、干扰素响应基因、NFkB、Bax、TRAIL、TRAILrec、TRAILrecDRC5、TRAIL-R3、TRAIL-R4、RANK、RANKLIGAND、Ox40、Ox40LIGAND、NKG2D、MICA、MICB、NKG2A、NKG2B、NKG2C、NKG2E、NKG2F、TAPI、和TAP2。在一些情况中,佐剂是粒细胞巨噬细胞集落刺激因子(GM-CSF)。其他佐剂包括:MCP-1、MIP-la、MIP-lp、IL-8、RANTES、L-选择素、P-选择素、E-选择素、CD34、GlyCAM-1、MadCAM-1、LFA-1、VLA-1、Mac-1、pl50.95、PECAM、ICAM-1、ICAM-2、ICAM-3、CD2、LFA-3、M-CSF、G-CSF、IL-4、IL-18的突变形式、CD40、CD40L、血管生长因子、成纤维细胞生长因子、IL-7、IL-22、神经生长因子、血管表皮生长因子、Fas、TNF受体、Fit、Apo-1、p55、WSL-1、DR3、TRAMP、Apo-3、AIR、LARD、NGRF、DR4、DR5、KILLER、TRAIL-R2、TRICK2、DR6、胱冬酶ICE、Fos、c-jun、Sp-1、Ap-1、Ap-2、p38、p65Rel、MyD88、IRAK、TRAF6、IkB、失活NIK、SAPK、SAP-1、JNK、干扰素响应基因、NFkB、Bax、TRAIL、TRAILrec、TRAILrecDRC5、TRAIL-R3、TRAIL-R4、RANK、RANKLIGAND、Ox40、Ox40LIGAND、NKG2D、MICA、MICB、NKG2A、NKG2B、NKG2C、NKG2E、NKG2F、TAP1、TAP2及其功能性片段。在一些方面中,佐剂可以是toll样受体的调节剂。toll样受体的调节剂的示例包括TLR-9拮抗剂并且不限于小分子调节剂,如toll-样受体如咪喹莫特。可与本文所述的疫苗联用的佐剂的其他示例可包括并且不限于皂苷、CpGODN等。有时,佐剂可包括铝盐,如氢氧化铝凝胶(alum)、磷酸铝,钙、铁或锌盐,或可以是酰化酪氨酸的不溶性悬浮液,或酰化糖,阳离子或阴离子衍生多糖,或聚磷腈。有时,佐剂可为完全弗氏佐剂(CFA)。完全弗氏佐剂(CFA)可包含热杀死分枝杆菌,其可负责刺激抗体生产。佐剂还可包括不完全弗氏佐剂(IFA)。不完全弗氏佐剂(IFA),油包水(w/o)乳液,可通过在注射位置形成储库并刺激产抗体的血浆细胞而引发Th2-偏好应答。在一些方面中,促进主要Th1应答的合适佐剂系统包括单磷酰脂质A或其衍生物,尤其是3-脱-O-酰化单磷酰脂质A,以及单磷酰脂质A,优选3-脱-O-酰化单磷酰脂质A(3D-MPL)与铝盐的组合。在一些方面中,强化系统包括单磷酰脂质A和皂苷衍生物的组合,尤其是QS21和3D-MPL的组合,如WO94/00153中所述,或反应原性较低的组合物,其中用胆固醇猝灭QS21,如WO96/33739中所述。在一些方面中,特别强效的佐剂制剂包括水包油乳液中的QS21、3D-MPL和生育酚,如WO95/17210所述。在一些方面中,疫苗还包含皂苷,更优选为QS21。在一些方面中,制剂还可包含水包油乳液和生育酚(WO95/17210)。在一些方面中,含有未甲基化的CpG的寡核苷酸(WO96/02555)也是潜在的TH1应答诱导剂并且适用于本发明。在一些方面中,铝盐是上述免疫原性组合物中的优选佐剂。在一些方面中,为了最小化本发明组合物中的佐剂水平,多糖偶联物未佐剂化。在一些方面中,本发明疫苗还包含佐剂或免疫刺激剂,诸如但不限于来自任意来源的脱毒脂质A和脂质A的无毒衍生物、皂苷和其他能够刺激TH1型应答的试剂。长久以来已知肠细菌脂多糖(LPS)是免疫系统的强效刺激剂,虽然其在佐剂中的用途已经受到其毒性作用的限制。Ribi等(1986,细菌内毒素免疫学和体液药学(Immunologyandhnmunopharmacologyofbacterialendotoxins),PlenumPubl.Corp.,NY,第407-419页)已经描述了LPS的无毒性衍生物,单磷酰脂质A(MPL),其通过从末端缩短的葡糖胺中去除核心糖基团和磷酸而产生。通过从二糖主链的3-位去除酰基链产生进一步脱毒形式的MPL,并且称为3-O-脱酰化单磷酰脂质A(3D-MPL)。在一些方面中,已经通过GB2122204B所述的方法纯化并制备,参考文献也公开了二磷酰脂质A及其3-O-脱酰化变体的制备。3D-MPL的优选形式为具有直径小于0.2μm的小粒度的乳液形式,并且其制备方法描述于WO94/21292。包含单磷酰脂质A和表面活性剂的水性制剂已经描述于WO9843670A2。在一些方面中,从细菌来源纯化并加工待在本发明的组合物中配制的细菌脂多糖衍生的佐剂,或者它们是合成的。在一个方面,纯化的单磷酰脂质A描述于Ribi等,1986(同上),并且衍生自沙门氏菌的二磷酰脂质A或3-O-脱酰化单磷酰脂质A描述于GB2220211和US4912094。已经描述了其他纯化和合成的脂多糖(Hilgers等,1986,Int.ArchAllergy.Immunol,79(4):392-6;Hilgers等,1987,Immunology,60(l):141-6;和EP0549074B1)。在一些方面中,特别优选的细菌脂多糖佐剂是3D-MPL。因此,在一些方面中,用于本发明的LPS衍生物是在结构上与LPS或MPL或3D-MPL相似的那些免疫刺激剂。在本发明的另一个方面中,LPS衍生物是酰化单糖,其是MPL的上述结构的子区域。皂苷描述于Lacaille-Dubois,M和WagnerH.(1996.皂苷生物和药学活性综述(Areviewofthebiologicalandpharmacologicalactivitiesofsaponins).Phytomedicine,第2卷,第363-386页)。皂苷是广泛分布在植物和海洋动物界的类固醇或三萜皂苷。皂苷用于在水中形成胶体溶液,其在摇晃中形成泡沫,并用于使胆固醇沉淀。当皂苷接近细胞膜时,它们在膜中产生孔状结构,其导致膜破裂。红细胞的溶血是这种现象的示例,其是某些而非全部皂苷的性质。皂苷已知作为全身给药疫苗中的佐剂。在本领域中已经深入研究了单个皂苷的佐剂和溶血活性(Lacaille-Dubois和Wagner,同上)。例如,QuilA(衍生自南美洲皂皮树的树皮)及其部分描述于US5,057,540和“用作疫苗佐剂的皂苷(Saponinsasvaccineadjuvants)”,Kensil,C.R.,CritRevTherDrugCarrierSyst,1996,12(l-2):l-55;以及EP0362279B1。称为免疫刺激复合物(ISCOMS)的包含QuilA部分的颗粒结构是溶血性的并且已经用于制备疫苗(Morein,B.,EP0109942B1;WO96/11711;WO96/33739)。溶血性皂苷QS21和QS17(QuilA的HPLC纯化部分)已经描述为强效全身佐剂,并且其生产方法描述于美国专利号5,057,540和EP0362279B1。已经用于全身免疫研究的其他皂苷包括衍生自其他植物物种如石竹和肥皂草的那些(Bomford等,Vaccine,10(9):572-577,1992)。在一些方面中,强化系统包括非毒性脂质A衍生物和皂苷衍生物的组合,尤其是QS21和3D-MPL的组合,如WO94/00153中所述,或反应原性较低的组合物,其中用胆固醇猝灭QS21,如WO96/33739中所述。在一些方面中,特别强效的佐剂制剂包括水包油乳液中的QS21和3D-MPL,如WO95/17210所述并且是优选制剂。因此,在本发明的一个方面,提供含有本发明抗原制剂的疫苗,所述抗原制剂用脱毒脂质A或脂质A的无毒衍生物佐剂化,更优选用单磷酰脂质A或其衍生物佐剂化。在一些方面中,优选疫苗还包含皂苷,更优选为QS21。在一些方面中,制剂优选还包涵水包油乳液。本发明还提供生产疫苗制剂的方法,所述方法包括混合本发明的抗原制剂与药物可接受赋形剂,例如3D-MPL。在一些方面中,优选存在于本发明的佐剂化疫苗制剂中的其他组分包括非离子去污剂例如本文所述的辛苯聚醇和聚氧乙烯酯,优选叔辛基苯氧基-聚乙氧基乙醇(曲通X-100)和聚氧乙烯失水山梨糖醇单油酸酯(吐温80);和本文所述的胆汁盐或胆酸衍生物,尤其是脱氧胆酸钠或牛磺脱氧胆酸钠。因此,在一些方面中,特别优选的制剂包含3D-MPL、曲通X-100、吐温80和脱氧胆酸钠,其可与抗原制剂组合以提供适于皮内应用的疫苗。在一些方面中,在本发明的一个优选情况中,皮内疫苗包含囊泡佐剂制剂。因此,在一些方面中,优选的佐剂制剂包含大单室囊泡,其包含胆固醇,具有优选包含二油酰磷脂酰胆碱的脂双层,其中皂苷和LPS衍生物与脂双层关联或包埋于其中。在一些方面中,更优选地,这些佐剂制剂包含QS21作为皂苷,3D-MPL作为LPS衍生物,其中QS21:胆固醇的比例为1:1-1:100质量/质量,并且最优选1:5质量/质量。该佐剂制剂如EP0822831B所述,其公开纳入本文作为参考。有时,本文所述疫苗还可包含选自下组的佐剂:细菌类毒素、非毒素蛋白、蛋白质体、聚氧丙烯-聚氧乙烯嵌段聚合物、脂质体、CpG聚合物、水包油乳液、或其组合。示例性的细菌类毒素包括霍乱弧菌(Vibriocholerae)(CT)的毒素、大肠杆菌(E.coli)的毒素(HLT)、百日咳(Pertussigenpertussis)的毒素(PT)、艰难梭状芽胞杆菌(Clostridiumdifficile)的毒素A和毒素B、志贺痢疾菌(Shigadysenteriae)的志贺毒素(STx)、或金黄色葡萄球菌(Staphylococcalaureus)的肠毒素。非毒素蛋白可包括胞壁酰二肽(MDP)(N-乙酰胞壁酰-L-丙氨酰-D-异谷氨酰胺)。在一些情况中,MDP源自分枝杆菌的细胞壁,并且是IL-1的诱导物,可以活化巨噬细胞和T细胞。蛋白质体可包括脑膜炎球菌外膜蛋白质,其可引发抗毒素IgA应答。其他基于蛋白质体的佐剂可包括Protollin。脂质体可包括脂质A(LA)、单磷酰脂质A(MPL)、阳离子脂质体例如二甲基双十八烷基溴化铵(DDA)、1,2-二酰基-sn-甘油-3-乙基磷酸胆碱(eDPPC)、或3β-[N-(N',N'-二甲基氨基乙烷)-氨甲酰基]胆固醇(DC-Chol)、或中性磷脂例如1,2-二棕榈酰-sn-甘油-3-磷酸酯(DPPC)。CpG聚合物可包括含未甲基化CpG双核苷酸的寡脱氧核苷酸聚合物,其可对免疫系统产生显著刺激影响。有时,佐剂是水包油乳液。水包油乳液可包含至少一种油和至少一种表面活性剂,其中所述油和表面活性剂是生物可降解的(可代谢)且生物相容的。乳液中的油滴直径通常小于5μm,甚至可具有亚微米直径,通过微流化床实现这种小尺寸以提供稳定乳剂。优选尺寸小于220nm的液滴,因为其可进行过滤灭菌。使用的油可包括如动物(如鱼)或植物来源的油。植物油的来源可包括坚果、种籽和谷物。最常见的坚果油的示例有花生油、大豆油、椰子油和橄榄油。可以采用例如获自霍霍巴豆的霍霍巴油。种籽油包括红花油、棉花籽油、葵花籽油、芝麻籽油等。谷物组可包括:玉米油和其它谷类如小麦、燕麦、裸麦、稻、画眉草、黑小麦等的油。甘油和1,2-丙二醇的6-10碳脂肪酸酯虽然不天然存在于种籽油中,但可从坚果和种籽油开始,通过水解、分离和酯化合适物质来制备。来自哺乳动物乳液的脂肪和油可以是可代谢的并且因此可用于本文所述的疫苗中。获得动物来源的纯油所必需的分离、纯化、皂化和其它方法的过程是本领域中熟知的。鱼类可含有容易回收的可代谢油。例如,可用于本文的鱼油的几种示例有鳕鱼肝油、鲨鱼肝油和鲸油(诸如鲸蜡)。可通过生化途径以5-碳异戊二烯单位合成许多支链油,其总称为萜类。鲨鱼肝油含有称为角鲨烯的支链不饱和萜类化合物,2,6,10,15,19,23-六甲基-2,6,10,14,18,22-二十四碳六烯。也可采用角鲨烯的饱和类似物角鲨烷。包括角鲨烯和角鲨烷在内的鱼油易于从市售来源获得,或可以通过本领域已知的方法获得。其他可用的油包括生育酚,其可包括在用于老年患者(如年龄在60岁以上的患者)的疫苗中,因为据报道维生素E在此患者群体中对免疫应答有正面作用。另外,生育酚具有抗氧化特性,这种特性有助于稳定该乳液。存在各种生育酚(α、β、γ、δ、ε或ξ),但通常使用α-生育酚。α-生育酚的示例是DL-α-生育酚。琥珀酸α-生育酚与癌症疫苗相容,并且是有用的替代含汞化合物的防腐剂。可使用油混合物,例如,角鲨烯和和α-生育酚。可使用的油含量为2-20%(体积)。表面活性剂可以按其“HLB”(亲水/亲脂平衡)分类。在一些情况中,表面活性剂的HLB为至少10、至少15、和/或至少16。表面活性剂可包括,但不限于:聚氧乙烯脱水山梨糖醇酯表面活性剂(通常称为吐温),特别是聚山梨酯20和聚山梨酯80;以商品名DOWFAXTM出售的环氧乙烷(EO)、环氧丙烷(PO)和/或环氧丁烷(BO)的共聚物,如直链EO/PO嵌段共聚物;重复乙氧基(氧-1,2-乙二基)数量不同的辛苯聚醇,特别感兴趣的是辛苯聚醇9(曲通(Triton)X-100或叔辛基苯氧基聚乙氧基乙醇);(辛基苯氧基)聚乙氧基乙醇(IGEPALCA-630/NP-40);磷脂,如磷脂酰胆碱(卵磷脂);壬酚乙醇酯,如特吉托(Tergitol)TMNP系列;衍生自月桂醇、鲸蜡醇、硬脂醇和油醇的聚氧乙烯脂肪醚(称为苄泽(Brij)表面活性剂),如三乙二醇单月桂基醚(苄泽30);以及脱水山梨糖醇酯(通常称为司盘(SPAN)),如脱水山梨糖醇三油酸酯(司盘85)和脱水山梨糖醇单月桂酸酯。本文中可使用非离子型表面活性剂。可使用表面活性剂的混合物,如吐温80/司盘85混合物。聚氧乙烯失水山梨糖醇酯和辛苯聚醇的组合也是合适的。另一种组合包括月桂醇聚醚-9加聚氧乙烯山梨糖醇酯和/或辛苯聚醇。表面活性剂的量(重量%)可以是:聚氧乙烯失水山梨糖醇酯(如吐温80)0.01-1%,特别是约0.1%;辛基-或壬基-苯氧基聚氧乙醇(如曲通X100或曲通系列的其它去污剂)0.001-0.1%,特别是0.005-0.02%;聚氧乙烯醚(如月桂醇聚醚9)0.1-20%,优选0.1-10%,特别是0.1-1%或约0.5%。示例性水包油乳液佐剂可包括但不限于:角鲨烯、聚山梨酯80和山梨糖醇三油酸酯的亚微米乳剂。所述乳液的体积组成可以是约5%角鲨烯、约0.5%聚山梨酯80和约0.5%司盘85。以重量计,这些比例为4.3%角鲨烯、0.5%聚山梨酯80和0.48%司盘85。这种佐剂称为“MF59”。MF59乳液宜包含柠檬酸根离子,如10mM柠檬酸钠缓冲液。角鲨烯、生育酚和聚山梨酯80的亚微米乳液。这些乳剂可含有2-10%角鲨烯、2-10%生育酚和0.3-3%聚山梨酯80,且角鲨烯:生育酚的重量比优选≤1(例如0.90),因为这能提供更稳定的乳剂。角鲨烯和聚山梨酯80的体积比可以约为5:2,或者重量比约为11:5。可通过下述方法制备一种这样的乳液:将吐温80溶解于PBS得到2%溶液,然后将90ml该溶液与5gDL-α-生育酚和5ml鲨烯的混合物混合,然后使该混合物微流体化。所得乳液含有如平均直径为100-250nm,优选约180nm的亚微米油滴。该乳液也可含有3-脱-O-酰化单磷酰脂质A(3d-MPL)。此种类型的另一有用乳液可包含(每人剂量)0.5-10mg角鲨烯、0.5-11mg生育酚和0.1-4mg聚山梨酯80。角鲨烯、生育酚和曲通去污剂(如曲通X-100)的乳液。该乳液还可包含3d-MPL(见下文)。该乳液可包含磷酸盐缓冲液。含有聚山梨酯(如聚山梨酯80)、曲通去污剂(如曲通X-100)和生育酚(如α-生育酚琥珀酸盐)的乳液。该乳液可包含这三种组分,其质量比约为75:11:10(如750μg/ml聚山梨酯80、110μg/ml曲通X-100和100μg/ml琥珀酸α-生育酚),这些浓度应包括抗原中这些组分的贡献。该乳液还可包含角鲨烯。该乳液也可包含3d-MPL。水相可包含磷酸盐缓冲液。角鲨烷、聚山梨酯80和泊洛沙姆401(“PluronicTML121”)的乳液。该乳液可用pH7.4的磷酸盐缓冲盐水配制。该乳液是一种有用的胞壁酰二肽递送载体,且可与含苏氨酰基-MDP的“SAF-1”佐剂(0.05-1%Thr-MDP、5%角鲨烯、2.5%普流罗尼克L121和0.2%聚山梨酸酯80)一起使用。也可不与Thr-MDP一起使用,例如用“AF”佐剂(5%角鲨烯、1.25%普流罗尼克L121和0.2%聚山梨酸酯80)。含有角鲨烯、水溶剂、聚氧乙烯烷基醚亲水性非离子型表面活性剂(如聚氧乙烯(12)十六十八醚)和疏水性非离子型表面活性剂(如失水山梨糖醇酯或二缩甘露醇酯,如失水山梨糖醇单油酸酯或“司盘80”)的乳液。该乳液可为热可逆的和/或其中至少90%油滴(以体积计)的尺寸小于200nm。乳液也可包含以下的一种或多种:糖醇;低温保护剂(例如糖,如十二烷基麦芽苷和/或蔗糖);和/或烷基聚糖苷。该乳液可包含TLR4激动剂。可将这类乳液冻干。角鲨烯、泊洛沙姆-105和Abil-Care的乳液。含佐剂化疫苗中这些组分的终浓度(重量)可以是5%角鲨烯、4%泊洛沙姆-105(普流罗尼克多元醇)和2%Abil-Care85(双-PEG/PPG-16/16PEG/PPG-16/16二甲硅油;辛酸/癸酸甘油三酯)。含有0.5-50%油、0.1-10%磷脂和0.05-5%非离子型表面活性剂的乳液。磷脂组分可包括磷脂酰胆碱、磷脂酰乙醇胺、磷脂酰丝氨酸、磷脂酰肌醇、磷脂酰甘油、磷脂酸、鞘磷脂和心磷脂。优选亚微米液滴尺寸。不可代谢油(如轻质矿物油)和至少一种表面活性剂(如卵磷脂、吐温80或司盘80)的亚微米水包油乳液。添加剂可包括,例如QuilA皂苷、胆固醇、皂苷-亲脂偶联物(如通过葡糖醛酸的羧基将脂族胺加到脱酰基皂苷上而产生的GPI-0100)、二甲基双十八烷基溴化铵和/或N,N-双十八烷基-N,N-双(2-羟乙基)丙二胺。运载体和赋形剂本发明还提供生产疫苗制剂的方法,所述方法包括混合疫苗组分与药物可接受赋形剂的步骤。在一些方面中,优选表面活性剂包括辛基苯氧基聚氧基乙醇和聚氧乙烯失水山梨糖醇酯,如Attwood和Florence编的《表面活性剂体系》(SurfactantSystems)(1983,ChapmanandHall)中所述。辛基苯氧基聚氧基乙醇(辛苯聚醇)包括叔辛基苯氧基聚乙氧基乙醇(曲通X-100TM),也描述于《默克索引条目》(MerckIndexEntry)6858(第1162页,第12版,Merck&Co.Inc.,WhitehouseStation,N.J.,USA;ISBN0911910-12-3)。聚氧乙烯失水山梨糖醇酯包括聚氧乙烯失水山梨糖醇单酯(吐温80TM),也描述于《默克索引条目》(MerckIndexEntry)7742(第1308页,第12版,Merck&Co.Inc.,WhitehouseStation,N.J.,USA;ISBN0911910-12-3)。两者都可使用本文所述的方法制备,或购自市售来源如西格玛公司(SigmaInc)。在一些方面中,特别优选的非离子型表面活性剂包括曲通X-45、叔辛基苯氧基-聚乙氧基乙醇(曲通X-100)、曲通X-102、曲通X-114、曲通X-165、曲通X-205、曲通X-305、曲通-57、曲通-101、曲通-128、Breij35、聚氧乙烯-9-月桂基醚(laureth9)和聚氧乙烯-9-硬脂醇醚(steareth9)。在一些方面中,特别优选曲通X-100和laureth9。在一些方面中,还特别优选聚氧乙烯失水山梨糖醇酯,聚氧乙烯失水山梨糖醇单油酸酯(Tween80TM)。在一些方面中,其他合适的通式聚氧乙烯醚选自:聚氧乙烯-8-硬脂醇醚、聚氧乙烯-4-月桂基醚、聚氧乙烯-35-月桂基醚、和聚氧乙烯-23-月桂基醚。聚氧乙烯月桂基醚的其他术语或名称描述于CAS登记中。聚氧乙烯-9-月桂基醚的CAS登记号是9002-92-0。聚氧乙烯醚如聚氧乙烯月桂基醚描述于默克索引中(第12版:条目7717,Merck&Co.Inc.,WhitehouseStation,N.J.,USA;ISBN0911910-12-3)。通过将环氧乙烷与十二烷醇反应来形成Laureth9,并且其具有平均9个环氧乙烷单元。表面活性剂中聚氧乙烯部分的长度与烷基链的长度之比(即,n:烷基链长度之比)影响了这类表面活性剂在水性介质中的溶解性。因此,在一些方面中,本发明的表面活性剂在溶液中或形成颗粒结构例如胶束或囊泡。作为溶液,本发明的表面活性剂是安全的,易于灭菌,并且给药简便,并且可以简单方式制备,而不没有与均匀颗粒结构形成相关的GMP和QC问题。一些聚氧乙烯醚,如laureth9能够形成非囊泡溶液。然而,聚氧乙烯-8棕榈酰醚(C18E8)能够形成囊泡。因此,在一些方面中,聚氧乙烯-8棕榈酰醚与至少一种其他非离子型表面活性剂组合的囊泡用于本发明的制剂中。在这种生物试验的固有实验误差内,本发明的通式(I)的聚氧乙烯醚或表面活性剂在一些方面中优选具有溶血活性,为约0.5-0.0001%,更优选0.05-0.0001%,更优选0.005-0.0001%,并且最优选0.003-0.0004%。在一些方面中,理想地,所述聚氧乙烯醚或酯应该具有与聚氧乙烯-9月桂基醚或聚氧乙烯-8硬脂醇醚相似的溶血活性(即,在10倍差异内)。在一些方面中,来自不同组所述表面活性剂的2种或更多种非离子型表面活性剂存在于本文所述的疫苗制剂中。具体地,在一些方面中,优选聚氧乙烯去水山梨糖醇酯如聚氧乙烯去水山梨糖醇单油酸酯(吐温80TM)和辛苯聚糖如叔辛基苯氧基聚乙氧基乙醇(曲通)X-100TM的混合物。在其他方面中,其他特别优选的非离子型表面活性剂的组合包含laureth9加上聚氧乙烯失水山梨糖醇酯或辛苯聚醇或两者。在一些方面中,优选地,各非离子型表面活性剂以0.001至20%,更优选0.01至10%,并且最优选高至2%(w/v)的浓度存在于最终疫苗制剂中。在一些方面中,在存在一种或两种表面活性剂的情况中,通常以各高至约2%,一般以各高至约0.6%的浓度存在于最终制剂中。在一些方面中,存在一种或多种其他表面活性剂,通常各高至约1%的浓度,并且一般各高至约0.2%或0.1%的痕量。在一些方面中,表面活性剂的任意混合物存在于本发明的疫苗制剂中。在一些方面中,如上所述那些的非离子型表面活性剂在最终疫苗组合物中具有以下的优选浓度:聚氧乙烯失水山梨糖醇酯如吐温80TM:0.01至1%,最优选约0.1%(w/v);辛基-或壬基苯氧基聚氧乙醇如曲通X-100TM或曲通系列的其它去污剂:0.001至0.1%,最优选0.005至0.02%(w/v);通式(I)的聚氧乙烯醚如laureth9:0.1至20%,优选0.1至10%并且最优选0.1至1%或约0.5%(w/v)。在一些方面中,其他试剂也存在于制剂中。因此,在一些方面中,本发明制剂还包含胆酸或其衍生物,尤其是其盐形式。这些包括胆酸衍生物及其盐,尤其是胆酸或胆酸衍生物的钠盐。胆汁酸及其衍生物的示例包括胆酸、脱氧胆酸、鹅脱氧胆酸、石胆酸、乌索脱氧胆酸、猪脱氧胆酸和衍生物如前述胆汁酸的糖-、牛磺-、氨基丙基-1-丙磺酸-、氨基丙基-2-羟基-l-丙磺酸-衍生物,或N,N-双(3D葡糖氨基丙基)脱氧胆胺。在一些方面中,特别优选的示例是脱氧胆酸钠(NaDOC),其存在于最终疫苗制剂中。也可采用熟知技术将组合物包封在脂质体中。生物可降解微球也可用作本发明的药物组合物的运载体。合适的生物可降解微球公开于例如美国专利号4,897,268、5,075,109、5,928,647、5,811,128、5,820,883、5,853,763、5,814,344和5,942,252。可将组合物给予至脂质体或微球(或微颗粒)中。制备用于给予患者的脂质体和微球的方法是本领域技术人员所熟知的。美国专利号4,789,734描述了将生物材料包封到脂质体中的方法,其内容通过引用纳入本文。具体地,材料溶于水性溶液中,加入合适的磷脂和脂质以及需要的表面活性剂,并且在需要时透析或超声处理材料。G.Gregoriadis,第14章,“脂质体”,《生物学和医学中的药物运载体》(DrugCarriersinBiologyandMedicine),第2页.sup.87-341(学术出版社,1979)提供了已知方法的综述。由聚合物或蛋白质形成的微球是本领域技术人员所熟知的,并且可经调整用于通过胃肠道直接进入血流。或者,可纳入化合物并且可植入微球或微球复合物来在从数天到数月的时间段内缓释。例如,参加美国专利4,906,474、4,925,673和3,625,214,和Jein,TIPS19:155-157(1998),其内容被纳入本文作为参考。组合物可含有防腐剂,如硫柳汞或2-苯氧乙醇。在一些情况中,疫苗基本不含(例如,<10μg/ml)含汞物质,例如不含硫柳汞。琥珀酸α-生育酚可用作含汞化合物的替代物。为了控制张力,疫苗中可包括生理盐如钠盐。其他盐可包括氯化钾、磷酸二氢钾、磷酸氢二钠、和/或氯化镁等。组合物可具有200mOsm/kg至400mOsm/kg,240至360mOsm/kg或290至310mOsm/kg范围内的渗透压。组合物可包含一种或多种缓冲剂,如Tris缓冲剂;硼酸盐缓冲剂;琥珀酸盐缓冲剂;组氨酸缓冲剂(具体是有氢氧化铝佐剂时);或柠檬酸盐缓冲剂。在一些情况中,包含的缓冲剂的浓度一般为5-20mM的范围。组合物的pH可以是约5.0至约8.5、约6.0至约8.0、约6.5至约7.5、或约7.0至约7.8。组合物可以无菌。该疫苗可无热原,如小于1EU/剂量(内毒素单位,标准量度),并且可小于0.1EU/剂量。该组合物可不含谷蛋白。组合物可包含去污剂,如聚氧乙烯去水山梨糖醇酯表面活性剂(称为“吐温”)、辛苯聚醇(如辛苯聚醇-9(曲通X-100)或叔辛基苯氧基聚乙氧基乙醇)、溴化十六烷基三甲铵(“CTAB”)或脱氧胆酸钠,特别适用于裂解疫苗或表面抗原疫苗。去污剂可仅以痕量存在。因此,疫苗中可包含各自的含量小于1mg/ml的辛苯聚醇-10和聚山梨醇酯80。其它痕量残留组分可以是抗生素(如新霉素、卡那霉素、多粘菌素B)。组合物可配制成无菌溶液或悬液,合适载剂,如本领域所熟知。药物组合物可通过熟知的常规灭菌技术灭菌,或可经无菌过滤。所得水性溶液可经包装用于原样(as-is)使用,或经冻干,冻干的制剂在给予之前与无菌溶液合并。合适的制剂和其他运载体描述于《雷明顿:药物科学和实践》(Remington:TheScienceandPracticeofPharmacy)(第20版,LippincottWilliams&Wilkins,BaltimoreMd.),其通过引用全文纳入本文。可用一种或多种药学上可接受的盐来配制组合物。药学上可视的盐可包括无机离子的那些,例如,钠、钾、钙、镁离子等。这类盐可包括无机或有机酸,如盐酸、氢溴酸、磷酸、硝酸、硫酸、甲磺酸、对甲苯磺酸、乙酸、富马酸、琥珀酸、乳酸、扁桃酸、苹果酸、柠檬酸、酒石酸或马来酸的盐。另外,如果试剂含有羧基或其他酸性基团,其可被转化成与无机或有机碱的药学上可接受的加成盐。合适的碱的示例包括氢氧化钠、氢氧化钾、氨、环己胺、二环己基、乙醇胺、二乙醇胺、三乙醇胺等。加成盐可包含胆汁酸或其衍生物。这些包括胆酸衍生物及其盐,尤其是胆酸或胆酸衍生物的钠盐。胆汁酸及其衍生物的示例包括胆酸、脱氧胆酸、鹅脱氧胆酸、石胆酸、乌索脱氧胆酸、猪脱氧胆酸和衍生物如前述胆汁酸的糖-、牛磺-、氨基丙基-1-丙磺酸-、氨基丙基-2-羟基-l-丙磺酸衍生物,或N,N-双(3D葡糖氨基丙基)脱氧胆胺。特别优选的示例是脱氧胆酸钠(NaDOC),其可存在于最终疫苗制剂中。本文所述包含活性佐剂如肽或核酸与一种或多种佐剂的组合物可使用一种或多种生理上可接受的运载体,包括赋形剂、稀释剂和/或助剂以常规方式配制,例如,其促进将活性剂加工成可给予的制剂。合适的试剂可至少部分取决于所选的给药途径。可使用多种给药途径或模式来递送本文所述的试剂,包括,口服、口颊、局部、直肠、透皮、粘膜、皮下、静脉内、和肌内应用,以及通过吸入。活性剂也可配制用于胃肠外给药(例如注射,如推注或连续输注),并可制成单位剂型装在安瓿、预填充注射器、小体积输液瓶或加入防腐剂的多剂量容器中。组合物可采取这类形式,如油性或水性载剂中的悬液、溶液或乳液,例如,水性聚乙二醇中的溶液。对于注射制剂,载剂可选自本领域已知的合适的那些,包括水性溶液或油悬液,或乳液,以及芝麻油、玉米油、棉籽油或花生油,以及酏剂、甘露醇、右旋糖或无菌水溶液,和类似的药物载剂。制剂还可包含聚合物组合物,其是生物相容的或可生物降解的,如聚(乳酸-共-乙醇酸)。这些材料可制成微球或纳米球,加载药物并且进一步涂覆或衍生化以产生优异的持续释放性质。适用于眼周或眼内注射的载剂包括,例如,在注射级水、脂质体和适于亲脂性物质的载剂中的治疗剂悬液。用于眼周或眼内注射的其他载剂为本领域所熟知。在一些情况中,按照常规方法将组合物配制成适合静脉内给予人类的药物组合物。静脉内给予的组合物通常是溶于无菌等渗水性缓冲液的溶液。如果需要,组合物也可含有增溶剂和局部麻醉剂(如利多卡因)来减轻注射部位的疼痛。通常,各成分单独提供或混合在一起以单位剂型的形式提供,例如作为标明活性物质含量的密封容器(如安瓿或药囊)中的冻干粉末或无水浓缩物。通过输液给予该组合物时,可用含有无菌药物级水或盐水的输液瓶分配该组合物。通过注射给予该组合物时,可提供一安瓿的无菌注射用水或盐水,以便在给药前与药物成分混合。当通过注射给药时,活性试剂可配制在水溶液中,具体在生理相容性缓冲液中,如汉克斯溶液、林格溶液或生理盐水缓冲液。该溶液可包含配制剂,如助悬剂、稳定剂和/或分散剂。或者,活性化合物可以是使用前用合适的运载体如无菌无热原的水进行重建的粉末形式。在另一个实施方式中,药物组合物不包含用于添加以强化由肽刺激的免疫应答的佐剂或任何其他物质。在另一个实施方式中,药物组合物包含抑制对肽的免疫应答的物质。配制的方法为本领域所知,例如,如最新版的《雷明顿药物科学》,马克出版公司(MackPublishingCo.),EastonP中所述。除上述制剂外,活性试剂也可配制成长效制剂。这种长效制剂可通过植入或经皮递送(例如,皮下或肌内),肌内注射或使用透皮贴片来给予。因此,例如,试剂也可与合适的聚合物材料或疏水材料(例如,用可接受的油配制成乳剂)或离子交换树脂配制在一起,或者配制成微溶性衍生物,例如,微溶性盐。在一些情况中,包含一种或多种试剂的组合物在局部给予或者在特定注射位点处或附近注射时显示出局部和区域性效果。粘稠液体、溶液、悬液、二甲亚砜(DMSO)-基溶液、脂质体制剂、凝胶、胶状物、霜、乳液、油膏、栓剂、泡沫、或气溶胶喷雾的直接局部施用可用于局部给药,以产生例如局部和/或区域性效果。用于这种配制的药学上的合适载剂包括,例如,低级脂肪醇、多元醇(例如,甘油,或聚乙二醇)、脂肪酸的酯、油、脂肪、硅酮等。这类制备物也可包括防腐剂(例如,对羟基苯甲酸酯)和/或抗氧化剂(例如,抗坏血酸和生育酚)。也参见《皮肤病制剂:经皮吸收》(DermatologicalFormulations:Percutaneousabsorption),Barry(编),MarcelDekkerIncl,1983。在另一个实施方式中,包含转运剂、运载体、或离子通道抑制剂的局部制剂可用于治疗表皮或粘膜病毒感染。组合物可含有美容或皮肤可接收的运载体。这类运载体与皮肤、指甲、粘膜、组织和/或头发相容,并且可包括满足这些要求的任何常用美容或皮肤运载体。本领域普通技术人员可易于选择这类运载体。在配制皮肤油膏中,可在油性烃类基、水性吸收基、油包水吸收基、水包油水可去除基和/或水溶基中配制试剂或试剂组合。这类运载体和赋形剂的示例包括但不限于致湿剂(例如,尿素)、二醇(例如,聚乙二醇)、醇(例如,乙醇)、脂肪酸(例如,油酸)、表面活性剂(例如,肉豆蔻酸异丙酯和月桂基硫酸钠)、吡咯烷酮、单月桂酸甘油酯、亚砜、萜烯(例如,薄荷醇)、胺、酰胺、烷烃、烷醇、水、碳酸钙、磷酸钙、各种糖、淀粉、纤维素衍生物、明胶、和聚合物如聚乙二醇。可用水性或油性基料,加入合适的增稠剂和/或凝胶剂来配制软膏剂和乳膏剂。洗剂可用水性或油性基料配制,且通常还含有一种或多种乳化剂、稳定剂、分散剂、悬浮剂、增稠剂或着色剂。用于递送药物试剂的透皮贴片的构建和使用是本领域所熟知的。参见美国专利5,023,252、4,992,445和5,001,139。可构建这类贴片用于连续、脉冲或根据需要递送药物试剂。可用于形成药物组合物和剂型的润滑剂包括但不限于,硬脂酸钙、硬脂酸镁、矿物油、轻矿物油、甘油、山梨醇、甘露醇、聚乙二醇、其它二醇、硬脂酸、十二烷基硫酸钠、滑石、氢化植物油(例如,花生油、棉籽油、葵花油、芝麻油、橄榄油、玉米油和大豆油)、硬脂酸锌、油酸乙酯、月桂酸乙酯、琼脂或其混合物。其他润滑剂包括,例如,塞罗得(syloid)硅胶、合成氧化硅的凝结气溶胶、或其混合物。润滑剂可任选地以小于药物组合物的约1重量%的量添加。组合物可以是适于局部施用的任意形式,包括水性、水性-醇或油性溶液、乳液或血清分散体、水性、无水或油性凝胶、通过将脂肪相分散到水相中获得的乳液(O/W或水包油),或者相反(W/O或油包水)、微乳液或者微囊、微粒或者离子型和/或非离子型的脂质载剂分散体。可按照常规方法来制备这些组合物。除了本发明的试剂以外,本发明的组合物的各种组分的量按照本领域常规选择。这些组合物具体构成用于面部、手、身体和/或粘膜,或用于清洁皮肤的保护、治疗或护理油膏、乳、乳液或泡沫。组合物也可由构成肥皂或清洁皂的固体制备物组成。组合物可含有佐剂,如亲水性或亲脂性胶凝剂、亲水性或亲脂性活性剂、防腐剂、抗氧化剂、溶剂、芳香剂、填充剂、防晒剂、除臭剂和染料。这些佐剂的量是用于所考虑领域中的常规的量,例如,组合物总重量的约0.01%至约20%。根据其性质,这些佐剂可导入脂肪相,导入水性和/或导入脂质囊泡中。就口服给药而言,通过组合所述活性试剂和本领域熟知的药学上可接受载体能容易地配制所述活性试剂。能使本发明试剂配制为例如片剂(包括咀嚼片)、丸剂、糖衣剂、胶囊、锭剂、硬糖、液体、凝胶、糖浆、浆液、粉末、混悬液、酏剂、薄片等,所述制剂由待治疗的患者口服咽下。这类制剂可包含药学上可接受的运载体,包括固体稀释剂或填充剂、无菌水性介质和各种无毒性有机溶剂。固体运载体可为一种或多种还能用作稀释剂、调味剂、稳定剂、润滑剂、助悬剂、粘合剂、防腐剂、片剂崩解剂、或包封材料的物质。在粉末剂中,运载体一般是细碎的固体,其与细碎的活性组分混合。在片剂中,所述活性组分一般与具有所需结合能力的运载体以合适比例混合并压缩为所需的形状和大小。含有占活性化合物的约1%至约70%的粉末和片剂。合适的运载体包括但不限于碳酸镁、硬脂酸镁、滑石、糖、乳糖、果胶、糊精、淀粉、明胶、黄蓍胶、甲基纤维素、羧甲基纤维素钠、低熔点蜡、可可油等。一般而言,包括占口服剂型的总组合物重量的约0.5%、约5%、约10%、约20%、或约30%至约50%、约60%、约70%、约80%或约90%的活性试剂,其量足以提供所需的单位剂量。口服使用的水性悬液可含有活性试剂和药学上可接受的赋形剂,如悬浮剂(例如,甲基纤维素)、润湿剂(例如,卵磷脂、溶血卵磷脂和/或长链脂肪醇)、以及着色剂、防腐剂、风味剂等。可能需要油或非水性溶剂来将活性试剂带入溶液中,由于,例如,存在大亲脂性部分。或者,可使用乳液、悬液或其他制备物,例如,脂质体制备物。对于脂质体制备物,可使用制备用于治疗病症的脂质体的任何已知方法。参见,例如,Bangham等,J.Mol.Biol.23:238-252(1965)和Szoka等,Proc.Natl.Acad.Sci.USA75:4194-4198(1978),通过引用纳入本文。配体也可连接至脂质体以引导这些组合物至特定作用位点。可通过以下方法获得口服用途的药物制剂:以固体赋形剂,任选地研磨所得混合物,并在加入合适的辅助剂(如果需要)后加工该颗粒混合物,以获得片剂或糖衣丸芯体。合适的赋形剂是,具体地,填充剂如糖,包括乳糖、蔗糖、甘露醇或山梨醇;风味元素,纤维素制品例如玉米淀粉、小麦淀粉、水稻淀粉、马铃薯淀粉、明胶、黄蓍胶、甲基纤维素、羟丙基甲基纤维素、羧甲基纤维素钠和/或聚乙烯吡咯烷酮(PVP)。如果需要,可加入崩解剂,例如交联聚乙烯吡咯烷酮、琼脂、或藻酸或其盐如藻酸钠。试剂也可配制成缓释制剂。糖衣剂芯体能具有合适包衣。出于这种目的,可使用浓缩糖溶液,其可任选地含有阿拉伯胶、滑石、聚乙烯吡咯烷酮、卡波姆凝胶、聚乙二醇和/或二氧化钛、漆溶液和合适的有机溶剂或溶剂混合物。可将染料或颜料加入片剂或糖衣剂包衣中,用于标识或表征活性试剂的不同组合。可口服使用的药物制剂包括明胶制成的推入式(push-fit)胶囊,以及明胶和增塑剂(如甘油或山梨糖醇)制成的密封软胶囊。推入式胶囊可含有活性成分,该活性成分可混合填充剂如乳糖、粘合剂如淀粉和/或润滑剂如滑石粉或硬脂酸镁以及任选的稳定剂。在软胶囊中,活性试剂可溶解或悬浮于合适液体如脂肪油、液体石蜡或液体聚乙二醇中。此外可加入稳定剂。所有的口服给予制剂的剂量应该适于给药方式。适于口服给药的其他形式包括液体形式制备物,包括乳液、糖浆、酏剂、水溶液、水性悬液、或固体形式制备物,其可在使用前短期内转换成液体形式制备物。乳液可制备成溶液,例如,水性聚乙二醇溶液或者可含有乳化剂,例如,卵磷脂、失水山梨糖醇单油酸酯或阿拉伯胶。可通过将活性组分溶解于水中并添加合适的着色剂、调味剂、稳定剂和增稠剂来制备水溶液。水性悬液可通过用粘性材料将细碎活性组分分散于水中制备,所述粘性材料如天然或合成树胶、树脂、甲基纤维素、羧甲基纤维素钠的和其他熟知的悬浮剂。可与组合物一起给予的合适填充剂或运载体包括以合适量使用的糖、醇、脂肪、乳糖、淀粉、纤维素衍生物、多糖、聚乙烯吡咯烷酮、氧化硅、无菌盐水等,或其混合物。除活性组分外,固体形式制备物包括溶液、悬液和乳液并且可含有着色剂、调味剂、稳定剂、缓冲剂、人工和天然甜味剂、分散剂、增稠剂、增溶剂等。可通过向糖,例如蔗糖的浓缩水性溶液(其中可添加任何助剂)中添加活性化合物来制备糖浆或悬液。这类助剂可包括风味剂,阻止糖或试剂结晶以增加任意其他成分溶解性的试剂,例如,多元醇,例如,甘油或山梨糖醇。当配制用于口服给药的化合物时,需要采用胃滞留制剂来增强胃肠(GI)道吸收。在胃中滞留几个小时的制剂可缓慢释放本发明的化合物并提供可在本文中使用的缓释。这类胃滞留制剂的内容发现于Klausner,E.A.;Lavy,E.;Barta,M.;Cserepes,E.;Friedman,M.;Hoffman,A.2003“新胃滞留剂型:人中胃滞留性及其对左旋多巴影响的评估(Novelgastroretentivedosageforms:evaluationofgastroretentivityanditseffectonlevodopainhumans).”Pharm.Res.20,1466-73,Hoffman,A.;Stepensky,D.;Lavy,E.;Eyal,S.Klausner,E.;Friedman,M.2004“胃滞留剂型的药代动力学和药效方面(Pharmacokineticandpharmacodynamicaspectsofgastroretentivedosageforms)”Int.J.Pharm.11,141-53,Streubel,A.;Siepmann,J;Bodmeier,R.;2006“胃滞留药物递送系统(Gastroretentivedrugdeliverysystems)”ExpertOpin.DrugDeliver.3,217-3,和Chavanpatil,M.D.;Jain,P.;Chaudhari,S.;Shear,R.;Vavia,P.R.“用于氟嗪酸的新缓释可吞咽且生物粘附胃滞留药物递送系统(Novelsustainedrelease,swellableandbioadhesivegastroretentivedrugdeliverysystemforolfoxacin)”Int.J.Pharm.2006epub3月24日。可采用可膨胀浮动生物粘附技术来最大化本发明化合物的吸收。可通过组合物中的表面活性剂或其他合适的助溶剂来增强组合物组分的溶解性。这类助溶剂包括聚山梨酯20、60和80,普流罗尼克F68、F-84和P-103,环糊精,或本领域技术人员已知的其他试剂。通常约在0.01-2重量%的水平上使用这些助溶剂。可以多剂形式包装组合物。防腐剂可优选用于防止使用期间的微生物污染。合适的药剂包括:苯扎氯铵、硫柳汞、氯代丁醇、对羟基苯甲酸甲酯、对羟基苯甲酸丙酯、苯乙醇、乙二胺四乙酸二钠、山梨酸、OnamerM、或其他本领域技术人员已知的试剂。在现有技术的眼科产品中,这类防腐剂可以0.004%至0.02%的水平采用。在本发明的组合物中,防腐剂,优选苯扎氯铵可以0.001重量%至小于0.01重量%,例如0.001重量%至0.008重量%,优选约0.005重量%的水平使用。已经发现0.005%的苯扎氯铵浓度足够保护本发明的组合物免受微生物攻击。在与局部施用相关的情况中,组合物可包括一种或多种渗透增强剂。例如,制剂可包含合适的固相或凝胶相运载体或赋形剂,其增加了渗透并有助于本发明的试剂或试剂组合递送通过渗透屏障,例如,皮肤。许多这类渗透增强化合物是局部制剂领域技术人员已知的,并且包括,例如,水、醇(例如,萜烯如甲醇、乙醇、2-丙醇),亚砜(例如,二甲亚砜、癸基甲基亚砜、四癸基甲基亚砜),吡咯烷酮(例如,2-吡咯烷酮、N-甲基-2-吡咯烷酮、N-(2-羟乙基)吡咯烷酮),月桂氮卓酮,丙酮,二甲基乙酰胺,二甲基甲酰胺,四氢糠醇,L-α-氨基酸,阴离子、阳离子、两性或非离子型表面活性剂(例如,肉豆蔻酸异丙酯和月桂基硫酸钠),脂肪酸,脂肪醇(例如,油酸),胺,酰胺,氯贝酸酰胺,六亚甲基月桂酰胺,蛋白水解酶,α-没药醇,d-柠檬烯,尿素和N,N-二乙基-间-甲苯酰胺等。其他示例包括致湿剂(例如,尿素)、二醇(例如,丙二醇和聚乙二醇)、单月桂酸甘油酯、烷烃、烷醇、水、ORGELASE、碳酸钙、磷酸钙、各种糖、淀粉、纤维素衍生物、明胶和/或其他聚合物。在另一个实施方式中,组合物可包含一种或多种这类渗透增强剂。局部施用的组合物可包含一种或多种抗微生物防腐剂,如季铵化合物、有机汞、对羟基苯甲酸、芳族醇、氯丁醇等。组合物可配制成气溶胶溶液、悬液或干粉。可通过呼吸系统或鼻通道来给予气溶胶。例如,本领域技术人员将认识到本发明的组合物可在合适运载体中悬浮或溶液,例如,药学上可接受的推进剂,并且使用鼻喷雾或吸入剂直接给予肺中。例如,包含转运剂、运载体、或离子通道抑制剂的气溶胶制剂可在推进剂或溶剂与推进剂的混合物中溶解、悬浮或乳化,例如,用于以鼻喷雾或吸入剂给予。气溶胶制剂可含有任何在压力下可接受的推进剂,如化妆或皮肤或药学上可接受的推进剂,如本领域常规使用的那样。用于鼻给药的气溶胶制剂一般是设计成以液滴或喷雾给予鼻通道的水溶液。鼻溶液可与鼻分泌物相似,即它们一般是等渗的并且稍加缓冲以维持约5.5至约6.5的pH,虽然可额外使用在该范围以外的pH值。制剂中也可包含抗微生物剂或防腐剂。可设计用于吸入的气溶胶制剂或吸入剂,使得试剂或试剂组合在通过鼻或口腔呼吸途径给予时被运载到对象的呼吸道中。可例如通过喷雾器来给予吸入溶液。包含细粉末或液体药物的吸入或吹入可以推进剂中的试剂或试剂组合的溶液或悬液的药物气溶胶递送到呼吸系统中,例如,辅助补偿。推进剂可以是液化的气体,包括卤代烃,例如,碳氟化合物如氟化氯化烃、氢氯氟烃、和氢氯烃、以及烃类和烃醚。卤代烃推进剂可包括碳氟化合物推进剂(其中所有氢都被氟取代)、氯氟烃推进剂(其中所有氢都被氯和至少一个氟取代)、含氢氟碳化合物推进剂、和含氢氯氟烃推进剂。卤代烃推进剂描述于Johnson的1994年12月27日授权的美国专利号5,376,359;Byron等的1993年3月2日授权的美国专利号5,190,029;和Purewal等的1998年7月7日授权的美国专利号5,776,434。可用于本发明的烃推进剂包括,例如,丙烷、异丁烷、正丁烷、戊烷、异戊烷和新戊烷。烃类的掺混物也可用作推进剂。醚推进剂包括,例如,二甲醚以及醚。本发明的气溶胶制剂也可包含超过一种推进剂。例如,气溶胶制剂可包含超过一种相同类别的推进剂,如2种或更多种含氟烃;或超过一种、超过2种、超过3种来自不同类别的推进剂,如含氟烃和烃。本发明的药物组合物也可用压缩气体分散,例如,惰性气体如二氧化碳、一氧化氮或氮气。气溶胶制剂也可包括其他组分,例如,乙醇、异丙醇、丙二醇、以及表面活性剂或其他组分如油和去污剂。这些组分可用于使制剂和/或润滑价值组分稳定化。气溶胶制剂可在压力下包装并且可配制为使用溶液、悬液、乳液、粉末和半固体制备物的气溶胶。例如,溶液气溶胶制剂可包含在(基本)纯的推进剂中本发明的试剂,如转运剂、运载体或离子通道抑制剂的溶液,或推进剂与溶剂的混合物。溶剂可用于溶解试剂和/或阻滞推进剂蒸发。溶剂可包括例如,水、乙醇和二醇。合适溶剂的任意组合可任选地以防腐剂、抗氧化剂、和/或其他气溶胶组分联用。气溶胶制剂可以是分散体或悬液。悬浮气溶胶制剂可包含本发明的试剂或试剂组合的悬液,例如,转运剂、运载体或离子通道抑制剂,和分散剂。分散剂可包括,例如,失水山梨糖醇三油酸酯、油酰基醇、油酸、卵磷脂和玉米油。悬浮气溶胶制剂也可包括润滑剂、防腐剂、抗氧化剂和/或其他气溶胶组分。气溶胶制剂可与乳液类似配制。乳液气溶胶制剂可包括,例如,醇如乙醇、表面活性剂、水和推进剂,以及本发明的试剂或试剂组合,例如,转运剂、运载体或离子通道。使用的表面活性剂可以是非离子、阴离子或阳离子的。乳液气溶胶制剂的一个示例包含,例如,乙醇、表面活性剂、水和推进剂。乳液气溶胶制剂的另一个示例包括,例如,植物油、单硬脂酸甘油酯和丙烷。化合物也可以配制用于作为栓剂给予。低熔蜡,如甘油三酯、脂肪酸甘油酯、WitepsolS55(德国诺贝尔化学(DynamiteNobelChemical,Germany)的商标)或可可油的混合物首先熔化并且通过例如搅拌使活性组分均匀分散。然后将熔化均匀的混合物倒入常规尺寸的模具中,使其冷却,从而固化。可配制化合物用于阴道给予。本领域已知阴道栓剂、棉塞剂,乳膏剂、凝胶剂、贴剂、泡沫剂或喷雾剂也是适合的。化合物可以可释放地附连至生物相容聚合物用于缓释制剂,或附连至惰性物体用于局部、眼内、眼周或全身给予。从生物相容聚合物受控释放也可用于水溶性聚合物以形成可灌注制剂。从生物相容聚合物例如PLGA微球或纳米球受控释放可用于使用眼内植入或用于持续释放给药注射的制剂。可使用任意合适的生物可降解且生物相容的聚合物。给予药物组合物在一些方面中,本文所述的组合物和方法在对象中引发针对抗原性肽的表位的免疫应答。在一些情况中,组合物是结直肠癌疫苗、NSCLC癌疫苗或卵巢癌疫苗。在一些方面中,结直肠癌疫苗是多抗原结直肠癌疫苗、多抗原NSCLC癌疫苗或多抗原卵巢癌疫苗。在一些情况中,对象在给予疫苗之前携带肿瘤。在其他情况中,对象在给予疫苗之前不携带肿瘤。在其他情况中,对象在给予疫苗之前不携带肿瘤,但是在给予疫苗之后携带肿瘤。在其他情况中,对象在给予疫苗之前不携带肿瘤,且在给予疫苗之后也不变得携带肿瘤。在一个方面,肿瘤是结直肠癌肿瘤、NSCLC肿瘤或卵巢癌肿瘤。在一些方面中,对象是啮齿类并且啮齿类的结直肠癌肿瘤是AOM诱导肿瘤。本文所述的疫苗可通过多种途径递送。递送途径可包括口服(包括口颊和舌下)、直肠、经鼻、局部、透皮贴片、经肺、阴道、栓剂或胃肠外(包括肌内、动脉内、鞘内、皮内、腹膜内、皮下和静脉内)给药或适于通过气溶胶化、吸入或吹入给药的形式。药物递送系统的一般内容发现于Ansel等,《药物剂型和药物递送系统》(PharmaceuticalDosageFormsandDrugDeliverySystems)(LippencottWilliams&Wilkins,BaltimoreMd.(1999))。本文所述的疫苗可给予肌肉,或可通过皮内或皮下注射给予,或透皮,如通过离子透入。可采用疫苗的表皮给予。在一些情况中,也可配制疫苗用于通过鼻通道给予。适用于经鼻给药的制剂(其中运载体是固体)包括粒度范围为约10至约500微米的粗粉末,其以摄取鼻烟的方式给予,即从保持在靠近鼻部的处的粉末容器中通过鼻部通道迅速吸入。该制剂可以是鼻喷雾剂,鼻滴剂,或通过喷雾器的气溶胶给予。该制剂可包含疫苗的水溶液或油性溶液。疫苗可以是液体制备物如悬液、糖浆或酏剂。疫苗也可以是用于胃肠外、皮下、皮内、肌内或静脉内给予(例如,注射给予)的制备物,如无菌悬液或乳液。疫苗可含有单次免疫的物质,或者可含有多次免疫的物质(即“多剂”药盒)。多剂量配置优选含有防腐剂。作为多剂量组合物中包含防腐剂的替代方案(或补充方案),该组合物可包含在装有无菌接头以取出物质的容器中。疫苗可以约0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、或1.0mL的剂体积给予。有时,疫苗可以例如超过1ml的较高剂量给予。在一些方面中,本文所述的组合物作为疫苗给予有此需要的对象。在一些方面中,对象用多抗原结直肠癌疫苗、多抗原NSCLC癌疫苗或多抗原卵巢癌疫苗免疫。在一些情况中,用一剂疫苗来免疫对象。在其他情况中,用超过一剂疫苗来免疫对象。在一个方面,用超过1剂、超过2剂、超过3剂、超过4剂、超过5剂、超过6剂、超过7剂、超过8剂、超过9剂、超过10剂、超过11剂、超过12剂、超过13剂、超过14剂、超过15剂、超过16剂、超过17剂、超过18剂、超过19剂、或超过20剂疫苗来免疫对象。在一个方面中,用3剂疫苗来免疫对象。在一些方面中,在对象接受超过1剂疫苗的情况中,时间在疫苗的第一剂和各后续剂之间流逝。在一些情况中,在疫苗的第一剂和各后续剂之间流逝的时间是数秒、数分钟、数小时、数天、数周、数月或数年。在一个方面中,间隔给予对象超过1剂。在一些情况中,间隔是数秒、数分钟、数小时、数天、数周、数月或数年。在一些情况中,对象接受加强剂。在一个方面,用超过1剂、超过2剂、超过3剂、超过4剂、超过5剂、超过6剂、超过7剂、超过8剂、超过9剂、超过10剂、超过11剂、超过12剂、超过13剂、超过14剂、超过15剂、超过16剂、超过17剂、超过18剂、超过19剂、或超过20剂加强剂的疫苗来向对象给予加强剂。在一个方面,对象接受高至3剂加强剂疫苗。在一些情况中,间隔在疫苗各剂之间相同。在一些情况中,间隔在疫苗各加强剂之间相同。在一些情况中,间隔在疫苗各剂之间不同。在一些情况中,间隔在疫苗各加强剂之间不同。在一个方面,在至少1天的间隔下给予对象超过1剂。在一些情况中,间隔是1天、2天、3天、4天、5天、6天、7天、8天、9天、10天、11天、12天、13天、14天、15天、16天、17天、18天、19天、20天、21天、22天、23天、24天、25天、26天、27天、28天、29天或30天间隔。在其他情况中,间隔是数天的范围,在一些方面中,数天的范围是1-5天、1-7天、1-10天、3-15天、5-10天、5-15天、5-20天、7-10天、7-15天、7-20天、7-25天、10-15天、10-20天、10-25天、15-20天、15-25天、15-30天、20-30天、20-35天、20-40天、20-50天、25-50天、30-50天、35-50天、或40-50天。在一些方面中,在给予疫苗之后评价对象。在一些情况中,在最后给予疫苗的1个月内(例如,短期)评价对象。在一个方面,短期是最后给予疫苗后的1天、2天、3天、4天、5天、6天、7天、8天、9天、10天、11天、12天、13天、14天、15天、16天、17天、18天、19天、20天、21天、22天、23天、24天、25天、26天、27天、28天、29天、30天或31天。在一些情况中,在最后给予疫苗的4个月内(例如,长期)评价对象。在一个方面,长期是最后给予疫苗后的1周、2周、3周、4周、5周、6周、7周、8周、9周、10周、11周、12周、13周、14周、15周、16周、17周、18周、19周、20周、21周、22周、23周、24周、25周、26周、27周、28周、29周、30周或31周。在一些情况中,对象在最后给予疫苗剂量后接受至少1剂疫苗加强剂。在一个方面,至少1剂加强剂在最后给予疫苗后的1周、2周、3周、4周、5周、6周、7周、8周、9周、10周、11周、12周、13周、14周、15周、16周、17周、18周、19周、20周、21周、22周、23周、24周、25周、26周、27周、28周、29周、30周或31周后给予对象。在一些情况中,对象接受1剂加强、2剂加强、3剂加强、4剂加强、5剂加强、6剂加强、7剂加强、8剂加强、9剂加强、10剂加强、11剂加强、12剂加强、13剂加强、14剂加强、15剂加强、16剂加强、17剂加强、18剂加强、19剂加强、20剂加强、21剂加强、22剂加强、23剂加强、24剂加强、25剂加强、26剂加强、27剂加强、28剂加强、29剂加强、或30剂加强剂。本发明在另一个方面提供了一种包含皮内给药装置和本文所述的疫苗制剂的药盒。在一些方面中,该装置优选已填充疫苗。在一些方面中,疫苗优选地处于小于常规肌内疫苗的液体体积,如本文所述,具体是约0.05ml至0.2ml的体积。在一些方面中,优选地,装置是用于向真皮给予疫苗的短针递送装置。用于本文所述的皮内疫苗的合适装置包括短针装置,如US4,886,499、US5,190,521、US5,328,483、US5,527,288、US4,270,537、US5,015,235、US5,141,496、US5,417,662中所述的那些。在一些方面中,还通过限制针在皮肤内的有效渗透长度的装置及其功能等价物来给予皮内疫苗,如WO99/34850中所述的那些,其通过引用纳入本文。喷射注射装置也是合适的,其通过液体喷射注射器或通过针向真皮递送液体疫苗,该针穿透角质层并且产生到达真皮的喷射。喷射注射装置描述于,例如,US5,480,381、US5,599,302、US5,334,144、US5,993,412、US5,649,912、US5,569,189、US5,704,911、US5,383,851、US5,893,397、US5,466,220、US5,339,163、US5,312,335、US5,503,627、US5,064,413、US5,520,639、US4,596,556、US4,790,824、US4,941,880、US4,940,460、WO97/37705和WO97/13537。弹道粉末/颗粒递送系统也是合适的,其使用压缩气体来加速粉末形式的疫苗通过皮肤的外层到达真皮。另外,在一些方面中,常规注射器用于皮内给予的经典曼托测试法(mantoux)中。然而,常规注射器的使用要求有高度技能的操作者,并且优选能够准确递送而不需要高度技能使用者的装置。本发明的另一种情况涉及针对疾病免疫对象或对象群以在该对象或对象群中预防疾病、和/或降低疾病严重性的方法。该方法包括向患有疾病(或被认为未患有疾病)的对象或对象群给予本发明的组合物的步骤。可使用本领域技术人员熟知的技术来给予本发明的一种情况的组合物。在一些方面中,优选通过遗传免疫来配制并给予化合物。配制和给药的技术参考《雷明顿药物科学》,第18版,1990,宾西马尼亚州伊斯顿的马克出版公司。在一些方面中,合适的途径包括胃肠外递送,如肌内、皮内、皮下、髓内注射、以及鞘内、直接心室内、静脉内、腹膜内、或眼内注射等。其他途径包括口服或透皮递送。就注射而言,在一些方面中,本发明的一种情况的组合物配制在水溶液中,所述水溶液优选生理相容性缓冲液,如汉克斯溶液、林格溶液或生理盐水缓冲液。就胃肠外施用而言,包括肌内、皮内、皮下、鼻内、囊内、脊柱内、胸骨内、和静脉内注射,在一些方面中特别合适的是可注射无菌溶液,优选油性或水性溶液,以及悬液,乳液,或植入物,包括栓剂。在一些方面中,用于注射的制剂可以单位剂型存在,例如装在安瓿或多剂量容器中,其添加有防腐剂。在一些方面中,这些组合物采取的形式诸如含悬浮剂、溶液剂或油性或水性载剂中的乳液,并且含有配制剂,例如助悬剂、稳定剂和/或分散剂。或者,在其他方面中,活性成分是使用前用合适的载剂如无菌无热原的水进行重建的粉末形式。在一些方面中,就肠道施用而言,特别合适的是片剂、糖衣丸、液体、滴剂、栓剂或胶囊。在一些方面中,药物组合物通过常规方式与药学上可接受的赋形剂如粘合剂(如预胶化玉米淀粉、聚乙烯吡咯烷酮或羟丙基甲基纤维素);填充剂(如乳糖、微晶纤维素或磷酸氢钙);润滑剂(如硬脂酸镁、滑石粉或二氧化硅);崩解剂(如马铃薯淀粉或淀粉乙醇酸钠);或湿润剂(如月桂基硫酸钠)一起制备。在一些方面中,按照本领域熟知方法对片剂进行包衣。在一些方面中,口服液体制剂是(例如)溶液剂、糖浆剂或混悬剂的形式,或者制成临用前用水或其它合适的载剂进行重建的干燥产品。在一些方面中,通过常规方式用药学上可接受的添加剂如助悬剂(如,山梨糖醇糖浆、纤维素衍生物或氢化食用脂肪);乳化剂(如,卵磷脂或阿拉伯胶);非水性载剂(如,杏仁油、油性酯、乙醇或分馏植物油);和防腐剂(如,对羟基苯甲酸甲酯或丙酯,或山梨酸)配制这类液体制剂。在一些方面中,该制剂还适当地含有缓冲盐、调味剂、着色剂和甜味剂。在一些方面中,使用糖浆、酏剂等,其中采用甜味载剂。在一些方面中,配制持续或引导释放组合物,例如,脂质体或其中活性化合物受到可差异降解的涂层的保护,例如,微囊化、多涂层等。在一些方面中,也可能冻干新化合物并且使用获得的冻干物,例如,用于制备用于注射的产物。就吸入给药而言,使用合适推进剂(如二氯二氟甲烷、三氯氟甲烷、二氯四氟乙烷、二氧化碳或其它合适的气体)从加压包装或喷雾器中以气溶胶喷雾形式方便地递送按本发明的一种情况使用的化合物。在一些方面中,在加压气溶胶的情况下,通过阀门递送计量用量,以确定剂量单位。在一些方面中,将用于吸入器或吹入器内的胶囊和药筒(例如,由明胶制成)配制成含有化合物和合适粉末基料(如乳糖或淀粉)的粉末混合物。局部或透皮施用可包括非可喷雾形式,粘性至半固体或固体形式,其包含与局部施用相容的运载体并具有优选比水大的动态粘度。合适的制剂包括但不限于溶液剂、混悬剂、乳剂、乳膏剂、油膏剂、粉末剂、搽剂、软膏剂、气溶胶等,需要的话它们可以是无菌的并与辅料(如防腐剂、稳定剂、湿润剂、缓冲剂或盐)混合以影响渗透压等。对于局部施用,可喷雾的气溶胶制备物也是合适的,其中优选与固体或液体惰性运载体材料组合的活性成分包装到挤压瓶中或与压缩的挥发物混合,通常是气体推进剂,例如,氟利昂。在一些方面中,可将该组合物装入包装或分配装置中,所述包装或分配装置包含一个或多个含有活性成分的单位剂型。在一些方面中,该包装包括金属或塑料薄片,如泡罩包装。在一些方面中,所述包装或分配装置附有给药说明书。根据本发明的一种情况,组合物包含药学上可接受的赋形剂、运载体、缓冲液、稳定剂或本领域技术人员熟知的其他材料。这些材料应无毒,不应干扰活性成分的效力。在一些方面中,运载体或其他材料的精确性质取决于给药途径,例如,静脉内、皮肤或皮下、粘膜内(例如,肠)、鼻内、肌内、或腹膜内途径。“对象”指任意成员,包括但不限于人和其他灵长类动物,包括非人灵长类动物如黑猩猩和其他猿和猴物种;家畜如牛、绵羊、猪、山羊和马;家养哺乳动物如狗和猫;实验室动物,包括啮齿动物如小鼠、大鼠和豚鼠;包括家养、野生和狩猎鸟类在内的禽类如鸡、火鸡和其他鹑鸡类禽、鸭、鹅等。该术语不表示特定年龄。因此,旨在覆盖成年和新生个体。本发明旨在用于任一上述脊椎动物,因为所有这些脊椎动物的免疫系统运作相似。一般而言,术语“生物活性”表示化合物(包括蛋白质或肽)有至少一种可检测的活性,其对细胞或生物体的代谢或其他过程有影响,如体内(即,在中性生理环境中)或体外(即,在实验室条件下)测量或观察的那样。组合物的免疫原性在一些方面中,本文所述组合物的免疫原性在对象中评价。在一些情况中,在接受对象中评价由组合物(例如,基于质粒的疫苗)编码的表位。在一个情况中,受者对象是啮齿类、非人灵长类或人。一些情况中,啮齿类是小鼠。在一些方面中,本文所述的组合物和方法在对象中引发针对抗原性肽的表位的免疫应答。在一些情况中,组合物是结直肠癌、NSCLC或卵巢癌疫苗。在一些情况中,结直肠癌疫苗是多抗原结直肠癌疫苗。在一些方面中,NSCLC疫苗是多抗原NSCLC疫苗。在一些情况中,卵巢癌疫苗是多抗原卵巢癌疫苗。在一些方面中,免疫应答是I型免疫应答、II型免疫应答、或I型和II型免疫应答。在一些情况中,I型免疫应答导致抗原特异性T-细胞分泌炎性细胞因子(例如,IFN-γ,TNF-α)。在一些方面中,炎性细胞因子(例如,I型细胞因子)激活细胞毒性T-细胞,其杀死表达至少一种由疫苗编码(例如,核酸,质粒)或递送(例如,肽,蛋白质)的表位的细胞。在一些情况中,Th1细胞因子激活其他免疫细胞。在一些情况中,II型免疫应答导致调节T-细胞分泌免疫抑制细胞因子(例如,IL-10,IL-4和IL-5)。在一些方面中,免疫抑制细胞因子(例如,II型细胞因子)激活调节T-细胞,其不杀死表达至少一种由疫苗编码(例如,核酸,质粒)或递送(例如,肽,蛋白质)的表位而只是抑制Th1免疫应答的细胞。在一些方面中,发生在对象中的Th1或Th2免疫应答或二者均发生,是表位与MHC-T细胞受体相互作用之间的亲和性的结果。在一些情况中,对MHC分子的结合肽的亲和性高。在其他情况中,对MHC分子的结合肽的亲和性低。在一些情况中,低亲和性结合肽诱导Th1应答。在其他情况中,高亲和性结合肽诱导Th2应答。在一些方面中,筛选对MHC分子的候选结合肽的亲和性。在一些方面中,如本文所述或使用本领域普通技术人员已知的技术确定由候选结合肽诱导的IFNγ和IL-10分泌。在一些方面中,使用本领域普通技术人员已知的多种方法中的任一种来分析疫苗在对象中的免疫原性。在一些情况中,通过检测对象中由给予对象的疫苗编码的肽的表达来分析免疫原性。在一个方面,检测方法包括ELISPOT、ELISA、Western印迹、流式细胞术、组织学、色谱、质谱等。在一些方面中,分析对象中响应疫苗产生的针对分离的肽的免疫原性。在一些情况中,分析取自对象的肿瘤细胞、癌细胞、脾细胞或正常细胞的样品。在一些情况中,从对象分离淋巴细胞用于分析免疫原性。在一个方面中,淋巴细胞分离自脾、分离自淋巴结和/或分离自引流淋巴结。在一些情况中,在给予单剂疫苗之后分离淋巴细胞。在其他情况中,在给予多剂疫苗的最后一剂之后分离淋巴细胞。在一个方面中,在给予任一单剂疫苗后的1天、2天、3天、4天、5天、6天、7天、8天、9天、10天、11天、12天、13天、14天、15天、16天、17天、18天、19天、20天、21天、22天、23天、24天、25天、26天、27天、28天、29天或30天分离淋巴细胞。在一些情况中,在给予多剂疫苗的最后一剂之后分离淋巴细胞。在一个方面中,在最后给予多剂疫苗的最后一剂后的1天、2天、3天、4天、5天、6天、7天、8天、9天、10天、11天、12天、13天、14天、15天、16天、17天、18天、19天、20天、21天、22天、23天、24天、25天、26天、27天、28天、29天或30天分离淋巴细胞。在一些情况中,使用蛋白质检测方法来确定由对象产生的由组合物(例如,基于质粒的疫苗)的核酸编码的各肽的量。在一个方面,进行ELISPOT并且ELISPOT检测IFN-γ。在其他方面,进行不同ELISPOT并且该ELISPOT检测测粒酶B。在一些情况中,使用蛋白质检测方法来确定由对象产生的响应组合物(例如,基于质粒的疫苗)的蛋白质特异性T-细胞的存在。在一个方面,进行ELISPOT并且ELISPOT检测IFN-γ。在其他方面,进行不同ELISPOT并且该ELISPOT检测测粒酶B。在一些方面中,通过比较给予组合物(例如,疫苗)后的对象的结果与给予对照组合物(例如,质粒不编码任何物质或无肽)后的对象的本文所述方法的结果来确定疫苗编码的肽的免疫原性。在一些情况中,对照是仅佐剂。在其他情况中,对照是阴性对照(例如,缺少抗原性肽表位的空白质粒)。在一些方面中,通过产生的IFN-g的量的增加(ELISPOT上的IFNγ阳性点)或产生的肿瘤特异性粒酶B的量的增加(ELISPOT上的粒酶B阳性点)来确定免疫原性。在一些方面中,与给予对照组合物的对象相比,在给予组合物(例如,疫苗)之后在对象中观察到增加。在一些情况中,增加在统计学上与对照不同,如P值所示(例如,p<0.05)。在一些方面中,在p<0.05的统计学差异是统计学显著的。在一个方面中,通过以98%效力比较2组(n=10个对象/组)来确定免疫原性的统计学显著性,其中至少双侧水平可以是0.05并且真效应量可以是2.0。在一个情况中,效应量定义为平均特异性T-细胞应答水平之差除以共同标准差。在一些方面中,约1.5或更小的真效应量将是不显著的。在一些方面中,在给予至少一剂疫苗之后分析其他参数。在一些情况中,从对象中分离血液并且对血液进行本领域普通技术人员已知的多种测试。在一个方面中,进行基础代谢组和/或完全血计数。在一些情况中,检验其他组织。在一个方面中,在给予至少一剂疫苗后检查结肠、直肠、小肠、盲肠、阑尾、肛管、腹膜、脾、皮肤、骨骼肌、淋巴结、骨、骨髓、卵巢、输卵管、子宫、外周神经、脑、心、胸腺、肺、肾、肝和/或胰腺。使用模型系统的组合物功效在一些方面中,本文所述的组合物用于多种小鼠模型系统。在一些情况中,小鼠模型包括遗传多样性小鼠模型。在一个方面中,用于小鼠模型系统的小鼠包括APCmin突变小鼠。在其他方面,用于小鼠模型系统的小鼠包括用氧化偶氮甲烷(AOM)注射的小鼠。在一些情况中,小鼠模型是肿瘤移植模型。在一个方面中,肿瘤移植模型用于分析本文所述的组合物的治疗功效。在一个方面中,肿瘤移植模型是MC-38肿瘤移植模型。在一个方面中,组合物是结直肠癌疫苗。在一些情况中,将肿瘤细胞皮下植入小鼠中。在一个方面中,可将至少1,000、2,500、5,000、7,500、10,000、12,500、15,000、17,500、20,000、22,500、25,000、27,500、30,000、35,000、40,000、45,000、50,000、75,000、100,000、125,000、150,000、175,000、200,000、225,000、250,000、275,000、300,000、350,000、400,000、450,000、500,000、750,000、1,000,000、1,250,000、1,500,000、1,750,000、2,000,000、2,500,000、3,000,000、3,500,000、4,000,000、4,500,000、5,000,000、5,500,000、6,000,000、6,500,000、7,000,000、7,500,000、8,000,000、8,500,000、9,000,000、9,500,000或至少1,000,000,000个肿瘤细胞皮下植入小鼠中。在一些方面中,使用本领域普通技术人员已知的方法测量肿瘤生长。在一个方面中,测量方法包括肿瘤直径、肿瘤体积、肿瘤质量等。在一些情况中,使用成像、提取或组织学技术。在一个方面中,任意技术包括使用造影剂。在一些情况中,通过相对于对照(例如,未免疫的小鼠或用对照疫苗处理的小鼠)的肿瘤生长的尺寸来确定疫苗功效。在一个方面中,在没有免疫的情况下,超过90%的小鼠发展肿瘤,并且在有免疫的情况下,观察到60%的肿瘤生长抑制。在一些情况中,免疫会抑制至少2%、5%、7%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%或至少99%的肿瘤生长。在一些方面中,给予疫苗之后,对象100%不含肿瘤。在其他情况中,对象在给予疫苗之后低于100%无肿瘤。在一个方面中,对象在给予疫苗之后低于99%、95%、90%、85%、80%、75%、70%、65%、60%、55%、50%、45%、40%、35%、30%、25%、20%、15%或低于10%无肿瘤。在一些情况中,对象在给予疫苗后数小时变得无肿瘤。在一个方面中,对象在给予疫苗后1小时、2小时、3小时、4小时、5小时、6小时、7小时、8小时、9小时、10小时、11小时、12小时、13小时、14小时、15小时、16小时、17小时、18小时、19小时、20小时、21小时、22小时、23小时、24小时、25小时、26小时、27小时、28小时、29小时、30小时、31小时、32小时、33小时、34小时、35小时、36小时、37小时、38小时、39小时、40小时、41小时、42小时、43小时、44小时、45小时、46小时、47小时、48小时、49小时、50小时或更久变得无肿瘤。在其他情况中,对象在给予疫苗后数天变得无肿瘤。在一个方面中,对象在给予疫苗后1天、2天、3天、4天、5天、6天、7天、8天、9天、10天、11天、12天、13天、14天、15天、16天、17天、18天、19天、20天、21天、22天、23天、24天、25天、26天、27天、28天、29天、30天、31天、32天、33天、34天、35天、36天、37天、38天、39天、40天、41天、42天、43天、44天、45天、46天、47天、48天、49天、50天或更久变得无肿瘤。在其他情况中,对象在给予疫苗后数周变得无肿瘤。在一个方面中,对象在给予疫苗后1周、2周、3周、4周、5周、6周、7周、8周、9周、10周、11周、12周、13周、14周、15周、16周、17周、18周、19周、20周、21周、22周、23周、24周、25周、26周、27周、28周、29周、30周、31周、32周、33周、34周、35周、36周、37周、38周、39周、40周、41周、42周、43周、44周、45周、46周、47周、48周、49周、50周或更久变得无肿瘤。在其他情况中,对象在给予疫苗后数月变得无肿瘤。在一个方面中,对象在给予疫苗后1个月、2个月、3个月、4个月、5个月、6个月、7个月、8个月、9个月、10个月、11个月、12个月、13个月、14个月、15个月、16个月、17个月、18个月、19个月、20个月、21个月、22个月、23个月、24个月、25个月、26个月、27个月、28个月、29个月、30个月、31个月、32个月、33个月、34个月、35个月、36个月、37个月、38个月、39个月、40个月、41个月、42个月、43个月、44个月、45个月、46个月、47个月、48个月、49个月、50个月或更久变得无肿瘤。在其他情况中,对象在给予疫苗后数年变得无肿瘤。在一个方面中,对象在给予疫苗后1年、2年、3年、4年、5年、6年、7年、8年、9年、10年、11年、12年、13年、14年、15年、16年、17年、18年、19年、20年、21年、22年、23年、24年、25年、26年、27年、28年、29年、30年、31年、32年、33年、34年、35年、36年、37年、38年、39年、40年、41年、42年、43年、44年、45年、46年、47年、48年、49年、50年或更久变得无肿瘤。在一些情况中,通过相对于对照(例如,未免疫的小鼠)的免疫对象(例如,小鼠)中产生的IFNγ的量来确定疫苗的功效。在一些情况中,通过相对于对照(例如,未免疫的小鼠)的免疫对象(例如,小鼠)中产生的IL-10的量来确定疫苗的功效。在一些方面中,评价表位特异性免疫应答的多克隆性。在一些情况中,通过估计响应给予的疫苗的表位产生的IgG抗体来评价多克隆性。在一些情况中,针对一种抗原引发IgG。在其情况中,针对多种抗原引发IgG。在一些情况中,从取自对象的样品中制备裂解物并且从对象的免疫前和免疫后血清评价。在一个方面中,对象是APCmin小鼠模型的小鼠,并且使用肽检测方法如ELISA或ELISPOT检测IgG。在一些情况中,使用统计学方法来分析免疫前对象(例如,小鼠)和免疫后对象(例如,小鼠)之间针对各抗原的应答。在一个方面中,统计学方法包括使用单因素ANOVA的分析。在一些情况中,进行在免疫过程期间针对对象(例如,小鼠)发展免疫的抗原数量的分析。组合物的毒性和安全性概况在一些方面中,评价本文所述的组合物的毒性和安全性。本领域普通技术人员已知的评价毒性和安全性的方法可用于本文所述的组合物。在一些情况中,进行剂量递增研究。在一些情况中,针对对象中疾病发展、对象中器官破坏、对象中组织破坏、对象中细胞破坏、血液病症等来筛选毒性和安全性研究。在一个方面中,疾病包括自身免疫疾病。组合物的制备和质量控制在一些方面中,按照cGMP生物学生产设施(BPF)的现有标准来进行本文所述组合物(例如,基于质粒的疫苗)的制备和测试。在一些方面中,过程开发包括用对cGMPBPF的卡那霉素选择标记物对含有合适质粒构建体的各候选细胞(例如,细胞系)转化。在一些情况中,从细菌储库中生成研究库。在一个方面中,采用可匹配更新cGMP生产的中试生产来评价质粒产率和纯度。在一些情况中,建立最初生产批次记录和质量控制测试方案。在一个方面中,从各细菌储库中生成主细胞库。在一些情况中,进行质量控制测试,包括:质粒和宿主细胞身份、质粒拷贝数、纯度、活力、和抗生素抗性保留(质粒保留)。在一些情况中,最终并批准的生产批次记录和标准操作过程按照疫苗质粒的cGMP生产和纯化,并且可开发大量投放标准。在一些情况中,最终总/汇集的纯化产物按照现有的规章指南进行质量控制测试,并且然后按照验证的填充和精制标准操作流程瓶装为单一单位剂型。在一些方面中,按照cGMP规定,瓶装的产物在最终产物投放之前经过质量控制测试。免疫原性在一些方面中,疫苗在对象中引发免疫应答。在一些情况中,确定在免疫之后引发的免疫应答类型。在一个方面中,本文所述的组合物在给予对象时引发Th1免疫应答。在一些情况中,Th1免疫应答包括形成和维持识别疫苗的至少一种肽的抗原特异性T细胞。在一个方面中,肽是干细胞和/或EMT抗原。在一些方面中,通过评价由抗原特异性T细胞分泌的细胞因子的类型来确定免疫应答的类型。在一些情况中,使用ELISPOT试验来鉴定细胞因子的类型。在一个方面中,ELISPOT方法包括对抗原刺激后(例如,72小时)的样品上清的分析。在一些情况中,评价样品上清的一组细胞因子。在一些情况中,评价是多重分析。在一个方面中,对细胞因子的多重分析包括Th1(例如,IFN-g、IL-2、TNF-a、IL-1b、GM-CSF)、Th17(IL-17)、和Th2(例如,IL-6、IL-4、IL-10、IL-13)的细胞因子。在一些情况中,分析样品上清中是否存在TGF-β。在一个方面中,使用ELISA方法来分析TGF-β。在一些情况中,分泌的模式或量级用作免疫后临床结果的生物标记物。在一些方面中,从多重细胞因子数据中生成热图。在一些情况中,根据接种的抗原特异性细胞因子增加(例如红色)或减少(例如蓝色)的量级对热图进行颜色编码。在一个方面中,颜色强度表示应答的最低(例如浅)到最高(例如深)四分位。在一些情况中,热图显示针对至少一种免疫抗原的免疫应答的量级和类型的特异性图案。在一个方面中,热图显示细胞因子分泌的量级。在一些情况中,通过针对大多数免疫抗原有强于1:20,000PBMC的蛋白质特异性前体频率的发展而将对象分类为经免疫的。在一些情况中,如果对象预先存在针对任意抗原的免疫,则应答增强超过2倍的基线应答。在一些情况中,对免疫原性的分析确定Th1抗原特异性免疫应答的量级。在一个方面中,通过进行IFN-gELISPOT来确定Th1应答,其在2.0和3.5x105PBMC/孔之间是线性且精确的,具有1:60,000的检测限,并且具有93%的检测效率。在一些情况中,同时分析疫苗前和疫苗后样品以校正差异。在一个方面中,使用与新鲜分离的PBMC相比在冷冻细胞中保存抗原特异性T细胞应答的冻存方法。在一些情况中,样品包括1ug/ml蛋白质抗原(例如,在提出的候选抗原的全部上可及的重组蛋白质,人肌红蛋白(阴性对照))或1ug/ml的CMV裂解物和0.5U/mltt(阳性对照)和以10ug/ml包括在疫苗内的肽抗原)。在一些方面中,结直肠癌疫苗显示免疫成功,其使用统计学方法分析。通常,疫苗的免疫成功是针对超过50%的由疫苗内的质粒表达的抗原出现免疫应答(例如,Th1)在一些情况中,向一组22个对象给予疫苗,使得真成功率为40%时观察到超过50%成功率的概率低于0.1。在一个方面中,观察到的成功率是0.06.在一些情况中,向一组22个对象给予疫苗,使得真成功率为70%时观察到超过50%成功率的概率大于0.7。在一个方面中,使用一组22名患者以80%的置信度证明估计的免疫应答可在至少0.14的真应答率内。在一些情况中,如果一半对象引发免疫应答,则对于统计学显著(在0.05的两侧水平上)和连续测量中的差异(如果真效应量是1.5)来说,则功效是至少91%。在一个方面中,使用斯皮尔曼相关系数来估计2次连续测量之间的相关性。在一些情况中,数据估计较大群中的预期应答率。在其他方面中,25%的对象针对疫苗引发免疫原性应答。在一些情况中,25%的具有免疫原性应答的对象为基线,用以评价疫苗功效。在一些情况中,真应答率是60%,其中与25%的固定率相比(单侧显著水平0.05),使用一组22个对象针对统计学显著的应答率提供97%的功效。应用在一些方面中,本文所述组合物给予需要疫苗的对象用于预防癌症,例如结直肠癌、非小细胞肺癌或卵巢癌。在一些方面中,本文所述的方法与本文所述的组合物结合用于给予需要疫苗的对象来预防癌症。在一些情况中,给予疫苗会在细胞开始表达增加水平的作为疫苗组分的蛋白质时引发细胞消除。在一些情况中,蛋白质是干细胞/EMT相关的。在一个方面中,在将正常细胞恶性转化成癌细胞(例如结直肠癌细胞、NSCLC细胞或卵巢癌细胞)期间表达增加水平的蛋白质。在一些情况中,在疾病变的临床明显之前消除结直肠癌细胞、NSCLC细胞或卵巢癌细胞防止对象发生结直肠癌、NSCLC或卵巢癌。在一些方面中,用于预防结直肠癌、NSCLC或卵巢癌的疫苗可以单剂给予对象,该剂为至少10ug、15ug、20ug、25ug、30ug、35ug、40ug、45ug、50ug、55ug、60ug、65ug、70ug、75ug、80ug、85ug、86ug、87ug、88ug、89ug、90ug、91ug、92ug、93ug、4ug、95ug、96ug、97ug、98ug、99ug、100ug、101ug、102ug、103ug、104ug、105ug、106ug、107ug、108ug、109ug、110ug、111ug、112ug、113ug、114ug、115ug、116ug、117ug、118ug、119ug、120ug、125ug、130ug、135ug、140ug、145ug、150ug、155ug、160ug、165ug、170ug、175ug、180ug、185ug、190ug、195ug、或至少200ug/质粒。在一个方面中,给予对象的单剂是100ug/质粒。在一些方面中,用于预防结直肠癌、NSCLC或卵巢癌的疫苗可以多于一剂给予对象,各剂为至少10ug、15ug、20ug、25ug、30ug、35ug、40ug、45ug、50ug、55ug、60ug、65ug、70ug、75ug、80ug、85ug、86ug、87ug、88ug、89ug、90ug、91ug、92ug、93ug、4ug、95ug、96ug、97ug、98ug、99ug、100ug、101ug、102ug、103ug、104ug、105ug、106ug、107ug、108ug、109ug、110ug、111ug、112ug、113ug、114ug、115ug、116ug、117ug、118ug、119ug、120ug、125ug、130ug、135ug、140ug、145ug、150ug、155ug、160ug、165ug、170ug、175ug、180ug、185ug、190ug、195ug、或至少200ug/质粒。在一些情况中,给予对象的各剂大于或小于之前给予对象的剂。在一些方面中,本文所述组合物给予需要疫苗的对象用于治疗癌症,例如结直肠癌、NSCLC或卵巢癌。在一些方面中,本文所述的方法与本文所述的组合物结合用于给予需要疫苗的对象来治疗癌症。在一些情况中,给予疫苗引发细胞消除,所述细胞表达增加水平的作为疫苗组分的蛋白质消除。在一些情况中,蛋白质是干细胞/EMT相关的。在一个方面中,癌细胞(例如结直肠癌细胞、NSCLC细胞或卵巢癌细胞)表达增加水平的蛋白质。在一些方面中,在疾病变的临床明显之后消除结直肠癌细胞、NSCLC细胞或卵巢癌细胞可防止对象的结直肠癌、NSCLC或卵巢癌持续和蔓延。在一些方面中,用于治疗结直肠癌、NSCLC或卵巢癌的疫苗可以单剂给予对象,该剂为至少10ug、15ug、20ug、25ug、30ug、35ug、40ug、45ug、50ug、55ug、60ug、65ug、70ug、75ug、80ug、85ug、86ug、87ug、88ug、89ug、90ug、91ug、92ug、93ug、4ug、95ug、96ug、97ug、98ug、99ug、100ug、101ug、102ug、103ug、104ug、105ug、106ug、107ug、108ug、109ug、110ug、111ug、112ug、113ug、114ug、115ug、116ug、117ug、118ug、119ug、120ug、125ug、130ug、135ug、140ug、145ug、150ug、155ug、160ug、165ug、170ug、175ug、180ug、185ug、190ug、195ug、或至少200ug/质粒。在一个方面中,给予对象的单剂是100ug/质粒。在一些方面中,用于治疗结直肠癌、NSCLC或卵巢癌的疫苗可以多于一剂给予对象,各剂为至少10ug、15ug、20ug、25ug、30ug、35ug、40ug、45ug、50ug、55ug、60ug、65ug、70ug、75ug、80ug、85ug、86ug、87ug、88ug、89ug、90ug、91ug、92ug、93ug、4ug、95ug、96ug、97ug、98ug、99ug、100ug、101ug、102ug、103ug、104ug、105ug、106ug、107ug、108ug、109ug、110ug、111ug、112ug、113ug、114ug、115ug、116ug、117ug、118ug、119ug、120ug、125ug、130ug、135ug、140ug、145ug、150ug、155ug、160ug、165ug、170ug、175ug、180ug、185ug、190ug、195ug、或至少200ug/质粒。在一些情况中,给予对象的各剂大于或小于之前给予对象的剂。对象在一些方面中,本文所述组合物给予需要癌症,例如结直肠癌、NSCLC或卵巢癌疫苗的对象。在一些方面中,本文所述的方法与本文所述的组合物结合用于给予需要癌症疫苗的对象。在一些情况中,疫苗给予未患癌症的对象。在其他情况中,疫苗给予已患癌症,例如结直肠癌、NSCLC或卵巢癌的对象。在其他情况中,疫苗给予患有癌症,例如结直肠癌、NSCLC或卵巢癌的对象。在一些情况中,该对象是健康个体。在一些情况中,对象是患有癌症例如结直肠癌、NSCLC或卵巢癌的个体。在一个方面中,个体是患者。在一些情况中,该对象是人个体。在其他情况中,该对象是非人个体。在一个方面中,非人个体包括非人灵长类、猴、猕猴、狒狒、黑猩猩、猩猩、小鼠、大鼠、豚鼠、兔、马、牛、猪、狗、猫或可发展或具有结直肠癌、NSCLC或卵巢癌的任何个体。结直肠癌的类型在一些方面中,本文所述组合物给予需要结直肠癌疫苗的对象。在一些方面中,本文所述的方法与本文所述的组合物结合用于给予需要结直肠癌症疫苗的对象。通常,结直肠癌是任何类型的结直肠癌,例如结直肠癌是腺癌、粘液腺癌,印戒细胞腺癌、胃肠类癌瘤、原发性结肠直肠淋巴瘤、胃肠道间质瘤、平滑肌肉瘤、黑素瘤或鳞状细胞癌。有时,结直肠癌是复发性、难治性或转移的结直肠癌。可给予本文所述组合物用于治疗复发性、难治性或转移的结直肠癌。在一些情况中,将对象鉴定为特定级别的结直肠癌。在一个方面中,结直肠癌的级别为X级、1级、2级、3级或4级。在其他方面中,结直肠癌表示为小管形成,核级和/或有丝分裂率的类别。在其他方面中,各类别分配有1-3之间的具体分数。在一些情况中,对象患有具体阶段的结直肠癌。在一些情况中,基于肿瘤、区域性淋巴结和/或远处转移来分配阶段。在一个方面中,分配给肿瘤的阶段是TX、T0、Tis、T1、T2、T3或T4。在一个方面中,分配至局部淋巴结的阶段为NX、N0、N1、N2或N3。在一个方面中,分配至远处转移的阶段为MX、M0或M1。在一些情况中,阶段是0期、I期、II期、III期或IV期。通常,结直肠癌分类为超过1种级或癌症阶段。非小细胞肺癌在一些方面中,本文所述组合物给予需要非小细胞肺癌(NSCLC)疫苗的对象。在一些方面中,本文所述的方法与本文所述的组合物结合用于给予需要NSCLC癌症疫苗的对象。有时,NSCLC是复发性、难治性或转移的NSCLC癌。可给予本文组合物用于治疗复发性、难治性或转移的NSCLC癌。非小细胞肺癌(NSCLC)可为最常见类型的肺癌。NSCLC可为与其他类型肺癌例如SCLC相关的慢生长癌症。有约4种NSCLC亚型,包括腺癌、鳞状细胞癌、大细胞癌和大细胞神经内分泌肿瘤。腺癌具有glad样性质,并且可在形成肺内层的细胞中开始。腺癌可进一步再分为可在肺泡中开始的原位腺癌(AIS)和可涵盖小腺癌肺肿瘤的微浸润性腺癌。鳞状细胞癌可在填塞呼吸道通道的薄平面细胞中起源。大细胞癌包含NSCLC的快速生长形式。大细胞神经内分泌肿瘤包括与大细胞癌相关的NSCLC的快速生长形式。在一些情况中,将对象分类为特定级别或阶段的NSCLC。在一个方面中,NSCLC的级别或阶段包含I、II、III、和IV期。I期涵盖癌症仅位于肺中以及癌症还未扩散到任何淋巴结的时期。II期涵盖癌症在肺中以及邻近的淋巴结的时期。III期涵盖癌症位于肺中和胸中部的淋巴结的时期。此外,III期可再分为IIIA期和IIIB期。IIIA期表示癌症扩散至癌症起源的同侧胸上的淋巴结。IIIB期表示癌症扩散至癌症起源的对侧胸上的淋巴结。IV期涵盖癌症扩散至双侧肺中、肺周围区域的流体中或身体的其他部分。卵巢癌在一些方面中,本文所述组合物给予需要卵巢癌疫苗的对象。在一些方面中,本文所述的方法与本文所述的组合物结合用于给予需要卵巢癌疫苗的对象。有时,卵巢癌是复发性、难治性或转移的卵巢癌。可给予本文组合物用于治疗复发性、难治性或转移的卵巢癌。有时,组合物包含EGFR表位。EGFR表位包含具有与SEQIDNO:11-13的氨基酸序列有至少90%序列相同性的氨基酸序列的表位。有时,组合物包含EGFR表位和一种或多种选自CDC25B、COX2、FASCIN1、IGF1R、PRL3、RCAS1、或VCP的其他表位。其他治疗剂在一些情况中,本文所述的癌症疫苗(例如结直肠癌、非小细胞肺癌或卵巢癌疫苗)可与其他治疗剂一起给予患者。在一些情况中,其他治疗剂是化疗剂、类固醇、免疫治疗剂、靶向疗法或其组合。在一些实施方式中,其他治疗剂选自:阿霉素、放线菌素D、博来霉素、长春花碱、顺铂、阿西维辛、阿柔比星、盐酸阿考达唑、阿克罗宁、阿多来新、阿地白介素、六甲蜜胺、安波霉素、乙酸阿美蒽醌、氨鲁米特、安吖啶、阿那曲唑、安曲霉素、门冬酰胺酶、曲林菌素、阿扎胞苷、阿扎替派、阿佐霉素、巴马司他、苯佐替派、比卡鲁胺、盐酸比生群、二甲磺酸双奈法德、比折来新、硫酸博来霉素、布喹那钠、溴匹立明、白消安、放线菌素C、卡普睾酮、卡醋胺、卡贝替姆、卡铂、卡莫司汀、盐酸卡柔比星、卡折来新、西地芬戈、苯丁酸氮芥、西罗霉素、克拉屈滨、甲磺酸克立那托、环磷酰胺、阿糖胞苷、达卡巴嗪、盐酸柔红霉素、地西他滨、右奥马铂、地扎胍宁、甲磺酸地扎胍宁、地吖醌、多柔比星、盐酸多柔比星、屈洛昔芬、柠檬酸屈洛昔芬、丙酸屈他雄酮、达佐霉素、依达曲沙、盐酸依氟鸟氨酸、依沙芦星、恩洛铂、恩普氨酯、依匹哌啶、盐酸表柔比星、厄布洛唑、盐酸依索比星、雌莫司汀、雌莫司汀磷酸钠、依他硝唑、依托泊苷、磷酸依托泊苷、氯苯乙嘧胺、盐酸法倔唑、法扎拉滨、芬维A胺、氮尿苷、磷酸氟达拉滨、氟尿嘧啶、氟西他滨、磷喹酮、福司曲星钠、吉西他滨、盐酸吉西他滨、羟基脲、盐酸伊达比星、异环磷酰胺、伊莫福新、白介素2(包括重组白介素2或rIL2),干扰素α-2a、干扰素α-2b、干扰素α-n1、干扰素α-n3、干扰素β-Ia、干扰素γ-Ib、异丙铂、盐酸伊立替康、乙酸兰瑞肽、来曲唑、乙酸亮丙瑞林、盐酸利阿唑、洛美曲索钠、洛莫司汀、盐酸洛索蒽醌、马索罗酚、美登素、盐酸氮芥、乙酸基孕甾酮、乙酸美仑孕酮、苯丙氨酸氮芥、美诺立尔、巯嘌呤、氨甲喋呤、氨甲喋呤钠、氯苯氨啶、美妥替哌、米丁度胺、米托卡星、丝裂红素、米托洁林、丝裂马菌素、丝裂霉素、米托司培、米托坦、盐酸米托蒽醌、霉酚酸、诺考达唑、诺拉霉素、奥马铂、奥昔舒仑、培门冬酶、培利霉素、奈莫司汀、硫酸培洛霉素、培磷酰胺、哌泊溴烷、哌泊舒凡、盐酸吡罗蒽醌、普卡霉素、普洛美坦、卟菲尔钠、泊非霉素、泼尼莫司汀、盐酸丙卡巴肼、嘌罗霉素、盐酸嘌罗霉素、吡唑呋喃菌素、利波腺苷、罗谷亚胺、沙芬戈、盐酸沙芬戈、司莫司汀、辛曲秦、磷乙酰天冬氨酸钠、司帕霉素、盐酸锗螺胺、螺莫司汀、螺铂、链黑霉素、链佐星、磺氯苯脲、他利霉素、替可加兰钠、替加氟、盐酸替洛蒽醌、替莫泊芬、替尼泊苷、替罗昔隆、睾内酪、硫咪嘌呤、硫鸟嘌呤、塞替派、噻唑呋林、替拉扎明、柠檬酸托瑞米芬、乙酸曲托龙、磷酸曲西立滨、三甲曲沙、葡糖醛酸三甲曲沙、曲普瑞林、盐酸妥布氯唑、乌拉莫司汀、乌瑞替派、伐普肽、维替泊芬、硫酸长春碱、硫酸长春新碱、长春地辛、硫酸长春地辛、硫酸长春匹定、硫酸长春甘酯、硫酸长春罗新、酒石酸长春瑞滨、硫酸长春罗定、硫酸长春利定、伏氯唑、折尼铂、净司他丁、盐酸佐柔比星。在一些实施方式中,其他治疗剂选自:20-表-1,25二羟基维生素D3、5-乙炔基尿嘧啶、阿比特龙、阿柔比星、酰基富烯、腺环戊醇(adecypenol)、阿多来新、阿地白介素、ALL-TK拮抗剂、六甲蜜胺、氨莫司汀、阿米多克斯(amidox)、氨磷汀、氨基乙酰丙酸、氨柔比星、安吖啶、阿那格雷、阿那曲唑、穿心莲内酯、血管新生抑制剂、拮抗剂D、拮抗剂G、安雷利克斯、抗-背侧化形成蛋白-1、抗雄激素前列腺癌、抗雌激素、抗瘤酮(antineoplaston)、甘氨酸阿非迪霉素、凋亡基因调节剂、凋亡调节剂、脱嘌呤核酸、ara-CDP-DL-PTBA、精氨酸脱氨酶、阿苏拉科林(asulacrine)、阿他美坦、阿莫司汀、阿西他汀(axinastatin)1、阿西他汀2、阿西他汀3、阿扎司琼、阿扎毒素、重氮酪氨酸、浆果赤霉素III衍生物、巴拉醇(balanol)、巴马司他、BCR/ABL拮抗剂、苯并二氢卟酚(benzochlorin)、苯甲酰星孢素、内酰胺衍生物、-阿里辛(beta-alethine)、贝塔克拉霉素(betaclamycin)B、桦木酸、bFGF抑制剂、比卡鲁胺、比生群、双氮丙啶精胺、双奈法德、比特迪尼(bistratene)A、比折来新、贝伏特(breflate)、溴匹立明、布度钛、丁基硫堇亚胺、卡泊三醇、卡弗他丁(calphostin)C、喜树碱衍生物、金丝雀痘IL-2、卡培他滨、羧酰胺-氨基-三唑、羧基酰胺三唑、CaRestM3、CARN700、软骨衍生的抑制剂、卡折来新、酪蛋白激酶抑制剂(ICOS)、澳粟精胺、杀菌肽B、西曲瑞克、氯代喹喔啉磺酰胺、西卡前列素、顺-卟啉、克拉屈滨、恩氯米芬类似物、克霉唑、克利霉素(collismycin)A、克利霉素B、考布他汀A4、考布他汀类似物、克纳宁(conagenin)、科莱贝司丁(crambescidin)816、克立那托、自念珠藻环肽(cryptophycin)8、自念珠藻环肽A衍生物、麻疯树毒蛋白(curacin)A、环戊蒽醌(cyclopentanthraquinone)、环普拉坦(cycloplatam)、塞培霉素(cypemycin)、阿糖胞苷十八烷基磷酸钠、细胞裂解因子、磷酸己烷雌酚(cytostatin)、达昔单抗、地西他滨、脱氢代代宁B、地洛瑞林、地塞米松、右异环磷酰胺、右雷佐生、右维拉帕米、地吖醌、代代宁B、二羟基苯并氧肟酸(didox)、二乙基正精胺、二氢-5-氮杂胞苷、二氧霉素(dioxamycin)、二苯基螺莫斯汀、多西他赛、多拉司琼、去氧氟尿苷、屈洛昔芬、屈大麻酚、多卡霉素SA、依布硒、依考莫司汀、依地福新、依决洛单抗、依氟鸟氨酸、榄香烯、乙嘧替氟、表柔比星、依立雄胺、雌莫司汀类似物、雌激素激动剂、雌激素拮抗剂、依他硝唑、磷酸依托泊甙、依西美坦、法倔唑、法扎拉滨、芬维A胺、非格司亭、非那雄胺、黄皮酮(flavopiridol)、氟卓斯汀、夫卢丝龙(fluasterone)、氟达拉滨、盐酸氟代柔红霉素(fluorodaunorunicin)、福酚美克、福美坦、福司曲星、福莫司汀、德卟啉钆(gadoliniumtexaphyrin)、硝酸镓、加洛他滨、加尼瑞克、明胶酶抑制剂、吉西他滨、谷胱甘肽抑制剂、赫舒反(hepsulfam)、调蛋白、环己基双乙酰胺、金丝桃蒽酮、伊班膦酸、黄胆素、艾多昔芬、伊决孟酮、伊莫福新、伊洛马司他、咪唑并吖啶酮、咪喹莫特、免疫刺激肽、胰岛素样生长因子-1受体抑制剂、干扰素激动剂、干扰素、白介素、碘苄胍、碘阿霉素、甘薯苦醇,4-、伊罗普拉、伊索拉定、异本格唑(isobengazole)、异高软海绵素(isohomohalicondrin)B、伊他司琼、结丝立得(jasplakinolide)、卡哈拉得(kahalalide)F、片螺素(lamellarin)-N三乙酸、兰瑞肽、雷纳霉素(leinamycin)、来格司亭、硫酸蘑菇多糖、莱托斯汀(leptolstatin)、来曲唑、白血病抑制因子、白细胞_干扰素、亮丙瑞林+雌激素+孕酮、亮丙瑞林、左旋咪唑、利阿唑、直链多胺类似物、亲脂性二糖肽、亲脂性铂化合物、利索纳得(lissoclinamide)7、洛铂、胍乙基磷酸丝氨酸、洛美曲索、氯尼达明、洛索蒽醌、洛伐他汀、洛索立宾、勒托替康、德卟啉镥(lutetiumtexaphyrin)、莱索菲林(lysofylline)、细胞裂解肽、美坦新、慢诺他汀(mannostatin)A、马立马司他、马索罗酚、马斯平(maspin)、基质溶解因子抑制剂、基质金属蛋白酶抑制剂、美诺立尔、硫巴妥苯胺、美替瑞林、甲硫氨酸酶、甲氧氯普胺、MIF抑制剂、米非司酮、米替福新、米立司亭、错配的双链RNA、米托胍腙、二溴卫矛醇、丝裂霉素类似物、米托萘胺、米托毒素(mitotoxin)成纤维细胞生长因子-皂草毒蛋白、米托蒽醌、莫法罗汀、莫拉司亭、单克隆抗体,人绒毛膜促性腺激素、单磷酰基脂质A+分支杆菌细胞壁骨架、莫哌达醇、多药耐药基因抑制剂、基于多肿瘤抑制物1的治疗、芥类抗癌剂、印度洋海绵(mycaperoxide)B、分枝杆菌细胞壁提取物、米亚普龙(myriaporone)、N-乙酰基地那林、N-取代的苯甲酰胺、那法瑞林、那瑞替喷(nagrestip)、纳洛酮+镇痛新、纳帕英(napavin)、萘萜二醇(naphterpin)、那托司亭、奈达铂、奈莫柔比星、奈立膦酸、中性内肽酶、尼鲁米特、尼萨霉素(nisamycin)、氮氧化物调节剂、硝基氧抗氧化剂、尼多林(nitrullyn)、O6-苄基鸟嘌呤、奥曲肽、奥可斯酮(okicenone)、寡核苷酸、奥那司酮、昂丹司琼、昂丹司琼、奥莱辛(oracin)、口服细胞因子诱导物、奥马铂、奥沙特隆、奥沙利铂、氧杂奥诺霉素(oxaunomycin)、帕劳胺(palauamine)、棕榈酰根霉素、帕米磷酸、人参炔三醇、帕诺米芬、副菌铁素(parabactin)、帕折普汀、培门冬酶、培得星、戊聚硫钠、喷司他丁、喷托唑(pentrozole)、全氟溴烷、培磷酰胺、紫苏子醇、苯那霉素(phenazinomycin)、乙酸苯酯(phenylacetate)、磷酸酶抑制剂、皮西巴尼(picibanil)、盐酸匹鲁卡品、吡柔比星、吡曲克辛、胎盘素(placetin)A、胎盘素B、纤溶酶原激活物抑制剂、铂络合物、铂化合物、铂-三胺络合物、卟菲尔钠、泊非霉素、氯泼尼松、丙基双吖啶酮、前列腺素J2、蛋白酶体抑制剂、基于蛋白A的免疫调节剂、蛋白激酶C抑制剂、蛋白激酶C抑制剂,微藻(microalgal)、蛋白质酪氨酸磷酸酶抑制剂、嘌呤核苷磷酸化酶抑制剂、红紫素、吡唑啉吖啶、吡哆醛化的血红蛋白聚氧乙烯偶联物、raf拮抗剂、雷替曲塞、雷莫司琼、ras法尼基蛋白转移酶抑制剂、ras抑制剂、ras-GAP抑制剂、去甲基化的瑞替普汀、依替膦酸铼Re186、根霉素、核酶、RII维甲酰胺(retinamide)、罗谷亚胺、罗希吐碱(rohitukine)、罗莫肽、罗喹美克、卢比格酮(rubiginone)B1、卢伯西(ruboxyl)、沙芬戈、伞托平(saintopin)、SarCNU、萨可菲醇(sarcophytol)A、沙格司亭、Sdi1模拟物、司莫司汀、衰老衍生的抑制剂1、有义寡核苷酸、信号转导抑制剂、信号转导调节剂、单链抗原结合蛋白、西佐喃、索布佐生、硼卡钠、苯基乙酸钠、索尔醇(solverol)、生长调节素结合蛋白、索纳明、膦门冬酸、斯卡霉素(spicamycin)D、螺莫司汀、脾脏五肽(splenopentin)、海绵他汀(spongistatin)1、角鲨胺、干细胞抑制剂、干细胞分裂抑制剂、斯提酰胺(stipiamide)、基质分解素抑制剂、斯菲诺辛(sulfinosine)、强效血管活性肠肽拮抗剂、素拉迪塔(suradista)、苏拉明、苦马豆碱、合成粘多糖、他莫司汀、他莫昔芬甲碘化物、牛磺莫司汀、他扎罗汀、替可加兰钠、替加氟、碲吡喃洋(tellurapyrylium)、端粒酶抑制剂、替莫泊芬、替莫唑胺、替尼泊苷、十氧化四氯(tetrachlorodecaoxide)、四佐胺(tetrazomine)、泰立拉汀(thaliblastine)、噻可拉林、血小板生成素、血小板生成素模拟物、胸腺法新、胸腺生成素受体激动剂、胸腺曲南、促甲状腺激素、本紫红素乙酯锡、替拉扎明、二氯环戊二烯钛、拓扑森汀(topsentin)、托瑞米芬、全能干细胞因子、翻译抑制剂、维甲酸、三乙酰基尿苷、曲西立滨、三甲曲沙、曲普瑞林、托烷司琼、妥罗雄脲、酪氨酸激酶抑制剂、酪氨酸磷酸化抑制剂(tyrphostin)、UBC抑制剂、乌苯美司、泌尿生殖窦衍生的生长抑制因子、脲激酶受体拮抗剂、伐普肽、瓦立奥林(variolin)B、载体系统,红细胞基因治疗、维拉雷琐、藜芦明、瓦尔丁(verdins)、维替泊芬、长春瑞滨、威科萨汀(vinxaltine)、维他辛(Vitaxin)、伏氯唑、扎诺特隆、折尼铂、亚苄维C、和净司他丁斯酯。在一些实施方式中,其他治疗剂选自:通过由于稳定化的微管将细胞阻滞在G2-M期而发挥作用的试剂,例如,厄布洛唑(也称为R-55104)、多拉司他汀10(也称为DLS-10和NSC-376128)、羟乙基磺酸米伏布林(也称为CI-980)、长春新碱、NSC-639829、淅皮海绵内酯(也称为NVP-XX-A-296)、ABT-751(雅培公司(Abbott),也称为E-7010)、奥图来尔亭(如奥图来尔亭A和奥图来尔亭C)、海绵司达汀(如海绵司达汀1、海绵司达汀2、海绵司达汀3、海绵司达汀4、海绵司达汀5、海绵司达汀6、海绵司达汀7、海绵司达汀8和海绵司达汀9)、盐酸西马多亭(也称为LU-103793和NSC-D-669356)、埃坡霉素类(如埃坡霉素A、埃坡霉素B、埃坡霉素C(也称为去氧埃坡霉素A或dEpoA)、埃坡霉素D(也称为KOS-862、dEpoB和去氧埃坡霉素B)、埃坡霉素E、埃坡霉素F、埃坡霉素BN-氧化物、埃坡霉素AN-氧化物、16-氮杂-埃坡霉素B、21-氨基埃坡霉素B(也称为BMS-310705见知)、21-羟基埃坡霉素D(也称为去氧埃坡霉素F和dEpoF)、26-氟埃坡霉素)、奥立司达汀PE(也称为NSC-654663)、索卜利多亭(也称为TZT-1027)、LS-4559-P(Pharmacia公司,也称为LS-4557)、LS-4578(Pharmacia公司,也称为LS-477-P)、LS-4477(Pharmacia公司)、LS-4559(Pharmacia公司)、RPR-112378(Aventis公司)、硫酸长春新碱、DZ-3358(Daiichi公司)、FR-182877(Fujisawa公司,也称为WS-9885B)、GS-164(Takeda公司)、GS-198(Takeda公司)、KAR-2(匈牙利科学院)、BSF-223651(BASF,也称为ILX-651和LU-223651)、SAH-49960(礼来/诺华公司)、SDZ-268970(礼来/诺华公司)、AM-97(Armad/KyowaHakko公司)、AM-132(Armad公司)、AM-138(Armad/KyowaHakko公司)、IDN-5005(Indena公司)、克来普妥素52(也称为LY-355703)、AC-7739(Ajinomoto公司,也称为AVE-8063A和CS-39.HCl)、AC-7700(Ajinomoto公司,也称为AVE-8062、AVE-8062A和CS-39-L-Ser.HCl和RPR-258062A)、维替乐福酰胺、吐卜溶素A、加纳单索、矢车菊黄素(也称为NSC-106969)、T-138067(Tularik公司,也称为T-67、TL-138067、TI-138067)、COBRA-1(帕克-休斯研究中心,也称为DDE-261和WHI-261)、H10(堪萨斯州立大学)、H16(堪萨斯州立大学)、杀肿瘤素A1(也称为BTO-956和DIME)、DDE-313(帕克-休斯研究中心)、非将诺来B、劳力马来、SPA-2(帕克-休斯研究中心)、SPA-1(帕克-休斯研究中心,也称为SPIKET-P)、3-IAABU(细胞骨架公司/西奈山医学院,也称为MF-569)、纳可辛(也称为NSC-5366)、纳司卡滨、D-24851(Asta医学公司)、A-105972(雅培公司)、丰星素、3-BAABU(细胞骨架公司/西奈山医学院,也称为MF-191)、TMPN(亚利桑那大学)、乙酰基丙酮酸凡纳多新、T-138026(Tularik公司)、孟沙醇、引纳诺新(也称为NSC-698666)、3-IAABE(细胞骨架公司/西奈山医学院)、A-204197(雅培公司)、T-607(Tularik公司,也称为T-900607)、RPR-115781(Aventis公司)、艾榴素类(如去甲基艾榴素、去乙酰基艾榴素、异艾榴素-A和Z-艾榴素)、卡利贝苷、卡利贝林、海利软骨胶B、D-64131(Asta医学公司)、D-68144(Asta医学公司)、重氮酰胺A、A-293620(雅培公司)、NPI-2350(Nereus公司)、他卡诺洛来A、TUB-245(Aventis公司)、A-259754(雅培公司)、二奥唑司达汀、(-)-苯基阿西司汀(也称为NSCL-96F037)、D-68838(Asta医学公司)、D-68836(Asta医学公司)、肌割蛋白B、D-43411(Zentaris公司,也称为D-81862)、A-289099(雅培公司)、A-318315(雅培公司)、HTI-286(也称为SPA-110,三氟乙酸盐)(惠氏药厂)、D-82317(Zentaris公司)、D-82318(Zentaris公司)、SC-12983(NCI)、力司弗拉司达汀磷酸钠、BPR-OY-007(国立卫生研究院),和SSR-250411(Sanofi公司)。在一些实施方式中,其他治疗剂选自:影响肿瘤微环境(如细胞信号转导网络,例如,磷脂酰肌醇3-激酶(PI3K)信号转导通路,来自B-细胞受体和IgE受体的信号转导)的试剂。影响肿瘤微环境的试剂的示例包括PI3K信号转导抑制剂、syc激酶抑制剂、蛋白激酶抑制剂例如达沙替尼、埃罗替尼、依维莫司、吉非替尼、伊马替尼、拉帕替尼、尼罗替尼、帕宗纳尼、索拉非尼、舒尼替尼、坦西莫司;其他血管生成抑制剂例如GT-111、JI-101、R1530;其他激酶抑制剂例如AC220、AC480、ACE-041、AMG900、AP24534、Arry-614、AT7519、AT9283、AV-951、阿西替尼、AZD1152、AZD7762、AZD8055、AZD8931、巴非替尼、BAY73-4506、BGJ398、BGT226、BI811283、BI6727、BIBF1120、BIBW2992、BMS-690154、BMS-777607、BMS-863233、BSK-461364、CAL-101、CEP-11981、CYC116、DCC-2036、迪那希(dinaciclib)、乳酸多韦替尼、E7050、EMD1214063、ENMD-2076、福斯塔玛替尼二钠、GSK2256098、GSK690693、INCB18424、INNO-406、JNJ-26483327、JX-594、KX2-391、里尼非尼(linifanib)、LY2603618、MGCD265、MK-0457、MK1496、MLN8054、MLN8237、MP470、NMS-1116354、NMS-1286937、ON01919.Na、OSI-027、OSI-930、Btk抑制剂、PF-00562271、PF-02341066、PF-03814735、PF-04217903、PF-04554878、PF-04691502、PF-3758309、PHA-739358、PLC3397、造血生长因子、R547、R763、雷莫芦单抗、瑞格拉芬尼、RO5185426、SAR103168、SCH727965、SGI-1176、SGX523、SNS-314、TAK-593、TAK-901、TKI258、TLN-232、TTP607、XL147、XL228、XL281RO5126766、XL418、XL765。在一些实施方式中,其他治疗剂选自:丝裂原活化蛋白激酶信号转导抑制剂,例如U0126、PD98059、PD184352、PD0325901、ARRY-142886、SB239063、SP600125、BAY43-9006、渥曼青霉素或LY294002;Syk抑制剂;mTOR抑制剂;和抗体(例如,利妥昔)。在一些实施方式中,其他治疗剂选自:干扰素、白介素、肿瘤坏死因子、生长因子等。在一些实施方式中,其他治疗剂选自:安西司亭、非格司亭、来格司亭、莫拉司亭、聚乙二醇非格司亭、沙格司亭;干扰素例如天然干扰素α、干扰素α-2a、干扰素α-2b、干扰素alfacon-1、干扰素α-n1、天然干扰素β、干扰素β-1a、干扰素β-1b、干扰素γ、聚乙二醇干扰素α-2a、聚乙二醇干扰素α-2b;白介素例如阿地白介素、奥普瑞白介素;其他免疫刺激剂例如卡介苗、醋酸格拉替雷、二盐酸组胺、免疫花青、蘑菇多糖、黑色素瘤疫苗、米伐木肽、培加酶、匹多莫德、普乐沙福、聚I:C、聚ICLC、罗喹美克、他索纳明、胸腺五肽;免疫抑制剂例如阿巴西普、阿贝莫司、依坦西普、抗淋巴细胞免疫球蛋白(马)、抗胸腺细胞免疫球蛋白(兔)、依库丽单抗、依法利珠单抗、依维莫司、胍立莫司、来氟米特、莫罗单抗-CD3、霉酚酸、那他珠单抗、西罗莫司;TNF-α抑制剂例如阿达木单抗、阿非莫单抗、赛妥珠单抗、依坦西普、戈利木单抗、英夫利昔单抗;白介素抑制剂例如阿那白滞素、巴利昔单抗、卡纳努单抗、达珠单抗、美泊利单抗、利纳西普、托珠单抗、乌斯克努单抗;神经钙蛋白抑制剂例如环孢素、他克莫司;其他免疫抑制剂例如硫唑嘌呤、甲氨蝶呤、来那度胺、沙利度。在一些实施方式中,其他治疗剂选自:阿达木单抗、阿来组单抗、巴利昔单抗、贝伐单抗、西妥昔单抗、赛妥珠单抗、达利珠单抗、依库丽单抗、依法利珠单抗、吉姆单抗、替伊莫单抗、英夫利昔单抗、莫罗单抗-CD3、那他珠单抗、帕尼单抗、利妥昔单抗、托西莫单抗、曲妥珠单抗、兰尼单抗等或其组合。在一些实施方式中,其他治疗剂选自:单克隆抗体例如阿仑单抗、贝伐单抗、西妥昔单抗、卡妥索单抗、依决洛单抗、吉姆单抗、帕尼单抗、利妥昔单抗、曲妥珠单抗;免疫抑制剂,依库丽单抗、依法利珠单抗、莫罗单抗-CD3、那他珠单抗;TNF-α抑制剂例如阿达木单抗、阿达木单抗、阿非莫单抗、戈利木单抗、英夫利昔单抗;白介素抑制剂,巴利昔单抗、卡纳努单抗、达珠单抗、美泊利单抗、托珠单抗、乌斯克努单抗;放射性药物,替伊莫单抗、单克隆抗体托西莫单抗;其他单克隆抗体例如阿巴伏单抗、阿德木单抗、阿仑单抗、抗CD30单克隆抗体Xmab2513、抗Met单克隆抗体MetMAb、阿泊珠单抗、阿伯单抗、阿西莫单抗、巴利昔单抗、双特异性抗体2B1、博纳吐单抗、布妥昔单抗、卡罗单抗喷地肽、西妥木单抗、克劳昔单抗、可那木单抗、达西珠单抗、地诺单抗、依库丽单抗、依帕珠单抗、依帕珠单抗、厄马索单抗、伊塔木单抗、芬妥木单抗、弗瑞索单抗、加利昔单抗、加尼单抗、吉妥单抗、格来莫单抗、替伊莫单抗、奥英妥珠单抗、伊匹单抗、来沙木单抗、林妥珠单抗、林妥珠单抗、鲁卡木单抗、马帕木单抗、马妥珠单抗、米拉妥珠单抗、单克隆抗体CC49、耐昔木单抗、尼妥珠单抗、奥戈伏单抗、帕妥珠单抗、拉马单抗、兰尼单抗、西利珠单抗、松匹珠单抗、他尼珠单抗、托西莫单抗、曲妥珠单抗、曲美木单抗、西莫白介素单抗、维妥珠单抗、维西珠单抗、弗洛昔单抗、扎鲁木单抗。在一些实施方式中,其他治疗剂选自:氮芥类如苯达莫司汀、苯丁酸氮芥、氮芥、环磷酰胺、异环磷酰胺、美法仑、泼尼氮芥、氯乙环磷酰胺;烷基磺酸盐如白消安、甘露舒凡、曲奥舒凡;乙烯亚胺如卡波醌、噻替哌、三亚胺醌;亚硝基脲类像卡莫司汀、福莫司汀、洛莫司汀、尼莫司汀、雷莫司汀、司莫司汀、链脲菌素;环氧化合物,例如乙环氧啶;其它烷化剂,例如达卡巴嗪、二溴甘露醇、哌血生、替莫唑胺;叶酸类似物如氨甲喋呤、培美曲塞、普拉曲沙、雷替曲塞;嘌呤类似物例如克拉屈滨、氯法拉滨、氟达拉滨、巯嘌呤、奈拉滨、硫鸟嘌呤;嘧啶类似物例乐阿扎胞苷、卡培他滨、卡莫氟、阿糖胞苷、地西他滨、氟尿嘧啶、吉西他滨、替加氟;长春花生物碱例如长春碱、长春新碱、长春碱、长春氟宁、盖诺;鬼臼毒素衍生物例如依托泊苷、替尼泊甙;秋水仙碱衍生物例如秋水仙碱;紫杉类药物如多西紫杉醇、紫杉醇、聚谷氨酸紫杉醇;其他植物生物碱和天然产物例如曲贝替定;放线菌素类化合物例如更生霉素;蒽环类例如柔红霉素、阿霉素、阿柔比星、表柔比星、伊达比星、米托蒽醌、吡柔比星、戊柔比星、祖鲁比星;其他细胞毒性抗生素例如博莱霉素、伊沙匹隆、丝裂霉素、普卡霉素;铂化合物例如卡铂、顺铂、奥沙利铂、赛特铂;甲基肼例如甲基苄肼;增敏剂如氨基酮戊酸、增敏剂、甲基氨基酮戊酸,卟吩姆钠、替莫泊芬;蛋白激酶抑制剂例如厄洛替尼、吉非替尼、达沙替尼、依维莫司、伊马替尼、拉帕替尼、尼洛替尼、帕宗纳尼、索拉非尼、舒尼替尼、替西罗莫司;其他抗肿瘤药物例如阿利维A酸、六甲蜜胺、安吖啶、阿那格雷、三氧化二砷、门冬酰胺酶、贝沙罗汀、硼替佐米、塞来昔布、地尼白介素、雌莫司汀、羟基脲、伊立替康、氯尼达明,马索丙考、米替福新、丙脒腙、米托坦、奥利默森、培门冬酶、喷司他丁、罗米地辛、塞西马集、噻唑呋林、拓扑替康、维甲酸、伏立诺他;雌激素例如二乙基茋、炔雌醇、磷雌酚、聚磷酸雌二醇;孕激素例如诺孕酮、甲孕酮、甲地孕酮;促性腺激素释放激素类似物例如布舍瑞林、戈舍瑞林、亮丙瑞林、曲普瑞林;抗雌激素例如氟维司群、他莫昔芬、托瑞米芬;抗雄激素例如比卡鲁胺、氟他胺、尼鲁米特、酶抑制剂、氨鲁米特、阿那曲唑、来曲唑、依西美坦、福美坦、伏氯唑;其他激素拮抗剂例如阿巴瑞克、地加瑞克;免疫刺激剂例如二盐酸组胺、米伐木肽、匹多莫德、普乐沙福、罗喹美克、胸腺五肽;免疫抑制剂例如依维莫司、胍立莫司、来氟米特、霉酚酸、西罗莫司;钙调神经磷酸酶抑制剂例如环孢素、他克莫司;其他免疫抑制剂例如硫唑嘌呤、甲氨蝶呤、沙利度胺、来那度胺;和放射性药物例如碘苄胍。在一些实施方式中,其他治疗剂选自检验点抑制剂。示例性的检验点抑制剂包括:PD-L1抑制剂如Genentech的MPDL3280A(RG7446)、来自BioXcell的抗-小鼠PD-L1抗体克隆10F.9G2(目录号BE0101)、来自Bristol-Meyer’sSquibb的抗-PD-L1单克隆抗体MDX-1105(BMS-936559)和BMS-935559,MSB0010718C,小鼠抗-PD-L1克隆29E.2A3,和AstraZeneca的MEDI4736;PD-L2抑制剂如葛兰素史克的AMP-224(Amplimmune),和rHIgM12B7;来自BioXcell的PD-1抑制剂如抗-小鼠PD-1抗体克隆J43(目录号BE0033-2),来自BioXcell的抗-小鼠PD-1抗体克隆RMP1-14(目录号BE0146),小鼠抗-PD-1抗体克隆EH12,默克的MK-3475抗-小鼠PD-1抗体(Keytruda,帕姆单抗,兰波单抗),称为ANB011的AnaptysBio的抗-PD-1抗体,抗体MDX-1106(ONO-4538),Bristol-MyersSquibb的人IgG4单克隆抗体纳武单抗(BMS-936558,MDX1106),AstraZeneca的AMP-514和AMP-224,来自治愈技术公司(CureTechLtd)的匹迪单抗(Pidilizumab)(CT-011);CTLA-4抑制剂如BristolMeyersSquibb的抗-CTLA-4抗体伊匹单抗(也称为MDX-010,BMS-734016和MDX-101),来自密理博的抗-CTLA4抗体克隆9H10,辉瑞的特姆单抗(CP-675,206,替西木单抗),和来自Abcam的抗-CTLA4抗体克隆BNI3;LAG3抑制剂如来自eBioscience的抗-Lag-3抗体克隆eBioC9B7W(C9B7W),来自LifeSpanBiosciences的抗-Lag3抗体LS-B2237,来自Immutep的IMP321(ImmuFact),抗-Lag3抗体BMS-986016,和LAG-3嵌合抗体A9H12;B7-H3抑制剂如MGA271;KIR抑制剂如利瑞单抗(Lirilumab)(IPH2101);CD137(41BB)抑制剂如乌鲁单抗(urelumab)(BMS-663513,Bristol-MyersSquibb),PF-05082566(抗-4-1BB,PF-2566,辉瑞),或XmAb-5592(Xencor);PS抑制剂如巴维昔单抗;和抑制剂,如针对TIM3、CD52、CD30、CD20、CD33、CD27、OX40(CD134)、GITR、ICOS、BTLA(CD272)、CD160、2B4、LAIR1、TIGHT、LIGHT、DR3、CD226、CD2、或SLAM的抗体或其片段(例如,单克隆抗体、人、人源化、或嵌合抗体)、RNAi分子、或小分子。在一些实施方式中,其他治疗剂是CD40激动剂。CD40激动剂可为抗体或其片段或小分子。示例性CD40激动剂包括:达西珠单抗(西雅图遗传学公司(SeattleGenetics)的SGN-40或huS2C6)、SEA-CD40(西雅图遗传学公司)、CP-870,893(辉瑞)、ChiLob7/4(南安普顿大学)、或ADC-1013。其他CD40激动剂可包括那些例如FGK-45,如Medina-Echeverz等“激动性CD40抗体诱导免疫介导的肝损伤并调控肿瘤诱导的骨髓抑制细胞(AgonisticCD40antibodyinducesimmune-mediatedliverdamageandmodulatestumor-inducedmyeloidsuppressivecells)”J.forImmunoTherapyofCancer2(3):P174(2014)中所述。样品用于分析免疫原性、安全性和/或毒性的样品可分离自个体。在一些情况中,样品可选自下组:全血,分离的血,血清,血浆,汗水,泪水,耳流体,痰,淋巴,骨髓悬液,淋巴,尿液,唾液,精液,阴道流体,粪便,经子宫颈的灌洗,脑脊液,脑液,腹水,母乳,玻璃体液,房水,皮脂,内淋巴(endolympth),腹膜液,胸膜液,耵聍,心外膜流体,以及呼吸道、肠道和泌尿生殖道的分泌物。在一些情况中,样品可以是组织,通常是活检样品。例如,活检可含有皮肤组织、结肠组织、直肠组织、腺组织、骨骼肌组织和/或脂肪组织。试剂盒本文也提供试剂盒和制品用于本文所述的一种或多种方法。试剂盒可含有本文所述的核酸分子中的一种或多种和/或多肽中的一种或多种,如SEQIDNO:1-45所示的多肽和核酸,或具有与选自SEQIDNO:1-45的多肽或核酸有至少40%、50%、60%、70%、80%、90%、95%或更高序列同源性的序列的多肽和/或核酸分子。该试剂盒也可含有编码一种或多种本文所述多肽的核酸。该试剂盒还可含有制备和递送疫苗所需的佐剂、试剂、和缓冲剂。该试剂盒可包含运载体、包装或容器,其经分隔可容纳一个或多个容器例如小瓶、管等,每个容器包含一种用于本文所述方法的单独元素,如多肽和佐剂。合适的容器包括例如瓶、小瓶、注射器和试管。该容器可由各种材料如玻璃或塑料制成。本发明提供的制品含有包装材料。药用包装材料的示例包括但不限于泡罩包装、瓶、管、包、容器、瓶和任何适用于所需制剂和期望的给药和治疗方式的包装材料。试剂盒一半包含列出组分和/或使用说明的标签,以及带有使用说明的包装插页。一般装有一套说明书。虽然本文显示和描述了本发明的优选实施方式,但本领域技术人员显然了解这些实施方式仅以举例方式提供。本领域技术人员在不背离本发明的情况下可以作出多种改变、变化和取代。应理解,本文所述的本发明实施方式的各种替代形式可用于实施本发明。下列权利要求书确定了本发明范围,这些权利要求范围内的方法和结构以及其等同物均为本发明所涵盖。实施例实施例1人和小鼠之间高同源性的MHCII类结合表位的确定和结直肠癌抗原的鉴定在PubMed中用术语“蛋白质表达”和“差预后”和“结直肠癌”进行文献搜索。搜索得到125篇,从中选择8种蛋白质,进一步使用下述标准进行评估:(1)表达发生率;(2)差预后的独立预测物,(3)早期疾病复发的独立预测物,和(4)结肠癌发病中的已知生物功能。表1显示8种蛋白质:CDC25B、COX2、EGFR、FASCIN1、IGF1R、PRL3、RCAS1和VCP。表1CRC抗原。蛋白质过表达发生率(n)小鼠完整蛋白同源性%CDC25B45%(181)82%COX281%(284)93%EGFR54%(99)95%FASCIN171%(221)99%IGF1R51%(144)98%PRL356%(46)77%RCAS145%(106)99%VCP68%(88)100%人对象。图1显示评估50名结直肠癌患者针对各候选蛋白的抗体应答。结直肠癌患者年龄为31-83岁(年龄中值61.5),女性50%。图2显示包括1期(12%)、2期(16%)、3期(28%)、和4期(34%)结直肠癌患者血清。所有血清等分并储存于-80摄氏度。图3显示50名正常供体年龄为23-84岁(年龄中值51.5),女性32%。所有血清等分并储存于-80摄氏度。收集并冷冻保存10名志愿者对照和10名结直肠癌患者的外周血单核细胞(PBMC)。使用重组蛋白质的间接ELISA。针对所有提出的候选抗原合成蛋白质。IgG抗体对候选抗原的应答通过Park(2008)所述的间接ELISA进行评估,所进行的调整为ImmuluxHB平底微孔板用碳酸钠缓冲液中的100ng/ml人全长重组蛋白质包被过夜。450nm处读取显色板。结果计算为从缓冲液包被孔的OD值中减去蛋白质包被孔的OD值,如Cecil(2013)所述。间接ELISA试验的评估和western印迹验证。所有测试蛋白质是免疫原性的,即至少有一个分析个体证明了针对特异抗原的可检测的IgG抗体免疫,这可由具有合适特异性对照的间接ELISA所证明。可在志愿者对照和癌症患者中鉴定到抗体应答。为了说明针对特定抗原的免疫率,使用平均ug/ml和2个标准差的对照群来确定95%置信度下认为应答为阳性的截止值。用未配对的双尾斯氏t检验对人血清IgG应答进行评估,显著性设置为p<0.05,使用GraphPadPrism5.0版。图4显示在0.51ug/ml处确定CDC25B的截止值。图5显示在0.63ug/ml处确定COX2的截止值。图6显示在2.57ug/ml处确定EGFR的截止值。图7显示在1.44ug/ml处确定FASCINI的截止值。图8显示在3.77ug/ml处确定IGF1R的截止值。图9显示在0.93ug/ml处确定PRL3的截止值。图10显示在2.12ug/ml处确定RCAS1的截止值。图11显示在3.38ug/ml处确定VCP的截止值。图4-11在y轴显示蛋白质特异血清IgG(ug/ml),并在x轴显示实验组。正常对照的平均和两个标准偏差通过虚线表示,并且显示癌症和正常对照组之间p<0.05的截止值。所有测试抗原的抗体在结直肠癌蛋白质中相比志愿正常供体对照中显著升高。CDC25B、COX2、FASCIN1和RCAS1的阳性和阴性样品通过Western印迹进行验证,如Park(2008)所述。300ng重组CDC25B、COX2、FASCIN1和RCAS1在Mini-PROTEANTGX凝胶上分离,用抗CDC25B、抗COX2、抗FASCIN1、抗RCAS1多克隆抗体或实验血清进行探测。鉴定候选抗原用于表位作图。选择所有8种与结直肠癌相关的免疫原性蛋白质移向表位作图。实施例2鉴定源自结直肠癌抗原的混杂高亲和性结合II类表位按照计算机作图来构建肽。如Park(2008)所述预测并筛选肽序列。生成8种蛋白质的热图和结合亲和性分数,并根据预测的最高结合亲和性对表位进行排列。选择在人和小鼠之间共有≥90%同源性的最终肽。选择并合成具有预测的最高结合亲和性的肽。合成并通过高效液相色谱纯化肽,然后冻干。表2列出了选择并合成的8种抗原的45种肽。表3显示候选蛋白质的中值肽覆盖是总序列的21%(范围4-54%)。表2.CRC肽。表3.候选蛋白质的肽覆盖。IFN-γELISpot试验。源自基于网络的算法预测结合人MHCII表位的CDC25B、COX2、FASCIN1、和RCAS1蛋白质,和CDC25B、COX2、FASCIN1、和RCAS1肽诱导癌症患者中相比志愿正常供体对照中更高量级应答的Th1免疫。通过抗原特异性IFN-γELISpot评估PBMC。以2x105/孔将细胞接种于下述培养基中,含10ug/ml所选CDC25B、COX2、FASCIN1和RCAS1肽、HIVp17(基因医学合成公司(GenemedSynthesisInc.))、PHA(1ug/ml密苏里州圣路易斯市的西格玛公司(Sigma,St.Louis,MO))、CEF(2.5ug/ml,加利福尼亚州弗里蒙特的AnaSpec公司)的培养基,或具有庆大霉素、L-谷氨酰胺的X-Vivo15、或仅酚红培养基中(马里兰州沃克斯维尔的Lonza公司),5%CO2培养器中37℃持续7天。在第5天,加入重组人IL-2(10U/ml)。通过在第8天向原始培养物加入2x105肽-加载的(与上述相同浓度)自体辐射(30000rads)人PBMC并孵育24小时,进行第二体外刺激。密理博(Millipore)MultiScreen96孔分析板(德克萨斯州休斯顿市的密理博公司)用PBS中的2%牛血清白蛋白包被之后用PBMC培养基孵育24小时。多次洗涤后,加入0.1ug/ml生物素化的抗-人IFN-γ(克隆1-D1K,俄亥俄州马里蒙特的Mabtech公司)持续2小时。ELISpot试验经显色并在每孔校正的点上计算统计学显著性,如Park2008和Cecil2013所述。结直肠癌和志愿对照的各肽的每孔校正的点(CSPW)显示为带杜克晶须的四分位盒图。横线条显示中值CSPW,相比志愿正常供体对照的*p<0.05或***p<0.001。图12显示CSPW,IFN-γ在y轴,并且在结直肠癌和志愿正常供体对照中测试的CDC25B抗原(rCDC25B、p130和p405)在x轴。图13显示CSPW,IFN-γ在y轴,并且在结直肠癌和志愿正常供体对照中测试的COX2抗原(rCOX2、p81、p279和p538)在x轴。图14显示CSPW,IFN-γ在y轴,并且在结直肠癌和志愿正常供体对照中测试的FASCIN1抗原(rFASCIN1、p21、p138、p190和p374)在x轴。图15显示CSPW,IFN-γ在y轴,并且在结直肠癌和志愿正常供体对照中测试的RCAS1抗原(rRCAS1、p8、p91、p126和p161)在x轴。图16显示CSPW,IFN-γ在y轴,并且在结直肠癌和志愿正常供体对照中测试的抗原(HIVp17、PHA、tt和CEF)在x轴。实施例3构建靶向结直肠癌抗原的肽疫苗并使用3种小鼠模型确定安全性和免疫原性使用三种小鼠模型:APCmin小鼠模型、AOM小鼠模型、和MC-38小鼠模型鉴定基于肽的疫苗构建体的免疫原性和有效性,所述构建体包含选自CDC25B、COX2、EGFR、FASCIN1、IGF1R、PRL3、RCAS1和VCP的肽。表4显示三种小鼠模型中肽功效的总结。表4.三种小鼠模型中肽功效的总结。APCmin小鼠模型。APCmin的后代通过PCR针对Min突变的存在进行基因分型,使用下述引物:野生型:5’-GCCATCCCTTCACGTTAG-3’(SEQIDNO:46),共有5’-TTCCACTTTGGCATAAGGC-3’(SEQIDNO:47),突变:5’-TCCTGAGAAAGACAGAAGTTA-3’(SEQIDNO:48)。针对Min突变测试阳性的雄性和雌性小鼠均包括在研究中并随机分组。APCmin体内实验。4-6周龄时,小鼠用CFA/IFA、PBS和疫苗组进行免疫。各组每7-10天接受一次皮下注射(100ulPBS、50ulCFA和50ulPBS,50ug各肽和50ulCFA),总计三剂,并在第三次疫苗之后4-5周给予一次加强剂。参见表5包括在疫苗组合物中的肽。首次疫苗后,CFA用IFA替代。14-17周龄处死所有小鼠,收集胃肠道并计数肿瘤。表5.APCmin体内实验:疫苗组合物中包括的肽。图17显示用源自CDC25B的肽进行免疫显著抑制APCmin小鼠的小肠肿瘤负荷。小肠肿瘤计数示于y轴,APCmin免疫组示于x轴。各值点代表一只小鼠的小肠中的肿瘤数量。使用未配对双尾斯氏t检验计算的p值在CFA/IFA(n=10)和CDC25B(组n=8)免疫的APCmin小鼠之间统计上显著,p=0.0003。图18显示用源自CDC25B的肽进行免疫不显著抑制APCmin小鼠中的结肠肿瘤负荷。结肠肿瘤计数示于y轴,APCmin免疫组示于x轴。各值点代表一只小鼠的结肠中的肿瘤数量。使用未配对双尾斯氏t检验计算的p值在CFA/IFA(n=10)和CDC25B(组n=8)免疫的APCmin小鼠之间统计上不显著,p=0.74。图19显示用源自COX2的肽进行免疫显著抑制APCmin小鼠的小肠肿瘤负荷。小肠肿瘤计数示于y轴,APCmin免疫组示于x轴。各值点代表一只小鼠的小肠中的肿瘤数量。使用未配对双尾斯氏t检验计算的p值在CFA/IFA(n=10)和COX2(组n=8)免疫的APCmin小鼠之间统计上显著,p<0.0001。图20显示用源自COX2的肽进行免疫不显著抑制APCmin小鼠中的结肠肿瘤负荷。结肠肿瘤计数示于y轴,APCmin免疫组示于x轴。各值点代表一只小鼠的结肠中的肿瘤数量。使用未配对双尾斯氏t检验计算的p值在CFA/IFA(n=10)和COX2(组n=8)免疫的APCmin小鼠之间统计上不显著,p=0.84。图21显示用源自CDC25B和COX2的肽进行免疫显著抑制APCmin小鼠中的肿瘤负荷(n=8小鼠/组)。小肠肿瘤计数示于y轴,实验组示于x轴。各值点代表一只小鼠的小肠中的肿瘤数量。使用未配对双尾斯氏t检验计算的p值相比CFA对照组统计上显著,*p<0.05或**p<0.005。图22显示用源自EGFR的肽进行免疫显著抑制APCmin小鼠的小肠肿瘤负荷。小肠肿瘤计数示于y轴,APCmin免疫组示于x轴。各值点代表一只小鼠的小肠中的肿瘤数量。使用未配对双尾斯氏t检验计算的p值在CFA/IFA(n=10)和EGFR(组n=8)免疫的APCmin小鼠之间统计上显著,p<0.0001。图23显示用源自EGFR的肽进行免疫不显著抑制APCmin小鼠中的结肠肿瘤负荷。结肠肿瘤计数示于y轴,APCmin免疫组示于x轴。各值点代表一只小鼠的结肠中的肿瘤数量。使用未配对双尾斯氏t检验计算的p值在CFA/IFA(n=10)和EGFR(组n=8)免疫的APCmin小鼠之间统计上不显著,p=0.71。图24显示用源自FASCIN1的肽进行免疫显著抑制APCmin小鼠的小肠肿瘤负荷。小肠肿瘤计数示于y轴,APCmin免疫组示于x轴。各值点代表一只小鼠的小肠中的肿瘤数量。使用未配对双尾斯氏t检验计算的p值在CFA/IFA(n=10)和FASCIN1(组n=9)免疫的APCmin小鼠之间统计上显著,p<0.0001。图25显示用源自FASCIN1的肽进行免疫不显著抑制APCmin小鼠中的结肠肿瘤负荷。结肠肿瘤计数示于y轴,APCmin免疫组示于x轴。各值点代表一只小鼠的结肠中的肿瘤数量。使用未配对双尾斯氏t检验计算的p值在CFA/IFA(n=10)和FASCIN1(组n=9)免疫的APCmin小鼠之间统计上不显著,p=0.93。图26显示用源自IGF1R的肽进行免疫显著抑制APCmin小鼠的小肠肿瘤负荷。小肠肿瘤计数示于y轴,APCmin免疫组示于x轴。各值点代表一只小鼠的小肠中的肿瘤数量。使用未配对双尾斯氏t检验计算的p值在CFA/IFA(n=10)和IGF1R(组n=10)免疫的APCmin小鼠之间统计上显著,p=0.0016。图27显示用源自IGF1R的肽进行免疫不显著抑制APCmin小鼠中的结肠肿瘤负荷。结肠肿瘤计数示于y轴,APCmin免疫组示于x轴。各值点代表一只小鼠的结肠中的肿瘤数量。使用未配对双尾斯氏t检验计算的p值在CFA/IFA(n=10)和IGF1R(组n=10)免疫的APCmin小鼠之间统计上不显著,p=0.078。图28显示用源自PRL3的肽进行免疫显著抑制APCmin小鼠的小肠肿瘤负荷。小肠肿瘤计数示于y轴,APCmin免疫组示于x轴。各值点代表一只小鼠的小肠中的肿瘤数量。使用未配对双尾斯氏t检验计算的p值在CFA/IFA(n=10)和PRL3(组n=13)免疫的APCmin小鼠之间统计上显著,p=0.0006。图29显示用源自PRL3的肽进行免疫不显著抑制APCmin小鼠中的结肠肿瘤负荷。结肠肿瘤计数示于y轴,APCmin免疫组示于x轴。各值点代表一只小鼠的结肠中的肿瘤数量。使用未配对双尾斯氏t检验计算的p值在CFA/IFA(n=10)和PRL3(组n=13)免疫的APCmin小鼠之间统计上不显著,p=0.42。图30显示用源自RCAS1的肽进行免疫显著抑制APCmin小鼠的小肠肿瘤负荷。小肠肿瘤计数示于y轴,APCmin免疫组示于x轴。各值点代表一只小鼠的小肠中的肿瘤数量。使用未配对双尾斯氏t检验计算的p值在CFA/IFA(n=10)和RCAS1(组n=11)免疫的APCmin小鼠之间统计上显著,p=0.002。图31显示用源自RCAS1的肽进行免疫不显著抑制APCmin小鼠中的结肠肿瘤负荷。结肠肿瘤计数示于y轴,APCmin免疫组示于x轴。各值点代表一只小鼠的结肠中的肿瘤数量。使用未配对双尾斯氏t检验计算的p值在CFA/IFA(n=10)和RCAS1(组n=11)免疫的APCmin小鼠之间统计上不显著,p=0.24。图32显示用源自VCP的肽进行免疫显著抑制APCmin小鼠的小肠肿瘤负荷。小肠肿瘤计数示于y轴,APCmin免疫组示于x轴。各值点代表一只小鼠的小肠中的肿瘤数量。使用未配对双尾斯氏t检验计算的p值在CFA/IFA(n=10)和VCP(组n=11)免疫的APCmin小鼠之间统计上显著,p=0.0017。图33显示用源自VCP的肽进行免疫显著抑制APCmin小鼠的结肠肿瘤负荷。结肠肿瘤计数示于y轴,APCmin免疫组示于x轴。各值点代表一只小鼠的结肠中的肿瘤数量。使用未配对双尾斯氏t检验计算的p值在CFA/IFA(n=10)和VCP(组n=11)免疫的APCmin小鼠之间统计上不显著,p=0.014。图34显示用源自MIX,CDC25B、COX2和PRL3的组合,的肽的免疫显著抑制APCmin小鼠的小肠肿瘤负荷。小肠肿瘤计数示于y轴,APCmin免疫组示于x轴。各值点代表一只小鼠的小肠中的肿瘤数量。使用未配对双尾斯氏t检验计算的p值在CFA/IFA(n=10)和MIX(组n=10)免疫的APCmin小鼠之间统计上显著,p<0.0001。图35显示用源自MIX的肽进行免疫显著抑制APCmin小鼠的结肠肿瘤负荷。结肠肿瘤计数示于y轴,APCmin免疫组示于x轴。各值点代表一只小鼠的结肠中的肿瘤数量。使用未配对双尾斯氏t检验计算的p值在CFA/IFA(n=10)和MIX(组n=10)免疫的APCmin小鼠之间统计上不显著,p=0.0086。APCmin存活研究体内实验。4-6周龄时,小鼠用CFA/IFA、PBS和免疫组进行免疫。各组每7-10天接受一次皮下注射(100ulPBS、50ulCFA和50ulPBS,每50ug肽和50ulCFA),总计三剂,并在三次疫苗之后4-5周给予加强疫苗。参见表6包括在疫苗组合物中的肽。首次疫苗后,CFA用IFA替代。一周两次观察小鼠的健康情况和身体状况,若濒死则处死。处死时,收集小肠并计数小肠肿瘤。表6.APCmin存活研究体内实验:疫苗组合物中包括的肽。图36显示用源自CDC25B、COX2和PRL3肽的肽进行免疫不显著抑制APCmin小鼠的小肠肿瘤负荷。小肠肿瘤计数示于y轴,APCmin免疫组示于x轴。各值点代表一只小鼠的小肠中的肿瘤数量。使用未配对双尾斯氏t检验计算的p值在使用CFA/IFA(n=4)和疫苗组CDC25B(n=7,p=0.65)、COX2(n=8,p=0.24)、PRL3(n=6,p=0.84)免疫的APCmin小鼠之间统计上不显著。APCmin毒性研究体内实验。用PBS(n=2)、CFA(n=3)、CDC25B(n=6)、COX2(n=2)和PRL3(n=2)免疫的APCmin小鼠的血液转移至凝血激活剂的管进行血清分离,和肝素锂管得到血浆。正常C57BI6/J对照的数据取自“11个小鼠纯系的杰克逊实验室密度计量调查MPD:jaxpheno1.小鼠表型数据网,杰克逊实验室,美国缅因州巴尔港,http://phenome.jax.org,2013年5月”。使用Tukey多重比较检验计算P值。*=p<0.05,**=p<0.01,***=p<0.001。图37显示用PBS、CFA、CDC25B、COX2和PRL3免疫的小鼠的血液分析AST、ALT、BUN、ALP、胆固醇和葡萄糖/血清。y轴显示血清中的化学化合物的水平,每升单位数或每分升毫克数。小鼠免疫组示于x轴。APCminIFN-γ研究体内实验。96孔MAIPS硝酸纤维素板在70%EtOH中预浸渍,并用10ug/ml抗小鼠IFN-γ抗体孵育过夜。第二天,用PBS洗板三次并在37℃的CO2孵育器中用PBS+2%BSA封闭2小时。用PBS洗板三次并以3x105细胞/孔接种分离的小鼠脾细胞(6重复/抗原)。加入抗原并将板置于37℃CO2孵育器中持续72小时。阳性对照是PHA(5ug/ml)、PMA/I(2ug/ml)和CD3(1:10,000),阴性对照是无抗原孔,所有肽以20ug/ml加入。用1xPBS洗板一次,然后用PBS+0.05%吐温缓冲液洗板两次。图38-39显示针对PRL3肽的免疫的IFN-γ应答,每孔的平均点(6孔重复)在y轴上,用于刺激t细胞的抗原在x轴上。柱上的星号(*)表示用未配对双尾斯氏t检验的相对无抗原孔的显著性,p<0.05。ELISpot图旁的表显示个体免疫小鼠的处死周龄和小肠肿瘤计数。图38显示用PRL3抗原免疫的8只小鼠(M158,F188,F191,F162,F182,M219,M221和M224)的IFN-γ应答。图39显示用PRL3抗原免疫的5只小鼠(F228,F236,F246,F235和F243)的IFN-γ应答。AOM小鼠模型。AOM小鼠体内实验。6周龄时,FVB小鼠用CFA/IFA、PBS和疫苗组进行免疫。各组每10-14天接受一次皮下注射(100ulPBS、50ulCFA和50ulPBS,50ug各肽和50ulCFA),总计三剂,并在第三次疫苗之后每4-5周给予加强剂。参见表7包括在疫苗组合物中的肽。首次疫苗后,CFA用IFA替代。第三次疫苗后7天,用10mg/kg氧化偶氮甲烷(AOM)注射小鼠,每周两次持续6周。26周龄时,处死所有小鼠并计数结肠中的肿瘤。表7.AOM小鼠体内实验:疫苗组合物中包括的肽。图40显示用源自CDC25B的肽进行免疫显著抑制AOM小鼠的结肠肿瘤负荷。结肠肿瘤计数示于y轴,AOM免疫组示于x轴。使用未配对双尾斯氏t检验计算的p值在CFA/IFA(n=10)和CDC25B(组n=10)免疫的AOM小鼠之间统计上显著,p=0.002。图41显示用源自COX2的肽进行免疫显著抑制AOM小鼠的结肠肿瘤负荷。结肠肿瘤计数示于y轴,AOM免疫组示于x轴。使用未配对双尾斯氏t检验计算的p值在CFA/IFA(n=10)和COX2(组n=10)免疫的AOM小鼠之间统计上显著,p<0.0001。图42显示用源自EGFR的肽进行免疫显著抑制AOM小鼠的结肠肿瘤负荷。结肠肿瘤计数示于y轴,AOM免疫组示于x轴。使用未配对双尾斯氏t检验计算的p值在CFA/IFA(n=4)和EGFR(组n=10)免疫的AOM小鼠之间统计上显著,p=0.01。图43显示用源自FASCIN1的肽进行免疫不显著抑制AOM小鼠中的结肠肿瘤负荷。结肠肿瘤计数示于y轴,AOM免疫组示于x轴。使用未配对双尾斯氏t检验计算的p值在CFA/IFA(n=10)和FASCIN1(组n=10)免疫的AOM小鼠之间统计上显著,p=0.05。图44显示用源自IGF1R的肽进行免疫不显著抑制AOM小鼠中的结肠肿瘤负荷。结肠肿瘤计数示于y轴,AOM免疫组示于x轴。使用未配对双尾斯氏t检验计算的p值在PBS(n=9)和IGF1R(组n=10)免疫的AOM小鼠之间统计上显著,p=0.54。P值相对于PBS对照组,CFA对照组由于AOM过量而死亡。图45显示用源自PRL3的肽进行免疫不显著抑制AOM小鼠中的结肠肿瘤负荷。结肠肿瘤计数示于y轴,AOM免疫组示于x轴。使用未配对双尾斯氏t检验计算的p值在PBS(n=9)和PRL3(组n=10)免疫的AOM小鼠之间统计上显著,p=0.53。P值相对于PBS对照组,CFA对照组由于AOM过量而死亡。图46显示用源自RCAS1的肽进行免疫不显著抑制AOM小鼠中的结肠肿瘤负荷。结肠肿瘤计数示于y轴,AOM免疫组示于x轴。使用未配对双尾斯氏t检验计算的p值在PBS(n=9)和RCAS1(组n=8)免疫的AOM小鼠之间统计上显著,p=0.14。P值相对于PBS对照组,CFA对照组由于AOM过量而死亡。图47显示用源自VCP的肽进行免疫不显著抑制AOM小鼠中的结肠肿瘤负荷。结肠肿瘤计数示于y轴,AOM免疫组示于x轴。使用未配对双尾斯氏t检验计算的p值在CFA/IFA(n=10)和VCP(组n=7)免疫的AOM小鼠之间统计上显著,p=0.1。图48显示用源自MIX,CDC25B、COX2和PRL3的组合,的肽的免疫显著抑制AOM小鼠的结肠肿瘤负荷。结肠肿瘤计数示于y轴,AOM免疫组示于x轴。使用未配对双尾斯氏t检验计算的p值在CFA/IFA(n=10)和MIX(组n=8)免疫的AOM小鼠之间统计上显著,p<0.0001。AOMIFN-γ研究体内实验。96孔MAIPS硝酸纤维素板在70%EtOH中预浸渍,并用10ug/ml抗小鼠IFN-γ抗体孵育过夜。第二天,用PBS洗板三次并在37℃的CO2孵育器中用PBS+2%BSA封闭2小时。用PBS洗板三次并以3x105细胞/孔接种分离的小鼠脾细胞(6重复/抗原)。加入抗原并将板置于37℃CO2孵育器中持续72小时。阳性对照是PHA(5ug/ml)、PMA/I(2ug/ml)和CD3(1:10,000),阴性对照是无抗原孔,所有肽以20ug/ml加入。用1xPBS洗板一次,然后用PBS+0.05%吐温缓冲液洗板两次。PBS+0.05%吐温中5ug/ml的抗小鼠IFN-γ抗体加入各孔,板在4℃孵育过夜。用PBS+0.05%吐温洗板两次,然后用PBS洗板一次。稀释的链霉亲和素-HRP加入板中并室温孵育45分钟。用AECELISPOT底物试剂盒将板显色。产生蛋白质特异性IFN-γ的点的数量增加相比无抗原对照孔和/或对照(p<0.05)统计上不同时,其示为免疫应答的指标。图49-51显示针对肽的免疫的IFN-γ应答,使用n=3小鼠池并且每孔的平均点(6孔重复)在y轴上,用于刺激t细胞的抗原在x轴上。柱上的星号(*)表示用未配对双尾斯氏t检验的相对无抗原孔的显著性,p<0.05。ELISpot图旁的表显示个体免疫小鼠的处死周龄和结肠肿瘤计数。图49显示用CDC25B抗原:CDC25B、p130-150和p405-427免疫的三只小鼠(F31、F32和F38)的IFN-γ应答。图50显示用PRL3抗原:PRL-3、p12-30、p33-53、p81-95、p104-122和p124-142免疫的三只小鼠(F91、F93、F95)的IFN-γ应答。图51显示用RCAS1抗原:RCAS1、p8-27、p91-110、p126-148和p161-181免疫的三只小鼠(F121、F124和F126)的IFN-γ应答。图52-54显示针对IGF1R肽的免疫的IFN-γ应答,每孔的平均点(6孔重复)在y轴上,用于刺激t细胞的抗原在x轴上。柱上的星号(*)表示用未配对双尾斯氏t检验的相对无抗原孔的显著性,p<0.05。ELISpot图旁的表显示个体免疫小鼠的处死周龄和结肠肿瘤计数。图52显示用IGF1R免疫的10只小鼠(F61,F62,F63,F64,F65,F66,F67,F68,F69和F70)的IFN-γ应答。图53显示用PRL3免疫的10只小鼠(F91,F92,F93,F94,F95,F96,F97,F98,F99和F100)的IFN-γ应答。图54显示用RCAS1免疫的8只小鼠(F121,F124,F125,F127,F128,F129和F130)的IFN-γ应答。AOMmRNA研究体内实验。从免疫的小鼠中分离总RNA并如上所述(Broussard,2013)定量基因表达。表8显示使用的特异性mRNA引物。表8.AOMmRNA研究:mRNA引物图55显示用CDC25B、COX2、FASCIN1和RCAS1免疫的AOM小鼠的mRNA水平。y轴显示标准化至PBS的相对mRNA表达。x轴显示AOM处理的FVB小鼠结肠肿瘤的实验组。计算的p值在PBS处理小鼠和肽免疫小鼠中的表达之间的差异,*p<0.05,**p<0.01,***p<0.001。AOM蛋白质表达体内研究实验。使用从用源自CDC25B、COX2、EGFR、FASCIN1、IGF1R、PRL3、RCAS1和VCP的肽进行免疫的小鼠的结肠肿瘤中分离的蛋白质进行Western印迹,如上所述(Broussard,2013)。所用具体试剂包括:CDC25B(羊多抗AF1649,R&D系统公司,明尼苏达州明尼阿波利斯),COX2(兔多抗ab15191,Abcam公司,马萨诸塞州剑桥),EGFR(羊多抗,AF1280,R&D系统),FASCIN1(鼠单抗D-10,sc-46675,SantaCruz生物科技公司,加利福尼亚州圣克鲁斯),IGF1R(兔多抗N-20,sc-712,SantaCruz生物科技公司),PRL3(鼠单抗318,sc-130355,SantaCruz生物科技公司),RCAS1(羊多抗,ab52032,Abcam公司),VCP(兔多抗H-120,sc-20799,SantaCruz生物科技公司),和重组人蛋白质(都来自台湾中壢的亚诺法(Abnova)公司):CDC25B(ab158074,Abcam公司),COX2(ptgs2)(ab159279,Abcam公司),EGFR,FASCIN1(TP303031,Origene技术公司),PRL3(ptp4a3),RCAS1(ebag9)(TP315667,Origene技术公司),VCP和20ug的IGF1R转染的COS7细胞裂解物(Cecil等,2012)。图56显示用CDC25B、COX2、FASCIN1和RCAS1免疫的AOM小鼠的蛋白质表达。y轴显示标准化至微管蛋白的相对蛋白质表达。x轴显示AOM处理的FVB小鼠结肠肿瘤的实验组(n=1)。计算的p值在PBS处理小鼠和肽免疫小鼠中的表达之间的差异,*p<0.05,**p<0.01,***p<0.001。MC-38小鼠模型。MC-38肿瘤移植体内实验。6周龄时,小鼠用CFA/IFA、PBS和疫苗组进行免疫。各组每10-14天接受一次皮下注射(100ulPBS、50ulCFA和50ulPBS,50ug各肽和50ulCFA),总计三剂。参见表9包括在疫苗组合物中的肽。第二和第三次疫苗用IFA替代CFA。最终疫苗两周后,皮下植入4x104个MC-38细胞(小鼠腺癌),并用Vernier游标卡尺每周测量2-3次肿瘤生长。肿瘤体积计算为长度x宽度x高度xπ/6,这是椭圆的标准体积计算。当对照小鼠的肿瘤尺寸超过1000mm3时处死小鼠。表9.MC-38肿瘤移植体内实验:疫苗组合物中包括的肽图57显示用源自CDC25B的肽进行免疫显著抑制MC-38肿瘤移植小鼠的肿瘤体积。以mm3计的肿瘤体积示于y轴,MC-38肿瘤移植入C57Bl/6小鼠免疫组中的天数示于x轴。在第18天,使用未配对双尾斯氏t检验计算的p值在CFA/IFA(n=4)和CDC25B(n=8)免疫的C57Bl/6小鼠之间统计上显著,p=0.0003。MC-38肿瘤移植后18天处死小鼠。图58显示用源自COX2的肽进行免疫显著抑制MC-38肿瘤移植小鼠的肿瘤体积。以mm3计的肿瘤体积示于y轴,MC-38肿瘤移植入C57Bl/6小鼠免疫组中的天数示于x轴。在第18天,使用未配对双尾斯氏t检验计算的p值在CFA/IFA(n=4)和COX2(n=8)免疫的C57Bl/6小鼠之间统计上显著,p<0.0001。MC-38肿瘤移植后18天处死小鼠。图59显示用源自EGFR的肽进行免疫不显著抑制MC-38肿瘤移植小鼠的肿瘤体积。以mm3计的肿瘤体积示于y轴,MC-38肿瘤移植入C57Bl/6小鼠免疫组中的天数示于x轴。在第23天,使用未配对双尾斯氏t检验计算的p值在CFA/IFA(n=3)和EGFR(n=3)免疫的C57Bl/6小鼠之间统计上不显著,p=0.06。MC-38肿瘤移植后23天处死小鼠。图60显示用源自FASCIN1的肽进行免疫显著抑制MC-38肿瘤移植小鼠的肿瘤体积。以mm3计的肿瘤体积示于y轴,MC-38肿瘤移植入C57Bl/6小鼠免疫组中的天数示于x轴。在第23天,使用未配对双尾斯氏t检验计算的p值在CFA/IFA(n=3)和FASCIN1(n=3)免疫的C57Bl/6小鼠之间统计上显著,p=0.008。MC-38肿瘤移植后23天处死小鼠。图61显示用源自IGF1R的肽进行免疫不显著抑制MC-38肿瘤移植小鼠的肿瘤体积。以mm3计的肿瘤体积示于y轴,MC-38肿瘤移植入C57Bl/6小鼠免疫组中的天数示于x轴。在第23天,使用未配对双尾斯氏t检验计算的p值在CFA/IFA(n=5)和IGF1R(n=8)免疫的C57Bl/6小鼠之间统计上不显著,p=0.3。CFA/IFA免疫的小鼠在MC-38肿瘤移植后23天处死,IGF1R免疫的小鼠在肿瘤移植后28-32天处死。图62显示用源自PRL3的肽进行免疫显著抑制MC-38肿瘤移植小鼠的肿瘤体积。以mm3计的肿瘤体积示于y轴,MC-38肿瘤移植入C57Bl/6小鼠免疫组中的天数示于x轴。在第20天,使用未配对双尾斯氏t检验计算的p值在CFA/IFA(n=3)和PRL3(n=3)免疫的C57Bl/6小鼠之间统计上显著,p<0.0001。MC-38肿瘤移植后23天处死小鼠。图63显示用源自PRL3的肽进行免疫显著抑制MC-38肿瘤移植小鼠的肿瘤体积。以mm3计的肿瘤体积示于y轴,MC-38肿瘤移植入C57Bl/6小鼠免疫组中的天数示于x轴。在第23天,使用未配对双尾斯氏t检验计算的p值在CFA/IFA(n=5)和PRL3(n=4)免疫的C57Bl/6小鼠之间统计上显著,p=0.0062。MC-38肿瘤移植后23天处死小鼠。图64显示用源自PRL3的肽进行免疫显著抑制MC-38肿瘤移植小鼠的肿瘤体积。以mm3计的肿瘤体积示于y轴,MC-38肿瘤移植入C57Bl/6小鼠免疫组中的天数示于x轴。在第18天,使用未配对双尾斯氏t检验计算的p值在CFA/IFA(n=4)和PRL3(n=4)免疫的C57Bl/6小鼠之间统计上显著,p=0.0026。MC-38肿瘤移植后18天处死小鼠。图65显示用源自RCAS1的肽进行免疫显著抑制MC-38肿瘤移植小鼠的肿瘤体积。以mm3计的肿瘤体积示于y轴,MC-38肿瘤移植入C57Bl/6小鼠免疫组中的天数示于x轴。在第23天,使用未配对双尾斯氏t检验计算的p值在CFA/IFA(n=3)和RCAS1(n=3)免疫的C57Bl/6小鼠之间统计上显著,p=0.01。MC-38肿瘤移植后23天处死小鼠。图66显示用源自RCAS1的肽进行免疫显著抑制MC-38肿瘤移植小鼠的肿瘤体积。以mm3计的肿瘤体积示于y轴,MC-38肿瘤移植入C57Bl/6小鼠免疫组中的天数示于x轴。在第23天,使用未配对双尾斯氏t检验计算的p值在CFA/IFA(n=4)和RCAS1(n=4)免疫的C57Bl/6小鼠之间统计上显著,p=0.046。MC-38肿瘤移植后23天处死小鼠。图67显示用源自RCAS1的肽进行免疫显著抑制MC-38肿瘤移植小鼠的肿瘤体积。以mm3计的肿瘤体积示于y轴,MC-38肿瘤移植入C57Bl/6小鼠免疫组中的天数示于x轴。在第18天,使用未配对双尾斯氏t检验计算的p值在CFA/IFA(n=4)和RCAS1(n=4)免疫的C57Bl/6小鼠之间统计上显著,p=0.0031。MC-38肿瘤移植后18天处死小鼠。图68显示用源自VCP的肽进行免疫不显著抑制MC-38肿瘤移植小鼠的肿瘤体积。以mm3计的肿瘤体积示于y轴,MC-38肿瘤移植入C57Bl/6小鼠免疫组中的天数示于x轴。在第23天,使用未配对双尾斯氏t检验计算的p值在CFA/IFA(n=3)和VCP(n=3)免疫的C57Bl/6小鼠之间统计上显著,p=0.65。MC-38肿瘤移植后23天处死小鼠。图68显示用源自MIX,CDC25B、COX2和PRL3的组合,的肽进行免疫显著抑制MC-38肿瘤移植小鼠的肿瘤体积。以mm3计的肿瘤体积示于y轴,MC-38肿瘤移植入C57Bl/6小鼠免疫组中的天数示于x轴。在第18天,使用未配对双尾斯氏t检验计算的p值在CFA/IFA(n=4)和MIX(n=8)免疫的C57Bl/6小鼠之间统计上显著,p<0.0001。MC-38肿瘤移植后18天处死小鼠。MC-38IFN-γ研究体内实验。96孔MAIPS硝酸纤维素板(Millipore公司)在70%EtOH中预浸渍,并用10ug/ml抗小鼠IFN-g抗体(Mabtech公司)孵育过夜。第二天,用PBS洗板三次并在37℃的CO2孵育器中用PBS+2%BSA封闭2小时。用PBS洗板三次并以3x105细胞/孔接种分离的小鼠脾细胞(6重复/抗原)。加入抗原并将板置于37℃CO2孵育器中持续72小时。阳性对照是PHA(5ug/ml)、PMA/I(2ug/ml)和CD3(1:10,000),阴性对照是无抗原孔,所有肽以20ug/ml加入。用1xPBS洗板一次,然后用PBS+0.05%吐温缓冲液洗板两次。PBS+0.05%吐温中5ug/ml的抗小鼠IFN-γ抗体(Mabtech公司)加入各孔,板在4℃孵育过夜。用PBS+0.05%吐温洗板两次,然后用PBS洗板一次。稀释的链霉亲和素-HRP(Mabtech公司)加入板中并室温孵育45分钟。用AECELISPOT底物试剂盒(BD生物科学公司)将板显色。产生蛋白质特异性IFN-γ的点的数量增加相比无抗原对照孔和/或对照(p<0.05)显著不同时,其示为免疫应答的指标。图70显示针对IGF1R肽的免疫的IFN-γ应答,每孔的平均点(6孔重复)在y轴上,用于刺激t细胞的抗原在x轴上。柱上的星号(*)表示用未配对双尾斯氏t检验的相对无抗原孔的显著性,p<0.05。ELISpot图旁的表显示个体免疫小鼠的处死周龄、MC-38肿瘤移植的天数和肿瘤体积mm3。图71显示针对PRL3肽的免疫的IFN-γ应答,每孔的平均点(6孔重复)在y轴上,用于刺激t细胞的抗原在x轴上。柱上的星号(*)表示用未配对双尾斯氏t检验的相对无抗原孔的显著性,p<0.05。ELISpot图旁的表显示个体免疫小鼠的处死周龄、MC-38肿瘤移植的天数和肿瘤体积mm3。CD4和CD8缺失的MC-38肿瘤移植研究体内实验。5周龄雌性C57Bl6/J小鼠购自杰克逊实验室(加利福尼亚州圣地亚哥)。驯化一周后,用仅PBS(n=5)或疫苗+佐剂(n=20)对小鼠进行皮下接种三次,两周间隔。完全弗氏佐剂用于第一次疫苗,然后后续疫苗使用不完全弗氏佐剂(美国密苏里州圣路易斯的西格玛-奥德里奇公司)。最终疫苗两周后,小鼠用40,000MC38细胞进行皮下刺激。在发展可触摸肿瘤块后,每疫苗组n=5只小鼠腹膜内连续3天注射100ug抗大鼠IgG2b、100ug抗CD8或250ug抗CD4(UCSF单克隆抗体中心,加利福尼亚州南旧金山)。继续给予抗体,每周进行两次,直到研究结束。使用Vernier游标卡尺酶每2-3天监控小鼠的肿瘤生长。肿瘤体积计算为长x宽x高x0.5236。图72显示CDC25B免疫并且IgG、CD8和CD4消耗的MC-38小鼠的肿瘤体积。图73显示COX2免疫并且IgG、CD8和CD4消耗的MC-38小鼠的肿瘤体积。图74显示FASCIN1免疫并且IgG、CD8和CD4消耗的MC-38小鼠的肿瘤体积。实施例4-鉴定混杂MHCII类表位用于开发人疫苗的方法使用从3个不同公开算法的汇编结果鉴定最常见的HLA-DR蛋白质中14种的预测MHCII表位。使用算法生成表位结合评分来对预测含有与多种HLA-DR蛋白质相互作用的表位的蛋白质序列内的表位进行作图,这些表位称为“混杂表位”。算法筛选的14种HLA-DR蛋白质为:HLA-DRB1*0101、HLA-DRB1*0301、HLA-DRB1*0401、HLA-DRB1*0404、HLA-DRB1*0405、HLA-DRB1*0701、HLA-DRB1*0802、HLA-DRB1*0901、HLA-DRB1*1101、HLA-DRB1*1201、HLA-DRB1*1302、HLA-DRB1*1501、HLA-DRB4*0101、和HLA-DRB5*0101。采用的基于网页的算法是SYFPEITHI(http://www.syfpeithi.de/Scripts/MHCServer.dll/EpitopePrediction.htm)、PROPRED(http://www.imtech.res.in/raghava/propred/)、和RANKPEP(http://imed.med.ucm.es/Tools/rankpep.html)。可用于筛选的HLA-DR蛋白质的数量在各网站之间变化(上述14种中的6、11或13种)。从NCBI数据库中获得参考蛋白质序列并且复制到FASRA格式中用于进入算法搜索引擎并且使用各HLA-DR蛋白质的前20种评分表位来产生参考蛋白质的“MHCII热图”。为了汇编和分析表位预测数据,开发基于MSExcel的工作簿,称为“MHCII热图模板”。由于三种算法各自有鉴定表位的不同评分系统,在汇编来自不同检索方法的结果之前首先标准化表位评分。为了标准化表位评分,所有评分除以通过各算法获得的顶部分数,使得具有最高预测亲和性的表位应具有1.0的标准化评分。然后将标准化的评分粘贴到MHCII热图模板中,其用多个包埋的等式和功能来进行以下任务:(i)特定表位的各氨基酸分配表位的标准化评分,(ii)计算并绘制在各氨基酸位置处有表位的不同HLA-DR蛋白质/等位基因的数量,(iii)在各氨基酸位置处计算并绘制各表位的标准化评分的总和,和(iv)计算并绘制“多评分”,其为标准化的评分总和与HLA-DR等位基因的积。多评分表示表位结合强度和表位混杂性,并且可使用该值来产生参考蛋白质的MHCII热图。氨基酸位置(x轴)对比多评分(y轴)的图能够易于观察预测含有混杂表位的蛋白质区。另外,产生MSAccess应用以简化FASTA蛋白质序列输入到MHCII热图模板的纵列。一旦蛋白质序列已经进入,可通过基于多评分值的氨基酸颜色编码产生MHCII热图来辅助用于免疫试验的肽选择。一般而言,颜色编码表示75-100%、50-75%、25-50%、和10-25%的多评分。基于复合评分来构建肽。通过针对由覆盖最少25%蛋白质的预测表位诱导的抗原特异性IFN-γ(g)和IL-10产生的ELISPOT来评价来自40个人供体的外周血单核细胞(PBMC)。对于IFN-gELISPOT,细胞以2x105/孔(96孔板)接种到含10ìg/mL各种肽或HIVp17,PHA(1ìg/ml),CEF(2.5ìg/mL)的培养基中或仅培养基中在37℃下5%CO2中持续7天。在第5天,加入重组人IL-2(10U/ml)。通过在第8天向原始培养物加入2x105肽-加载的(与上述相同浓度)自体辐射(3000rads)人PBMC进行第二体外刺激(IVS),并孵育24小时。用10ug/ml抗-人IFN-g包被96孔硝酸纤维素板。用DPBS中2%牛血清白蛋白之后用PBMC培养复孵育24小时来封闭洗涤的硝酸纤维素板。在充分洗涤后,加入生物素化的抗-人IFN-g持续2小时。对于IL-10ELISPOT,如上所述封闭抗-人IL-10包被(2ìg/ml)硝酸纤维素96孔板。PBMC浓度和肽刺激如上所述,除了以20ìg/ml使用PHA。在充分洗涤后,加入生物素化的抗-人IL-10持续2小时。在充分洗涤之后,加入1ìg/mL链霉亲和素-AP持续45分钟。通过用BCIP孵育平板使点可视化并且在C.T.L.ELISPOT酶标仪上对NBT溶液点进行计数。原始数据输入TVG数据库ELISPOT工具并且通过实验孔中5个重复点的平均数与无抗原对照孔的平均数之间的统计学显著差异(p<0.05)来定义阳性应答。产生TH1/TH2比率,其使用以下算法分析各预测的II类特异性肽的ELISPOT应答的量级和频率:(每孔校正平均点)x(响应供体百分比)。使用抗原特异性T-细胞刺激介质以及通过针对复合TH1/TH2表型的多重试验,Th1/Th2活性比率也衍生自针对I型和II型细胞因子的ELISA试验。以相似方式将发生率和量级纳入这些分析中。图75显示各所测EGFR肽的Th1(IFNγ)相比Th2(IL10)的刺激活性。参考文献ParkKH,GadE,GoodellV,DangY,WildT,HigginsD,FintakP,ChildsJ,DelaRosaC,DisisML(2008)胰岛素样生长因子结合蛋白2是乳腺癌免疫调控的靶标(Insulin-likegrowthfactor-bindingprotein-2isatargetfortheimmunomodulationofbreastcancer).CancerResearch68:8400–8409CecilD,ParkKH,GadE,ChildsJS,HigginsDM,PlymateSR,DisisML(2013)对乳腺癌抗原胰岛素样生长因子I受体(IGF-IR)特异的T辅助因子I免疫与增加的肥胖相关(T-helperIimmunity,specificforthebreastcancerantigeninsulin-likegrowthfactor-Ireceptor(IGF-IR),isassociatedwithincreasedadiposity).BreastCancerResearchTreatment139:657-665BroussardEK,KimR,WileyJC,MarquezJP,AnnisJE,PritchardD,和DisisML.(2013)"基于侵入前至恶性病灶的保守基因上调,鉴定针对结肠癌预防的推定免疫靶标(IdentificationofPutativeImmunologicTargetsforColonCancerPreventionBasedonConservedGeneUpregulationfromPreinvasivetoMalignantLesions.)"CancerPreventionResearch(2013):666-74.RamduthD,DayCL,ThobakgaleCF,MkhwanaziNP,dePierresC,ReddyS,vanderStokM,MncubeX,NairK,MoodleyES,KaufmannDE,StreeckH,CoovadiaHM,KiepielaP,GoulderPJ,WalkerBD(2009)免疫优势HIV-1感染(ImmunodominantHIV-1infections).PLoSONE4:e5013序列表<110>华盛顿大学(UniversityofWashington)M·L·迪西斯(Disis,MaryL.)E·布劳萨尔德(Broussard,Elizabeth)<120>结直肠癌疫苗组合物<130>41299-781.601<150>US62/026,246<151>2014-07-18<160>59<170>PatentInversion3.5<210>1<211>21<212>PRT<213>人工序列<220><223>合成多肽<400>1GlnAlaIleGlnAlaAlaSerArgIleIleArgAsnGluGlnPheAla151015IleArgArgPheGln20<210>2<211>23<212>PRT<213>人工序列<220><223>合成多肽<400>2ValAspGlyLysHisGlnAspLeuLysTyrIleSerProGluThrMet151015ValAlaLeuLeuThrGlyLys20<210>3<211>16<212>PRT<213>人工序列<220><223>合成多肽<400>3PheLysGlyPheTrpAsnValValAsnAsnIleProPheLeuArgAsn151015<210>4<211>17<212>PRT<213>人工序列<220><223>合成多肽<400>4GlyLeuValProGlyLeuMetMetTyrAlaThrIleTrpLeuArgGlu151015His<210>5<211>18<212>PRT<213>人工序列<220><223>合成多肽<400>5GlyGluValGlyPheGlnIleIleAsnThrAlaSerIleGlnSerLeu151015IleCys<210>6<211>16<212>PRT<213>人工序列<220><223>合成多肽<400>6AsnAlaIleMetSerTyrValLeuThrSerArgSerHisLeuIleAsp151015<210>7<211>18<212>PRT<213>人工序列<220><223>合成多肽<400>7HisIleTyrGlyGluThrLeuAlaArgGlnArgLysLeuArgLeuPhe151015LysAsp<210>8<211>18<212>PRT<213>人工序列<220><223>合成多肽<400>8LeuPheGlnThrSerArgLeuIleLeuIleGlyGluThrIleLysIle151015ValIle<210>9<211>16<212>PRT<213>人工序列<220><223>合成多肽<400>9GlnPheGlnTyrGlnAsnArgIleAlaAlaGluPheAsnThrLeuTyr151015<210>10<211>19<212>PRT<213>人工序列<220><223>合成多肽<400>10GlnGlnPheIleTyrAsnAsnSerIleLeuLeuGluHisGlyIleThr151015GlnPheVal<210>11<211>20<212>PRT<213>人工序列<220><223>合成多肽<400>11SerCysValArgAlaCysGlyAlaAspSerTyrGluMetGluGluAsp151015GlyValArgLys20<210>12<211>17<212>PRT<213>人工序列<220><223>合成多肽<400>12AsnAsnThrLeuValTrpLysTyrAlaAspAlaGlyHisValCysHis151015Leu<210>13<211>19<212>PRT<213>人工序列<220><223>合成多肽<400>13ValTrpSerTyrGlyValThrValTrpGluLeuMetThrPheGlySer151015LysProTyr<210>14<211>19<212>PRT<213>人工序列<220><223>合成多肽<400>14IleAlaMetHisProGlnValAsnIleTyrSerValThrArgLysArg151015TyrAlaHis<210>15<211>20<212>PRT<213>人工序列<220><223>合成多肽<400>15ThrAlaAspHisArgPheLeuArgHisAspGlyArgLeuValAlaArg151015ProGluProAla20<210>16<211>20<212>PRT<213>人工序列<220><223>合成多肽<400>16AsnLysTyrLeuThrAlaGluAlaPheGlyPheLysValAsnAlaSer151015AlaSerSerLeu20<210>17<211>25<212>PRT<213>人工序列<220><223>合成多肽<400>17GluLeuPheLeuMetLysLeuIleAsnArgProIleIleValPheArg151015GlyGluHisGlyPheIleGlyCysArg2025<210>18<211>16<212>PRT<213>人工序列<220><223>合成多肽<400>18ValGlnIleGlnPheGlyLeuIleAsnCysGlyAsnLysTyrLeuThr151015<210>19<211>17<212>PRT<213>人工序列<220><223>合成多肽<400>19AlaValCysLeuArgSerHisLeuGlyArgTyrLeuAlaAlaAspLys151015Asp<210>20<211>16<212>PRT<213>人工序列<220><223>合成多肽<400>20ThrGlyLysTyrTrpThrLeuThrAlaThrGlyGlyValGlnSerThr151015<210>21<211>20<212>PRT<213>人工序列<220><223>合成多肽<400>21LeuPheAlaLeuGluGlnSerCysAlaGlnValValLeuGlnAlaAla151015AsnGluArgAsn20<210>22<211>18<212>PRT<213>人工序列<220><223>合成多肽<400>22LysAspSerThrGlyLysTyrTrpThrValGlySerAspSerAlaVal151015ThrSer<210>23<211>15<212>PRT<213>人工序列<220><223>合成多肽<400>23ValValThrGlyTyrValLysIleArgHisSerHisAlaLeuVal151015<210>24<211>15<212>PRT<213>人工序列<220><223>合成多肽<400>24ThrGlnTyrAlaValTyrValLysAlaValThrLeuThrMetVal151015<210>25<211>15<212>PRT<213>人工序列<220><223>合成多肽<400>25LeuValIleMetLeuTyrValPheHisArgLysArgAsnAsnSer151015<210>26<211>15<212>PRT<213>人工序列<220><223>合成多肽<400>26GlyMetAlaTyrLeuAsnAlaAsnLysPheValHisArgAspLeu151015<210>27<211>19<212>PRT<213>人工序列<220><223>合成多肽<400>27ValSerTyrLysHisMetArgPheLeuIleThrHisAsnProThrAsn151015AlaThrLeu<210>28<211>21<212>PRT<213>人工序列<220><223>合成多肽<400>28PheIleGluAspLeuLysLysTyrGlyAlaThrThrValValArgVal151015CysGluValThrTyr20<210>29<211>20<212>PRT<213>人工序列<220><223>合成多肽<400>29ProCysValAlaGlyLeuGlyArgAlaProValLeuValAlaLeuAla151015LeuIleGluSer20<210>30<211>19<212>PRT<213>人工序列<220><223>合成多肽<400>30MetLysTyrGluAspAlaIleGlnPheIleArgGlnLysArgArgGly151015AlaIleAsn<210>31<211>15<212>PRT<213>人工序列<220><223>合成多肽<400>31ValGluAspTrpLeuSerLeuValLysAlaLysPheCysGluAla151015<210>32<211>20<212>PRT<213>人工序列<220><223>合成多肽<400>32GluProAspTyrPheLysAspMetThrProThrIleArgLysThrGln151015LysIleValIle20<210>33<211>21<212>PRT<213>人工序列<220><223>合成多肽<400>33AspTyrPheLysAspMetThrProThrIleArgLysThrGlnLysIle151015ValIleLysLysArg20<210>34<211>20<212>PRT<213>人工序列<220><223>合成多肽<400>34LeuPheLysPheCysThrCysLeuAlaThrValPheSerPheLeuLys151015ArgLeuIleCys20<210>35<211>23<212>PRT<213>人工序列<220><223>合成多肽<400>35GlyPheSerSerArgLeuAlaAlaThrGlnAspLeuProPheIleHis151015GlnSerSerGluLeuGlyAsp20<210>36<211>21<212>PRT<213>人工序列<220><223>合成多肽<400>36GluGluGluAspAlaAlaTrpGlnAlaGluGluValLeuArgGlnGln151015LysLeuAlaAspArg20<210>37<211>21<212>PRT<213>人工序列<220><223>合成多肽<400>37IleArgMetAsnArgValValArgAsnAsnLeuArgValArgLeuGly151015AspValIleSerIle20<210>38<211>17<212>PRT<213>人工序列<220><223>合成多肽<400>38LeuGlnLeuPheArgGlyAspThrValLeuLeuLysGlyLysLysArg151015Arg<210>39<211>19<212>PRT<213>人工序列<220><223>合成多肽<400>39TyrPheLeuGluAlaTyrArgProIleArgLysGlyAspIlePheLeu151015ValArgGly<210>40<211>20<212>PRT<213>人工序列<220><223>合成多肽<400>40ValGluPheLysValValGluThrAspProSerProTyrCysIleVal151015AlaProAspThr20<210>41<211>19<212>PRT<213>人工序列<220><223>合成多肽<400>41LeuArgHisProAlaLeuPheLysAlaIleGlyValLysProProArg151015GlyIleLeu<210>42<211>17<212>PRT<213>人工序列<220><223>合成多肽<400>42GluThrGlyAlaPhePhePheLeuIleAsnGlyProGluIleMetSer151015Lys<210>43<211>17<212>PRT<213>人工序列<220><223>合成多肽<400>43AlaValThrMetAspAspPheArgTrpAlaLeuSerGlnSerAsnPro151015Ser<210>44<211>16<212>PRT<213>人工序列<220><223>合成多肽<400>44GlnArgAlaHisValIleValMetAlaAlaThrAsnArgProAsnSer151015<210>45<211>15<212>PRT<213>人工序列<220><223>合成多肽<400>45LysAsnValPheIleIleGlyAlaThrAsnArgProAspIleIle151015<210>46<211>18<212>DNA<213>人工序列<220><223>合成引物<400>46gccatcccttcacgttag18<210>47<211>19<212>DNA<213>人工序列<220><223>合成引物<400>47ttccactttggcataaggc19<210>48<211>21<212>DNA<213>人工序列<220><223>合成引物<400>48tcctgagaaagacagaagtta21<210>49<211>25<212>DNA<213>人工序列<220><223>合成引物<400>49tgaacggatttggccgtattgggcg25<210>50<211>25<212>DNA<213>人工序列<220><223>合成引物<400>50actgagctgcgttttacaccctttc25<210>51<211>25<212>DNA<213>人工序列<220><223>合成引物<400>51gcagagcgcacgtttgaacaggcca25<210>52<211>25<212>DNA<213>人工序列<220><223>合成引物<400>52gactgggccatggagtggacttaaa25<210>53<211>25<212>DNA<213>人工序列<220><223>合成引物<400>53gcagttgccccaaatgtgatccaag25<210>54<211>25<212>DNA<213>人工序列<220><223>合成引物<400>54gaagtggagcagaataatctagtcc25<210>55<211>25<212>DNA<213>人工序列<220><223>合成引物<400>55catcaaagactccacgggcaagtac25<210>56<211>25<212>DNA<213>人工序列<220><223>合成引物<400>56gttcatccgacagaagcgccgtggg25<210>57<211>25<212>DNA<213>人工序列<220><223>合成引物<400>57aaactcagaaaattgtcattaagaa25<210>58<211>25<212>DNA<213>人工序列<220><223>合成引物<400>58ctgtcgtagtttggggtggtgcagg25<210>59<211>58<212>PRT<213>人工序列<220><223>合成多肽<400>59PheMetArgArgArgHisIleValArgLysArgThrLeuArgArgLeu151015LeuGlnGluArgGluLeuValGluProLeuThrProSerGlyGluAla202530ProAsnGlnAlaLeuLeuArgIleLeuLysGluThrGluPheLysLys354045IleLysValLeuGlySerGlyAlaPheGly5055当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1