脱落酸衍生物的制作方法
本发明涉及脱落酸衍生物。更详细的是涉及脱落酸受体拮抗剂。
背景技术:
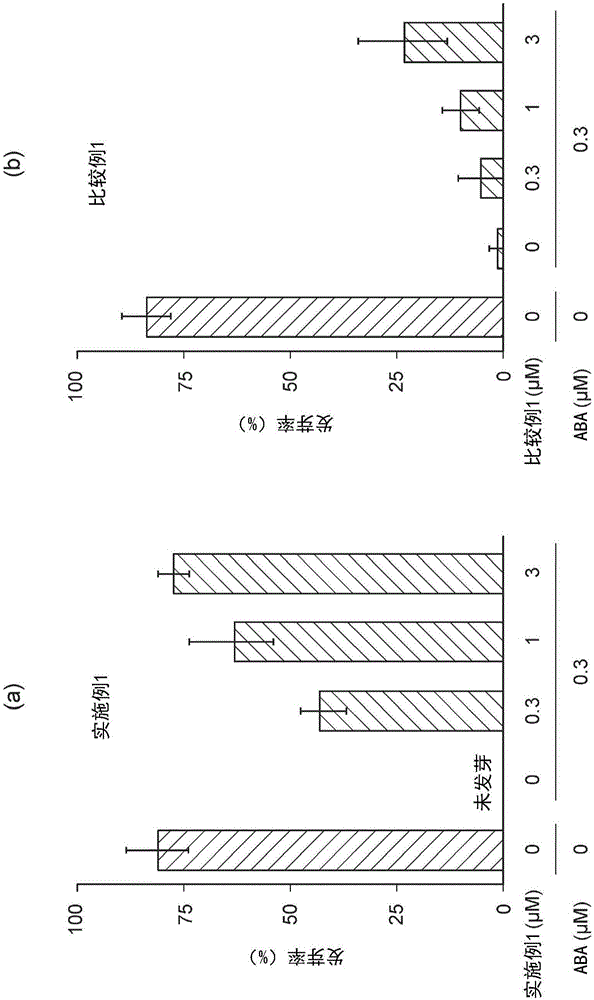
:脱落酸是在种子休眠及环境应激响应方面担任重要作用的植物激素。脱落酸受体通过与脱落酸的结合改变其立体结构,通过与蛋白质磷酸酶PP2C的结合抑制其酶活性,激活其下游的信号传递。脱落酸受体拮抗剂作为植物的生长调节剂被希望应用于农业领域,最近报道了,脱落酸的3’位上引入烷基硫烷基的脱落酸衍生物具有脱落酸受体拮抗作用(非专利文献1)。现有技术文献非专利文献非专利文献1:Takeuchi等,“DesignedabscisicacidanalogsasantagonistsofPYL-PP2Creceptorinteractions”,NatureChemicalBiology,vol.10,pp.477-482(2014)。技术实现要素:发明所要解决的课题本发明的目的是提供一种新的脱落酸受体拮抗剂。解决课题的技术方案本发明的发明人经过潜心研究,发现通过将脱落酸的4’位的氧基替换为取代或者非取代的2-丙基氧基、2-丙烯基氧基或者2-丙炔基氧基而得到的脱落酸衍生物,具有脱落酸受体拮抗作用,从而完成了本发明。即,本发明提供式(IV)表示的化合物或其盐。[化学式1]上式中,X是亚乙基、亚乙烯基、或者亚乙炔基,R1是氢原子、苯基或者萘基,苯基和萘基具有或不具有取代基,该取代基选自由卤族原子、羟基、C1-6烷基、被卤族原子取代的C1-6烷基、C1-6烷氧基、乙酰基、氨基、乙酰氨基、苯基和五氟硫基组成的组。再者,本发明提供式(I)表示的化合物或者其盐。[化学式2]上式中,R2是氢原子、苯基或者萘基,苯基和萘基具有或不具有取代基,该取代基选自由卤族原子、羟基、C1-6烷基、被卤族原子取代的C1-6烷基、C1-6烷氧基、乙酰基、氨基、乙酰氨基和苯基组成的组。在上述化合物或者其盐中,R2也可以是苯基或者1-萘基。上述化合物或者其盐具有利用作为脱落酸受体的抑制剂的可能;再者,也具有利用作为植物生长调节剂的可能。发明的效果式(IV)或者式(I)所表示的化合物或者其盐具有脱落酸受体拮抗作用,能成为控制种子的发芽等的植物生长调节剂。附图说明图1是表示实施例1的化合物对拟南芥的种子发芽产生的影响的考察结果的图。图2是表示实施例1和比较例1的化合物对拟南芥的种子发芽产生的影响的比较结果的图。图3是实施例1的化合物对脱落酸受体产生的影响的考察结果的图。具体实施方式下面,对本说明书中使用的术语等进行说明,详细地说明本发明。本说明书中,所指的“卤族原子”指的是氟原子、氯原子、溴原子、碘原子等,优选是氟原子、氯原子。本说明书中,所指的“C1-6烷基”指的是碳数为1~6个的直链或者支链烷基,例如,可举出甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基、叔丁基、正戊基、异戊基、新戊基、正己基等。C1-6烷基更优选的是甲基、乙基、正丙基等的碳数为1~3个的烷基的C1-3烷基。在本说明书中“被卤族原子取代的C1-6烷基”指的是C1-6烷基中的1个或者多个的氢原子被卤族原子取代的基团,例如,可举出氟甲基、二氟甲基、三氟甲基、三氯甲基、1-氟乙基、2-氟乙基、2-氯乙基、1,2-二氟乙基、2,2-二氟乙基、2,2,2-三氟乙基、1-氟丙基、2-氟丙基、3-氟丙基、3-氯丙基等。被卤族原子取代的C1-6烷基,更优选的是被卤族原子取代的C1-3烷基。在本说明书中,“C1-6烷氧基”指的是与C1-6烷基结合的氧基,例如,可举出甲氧基、乙氧基、1-丙氧基、2-丙氧基、1-丁氧基、2-甲基丙氧基、1-甲基丙氧基、1,1-二甲基乙氧基等。在本说明书中,“萘基”指的是1-萘基或者2-萘基。本实施方式中涉及的化合物用式(IV)表示。以下,也有用化合物(IV)表示的情况。[化学式3]其中,X是亚乙基、亚乙烯基、或者亚乙炔基,R1是氢原子、苯基或者萘基,苯基和萘基具有或不具有取代基,该取代基选自由卤族原子、羟基、C1-6烷基、被卤族原子取代的C1-6烷基、C1-6烷氧基、乙酰基、氨基、乙酰氨基、苯基和五氟硫基组成的组。化合物(IV)也可以是式(I)所表示的化合物(以下也称作“化合物(I)”)。[化学式4]其中,R2是氢原子、苯基或者萘基,苯基和萘基具有或不具有取代基,该取代基是选自由卤族原子、羟基、C1-6烷基、被卤族原子取代的C1-6烷基、C1-6烷氧基、乙酰基、氨基、乙酰氨基和苯基组成的组。R1或者R2为具有取代基的苯基或者萘基的情况下,取代基的位置可以是任意的位置,再者取代基的数量可以是1个或者多个。R1或者R2为具有取代基的苯基的情况下,优选取代基的数量是1个、取代基的位置在间位或者对位。R1优选是氢原子、苯基、1-萘基、2-萘基、p-三氟甲基苯基、p-甲氧基苯基、p-乙酰苯基、p-甲苯基、m-甲苯基、p-羟基苯基、p-氨基苯基、p-乙酰氨基苯基、p-氯苯基、p-联苯基或者p-五氟硫基。R1更优选的是氢原子、苯基、1-萘基、2-萘基、p-三氟甲基苯基、p-甲氧基苯基、p-乙酰苯基、p-甲苯基或者p-五氟硫基。R1最优选是苯基、p-甲苯基或者1-萘基。R2优选是氢原子、苯基、1-萘基、2-萘基、p-三氟甲基苯基、p-甲氧基苯基、p-乙酰苯基、p-甲苯基、m-甲苯基、p-羟基苯基、p-氨基苯基、p-乙酰氨基苯基、p-氯苯基或者p-联苯基。R2更优选的是氢原子、苯基、1-萘基、2-萘基、p-三氟甲基苯基、p-甲氧基苯基、p-乙酰苯基或者p-甲苯基。R2最优选是苯基、p-甲苯基或者1-萘基。X可以是亚乙基、亚乙烯基、或者亚乙炔基中任一者,优选是亚乙基或者亚乙炔基。化合物(IV)也可以是盐的形态。作为盐,例如,可举出无机碱盐和有机碱盐。无机碱盐的示例,可举出,钠盐、钾盐等的碱金属盐,钙盐和镁盐等的碱土金属类盐,铝盐、铵盐等。有机碱盐的示例,可举出,二乙基胺盐、二乙醇胺盐、葡甲胺盐、N,N’-二苄基乙二胺盐等。化合物(I)能通过以下的反应路线制备。[化学式5]化学式中,Ts表示甲苯磺酰基。工序1是将脱落酸(以下,有时简称为ABA)还原得到化合物(II)的工序。使用能进行从酮到醇的还原反应的还原剂。在还原反应常用的反应条件下(反应溶剂、反应温度、反应时间等),能够进行工序1的反应。作为还原剂,例如,可举出硼氢化钠、氢化铝锂等。作为具体的反应条件,例如,可举出制造例1中所示的反应条件。工序2是使化合物(II)和化合物(III)反应,获得化合物(I)的工序。在氢化钠等的碱存在下进行反应。例如,参考实施例1所示的反应条件,能够进行工序2的反应。化合物(I)以自由体(フリー体)被获得的情况下,能通过常用的方法转变成盐。另外,化合物(I)以盐被获得的情况下,也能通过常用的方法转变成自由体。化合物(III)是以市售的化合物为原料,本领域技术人员能够很容易地制备。例如,参考制造例2所示的反应条件,能够制造化合物(III)。化合物(IV)能通过与化合物(I)相同的方法制备。例如,使化合物(II)和式(V)所表示的化合物(以下,也称作化合物(V))反应,能获得化合物(IV)。作为具体的反应条件,例如,可举出实施例9所表示的反应条件。化合物(IV)以自由体被获得的情况下,能通过常用的方法转变成盐。再者,化合物(IV)以盐的被获得的情况下,也能通过常用的方法转变成自由体。[化学式6]其中,X是亚乙基、亚乙烯基、或者亚乙炔基,R1是氢原子、苯基或者萘基,苯基和萘基具有或不具有取代基,该取代基选自由卤族原子、羟基、C1-6烷基、被卤族原子取代的C1-6烷基、C1-6烷氧基、乙酰基、氨基、乙酰氨基、苯基和五氟硫基组成的组。化合物(V)使用市售的化合物做原料,本领域技术人员能够容易地制造。例如,参考制造例3中表示的反应条件,能够制造化合物(V)。因为化合物(IV)具有脱落酸受体拮抗作用,能够作为脱落酸受体的抑制剂被利用。脱落酸受体是指作为PYR/PYL/RCAR蛋白质而已知的属于蛋白质家族中的任意的受体。通常,在植物中PP2C使蛋白激酶SnRK2去磷酸化并将其维持在非活性状态。植物受到应激时,脱落酸被合成,在被输送到目标器官后,与脱落酸受体结合。脱落酸与脱落酸受体结合,则脱落酸受体和PP2C形成复合物,基于PP2C的去磷酸化被抑制。其结果是,SnRK2发生自身磷酸化向活性化状态转化,激活下游的离子通道和转录因子等,从而脱落酸响应被诱导。施加了化合物(IV)的植物,即使脱落酸基于应激被合成,由于化合物(IV)抑制脱落酸和脱落酸受体的结合及其后续的与PP2C的复合物的形成,脱落酸响应没有被诱导。因此,化合物(IV)能够调节植物的生长。如上所述,化合物(IV)能够调节植物生长。所述植物生长只要是伴随植物细胞的通常的分化或者繁殖的现象即可,并没有特殊限定,其不仅包括构成植物体的器官的伸长、扩大,也包括从种子发芽、形成花芽、形成种子等。成为对象的植物并没有特殊限定,可以是种子植物、蕨类植物或者藓类植物,作为种子植物,可以是裸子植物或者被子植物,作为被子植物,可以是单子叶植物或者是双子叶植物。成为对象的植物器官并没有特殊限定,可以是根、茎、叶、花、生殖器官、种子中的任何一种,进一步地,也可以是培养细胞。应用到植物的化合物(IV)的浓度和接触方法,根据成为对象的植物的种类、其器官和目的等可以做适当调整。例如,以双子叶植物作为对象植物,以种子作为对象器官,以使种子发芽作为目的的情况下,优选使用在通常的培养液中溶解0.3~300μM的化合物(IV)的培养液进行栽培。含有化合物(IV)的植物生长调节剂,除了化合物(IV)以外,也可以含有杀菌剂、抗真菌剂、杀虫剂、或者也可以含有化合物(IV)以外的具有植物生长调节作用的化合物。另外,也可以含有公知的制剂用添加剂。作为这种制剂用添加剂,例如,能够使用赋形剂、乳化剂、润湿剂。而且,对本发明的植物生长调节剂的剂型没有特别的限定,例如,可制成乳剂、水合剂、水溶剂、液剂、粒剂、粉剂、微胶囊、熏蒸剂、熏烟剂、气雾剂、流动剂、糊剂、片剂、涂布剂、微量散布用剂、油剂、复合肥料,根据成为对象的植物、其器官以及目的等,使用者能够合适地选择。这种类型的植物生长调节剂能够通过公知的方法制造。实施例制造例1:(2Z,4E)-5-((1S,4S)-1,4-二羟基-2,6,6-三甲基环己-2-烯-1-基)-3-甲基戊-2,4-二烯酸的合成[化学式7]将S-脱落酸(纯度90%)11.2g(S-脱落酸10g,37.8mmol)溶于甲醇400mL。加入氯化铈(III)·7水和物42.9g(115.1mmol),溶解后,在冰浴下缓慢加入硼氢化钠14.7g(389mmol)。升温至室温,搅拌15分钟后,在冰浴下,加入饱和氯化铵水溶液200mL使反应结束,用蒸发器减压浓缩反应液,除去甲醇。在其中加入2M盐酸200mL,用pH试纸确定反应液的pH在1-2,加入蒸馏水400mL,用乙酸乙酯600mL分3次提取。将其用饱和氯化钠水溶液洗涤3次,用硫酸钠干燥,再浓缩,得到白色固体16.87g。将其用以己烷-乙酸乙酯(0-30-50%,阶梯梯度法)作为洗脱液的硅胶柱色谱(365g,4cm内径×30cm长)处理,得到目标产物(白色固体,4.35g)和目标产物与杂质的混合物(白色固体,6.58g)之后,仅将与杂质的混合物,进一步用以己烷-乙酸乙酯(0-30-65%,阶梯梯度法)为洗脱液的硅胶柱色谱(995g,3cm内径×33cm长)处理,得到题记化合物1.38g(合计5.73g,收率56%)。1HNMR(270MHz,CD3OD):δ0.81(3H,s),0.92(3H,s),1.51(1H,dd,J=13.2和9.9Hz),1.55(3H,d,J=1.65Hz),1.63(1H,ddd,J=13.2,6.6和1.3Hz),1.92(3H,d,J=1.3Hz),4.09(1H,m),5.43(1H,m),5.60(1H,q,J=1.0Hz),6.12(1H,dd,J=16.2和0.7Hz),7.58(1H,dd,J=16.2和0.7Hz)制造例2:4-甲基苯磺酸3-苯基丙-2-炔-1-基酯的合成[化学式8]将碘苯8.0g(39.2mmol)溶于四氢呋喃50mL,冰浴下加入三乙胺7.93g(78.4mmol),双(三苯膦)二氯化钯(II)566mg(0.784mmol)及碘化铜(I)519mg(2.74mmol),搅拌30分钟。往其中用滴液漏斗滴加丙炔醇2.20g(39.2mmol)的四氢呋喃溶液10mL后,升温至室温,搅拌30分钟,通过短柱(硅胶64-210μm直径,1.5cm内径×25cm高)后使反应终止。将产物用饱和氯化钠水溶液洗涤3次,用硫酸钠干燥,浓缩,得到褐色油状物质6.29g。将该物质用以己烷-乙酸乙酯(0-20-100%,阶梯梯度法)为洗脱液的硅胶柱色谱(289g,2.1cm内径×40cm长)处理,得到3-苯基丙-2-炔-1-醇(褐色油状物质,4.56g)(收率88%)。将3-苯基丙-2-炔-1-醇4.00g(30.3mmol)溶解于四氢呋喃8mL。在该溶液中,-10℃条件下加入三乙胺12.3g(121mmol)和对甲苯磺酰氯11.8g(60.6mmol)的四氢呋喃溶液20mL。升温至0℃,搅拌90分钟后,在加入乙酸乙酯400mL的分液漏斗中加入反应液,加入1M盐酸20mL,充分振动,除去三乙胺。重复该操作一次后,用饱和氯化钠水溶液洗涤4次,用硫酸钠干燥,浓缩,得到褐色油状物质10.0g。用以己烷-乙酸乙酯(0-10%,阶梯梯度法)为洗脱液的硅胶柱色谱(995g,4.1cm内径×38cm长)处理,得到题记化合物3.60g(收率42%)。1HNMR(270MHz,CDCl3):δ2.39(3H,s),4.95(2H,s),7.24-7.37(7H,m),7.85(2H,m)制造例3:4-甲基苯磺酸3-苯基丙-1-基酯的合成[化学式9]将3-苯基-1-丙醇200mg(1.47mmol)溶解于二氯甲烷2mL,加入对甲苯磺酰氯339.6mg(1.78mmol)和三乙胺178.1mg(1.76mmol)。室温条件下搅拌2小时后,加入蒸馏水8mL和1M盐酸2mL,用乙酸乙酯10mL分为3次提取。将其用饱和氯化钠水溶液洗涤3次,用硫酸钠干燥后,将用棉花过滤后的滤液减压浓缩,得到无色透明的油状物质475mg。将其用以己烷-乙酸乙酯(1:9)为洗脱液的硅胶柱色谱(WakoSiIC-2009.21g,16mm内径×95mm长)处理,得到题记化合物339.3mg(收率79%)。1HNMR(270MHz,CDCl3):δ1.91(2H,m),2.45(3H,s),2.60(2H,t,J=7.6Hz),4.00(2H,t,J=6.3Hz),7.04-7.23(5H,m),7.43(2H,m),7.78(2H,m)实施例1:(2Z,4E)-5-((1S,4S)-1-羟基-2,6,6-三甲基-4-((3-苯基丙-2-炔-1-基)氧)环己-2-烯-1-基)-3-甲基戊-2,4-二烯酸的合成[化学式10]将氢化钠(油性60%)2.78g(氢化钠1.67g,64.8mmol)溶解于己烷100mL,除去上清液。在其中加入四氢呋喃50mL,上清液除去后,加入四氢呋喃200mL。冰浴下,加入(2Z,4E)-5-((1S,4S)-1,4-二羟基-2,6,6-三甲基环己-2-烯-1-基)-3-甲基戊-2,4-二烯酸5.72g(21.5mmol),搅拌30分钟,进一步加入4-甲基苯磺酸3-苯基丙-2-炔-1-基酯3.09g(10.8mmol)的四氢呋喃溶液40mL。升温至室温,搅拌44小时后,冰浴下加入2M盐酸100mL使反应终止,将反应液加入蒸馏水900mL中,用乙酸乙酯600mL分成3次提取。将其用饱和氯化钠水溶液洗涤3次,用硫酸钠干燥,浓缩,得到褐色油状物质8.34g。将该物质通过以己烷-乙酸乙酯(0-20-40%,阶梯梯度法)作为洗脱液的硅胶柱色谱(1039g,4.1cm内径×39cm长)处理,得到杂质与目标产物的混合物(褐色油状物质,2.34g)后,进一步使用以二氯甲烷-乙酸乙酯(30%)作为洗脱液的硅胶柱色谱(398g,2.5cm内径×40cm长)处理,得到题记化合物1.375g(收率33%)。1HNMR(500MHz,CDCl3):δ0.92(3H,s,H3-9'),1.06(3H,s,H3-8'),1.67(3H,m,H3-7'),1.72(1H,dd,J=13.1和9.5Hz,H-5'),1.90(1H,m,H-5'),2.01(3H,d,J=0.6Hz,H3-6),4.27(1H,m,H-4'),4.42(1H,d,J=15.9Hz,H-1"),4.47(1H,d,J=15.9Hz,H-1"),5.68(1H,brs,H-3'),5.71(1H,s,H-2),6.21(1H,d,J=15.9Hz,H-5),7.31(3H,m,H-6",7"和8"),7.44(2H,m,H-5"和9"),7.74(1H,d,J=15.9Hz,H-4)13CNMR(125MHz,CDCl3):δ17.7(C7'),21.5(C6),22.7(C8'),25.3(C9'),39.7(C6'),40.7(C5'),56.1(C1"),72.3(C4'),79.3(C1'),85.5(C2"),86.0(C3"),117.0(C2),122.7(C4"),124.6(C3'),126.5(C4),128.3(C6"和8"),128.4(C7"),131.7(C5"和9"),139.1(C2'),140.3(C5),152.2(C3),170.6(C1)UVλmax(MeOH)nm(ε):242.4(27600),250.4(29000)HRMS(m/z):[M+Na]+C24H28O4Na的计算值是403.1885;测定值是403.1880。实施例2:(2Z,4E)-5-((1S,4S)-1-羟基-2,6,6-三甲基-4-((3-(萘-1-基)丙-2-炔-1-基)氧)环己-2-烯-1-基)-3-甲基戊-2,4-二烯酸的合成[化学式11]将S-脱落酸替换成使用S-脱落酸-甲脂进行与制造例1相同的反应,得到甲基(2Z,4E)-5-((1S,4S)-1,4-二羟基-2,6,6-三甲基环己-2-烯-1-基)-3-甲基戊-2,4-二烯酸865.9mg(收率75.5%)。将甲基((2Z,4E)-5-((1S,4S)-1,4-二羟基-2,6,6-三甲基环己-2-烯-1-基)-3-甲基戊-2,4-二烯酸30.0mg(0.107mmol)溶解于四氢呋喃1.0mL,冰浴下加入氢化钠(油性60%)8.6mg(氢化钠5.22mg,0.214mmol)搅拌30分钟。在其中加入1-(3-溴代丙-1-炔-1-基)萘26.2mg(0.107mmol),升温至室温。搅拌4小时后,加入饱和氯化铵水溶液30mL使反应终止,将其用乙酸乙酯30mL分为3次提取。将其用饱和氯化钠水溶液洗涤3次,用硫酸钠干燥,得到淡黄色油状物質55.4mg。将该物质用以己烷-乙酸乙酯(0-20-30-100%,阶梯梯度法)作为洗脱液的硅胶柱色谱(5g,0.5cm内径×28cm长)处理,得到甲基(2Z,4E)-5-((1S,4S)-1-羟基-2,6,6-三甲基-4-((3-(萘-1-基)丙-2-炔-1-基)氧)环己-2-烯-1-基)-3-甲基戊-2,4-二烯酸(淡黄色油状物質,3mg)(收率3%)。将其溶解于甲醇1.5mL,冰浴下,加入1M氢氧化钠1.8mL,搅拌3.5小时。在其中加入1M盐酸2mL使反应终止,加入蒸馏水30mL,用乙酸乙酯20mL分为3次提取,用饱和氯化钠洗涤3次,用硫酸钠干燥,浓缩,得到淡黄色油状物质5.6mg。将该物质用以己烷-乙酸乙酯(0-30-40%,阶梯梯度法)作为洗脱液的硅胶柱色谱(2g,0.5cm内径×15cm长)处理,得到题记化合物0.8mg(收率27.5%)。1HNMR(500MHz,CD3OD):δ0.95(3H,s,H3-9'),1.07(3H,s,H3-8'),1.70(3H,dd,J=1.5和1.5Hz,H3-7'),1.76(1H,dd,J=13.1和9.8Hz,H-5'),1.92(1H,ddd,J=13.1,6.4和1.5Hz,H-5'),2.01(3H,d,J=1.2Hz,H3-6),4.41(1H,m,H-4'),4.60(2H,d,J=1.5Hz,OCH2-),5.70(1H,brs,H-2),5.73(1H,m,H-3'),6.22(1H,d,J=16.2Hz,H-5),7.44(1H,dd,J=8.2和7.3Hz,H-6”),7.54(2H,m,H-10”和11”),7.65(1H,dd,J=7.3和1.2Hz,H-5”),7.73(1H,d,J=16.2Hz,H-4),7.88(2H,m,H-7”和12”),8.30(1H,d,J=8.2Hz,H-9”)13CNMR(125MHz,CD3OD):δ18.4(C7'),21.4(C6),23.3(C8'),25.7(C9'),40.9(C6'),41.7(C5'),56.8(C1”),74.1(C4'),80.2(C1'),84.8(C2”),91.9(C3”),118.8(C2),121.5(C8”),125.6(C3'),126.3(C6”),126.9(C9”),127.5(C11”),127.9(C10”),128.2(C4),129.4(C12”),130.0(C7”),131.5(C5”),134.6(C4'‘or13”),134.7(C4'‘or13”),141.1(C5),141.2(C2'),151.4(C3),169.8(C1)UVλmax(MeOH)nm(ε):226.8(59700),262.2(18000),297.0(13700),310.4(8410)HRMS(m/z):[M+Na]+C28H30O4Na的计算值是453.2042;测定值是453.2045。实施例3:(2Z,4E)-5-((1S,4S)-1-羟基-2,6,6-三甲基-4-(丙-2-炔-1-基氧)环己-2-烯-1-基)-3-甲基戊-2,4-二烯酸的合成[化学式12]将4-甲基苯磺酸3-苯基丙-2-炔-1-基酯替换成使用4-甲基苯磺酸丙-2-炔-1-基酯进行与实施例1相同的反応,得到题记化合物(收率9%)。1HNMR(270MHz,CDCl3):δ0.92(3H,s,H3-8’or9'),1.05(3H,s,H3-8'or9’),1.63-1.71(4H,m,H3-7'和H-5’),1.86(1H,ddd,J=13.2,6.6和1.3Hz,H-5’),2.02(3H,d,J=1.0Hz,H3-6),2.43(1H,t,J=2.3Hz,H-3’),4.16-4.23(3H,m,H-4’和H2-1’),5.64(1H,m,H-3’),5.72(1H,s,H-2),6.19(1H,d,J=16.2Hz,H-5),7.35(1H,d,J=16.2Hz,H-4)实施例4:(2Z,4E)-5-((1S,4S)-1-羟基-2,6,6-三甲基-4-((3-(4-三氟甲基)苯基丙-2-炔-1-基)氧)环己-2-烯-1-基)-3-甲基戊-2,4-二烯酸的合成[化学式13]将4-甲基苯磺酸3-苯基丙-2-炔-1-基酯替换成使用4-甲基苯磺酸3-(4-三氟甲基)苯基丙-2-炔-1-基酯进行与实施例1相同的反应,得到题记化合物(收率18%)。1HNMR(270MHz,CDCl3):δ0.93(3H,s),1.07(3H,s),1.63-1.73(4H,m),1.82-1.93(1H,m),2.02(3H,s),4.14-4.29(3H,m),5.68(1H,m),5.71(1H,s),6.20(1H,d,J=16.1Hz),7.52-7.60(4H,m),7.74(1H,d,J=16.1Hz)实施例5:(2Z,4E)-5-((1S,4S)-1-羟基-2,6,6-三甲基-4-((3-(4-甲氧基)苯基丙-2-炔-1-基)氧)环己-2-烯-1-基)-3-甲基戊-2,4-二烯酸的合成[化学式14]将4-甲基苯磺酸3-苯基丙-2-炔-1-基酯替换成4-甲基苯磺酸3-(4-甲氧基)苯基丙-2-炔-1-基酯进行与实施例1相同的反应,得到题记化合物(收率3%)。1HNMR(270MHz,CDCl3):δ0.90(3H,s),1.04(3H,s),1.65(3H,s),1.70(1H,dd,J=12.5和9.6Hz),1.89(1H,dd,J=12.5和6.6Hz),1.99(3H,s),3.85(3H,s),4.24(1H,m),4.36-4.48(2H,m),5.66(1H,s),5.71(1H,s),6.16(1H,s),6.81-6.87(2H,m),7.35-7.41(2H,m),7.73(1H,s)实施例6:(2Z,4E)-5-((1S,4S)-1-羟基-2,6,6-三甲基-4-((3-(4-乙酰基)苯基丙-2-炔-1-基)氧)环己-2-烯-1-基)-3-甲基戊-2,4-二烯酸的合成[化学式15]将4-甲基苯磺酸3-苯基丙-2-炔-1-基酯替换成使用4-甲基苯磺酸3-(4-乙酰基)苯基丙-2-炔-1-基酯进行与实施例1相同的反应,得到题记化合物(收率0.5%)。1HNMR(270MHz,CDCl3):δ0.93(3H,s),1.07(3H,s),1.68(3H,s),1.72(1H,dd,J=13.5和9.6Hz),1.90(1H,dd,J=13.5和6.9Hz),2.02(3H,s),2.60(3H,s),4.25(1H,m),4.46(2H,m),5.69(1H,s),5.72(1H,s),6.21(1H,d,J=16.2Hz),7.50-7.53(2H,m),7.74(1H,d,J=16.2Hz),7.89-7.92(2H,m)实施例7:(2Z,4E)-5-(1S,4S)-1-羟基-2,6,6-三甲基-4-((3-(4-甲基)苯基丙-2-炔-1-基)氧)环己-2-烯-1-基)-3-甲基戊-2,4-二烯酸的合成[化学式16]将4-甲基苯磺酸3-苯基丙-2-炔-1-基酯替换为使用4-甲基苯磺酸3-(4-甲基)苯基丙-2-炔-1-基酯进行与实施例相同的反应,得到题记化合物(收率18%)。1HNMR(500MHz,CDCl3):δ0.91(3H,s),1.05(3H,s),1.66(3H,m),1.71(1H,dd,J=13.1和9.8Hz),1.89(1H,m),2.00(3H,s),2.34(3H,s),4.26(1H,m),4.41(1H,d,J=15.9Hz),4.45(1H,d,J=15.9Hz),5.67(1H,s),5.71(1H,s),6.19(1H,d,J=15.9Hz),7.10-7.12(3H,m),7.32-7.34(2H,m),7.74(1H,d,J=15.9Hz)实施例8:(2Z,4E)-5-(1S,4S)-1-羟基-2,6,6-三甲基-4-((3-(4-五氟硫基)苯基丙-2-炔-1-基)氧)环己-2-烯-1-基)-3-甲基戊-2,4-二烯酸的合成[化学式17]在(2Z,4E)-5-((1S,4S)-1-羟基-2,6,6-三甲基-4-(丙-2-炔-1-基氧)环己-2-烯-1基)-3-甲基戊-2,4-二烯酸72.0mg(237nmol)的四氢呋喃溶液2mL中,加入碘化铜(I)3.2mg(17nmol),反式-二氯双(三苯膦)钯(II)3.2mg(4.6nmol),三乙胺1.0mL,和4-碘苯基五氟化硫75.6mg(229nmol)的四氢呋喃溶液1mL。室温条件下搅拌6小时后,加入1M盐酸水溶液5mL,将反应液用乙酸乙酯20mL分3次提取。将其用饱和氯化钠水溶液洗涤3次。用硫酸钠干燥,浓缩,得到褐色油状物质114mg。将该物质用以二氯甲烷-乙酸乙酯(0-20%,阶梯梯度法)作为洗脱液的硅胶柱色谱(12g,14mm内径×160mm长)处理,得到目标化合物与杂质的混合物53mg。将其进一步用以77%甲醇作为洗脱液的高效液相色谱(HydroSphereC18,20mm内径×150mm长)处理,得到题记化合物30.3mg(收率25%)。1HNMR(500MHz,CD3OD):δ0.94(3H,s),1.04(3H,s),1.68(3H,m),1.69(1H,dd,J=13.0和9.3Hz),1.84(1H,ddd,J=13.0,6.4和1.5Hz),2.01(3H,d,J=0.9Hz),4.27(1H,m),4.45(1H,d,J=16.4Hz),4.49(1H,d,J=16.4Hz),5.66(1H,m),5.71(1H,m),6.17(1H,d,J=16.1Hz),7.58-7.60(2H,m),7.68(1H,d,J=16.1Hz),7.79-7.82(2H,m)实施例9:(2Z,4E)-5-(1S,4S)-1-羟基-2,6,6-三甲基-4-((3-苯基丙-1-基)氧)环己-2-烯-1基)-3-甲基戊-2,4-二烯酸的合成[化学式18]将4-甲基苯磺酸3-苯基丙-2-炔-1-基酯替换为使用4-甲基苯磺酸3-苯基丙-1-基酯进行与实施例1相同的反应,得到题记化合物(收率44%)。1HNMR(500MHz,CDCl3):δ0.91(3H,s),1.00(3H,s),1.62(1H,dd),1.66(3H,s),1.75(1H,ddd,J=13.2,6.3和1.0Hz),1.85(2H,m),2.01(3H,s),2.68(2H,t,J=7.3Hz),3.49(2H,m),3.96(1H,m),5.58(1H,m),5.73(1H,brs),6.17(1H,d,J=15.2Hz),7.20(5H,m),7.68(1H,d,J=15.2Hz)比较例1:3’-己基硫-脱落酸的合成[化学式19]按照非专利文献1中记载的方法,合成题记化合物。试验例1:拟南芥种子的发芽试验(1)将拟南芥(Arabidopsisthaliana,Col-0)的种子浸渍在70%乙醇水溶液500μL中30分钟,接着,浸渍在100%乙醇溶液500μL中1分钟,用蒸馏水1mL洗涤5次后,使种子浸渍在蒸馏水中,在暗处,4℃条件下春化处理3天。将试样的甲醇溶液放入1.5mL容量的微型管中,减压下除去甲醇,加入70℃的0.5%琼脂水溶液(含1/2MS培养基无机盐类),搅拌后放入96孔板中,作为含有试样的培养基。试样中,实施例1~9及比较例1的浓度均配制为3μM。再者,施加ABA的情况下,ABA的浓度配制为0.3μM。将春化处理完毕的拟南芥种子各20-30粒播种,22℃、连续光照下培养,随时间推移观察其发芽数量。根据下述公式(1)计算发芽率。此外,使用甲醇同样配制的培养基用作对照。结果表示在表1中。表明了将实施例1~9的化合物和ABA共同给药时,通过施加ABA后下降的种子的发芽得到恢复。发芽率(%)=发芽数(个)/播种数(个)×100…(1)(表1)实施例和比较例的浓度均是3μM试验例2:拟南芥种子发芽试验(2)使实施例1的化合物的处理浓度从0.3μM变化到30μM,进行与试验例1相同的试验。结果表示在图1中。表明了即使在该浓度范围内,将实施例1的化合物和ABA共同给药,由ABA导致的下降的种子的发芽率也得到恢复。同样地,使实施例2的化合物的处理浓度从0.3μM变化到30μM,进行同样的试验。表明了即使在该浓度范围内,将实施例2的化合物和ABA共同给药,由ABA导致的下降的种子的发芽率也得到恢复。试验例3:生菜和青梗菜的种子发芽试验进一步地,将拟南芥替换成使用生菜(Lactucasativa)和青梗菜(Brassicarapavar.chinensis),进行与试验例2相同的试验。即使对生菜和青梗菜的种子,通过实施例1和2的化合物与ABA的共同给药,由ABA导致的下降的种子的发芽率也得到恢复。试验例4:实施例1的化合物和比较例1的化合物的比较为了比较实施例1的化合物和比较例1的化合物的种子发芽率的恢复效果,使化合物的处理浓度从0.3μM变化到3μM,进行与试验例2相同的试验。结果表示在图2中。表明了实施例1的化合物相比于比较例1的化合物对种子发芽率的恢复效果更优良。试验例5:蛋白质脱磷酸化酶的活性试验将拟南芥的PYR/PYL/RCAR蛋白质(PYL,脱落酸受体)或者编码(コード)有蛋白质脱磷酸化酶HAB1的质粒(pGex-2T-GST-HAB1或者pET28-6xHis-PYL)转化成大肠杆菌体(HAB1:BL21(DE3)pLysS,PYL:BL21-codonplus(DE3)-RIPL)。在进行过预培养(30℃,180rpm,15小时)和主培养(30℃,180rpm,4小时)的培养液中,加入异丙基-β-硫代半乳糖吡喃糖苷,用FPLC精制呈现蛋白质(16℃,150rpm,18小时)的粗酶溶液,配制重组PYL(PYR1,PYL1-6,PYL8-10)和HAB1。在96孔板中依次加入β-巯基乙醇、氯化锰水溶液、HAB1、PYL、试样的二甲基亚砜溶液、超纯水,22℃条件下静置30分钟后,加入作为HAB1的人工基质的p-硝基苯磷酸酯开始反应,放入酶标仪中(TECAN,infiniteTMN200NanoQuant))。反应开始3分钟后开始测定p-硝基苯磷酸酯的水解产物p-硝基苯酚的405nm的吸光度,根据下述公式(2)计算HAB1的活性。此外,以仅仅加入二甲基亚砜的分级作为对照,在该时刻的活性为100%。其结果表示在图3和表2中。表明了实施例1和4~9的化合物起到ABA受体的拮抗剂的作用。HAB1比活性(%)=样品添加时的吸光强度/对照的吸光度×100…(2)表2-:未测定试验例6:采用等温滴定量热仪的结合亲和力的测定试验在与试验例5相同的顺序下,配制重组PYL5的磷酸钠缓冲溶液,将其倒入等温滴定量热仪(GEHealthcare,MicroCaliTC200)的反应池中,将实施例1的化合物的磷酸钠缓冲溶液吸入注射器内。然后,将上述的量热仪设定为20℃,进行测定。实施例7~9的化合物也进行与上述相同的测定。使用作为比较对象的ABA及比较例1化合物的磷酸钠缓冲溶液的结果表示在表3。实施例1和7~9的化合物的解离常数Kd比ABA和比较例1的化合物更低,表明和ABA受体的亲和力更强。(表3)试样Kd(μM)ΔH(kcal/mol)-TΔS(kcal/mol)ΔG(kcal/mol)ABA0.88±0.11-7.8±0.1-0.3-8.1±0.1实施例10.07±0.02-7.9±0.1-1.7-9.6±0.1比较例10.48±0.10-9.7±0.21.2-9.6±0.1实施例70.07±0.02-5.5±0.1-4.2-9.6±0.2实施例80.18±0.01-4.9±0.1-4.1-9.0±0.1实施例90.36±0.07-6.7±0.1-2.0-8.6±0.1试验例7:拟南芥的生长发育试验将拟南芥(Arabidopsisthaliana,Col-0)种子依次分别浸渍在5%漂白剂+1%SDS水溶液500mL、70%乙醇水溶液500μL、70%乙醇水溶液500μL各1分钟,用灭菌水1mL洗涤5次,然后,悬浮在0.1%琼脂水溶液中。将用高压釜灭菌后的发芽培养基(含1/2MS培养基无机盐类)各25mL分别加入灭菌塑料培养皿中,将0.1%琼脂水溶液中悬浮的种子各60-80粒分别播种,在暗处,4℃条件下春化处理3天。将其在22℃、连续光照条件下培养10天。将灭菌后的土(有机培养土:蛭石=1:1)各40g分别加入到塑料盆(50mm×50mm×50mm,35mm底面×35mm高)中。该塑料盆6个放在3000mL容量的托盘上,加入稀释1000倍的HYPONeX(商品名(注册商标),日本株式会社HYPONeX制造)水溶液300mL(深10mm),将拟南芥幼苗从塑料培养皿中各5株分别移植。将其在22℃、16小时明周期-8小时暗周期下培养,每日喷洒1次0.1%DMSO(含有实施例7的化合物)+0.1%展着剂BI(商品名(注册商标),花王株式会社制造)水溶液1mL(调配至实施例7的化合物的最终浓度为50μM)。再者,每1周加入稀释2000倍的HYPONEX水溶液300mL。使用比较例1的化合物进行与上述的同样的处理。此外,将每日喷洒1次不含上述化合物的0.1%DMSO+0.1%展着剂BI水溶液1mL的情形作为对照。进一步地,在与上述相同的条件下,在0.1%DMSO(包含实施例7的化合物,包含比较例1的化合物,或者不包含这两者的化合物)+0.1%展着剂BI水溶液1mL(包含化合物的情况下,其最终浓度调配至50μM)中,添加ABA,调配ABA的最终浓度为5μM,将其每日喷洒1次进行试验。将培养3周后的拟南芥的生长发育状态进行比较,仅仅给药ABA的情况下,拟南芥的生长发育被显著抑制。与此相对,比较例1的化合物和ABA共同给药的情况下,ABA的生长发育抑制效果几乎没有被改善。另外,实施例7的化合物和ABA共同给药的情况下,由于ABA引起的生长发育抑制效果被显著改善,拟南芥的生长发育恢复到与对照同样的程度。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1