获得配对末端测序信息的方法与流程
本发明总体上涉及核酸测序领域。特别地,本发明涉及获得配对末端测序信息的方法。本发明还涉及用于所述方法的套件和结合所述方法的系统。
背景技术:
配对末端(pe)或成对测序是一种已知的技术,其涉及对测序库中的核酸片段的两端进行测序,并将正向读取和反向读取对齐为读取对。
除了在相同的时间内产生两倍的读取以及在库制备中的效力以外,对齐为读取对的序列允许更精确的读取对齐。
配对末端测序允许用户对片段的两端进行测序,并产生高质量、可对齐的测序数据。其有助于对基因组重组和重复序列单元、以及基因融合和新型转录本的检测。由于配对末端读取更可能与参考对齐,通过使用该技术可改善整个数据集的质量。
期望提供一种获得配对末端测序信息的改进方法,以便降低成本、增加吞吐量和/或简化过程。
技术实现要素:
本发明的一个方面提供一种在测序反应中获得配对末端测序信息的方法,其包括以下步骤:
提供固定化在固体支持体上的靶核酸;
通过产生互补核酸链来确定所述靶核酸的序列,所述互补核酸链包括至少一个可链接部分;
确定所述互补核酸链的序列;以及
比对所述靶核酸的序列和所述互补核酸链的序列,以提供所述配对末端测序信息。
有利地,所述至少一个可链接部分可以在链的合成期间结合到所述互补链中。
所述至少一个可链接部分可以提供在第一测序引物上。
所述至少一个可链接部分可以提供在延伸寡核苷酸上。
所述至少一个可链接部分可以提供在修饰核苷酸上。
在一个实施例中,所述固体支持体包括至少一个相对应的可链接部分,以在预定条件下选择性地共价或非共价地连结所述互补核酸链上的至少一个可链接部分。
在一个实施例中,所述至少一个相对应的可链接部分包括在所述固体支持体上的表面寡核苷酸,且所述至少一个可链接部分包括与所述表面寡核苷酸基本上互补的核酸序列。
在一个实施例中,所述靶核酸可以通过包括第一序列的表面寡核苷酸固定化在所述固体支持体上,且所述固体支持体上的所述相对应的可链接部分表面寡核苷酸可以具有不同于所述第一序列的第二序列。
这提供了在杂交步骤期间最小化不期望的杂交的优点,这是由于不同的表面寡核苷酸可以用于扩增步骤和杂交步骤。
在一个实施例中,在杂交步骤中升高的温度可能抑制可链接部分到所述固体支持体上的表面寡核苷酸的杂交。
这提供了在杂交步骤期间最小化不期望的杂交的优点。
本发明提供了如下优点,所述互补链可以锚定到用于下一代测序反应的类型的固体支持体上的表面引物。
在一个实施例中,所述至少一个相对应的可链接部分包括固定化在所述固体支持体上的所述靶核酸的序列的一部分。
在某些实施例中,可以在延伸步骤中使用链置换聚合酶。
可选地,所述方法包括如下步骤,活化所述至少一个可链接部分,以将所述互补核酸链结合到所述固体支持体。
有利地,活化可以在测序步骤期间进行。例如,通过在合成反应测序期间添加活化分子。替代地,或附加地,活化可以是通过改变反应的一个或多个条件。
在一个实施例中,所述至少一个可链接部分包括在所述互补链上的生物素化部分和在所述固体支持体上的链霉亲和素。
优选地,所述方法包括如下步骤,在确定所述靶核酸的序列的步骤之后移除所述靶核酸。
可以通过线性化步骤移除所述靶核酸。
有利地,可以在测序步骤期间进行所述靶核酸的移除。例如,在合成测序的循环期间。
在一些实施例中,在任何一个时间,仅相同的核酸约束到固体支持体。在测序读取期间,靶或互补链中的任一个固定化在固体支持体上。
在优选的实施例中,确定所述靶核酸的序列的步骤包括,使第一测序引物与所述靶核酸杂交,并延伸所述第一测序引物以获得第一测序读取。
可选地,所述第一测序引物在所述第一测序读取之后延伸到所述靶核酸的基本上全部长度。
有利地,所述互补核酸链可以延伸到所述靶核酸的基本上全部长度。
优选地,确定所述互补核酸链的序列的步骤包括,使第二测序引物与所述互补核酸链杂交,并延伸所述第二测序引物以获得第二测序读取。
可以使用合成测序或连接测序来获得所述测序读取。
比对所述靶核酸的序列和所述互补核酸链的序列以提供所述配对末端测序信息的步骤可以利用算法和/或计算机处理器。
所述靶核酸可以包括单链核酸。
在一个实施例中,所述靶核酸可以包括双链核酸。
在一个实施例中,所述靶核酸包括部分单链且部分双链的核酸。
在提供单链以进行测序之前,所述靶核酸可以作为双链核酸固定化在固体支持体上。
所述靶核酸可以作为双链核酸固定化在固体支持体上。
重组酶可以有助于将测序引物杂交到双链核酸中。
在一个实施例中,所述方法包括所述靶核酸分子的克隆扩增的前置步骤。
有利地,所述方法可以应用于群集或克隆种群。
所述核酸可以包括dna或rna。
所述固体支持体可以包括流动池或珠。
本发明的另一方面提供一种用于上述方法的引物,其包括用于与靶核酸序列杂交的序列,以及可链接部分,所述可链接部分用于将与靶核酸序列互补的核酸链固定化到固体支持体。
在一个实施例中,所述可链接部分包括与所述固体支持体上的表面寡核苷酸基本上互补的核酸序列。
可选地,用于与靶核酸序列杂交的序列在其5’末端附着到所述可链接部分的核酸序列的5’末端。
用于与靶核酸序列杂交的序列在其5’末端附着到所述可链接部分的核酸序列的3’末端。
本发明的另一方面提供一种用于获得配对末端测序信息的系统,其包括测序设备,所述测序设备具有用于固定化靶核酸的固体支持体,用于测序试剂的入口和出口,以及
通过产生互补核酸链来确定所述靶核酸的序列的装置,所述互补核酸链包括至少一个可链接部分;
确定所述互补核酸链的序列;以及
比对所述靶核酸的序列和所述互补核酸链的序列,以提供所述配对末端测序信息。
在一个实施例中,所述设备包括链霉亲和素涂覆的固体支持体。
本发明的另一方面提供一种用于在测序反应中获得配对末端测序信息的套件,其包括一个或多个测序试剂和至少一个可链接部分。
所述套件可以包括用于执行本发明的方法的指令。
附图说明
在附图中,其仅通过示例的方式说明了本发明的各个方面:
图1a和图1b图示了用于高通量测序的测序基底的区域的侧视图;
图2a至图2e图示了图1b的测序基底的侧视图,且示出了,当仅一种类型的dna链约束到固体支持体的表面时,获得配对末端测序信息的过程的示例;
图3a至图3e图示了图1b的测序基底的侧视图,且示出了,当仅一种类型的dna链约束到固体支持体的表面时,获得配对末端测序信息的过程的另一示例;以及
图4a至图4e图示了图1b的测序基底的侧视图,且示出了,当仅一种类型的dna链约束到固体支持体的表面时,获得配对末端测序信息的过程的又一示例。
图5a和图5b图示了图5a所示的现有技术方法的步骤与图5b所概述的本发明方法的步骤的比较。
图6a至图6e图示了图1b的测序基底的侧视图,且示出了获得配对末端测序信息的过程的示例。
图7a和图7b图示了图1b的测序基底的侧视图,且示出了获得配对末端测序信息的过程的示例。
具体实施方式
本发明提供了当仅一种类型的dna链约束到固体支持体的表面时获得配对末端测序信息的方法。例如,可以使用单个类型的寡核苷酸捕获探针使一种类型的dna链在固体支持体(例如,流动池)上约束并克隆扩增。一种类型的dna链可以指定为“a”,且其互补链可以指定为“aprime”(a′)。在各种实施例中,一种类型的dna链(例如,链a)被约束到固体支持体的表面,并用于产生第一测序读取。然后,产生基本上全长互补链(例如,链a′),并约束到固体支持体的表面。第一类型的dna链(例如,链a)被移除,并从表面约束互补链(例如,链a′)获得第二测序读取。
在一个示例中,包含可链接部分的第一测序引物被用于获得第一测序读取。在完成第一测序读取之后,在dntp(天然或非天然的)和dna聚合酶的存在下进行测序引物的完全延伸,以产生基本上全长互补链a′。然后,互补链a′经由完全延伸的第一测序引物中的可链接部分约束到固体支持体的表面。
在另一示例中,用于从链a获取第一测序读取的第一测序引物被移除,且包含可链接部分的延伸寡核苷酸被杂交,并用于产生基本上全长互补链a′。然后,互补链a′经由可链接部分被锚定到固体支持体的表面。
在又一示例中,包含可链接部分的修饰核苷酸可以在第一测序读取的循环期间被结合。这些核苷酸可以在前几个循环期间被结合,或可以在后几个循环期间被结合,特别是如果分子远长于读取长度。
在完成第一测序读取之后,在dntp和dna聚合酶的存在下进行第一测序引物的完全延伸,以产生基本上全长互补链a′。然后,互补链a′经由结合的修饰核苷酸上的可链接部分约束到固体支持体的表面。
互补链a’的后续连结和/或测序可以在相同的基底/支持体上,在第一测序读取的基本上相同或不同的区域。替代地或附加地,其可以在不同的基底/支持体上。
可能需要可链接部分的活化或者某些条件,以便使得与链a’相关联的可链接部分连结固体支持体的表面上的相关联的部分,使得可以控制互补链到表面的锚定。
例如,在某些实施例中,使用多步骤化学反应,使得可链接部分不会耦联到固体支持体部分,直到添加第三部分或其他条件(例如,ph或温度变化)。如果需要,这允许在测序期间对可链接部分的耦联的控制和延迟(deferring)。用于本发明的合适的附着化学反应的非限制性实例描述于美国申请号13/784,368中。
附加地或替代地,一个或多个可链接部分的受控活化可以通过配体-受体/抗体-抗原相互作用来实现,例如抗体与抗原的连结。
本文所述的方法可以应用于约束到固体支持体的表面的单个dna分子(例如,链a)或者dna分子的克隆种群(例如,链a的克隆种群)。
因此,与目前的配对末端测序方案相比,用于获得配对末端测序信息的本发明提供了获得配对末端测序信息的更简单的方法。
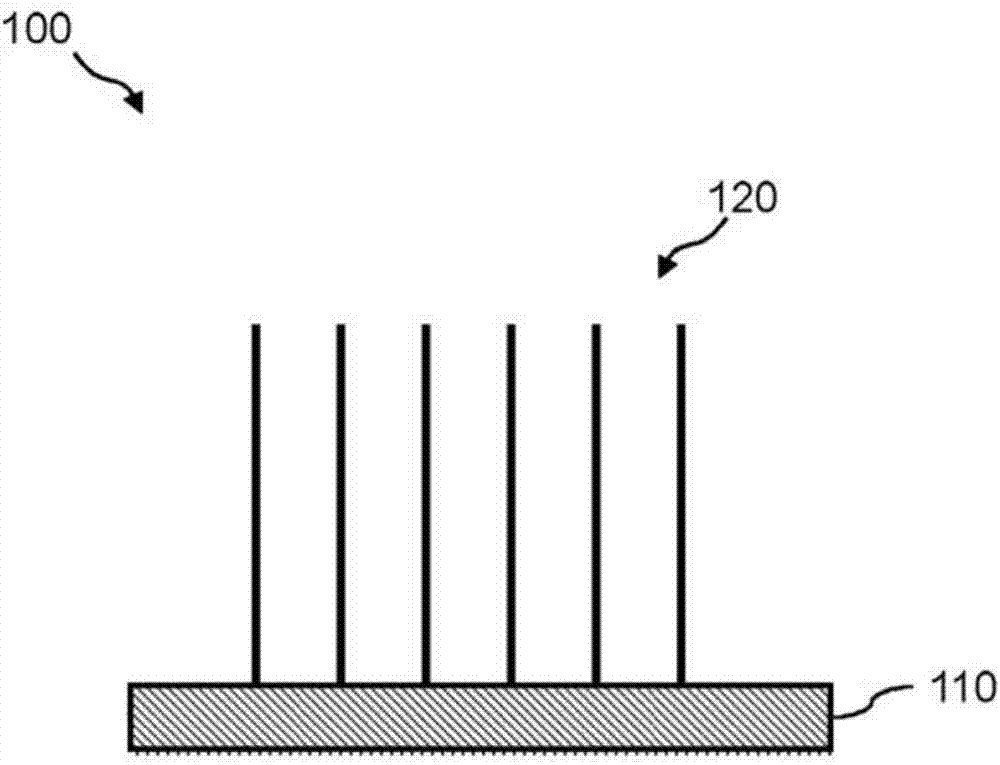
图1a和图1b图示了用于高通量测序的测序基底100的区域的侧视图。测序基底100包含固体支持体110。在一个示例中,固体支持体110是平面基底,例如流动池。在另一示例中,固体支持体110是珠(未示出)。参考图1a,单个类型的dna链115可以约束到固体支持体110的表面。dna链115可以被称为a链。链a的反向互补可以被称为链a′(未示出)。
参考图1b,dna分子的克隆种群120可以约束到固体支持体110的表面。克隆种群120是由待测序的单个dna分子的克隆扩增衍生的相同dna分子的种群。克隆种群120中的所有相同复制附着到固体基底110。在一个示例中,克隆种群120包含一种类型的dna链(例如,链a)。在另一示例中(未示出),第一克隆种群120可以包括链a,且第二克隆种群120可以包括链a′。在该示例中,示出了单个克隆种群120,但任何数量的克隆种群可被约束到固体支持体110的表面。
图2a至图2e图示了图1b的测序基底100的侧视图,且示出了,当仅一种类型的dna链约束到固体支持体的表面时,获得配对末端测序信息的过程的示例。在该示例中,第一测序引物包含可链接部分,所述可链接部分可以用于将基本上完全延伸的互补链a′锚定到固体支持体的表面。当仅一种类型的dna链约束到固体支持体的表面时,获得配对末端测序信息的过程的示例可以包含但不限于以下步骤。
在一个步骤中,图2a示出了多个第一测序引物210与克隆种群120的杂交。在该示例中,克隆种群120包括链a。每个第一测序引物210包含可链接部分215,其可以在某些条件下共价或非共价地锚定到固体支持体110。在一个示例中,可链接部分215可以是生物素化部分,其可以经由生物素-链霉亲和素复合物锚定到链霉亲和素涂覆的固体支持体110。在另一示例中,可链接部分215可以为任何其他合适的官能团,其可以共价或非共价地锚定到固体支持体110。可以用于将寡核苷酸锚定到固体支持体的官能团的示例描述于“strategiesforattachingoligonucleotidestosolidsupports(用于将寡核苷酸附着到固体支持体的策略)”中(integrateddnatechnologies(集成dna技术)2014(v5))。第一测序引物210可以用于获得测序反应中的第一读取,例如合成测序(sbs)、连接测序、或任何其他合适的测序方法。
在另一步骤中,图2b示出了在完成第一测序读取之后的第一测序引物210的完全延伸。第一测序引物210可以在天然dntp和dna聚合酶的存在下延伸,以产生多个基本上全长dna链a′220。dna链a′220与克隆种群120a链互补。
在另一步骤中,图2c示出经由可链接部分215将完全延伸的dna链a′220锚定到固体支持体110。克隆种群120(链a)已经被移除。在一个示例中,克隆种群120通过线性化步骤(未示出)被移除。
在另一步骤中,图2d示出了多个第二测序引物225与dna链a′220的杂交。
在另一步骤中,图2e示出了通过第二测序引物225的延伸对dna链a′220进行测序,以获得第二测序读取230和产生的配对末端测序信息。
图3a至图3e图示了图1b的测序基底100的侧视图,且示出了,当仅一种类型的dna链约束到固体支持体的表面时,获得配对末端测序信息的过程的另一示例。在该示例中,用于从链a获得第一测序读取的第一测序引物被移除,且包含可链接部分的延伸寡核苷酸被杂交,且用于产生基本上全长互补链a′。互补链a′经由可链接部分锚定到固体支持体的表面。在该示例中,当仅一种类型的dna链约束到固体支持体的表面时,获得配对末端测序信息的过程的示例可以包含但不限于以下步骤。
在一个步骤中,图3a示出了多个第一测序引物310与克隆种群120的杂交。在该示例中,克隆种群120包括链a。
在另一步骤中,图3b示出了第一测序引物310的延伸,以在测序反应中获得第一测序读取,测序反应例如是sbs、连接测序、或任何其他合适的测序方法。
在另一步骤中,图3c示出了在完成第一读取测序反应之后的第一测序引物310的移除和延伸的第一读取。
在另一步骤中,图3d示出了多个延伸寡核苷酸315与克隆种群120(a链)的杂交。每个延伸寡核苷酸315包含可链接部分320,其可以在某些条件下共价或非共价地锚定(链接)到固体支持体110。
在另一步骤中,图3e示出了延伸寡核苷酸315的延伸。延伸寡核苷酸315可以在dntp和dna聚合酶的存在下延伸,以产生多个基本上全长dna链a′325。dna链a′325与克隆种群120a链互补。
在另一步骤中,图3f示出了经由可链接部分320锚定到固体支持体110的表面的dna链a′325。克隆种群120(a链)已经被移除。在一个示例中,克隆种群120可以通过线性化步骤(未示出)移除。
在另一步骤中,图3g示出了多个第二测序引物330与全长dna链a′325的杂交,全长dna链a′325经由可链接部分320锚定在固体支持体110的表面上。
在另一步骤中,图3h示出了测序引物330的延伸,以获得第二测序读取。第一测序读取(图3b)和第二测序读取提供配对末端测序信息。
图4a至图4e图示了图1b的测序基底100的侧视图,且示出了,当仅一种类型的dna链约束到固体支持体的表面时,获得配对末端测序信息的过程的又一示例。在该示例中,包含可链接部分的修饰核苷酸被结合到互补链a′的最多5′部分。在另一示例中(未示出),具有可链接部分的核酸可以在远离5′末端的一距离处被结合。位置可以取决于插入物尺寸和读取长度。例如,如果插入物非常长,则可能将修饰核苷酸结合到基本上中心的部分,这是由于读取不会到达插入物的中心区域。
在某些实施例中,可能期望使修饰核苷酸包含在延伸的末端(3’末端)附近,这是由于这可以改善核酸链的固位(retention)(特别是在测序条件可能导致破坏的情况下)。在3’末端处定位核酸的一种方法是结合天然dntp以产生全长链a’,然后在修饰核苷酸的存在下添加具有3’-5’核酸外切酶活性的聚合酶,使得修饰核苷酸可以在该3’末端处被结合。
在图4a-4e所示的示例中,当仅一种类型的dna链约束到固体表面时,获得配对末端测序信息的过程可以包含但不限于以下步骤。
在一个步骤中,图4a示出了多个第一测序引物410与克隆种群120的杂交。在该示例中,克隆种群120包括链a。
在另一步骤中,图4b示出了第一测序引物410的延伸,以及在测序反应中包含可链接部分415的修饰核苷酸的结合,测序反应例如是sbs、连接测序、或任何其他合适的测序方法。可以结合包含可链接部分415的修饰核苷酸,例如在测序的前几个循环期间。可以使用不包含可链接部分415的核苷酸来进行测序的随后的周期。
在另一步骤中,图4c示出了在完成第一测序读取之后的第一测序引物410的完全延伸。第一测序引物410可以在天然dntp(例如,其不包含可链接部分)和dna聚合酶的存在下完全延伸,以产生多个基本上全长dna链a′420。dna链a′420与克隆种群120a链互补。
在另一步骤中,图4d示出了可链接部分415的活化以及随后将dna链a′420链接到固体支持体110的表面。可链接部分415可以例如通过化学、物理或酶的方法来活化。由于可链接部分415需要活化步骤,防止了固体支持体110的表面上的游离修饰核苷酸的附着以及表面连结位点的饱和。克隆种群120(a链)现在可以被移除。dna链a′420现在链接到固体基底110。然后,多个第二测序引物425与dna链a′420杂交。
在另一步骤中,图4e示出了第二测序引物425的延伸,以获得第二测序读取430和产生的配对末端测序信息。
图5a和图5b图示了示出了与现有技术方法相比较的本发明的简化方法(如图5b所示)。图5a所示的现有技术方法需要大量的步骤来获得配对末端测试信息。
从图5b所示的方法步骤可以清楚地看出,本发明提供了一种改进的、更简单的并且更省时的方法。事实上,在图5b中以虚线示出的步骤(“附着”和“移除链a”)可以并入测序反应的循环中,进一步减少了执行该方法所需的步骤和时间。例如,可以通过在sbs的最后几个周期中包含活化分子来执行附着步骤。在这种情况下,同时执行sbs和附着,从而不需要额外的时间来执行作为单独的步骤的附着步骤。类似地,可以使用包含在sbs的后续循环中的线性化酶或化学物质来通过线性化步骤执行链a的移除。因此,与现有技术方案相比,改进的方法提供了显著的工作流程优点。
图6a至图6e图示了图1b的测序基底100的侧视图,且示出了获得配对末端测序信息的过程的示例。在该示例中,第一测序引物610上的可链接部分615包括与固体支持体的表面上的表面引物130互补的序列。
如图6a所示,序列(可链接部分615)在其5’末端附着到测序引物的5’末端,且面向相反的方向,使得得到的引物寡核苷酸640(其包括测序引物610和可链接部分序列615两者)具有两个3’末端。
引物寡核苷酸640可以通过测序引物的5’末端到与表面引物互补的序列的5’末端的化学链接来构建,或者经由链霉亲和素/生物素链接——例如,约束到链霉亲和素的两个生物素化的5′寡核苷酸来构建。
图6a图示了多个这些第一“双端”寡核苷酸引物640经由侧序引物组分610的杂交与克隆种群120杂交。在该示例中,克隆种群120包括链a。每个链a通过固体支持体的表面上的表面引物130锚定到固体支持体110。如图所示,多个表面引物130在扩增之后保持为可用于杂交。
通常,大量的表面引物130保持为可用于杂交。然而,在某些实施例中,可以优化杂交步骤的反应条件,以促进寡核苷酸引物640与表面引物130的杂交。例如,杂交期间的较高温度促进测序引物组分610与链a上的相关位点的杂交,这是因为测序引物位点比较短的表面引物序列130具有更高的熔解温度。
在某些条件下,寡核苷酸引物640可以在测序引物组分610与链a上的相关位点杂交之前与表面引物130杂交。与表面引物130杂交但不与链a杂交的任何寡核苷酸引物640将不会在测序步骤期间延伸,并且可以随后被移除,例如通过使用加热步骤。
类似地,在延伸步骤中可以使用链置换聚合酶,以确保在延伸期间可链接部分序列615与进行测序的分子的部分的任何不期望的杂交被校正,使得序列615与核酸链分离,因此与可用的表面引物130自由杂交。
在一个实施例中,可链接部分615与表面引物130和/或克隆种群序列的不期望的连结通过提供具有与可链接部分615互补的序列(但是该序列不同于将克隆种群链a链接到固体支持体的表面引物130的序列)的附加表面引物而减少。
如图6b所示,具有附着到5′末端的可链接部分序列615的第一测序引物610可用于在测序反应中获得第一读取,测序反应例如是合成测序(sbs)、连接测序、或任何其他合适的测序方法。
图6c示出了在完成第一测序读取之后的第一测序引物610的完全延伸。第一测序引物610可以在dntp和dna聚合酶的存在下延伸,以产生多个基本上全长dna链a′220。dna链a′220与克隆种群120a链互补。
如图6d所示,寡核苷酸引物640上的可链接部分序列615与固体支持体上的可用的表面引物130杂交,形成如图所示的桥,并将a′链锚定到固体支持体上。线性化步骤(以650表示)使得表面引物130在其3′末端附近线性化,以在链a120中产生5′末端。然后可以使用5′-3′核酸外切酶移除链a。
完全延伸的dna链a′220从而经由可链接部分615与表面引物130的杂交锚定到固体支持体110。克隆种群120(链a)已经被移除。图6e示出了多个第二测序引物225与dna链a′220的杂交。
然后,dna链a′220通过第二测序引物225的延伸被测序,以获得第二测序读取和产生的配对末端测序信息。
图6a至6e所示的本发明的实施例提供了可以使用常规固体支持体的优点,而不需要任何附加的表面化学反应来将链a′锚定到表面。
图7a和图7b图示了这样的实施例,其中图6a至图6e所示的方法可以使用替代寡核苷酸引物740来执行,所述替代寡核苷酸引物740包括的序列与表面引物(可链接部分615)互补,所述表面引物在其3’末端附着到测序引物的5’末端并面向相同的方向,使得得到的引物寡核苷酸240(其包含测序引物610和可链接部分序列615两者)具有5’和3’末端。
图7b更准确地示出了,当使用图7a的替代引物寡核苷酸时,关于图6d所示并描述的方法步骤。
- 还没有人留言评论。精彩留言会获得点赞!