一种水体中微生物DNA的提取方法与流程
本发明属于分子生态学领域,具体地涉及一种水体中微生物dna的提取方法。
背景技术:
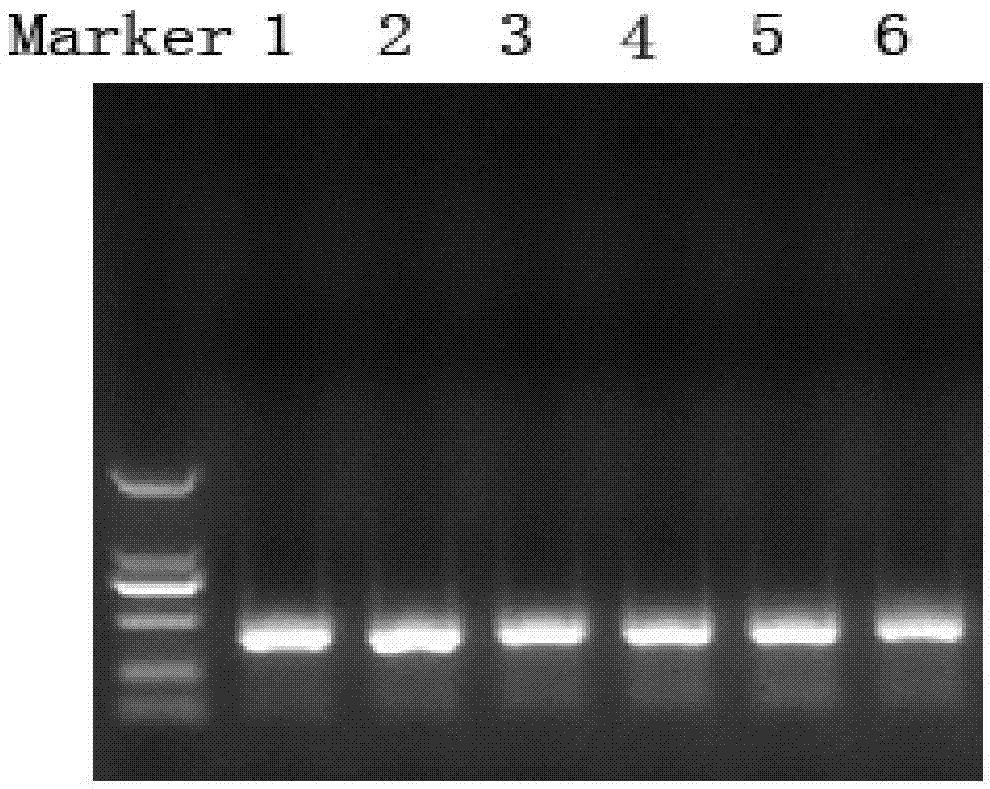
:水体中含有非常丰富的微生物资源,传统的纯培养技术主要是把微生物通过选择性培养基分离培养后,再进行纯菌的分类鉴定。利用传统的纯培养技术,淡水环境中大概0.25%的微生物可以培养,海水环境中大约0.001~0.1%的微生物可培养,不仅费时、费力,只能检测可培养微生物,对水体中大量的不可培养的微生物无法分析,这给微生物多样性资源开发和利用带来很大局限。但近年来,各种分子生物学方法(pcr、克隆文库、dgge等)相继应用到微生物生态学中,这些技术能快速地分析微生物群落结构的多样性,进行复杂微生物群落结构演替规律、微生物种群动态性、以及重要基因定位、表达及调控的评价分析,更好地揭示微生物与环境之间的生态学意义。而以上方法的关键技术之一是从各种水体样品中获得高纯度、大片段、完整性好的水体微生物dna。由于水体样品种类繁多,成分复杂,含有大量的无机和有机化合物,尤其是水体环境中天然有机质腐殖酸和重金属会干扰提取反应和后续的pcr酶反应的进行,此外,粗提dna的每一个纯化步骤,不可避免的会引起dna损失。因此,需要研究适用于水体微生物多样性分析的dna提取的方便、快捷、实用的方法,以解决常规方法所获得的dna样品存在腐殖酸等pcr抑制剂、细胞裂解率低、dna损失严重等问题。技术实现要素:本发明的目的在于提供一种水体中微生物dna的提取方法,适用于各种水体微生物的多样性分析,提取过程不使用酚、氯仿,减少对实验操作人员的危害,所提取的微生物dna具有较好的完整性,经琼脂糖凝胶电泳后染色,dna条带清晰且单一,无拖尾,无杂带,获得的微生物dna纯度高、产量高、操作简单、成本低。为了达到上述目的,本发明提供的技术方案如下:一种水体中微生物dna的提取方法,包括如下步骤:1)收集微生物将水样经微孔滤膜过滤,收集滤膜,在无菌条件下,将滤膜剪碎,放入离心管;2)破碎微生物细胞向步骤1)的离心管中加入氧化锆、试剂i、试剂ii,震荡,离心,取上清液;其中,所述的试剂i为0.2~0.3m磷酸缓冲液,ph=7.0~8.0;所述试剂ii包括:1~2wt.%sds细胞裂解液,20~60mmtris-hcl,100~200mmnacl,40~100mmedta,0.1~1wt.%乙烯聚吡咯烷酮,ph=7.8~8.0;3)去除腐殖酸和蛋白质向步骤2)的上清液中加入试剂iii,混匀,离心,向离心后的上清液中加入试剂iv,混匀,离心,得到裂解液;其中,所述的试剂iii为80~120mm硫酸铝;试剂iv中含有浓度为2~5m的醋酸钾、2~6wt.%的冰醋酸,ph=4.6~5.0;4)纯化裂解液将裂解液的上清液中加入试剂v,混匀,移入核酸纯化柱中,静置,离心,弃去虑液;向核酸纯化柱中加入试剂vi,离心,弃去滤液,再加试剂vii,离心,弃去滤液;其中,利用试剂vii纯化2~3次;其中,所述的试剂v中含有:6~10m异硫氰酸胍,0.2~0.6m醋酸钾;试剂vi中含有:6~10m异硫氰酸胍,20~23mm柠檬酸钠;试剂vii中含有:70~75%乙醇,体积分数;5)洗脱dna将核酸纯化柱安置于离心管内,离心,向核酸纯化柱中加入灭菌蒸馏水,室温静置,将静置后获得的洗脱液进行离心,获得所述微生物dna。进一步,步骤2)所述氧化锆的粒径为1.0~1.2mm。优选地,所述试剂i为0.2~0.3m磷酸缓冲液,ph=7.0~8.0;所述试剂ii包括:1.4~1.6wt.%sds细胞裂解液,30~50mmtris-hcl,140~160mmnacl,60~80mmedta,0.4~0.6wt.%乙烯聚吡咯烷酮,ph=7.85~7.95。优选地,步骤3)所述的试剂iii包括:90~110mm硫酸铝;所述试剂iv包括:3~4mol/l的醋酸钾、3~5wt.%的冰醋酸,ph=4.7~4.9。优选地,步骤4)所述的核酸纯化柱是含有聚丙烯膜+硅胶膜的核酸纯化柱。优选地,所述步骤5)中洗脱dna时,灭菌蒸馏水加热至60~65℃。进一步,将获得的dna保存于-20~-18℃。进一步,所述水样的体积为50~100ml,所述的氧化锆的加入量为0.8~1.0g,水样和试剂i的体积比为40~50:1,所述的试剂i、试剂ii、试剂iii、试剂iv、试剂v、试剂vi和试剂vii之间的体积比为1:0.15~0.2:0.15~0.2:0.3~0.4:1~1.2:0.4~0.6:0.4~0.6。本发明采用利用物理和化学方法破碎微生物细胞,在物理破碎时,比重越大的研磨珠,冲量越大,研磨效率越高,破碎效果越好,相对于玻璃珠和硅酸锆,氧化锆比重最大,密度和强度最高,抗破裂性强;同时研磨珠的大小决定了研磨珠和物料的接触点的多少,粒径小的珠子在相同的容积下接触点越多,理论上研磨效率也越高;采用粒径为1.0~1.2mm的氧化锆,可以充分破碎水体中微生物细胞壁和细胞膜,使得细胞内的物质包括dna最大程度释放。本发明进行化学破碎时,试剂ii中除了含有sds细胞裂解液,还加入了浓度为0.1~1%的乙烯聚吡咯烷酮(pvpp),可以去除细胞内的酚类和萜类杂质,在提高细胞裂解率同时,提高dna纯度。本发明利用硫酸铝和醋酸钾试剂去除腐殖酸和蛋白质,加入试剂iii去除水体中的腐殖酸,试剂iii中硫酸铝的浓度过高或过低均会影响腐殖酸的去除效率,设定硫酸铝浓度为80~120mm时,去除腐殖酸的效果最佳,可以完全去除腐殖酸,同时不影响dna的收率;加入试剂iv沉淀去除细胞中的蛋白杂质,试剂iv中添加冰醋酸,其作用是调节ph到4.6~5.0,试剂iv中醋酸钾的浓度是2~5m、冰醋酸的浓度是2~6wt.%,在此浓度及ph下,去除蛋白杂质效果最佳。本发明对获得的裂解液纯化时,利用核酸纯化柱进行纯化,使用聚丙烯膜+硅胶滤膜的纯化柱,相对于常规的纯化柱,聚丙烯膜+硅胶滤膜韧性好,抗拉强度较高,在高速离心状态下,能保持其性能;在高盐条件下,核酸纯化柱的滤膜可以同核酸发生吸附反应,而在低盐条件下,核酸又可以从滤膜中释放出来,蛋白质和其它杂质不会被吸附,从而达到纯化核酸的目的。本发明的试剂v中含有异硫氰酸胍和醋酸钾,能够破坏核酸表面亲水薄膜的相对有序排列,形成疏水环境,在此环境中,核酸与硅胶膜能有效结合,而蛋白质、代谢产物和其他污染物则不能结合,因此加入试剂v的作用是促进dna与硅胶模的结合,使dna吸附到硅胶模上,试剂v中异硫氰酸胍的浓度是6~10m,醋酸钾的浓度是0.2~0.6m时,这样的浓度范围可以促进dna与硅胶模的结合效果最好。本发明利用试剂vi、试剂vii对裂解液进行纯化,洗脱dna有残存的盐和小分子杂质,如核苷酸、氨基酸,试剂vi、试剂vii中成分的浓度范围可以保证洗脱dna小分子杂质,而dna继续吸附在硅胶模表面,保持较好的dna较好的纯度,在洗脱dna时,使用加热的灭菌蒸馏水,有利于提高洗脱效率。与现有技术相比,本发明的有益效果是:1)本发明提取水体样品的微生物dna,纯度高、产量高,采用分光光度计分别在260nm和280nm测定微生物dna的吸光度,其od260和od280比值在1.8~2.0之间,测得微生物dna的浓度为10~30ng/μl。2)本发明所提取的微生物dna具有较好的完整性,经琼脂糖凝胶电泳后染色,dna条带清晰且单一,无拖尾,无杂带,操作简单、成本低。3)利用本发明方法提取的水体样品的微生物dna,可以扩增出目标基因,不受腐殖酸等pcr抑制剂的影响,可以保证后续的pcr扩增的进行。4)本发明在提取dna时不使用酚、氯仿,减少对实验操作人员的危害。附图说明图1为本发明实施例提取的6个不同的水体样品的微生物dna经1.0%琼脂糖凝胶电泳后用0.5%eb染色结果。图2为本发明实施例提取的6个不同的水体样品的微生物dna进行pcr扩增18srrna基因的琼脂糖凝胶电泳结果。图3为本发明实施例提取的6个不同的水体样品的微生物dna进行pcr-dgge扩增18srrna基因的电泳结果。具体实施方式以下结合具体实施例对本发明做进一步说明。实施例11.利用本发明方法分别提取6个不同的水体样品(河水,湖水,海水位置不同的各2个采样点)的微生物dna,样品分别取自2个不同位置的黄浦江淡水,2个不同位置的太湖富营养化水,2个不同位置的崇明岛长江入海口海水,提取步骤如下:1)分别采用五点采样法,使用有机玻璃采样器采集2个不同位置(水面相距10~20米)的水面以下0.5米处的水体,装入灭菌瓶,样品存放于4度,运送回实验室,立即提取dna,取50ml水样经0.22μm的微孔滤膜过滤,将滤膜及过滤物在无菌条件下剪成1~2mm的碎屑,放入2.0ml微量离心管中,加入0.8~1.0g氧化锆(粒径1.0~1.2mm)。2)加入978μl试剂i,122μl试剂ii,使用仪器进行震荡:70hz,震荡60s,震荡重复2次,转速13000rmp,离心10min。3)取约650μl上清液到2.0mleppendorf管中,加入100μl试剂iii,上下颠倒混匀2min,转速12000rmp离心5min。4)取约650μl上清液到2.0mleppendorf管中,加入250μl试剂iv,上下颠倒混匀10次,转速13000rmp离心5min。5)取约700μl上清液到2.0mleppendorf管中,加入1000μl试剂v,上下颠倒混匀2min;将液体移入预先置于2.0mleppendorf管上的纯化柱中(每次600~700μl),室温放置2min,转速13000rmp离心1min,弃虑液;加500μl试剂vi到纯化柱中,转速13000rmp离心1min,弃滤液;加500μl试剂vii到纯化柱中,转速13000rmp离心1min,弃滤液。重复2~3次。6)将纯化柱安置于2.0mleppendorf管内,转速13000rmp离心1min;将纯化柱安置于另一1.5ml的离心管内,在纯化柱膜的中央处加入60μl加热至65℃的灭菌蒸馏水,室温静置1分钟,将洗脱液进行离心1分钟,获得微生物dna,-20度保存或进行下一步实验。本实施例中,试剂i为:0.2m磷酸缓冲液,ph=7.0;试剂ii中各成分含量为:1wt%sds,20mmtris-hcl,100mmnacl,40mmedta,0.1wt%pvpp,ph=7.8;试剂iii为:80mm硫酸铝;试剂iv的各成分含量为:2m醋酸钾,2wt.%冰醋酸,ph=4.6;试剂v的各成分含量为:6m异硫氰酸胍,0.2m醋酸钾;试剂vi的各成分含量为:6m异硫氰酸胍,20mm柠檬酸钠;试剂vii为:70%乙醇。2.对提取的水体微生物dna作进一步检测2.1琼脂糖凝胶电泳对利用本发明方法分别提取的6个不同的水体样品(河水,湖水,海水位置不同的各2个采样点)的微生物dna,经1.0%琼脂糖凝胶电泳后用0.5%eb染色,结果参见图1,其中,1为河水1,2为河水2,3为湖水1,4为湖水1,5为海水1,6为海水2,marker:dl15,000(takara)。结果显示:各种样品的dna条带清晰且单一,无拖尾,无杂带,dl15000marker对比,说明各微生物dna具有较好的完整性。2.2测定dna浓度和纯度利用本发明方法分别提取6个不同的水体样品(河水,湖水,海水位置不同的各2个采样点)的微生物dna,采用分光光度计分别在260nm和280nm测定微生物dna的吸光度od值,可知,dna浓度约为10~30ng/μl,od260/od280比值在1.8~2.0之间,结果见表1。表12.3pcr扩增利用本实施例提取的6个不同的水体样品(河水,湖水,海水位置不同的各2个采样点)的微生物dna,pcr扩增18srrna基因,琼脂糖凝胶电泳结果参见图2,其中,1为河水1,2为河水2,3为湖水1,4为湖水1,5为海水1,6为海水2,marker:dl15000(takara)。结果显示:各种样品的dna可以扩增储目标基因,不受腐殖酸等pcr抑制剂的影响,说明采用本发明方法提取的各种样品的dna可以保证后续的pcr扩增的进行。2.4pcr-dgge扩增利用本实施例提取的6个不同的水体样品(河水,湖水,海水位置不同的各2个采样点)的微生物dna,pcr-dgge扩增18srrna基因,电泳结果参见图3,其中,1为河水1,2为河水2,3为湖水1,4为湖水1,5为海水1,6为海水2。结果表明,不同样品的pcr-dgge的图谱和条带均不同,反映了不同样品的微生物群落结构存在差异,说明采用本发明方法提取的各种样品的dna可以保证后续的pcr-dgge的进行。实施例2本实施例中,试剂i为:0.3m磷酸缓冲液,ph=8.0;试剂ii中各成分含量为:2wt%sds,60mmtris-hcl,200mmnacl,100mmedta,1wt.%pvpp,ph=8.0;试剂iii为:120mm硫酸铝;试剂iv的各成分含量为:5m醋酸钾,6wt.%冰醋酸,ph=5.0;试剂v的各成分含量为:10m异硫氰酸胍,0.6m醋酸钾;试剂vi的各成分含量为:10m异硫氰酸胍,23mm柠檬酸钠;试剂vii为:75%乙醇。其它操作步骤同实施例1,提取的水体样品的dna浓度和纯度结果见表2。表2利用本实施例提取的6个不同的水体样品(河水,湖水,海水位置不同的各2个采样点)的微生物dna,pcr扩增18srrna基因,琼脂糖凝胶电泳结果与图2一致;pcr-dgge扩增18srrna基因,电泳结果与图3一致,说明采用本发明方法提取的各种样品的dna可以保证后续的pcr扩增及pcr-dgge的进行。实施例3本实施例中,试剂i为:0.25m磷酸缓冲液,ph=7.5;试剂ii中各成分含量为:1.5wt%sds,40mmtris-hcl,150mmnacl,70mmedta,0.5%pvpp,ph=8.0;试剂iii为:100mm硫酸铝;试剂iv的各成分含量为:3m醋酸钾,4wt.%冰醋酸,ph=4.8;试剂v的各成分含量为:8m异硫氰酸胍,0.4m醋酸钾;试剂vi的各成分含量为:8m异硫氰酸胍,22mm柠檬酸钠;试剂vii为:73%乙醇。其它操作步骤同实施例1,提取的水体样品的dna浓度和纯度结果见表3。表3样品河水1河水2湖水1湖水2海水1海水2浓度(ng/μl)15.925.018.120.115.223.5od260/od2801.901.871.951.901.861.95利用本实施例提取的6个不同的水体样品(河水,湖水,海水位置不同的各2个采样点)的微生物dna,pcr扩增18srrna基因,琼脂糖凝胶电泳结果与图2一致;pcr-dgge扩增18srrna基因,电泳结果与图3一致,说明采用本发明方法提取的各种样品的dna可以保证后续的pcr扩增及pcr-dgge的进行。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1