一种鸭生长性状相关的POU1F1单倍型分子标记及应用的制作方法
本发明属于家禽分子标记筛选技术领域,具体涉及一种鸭生长性状相关的POU1F1单倍型分子标记及应用。
背景技术:
生长性状是畜禽生产中重要的经济性状,它能够反映畜禽的生长发育状况,是畜禽养殖场生产水平和经济效益的重要指标。畜禽的生长性状为微效多基因控制的数量性状,寻找鉴定与目标性状相关的候选基因及分子标记是非常必要的。但一个候选基因通常存在多个SNPs位点,且许多表型性状不是由单个SNP引起的,而是由多个SNPs的特定组合所致,这种SNPs特定组合即是单倍型。不同SNP位点上核苷酸碱基的线型排列即为一种SNP单倍型。单倍型集合了多个SNPs的信息,可为目标性状的研究提供更加丰富的信息、更加可靠的参考。
垂体特异性转录因子POU1F1(POU class 1 homeobox 1),又称Pit-1(Pituitary Specific Transription Factor-1),是动物垂体前叶特异表达的一种具有重要功能的转录因子。POU1F1主要参与调节机体细胞的生长与发育,并对垂体激素分泌细胞的基因转录起重要调节作用。在哺乳动物中的研究发现,小鼠POU1F1与伴性矮小基因dw基因座存在紧密连锁关系,并影响小鼠的生长发育过程;在人POU1F1中发现了20多个突变,可导致垂体的发育不全,阻碍激素的分泌,引起矮小现象的出现;猪POU1F1基因突变影响我国著名小型香猪的生长;在牛和羊POU1F1基因中均检测到与生产性状显著相关的突变位点。在家禽中,鸡POU1F1基因多态性对生长性状和屠体性状影响显著;在鹅POU1F1基因中也发现了与早期体重显著相关的多态位点。这些研究表明POU1F1对机体的生长发育具有重要调控作用,因此,在鸭中寻找鉴定POU1F1基因与生长性状相关的SNP及单倍型分子标记对畜禽生长性能的提高具有重要意义。
技术实现要素:
本发明的目的在于寻找鸭POU1F1基因的SNP位点,提供一种单倍型分子标记在鸭生长性状检测中应用,并以此作为鸭生长性状相关的SNP及单倍型分子标记在标记辅助选择中的应用。
本发明通过以下技术方案实现:
申请人提供了第一种鸭生长性状相关的POU1F1单倍型分子标记,所述的单倍型分子标记的核苷酸序列如SEQ ID NO:1所示;在该序列的第137位的碱基处有一个T/C突变,该突变导致TaqⅠ酶切的多态性。
申请人提供了第二种鸭生长性状相关的POU1F1单倍型分子标记,所述的单倍型分子标记的核苷酸序列如SEQ ID NO:2所示;在该序列的第128位的碱基处有一个T/A突变,该突变导致DraⅠ酶切的多态性。
申请人提供了第三种鸭生长性状相关的POU1F1单倍型分子标记,该单倍型分子标记的核苷酸序列如SEQ ID NO:3所示;在该序列的第84位和114位的碱基处有A/C和T/A的两个突变,所述突变分别导致ScaⅠ和SmiⅠ酶切的多态性。
扩增或检测如SEQ ID NO:1所述的分子标记的引物对,其DNA序列如SEQ ID NO:4和SEQ ID NO:5所示。
扩增或检测如SEQ ID NO:2所述的分子标记的引物对,其DNA序列如SEQ ID NO:6和SEQ ID NO:7所示。
扩增或检测如SEQ ID NO:3所述的分子标记的引物对,其DNA序列如SEQ ID NO:8和SEQ ID NO:9所示。
申请人提供了一种鸭生长性状相关的POU1F1单倍型分子标记的应用的方法,所述的应用包括:提取待测样本的鸭基因组DNA,用序列表SEQ ID NO:4-9所示的序列的特异性引物扩增分别得到337bp、433bp和347bp的片段,将所述的目的片段分别用TaqⅠ、DraⅠ、ScaⅠ与SmiⅠ酶切,得到3个PCR产物的4个RFLP图谱,根据图谱中的带型筛选得到h4h4和h2h4单倍型组合的个体。
具体地,本发明的步骤是:
提取待测样本的鸭基因组DNA,针对鸭POU1F1基因的第2内含子、第5内含子和3’端共设计3对引物(见实施例1),用序列表SEQ ID NO:4-9所示的特异性引物扩增分别得到337bp、433bp和347bp的片段,目的片段经回收后直接测序,比对分析后共发现4个SNPs位点,分别引起了TaqⅠ、DraⅠ、ScaⅠ和SmiⅠ酶切位点的改变。这4个位点经PCR-RFLP酶切分型,每个位点均出现3种基因型,且最后两个位点的基因型完全一一对应,可合并为一个位点。利用PHASE2.1软件分析这几个SNPs产生的单倍型种类及其频率,SAS软件进行基因型与性状间的关联分析。结果显示,在SEQ ID NO:1所示序列的第137位T/C位点从第4周开始对生长性状有显著影响(P<0.05),128T/A、84A/C(114T/A)从第2周开始对生长性状有显著影响(P<0.05);4个位点重构的单倍型,不同单倍型组合从第2周开始对生长性状有显著影响(P<0.05),其中h4h4与h2h4单倍型组合的生长性状值最大。
本发明通过直接测序、PCR-RFLP、单倍型构建及关联分析的方法得到与鸭生长性状相关的分子标记,为鸭的分子标记辅助选择提供了4个新的SNPs分子标记及1个单倍型分子标记。
更详细的技术方案参见《具体实施方式》。
附图说明
序列表SEQ ID NO:1是本发明筛选得到的与鸭生长性状相关的其中一个分子标记的核苷酸序列,序列长度为337bp,在该序列的137位存在一个T/C的碱基突变,该突变导致TaqⅠ酶切的多态性。
序列表SEQ ID NO:2是本发明筛选得到的与鸭生长性状相关的第二个分子标记的核苷酸序列,序列长度为共433bp,在该序列中的128位有一个T/A的碱基突变,该突变导致DraⅠ酶切的多态性。
序列表SEQ ID NO:3是本发明筛选得到的与鸭生长性状相关的另一个分子标记的核苷酸序列,序列长度为共347bp,在该序列中的84位、114位依次存在两个A/C、T/A的碱基突变,该突变分别导致ScaⅠ和SmiⅠ酶切的多态性。
序列表SEQ ID NO:4和SEQ ID NO:5是本发明制备的扩增或检测如SEQ ID NO:1所示的分子标记的引物对引物。
序列表SEQ ID NO:6和SEQ ID NO:7是本发明制备的扩增或检测如SEQ ID NO:2所示的分子标记引物对引物。
序列表SEQ ID NO:8和SEQ ID NO:9是本发明制备的扩增或检测如SEQ ID NO:3所示的分子标记的引物对引物。
图1:是POU1F1基因4个SNPs位点的测序峰图。附图标记说明:图1中依次为:137位T/C、128位T/A、84位A/C和114位T/A位点的测序峰图。
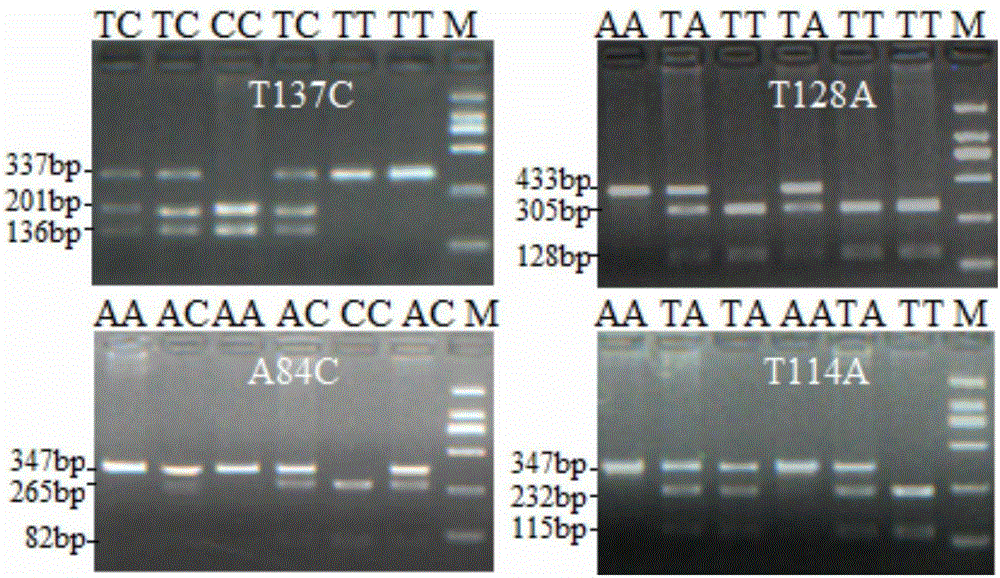
图2:是POU1F1基因4个SNPs位点的PCR-RFLP琼脂糖凝胶电泳图谱。附图标记说明:图中依次为:137位T/C、128位T/A、84位A/C和114位T/A位点的PCR-RFLP琼脂糖凝胶电泳图谱。
图3:是本发明筛选的其中一个分子标记的原序列。序列方框中的碱基(137位)为突变位点,突变位点附近带下划线部分为酶切位点,在序列首尾部分的阴影区下划线部分是正向引物(1-18位)和反向引物(320—337位)序列。
图4:是本发明筛选的第二个分子标记的原序列。序列方框(128位)中的碱基为突变位点,突变位点附近带下划线部分为酶切位点,在序列首尾部分的阴影区下划线部分是正向引物(1-18位)和反向引物(416—433位)序列。
图5:是本发明筛选的另一个分子标记的原序列。附图标记说明:序列方框(84位)中的碱基为突变位点,突变位点附近带下划线部分为酶切位点,在序列的首尾部分的阴影区下划线部分是正向引物(1-18)和反向引物(330—347位)序列。
具体实施方式
实施例1
1.1实验动物
实验动物为连城白鸭与白改鸭杂交第二世代(武汉市汉口精武食品工业园有限公司)群体,所有个体的饲喂日粮和管理条件均一致。记录个体初生重及每周体重至10周龄,随机采取其中450只鸭血样,采用常规苯酚/氯仿抽提法提取血样DNA,测定DNA的浓度及纯度,-20℃保存备用。
1.2引物设计
根据GenBank公布的绿头鸭(Anas platyrhynchos)POU1F1基因的基因组序列(NW_004676846.1),用Primer Preimer 5.0软件设计3对引物,扩增产物大小分别为337bp、433bp和347bp。
引物序列如下:
正向引物F:5’TACACTGGATGGGCTACT 3’(SEQ ID NO:4)
反向引物R:5’AGCATACCTGTGAGTGGA 3’(SEQ ID NO:5)
正向引物F:5’CAGAGCAAGTGGGAGGTA 3’(SEQ ID NO:6)
反向引物R:5’TCTTTATCCCATGGCCAC 3’(SEQ ID NO:7)
正向引物F:5’TCAAGGAGCATCACGAGT 3’(SEQ ID NO:8)
反向引物R:5’CAAGGAAGGCACGGTACA 3’(SEQ ID NO:9)
1.3PCR反应
PCR反应体系为15μL,其中10×Buffer(含Mg2+)1.5μL,dNTP(10mmol/μL)0.3μL,上、下游引物各0.3μL,Taq DNA聚合酶(5U/μL)0.1μL,模板DNA 1.0μL,用ddH2O补足至15μL。PCR反应条件为94℃预变性5min,(94℃变性20s,54℃退火20s,72℃延伸20s)×35,72℃延伸5min。取5μL PCR产物,加2μL 6×缓冲液于1.2%琼脂糖凝胶100V电泳25min,凝胶成像系统观察结果并拍照保存。
1.4测序与酶切位点分析
紫外灯下切胶回收纯化PCR产物,每对引物的PCR产物各选取4-8个样本交由武汉擎科新业生物技术有限公司进行测序。测序结果用DNAstar Package、NCBI数据库中的BLAST工具进行比对分析,用Primer Preimer 5.0和WatCut在线工具对存在SNPs位点的序列进行酶切位点分析。
1.5PCR-RFLP
PCR产物酶切反应体系为10μL:10×buffer 1μL、PCR产物5μL、限制性内切酶(10U/μL)0.3μL、ddH2O 3.7μL,混合均匀瞬时离心后于相应温度(TaqⅠ于65℃、DraⅠ和ScaⅠ于37℃、SmiⅠ于30℃)酶切过夜,酶切产物用2.0%-4.0%琼脂糖凝胶电泳检测,凝胶成像系统拍照保存,记录每个个体的基因型。
1.6单倍型构建与关联分析
用PHASE 2.1软件构建单倍型,SAS软件进行基因型与性状间的关联分析,使用广义线性模型(GLM)程序计算。具体模型:Y=μ+G+e,其中Y为性状表型值,μ为群体均值,G为基因型效应,e为随机效应。
1.7结果分析
序列比对结果显示共检测到4个SNPs位点,分别为SEQ ID NO:1所示序列中的137位T/C,SEQ ID NO:2所示序列中的128位T/A,以及SEQ ID NO:3所示序列中的84位A/C、114T/A。这几个SNPs分别引起了TaqⅠ、DraⅠ、ScaⅠ和SmiⅠ酶切位点的改变,经PCR-RFLP酶切分型,每个位点均出现3种基因型,且84位A/C与114位T/A位点的基因型完全一一对应。见表1。
表1鸭POU1F1基因单倍型组合与生长性状的关联分析
注:同一行中,不同小写字母表示差异显著(P<0.05),不同大写字母表示差异极显著(P<0.01)。
四个SNPs位点重构了8种单倍型,产生了17种单倍型组合,其中8种单倍型组合频率大于1%(如表1),占总基因型的96.18%。关联分析结果显示,四个位点重构的单倍型,不同单倍型组合从第二周开始即与生长性状有显著(P<0.05)或极显著(P<0.01)影响,其中h4h4与h2h4单倍型组合的生长性状值最大。因此,这4个SNPs构成的单倍型分子标记可运用到鸭的分子标记辅助选择中,作为辅助鉴定鸭的生长性状的有用分子标记。
- 还没有人留言评论。精彩留言会获得点赞!