与结核病阳性血清特异结合的多肽以及诊断试剂盒的制作方法
本发明提供了能够与结核病阳性血清特异结合的多肽,以及基于多肽的诊断试剂盒,更涉及了一种基于噬菌体展示多肽的结核病诊断试剂盒,属于生物制剂领域。
背景技术:
结核分枝杆菌(Mycobacterium tuberculosis,Mtb)是由德国细菌学家柯赫(Robert Koch)于1882发现并证实为引起结核病(Tuberculosis,TB)的病原菌。本菌可侵犯全身各组织器官,但以肺部感染最多见。据WHO统计,全世界约每3个人中就有1个人感染了Mtb,在某些发展中国家中,成人Mtb携带率高达80%,其中约5%~10%携带者可发展为活动性结核病。
目前,结核病诊断方法主要有以下几种:(1)细菌学诊断:包括痰涂片镜检法和痰样本培养法,其中痰涂片镜检法简单、快速和可靠,但其敏感性差;痰样本培养法是结核病诊断的金标准,但耗时长,假阴性率较高;(2)血清学诊断:结核病血清学诊断方法主要是利用免疫学技术检测血清中特异性抗Mtb的抗体。(3)结核菌素皮肤试验:是用于诊断Mtb感染所致IV型超敏反应的皮肤试验,对诊断活动性结核病和测定机体细胞免疫功能有参考价值,但其特异性差,常与环境分枝杆菌和卡介苗(BCG)产生交叉反应。(4)Mtb核酸扩增检测:该方法敏感性好,即使标本中拷贝数低的细菌也能被检出,但临床应用会有偏差,如标本处理不当,靶序列或扩增产物交叉污染等易造成假阴性。(5)IFN-γ释放试验:是结核病体外免疫检测的新方法,一般釆用酶联免疫吸附试验(ELISA)或者酶联免疫斑点实验(ELISPOT)测定机体全血或者外周血单核细胞中产生的IFN-γ的T细胞数量及细胞因子变化量,但该方法成本高,对技术要求高。
以上方法中,血清学检测是体外诊断结核病的有效方法,其检测方法简单、快速、高效和低廉,成为近年来结核病诊断的研究热点。该方法通过基因工程获取重组抗原,结合间接ELISA方法检测病人血清中的特异抗体,已在结核病的血清学诊断中显示出较好的诊断价值,如ESAT-6、CFP-21、Ag85复合物等。但现有的血清学诊断方法中所用的抗原很少能同时满足高灵敏性和特异性的需求,常将两种或者多种抗原结合用于结核病血清学诊断。但是传统的用蛋白抗原用于血清学诊断方法,必须先对相关基因进行克隆表达,再用亲和层析方法对蛋白进行纯化,这样比较费时费力,并且蛋白的表达与纯化过程易受多方面因素的影响。
噬菌体展示技术(Phage display technology)是由Smith等创建的一种分子生物学技术。该技术将编码外源目的蛋白或多肽的DNA片段插入到噬菌体一个特定的衣壳蛋白基因中,插入基因编码的蛋白与噬菌体的衣壳蛋白形成融合蛋白而呈现在噬菌体的表面,通过表型筛选即可获得相应的目的蛋白或多肽的DNA序列。目前,该技术广泛应用于抗原及表位筛选、细胞表面受体和蛋白质-蛋白质相互作用等领域。
技术实现要素:
本发明解决了背景技术中的不足,提供了一种能够与结核病阳性血清特异结合的多肽和展示该多肽的核心噬菌体,所述多肽和其相应的核心噬菌体的灵敏度和特异度高,具有良好的临床诊断价值。
实现本发明上述目的所采用的技术方案为:一种能够与结核病阳性血清特异结合的多肽,所述的多肽为A和B中的一种或两种的组合,其中A的氨基酸序列如SEQ ID NO:1所示:Ser-Val-Ser-Val-Gly-Met-Lys-Pro-Ser-Pro-Arg-Pro,B的氨基酸序列如SEQ ID NO:2所示:Thr-Met-Gly-Phe-Thr-Ala-Pro-Arg-Phe-Pro-His-Tyr。
本发明还提供了一种结核病血清学诊断试剂盒,该试剂盒中至少包括包被液、洗涤液、封闭液和终止液,所述试剂盒中含有上述与结核病阳性血清特异结合的多肽。
本发明还进一步提供了一种基于噬菌体展示多肽的结核病诊断试剂盒,该试剂盒中至少包括包被液、洗涤液、封闭液和终止液,试剂盒中还包含有核心噬菌体P1和核心噬菌体P4,其中核心噬菌体P1为展示多肽A的噬菌体,核心噬菌体P4为展示多肽B的噬菌体。
以上试剂盒中,所述包被液为0.05M的碳酸盐缓冲液,pH为9.6,所述的洗涤液为含0.05%Tween-20的TBST缓冲液,其pH为7.6,所述封闭液为含5%BSA的TBS缓冲液,所述的终止液为2mol/L的H2SO4溶液。
将本发明所提供的噬菌体及其相应的多肽进行ELISA反应,结果表明:代表性噬菌体克隆均能与结核病阳性血清发生特异结合,展示核心序列A的核心噬菌体P1和展示核心序列B的核心噬菌体P4能与不同的临床血清发生结合,灵敏度分别为78.57%和72.62%,特异度分别为95.31%和93.75;固相合成的多肽A和B与不同的临床血清发生反应,其灵敏度分别为89.41%和85.88%,特异度分别为90.63%和93.75%。
与现有技术相比,本发明中将噬菌体应用于血清学诊断具有以下显著的优势:噬菌体侵染大肠杆菌,繁殖速度快,易于实现大批量生产;噬菌体结构紧密,耐恶劣环境强,对检测的条件要求不高,使试验易于操作;敏感度和特异度高,能够达到快速、灵敏的诊断要求。因此,将噬菌体用于结核病的血清学诊断,对提高结核病的临床诊断效率具有重要意义。
附图说明
图1为琼脂糖凝胶电泳分析提取的部分噬菌体单链DNA图;
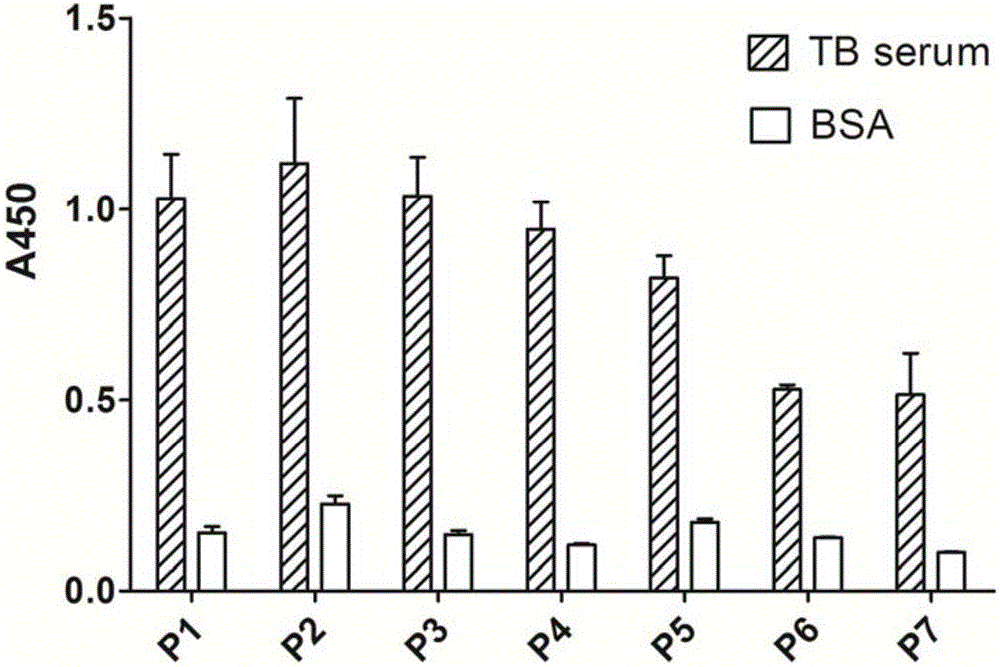
图2为噬菌体克隆与结核病阳性血清及牛血清白蛋白的ELISA反应性图;
图3为斑点免疫印迹法检测噬菌体与结核病阳性血清的特异结合图;
图4为核心噬菌体P1和不同的临床血清的ELISA反应图;
图5为核心噬菌体P4和不同的临床血清的ELISA反应图;
图6为核心噬菌体P1和不同临床血清ELISA反应的ROC分析图;
图7为核心噬菌体P4和不同临床血清ELISA反应的ROC分析图;
图8为多肽A和不同的临床血清的ELISA反应图;
图9为多肽B和不同的临床血清的ELISA反应图;
图10为多肽A和不同临床血清ELISA反应的ROC曲线图;
图11为多肽B和不同临床血清ELISA反应的ROC曲线图。
具体实施方式
下面结合具体实施例对本发明做详细具体的说明,但是本发明的保护范围并不局限于以下实施例。
本实施例中利用纯化的结核病阳性混合血清为靶分子,对噬菌体展示随机12肽库进行3轮生物淘选,筛选到能与结核病阳性混合血清特异结合的噬菌体,然后用固相法合成噬菌体展示的外源多肽,检测噬菌体以及外源多肽与不同临床血清的反应情况,以证明该噬菌体及其多肽在结核病血清学诊断中的应用价值。
主要试剂和仪器:噬菌体展示随机12肽库(The Ph.D.-12TM Phage Display Peptide Library)、受体菌Escherichia coli ER2738、测序引物及辣根过氧化物酶标记的抗M13pIII单克隆抗体均为美国New England Biolabs公司产品。经饱和硫酸铵法进行初步纯化的结核病阳性混合血清为课题组前期制备并保存。85份结核病阳性血清和32份结核病阴性血清来自衡阳市第三人民医院;32份肺炎支原体阳性血清和32份肺炎衣原体阳性血清来自南华大学附属第一医院检验科。
特异结合噬菌体的筛选:用包被缓冲液(pH9.6的0.1M NaHCO3缓冲液)将纯化的结核病阳性混合血清稀释成100μg/mL,取150μL加入96孔微量滴定板(Corning公司),轻轻旋转使孔壁完全湿润后,置于湿纸盒中于4℃过夜。甩掉包被液,将孔内加满封阻液于4℃封阻2h,去除封阻液,用含0.1%的吐温-20的Tris缓冲液(TBST)快速洗板6~8次。将用100μL TBST稀释的噬菌体展示随机12肽库(噬菌体数为4×1010)加至包被封阻好的96孔板内,室温温和摇动30~60min;倒掉未结合的噬菌体,用0.1%TBST洗涤液洗板10次。用100μL pH为2.2的洗脱缓冲液(0.2M甘氨酸-盐酸,1mg/mL BSA)洗脱特异结合的噬菌体;并用15μL pH 9.1的Tris-HCl中和缓冲液中和洗脱物;取10μL进行滴度测定,剩余部分进行扩增,将扩增后的洗脱物加到空白的微孔板内,室温缓慢摇动1h以吸附非特异性噬菌体,吸取上清液,此即为第一轮噬菌体筛选的阳性产物。测定其滴度后用于下一轮的生物淘选。
第二、三轮的生物淘选过程与第一轮相同,但TBST中吐温-20的含量增加为0.5%,第二轮得到扩增物之后,用同样的方式对结核病阴性血清进行包被、封阻、洗板,并将第二轮扩增后的洗脱物加至微孔板内室温摇动1h以再次吸附非特异性噬菌体。由表1可知,第1轮淘选后的产率为5.0×10-9,而第3轮淘选后其产率达到了2.3×10-6,说明具有特异结合活性的噬菌体克隆得到明显富集。
表1亲和筛选的产出与投入比
噬菌体单链DNA的提取与测序分析:依照噬菌体展示随机12肽库试剂盒的说明书,采用碘化钠法提取第3轮筛选后噬菌体的单链DNA,对所提取的部分噬菌体单链DNA采用琼脂糖凝胶电泳分析,结果如图1所示,图1中M:DNA-Marker;1-20:从随机挑取的噬菌体克隆中提取的单链DNA;21:空白对照。用琼脂糖凝胶电泳验证单链DNA提取成功后,送往上海生物工程有限公司进行测序,根据所测序列的反向互补序列推导出其相应的外源氨基酸序列。推导结果如表2所示:在随机挑取的37个噬菌体序列中,共出现7种不同的多肽序列(P1-P7),其中P1重复出现19次、P2重复出现2次,P4出现12次,其它肽序列各出现1次。根据所有37个多肽序列氨基酸组成的不同,可以将其大致分为2组。第一组的22个噬菌体序列中有19个完全一致,其余3个噬菌体展示的外源氨基酸序列中仅有1个或2个氨基酸不同,因此,推导出第一组核心序列(A):S-V-S-V-G-M-K-P-S-P-R-P;对第二组中的15个噬菌体展示的外源氨基酸序列进行比较分析,将在不同序列之间出现较多次数的氨基酸归属于一致的核心序列(B):T-M-G-F-T-A-P-R-F-P-H-Y。这2组核心序列初步判断可能为能与结核病阳性混合血清特异结合的多肽。
表2噬菌体展示肽序列的分组与比对分析
ELISA检测阳性噬菌体与结核病阳性混合血清的反应:扩增第3轮淘选的产物,用ELISA检测噬菌体与结核病阳性混合血清的结合能力。将结核病阳性混合血清用包被缓冲液(pH 9.6的0.1M NaHCO3)稀释成100μg/mL以包被96孔板,4℃过夜,同时设空白阴性对照。次日,用封阻液于4℃封阻2h。TBST洗板6次,向孔内加入以5倍稀释梯度稀释好的噬菌体,室温震荡作用2h后,洗板6次。加入HRP标记的抗M13pIII单克隆抗体(用封阻液以1∶3000的比例稀释),室温震荡作用1h后用TBST洗板8次;依次加入A、B显色剂各1滴,37℃避光显色15~20min后加入终止液(2mol/L的H2SO4溶液),用酶标仪检测450nm处的吸光度值,结果如图2所示,图2中P1~P7为7个代表性的噬菌体克隆。ELISA结果说明:7个代表性的噬菌体均能与结核病阳性混合血清结合(OD450值大于0.5),为阳性噬菌体克隆,说明这些噬菌体表面展示的12肽能特异识别结核病阳性混合血清。
斑点免疫印迹法鉴定阳性噬菌体:为更进一步证明阳性噬菌体克隆能否与结核病阳性混合血清发生特异结合,利用斑点免疫印迹法对其进行鉴定。方法如下:在PVDF膜上画上面积约为1cm2的小格,每个待检的阳性噬菌体各一格,取扩增后并经滴度测定的噬菌体上清1μL(约1011个噬菌体)点在小格上,同时设立结核病血清阳性对照和空白对照,待室温干燥;4℃封闭过夜,将膜用TBST洗涤液轻轻漂洗1~2次;用TBST以1∶200稀释纯化的结核阳性血清,取2mL于37℃浸膜2h,洗膜6次后,用HRP标记的羊抗人IgG(1∶5 000)于37℃浸膜1h,用TBST洗膜6次后用TMB显色、再进行显影与定影。
检测结果如图3所示,图3中A1-A4:阳性噬菌体P1-P4,B1-B3:阳性噬菌体P5-P7,C1:空白对照;C2:结核病阴性血清对照;C3:野生型噬菌体vcsM13对照;B4和C4:结核病阳性混合血清对照。从图3中可以看出,在所有阳性噬菌体克隆的点样处显示有明显的斑点,而在其它对照处无明显斑点。说明阳性噬菌体确实能与结核病阳性混合血清发生特异结合。
核心噬菌体的血清学检测:为研制基于噬菌体的临床诊断试剂,建立基于核心噬菌体的ELISA法,并检测其与不同的临床血清的反应情况。用包被液按1∶14的比例稀释血清,包被96孔板,4℃过夜。次日,用封阻液于4℃封阻2h。TBST洗板6次,向孔内加入30倍稀释的噬菌体(约1010个噬菌体),同时分别设立野生型噬菌体对照、血清对照和空白对照,37℃孵育1h后,洗板8次。加入HRP标记的抗M13pIII单克隆抗体(用封阻液以1∶3 000的比例稀释),37℃孵育1h后用TBST洗板8次;依次加入A、B显色剂各1滴,37℃避光显色15~20min后用酶标仪检测450nm处的吸光度值。以(阳性噬菌体的A450-空白的A450)/(野生型噬菌体的A450-空白的A450)≥2.1判为阳性。
检测结果如图4和图5所示,从图4和图5中可以看出:结核病阳性血清组与展示核心序列A的核心噬菌体P1和展示核心序列B的核心噬菌体P4的结合能力明显高于肺炎支原体、肺炎衣原体血清组以及结核病阴性血清组,P1和P4的灵敏度分别为78.57%和72.62%,特异度分别为95.31%和93.75。图6和图7分别为P1和P4的ROC分析图,其显示AUC均大于0.9,说明两种核心噬菌体有较高的临床诊断价值。
多肽的固相合成与ELISA检测:为了证实核心噬菌体与不同的结核病临床血清的特异结合确实是由于其展示的外源性多肽所致,而并不是噬菌体本身能和结核病临床血清发生结合,采用固相法成功合成了2条核心多肽A和B,对其进行质谱鉴定后用反向高效液相色谱(RP-HPLC)法进行纯化。
然后用ELISA法检测合成的多肽能否与不同的临床血清发生特异结合。将经包被缓冲液(pH 9.6的0.1M NaHCO3)稀释的不同浓度的多肽(50、100、150μg/mL)包被微孔板,4℃过夜,同时设空白与阴性对照。用封阻液于4℃封阻2h。TBST洗板后分别向孔内加入不同的临床血清,37℃作用2h后,洗板6次。再加入HRP标记的羊抗兔IgG抗体(1∶4 000)于37℃孵育1h,加入A、B显色剂,避光显色15min后用酶标仪检测450nm处的吸光度值。结果如图8、9、10、11所示,图8为多肽A和不同的临床血清的ELISA反应;图9为多肽B和不同的临床血清的ELISA反应;图10为多肽A和不同临床血清ELISA反应的ROC曲线;图11为多肽B和不同临床血清ELISA反应的ROC曲线。由图8和图9可知,多肽A和B与不同的结核病阳性血清具有较高的结合力,其灵敏度分别为89.41%和85.88%;而与肺炎支原体、肺炎衣原体和结核病阴性血清具有较低的结合力,其特异度分别为90.63%和93.75%。由图10和图11可知其AUC值分别为0.9632和0.9246,说明核心多肽A和B具有较好的临床诊断价值。
结论:本发明中,在对噬菌体展示随机12肽库进行筛选时,分别以结核病阴性血清和空的ELISA板进行两轮负筛选以去除非特异噬菌体,并且在第二轮和第三轮筛选时采取了逐步降低血清的包被浓度、增加洗脱物中吐温的浓度、降低孵育时间和延长洗脱时间等措施,因而使高度特异的噬菌体克隆得以明显富集,根据其氨基酸的组成最终推导出两组核心序列:第一组为Ser-Val-Ser-Val-Gly-Met-Lys-Pro-Ser-Pro-Arg-Pro,第二组为Thr-Met-Gly-Phe-Thr-Ala-Pro-Arg-Phe-Pro-His-Tyr。经ELISA鉴定,展示两组核心序列A和B的两种核心噬菌体P1和P4均能与结核病阳性血清发生特异结合,而与肺炎支原体阳性血清、肺炎衣原体阳性血清和结核病阴性血清的结合力较低,说明两种核心噬菌体用于结核病的血清学诊断具有较高的敏感性与特异性。经固相合成的核心多肽也能与不同的结核病临床血清发生特异结合,而与肺炎支原体阳性血清、肺炎衣原体阳性血清和结核病阴性血清的结合力较低,说明两种核心噬菌体所展示的多肽A和多肽B可用于结核病的血清学诊断,且具有较高的敏感性与特异性。
- 还没有人留言评论。精彩留言会获得点赞!