一种西他沙星二水合物晶型、制备方法及其组合物片剂与流程
本发明属于医药
技术领域:
,具体地说,涉及一种西他沙星二水合物晶型、制备方法及其组合物片剂。
背景技术:
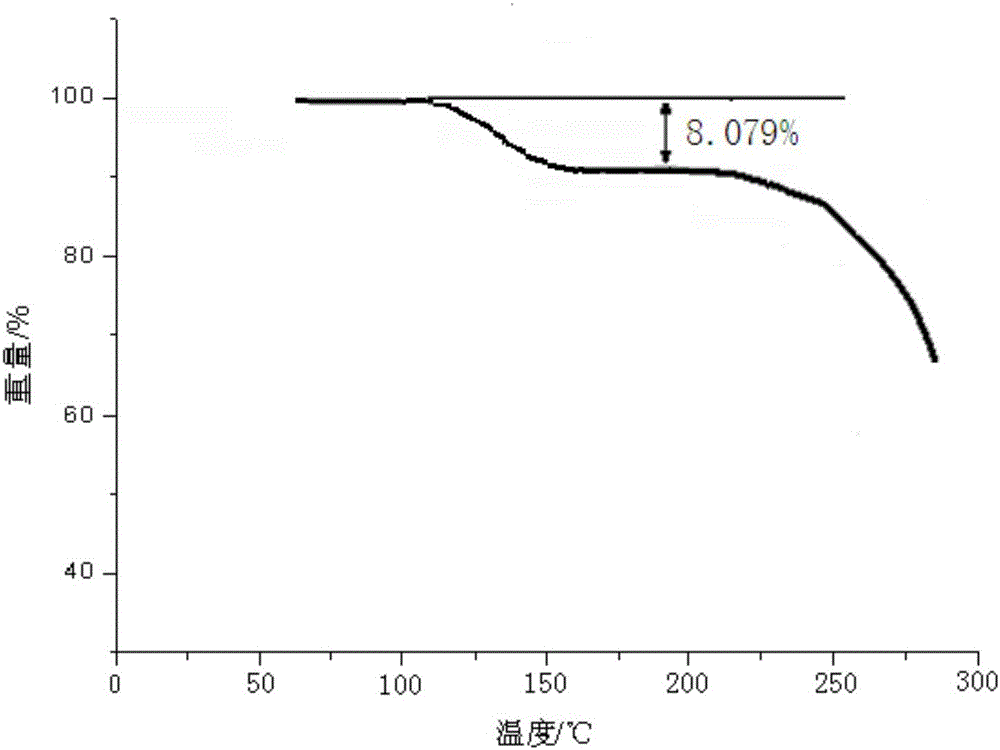
:西他沙星(sitafloxacin),化学名为7-[(7S)-氨基-5-氮杂螺[2.4]庚-5-基]-8-氯-6-氟-1-[(1R,2S)-cis-2-氟环丙基]-1,4-二氢-4-氧代-3-喹啉羧酸,是日本第一制药公司研发的氟喹诺酮类抗菌药物,临床用其3/2水合物。西他沙星是一种新型口服、具有广谱抗菌活性的N-1-氟环丙基新型喹诺酮类抗菌药,对需氧性或厌氧性革兰阳性菌及革兰阴性菌、支原体属及衣原体属等具有广谱抗菌作用。西他沙星化合物具有三个手性碳原子,其具有1个对映异构体和6个非对映异构体,确定其药用的化合物的绝对构型对于保证用药安全具有重要意义。目前文献报道了西他沙星的五种不同晶型[Int.J.Pharm.,2010,402,110-116],其中包括无水物α,β型、1/2水合物、1水合物和3/2水合物,其药用的晶型为3/2水合物,即7-[7-(S)-氨基-5-氮杂螺[2.4]庚烷-5-基]-8-氯-6-氟-1-[(1R,2S)-2-氟-1-环丙基]-1,4-二氢-4-氧代喹啉-3-羧酸3/2水合物。但是,由于西他沙星极难溶于水,采用现有晶型制得的片剂,口服后在体内溶解缓慢,而且难以达到完全溶解,导致药物的生物利用度降低,不能取得理想的抗菌效果。本领域技术人员意外发现,采用西他沙星二水合物制得的新晶型,添加适宜的辅料制成片剂,惊喜地发现本发明制得的片剂,溶出度及生物利用度提高,从而完成了本发明。技术实现要素:本发明的第一目的在于提供一种西他沙星二水合物晶型。本发明的第二个目的在于提供一种西他沙星二水合物晶型的制备方法,该方法工艺简单,操作简便,采用该方法制备的西他沙星二水合物结晶稳定性好。本发明的又一目的在于提供一种含有本发明所述的西他沙星二水合物晶型或采用本发明所述方法制得的西他沙星二水合物晶型制成片剂组合物及其制备方法,本发明人发现采用西他沙星二水合物晶型制得的片剂,改善了药物溶出度,提高了生物利用度。为实现本发明的目的,本发明采用如下技术方案:一种式(I)所示西他沙星二水合物晶型的化合物,其中,优选地,本发明提供的西他沙星二水合物晶型以2θ±0.2°衍射角表示的X-射线粉末衍射图谱在3.7°、5.3°、10.3°、11.5°、15.3°、16.8°、17.7°、19.8°、21.7°、24.8°、27.6°、30.6°、34.1°、和39.8°处显示有特征衍射峰。优选地,本发明提供的西他沙星二水合物晶型使用Cu-Kα射线测量得到的X-射线粉末衍射图如图1所示。本发明的第二个目的通过如下技术方案实现:一种权利要求1所述的西他沙星二水合物晶型的制备方法,包括如下步骤:1)将西他沙星粗品溶于无水乙醇、无水丙酮和去离子水中,加热回流,得溶液A;2)降温至40℃~50℃,加入活性炭,搅拌30min,过滤,得到溶液B,降温至20~25℃析晶1h,养晶3~12小时;3)用无水乙醇进行淋洗,得到白色固体;4)将步骤3)所得的固体置于真空干燥箱,体系抽真空,干燥至恒重,即得西他沙星二水合物晶型。优选地,按重量计,步骤1)中西他沙星:无水乙醇:无水丙酮为1:3-8:2-5:5-20,进一步优选地,西他沙星:无水乙醇:无水丙酮为1:3-5:2-3:8-10。优选地,步骤4)中所述的干燥在30-50℃条件下进行。本发明还提供一种含有西他沙星二水合物的组合物片剂,其中,该组合物片剂含有本发明制得的西他沙星二水合物晶型。组合物片芯有效成分包括以下重量比例:西他沙星二水合物32-33%、甘露醇38-39%、淀粉19-20%、羟丙基纤维素6-7%、羟丙基甲基纤维素1.3-1.4%、硬脂酸镁0.9-1%。本发明人在西他沙星原料药的研究过程中制备出了一种西他沙星二水合物晶型,晶型稳定性良好,且用本发明的西他沙星二水合物结晶制成的片剂,药物有效成分能以较快的速度从药物中释放出来,提高药物的溶出度及生物利用度。本发明所提供的组合物片剂可采用本领域技术人员公知的方法制备而成,优选采用如下方法制备:(1)粉碎过筛:将西他沙星粉碎后过80目筛,其他辅料均过80目筛。(2)将西他沙星二水合物晶型与经粉碎过筛的原辅料进行混合,制粒,干燥,整粒,压片,即得。与现有技术相比,本发明具有如下优点:(1)本发明所提供的西他沙星二水合物晶型,稳定性好。(2)本发明制备的西他沙星二水合物晶型制成的片剂溶出度及生物利用度高。(3)本发明所提供的西他沙星二水合物晶型的制备方法工艺简单,操作方便。附图说明图1为本发明的西他沙星二水合物晶型的X-射线衍射图谱;图2为本发明的西他沙星二水合物晶型的TG图谱;图3为24名男性志愿者多剂量口服50mg西他沙星试验制剂和参比制剂后,西他沙星平均血药浓度-时间曲线。具体实施方式通过下面的实施例可以对本发明进行进一步的描述,然而本发明的发明并不限于下面的实施例,这些实施例不以任何方式限制本发明的范围。本领域的技术人员在权利要求的范围内所作出的某些改变和调整也应认为属于本发明的范围。实施例1:西他沙星二水合物晶型的制备1)将西他沙星粗品1kg溶于3kg无水乙醇、2kg无水丙酮和去离子水5kg中,加热回流,得溶液A;2)降温至40℃~50℃,加活性炭25g,搅拌30min,得到溶液B,降温至20~25℃析晶1h,养晶3小时;3)用2kg无水乙醇进行淋洗,得到白色固体;4)将步骤3)所得的固体置于真空干燥箱,体系抽真空,于30℃条件下干燥至恒重,即得西他沙星二水合物晶型。对所制备的西他沙星二水合物晶型使用Cu-Kα射线测量得到的X-射线粉末衍射谱图(见图1)中特征峰在2θ为3.7°、5.3°、10.3°、11.5°、15.3°、16.8°、17.7°、19.8°、21.7°、24.8°、27.6°、30.6°、34.1°、和39.8°显示。元素分析:实测值:C51.21%、H4.98%、Cl7.97%、F8.51%、N9.45%、O17.95%。理论值:C51.18%、H4.97%、Cl7.95%、F8.52%、N9.42%、O17.94%。元素分析结果与理论值基本一致,其分子式为C19H18ClF2N3O3·2H2O采用美国Perkin-Elmer公司PEPyrisDiamondTG热分析仪,热重分析实验表明(见图2):该实施例制备的西他沙星二水合物结晶中含的水份8.079%,这与含2个结晶水(理论值为8.084%)的结果在误差范围之内。实施例2:西他沙星二水合物晶型的制备1)将西他沙星粗品1kg溶于8kg无水乙醇、5kg无水丙酮和去离子水10kg中,加热回流,得溶液A;2)降温至40℃~50℃,加活性炭25g,搅拌30min,过滤,得到溶液B,降温至20~25℃析晶1h,养晶6小时;3)用3kg无水乙醇进行淋洗,得到白色固体;4)将步骤3)所得的固体置于真空干燥箱,体系抽真空,于40℃条件下干燥至恒重,即得西他沙星二水合物晶型。根据XPRD数据,所得晶型与实施例1中晶型一致。采用美国Perkin-Elmer公司PEPyrisDiamondTG热重分析仪得到的热重分析图谱与实施例1一致。实施例3:西他沙星二水合物晶型的制备1)将西他沙星粗品1kg溶于5kg无水乙醇、3kg无水丙酮和去离子水20kg中,加热回流,得溶液A;2)降温至40℃~50℃,加活性炭25g,搅拌30min,过滤,得到溶液B,降温至20~25℃析晶1h,养晶12小时;3)用5kg无水乙醇进行淋洗,得到白色固体;4)将步骤3)所得的固体置于真空干燥箱,体系抽真空,于50℃条件下干燥至恒重,即得西他沙星二水合物晶型。根据XPRD数据,所得晶型与实施例1中晶型一致。采用美国Perkin-Elmer公司PEPyrisDiamondTG热重分析仪得到的热重分析图谱与实施例1一致。实施例4:西他沙星二水合物晶型的制备1)将西他沙星粗品1kg溶于3kg无水乙醇、2kg无水丙酮和去离子水8kg中,加热回流,得溶液A;2)降温至40℃~50℃,加活性炭25g,搅拌30min,过滤,得到溶液B,降温至20~25℃析晶1h,养晶9小时;3)用3kg无水乙醇进行淋洗,得到白色固体;4)将步骤3)所得的固体置于真空干燥箱,体系抽真空,于30℃条件下干燥至恒重,即得西他沙星二水合物晶型。根据XPRD数据,所得晶型与实施例1中晶型一致。采用美国Perkin-Elmer公司PEPyrisDiamondTG热重分析仪得到的热重分析图谱与实施例1一致。【制剂实施例】西他沙星组合物片剂的制备实施例1本实施例提供一种西他沙星片组合物,药物有效成分包括以下重量比例的组分:片芯:西他沙星二水合物晶型54.39g(相当于50gC19H18ClF2N3O3);甘露醇64.59g;淀粉33.99g;羟丙基纤维素11.39g;羟丙基甲基纤维素2.38g;硬脂酸镁1.52g。包衣:欧巴代(OPADRYXYWHITE)4.13g、纯水30.29g。本实施例西他沙星二水合物片组合物的制备方法包括以下步骤:a、粉碎过筛:将西他沙星二水合物晶型粉碎后过80目筛,其他片芯辅料均过80目筛。b、制粒:将西他沙星、甘露醇、淀粉、羟丙基纤维素置于高速湿法混合制粒机中,混合均匀,将羟丙基甲基纤维素配制成5%的羟丙基甲基纤维素水溶液作为粘合剂,将粘合剂与制粒机中的原辅料混合制成1000片湿颗粒。c、干燥:湿颗粒于55-65℃下通风干燥成为干颗粒。d、整粒:干颗粒经30目筛整粒。e、总混:称取硬脂酸镁及余量羟丙基纤维素,与干颗粒一并置于混合机中混合均匀。中间品检测步骤:检测总混步骤得到的中间品的休止角等参数,若符合标准,则进行下一步。f、压片:混合后的颗粒进行压片。g、包衣:用纯水与欧巴代配成包衣液,涂覆在药片表面并干燥,得1000片成品,每片含纯西他沙星50mg。实施例2本实施例提供一种西他沙星片组合物,药物有效成分包括以下重量比例的组分:片芯:西他沙星二水合物晶型54.42g(相当于50gC19H18ClF2N3O3);甘露醇64.31g;淀粉31.33g;羟丙基纤维素11.05g;羟丙基甲基纤维素2.14g;硬脂酸镁1.65g包衣:欧巴代(OPADRYXYWHITE)4.13g、纯水30.29g。本实施例西他沙星二水合物片组合物的制备方法包括以下步骤:a、粉碎过筛:将西他沙星二水合物晶型粉碎后过80目筛,其他片芯辅料均过80目筛。b、制粒:将西他沙星、甘露醇、淀粉、羟丙基纤维素置于高速湿法混合制粒机中,混合均匀,将羟丙基甲基纤维素配制成5%的羟丙基甲基纤维素水溶液作为粘合剂,将粘合剂与制粒机中的原辅料混合制成1000片湿颗粒。c、干燥:湿颗粒于55-65℃下通风干燥成为干颗粒。d、整粒:干颗粒经30目筛整粒。e、总混:称取硬脂酸镁及余量羟丙基纤维素,与干颗粒一并置于混合机中混合均匀。中间品检测步骤:检测总混步骤得到的中间品的休止角等参数,若符合标准,则进行下一步。f、压片:混合后的颗粒进行压片。g、包衣:用纯水与欧巴代配成包衣液,涂覆在药片表面并干燥,得1000片成品,每片含纯西他沙星50mg。试验例1:加速稳定性考察将市售西他沙星1.5个结晶水、实施例1西他沙星二水合物晶型在恒温恒湿箱中进行6个月的加速稳定性试验。试验条件是:40℃/75%相对湿度(RH),分别于0、1、2、3、6个月取样,进行纯度和杂质检验(高效液相色谱法),结果见下表1。表1加速实验结果由上表结果可知,西他沙星二水合物晶型的稳定性强于现有技术中西他沙星1.5个结晶水。对本发明实施例2~4所制备的西他沙星二水合物晶型也进行了上述稳定性试验,其获得的结果相似。试验例2:体外溶出度比较对照溶液配制方法:取干燥至恒重的西他沙星对照品适量,精密称定,用溶出介质稀释成每1ml中约5μg的溶液。分别取市售的第一制药三共株式会社(商品名:Gracevit)西他沙星片剂和制剂实施例1制得的西他沙星二水合物片剂,每批6片,以水作为溶出介质,按照上述溶出及测定方法进行试验。分别于5min、10min、15min、30min、45min、60min取溶液适量并补液,滤过,精密量取续滤液适量,加溶出介质水稀释成每1ml中约5μg的溶液,在288nm处测定吸光度,计算溶出度,结果如表2所示。表2溶出度对比结果对比事项5min10min15min30min45min60min市售产品25.146.262.474.283.491.2实施例1产品60.281.990.595.697.898.3由上表结果可以看出,本发明所制备的片剂溶出速率大于市售产品溶出速率。试验例3:生物利用度比较比较了受试制剂(本发明制剂实施例1的西他沙星二水合物片剂组合物)与参比制剂(采用本发明制剂实施例1的处方和制备工艺制得,所不同的是所用的西他沙星为市售原料)的药代动力学。24名男性志愿者多剂量口服50mg西他沙星试验制剂和参比制剂后,西他沙星平均血药浓度-时间曲线见图3。从西他沙星的平均血药浓度-时间曲线可以看出,受试制剂的Cmax优于参比试剂,对本发明制剂实施例2所制备的西他沙星片剂也进行了相同的试验,其获得的结果相似。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1