一种甘蓝型油菜低分子量富含半胱氨酸蛋白及其编码基因的制作方法
本发明属于生物基因工程技术领域,具体涉及一种与油菜遗传学调控相关的低分子量富含半胱氨酸蛋白及其编码基因与应用。
背景技术:
油菜是重要的经济作物。来自油菜的菜籽油是人类最主要的食用油来源之一,是我国粮油安全保障的重要一环,为我国重要的战略物质之一。作为食用油,菜籽油含有人类所需的多种脂肪酸,如营养价值很高的油酸与亚油酸两者含量高达90%以上,且菜籽油在人体中的消化率平均能达99%,为所有植物油中最高者。菜籽油中还含有多种脂溶性维生素,如维生素A、维生素D和维生素E,是人体脂溶性维生素的重要来源。除了作为食用油,菜籽油还是生物柴油的理想原料。
人们对油菜籽油脂合成与积累机制有一定的了解,并运用这些知识在油菜育种与油菜基因工程方面取得了很大的成绩,比如在食用油方面选育出了低芥酸、低硫苷、低亚麻酸油菜品种,通过基因工程培育出了营养价值很高的高油酸品系;在工业用油方面培育出了高月桂酸与高芥酸油菜的培育;大规模生产的油菜籽含油量达到了42%左右。到目前为止尽管在油菜含油量与菜油品质方面取得了很大的成绩,但是油菜生产中还是会遇到一些新问题,比如相同的品种在不同的生态条件下栽培,种子含油量和产油量会发生改变,导致品种的适应性受限;在相同地区栽培,不同的品种对气候条件反应不一致,有的产油量与品质波动很大,有的影响较小;这些现象说明油菜种子中油脂的合成与积累过程中还有很多我们未知分子作用机制,对这些认识上的缺陷,阻碍了人们进一步提高油菜油脂产量与品质的努力。为了满足社会发展对菜籽油的消费需求的不断增加,必须对参与油菜油脂合成与积累的基因类型进行深入研究。
技术实现要素:
低分子量富含半胱氨酸蛋白(low-molecular-weight cysteine-rich protein)基因在植物中是一个非常大的基因家族,在这个基因家族中,功能已知的基因是极少数,目前仅仅知道这个家族中的部分基因产物与抗病原菌相关,所以又命名为抗微生物肽;另一些已知的作用是参与植物花粉与柱头识别。其他大部分基因功能未知。我们在对油菜油脂合成与积累的分子机制进行深入研究的过程中,从甘蓝型油菜中发现一种编码低分子量富含半胱氨酸蛋白的功能未知基因Bna78。本发明通过基因工程的方法,首次发现低分子量富含半胱氨酸蛋白Bna78及其编码基因,该基因可用于提高甘蓝型油菜种子中的含油量。本发明的目的是提供一种来源于甘蓝型油菜的低分子量富含半胱氨酸蛋白及其编码基因与应用。
本发明提供一种甘蓝型油菜低分子量富含半胱氨酸蛋白,所述蛋白来源于甘蓝型油菜,其名称为Bna78,所述蛋白是具有下述氨基酸残基序列之一的蛋白质:
1)如SEQ ID No:1所示的氨基酸序列;
2)将SEQ ID No:1所示的氨基酸残基序列经过一至五个氨基酸残基的取代和/或缺失和/或添加而形成的且对植物的生长发育具有调控作用的蛋白质。
序列表中的SEQ ID No:1由78个氨基酸残基组成。
本发明还提供一种所述的甘蓝型油菜低分子量富含半胱氨酸蛋白的编码基因。
在一种具体的实施方式中,所述基因是下述核苷酸序列之一:
1)如SEQ ID No:2所示的核苷酸序列;
2)编码SEQ ID No:1所示氨基酸序列的DNA序列;
3)与SEQ ID No:2限定的核苷酸序列具有90%以上同源性且与SEQ ID No:2编码相同功能蛋白质的核苷酸序列;
4)在高严谨条件下可与SEQ ID No:2限定的DNA序列杂交的核苷酸序列。
上述高严谨条件为:用0.1×SSPE(或0.1×SSC),0.1%SDS的溶液,在65℃下杂交并洗膜。
序列表中的SEQ ID No:2由237个碱基组成,其编码框为自5’端第1-237位碱基,编码具有序列表中的SEQ ID No:1的氨基酸残基序列的蛋白质。
本发明还提供一种如上所述甘蓝型油菜低分子量富含半胱氨酸蛋白基因的表达载体。
本发明还提供一种如上所述的甘蓝型油菜低分子量富含半胱氨酸蛋白基因的转基因细胞系。
本发明还提供一种如上所述的甘蓝型油菜低分子量富含半胱氨酸蛋白基因的工程菌。
本发明还提供一种扩增如上所述的甘蓝型油菜低分子量富含半胱氨酸蛋白基因中任一片段的引物对。
本发明还提供一种如上所述的甘蓝型油菜低分子量富含半胱氨酸蛋白基因在植物生长发育中的应用。
在一种具体的实施方式中,所述的植物包括单子叶植物和双子叶植物,且所述基因用于调控植物种子含油量;优选所述植物为油菜。在一种具体的实施方式中,所述的植物为甘蓝型油菜。
在一种具体的实施方式中,将所述甘蓝型油菜低分子量富含半胱氨酸蛋白基因的沉默表达载体转化油菜,得到高含油量的油菜材料。
上述重组表达载体均可按照常规方法构建。
本发明的油菜低分子量富含半胱氨酸蛋白基因的沉默表达转基因植株种子含油量提高。本发明为油菜含油量的提高提供了一个目标基因。本发明的蛋白质及其编码基因具有较高的实际应用价值,应用前景广阔。
附图说明
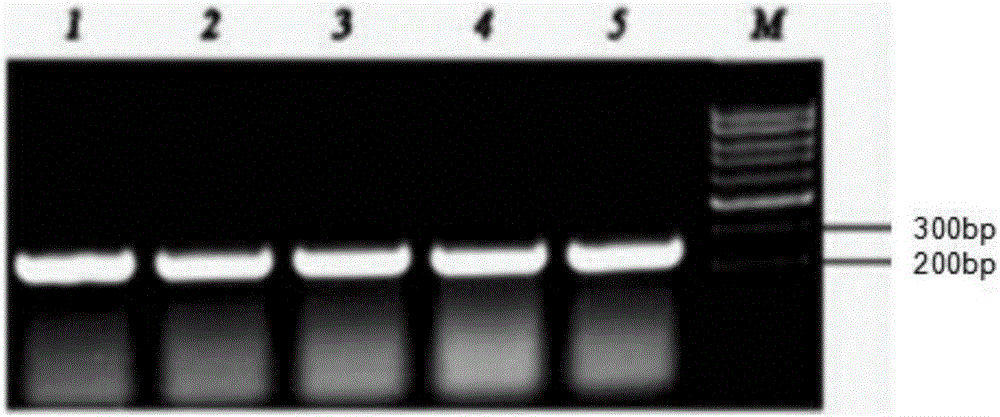
图1油菜低分子量富含半胱氨酸蛋白Bna78基因全长CDS(蛋白质编码区)的PCR扩增产物电泳结果。
图2 Bna78基因的过表达质粒构建的菌落PCR验证,结果与预期的片段大小一致。
图3 Bna78基因的过表达质粒构建酶切验证,结果与预期的片段大小一致。
图4 Bna78基因沉默质粒构建的片段PCR扩增产物电泳结果,结果与预期的片段大小一致。
图5 Bna78基因沉默质粒构建中干扰片段正向插入的PCR检测,结果与预期的片段大小一致。
图6 Bna78基因沉默质粒构建中干扰片段反向插入的PCR检测,结果与预期的片段大小一致。
图7正反向干扰片段插入后,Bna78基因沉默质粒的限制性内切酶酶切验证,结果与预期的片段大小一致。
图8转pFGC5941-Napin-Bna78CDS质粒的抗性苗PCR检测结果。图中M为100bp plus Ladder DNA;1-10为抗性苗,其中2-8为过表达转基因植株;+为阳性对照;-为阴性对照;WT为空白对照。
图9转pFGC5941-Napin-Bna78RNAi质粒的抗性苗PCR检测结果。图中M为100bp plus Ladder DNA;1-8为抗性苗,其中3为过表达转基因植株;+为阳性对照;-为阴性对照;WT为空白对照。
图10薄层层析分析检测种子含油量变化。1为Bna78基因过表达转基因植株种子;2为湘油15号对照;3为Bna78基因沉默转基因植株种子。
图11气相色谱法分析种子含油量变化。1为Bna78基因沉默转基因植株种子;2为湘油15号对照;3为Bna78基因过表达转基因植株种子。
具体实施方式
下述实施例中的方法,如无特别说明,均为常规方法。所用引物和测序工作由上海生工生物科技有限公司完成。
序列表中的SEQ ID No.1为Bna78基因对应的氨基酸序列,SEQ ID No.2为Bna78基因的全长编码序列,最后的TGA三个碱基为其终止密码子,对应SEQ ID No.1蛋白质序列中的最后一点“.”。
实施例1
甘蓝型油菜低分子量富含半胱氨酸蛋白基因Bna78全长CDS的获得与过表达载体的构建。
一、Bna78基因全长CDS的获得
分别从甘蓝型油菜“湘油15号”开花后生长20天(淀粉积累期)和35天(油脂积累期)的种子中分离mRNA,分别构建cDNA文库;以开花后35天的油菜种子cDNA文库为检测子(tester)、开花后20天的油菜种子cDNA文库为驱动子(driver),构建种子中油脂合成期特异表达基因的抑制性消减杂交(suppression subtractive hybridization,SSH)文库。送上海生工生物公司测序后,在273条测序结果中,编号为T350078的EST,经过NCBI数据库进行Blastx比对,确定其为低分子量富含半胱氨酸基因家族中的一员。将T350078的EST序列在Genoscope数据库中进行Blast,查找到该基因全长与其cDNA全长序列,并将这一基因命名为Bna78。
根据Bna78基因的CDS全长序列,在其5’和3’末端序列设计一对引物,引物序列分别为:5’-ATGGCgAAgCTATCATGTTC-3’(SEQ ID No:3),和5’-TCAACAATTCCAATTATAAGTACAAAG-3’(SEQ ID No:4)。以甘蓝型油菜(Brassica napus L.)开花后35天的种子为材料,用Trizol(Invitrogen)方法提取总RNA,以总RNA为模板,用AMV反转录酶(Invitrogen)合成cDNA(依据RevertAid First strand cDNA Synthesis Kit的用户手册进行)。以cDNA为模板,高保真PCR扩增低分子量富含半胱氨酸蛋白基因Bna78的全长CDS序列。50μl PCR反应体系包含:模板2μl,高保真酶Phusion High-fidelity DNA Polymerase(Invitrogen)1μl,10×缓冲液5μl,2.5uM dNTP 8μl,20μM的5'和3’引物各1μl,水32μl。反应条件为:94℃预变性2分钟;94℃变性30秒,57℃退火30秒,68℃延伸1分钟,共30个循环。反应结束后,将PCR产物进行1.5%琼脂糖凝胶电泳检测(图1),回收并纯化200bp左右的扩增片段,将其克隆到载体pEASY-Blunt Cloning(TaKaRa)中,得到含有回收片段的重组质粒pEASY-Bna78CDS,经测序表明低分子量富含半胱氨酸蛋白基因Bna78全长CDS具有序列表中的SEQ ID No:2的核苷酸序列,序列表中的SEQ ID No:2由237个碱基组成,编码具有序列表中的SEQ ID No:1的氨基酸残基序列的蛋白质,为78个氨基酸残基,编码的蛋白命名为Bna78。
二、Bna78基因过表达质粒构建
选择测序正确的pEASY-Bna78cDNA重组质粒,与pFGC5941-Napin质粒分别同时用Fast Digest Enzyme NcoI和XbaI(Fermetans)对两种质粒进行双酶切,酶切温度37℃,酶切时间为30-40min,反应体系40μL;酶切产物经过1.5%琼脂糖凝胶电泳分离后,切下目的条带,用胶回收试剂盒纯化回收,将回收的两个目标DNA片段通过T4连接酶连接,连接产物通过热激法转化大肠杆菌(Esherichia coli)DH5α,转化细胞在液体LB培养基中,37℃、200rpm的条件下复苏1h;将经恢复培养的细胞均匀涂于含卡那霉素(50μg/mL)的LB固体培养皿上,37℃培养16h。挑取LB固体培养基上的单菌落,以NAPIN703F:5'-AACTCATCCGCTTCACTCTTTACTCAT-3'(SEQ ID No.5)和Bna78CDSR:5'-GCTCTAGAACAATTCCAATTATAAGTACAAAG-3'(SEQ ID No.6)引物对进行菌落PCR鉴定(图2),检测结果与预期的一致。选择PCR检测正确的单菌落扩大培养,提取质粒,以Fast Digest Enzyme NcoI和XbaI进行双酶切验证,结果如图3所示,检测结果与预期的片段大小一致。PCR鉴定和双酶切鉴定两种结果都说明过表达质粒pFGC5941-Napin-Bna78CDS构建成功。质粒转到农杆菌菌株LBA4404中用于油菜的转化。
实施例2
用于Bna78基因沉默质粒构建干扰片段的克隆与RNA干扰质粒构建。
一、用于Bna78基因沉默质粒构建干扰片段的克隆
以甘蓝型油菜(Brassica napus L.)开花后35天的种子为材料,提取RNA,并反转录成cDNA作为模板,根据SEQ ID No.2的序列分别设计Bna78基因的干扰片段PCR扩增引物对(引物序列如下),高保真PCR扩增目标序列。
干扰片段序列扩增引物:
上游引物:5'-TTAATTAACCATGGACTGTGTGTATGTATGGGCT-3'(SEQ ID No.7);下划线为引入PacI和Nco1酶切位点。
下游引物:5'-TCTAGAGGCGCGCCCAGTTTTCATCATCTTCTCCTTC-3'(SEQ ID No.8);下划线为引入XbaI和Asc1酶切位点。
设计的PCR扩增片段大小为129bp。对扩增产物进行琼脂糖凝胶电泳检测,片段大小与设计的大小一致(图4);切下目的条带纯化回收,将回收的DNA片段连接到pEASY-Blunt Cloning载体上,得到pEASY-Bna78RNAi中间质粒,转化大肠杆菌DH5α感受态细胞,经抗生素筛选获得抗性菌落,对抗性菌落进行菌落PCR与质粒酶切电泳分析后,再将正确的单克隆测序,干扰片段克隆的插入片段为129bp。通过序列比对,这两个克隆片段与公布的甘蓝型油菜基因组(http://www.genoscope.cns.fr/brassicanapus/)中对应序列的一致性都为100%,目标DNA片段克隆成功。
二、Bna78基因沉默质粒的构建
选择测序正确的pEASY-Bna78RNAi重组质粒,与pFGC5941-Napin质粒分别同时用Fast Digest Enzyme NcoI和AscI对两种质粒酶切,酶切温度37℃,酶切时间为30-40min,反应体系40μL;酶切产物经过琼脂糖凝胶电泳分离后,切下目的条带,用胶回收试剂盒纯化回收,将回收的两个目标DNA片段通过T4连接酶连接,连接产物通过热激法转化大肠杆菌DH5α,转化细胞在液体LB培养基中,37℃、200rpm的条件下复苏1h;将经恢复培养的细胞均匀涂于含卡那霉素(50μg/mL)的LB固体培养皿上,37℃培养16h。挑取LB固体培养基上的单菌落,以NAPIN703F(SEQ ID No.5)与IntroR825:TGACTCCATCTTATTCCCTCCGTTTC(SEQ ID No.9)引物对进行菌落PCR鉴定,没有片段插入式扩增产物约为820bp左右(载体,vector),如果有129bp片段插入,PCR产物片段约为900bp左右,实际检测结果与预期的片段大小一致(图5),说明Bna78基因干扰质粒构建过程中,干扰片段正向插入到CHSA内含子5’端的多克隆位点。
选择带有片段正向插入正确的单菌落,扩大培养,提取质粒,以Fast Digest Enzyme BamHI和XbaI进行质粒双酶切,酶切产物经过琼脂糖凝胶电泳分离后,切下目的条带,用胶回收试剂盒纯化回收,将回收的两个目标DNA片段通过T4连接酶连接,连接产物通过热激法转化大肠杆菌DH5α,转化细胞在液体LB培养基中,37℃、200rpm的条件下复苏1h;将经恢复培养的细胞均匀涂于含卡那霉素(50μg/mL)的LB固体培养皿上,37℃培养16h。挑取LB固体培养基上的单菌落,以Intron-B:5'-CACTCCAAAGAAAGAGAAACTGACA-3’(SEQ ID No.10)和PolyAR:5'-CTCAGGTTTTTTACAACGTGCACAA-3’(SEQ ID No.11)引物对进行菌落PCR鉴定,没有片段插入式扩增产物约为400bp左右(载体,vector),如果有129bp片段插入,PCR产物片段约为500bp左右,实际检测结果与预期的片段大小一致(图6),说明Bna78基因干扰质粒构建过程中,干扰片段反向插入到CHSA内含子3’端的多克隆位点。正反向干扰片段插入的干扰质粒进一步进行BamHI与XbaI单酶切验证,BamHI酶切后的目标片段比XbaI单酶切的目标片段相差250bp,电泳检测结果说明两个目标片段与预期的片段大小一致(图7)。根据PCR检查和酶切检测两方面的结果,说明用于Bna78基因表达沉默的干扰质粒pFGC5941-Napin-Bna78RNAi构建成功。将构建成功的这个质粒转化到农杆菌菌株LBA4404中,用于甘蓝型油菜的转化。
实施例3
甘蓝型油菜转化及分子鉴定与转基因油菜种子含油量分析
一、甘蓝型油菜转化及分子鉴定
一)外植体的准备
选取甘蓝型油菜品种“湘油15号”完整饱满的种子约100颗,置于150mL三角瓶中。向装有种子的三角瓶中加入20-30mL 75%乙醇。振荡消毒30s,弃去酒精,再加入20mL 0.1%HgCl2和1滴TWEEN-20的消毒液,剧烈摇晃至起泡,静置20min。弃去消毒液,用无菌水反复冲洗3-5遍以洗净泡沫。)加入50mL经高温灭菌的无菌水浸泡种子,浸泡时间为1h。倒掉无菌水,把种子均匀铺在两瓶种子萌发培养基上,22℃暗培养4-5d。待油菜幼苗长到4-5cm后将其转移到光照条件下生长6-8h,使幼苗子叶转绿,子叶柄作为转化的外植体。
二)农杆菌的准备
幼苗生长到1-2cm时,开始准备菌液。将分别带有pFGC5941-Napin-Bna78CDS和pFGC5941-Napin-Bna78RNAi质粒的农杆菌LBA4404菌株在含卡那霉素(50mg/mL)、链霉素(50mg/mL)和利福平(100mg/mL)的YEB固体培养基上划线,28℃的恒温培养箱中培养3d。挑取单菌落于10mL含有相同浓度的三种抗生素的YEB液体培养基中,28℃、200rpm扩大培养16-18h。吸取1mL菌液加入到50mL含有相同浓度抗生素的YEB液体培养基中,扩大培养至菌液OD600达到0.4-0.8。
三)子叶柄的农杆菌转化与抗性苗筛选
将油菜幼苗子叶柄从生长点以上的分支处切下,转移到BM液中。将扩大后的农杆菌菌液从三角瓶转移至50mL离心管,6000rpm离心10min,倒掉上清。向离心管中加入25mL BM液,振荡使农杆菌重悬;再加入10μLβ-巯基乙醇和20μL乙酰丁香酮,摇匀后将工作液倒入已灭菌的平皿中。将切好的子叶柄转到工作液中浸泡10min。浸泡后,将子叶柄转移到已灭菌的吸水纸上。用镊子翻动子叶柄使子叶柄表面残留工作液被吸水纸吸干。最后将子叶柄均匀铺放在共培培养基上,22℃,暗培养36h。共培完成后,将外植体转移到MB筛选培养基中。22℃,长日照培养;每10-14d更换MB筛选培养基。
当外植体分化出若干簇抗性不定芽后,将不定芽切开分离后放入生根筛选培养基上继续培养。分化苗长出足够的根系后,将其从生根培养基中取出,并用无菌水将根上残留的培养基清洗干净。然后将分化苗移入蛭石中,炼苗10天。炼苗之后转入土壤中,Bna78基因过表达抗性苗获得10株,Bna78基因沉默植株8株。抗性苗用于下一步PCR转基因检测鉴定。
四)抗性苗转基因鉴定
用CTAB方法从抗性苗叶组织中提取总DNA,以总DNA作为模板,转pFGC5941-Napin-Bna88CDS质粒的抗性苗用NAPIN703F(SEQ ID No.5)和Bna78CDSR(SEQ ID No.6)引物对进行PCR检测,检测结果显示与质粒为阳性对照扩增片段大小一致的有7株,说明总共获得了7株Bna78基因过表达转基因植株(图8中的2~8号)。转pFGC5941-Napin-Bna88RNAi质粒的抗性苗用NAPIN703F(SEQ ID No.5)和INTRON703R:5’-TGACTCCATCTTATTCCCTCCGTTTC-3’(SEQ ID No.12)引物对进行PCR检测,检测结果显示与质粒为阳性对照扩增片段大小一致的有1株,说明总共获得了1株Bna78基因表达沉默的转基因植株(图9中的3号)。
二、转基因油菜种子的含油量测定
一)种子油脂提取
收集Bna78基因过表达与沉默转基因植株的种子,以及对照湘油15号的种子,各称取样品0.8g,放入研钵内,液氮速冻并快速研磨,反复操作2-3次至样品成粉末状;将样品粉末转移到1.5mL离心管中再次称重,保证各个样品重量一致;将样品放到波-伊匀浆器中,加入3.75mL甲醇:氯仿=2:1的混合液,反复抽提研磨。将研磨后的匀浆转移至10mL玻璃管中,并用1.25mL氯仿清洗匀浆器,并将洗液转移至玻璃管中。向玻璃管中先后加入1mL 0.15M醋酸和1.25mL无菌水,漩涡振荡30s使溶液充分混合,于3000rpm离心分离5min。将氯仿相(为绿色下层液,约2.5mL)转移至新的玻璃管中,即为含种子油脂的样品。
二)种子含油的薄层层析法(thin layer chromatography,TLC)检测
向层析缸中加入100mL层析液:正己烷(Hexane):乙醚(diethyl ethyl ether,DEE):醋酸=70:30:1。取5-10μL提取的种子油脂样品用移液枪点在标记好的硅胶层析板上。将层析版放入层析缸中,层析1-2h后将层析板取出,均匀喷洒20%磷钼酸溶液,并放入120℃烘箱中10-15min进行显色,冷却后观察斑点颜色深浅和斑点面积大小。结果显示Bna78基因沉默的种子含油量高于对照湘油15号,而湘油15号的含油量高于Bna78基因过表达转基因植株种子含油量(图10)。
三)种子含油量的气相色谱法(GC)检测
向装有1mL种子油脂样品的玻璃管中加入1mL 0.4M氢氧化钾-甲醇溶液,漩涡振荡混匀。再加入2mL石油醚:乙醚=1:1的混合液,混匀后室温静置4h以上,完成样品油脂的甲酯化。甲酯化结束后,向玻璃管中加入10mL无菌水,1000rpm离心1min,使混合液分层。取1-2μL上层含有脂肪酸甲酯的液体进行气相色谱测定。结果显示Bna78基因沉默的种子含油量高于对照湘油15号,而湘油15号的含油量高于Bna78基因过表达转基因植株种子含油量(图11)。TLC与GC两种方式测定结果都一致证实:Bna78基因具有改变种子含油量的功能。
在实际育种过程中,可通过转基因的方法使得Bna78基因沉默或敲除,例如可以通过RNAi技术使得Bna78基因沉默,也可以通过定向敲除的方法去掉该Bna78基因。或使用其它物理化学诱变方法(如射线或化学诱变)使得Bna78基因突变。以对照组基因的表达量为100%时,沉默的Bna78基因一般是指其表达量下降一倍或以上的情况,而过表达的Bna78基因一般是指其表达量为对照组的两倍或以上。
以上所述仅为本发明的优选实施例而已,并不用于限制本发明。对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
<110> 湖南农业大学
<120> 一种甘蓝型油菜低分子量富含半胱氨酸蛋白及其编码基因
<130> Q16F0930
<160> 12
<170> PatentIn version 3.2
<210> SEQ ID No:1
<211> 78
<212> 氨基酸
<400> 1
氨基酸序列:
MAKLSCSYFLILMFVFSVVLVAEGEDDENCIVFMDPKNPCNIVDCRQNCYEGYNGVGKCVKDVKAGGDTCLCT
YNWNC.
<210> SEQ ID No:2
<211> 237
<212> DNA
<400> 2
核苷酸序列:
ATGGCAAAACTATCATGTTCTTATTTCCTCATACTCATGTTTGTGTTCTCAGTGGTTCTAGTAGCTGAAGGAG
AAGATGATGAAAACTGTATTGTATTTATGGATCCAAAAAATCCATGTAATATTGTTGATTGTCGTCAAAACTG
CTATGAGGGATACAATGGAGTTGGAAAATGTGTTAAAGATGTTAAAGCTGGTGGAGATACTTGTCTTTGTACT
TATAATTGGAATTGTTGA;
<210> SEQ ID No.3
<211> 20
<212> DNA
<400> 3
5’-ATGGCgAAgCTATCATGTTC-3’;
<210> SEQ ID No.4
<211> 26
<212> DNA
<400> 4
5’-TCAACAATTCCAATTATAAGTACAAAG-3’;
<210> SEQ ID No.5
<211> 27
<212> DNA
<400> 5
NAPIN703F:5'-AACTCATCCGCTTCACTCTTTACTCAT-3';
<210> SEQ ID No.6
<211> 32
<212> DNA
<400> 6
Bna78CDSR:5'-GCTCTAGAACAATTCCAATTATAAGTACAAAG-3';
<210> SEQ ID No.7
<211> 34
<212> DNA
<400> 7
5'- TTAATTAACCATGGACTGTGTGTATGTATGGGCT-3';
<210> SEQ ID No.8
<211> 36
<212> DNA
<400> 8
5'-TCTAGAGGCGCGCCCAGTTTTCATCATCTTCTCCTTC-3';
<210> SEQ ID No.9
<211> 26
<212> DNA
<400> 9
IntroR825:TGACTCCATCTTATTCCCTCCGTTTC;
<210> SEQ ID No.10
<211> 25
<212> DNA
<400> 10
Intron-B:5'-CACTCCAAAGAAAGAGAAACTGACA-3’;
<210> SEQ ID No.11
<211> 25
<212> DNA
<400> 11
PolyAR:5'-CTCAGGTTTTTTACAACGTGCACAA-3’;
<210> SEQ ID No.12
<211> 26
<212> DNA
<400> 12
INTRON703R:5’-TGACTCCATCTTATTCCCTCCGTTTC-3’;
- 还没有人留言评论。精彩留言会获得点赞!