辅酶的制造方法以及辅酶制造用转化体组与流程
本发明涉及一种在需要nad+或nadh的酶反应体系中由nad+的分解产物合成nad+或nadh的方法以及在该方法中使用的用于制造nad+或nadh的转化体组。
本申请基于2015年2月24日向日本提出的日本特愿2015-33843号而主张优先权,并将其内容援用至此。
背景技术:
随着近年的基因改造技术的发展,采用微生物作为合成反应的反应体系,利用微生物具有的代谢路线制造有益的有机化合物的方法也逐渐被用于工业上的批量生产中。进一步地,为了更高效地合成有机化合物,不仅尝试改变活体微生物的代谢路线,而且也正在尝试通过将多种代谢酶预先模块化,并任意组合这些模块来人工构建在物质生产上特定化的合成路线(人工代谢系统)。据报道,通过利用人工代谢系统的方法,能够由例如葡萄糖、甘油以高回收率有选择性地生产乳酸、苹果酸、1-丁醇等(例如,参照非专利文献1。)。
通过使在微生物中导入编码该代谢酶的基因而成的转化体生产代谢酶,从而能廉价且简单地提供模块化而使用的代谢酶(酶模块)。其中,作为酶模块,优选使用耐热性酶,因为其具有优异的物理及化学的稳定性,适合在工业上利用。作为通过微生物生产耐热性酶的方法,例如,公开了以下方法:对在非耐热性的抗酸菌中导入了编码目的耐热性酶的基因而成的转化体进行培养,使该转化体内产生耐热性酶后,对培养的菌体物进行加热处理,从而得到被固定化于转化体的灭活菌体内的耐热性酶(例如,参照专利文献1。)。在该方法中,因为源自作为宿主的抗酸菌的蛋白质完全失活,而且仅目的耐热性酶在保持活性的状态下被固定化于转化体的灭活菌体内,所以具有的优势是即使将该灭活菌体直接添加于反应体系时,也不会产生因源自宿主的酶而引起的副反应。
现有技术文献
专利文献
专利文献1:日本特开2011-160778号公报;
非专利文献
非专利文献1:krutsakorn,etal.,metabolicengineering,2013,vol.20,p.84~91.
技术实现要素:
发明所要解决的问题
通过利用了人工代谢系统的方法,能够利用酶反应的优势、也即底物特异性、合成物立体选择性优异并且在比较温和的条件下能够合成目的有机化合物,从而能够高效地制造难以在有机合成中制造的有机化合物。但是,该方法缺乏长时间反应时的稳定性,结果得到的目的有机化合物量尚未达到工业批量生产的水平。其原因不是使用的酶模块的稳定性的问题,而起因于在酶反应中必需的辅酶、特别是作为氧化还原辅酶的nad+、nadh的热分解。为了长时间稳定地合成目的有机化合物,需要从反应体系外适当地补充因热分解而減少的nad+或nadh。nad+等比较昂贵,其成为利用人工代谢系统的方法在工业上的利用无法推进的一个因素。
本发明的主要目的是,针对需要nad+或nadh的酶反应体系,提供一种在该酶反应体系内合成nad+或nadh的方法,以及在该方法中使用的用于制造nad+或nadh的转化体组,用于补充因热分解而丧失的nad+或nadh。
解决问题的技术方案
本发明人等潜心研究,结果发现,通过构建用于由作为nad+的热分解产物的烟酰胺补救合成nad+的人工代谢路线(nad+人工合成路线)以及用于由烟酰胺补救合成nadh的人工代谢路线(nadh人工合成路线),针对需要nad+或nadh的酶反应体系不直接外部添加nad+或nadh,而是添加nad+人工合成路线或nadh人工合成路线所需的代谢酶,从而在该酶反应体系内合成nad+或nadh,由此,能够更廉价地补充因热分解而丧失的nad+或nadh,从而完成了本发明。
即,本发明的辅酶的制造方法以及辅酶制造用转化体组是下述[1]~[18]。
[1]一种辅酶的制造方法,其特征在于,通过在需要nad+的酶反应体系中添加用于由adp-核糖与烟酰胺合成nad+的反应所需的一种或两种以上的耐热性酶,从而在前述酶反应体系内进行nad+的合成。
[2]根据前述[1]的辅酶的制造方法,其中,用于前述合成nad+的反应所需的耐热性酶是烟酰胺酶、烟酸磷酸核糖基转移酶、烟酸-核苷酸腺苷酰基转移酶、nad+合酶、adp-核糖焦磷酸酶以及核糖磷酸焦磷酸激酶。
[3]一种辅酶的制造方法,其特征在于,通过在需要nadh的酶反应体系中添加用于由adp-核糖与烟酰胺合成nadh的反应所需的一种或两种以上的耐热性酶,从而在前述酶反应体系内进行nadh的合成。
[4]根据前述[3]的辅酶的制造方法,其中,用于前述合成nadh的反应所需的耐热性酶是烟酰胺酶、烟酸磷酸核糖基转移酶、烟酸-核苷酸腺苷酰基转移酶、nad+合酶、adp-核糖焦磷酸酶、核糖磷酸焦磷酸激酶以及对由nad+合成nadh的反应进行催化的氧化还原酶。
[5]根据前述[4]的辅酶的制造方法,其中,前述氧化还原酶是以糖、乙醇或有机酸为底物的脱氢酶。
[6]根据前述[1]~[5]中任一项的辅酶的制造方法,其中,在前述酶反应体系内进一步添加用于由amp或adp合成atp的反应所需的一种或两种以上的耐热性酶,在前述酶反应体系内进行atp的合成。
[7]根据前述[6]的辅酶的制造方法,其中,用于前述合成atp的反应所需的耐热性酶是腺苷酸激酶和多聚磷酸激酶。
[8]根据前述[1]~[7]中任一项的辅酶的制造方法,其中,前述耐热性酶是通过非耐热性微生物的表达体系合成的。
[9]根据前述[1]~[8]中任一项的辅酶的制造方法,其中,前述耐热性酶由转化体合成,所述转化体以非耐热性微生物为宿主,并导入了对耐热性酶进行编码的基因。
[10]根据前述[9]的辅酶的制造方法,其中,将对前述转化体进行培养而得到的菌体的加热处理物添加至前述酶反应体系。
[11]根据前述[8]~[10]中任一项的辅酶的制造方法,其中,前述非耐热性微生物是大肠杆菌。
[12]一种辅酶制造用转化体组,其特征在于,其由一种或两种以上的转化体组成,所述转化体以非耐热性微生物为宿主,并且导入了对用于由adp-核糖与烟酰胺合成nad+或nadh的反应所需的一种或两种以上的耐热性酶进行编码的基因。
[13]根据前述[12]的辅酶制造用转化体组,其中,前述耐热性酶是烟酰胺酶、烟酸磷酸核糖基转移酶、烟酸-核苷酸腺苷酰基转移酶、nad+合酶、adp-核糖焦磷酸酶以及核糖磷酸焦磷酸激酶。
[14]根据前述[12]的辅酶制造用转化体组,其中,前述耐热性酶是烟酰胺酶、烟酸磷酸核糖基转移酶、烟酸-核苷酸腺苷酰基转移酶、nad+合酶、adp-核糖焦磷酸酶、核糖磷酸焦磷酸激酶以及对由nad+合成nadh的反应进行催化的氧化还原酶。
[15]根据前述[12]~[14]中任一项的辅酶制造用转化体组,其中,还含有一种或两种以上的转化体,所述转化体以非耐热性微生物为宿主,并且导入了对用于由amp或adp合成atp的反应所需的一种或两种以上的耐热性酶进行编码的基因。
[16]根据前述[12]~[15]中任一项的辅酶制造用转化体组,其中,在一个转化体中导入对一种耐热性酶进行编码的基因。
[17]根据前述[12]~[16]中任一项的辅酶制造用转化体组,其中,前述非耐热性微生物是大肠杆菌。
[18]根据前述[12]~[17]中任一项的辅酶制造用转化体组,其中,前述转化体经过了加热处理。
发明效果
根据本发明的辅酶的制造方法,在利用酶的酶反应体系中,即使在酶反应开始后不外部添加昂贵的nad+或nadh,也能够长时间稳定地进行目的酶反应,所述酶以容易因热分解而丧失的nad+或nadh作为必需的辅酶。
另外,根据本发明的辅酶制造用转化体组,能够更简便地实施前述辅酶的制造方法。
附图说明
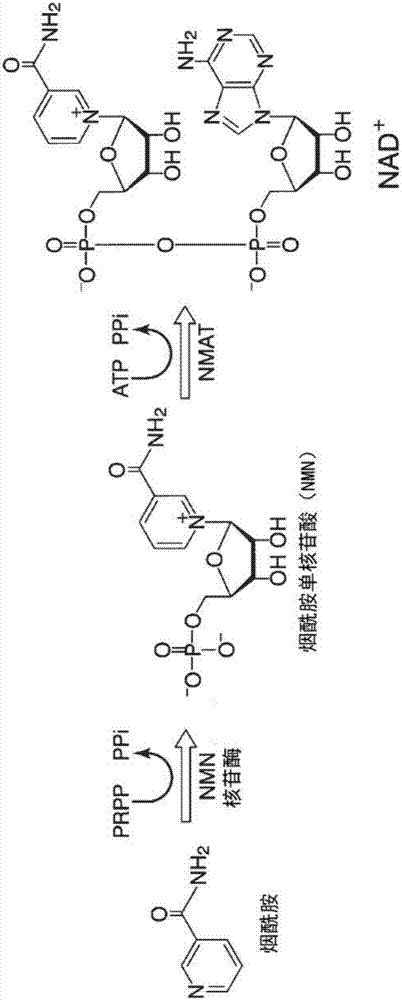
图1是表示以adp-核糖和烟酰胺为起始原料的nad+补救合成路线的一种方式的图。
图2是表示以烟酰胺为起始原料的nad+补救合成路线的一种方式的图。
图3表示atp合成路线的一种方式的图。
图4是表示在参考例1中nad+的热分解反应的图。
图5是表示在参考例1中nad+的热分解反应中的nad+、烟酰胺和adp-核糖随时间推移的变化的图。
图6是表示在实施例1中在横轴表示的浓度的nad+的存在下的ttnaprt活性值(以不含nad+的反应液中的活性为100%时的相对活性值)的图。
图7是表示在实施例1中将含有nad+补救合成路线以及atp合成路线所需的耐热性酶群和nad+的反应液在60℃条件下孵育时,反应液中的nad+浓度随时间推移的变化的图。
图8是表示在实施例2中将含有nad+补救合成路线以及atp合成路线所需的耐热性酶群和nad+的反应液在60℃条件下孵育时,反应液中的nad+浓度随时间推移的变化的图。
图9是表示在实施例3中将含有nadh补救合成路线以及atp合成路线所需的耐热性酶群和nadh的反应液在60℃条件下孵育时,反应液中的nadh浓度随时间推移的变化图。
具体实施方式
本发明的辅酶的制造方法的特征在于,通过在需要nad+或nadh的酶反应体系中添加用于由烟酰胺合成nad+或nadh的反应所需的一种或两种以上的耐热性酶,从而在前述酶反应体系内进行nad+或nadh的补救合成。本发明的辅酶的制造方法还可以用于需要nad+和nadh两者的酶反应体系。在本发明的辅酶的制造方法当中,将在需要nad+的酶反应体系中,添加用于合成nad+的反应所需的一种或两种以上的耐热性酶来进行nad+的补救合成的方法,称为“nad+的制造方法”。在本发明的辅酶的制造方法当中,将在需要nadh的酶反应体系中,添加用于合成nadh的反应所需的一种或两种以上的耐热性酶来进行nadh的补救合成的方法,称为“nadh的制造方法”。在需要nad+或nadh的酶反应体系内,通过由作为nad+或nadh的热分解物的烟酰胺合成nad+或nadh,即使不直接外部添加nad+或nadh,也能够补充因热分解而丧失的nad+或nadh,从而能够长时间稳定地合成作为该酶反应体系的目的产物的有机化合物。
在本发明的nad+的制造方法中,“需要nad+的酶反应体系”是指细胞外的反应体系(所谓的invitro的反应体系),并且该反应体系包含基于以nad+为辅酶的酶的酶反应。该酶反应体系既可以是仅由一个阶段的酶反应构成的反应体系,也可以是由两个阶段以上的酶反应构成的反应体系。在由两阶段以上的酶反应构成的酶反应体系的情况下,只要至少有一个阶段是基于以nad+为辅酶的酶的酶反应即可。另外,对以nad+为辅酶的酶没有特别的限定,能够基于目的有机化合物以及反应路线适当确定。
在本发明的nadh的制造方法中,“需要nadh的酶反应体系”是指细胞外的反应体系(所谓的invitro的反应体系)并且该反应体系包含基于以nadh为辅酶的酶的酶反应。该酶反应体系既可以是仅由一个阶段的酶反应构成的反应体系,也可以是由两个阶段以上的酶反应构成的反应体系。在由两阶段以上的酶反应构成的酶反应体系的情况,只要至少有一个阶段是基于以nadh为辅酶的酶的酶反应即可。另外,对以nadh为辅酶的酶没有特别的限定,能够基于目的有机化合物以及反应路线适当确定。
在本发明的辅酶的制造方法中,作为需要nad+或nadh的酶反应体系,优选为在中性~碱性的环境下进行的反应体系,更优选为在ph为7.6~9.0的弱碱性环境下进行的反应体系,进一步优选为在ph为7.8~8.5的弱碱性环境下进行的反应体系。这是因为,当反应体系的ph为中性~碱性时,nad+、nadh热分解的主要产物是烟酰胺和adp-核糖,通过本发明的辅酶的制造方法能够更高效地重新合成nad+和nadh。
此外,对于需要nad+或nadh的酶反应体系合成的目的有机化合物,没有特别的限定,优选为如乳酸、苹果酸、n-丁醇等的作为化学合成品、医药品、化妆品、食品等的原材料有用的有机化合物。
在本发明的nad+的制造方法中,“用于由烟酰胺合成nad+的反应”是指通过以烟酰胺为底物的一个阶段或两个阶段以上的酶反应,最终合成nad+的酶反应。以下将该反应称为“nad+补救合成路线”。nad+补救合成路线既可以是任意的生物固有的天然的代谢路线,也可以是适当改变该天然代谢路线而成的合成路线,还可以是人工合成的代谢路线。
作为nad+补救合成路线,具体可举出例如:如图1所示,以adp-核糖和烟酰胺作为起始原料,使用烟酰胺酶(naase)、烟酸磷酸核糖基转移酶(naprt)、烟酸-核苷酸腺苷酰基转移酶(nmat)、nad+合酶(nads)、adp-核糖焦磷酸酶(adprp)以及核糖磷酸焦磷酸激酶(rpk)的路线。以adp-核糖为底物,在adp-核糖焦磷酸酶的作用下合成核糖-5-磷酸,以核糖-5-磷酸为底物,在核糖磷酸焦磷酸激酶的作用下合成磷酸核糖焦磷酸(prpp)。与之独立地,以烟酰胺为底物,在烟酰胺酶的作用下合成烟酸。以烟酸和磷酸核糖焦磷酸为底物,在烟酸磷酸核糖基转移酶的作用下合成烟酸单核苷酸(namn),由烟酸单核苷酸和atp在烟酸-核苷酸腺苷酰基转移酶的作用下合成脱酰胺nad+。以该脱酰胺nad+为底物,在nad+合酶的作用下合成nad+。
作为nad+补救合成路线,还可举出例如:如图2所示,以烟酰胺为起始原料,用nmn核苷酶和烟酸-核苷酸腺苷酰基转移酶的路线。由烟酰胺和磷酸核糖焦磷酸(prpp)等磷酸化核糖给予体在nmn核苷酶的作用下合成烟酰胺单核苷酸(nmn),以烟酰胺单核苷酸为底物,在烟酸-核苷酸腺苷酰基转移酶的作用下合成nad+。
在本发明的nadh的制造方法中,“用于由烟酰胺合成nadh的反应”,是指通过以烟酰胺为底物的一个阶段或两个阶段以上的酶反应,最终合成nadh的酶反应。以下也将该反应称作“nadh补救合成路线”。nadh补救合成路线既可以是任意的生物固有的天然的代谢路线,也可以是适当改变该天然代谢路线而成的合成路线,还可以是人工合成的代谢路线。
在热分解作用下,nadh首先分解成nad+,然后,直至分解成adp-核糖和烟酰胺为止。因此,nadh补救合成路线优选为由adp-核糖和烟酰胺合成nadh的反应路线。例如,能够将在前述nad+补救合成路线中附加了对由nad+合成nadh的反应进行催化的氧化还原酶后的路线,作为nadh补救合成路线。
由nad+合成nadh的反应能够通过以nad+为辅酶的各种氧化反应来进行。对于以nad+为辅酶的氧化反应的底物、氧化还原酶,没有特别的限定。作为本发明所使用的对由nad+合成nadh的反应进行催化的氧化还原酶,例如可以使用以糖、乙醇或有机酸为底物的脱氢酶。作为以糖为底物的脱氢酶,可举出:葡萄糖脱氢酶(ec.1.1.1.47)、葡萄糖-6-磷酸脱氢酶(ec.1.1.1.49)、半乳糖-1-脱氢酶(ec.1.1.1.48)、l-阿拉伯糖-1-脱氢酶(ec.1.1.1.46)、d-木糖-1-脱氢酶(ec.1.1.1.175)、葡萄糖醛酸还原酶(ec.1.1.1.19)等。作为以乙醇为底物的脱氢酶可举出:乙醇脱氢酶(ec.1.1.1.1)、甘油脱氢酶(ec.1.1.1.6)、甘油-3-磷酸脱氢酶(nad+)(ec.1.1.1.8)、甘露醇-1-磷酸-5-脱氢酶(ec.1.1.1.17)、肌醇-2-脱氢酶(ec.1.1.1.18)、甘露醇-2-脱氢酶(ec.1.1.1.67)等。以有机酸为底物的脱氢酶,可举出:乳酸脱氢酶(ec.1.1.1.27、ec.1.1.1.28)、苹果酸脱氢酶(ec.1.1.1.37、ec.1.1.1.38、ec.1.1.1.39)、异柠檬酸脱氢酶(ec.1.1.1.41)、酒石酸脱氢酶(ec.1.1.1.93)、葡萄糖酸-5-脱氢酶(ec.1.1.1.69)、甲酸脱氢酶(ec.1.2.1.2)等。
作为本发明所使用的对由nad+合成nadh的反应进行催化的氧化还原酶,特别优选使用葡萄糖脱氢酶、甲酸脱氢酶、乙醇脱氢酶或乳酸脱氢酶,因为它们的底物比较廉价。例如,在进行nadh补救合成的酶反应体系中,通过添加葡萄糖和葡萄糖脱氢酶,从而使由补救合成的nad+和葡萄糖在葡萄糖脱氢酶的作用下,合成葡萄糖酸内酯与nadh。同样地,在进行nadh补救合成的酶反应体系中,通过添加甲酸和甲酸脱氢酶,从而合成二氧化碳和nadh,通过添加乙醇和乙醇脱氢酶,从而合成醛和nadh,通过添加乳酸和乳酸脱氢酶,从而合成丙酮酸和nadh。
在本发明的辅酶的制造方法中,作为在需要nad+或nadh的酶反应体系中添加的nad+补救合成路线或nadh补救合成路线所需的酶,优选是耐热性酶。与非耐热性酶相比,耐热性酶的化学稳定性及热稳定性优异,因此,在酶反应体系内能够更稳定地合成nad+或nadh。
在本发明以及本申请的说明书中,“耐热性酶”是指即使在进行了60℃的加热处理的情况下也不会变性,仍能保持酶活性的酶。作为在需要nad+的酶反应体系中添加的耐热性酶,优选的耐热性酶具有即使在进行了70℃的加热处理的情况下也不会变性而能保持酶活性的耐热性。
耐热性酶既可以是天然酶(任意生物固有的酶),也可以是将天然酶改造而成酶,还可以是人工设计/合成的酶。天然耐热性酶例如能够从超嗜热菌或嗜热菌离析而来。作为属于超嗜热菌或嗜热菌的微生物,例如能够举出:掘越氏火球菌(pyrococcushorikoshii)、深海火球菌(pyrococcusabyssi)、食葡萄糖热火球菌(pyrococcusglycovorans)、激烈火球菌(pyrococcusfuriosus)、沃氏火球菌(pyrococcuswosei)等火球菌属;坎氏甲烷嗜高热菌(methanopyruskandleri)等甲烷嗜热菌属;延胡索酸火叶菌(pyrolobusfumarii)等火叶菌属;嗜酸热硫化叶菌(sulfolobusacidocaldarius)、冰岛硫化叶菌(sulfolobusislandicus)、硫磺矿硫化叶菌(sulfolobussolfataricus)、床田硫化叶菌(sulfolobustokodaii)等硫化叶菌属;隐蔽热网菌(pyrodictiumoccultum)、深海热网菌(pyrodictiumabyssi)、布氏热网菌(pyrodictiumbrockii)等热网菌属;丁酸栖高温菌(hyperthermusbutylicus)等栖高温菌属;耐超高温热棒菌(pyrobaculumaerophilum)、pyrobaculumarsenaticum、嗜有机物热棒菌(嗜器官热棒菌)(pyrobaculumorganotrophum)等热棒菌属;敏捷气热菌(aeropyrumpernix)等气热菌属;深海热球菌(thermococcusprofundus)、鹿儿岛热球菌(thermococcuskodakarensis)、耐伽玛射线热球菌(thermococcusgammatolerans)等嗜热球菌属;产水细杆菌(aquifexpyrophilus)等产水菌属;海栖热袍菌(thermotogamaritima)、thermotoganaphthophila、莱廷格栖热袍菌(thermotogalettingae)、新阿波罗栖热袍菌(thermotoganeapolitana)、嗜岩热孢菌(thermotogapetrophila)等栖热袍菌属;普通热脱硫杆菌(thermodesulfobacteriumcommune)等热脱硫杆菌属;嗜热栖热菌(thermusthermophilus)、水生栖热菌(thermusaquaticus)等栖热菌属;嗜酸热原体(thermoplasmaacidophilum)、火山热原体(thermoplasmavolcanium)等热原体属;嗜热脂肪土芽孢杆菌(geobacillusstearothermophilus)等土芽孢杆菌属;半氧化醋杆菌食糖变种酸叶菌(acidilobussaccharovorans)等酸叶菌属;硫磺矿硫化叶菌(sulfolobussolfataticus)等硫化叶菌属等。
当nad+补救合成路线或nadh补救合成路线是多阶段反应时,各阶段的酶反应速度由酶反应自身的反应速度和酶反应体系内的耐热性酶的存在量决定。因此,优选向反应体系添加充分量的在这些合成路线中使用的各耐热性酶,以免因酶量的不足而引起反应效率的下降。特别是,对于反应速度较慢的耐热性酶的存在量(单位量)而言,优选在反应体系中添加充分的量,还优选以多于反应速度较快的耐热性酶的存在量的方式添加在反应体系中,以免使基于该耐热性酶的酶反应快速进行。通过考虑与反应速度的平衡来调节酶反应体系内的各耐热性酶的存在量,从而能够在抑制酶量的同时,更迅速、高效地合成nad+或nadh。需要说明的是,在本发明的辅酶的制造方法中,耐热酶可以在用于酶反应体系合成目的有机化合物的酶反应的反应开始前添加到酶反应体系,也可以在酶反应开始后添加到酶反应体系。
例如,在图1所示的nad+补救合成路线的情况下,优选的是,以使酶反应体系内存在的各耐热性酶的存在量比(单位比)相对于烟酰胺酶=1成为烟酸磷酸核糖基转移酶=5~50、烟酸-核苷酸腺苷酰基转移酶=10~100、nad+合酶=200~600、adp-核糖焦磷酸酶=1~2、核糖磷酸焦磷酸激酶=5~10的方式,将各耐热性酶添加到酶反应体系中,更优选的是,以使烟酰胺酶:烟酸磷酸核糖基转移酶:烟酸-核苷酸腺苷酰基转移酶:nad+合酶:adp-核糖焦磷酸酶:核糖磷酸焦磷酸激酶=1:50:75:500:1.2:10的方式,将各耐热性酶添加到酶反应体系中。
在nad+补救合成路线和nadh补救合成路线中,包括使用atp的反应。因此,在本发明的辅酶的制造方法中,除添加nad+补救合成路线或nadh补救合成路线所需的耐热性酶以外,还优选在需要nad+的酶反应体系或需要nadh的酶反应体系中添加合成atp的反应(atp合成路线)所需的耐热性酶。作为atp合成路线,可具体地举出,例如,如图3所示,以amp和atp为起始原料,使用腺苷酸激酶(adk)以及多聚磷酸激酶(ppk)的路线。由一分子的amp和一分子的atp在腺苷酸激酶的作用下合成两分子的adp,由该两分子的adp在多聚磷酸激酶的作用下合成两分子的atp。
本发明中使用的nad+补救合成路线所需的耐热性酶、nadh补救合成路线所需的耐热性酶以及atp合成路线所需的耐热性酶,例如,能够通过利用了微生物的代谢系统的表达体系来制造。该表达体系既可以是使耐热性酶在将编码该耐热性酶的基因(耐热性酶基因)导入微生物而成的转化体内表达的表达体系,也可以是所谓的无细胞(cell-free)表达体系。
在本发明中,当在转化体内合成添加于酶反应体系的耐热性酶时,一个转化体表达的耐热性酶可以是一种,也可以是两种以上。另外,还可以在一个转化体内表达nad+补救合成路线或nadh补救合成路线所需的全部耐热性酶基因。
能够按照该技术领域中公知的方法从超嗜热菌或嗜热菌离析耐热性酶基因。具体而言,首先,制备超嗜热菌或嗜热菌的基因组dna,然后,用适当的限制酶将基因组dna切断,用连接酶等将其连接至经相同的限制酶或产生相同的切断末端的限制酶切断的质粒或噬菌体中,从而制备基因组dna文库。接着,通过使用基于要获得的目的耐热性酶的碱基序列而设计的引物组合,进行以这些基因组dna文库为模板的pcr,能够得到目的耐热性酶基因。或者,通过使用基于上述碱基序列设计的探针,对这些基因组dna文库进行筛选,也能够得到目的耐热性酶基因。对于得到的耐热性酶基因,可以在不改变编码的耐热性酶的氨基酸序列的情况下,改造为在宿主细胞中使用频率高的密码子。此外,能够通过公知的基因重组技术进行密码子的改造。
该耐热性酶基因也可以是在n末端、c末端附加各种标签而成的嵌合基因。该标签能够使用在重组蛋白质的表达或纯化中通用的标签,例如his标签、ha(hemagglutinin)标签、myc标签以及flag标签等。在附加标签的状态下表达耐热性酶,使在表达体系中的纯化、表达量的测定等更简便。
能够通过公知的方法或通过对公知的方法作适当改变而来的方法,在宿主细胞中导入耐热性酶基因来制作转化体。具体而言,可举出以下方法,例如,通过将耐热性酶基因连接于适当的载体,从而得到含有该基因的重组载体,使用该重组载体对宿主细胞进行转化。能够依照氯化钙法、电穿孔法等公知的方法,利用该重组载体进行宿主细胞的转化。
作为用于导入耐热性酶基因的载体,只要能在进行转化的宿主细胞中使耐热性酶表达,就没有特别限制。例如,能够使用质粒、噬菌体等载体。具体而言可举出:pet11a、pet21a、puc18、pkk223-3、pbad、prci(ninhetal.,biotechnologyandbioengineering,2015,vol.112,p.189-196)、pnit-qt2、pnit-rc2、ptip-qt2、ptip-rc2等。另外,优选该重组载体包含用于能使耐热性酶基因在宿主细胞内表达的启动子、其他的调控序列(例如,增强子序列、终止子序列)。具体而言,该启动子可举出:t7启动子、lambdapr启动子、pnita启动子、ptipa启动子、lac启动子、tac启动子、pbad/arac启动子等启动子。
当nad+补救合成路线和nadh补救合成路线所需的耐热性酶为两种以上时,对各耐热性酶基因的表达进行调控的启动子,可以全部是相同种类,也可以是相互不同种类。当对各耐热性酶基因的表达进行调控的全部启动子是不同种类时,对于在酶反应体系中的添加量较多而反应速度慢的耐热性酶的表达进行控制的启动子而言,优选表达效率高的启动子。对于在酶反应体系中的添加量较少即可、反应速度快的耐热性酶的表达进行控制的启动子而言,可以使用表达效率较低的启动子。
另外,为了能对转化后的细胞进行选择,该重组载体也可以包含标记基因。该标记基因可举出例如,与宿主的营养需求性互补的基因、对药剂具有抗性的基因等。
对于用于得到导入了耐热性酶基因的转化体的宿主细胞,没有特别限定,可以是原核细胞,也可以是真核单细胞,还可以是真核多细胞生物的细胞。真核多细胞生物的细胞可以是植物细胞,也可以是昆虫细胞、哺乳细胞等的动物细胞。作为该宿主细胞,从容易培养且适于大量表达的理由出发,优选微生物。
作为用于得到导入了耐热性酶基因的转化体的宿主细胞,特别优选非耐热性微生物。在以非耐热性微生物为宿主细胞的转化体内表达耐热性酶时,通过对该转化体进行加热处理,能够在保持耐热性酶的活性的同时,使源自宿主细胞的全部蛋白质热变性而失活。因此,即使源自宿主细胞的蛋白质与耐热性酶一起被带入酶反应体系时,也能够抑制目的之外的副反应。作为宿主细胞的非耐热性微生物,优选大肠杆菌;枯草芽孢杆菌(bacillussubtilis)、巨大芽孢杆菌(bacillusmegaterium)等芽孢杆菌属菌;恶臭假单胞菌(pseudomonasputida)、荧光假单胞菌(pseudomonasfluorescense)等假单胞菌属菌;红串红球菌(rhodococcuserythropolis)、浑浊红球菌(rhodococcusopacus)等红球菌属菌;酿酒酵母(saccharomycescerevisiae)等酵母属菌;栗酒裂殖酵母(scizosaccharomycespombe)等裂殖酵母属菌;毕赤酵母(pichiapastoris)等毕赤属菌等,从表达效率高并且能容易地以较低成本进行培养的观点出发,特别优选大肠杆菌。
在本发明中,在酶反应体系中添加的耐热性酶可以是经纯化的,也可以是经粗纯化的,还可以是未纯化的。能够通过常用的方法纯化来自表达体系的耐热性酶。
特别是,在通过以非耐热性微生物为宿主细胞并导入耐热性酶基因的转化体从而合成耐热性酶的情况下,能够将表达了耐热性酶的转化体的加热处理物直接添加到酶反应体系。因为通过加热处理,在耐热性酶保持活性的同时,源自宿主细胞的蛋白质会失活,所以不会引起目的之外的副反应,能够不用纯化耐热性酶而将加热处理物直接添加至酶反应体系内。另外,加热处理会部分破坏转化体的细胞结构、特别是细胞膜、细胞壁,从而提高物质向转化体内外的透过性。总之,因为底物和酶反应的产物能够透过灭活菌体(加热处理后的转化体),所以即使在加热处理物中的耐热性酶被保留在转化体的灭活菌体内的情况下,即使将加热处理物直接添加到酶反应体系时,也能够在该酶反应体系内进行基于该加热处理物中的耐热性酶的酶反应。进一步地,加热处理物包含的源自宿主细胞的adp-核糖、烟酰胺、nad+、nadh、atp以及amp等成分,能够作为酶反应体系中的酶反应的原料来使用。
大肠杆菌的细胞壁比较容易因加热处理而破坏。因此,在转化体以大肠杆菌为宿主细胞并导入了耐热性酶基因的情况下,加热处理物中的耐热性酶相比于保留在灭活菌体内而言,更易流出到灭活菌体外。在将加热处理物添加到酶反应体系的情况下,流出到灭活菌体外的耐热性酶分散到酶反应体系内。相比于耐热性酶被保留在灭活菌体内的情况,当其广泛地分散在酶反应体系内时,基于该耐热性酶的酶反应的效率更好。从酶反应体系内的反应效率的方面出发,与细胞壁难以因加热处理而破坏的非耐热性微生物相比,更优选如大肠杆菌那样的细胞壁较容易因加热处理而破坏的非耐热性微生物,作为表达本发明所使用的耐热性酶的宿主细胞。
在本发明的辅酶的制造方法中,通过将原本作为辅酶被添加到酶反应体系中的nad+和/或nadh的热分解物、也即烟酰胺和/或adp-核糖用作底物,从而即使不在该酶反应体系中外部添加烟酰胺、adp-核糖也能够合成nad+或nadh。另外,也可以在酶反应体系中完全不添加nad+,而仅添加烟酰胺等作为nad+补救合成路线的起始原料的化合物,在酶反应体系内仅使用通过nad+补救合成路线合成的nad+。同样地,也可以在酶反应体系中完全不添加nadh,而仅添加烟酰胺等作为nadh补救合成路线的起始原料的化合物,在酶反应体系内仅使用通过nadh补救合成路线合成的nadh。
对于在非耐热性微生物中表达了耐热性酶的转化体的加热处理条件,只要是使源自宿主细胞的蛋白质失活,而使目的耐热性酶的活性得以保持的条件,就没有特别的限定。例如,能够以在60~90℃左右加热1~30分钟的条件,对表达了耐热性酶的转化体进行加热处理。
本发明的辅酶制造用转化体组的特征在于,其由一种或两种以上的转化体组成,所述转化体是以非耐热性微生物为宿主,并导入了对该辅酶的补救合成路线所需的一种或两种以上的耐热性酶进行编码的基因。在本发明的辅酶制造用转化体组中,将由以非耐热性微生物为宿主并导入了对nad+补救合成路线所需的一种或两种以上的耐热性酶进行编码的基因而成的一种或两种以上的转化体组成的组,称为nad+制造用转化体组。同样地,将由以非耐热性微生物为宿主并导入了对nadh补救合成路线所需的一种或两种以上的耐热性酶进行编码的基因而成的一种或两种以上的转化体组成的组,称为nadh制造用转化体组。
在该nad+制造用转化体组所含的任意转化体内表达nad+补救合成路线所需的耐热性酶。也就是说,通过培养该nad+制造用转化体组所含的转化体,能够制造nad+补救合成路线所需的全部种类的耐热性酶。同样地,通过在该nadh制造用转化体组所含的任意转化体内表达nadh补救合成路线所需的耐热性酶,通过培养该nadh制造用转化体组所含的转化体,能够制造nadh补救合成路线所需的全部种类的耐热性酶。
例如,如图1所示,当nad+补救合成路线需要烟酰胺酶、烟酸磷酸核糖基转移酶、烟酸-核苷酸腺苷酰基转移酶、nad+合酶、adp-核糖焦磷酸酶以及核糖磷酸焦磷酸激酶这全部六种耐热性酶时,该nad+制造用转化体组可以由将这六种耐热性酶基因全部导入而成的一种转化体组成,也可以由将各耐热性酶基因分别导入不同的转化体而成的六种转化体组成。另外,还可以由以下两种转化体组成、即:将这六种耐热性酶基因中的三种导入而成的转化体和将剩余的三种导入而成的转化体。
在该nad+制造用转化体组和nadh制造用转化体组中,进一步也可以包含导入了对atp合成路线所需的一种或两种以上的耐热性酶进行编码的基因的一种或两种以上的转化体。
作为该辅酶制造用转化体组包含的转化体,能够使用前述那样的转化体,优选使用以大肠杆菌为宿主细胞的转化体。
该辅酶制造用转化体组包含的转化体,可以是适合长期保存的甘油保存的状态,也可以是用琼脂培养基形成群落的状态。另外,可以是用培养用培养基培养到一定程度的培养液的状态(悬浊液),也可以是将培养后的湿菌体加热处理过的状态。
实施例
下面,通过实施例等对本发明作更详细的说明,但是本发明不受这些例子的限定。
<hplc分析>
采用5c18ar-ii色谱柱(4.6mm(内径)×250mm,纳卡拉公司(nacalaitesque,inc)制),通过hplc,对nad+、adp-核糖、烟酰胺、烟酸、烟酸单核苷酸以及脱酰胺nad+进行定量分析。溶出时采用梯度溶出,该梯度溶出中,将50mm磷酸钾缓冲液(ph6.5)用作洗脱液a,将在相同的缓冲液中溶解25%(v/v)的甲醇和5mm1-辛烷磺酸钠而得的溶液用作洗脱液b。洗脱液的流速是0.5ml/min,溶出开始起5分钟内,单独以洗脱液a进行溶出,然后,在从5~11分钟为止的时间内,使洗脱液b的混合比率从0上升至100%(v/v),然后,进一步单独以洗脱液b进行6分钟的溶出。色谱柱温度保持在40℃,在254nm的位置监测溶出液。
通过采用了hilic色谱柱(4.6mm(内径)×250mm,纳卡拉公司(nacalaitesque,inc)制)的hplc分析,对atp、adp以及amp实施定量。将20mm磷酸钾缓冲剂(ph7.0)和乙腈以等容量混合而成的溶液用作洗脱液,以流速1.0ml/min进行了溶出。色谱柱温度保持在40℃,在254nm对溶出液进行监测。
[参考例1]
1分子的nad+热分解产生1分子的烟酰胺和1分子的adp-核糖(图4)。
将终浓度1mm的nad+溶液在70℃孵育3小时后,将其用于采用5c18ar-ii色谱柱的hplc分析,结果观察到除nad+之外的两个峰。与作为nad+的构成单位的各种化合物的分析结果比较后可清楚地得知,烟酰胺、adp-核糖表现出与上述峰相同的停留时间。接着,随时间推移跟踪nad+的热分解可清楚地得知,随着分解,烟酰胺、adp-核糖的化学计量在累积(图5)。该结果意味着烟酰胺和adp-核糖这两个物质与nad+相比,对热具有更优良的稳定性,判断其能用作补救合成的起始物质。
需要说明的是,在此给出的分解方式,与chenault等在综述(chenaultandwhitesides,appliedbiochemistryandbiotechnology,1987,vol.14,p.147-197)中提出的碱催化下的nad+分解方案的发现非常吻合。
[实施例1]
<nad+补救合成路线的设计>
在设计以烟酰胺作为起始物质的nad+补救合成路线时,考虑了图1和2所示的两个路线。关于图1所示的nad+补救合成路线所必需的6种酶,从超嗜热菌或嗜热菌来源的酶中选出了表1所示的酶。另外,与此相应地,关于图3所示的atp合成路线所必需的两种酶和葡萄糖脱氢酶,从超嗜热菌或嗜热菌来源的酶中选出了表1所示的酶。需要说明的是,葡萄糖脱氢酶用于对合成的nad+进行定量。表1中,“ginumber”是genbank(ncbi(nationalcenterforbiotechnologyinformation)提供的碱基序列数据库)的登录编号。
表1
嗜酸热原体的烟酰胺酶具有烟酰胺酶活性,其是以源自半氧化醋杆菌食糖变种酸叶菌的烟酰胺酶(gi:503031789)的氨基酸序列为查询序列进行blast检索的结果中发现的酶,有报道称所述源自半氧化醋杆菌食糖变种酸叶菌的烟酰胺酶(gi:503031789)的氨基酸序列在大肠菌内还能进行异源表达;而编码该酶的基因是通过pcr法由嗜酸热原体的基因组dna离析而来。将离析而来的酶基因导入大肠菌,在得到的转化体内表达该酶,结果确认了在60℃具备烟酰胺酶活性。
另外,对于脱酰胺nad+的氨基化酶(nad合酶),还可以用源自嗜热栖热菌的nad合酶代替表1中记载的酶。
此外,表1中的ttnmat是不仅能以烟酸单核苷酸(namn)为底物,也能以烟酰胺单核苷酸(nmn)为底物的酶。
<转化体的制备>
针对表1记载的耐热性酶,将各耐热性酶基因导入大肠杆菌而制备了转化体(重组大肠杆菌)。
表1记载的耐热性酶中,源自嗜热栖热菌hb8的酶都包含于由理化学研究所提供的相同细菌的单基因表达质粒文库(thesinglegeneexpressionplasmidlibraryofthesamebacterium)(yokoyama,etal.,naturestructuralbiology,2000,vol.7,p.943-945)。同文库的表达载体是以pet11a(novagen社制)和其衍生物为主干而制成的,目的基因在t7启动子的调控下组装,接受由iptg的诱导表达。
对于源自嗜热栖热菌hb27的多聚磷酸激酶(ttpkk)以及源自嗜酸热原体的烟酰胺酶(tanaase)而言,将由各微生物的基因组dna进行pcr扩增而得的该基因连接于pet21a,同样地使其在t7启动子的调控下表达。
将这些基因表达载体全部导入e.colirosetta2(de3)plyss(novagen社制),制备了转化体。
将源自硫磺矿硫化叶菌的葡萄糖脱氢酶(ssgdh)基因在prci的lambdapr启动子调控下连接,并导入e.colidh5α株,制作了转化体。通过将培养温度转为42℃,从而进行诱导ssgdh基因的表达。
对重组大肠菌全部用含100μg/ml的氨苄青霉素的luria-bertani培养基,在37℃下进行有氧培养。在e.colirosetta2(de3)plyss的培养中,进一步在培养基中添加30μg/ml的氯霉素。在指数増殖后期通过向培养液中添加0.2mmiptg或热诱导(42℃),进行目的酶基因的诱导表达。
<粗酶液的制备>
将表达目的耐热性酶的重组大肠菌的湿菌体悬浊于100mmhepes-naoh(ph7.0),并使其成为200mg(wetcells)/ml。通过将得到的悬浊液供给超音波破碎处理,来破碎菌体,得到了无细胞提取液。在70℃条件下对该无细胞提取液实施30分钟的热处理,以使源自宿主的蛋白质变性并失活。对热处理后的悬浊液进行离心分离处理,将去除了细胞残留和变性蛋白质的上清作为粗酶液,并用于活性测定。
<酶活性测定>
在活性测定中使用400mmhepes-naoh(ph8.0),反应全部在60℃条件下实施。对于各酶的活性,将通过与图1所示的nad+补救合成路线中位于下游的酶偶联而生成的nad+进一步在ssgdh的作用下还原,通过监测在340nm位置的吸收从而测定了累积的nadh的浓度。将在本测定条件下在1分钟内对1μmol的底物消耗进行催化的量定义为1单位(u),并以此表示各酶的活性。
在由400mmhepes-naoh(ph8.0)、1mm葡萄糖、60mmnh4cl2、10mmmgcl2、3mmatp、1mm多聚磷酸(平均链长60)、0.2mm磷酸核糖焦磷酸(prpp)组成的反应液中实施tanaase的活性测定。在该反应溶液中添加tanaase、ttnaprt、ttnmat、gsnads和ssgdh的粗酶液,在60℃条件下进行了3分钟的预孵育。需要说明的是,此时,以相对于tanaase活性值为过剩量的方式添加ttnaprt、ttnmat、gsnads、ssgdh,以免下游酶的反应处于nadh合成反应的快速阶段。预孵育后,添加终浓度0.2mm的烟酰胺,监测在340nm处的吸光度的上升。在反应速度的计算中,使用在同一波长处的nadh的摩尔吸光度系数6.2mm-1cm-1。
除了不添加tanaase以外,同样地在相同组成的反应液中实施ttnaprt活性测定。在预孵育后,通过添加作为底物的0.2mm的烟酸,使反应开始。同样地对于ttnmat、gsnads,也使用0.2mm的各酶的底物(烟酸单核苷酸(namn)、脱酰胺nad)进行了活性测定。另外,还通过分别以0.2mm的adp-核糖、核糖5-磷酸为底物并对其与ttnaprt、ttnmat、gsnads或ssgdh的偶联反应速度进行定量,从而测定了ttadprp、ttrpk的活性。
另外,在评价nad+存在下的各酶的活性时,在400mmhepes-naoh(ph8.0)中将各酶及其底物在60℃条件下孵育,用hplc测定了产物的浓度。
对于ttadk、ttppk,将这些粗酶液在400mmhepes-naoh(ph8.0)中,与10mmmgcl2、0.2mmatp、3.0mmamp、1mm多聚磷酸一起在60℃条件下孵育,用hplc测定了atp累积量和amp減少量。
<nad+补救合成试验>
在由400mmhepes-naoh(ph8.0)、60mmnh4cl2、10mmmgcl2、4mmnad+、3mmatp、1mm多聚磷酸(平均链长60)、0.2mmadp-核糖、0.2mm烟酰胺组成的反应液中实施nad+补救合成试验。
将由各自表达tanaase、ttnaprt、ttnmat、gsnads、ttadprp、ttrpk、ttadk和ttppk的重组大肠杆菌分别制备的粗酶液混合,相对于0.5ml的反应液量,以使各酶的终浓度分别成为0.02、0.18、0.25、0.51、0.02、0.03、0.05和0.05u/ml的方式添加该粗酶液。另外,作为对照试验,准备不含重组大肠杆菌、粗酶液的反应液,将其在60℃条件下孵育。随时间的推移进行取样,用hplc对反应液中的nad+进行定量。
在hepes-naoh(400mm,ph8)中,在60℃条件下对4mm的nad+进行了孵育,推算出其分解速度是50μm/min左右。因此,在酶活性测定法中所示的反应条件下,通过吸光度变化来监测nadh的生成速度,同时调节各酶的添加量,从而推算了由各0.2mm的adp-核糖、烟酰胺以50μm/min的速度合成nadh所需的酶的浓度。
另一方面,通过hplc分析,对在4mm的nad+存在下的各酶的活性进行了测定。其结果清楚地表明,对烟酸的磷酸核糖化进行催化的ttnaprt因nad+而受到显著的抑制。图6中,在包含横轴表示的浓度的nad+的400mm的hepes-naoh(ph8.0)中,将ttnaprt与各0.2mm的prpp、atp和烟酸一起在60℃条件下孵育后,用hplc对反应液中的烟酸单核苷酸(namn)的浓度进行定量,将计算出的活性值(将不含nad+的反应液中的活性作为100%时的相对活性值)结果示于该图6。推算出在相同的条件下的ttnaprt活性约是不存在nad+的条件下的活性的1/4,因此,关于该酶,将添加量设为基于吸光度测定确定的酶浓度的4倍量。
<与atp合成路线的偶联>
在图1的nad+补救合成路线中,每合成1分子的nad+要消耗3分子的atp,并放出3分子的amp。因此,使由amp合成atp的合成路线与nad+补救合成路线偶联,所述由amp合成atp的合成路线利用ttadk和ttppk,并以多聚磷酸为磷酸基供给源。对于此时的酶量而言,将其设为相比于根据nad+分解速度推算的必要的速度(150μm/min)而言是过剩量。
对具有以此方式确定的浓度的活性值的粗酶液、或与该粗酶液具有同等酶活性值的含耐热性酶的重组大肠杆菌的悬浊液进行热处理(70℃,30分钟),将热处理后的液体加入反应液中,在该反应液中,在60℃条件下对4mm的nad+进行孵育,随时间推移跟踪其浓度变化(图7)。其结果确认了,至少在截至6小时为止的期间内,与未添加酶时相比,nad+的表观上的分解速度显著降低,nad+继续保持与初始浓度相近的浓度。即确认了,通过添加nad+补救合成路线和atp合成路线所需的耐热性酶,由nad+的热分解物重新合成了nad+,表观上体系内的nad+浓度不降低,由此,通过在需要nad+的酶反应体系中添加nad+补救合成路线所需的耐热性酶,即使不外部添加nad+也能够抑制因nad+的热分解而导致的浓度下降,进而能长时间稳定的进行目的有机化合物的合成。
[实施例2]
使用nad+补救合成路线和atp合成路线所需的耐热性酶,进行了nad+补救合成试验。使用的各种耐热性酶是在实施例1中使用的酶。
具体而言,在包含酶混合剂(cocktail)的反应液2ml中实施了nad+补救合成反应,所述酶混合剂是300mmhepes-naoh(ph8.0)、60mmnh4cl2、10mmmgcl2、1mm多聚磷酸(平均链长60)、4mmnad+、3mmatp、0.2mm烟酰胺、0.2mmadp-核糖和实施例1使用的各种耐热性酶的混合物。此外,该反应液包含的耐热性酶的最终浓度分别是:tanaase是0.12u(0.6u/ml);ttnaprt是0.26u(0.13u/ml);ttnmat是1.6u(0.8u/ml);gsnads是10u(5u/ml);ttadprp是0.12u(0.6u/ml);ttrpk是0.2u(0.1u/ml);ttadk是18u(9u/ml);ttppk是10u(5u/ml)。
将制备而成的反应液在60℃条件下孵育。另外,作为对照试验,准备不含酶混合剂(cocktail)的反应液,同样地在60℃条件下进行孵育。反应开始后每3小时进行一次取样,用hplc对反应液中的nad+进行定量。图8表示反应液中的nad+量随时间推移的变化。图中,“有酶”表示添加了酶混合剂的反应液的结果,“无酶”表示未添加酶混合剂的反应液的结果。如图8所示,对于未添加耐热性酶的反应液而言,nad+从孵育刚开始后就随时间的推移缓慢降低。相对地,对于添加了nad+补救合成路线和atp合成路线所需的耐热性酶的反应液,从孵育开始至21小时左右为止,nad+的量几乎不降低。根据这些结果能够确认,在该反应液中,通过nad+补救合成反应由nad+的分解物合成了nad+,nad+的合成所需的atp也通过atp合成反应得到补给。
[实施例3]
使用nadh补救合成路线和atp合成路线所需的耐热性酶,进行了nadh合成试验。使用的各种耐热性酶采用实施例1所用的酶。
具体而言,在包含酶混合剂的反应液2ml中实施了nadh补救合成反应,所述酶混合剂是300mmhepes-naoh(ph8.0)、60mmnh4cl2、10mmmgcl2、1mm多聚磷酸(平均链长60)、4mmnadh、50mm葡萄糖、3mmatp、0.2mm烟酰胺、0.2mmadp-核糖和实施例1中使用的各种耐热性酶的混合物。需要说明的是,该反应液包含的耐热性酶的最终浓度分别是:tanaase是0.12u(0.6u/ml);ttnaprt是0.26u(0.13u/ml);ttnmat是1.6u(0.8u/ml);gsnads是10u(5u/ml);ttadprp是0.12u(0.6u/ml);ttrpk是0.2u(0.1u/ml);ttadk是18u(9u/ml);ttppk是10u(5u/ml);ssgdh是10u(5u/ml)。
将制备的反应液在60℃条件下孵育。另外,作为对照试验,准备不含酶混合剂的反应液,同样地在60℃条件下孵育。反应开始后每3个小时进行一次取样,用hplc对反应液中的nadh进行定量。反应液中的nadh量随时间推移的变化示于图9。图中,“有酶”表示添加了酶混合剂的反应液的结果,“无酶”表示未添加酶混合剂的反应液的结果。如图9所示,对于未添加耐热性酶的反应液而言,nadh在孵育刚开始后就随时间的推移缓慢降低。与此相对,对于添加了nadh补救合成路线和atp合成路线所需的耐热性酶的反应液而言,从孵育开始起至15小时左右为止,nadh的量几乎不降低。根据这些结果能够确认,在该反应液中,通过nadh补救合成反应,由nadh的分解物合成了nadh,合成nadh所需的atp也通过atp合成反应得到补给。
- 还没有人留言评论。精彩留言会获得点赞!