基于IL-2的疗法和基于间充质干细胞的疗法的伴随方法和试剂盒与流程
本申请要求保护2015年6月3日提交的美国临时申请系列号62/170,604、和2015年6月3日提交的美国临时申请系列号62/170,619以及2015年6月 12日提交的美国临时申请系列号62/175,203的优先权,其每一篇通过引用以其整体并入。
发明背景
白细胞介素2(IL-2)是免疫系统中的一类细胞因子信号分子,其用于治疗。IL-2使用重组DNA技术制造,并作为称为阿地白介素(品牌为)的蛋白质治疗剂销售。IL-2在数个国家批准用于治疗癌症(转移性黑素瘤和肾细胞癌)和HIV。
已经批准IL-2作为高剂量方案用于癌症治疗的化学治疗剂,但是其也可以以低剂量形式施用。高剂量方案涉及每8小时静脉内给予药物,若耐受至最多15次。高剂量的IL-2疗法仅产生约15%至20%的总体应答率;此外,它与基本上影响每个器官系统的显着的毒性有关。由于这些副作用的严重程度,患者住院治疗,有时需要重症监护病房的支持;在严重的情况下,需停止IL-2治疗。
人类间充质干细胞(MSC)目前是用于移植治疗多种病况的干细胞的主要来源之一(Kucerova,Cancer Res July 1,2007 67;6304)。这种移植的干细胞在体内存在促炎或其他不适合环境的情况下可能会产生不想要的副作用。对于 MSC的有益特性受其局部环境影响的程度知之甚少。
综上所述,迄今为止,在如何确定与施用IL-2疗法相关的潜在不良事件以及环境对移植的MSC的潜在不利影响方面知之甚少。因此,需要用于改善用IL-2治疗的患者的治疗以及接受基于MSC的疗法的患者的伴随方法和试剂盒。本文描述了用于这些目的的方法和试剂盒。
发明概述
本文描述的是用于确定有资格接受基于IL-2的疗法的个体或已经接受基于IL-2的疗法的个体是否可能经历与基于IL-2的疗法有关的不良事件的伴随方法和试剂盒。如果确定个体可能经历如增加的肿瘤发生或转移的风险的不良事件,而不是根除如癌症的潜在疾病,则可以采取治疗决定不再进行任何进一步的基于IL-2的疗法。同样,如果确定个体可能不会经历与基于IL-2的疗法相关的不良事件,则可以决定开始或继续施用基于IL-2的疗法。
本文还描述了用于确定有资格接受基于MSC的疗法的个体是否可能经历与治疗相关的不良事件的伴随方法和试剂盒。
因此,在本发明的一个方面中,本文提供确定有资格接受基于IL-2的疗法的个体是否可能经历与基于IL-2的疗法相关的不良事件的方法,所述方法包括:(a)测量来自所述个体的样品中选自生物标志物集合的至少两种生物标志物的表达水平,其中(1)个体已接受至少一个剂量的基于IL-2的疗法或(2) 样品与IL-2在体外组合,且其中所述生物标志物集合包括TIE-1、TIE-2、 TIMP-4、FGF1、LIF、TGFBR2、CSF1、TGFα、TGFβ1、IL17D、SDF2、 TGFBRAP1、FGF11、TNFSF13B、FGF14、IL1β、IL-11、IL-32、IL-6、IL1RN、 IL-20RB、IL-21R、PLAU、GNB2L1、PLEKHA6、CTSB、FERMT1、CRMP1、 VEGFB、VEGFA和PLEKHA1;且(b)将生物标志物的水平与参照水平进行比较,其中参照水平以上的水平的增加表明个体可能经历与基于IL-2的疗法相关的不良事件,并且其中相比参照水平所述水平降低或无变化指示所述个体可能不会经历与基于IL-2的疗法相关的不良事件。在本发明的一个变化中,所述个体已接受(例如施用了)至少一个剂量的基于IL-2的疗法;在一些变化中,所述个体已接受基于IL-2的疗法用于癌症的治疗。在一些变化中,所述样品从已接受基于IL-2的疗法后24、48或72小时的个体获得。在另一个变化中,所述样品与IL-2在体外组合用于进一步分析;在一些变化中,所述样品可组合约24小时,其后在从样品中除去IL-2之后24、48或72小时测量生物标志物。如本文涵盖的,所述样品可以是任何生物样品;在一个变化中,所述样品是血液、血浆或血清样品。在具体的变化中,所述方法包括测量来自所述生物标志物集合的至少三种生物、来自所述生物标志物集合的至少四种生物标志物或来自所述生物标志物集合的至少五种生物标志物的表达水平。在一些变化中,所述方法包括测量TIE-1、TIE-2、TIMP-4、VEGFA、 PLEKHA1、VEGFB、CRMP1、FERMT1、CTSB、PLEKHA6、GNB2L1和 TGFβ1的表达水平。在一些变化中,所述方法可进一步包括测量其他生物标志物。在一个具体的变化中,所述方法进一步包括测量SIVA1的表达水平,并询问该生物标志物的表达降低。如本文涵盖,可以测量RNA或蛋白质表达水平。因此,在一个变化中,所述方法包括测量生物标志物的蛋白质水平,例如使用ELISA测定、抗体蛋白质组学阵列、免疫组织化学或质谱法。在另一个变化中,所述方法包括测量生物标志物的RNA水平,例如用Q-PCR测定或RNA-seq。在一些变化中,该方法包括从个体获得样本作为该方法的一部分。在确定表达结果时,所述方法可以进一步包括如果在步骤(b)中确定所述个体可能不经历与基于IL-2的疗法相关的不良事件,则向所述个体施用有效量的所述基于IL-2的疗法。该方法可以进一步包括如果在步骤(b)确定所述个体可能经历与基于IL-2的疗法相关的不良事件,则向所述个体施用复原疗法。
另一方面。本发明提供使用基于IL-2的疗法治疗个体癌症的方法。在一个变化中,使用基于IL-2的疗法治疗个体癌症的方法包括:(a)测量来自所述个体的样品中选自生物标志物集合的至少两种生物标志物的表达水平,其中 (1)个体已接受至少一个剂量的基于IL-2的疗法或(2)样品与IL-2在体外组合,且其中所述生物标志物集合包括TIE-1、TIE-2、TIMP-4、FGF1、LIF、TGFBR2、 CSF1、TGFα、TGFβ1、IL17D、SDF2、TGFBRAP1、FGF11、TNFSF13B、 FGF14、IL1B、IL-11、IL-32、IL-6、IL1RN、IL-20RB、IL-21R、PLAU、 GNB2L1、PLEKHA6、CTSB、FERMT1、CRMP1、VEGFB、VEGFA和 PLEKHA1;(b)将生物标志物的水平与参照水平进行比较,其中参照水平以下的水平中无变化或降低表明所述个体可能不会经历与基于IL-2的疗法相关的不良事件;和(c)如果在步骤(b)中确定所述个体可能不会经历与基于IL-2的疗法相关的不良事件,则向个体施用有效量的基于IL-2的疗法。在另一个变化中,用基于IL-2的疗法治疗个体癌症的方法包括当至少两种生物标志物的表达水平与来自所述个体的样品中的参照水平相比降低或不显示变化时,向所述个体施用有效量的基于IL-2的疗法,其中(1)个体已接受至少一个剂量的基于IL-2的疗法或(2)样品与IL-2在体外组合,且其中所述生物标志物集合包括TIE-1、TIE-2、TIMP-4、FGF1、LIF、TGFBR2、CSF1、TGFα、TGFβ1、 IL17D、SDF2、TGFBRAP1、FGF11、TNFSF13B、FGF14、IL1B、IL-11、IL-32、 IL-6、IL1RN、IL-20RB、IL-21R、PLAU、GNB2L1、PLEKHA6、CTSB、 FERMT1、CRMP1、VEGFB、VEGFA和PLEKHA1。在本发明的一个变化中,所述个体已接受(例如施用了)至少一个剂量的基于IL-2的疗法。在一些变化中,所述样品从已接受基于IL-2的疗法后24、48或72小时的个体获得。在另一个变化中,来自所述个体的样品与IL-2在体外组合用于进一步分析;在一些变化中,所述样品可组合约24小时,其后在从样品中除去IL-2之后24、 48或72小时测量生物标志物。如本文涵盖的,所述样品可以是任何生物样品;在一个变化中,所述样品是血液、血浆或血清样品。在具体的变化中,所述方法包括测量来自所述生物标志物集合的至少三种生物、来自所述生物标志物集合的至少四种生物标志物或来自所述生物标志物集合的至少五种生物标志物的表达水平。在一些变化中,所述方法包括测量TIE-1、TIE-2、 TIMP-4、VEGFA、PLEKHA1、VEGFB、CRMP1、FERMT1、CTSB、PLEKHA6、 GNB2L1和TGFβ1的表达水平。在一些变化中,所述方法可进一步包括测量其他生物标志物。在一个具体的变化中,所述方法进一步包括测量SIVA1的表达水平,并询问该生物标志物的表达降低。如本文涵盖,可以测量RNA或蛋白质表达水平。因此,在一个变化中,所述方法包括测量生物标志物的蛋白质水平,例如使用ELISA测定、抗体蛋白质组学阵列、免疫组织化学或质谱法。在另一个变化中,所述方法包括测量生物标志物的RNA水平,例如用 Q-PCR测定或RNA-seq。在一些变化中,该方法包括从个体获得样本作为该方法的一部分。如果确定个体可能经历与基于IL-2的疗法相关的不良事件,则该方法甚至可以进一步包括向个体施用复原疗法。
另一方面,本发明提供了确定间充质干细胞(MSC)群是否适用于个体用于基于MSC的疗法的方法,包括:(a)将IL-2与MSC群温育;(b)测量选自生物标志物集合的至少两种生物标志物在MSC中的表达水平,其中所述生物标志物集合包括TIE-1、TIE-2、TIMP-4、FGF1、LIF、TGFBR2、CSF1、TGFα、 TGFβ1、IL17D、SDF2、TGFBRAP1、FGF11、TNFSF13B、FGF14、IL1B、 IL-11、IL-32、IL-6、IL1RN、IL-20RB、IL-21R、PLAU、GNB2L1、PLEKHA6、 CTSB、FERMT1、CRMP1、VEGFB、VEGFA和PLEKHA1;和(c)将所述生物标志物的水平与参照水平进行比较,其中高于参照水平的水平的增加表明 MSC不适于施用于个体,且低于参照水平的水平无变化或降低表明MSC适于施用于个体。在一些变化中,所述方法包括测量来自所述生物标志物集合的至少三种生物、来自所述生物标志物集合的至少四种生物标志物或来自所述生物标志物集合的至少五种生物标志物的表达水平。在一些变化中,所述方法包括测量TIE-1、TIE-2、TIMP-4、VEGFA、PLEKHA1、VEGFB、CRMP1、 FERMT1、CTSB、PLEKHA6、GNB2L1和TGFβ1的表达水平。在一些变化中,所述方法可进一步包括测量其他生物标志物。在一个具体的变化中,所述方法进一步包括测量SIVA1的表达水平,并询问该生物标志物的表达降低。如本文涵盖,可以测量RNA或蛋白质表达水平。因此,在一个变化中,所述方法包括测量生物标志物的蛋白质水平,例如使用ELISA测定、抗体蛋白质组学阵列、免疫组织化学或质谱法。在另一个变化中,所述方法包括测量生物标志物的RNA水平,例如用Q-PCR测定或RNA-seq。在一些变化中,温育的时间段为约24小时。在一些变化中,与IL-2温育后24、48或72小时实施测量。在一些变化中,该方法进一步包括将细胞群施用至个体。所述方法可以进一步包括在将细胞施用至个体之前使细胞复原。
本发明的另一方面,本文提供用于评估MSC群用于移植的适合性或确定是否应该施用基于IL-2的疗法的试剂盒,其包含用于测量样品中选自生物标志物集合的至少两种生物标志物的表达水平的试剂,其中所述生物标志物集合包括TIE-1、TIE-2、TIMP-4、FGF1、LIF、TGFBR2、CSF1、TGFα、TGFβ1、 IL17D、SDF2、TGFBRAP1、FGF11、TNFSF13B、FGF14、IL1β、IL-11、IL-32、 IL-6、IL1RN、IL-20RB、IL-21R、PLAU、GNB2L1、PLEKHA6、CTSB、 FERMT1、CRMP1、VEGFB、VEGFA和PLEKHA1。在一些变化中,所述试剂盒可包含用于测量所述样品中至少三种生物标志物表达水平、用于测量所述样品中至少四种生物标志物表达水平的试剂或用于测量所述样品中至少五种生物标志物表达水平的试剂。在一些变化中,所述试剂盒包含包含用于测量TIE-1、TIE-2、TIMP-4、VEGFA、PLEKHA1、VEGFB、CRMP1、FERMT1、 CTSB、PLEKHA6、GNB2L1和TGFβ1的试剂。在一些变化中,所述试剂盒包含IL-2。
应该理解,本文所述的各种变化的一、一些或全部特性可组合以形成本发明的其他变化。本发明的这些和其他方面对于本领域的技术人员将变得显而易见。
附图简述
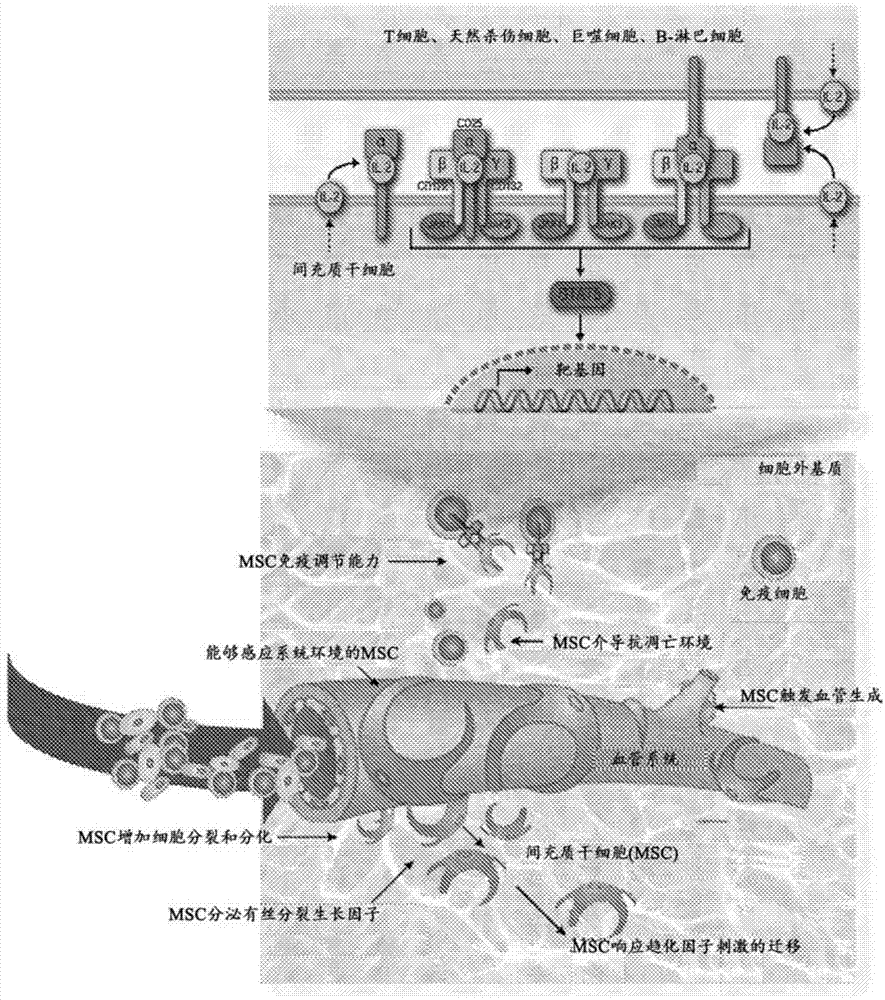
图1A是示意图,说明MSC在体内在血管上的定位,使其能够感知和响应炎性环境,并用细胞因子处理。
图1B是说明测试个体或干细胞以确定是否应当启动或继续基于IL-2的疗法的一个示例性方法的图表。
图2A是用于确定是否应该施用基于IL-2的疗法的示例性测定的示意图。图2B图示了使用图2A中所示的测定的示例性筛选结果。图2B中,结果是阳性的,几种标志物的表达增加,表明潜在的不良事件可能与IL-2的施用有关。
图3A-3D阐述了复制性衰老(SEN)如何损害人脂肪来源的间充质干细胞 (hADSC,在本文中也可互换地称为hADSC)的迁移特性。图3A显示了hADSC 的生长曲线,并且表示为培养日中的累积群倍增。图3B显示衰老相关β-半乳糖苷酶的检测。图3C显示SR(左)和SEN(右)hADSC的离体迁移测定。图 3D显示了SR-hADSC(左)和SEN-hADSC(右)的迁移。
图4A-4C阐述了IL-2受体亚型的基因表达及其与IL-2诱导的SR-hADSC 和SEN-hADSC中膜的结合。图4A显示了IL-2受体组合物的示意图。图4B 显示了在存在或不存在IL-2的情况下,通过定量PCR(qPCR)SR和 SEN-hADSC评估的IL-2受体α、β和γ。图4C显示了IL-2Rα和IL-2Rβ的细胞膜相关蛋白水平。
图5阐述了用IL-2刺激SR和SEN-hADSC的效果。通过定量RT-PCR 评估STAT5A、STAT5B和VEGFA mRNA的表达。
图6A-6D显示了在IL-2处理后SR与SEN细胞之间基因表达水平的比较。
图7A-7D阐述了功能上一致的基因集合中,在IL-2处理后SR和SEN细胞的基因表达水平。
图8A-8D阐述了经IL-2处理的SR和SEN-hADSC的RNA-seq概貌的分析。图8A提供了RNA-seq分析设计的示意图。图8B显示ACTB标准化之前各条件的基因特异性RNA-seq读取计数的分布。图8C显示用于标准化的 ACTB的条件特异性RNA-seq读取计数。图8D显示ACTB标准化后各条件的基因特异性RNA-seq读取计数的分布。
图9显示用于RNA-seq实验质量控制的外部RNA控制联合体(ERCC,一组常见的外部RNA对照)的剂量响应。
图10A-10B表示在SEN和SRhAMCS中在IL-2处理后差异表达的基因的表格。图10A显示了在SR和SEN-hADSC中IL-2处理后用于上调的基因的富集的生物途径。图10B显示了在SR和SEN-hADSC中IL-2处理后用于下调的基因的富集的生物途径。
图11-90阐述了在单独培养基(无IL-2刺激)温育或使用IL-2刺激后,来自SR-hADSC或SEN-hADSC的命名蛋白质(因子)的分泌增加。
发明详述
I.方法
1.介绍
本文提供了基于IL-2的疗法和基于间充质干细胞的疗法的伴随方法和试剂盒。
具体而言,在本发明的一个变化中,本文提供了用于确定有资格接受基于IL-2的疗法以治疗诸如癌症或HIV的病况的个体是否可能经历与基于IL-2 的疗法相关的不良事件。该方法涉及测量来自个体的样品中暴露于IL-2时的某些生物标志物表达水平的增加,这些生物标志物指示样品中MSC的细胞衰老。这种生物标志物的表达将表明,如果基于IL-2的治疗将被施用或继续,则个体可能经历不良事件(例如肿瘤发生或转移)。治疗决定可以基于这种方法的实践和本文所述的试剂盒的使用来进行。
在本发明的另一个变体中,这里提供了用于确定MSC群用于施用(例如,移植)到基于MSC的疗法的个体中的适合性的方法。该方法包括测量在暴露于IL-2时MSC中某些生物标志物的表达水平的变化,这些生物标志物与MSC 的细胞衰老相关。如果观察到生物标志物的增加,则表明如果将细胞施用至个体,则个体可能经历与移植相关的不良事件,例如转移性转化和侵入性生长。相反地,如果没有观察到生物标志物表达水平的改变或降低,则可以指示细胞群的施用适合性。可以基于这种方法的实践和本文所述的试剂盒的使用来进行关于MSC移植的治疗决定。
这些在这里进一步详细讨论。
2.SEN-MSC和SR-MSC
本文提供了用于在将包含MSC的样品暴露于IL-2时测量生物标志物表达水平的方法,其中生物标志物指示细胞衰老。如本文所用,SEN MSC是那些复制性衰老的细胞。复制性衰老的特征在于生长停滞,细胞凋亡抗性,高水平的代谢活性,形态和细胞大小改变,肿瘤抑制物P16,P21,P53和/或 RB的高水平表达,衰老相关β-半乳糖苷酶(SA-β-gal)活性增加和丧失合成和修复DNA的能力。MSC的复制性老化可影响其生物学特性。
另一方面,SR-MSC与生殖力有关:表达一组指示质量的编码或非编码 RNA;自我更新;不衰老;没有接近衰老;已经传代6次或更少;展现出高增长潜力;产生感兴趣的蛋白质;允许长期的组织再生;诱导疾病的长期矫正;没有或只有很小的永生化机会;没有呈现或低致瘤潜力;并包含很少或不包含前病毒整合。在示例性变化中,生产性干细胞是自我更新的。在一些变化中,生产性干细胞表现出至少2、3、4、5种或更多与生殖力有关的特征。
3.感兴趣的生物标志物的检测
本文所述的伴随方法依赖于测量来自与细胞衰老相关的生物标志物组的至少两种生物标志物的表达水平,例如所述组可以包含抗凋亡、血管生成、致瘤性、导致血管发育,负责用于侵入性生长、转移、细胞运动、迁移等的生物标志物。通常,如果使用IL-2疗法或移植MSC可导致不良事件,则所述方法提供对标志物的测量以作出确定。如本文所用,IL-2治疗或MSC移植后的不良事件包括但不限于肿瘤发生、抗凋亡活性、血管生成、血管发育、侵入性生长、转移、细胞运动和迁移的增加。
如本文所提供的,响应于IL-2而被上调的与细胞衰老相关的生物标志物可以包括表1-4、表5B和图7A-7D中列举的。
在一些变化中,该方法包括测量生物标志物的RNA水平。这些方法是本领域技术人员已知的,包括但不限于使用Q-PCR,基于阵列的技术,RNA-seq,转录组分析,单细胞转录组分析和原位杂交。
在一些变化中,该方法包括测量生物标志物的蛋白质水平。这些方法是本领域技术人员已知的,并且包括但不限于使用ELISA测定,蛋白质组阵列,免疫组织化学,蛋白质印迹,质谱(MS),抗体阵列或化学发光测定法。
在一些变化中,该方法包括测量生物标志物的RNA和蛋白质水平。
测量生物标志物,并与参照水平进行比较。如本文所考虑的,参照水平可以包含来自IL-2治疗前相同个体的样品;可以包含来自尚未接受任何IL-2 的健康个体的样品;或者可以包含代表尚未接受IL-2治疗的异质性个体组的样品的集合。
在具体变化中,如果显示至少1.1、至少1.2、至少1.3、至少1.4、至少 1.5、至少2、至少3、至少4、至少5、至少6、至少7、至少8、至少9、至少10、至少15、至少20、至少25、至少50、至少75或甚至至少比生物标志物的参照水平高100倍的表达,则确定生物标志物的RNA表达水平增加。倍数通常可以指使用本领域技术人员已知的算法计算的原始倍数值,GFOLD 值或倍数值。
可以使用GFOLD计算方法(Feng et al,Bioinformatics.2012)来测量基因表达中的RNA依赖性差异,以估计考虑了RNA-seq的基因表达测量的不确定性的倍数变化。在这些变化中,GFOLD的使用允许基因表达的相对差异,并便于比较具有不同表达水平或不同长度的基因。
在具体变化中,如果显示至少1.1、至少1.2、至少1.3、至少1.4、至少 1.5、至少2、至少3、至少4、至少5、至少6、至少7、至少8、至少9、至少10、至少15、至少20、至少25、至少50、至少75或甚至至少比生物标志物的参照水平高100倍的表达,则确定生物标志物的蛋白质表达水平增加。
4.感兴趣的生物标志物的鉴定
如本文所提到的,“生物标志物”是指任何感兴趣的生物分子(或其片段),例如,存在于细胞质,表面或分泌出的生物标志物。这样的生物标记物包括但不限于包含多肽,蛋白质,碳水化合物,脂质,糖蛋白,核糖核蛋白,脂蛋白,糖脂及其片段的生物分子。当生物标志物包含蛋白质时,蛋白质可以是分泌蛋白质,细胞内蛋白质或膜蛋白质。生物标记蛋白包括但不限于肽,多肽,糖蛋白,脂蛋白,细胞因子,生长因子,抗体和其它免疫原性分子。例如,生物标志物也可以是跨膜蛋白质或例如可以与跨膜蛋白质或膜脂质结合。
如本文所提供的,响应于IL-2而上调的与细胞衰老相关的生物标志物是在表1-4,表5B和图7A-7D中列举的那些。
在一些变化中,所述方法包括测量在一些变化中至少3、至少4、至少5、至少6、至少7、至少8、至少9、至少10、至少11、至少12种,至少13种,至少14种,至少15种,至少16种,至少17种,至少18种,至少19种或甚至至少20种来自生物标志物组的用于确定潜在的与基于IL-2的治疗剂相关的不良事件和/或用于确定MSC群用于移植的的适合性的生物标志物。
在一些变化中,测量选自表1-4中呈现的任何生物标志物的至少两种生物标志物的表达水平。在一些变化中,测量图7A-7D中至少两种生物标志物的表达水平。在一些变化中,测量表5B中呈现的至少两种生物标志物的表达水平。
在一个变化中,在所测量的至少两种生物标志物中,其中第一生物标志物是TIE-1,第二生物标志物选自TIE-2、TIMP-4、FGF1、LIF、TGFBR2、 CSF1、TGFα、TGFβ1、IL17D、SDF2、TGFBRAP1、FGF11、TNFSF13B、 FGF14、IL1β、IL-11、IL-32、IL-6、IL1RN、IL-20RB、IL-21R、PLAU、 GNB2L1、PLEKHA6、CTSB、FERMT1、CRMP1、VEGFB、VEGFA和 PLEKHA1。
在一个变化中,在所测量的至少两种生物标志物中,其中第一生物标志物是TIE-2,第二生物标志物选自TIE-1、TIMP-4、FGF1、LIF、TGFBR2、 CSF1、TGFα、TGFβ1、IL17D、SDF2、TGFBRAP1、FGF11、TNFSF13B、FGF14、IL1β、IL-11、IL-32、IL-6、IL1RN、IL-20RB、IL-21R、PLAU、 GNB2L1、PLEKHA6、CTSB、FERMT1、CRMP1、VEGFB、VEGFA和 PLEKHA1。在一个变化中,测量至少两种生物标志物的表达水平,其中第一生物标志物是TIE-1,第二生物标志物选自TIE-1、TIE-2、TIMP-4、FGF1、 LIF、TGFBR2、CSF1、TGFα、TGFβ1、IL17D、SDF2、TGFBRAP1、FGF11、 TNFSF13B、FGF14、IL1β、IL-11、IL-32、IL-6、IL1RN、IL-20RB、IL-21R、 PLAU、GNB2L1、PLEKHA6、CTSB、FERMT1、CRMP1、VEGFB、VEGFA 和PLEKHA1。
在一个变化中,在所测量的至少两种生物标志物中,其中第一生物标志物是TIMP-4,第二生物标志物选自TIE-1、TIE-2、FGF1、LIF、TGFBR2、 CSF1、TGFα、TGFβ1、IL17D、SDF2、TGFBRAP1、FGF11、TNFSF13B、 FGF14、IL1β、IL-11、IL-32、IL-6、IL1RN、IL-20RB、IL-21R、PLAU、 GNB2L1、PLEKHA6、CTSB、FERMT1、CRMP1、VEGFB、VEGFA和 PLEKHA1。
在一个变化中,在所测量的至少两种生物标志物中,其中第一生物标志物是FGF1,第二生物标志物选自TIE-1、TIE-2、TIMP-4、LIF、TGFBR2、 CSF1、TGFα、TGFβ1、IL17D、SDF2、TGFBRAP1、FGF11、TNFSF13B、 FGF14、IL1β、IL-11、IL-32、IL-6、IL1RN、IL-20RB、IL-21R、PLAU、 GNB2L1、PLEKHA6、CTSB、FERMT1、CRMP1、VEGFB、VEGFA和 PLEKHA1。
在一个变化中,在所测量的至少两种生物标志物中,其中第一生物标志物是LIF,第二生物标志物选自TIE-1、TIE-2、TIMP-4、FGF1、TGFBR2、 CSF1、TGFα、TGFβ1、IL17D、SDF2、TGFBRAP1、FGF11、TNFSF13B、FGF14、IL1β、IL-11、IL-32、IL-6、IL1RN、IL-20RB、IL-21R、PLAU、 GNB2L1、PLEKHA6、CTSB、FERMT1、CRMP1、VEGFB、VEGFA和 PLEKHA1。
在一个变化中,在所测量的至少两种生物标志物中,其中第一生物标志物是TGFBR2,第二生物标志物选自TIE-1、TIE-2、TIMP-4、FGF1、LIF、 CSF1、TGFα、TGFβ1、IL17D、SDF2、TGFBRAP1、FGF11、TNFSF13B、 FGF14、IL1β、IL-11、IL-32、IL-6、IL1RN、IL-20RB、IL-21R、PLAU、 GNB2L1、PLEKHA6、CTSB、FERMT1、CRMP1、VEGFB、VEGFA和 PLEKHA1。
在一个变化中,在所测量的至少两种生物标志物中,其中第一生物标志物是CSF1,第二生物标志物选自TIE-1、TIE-2、TIMP-4、FGF1、LIF、TGFBR2、 TGFα、TGFβ1、IL17D、SDF2、TGFBRAP1、FGF11、TNFSF13B、FGF14、 IL1β、IL-11、IL-32、IL-6、IL1RN、IL-20RB、IL-21R、PLAU、GNB2L1、 PLEKHA6、CTSB、FERMT1、CRMP1、VEGFB、VEGFA和PLEKHA1。
在一个变化中,在所测量的至少两种生物标志物中,其中第一生物标志物是TGFα,并且第二生物标志物选自TIE-1、TIE-2、TIMP-4、FGF1、LIF、 TGFBR2、CSF1、TGFβ1、IL17D、SDF2、TGFBRAP1、FGF11、TNFSF13B、 FGF14、IL1β、IL-11、IL-32、IL-6、IL1RN、IL-20RB、IL-21R、PLAU、 GNB2L1、PLEKHA6、CTSB、FERMT1、CRMP1、VEGFB、VEGFA和 PLEKHA1。
在一个变化中,在所测量的至少两种生物标志物中,其中第一生物标志物是TGFβ1,并且第二生物标志物选自TIE-2、TIMP-4、FGF1、LIF、TGFBR2、 CSF1、TGFα、IL17D、SDF2、TGFBRAP1、FGF11、TNFSF13B、FGF14、 IL1β、IL-11、IL-32、IL-6、IL1RN、IL-20RB、IL-21R、PLAU、GNB2L1、 PLEKHA6、CTSB、FERMT1、CRMP1、VEGFB、VEGFA和PLEKHA1。
在一个变化中,在所测量的至少两种生物标志物中,其中第一生物标志物是IL17D,第二生物标志物选自TIE-1、TIMP-4、FGF1、LIF、TGFBR2、 CSF1、TGFα、TGFβ1、SDF2、TGFBRAP1、FGF11、TNFSF13B、FGF14、 IL1β、IL-11、IL-32、IL-6、IL1RN、IL-20RB、IL-21R、PLAU、GNB2L1、 PLEKHA6、CTSB、FERMT1、CRMP1、VEGFB、VEGFA和PLEKHA1。
在一个变化中,在所测量的至少两种生物标志物中,其中第一生物标志物是SDF2,第二生物标志物选自TIE-1、TIE-2、TIMP-4、FGF1、LIF、TGFBR2、 CSF1、TGFα、TGFβ1、IL17D、TGFBRAP1、FGF11、TNFSF13B、FGF14、 IL1β、IL-11、IL-32、IL-6、IL1RN、IL-20RB、IL-21R、PLAU、GNB2L1、 PLEKHA6、CTSB、FERMT1、CRMP1、VEGFB、VEGFA和PLEKHA1。
在一个变化中,在所测量的至少两种生物标志物中,其中第一生物标志物是TGFBRAP1,第二生物标志物选自TIE-1、TIE-2、FGF1、LIF、TGFBR2、 CSF1、TGFα、TGFβ1、IL17D、SDF2、FGF11、TNFSF13B、FGF14、IL1β、 IL-11、IL-32、IL-6、IL1RN、IL-20RB、IL-21R、PLAU、GNB2L1、PLEKHA6、 CTSB、FERMT1、CRMP1、VEGFB、VEGFA和PLEKHA1。
在一个变化中,在所测量的至少两种生物标志物中,其中第一生物标志物是FGF11,第二生物标志物选自TIE-1、TIE-2、TIMP-4、LIF、TGFBR2、 CSF1、TGFα、TGFβ1、IL17D、SDF2、TGFBRAP1、TNFSF13B、FGF14、 IL1β、IL-11、IL-32、IL-6、IL1RN、IL-20RB、IL-21R、PLAU、GNB2L1、 PLEKHA6、CTSB、FERMT1、CRMP1、VEGFB、VEGFA和PLEKHA1。
在一个变化中,在所测量的至少两种生物标志物中,其中第一生物标志物是TNFSF13B,并且第二生物标志物选自TIE-1、TIE-2、TIMP-4、FGF1、 TGFBR2、CSF1、TGFα、TGFβ1、IL17D、SDF2、TGFBRAP1、FGF11、FGF14、 IL1β、IL-11、IL-32、IL-6、IL1RN、IL-20RB、IL-21R、PLAU、GNB2L1、 PLEKHA6、CTSB、FERMT1、CRMP1、VEGFB、VEGFA和PLEKHA1。
在一个变化中,在所测量的至少两种生物标志物中,其中第一生物标志物是FGF14,第二生物标志物选自TIE-1、TIE-2、TIMP-4、FGF1、LIF、CSF1、 TGFα、TGFβ1、IL17D、SDF2、TGFBRAP1、FGF11、TNFSF13B、IL1β、IL-11、 IL-32、IL-6、IL1RN、IL-20RB、IL-21R、PLAU、GNB2L1、PLEKHA6、 CTSB、FERMT1、CRMP1、VEGFB、VEGFA和PLEKHA1。
在一个变化中,在所测量的至少两种生物标志物中,其中第一生物标志物是IL1β,第二生物标志物选自TIE-1、TIE-2、TIMP-4、FGF1、LIF、TGFBR2、 TGFα、TGFβ1、IL17D、SDF2、TGFBRAP1、FGF11、TNFSF13B、FGF14、 IL-11、IL-32、IL-6、IL1RN、IL-20RB、IL-21R、PLAU、GNB2L1、PLEKHA6、 CTSB、FERMT1、CRMP1、VEGFB、VEGFA和PLEKHA1。
在一个变化中,在所测量的至少两种生物标志物中,其中第一生物标志物是IL-11,第二生物标志物选自TIE-1、TIE-2、TIMP-4、FGF1、LIF、TGFBR2、CSF1、TGFβ1、IL17D、SDF2、TGFBRAP1、FGF11、TNFSF13B、FGF14、 IL1β、IL-32、IL-6、IL1RN、IL-20RB、IL-21R、PLAU、GNB2L1、PLEKHA6、 CTSB、FERMT1、CRMP1、VEGFB、VEGFA和PLEKHA1。
在一个变化中,在所测量的至少两种生物标志物中,其中第一生物标志物是IL-32,第二生物标志物选自TIE-2、TIMP-4、FGF1、LIF、TGFBR2、 CSF1、TGFα、IL17D、SDF2、TGFBRAP1、FGF11、TNFSF13B、FGF14、 IL1β、IL-11、IL-6、IL1RN、IL-20RB、IL-21R、PLAU、GNB2L1、PLEKHA6、 CTSB、FERMT1、CRMP1、VEGFB、VEGFA和PLEKHA1。
在一个变化中,在所测量的至少两种生物标志物中,其中第一生物标志物是IL-6,第二生物标志物选自TIE-1、TIMP-4、FGF1、LIF、TGFBR2、CSF1、 TGFα、TGFβ1、SDF2、TGFBRAP1、FGF11、TNFSF13B、FGF14、IL1β、 IL-11、IL-32、IL1RN、IL-20RB、IL-21R、PLAU、GNB2L1、PLEKHA6、 CTSB、FERMT1、CRMP1、VEGFB、VEGFA和PLEKHA1。
在一个变化中,在所测量的至少两种生物标志物中,其中第一生物标志物是IL1RN,并且第二生物标志物选自TIE-1、TIE-2、TIMP-4、FGF1、LIF、 TGFBR2、CSF1、TGFα、TGFβ1、IL17D、TGFBRAP1、FGF11、TNFSF13B、 FGF14、IL1β、IL-11、IL-32、IL-6、IL-20RB、IL-21R、PLAU、GNB2L1、 PLEKHA6、CTSB、FERMT1、CRMP1、VEGFB、VEGFA和PLEKHA1。
在一个变化中,在所测量的至少两种生物标志物中,其中第一生物标志物是IL-20RB,第二生物标志物选自TIE-1、TIE-2、FGF1、LIF、TGFBR2、 CSF1、TGFα、TGFβ1、IL17D、SDF2、FGF11、TNFSF13B、FGF14、IL1β、 IL-11、IL-32、IL-6、IL1RN、IL-21R、PLAU、GNB2L1、PLEKHA6、CTSB、 FERMT1、CRMP1、VEGFB、VEGFA和PLEKHA1。
在一个变化中,在所测量的至少两种生物标志物中,其中第一生物标志物是IL-21R,第二生物标志物选自TIE-1、TIE-2、TIMP-4、LIF、TGFBR2、 CSF1、TGFα、TGFβ1、IL17D、SDF2、TGFBRAP1、TNFSF13B、FGF14、 IL1β、IL-11、IL-32、IL-6、IL1RN、IL-20RB、PLAU、GNB2L1、PLEKHA6、 CTSB、FERMT1、CRMP1、VEGFB、VEGFA和PLEKHA1。
在一个变化中,在所测量的至少两种生物标志物中,其中第一生物标志物是PLAU,第二生物标志物选自TIE-1、TIE-2、TIMP-4、FGF1、TGFBR2、 CSF1、TGFα、TGFβ1、IL17D、SDF2、TGFBRAP1、FGF11、FGF14、IL1β、IL-11、IL-32、IL-6、IL1RN、IL-20RB、IL-21R、GNB2L1、PLEKHA6、CTSB、 FERMT1、CRMP1、VEGFB、VEGFA和PLEKHA1。
在一个变化中,在所测量的至少两种生物标志物中,其中第一生物标志物是GNB2L1,第二生物标志物选自TIE-1、TIE-2、TIMP-4、FGF1、LIF、 CSF1、TGFα、TGFβ1、IL17D、SDF2、TGFBRAP1、FGF11、TNFSF13B、 IL1β、IL-11、IL-32、IL-6、IL1RN、IL-20RB、IL-21R、PLAU、PLEKHA6、 CTSB、FERMT1、CRMP1、VEGFB、VEGFA和PLEKHA1。
在一个变化中,在所测量的至少两种生物标志物中,其中第一生物标志物是PLEKHA6,第二生物标志物选自TIE-1、TIE-2、TIMP-4、FGF1、LIF、 TGFBR2、TGFα、TGFβ1、IL17D、SDF2、TGFBRAP1、FGF11、TNFSF13B、 FGF14、IL-11、IL-32、IL-6、IL1RN、IL-20RB、IL-21R、PLAU、GNB2L1、 CTSB、FERMT1、CRMP1、VEGFB、VEGFA和PLEKHA1。
在一个变化中,在所测量的至少两种生物标志物中,其中第一生物标志物是CTSB,第二生物标志物选自TIE-1、TIMP-4、FGF1、LIF、TGFBR2、 CSF1、TGFα、TGFβ1、SDF2、TGFBRAP1、FGF11、TNFSF13B、FGF14、 IL1β、IL-11、IL-32、IL1RN、IL-20RB、IL-21R、PLAU、GNB2L1、PLEKHA6、 FERMT1、CRMP1、VEGFB、VEGFA和PLEKHA1。
在一个变化中,在所测量的至少两种生物标志物中,其中第一生物标志物是FERMT1,并且第二生物标志物选自TIE-1、TIE-2、TIMP-4、FGF1、 LIF、TGFBR2、CSF1、TGFα、TGFβ1、IL17D、TGFBRAP1、FGF11、TNFSF13B、 FGF14、IL1β、IL-11、IL-32、IL-6、IL-20RB、IL-21R、PLAU、GNB2L1、PLEKHA6、CTSB、CRMP1、VEGFB、VEGFA和PLEKHA1。
在一个变化中,在所测量的至少两种生物标志物中,其中第一生物标志物是CRMP1,第二生物标志物选自TIE-1、TIE-2、FGF1、LIF、TGFBR2、 CSF1、TGFα、TGFβ1、IL17D、SDF2、FGF11、TNFSF13B、FGF14、IL1β、 IL-11、IL-32、IL-6、IL1RN、IL-21R、PLAU、GNB2L1、PLEKHA6、CTSB、 FERMT1、VEGFB、VEGFA和PLEKHA1。
在一个变化中,在所测量的至少两种生物标志物中,其中第一生物标志物是VEGFB,第二生物标志物选自TIE-1、TIE-2、TIMP-4、LIF、TGFBR2、 CSF1、TGFα、TGFβ1、IL17D、SDF2、TGFBRAP1、TNFSF13B、FGF14、 IL1β、IL-11、IL-32、IL-6、IL1RN、IL-20RB、PLAU、GNB2L1、PLEKHA6、CTSB、FERMT1、CRMP1、VEGFA和PLEKHA1.
在一个变化中,在所测量的至少两种生物标志物中,其中第一生物标志物是VEGFA,第二生物标志物选自TIE-1、TIE-2、TIMP-4、FGF1、TGFBR2、 CSF1、TGFα、TGFβ1、IL17D、SDF2、TGFBRAP1、FGF11、FGF14、IL1β、 IL-11、IL-32、IL-6、IL1RN、IL-20RB、IL-21R、GNB2L1、PLEKHA6、CTSB、 FERMT1、CRMP1、VEGFB和PLEKHA1
在一个变化中,在所测量的至少两种生物标志物中,其中第一生物标志物是PLEKHA1,第二生物标志物选自TIE-1、TIE-2、TIMP-4、FGF1、LIF、 CSF1、TGFα、TGFβ1、IL17D、SDF2、TGFBRAP1、FGF11、TNFSF13B、 IL1β、IL-11、IL-32、IL-6、IL1RN、IL-20RB、IL-21R、PLAU、PLEKHA6、 CTSB、FERMT1、CRMP1、VEGFB和VEGFA.
在本文提供的其他变化中,在所测量的至少两种生物标志物中,至少一种生物标志物是导致血管发育的因子,包括涉及血管发育和与血管生成相关的重塑的因子,例如TIE-1、TIE-2、TIMP-4、VEGFA、VEGFB、FBLN5、 FBLN7、PGF、ANGPT1、ANGPT2、ANGPTL2、ANGPTL6、TNFSF12、PRKCA、 PIK3CA和ESM1。
在本文提供的一些变化中,测量的至少两种生物标志物中,至少一种生物标志物是抗炎或免疫调节因子,例如CD99、CERCAM、HIVEP1、PTGER1、 IL-32、ITFG1、ITGAV、HIVEP2、CSF1R、TNFSF13、IRAK3、MYL9、 NOS3、IL12A、TNFRSF21、IRAK1、IL33、LRRC8A、CLEC11A、 CCL28、ESM1、CMIP、TNFRSF25、CHST3、CD72、CD320、CD83、 IL6、CD68、CD99、IL-16或ILF3。该方法可以进一步包括确定KIF14、 CCL2、ILF2、IL7R、PEAR1或IL16表达水平是否降低。
在本文提供的一些变化中,测量的至少两种生物标志物中,至少一种生物标志物是转化生长因子(TGFα,TGFβ1或TGFβ2),转化生长因子β受体TGFBR2或转化生长因子β受体相关蛋白TGFBRAP1。
在本文提供的一些变化中,所测量的至少两种生物标志物中,至少一种生物标志物是细胞运动、迁移和侵入性生长促进因子,例如TIE-1、TIE-2、 TIMP-4、CGNLl、CGREFl、CRMPl、FGD6、TNK2、PTGS1、TNFAIP8、 CTSB、CTSO、FAP、FERMTl、PLEKHA1、PLEKHA6、ROCK1或ROCK2。
在本文提供的一些变化中,在所测量的至少两种生物标志物中,至少一种生物标志物是抗凋亡因子,例如VEGFA、VEGFB、PLEKHA1、PLEKHA6、 CRMPl、FERMY1、CTSB、TGFB1或GNB2L1。
本文提供的一些变化中,另外监测CHD24、CYR61、ILK、NEDD9、 MYL9、PPAP2B、RELN、ICAM2、ICAM3和TLN2的表达水平的降低,因为这些是促进细胞粘附的因子。
在一些变化中,额外测量SIVA1表达水平的降低。
在本文提供的一些变化中,在所测量的至少两种生物标志物中,至少一种生物标志物是白细胞介素,例如IL1b、IL3、IL5、IL6、IL9、IL10、IL12b、 IL18-结合蛋白-α、IL9、IL-11、IL12a、IL12b、IL-4或IL-16。
在本文提供的一些变化中,在所测量的至少两种生物标志物中,至少一种生物标志物是白细胞介素受体,例如IL1Rα、IL1R4、IL10Rβ、IL18Rβ、 IL1R2、IL-21R、IL-2Rβ、IL-2Rγ、IL5Rα、IL1R1、IL1R2或IL1R4。
在本文提供的一些变化中,测量的至少两种生物标志物中,至少一种生物标志物是趋化因子,例如CCL8、CCL13、CCL15、CCL17、CCL18、CCL20、 CCL22、CCL24、CCL26、CXCL9、CXCL11、CCL2、CCL4、CCL5、CCL23、 CCL25、CCL27、CXCL10、CCL23、CXCL16或CCL27。
在本文提供的一些变化中,在所测量的至少两种生物标志物中,至少一种生物标志物是生长因子,激素或生长因子受体例如FGF6、IGF1、IGF2、 LAP、NT3、PDGFAA、PDGFAB、SCF、TGF2、TGFα、TGFβ1、TGFb3、 TNFβ、PDGFRα、PDGFRβ、VEGF、VEGFD、VEGFR、FGF4、FGF9、HGF like、IGFBP 6、PDGFBβ、IFNγ、SDF1α、DR6、ENDOGLIN、ERBB3、FASLG、 GDNF、GITR LG、LEPR、SCFR、SIGLEC 5、TIE-1&2、BDNF、BMP4、 FGF7、IGFBP2、DR6、ANG、CNTF、EGF、EOTAXIN 1、NGFR、ACRP 30、 AGRP、ANGPT2、LEP、NT4、HGF、PRL、SCFR、Fas LG、IGFBP 1或IGFBP 2。
在一个变化中,所述至少两种生物标志物选自生物标志物的集合,其包含TIE-1、TIE-2、TIMP-4、FGF1、LIF、TGFBR2、CSF1、TGFα、TGFβ1、 IL17D、SDF2、TGFBRAP1、FGF11、TNFSF13B、FGF14、IL1β、IL-11、IL-32、 IL-6、IL1RN、IL-20RB、IL-21R、PLAU、GNB2L1、PLEKHA6、CTSB、 FERMT1、CRMP1、VEGFB、VEGFA和PLEKHA1。
在一个变化中,所述方法包括测量至少2、至少3、至少4、至少5、至少6、至少7、至少8、至少9、至少10、至少11、至少12、至少13、至少 14、至少15、至少16、至少17、至少18、至少19或甚至至少20种生物标志物,其选自TIE-1、TIE-2、TIMP-4、FGF1、LIF、TGFBR2、CSF1、TGFα、 TGFβ1、IL17D、SDF2、TGFBRAP1、FGF11、TNFSF13B、FGF14、IL1β、 IL-11、IL-32、IL-6、IL1RN、IL-20RB、IL-21R、PLAU、GNB2L1、PLEKHA6、 CTSB、FERMT1、CRMP1、VEGFB、VEGFA和PLEKHA1。
在一个变化中,测量了TIE-1、TIE-2、TIMP-4、FGF1、LIF、TGFBR2、 CSF1、TGFα、TGFβ1、IL17D、SDF2、TGFBRAP1、FGF11、TNFSF13B、 FGF14、IL1β、IL-11、IL-32、IL-6、IL1RN、IL-20RB、IL-21R、PLAU、 GNB2L1、PLEKHA6、CTSB、FERMT1、CRMP1、VEGFB、VEGFA和PLEKHA1 的水平。
在一个变化中,所述方法包括测量至少2、至少3、至少4、至少5、至少6、至少7或甚至至少8种生物标志物的表达水平,其选自VEGFA、 PLEKHA1、VEGFB、CRMP1、FERMT1、CTSB、PLEKHA6、GNB2L1和 TGFβ1。
在一个变化中,所述方法包括测量VEGFA、PLEKHA1、VEGFB、CRMP1、 FERMT1、CTSB、PLEKHA6、GNB2L1和TGFβ1的表达水平。
在一些变化中,该方法还包括测量SIVA1的水平。当暴露于IL-2时,SIVA1 是在SEN-MSC中观察到减少的少数生物标志物之一。
在一些变化中,测量了选自生物标志物的集合中的至少两种生物标志物的表达,所述集合包含TIE-1、TIE-2、TIMP-4、FGF1、LIF、TGFBR2、CSF1、 TGFα、TGFβ1、IL17D、SDF2、TGFBRAP1、FGF11、TNFSF13B、FGF14、IL1β、IL-11、IL-32、IL-6、IL1RN、IL-20RB、IL-21R、PLAU、GNB2L1、 PLEKHA6、CTSB、FERMT1、CRMP1、VEGFB、VEGFA和PLEKHA1,并测量SIVA1的表达水平。如果确定所述至少两种生物标志物的表达水平相对于参照水平增加,并且相对于参照水平SIVA1的表达水平降低,则确定(1)所述个体具有经历增加的与基于IL-2的疗法相关的的不良事件的可能性;或 (2)MSC群不适用于移植。
在一些变化中,测量了选自生物标志物的集合中的至少两种生物标志物的表达,所述集合包含TIE-1、TIE-2、TIMP-4、FGF1、LIF、TGFBR2、CSF1、 TGFα、TGFβ1、IL17D、SDF2、TGFBRAP1、FGF11、TNFSF13B、FGF14、IL1β、IL-11、IL-32、IL-6、IL1RN、IL-20RB、IL-21R、PLAU、GNB2L1、 PLEKHA6、CTSB、FERMT1、CRMP1、VEGFB、VEGFA和PLEKHA1,并测量SIVA1的表达水平。如果确定所述至少两种生物标志物的表达水平相对于参照水平降低或者不显示变化,并且SIVA1的表达水平相对于参照水平增加,则确定(1)所述个体具有经历增加的与基于IL-2的疗法相关的的不良事件的可能性;或(2)MSC群不适用于移植。
在一些变化中,测量了选自生物标志物的集合中的至少两种生物标志物的表达,所述集合包含VEGFA、PLEKHA1、VEGFB、CRMP1、FERMT1、 CTSB、PLEKHA6、GNB2L1和TGFβ1,并测量SIVA1的表达水平。如果确定所述至少两种生物标志物的表达水平相对于参照水平增加,并且相对于参照水平SIVA1的表达水平降低,则确定(1)所述个体具有经历增加的与基于 IL-2的疗法相关的的不良事件的可能性;或(2)MSC群不适用于移植。
在一些变化中,测量了选自生物标志物的集合中的至少两种生物标志物的表达,所述集合包含TIE-1、TIE-2、TIMP-4、VEGFA、PLEKHA1、VEGFB、 CRMP1、FERMT1、CTSB、PLEKHA6、GNB2L1和TGFβ1,并测量SIVA1 的表达水平。如果确定所述至少两种生物标志物的表达水平相对于参照水平减少或未呈现变化,并且相对于参照水平SIVA1的表达水平增加,则确定(1) 所述个体具有经历增加的与基于IL-2的疗法相关的的不良事件的可能性;或 (2)MSC群不适用于移植。
在本发明的具体变化中,与参照水平(未用IL-2处理的样品)相比,在IL-2 处理后,样品中TGFβ1生物标志物的RNA表达水平降低了约0.25倍。倍数可以是原始倍数或GFOLD值。
在本发明的具体变化中,与参照水平(未用IL-2处理的样品)相比,在IL-2 处理后,样品中SIVA1生物标志物的RNA表达水平降低约0.2倍。倍数可以是原始倍数或GFOLD值。
在本发明的具体变化中,与参照水平(未用IL-2处理的样品)相比,在IL-2 处理后,样品中CRMP1生物标志物的RNA表达水平增加约至少0.22倍。倍数可以是原始倍数或GFOLD值。
在本发明的具体变化中,与参照水平(未用IL-2处理的样品)相比,在IL-2 处理后,样品中VEGFB生物标志物的RNA表达水平增加了约至少0.19倍。倍数可以是原始倍数或GFOLD值。
在本发明的具体变化中,与参照水平(未用IL-2处理的样品)相比,在IL-2 处理后,样品中VEGFA生物标志物的RNA表达水平增加至少约1.5倍或约 1.78倍。倍数可以是原始倍数或GFOLD值。
在本发明的具体变化中,与参照水平(未用IL-2处理的样品)相比,IL-2 处理后,样品中PLEKHA1生物标志物的RNA表达水平增加至少约0.46倍。倍数可以是原始倍数或GFOLD值。
在本发明的具体变化中,与参照水平(未用IL-2处理的样品)相比,在IL-2 处理后,样品中CTSB生物标志物的RNA表达水平增加至少约.25倍。倍数可以是原始倍数或GFOLD值。
在本发明的具体变化中,在IL-2治疗后,TGFβ1的RNA表达水平降低约-0.25GFOLD,而SIVA1降低约-0.2GFOLD,并且在相同条件下CRMP1 的水平增加约0.22GFOLD,VEGFB增加约0.19GFOLD,VEGFA增加约1.78 GFOLD,PLEKHA1增加约0.459GFOLD,CTSB增加约0.25GFOLD。
在本发明的具体变化中,在IL-2处理后,相比参照水平(未用IL-2处理的样品),样品中TIE-1生物标志物的蛋白质表达水平增加约至少2倍,至少 3倍或约3.73倍。
在本发明的具体变化中,在IL-2处理后,相比参照水平(未用IL-2处理的样品),样品中TIE-2生物标志物的蛋白质表达水平增加约至少2倍、至少 3倍、至少4倍、至少5倍或约5.24倍。
在本发明的具体变化中,在IL-2处理后,相比参照水平(未用IL-2处理的样品),样品中TIMP-4生物标志物的蛋白质表达水平增加约至少2倍、至少3倍、至少4倍或约4.31倍。
在本发明的具体变化中,在IL-2处理后,相比参照水平(未用IL-2处理的样品),样品中IL-11生物标志物的蛋白质表达水平增加约至少1.1倍、至少1.2倍、至少1.3倍、至少1.4或约1.42倍。
在本发明的具体变化中,在IL-2处理后,相比参照水平(未用IL-2处理的样品),样品中IL1β生物标志物的蛋白质表达水平增加约至少1.1倍或约 1.14倍。
在本发明的具体变化中,在IL-2处理后,相比参照水平(未用IL-2处理的样品),样品中TGFα生物标志物的蛋白质表达水平增加约至少1.5倍、至少2倍或约2.4倍。
在本发明的具体变化中,在IL-2处理后,相比参照水平(未用IL-2处理的样品),样品中TGFβ1生物标志物的蛋白质表达水平增加约至少1.1倍、至少1.2倍、至少1.3倍、至少1.4倍或约1.44倍。
在本发明的具体变化中,相比参照水平,在样品中,TIE-1生物标志物的蛋白质表达水平增加约3.73倍,TIE-2的蛋白质表达水平增加约5.24倍, TIMP-4的蛋白质表达水平增加约4.31倍,IL-11的蛋白表达水平增加约1.42 倍,IL1β的蛋白表达水平增加约1.14倍,TGFα蛋白表达水平增加约2.4倍, TGFβ1增加约1.44倍。
5.IL-2治疗剂的伴随方法
如本文所考虑,IL-2的施用影响分泌特性MSC且IL-2治疗可能导致某些个体的潜在不良结果。基于一些生物标志物产生的特性(如上所述),本文描述了诊断试剂盒,测定法和用于确定有资格接受IL-2的疗法的个体是否可能经历与基于IL-2的疗法相关的不良事件的方法。本文还描述了用IL-2治疗患者的方法。
如本文所用,与基于IL-2的疗法相关的潜在不良事件与细胞衰老有关,并且包括如血管生成、肿瘤发生、血管发育、侵入性生长、转移、细胞运动、迁移等事件。本发明允许确定个体是否可能经历,将经历或有可能经历与基于IL-2的疗法相关的不良事件。在一个变化中,本发明允许确定发生不良事件的可能性增加约10%、20%、30%、40%、50%、60%、70%、80%、90%或甚至约100%。
在一个变化中,在对个体样品进行该方法之前,该个体已经接受至少一剂基于IL-2的疗法。在该变化中,用于确定有资格接受基于IL-2的疗法的个体是否可能经历与基于IL-2的疗法相关的不良事件的方法包括:测量来自所述个体的样品中选自指示本文所述的MSC衰老的生物标志物组(该生物标志物组是抗凋亡、血管生成、肿瘤生成、导致血管发育、负责侵入性生长、转移、细胞运动、迁移等)的至少两种生物标志物的表达水平,其中所述个体已接受至少一剂基于IL-2的疗法;并将生物标志物的水平与参照水平进行比较,其中参照水平以上的水平增加表明个体可能经历与基于IL-2的疗法相关的不良事件,并且其中与参照水平相比水平的降低或不改变表明个体可能不会经历与基于IL-2的疗法相关的不良事件。
在另一个变化中,获得来自个体的样品,并在体外暴露于(与其一起温育、结合等)IL-2。在该变化中,用于确定有资格接受基于IL-2的疗法的个体是否可能经历与基于IL-2的疗法相关的不良事件的方法包括:测量来自所述个体的样品中选自指示MSC衰老的生物标志物组的至少两种生物标志物的表达水平,其中所述个体已接受至少一剂基于IL-2的疗法;并将生物标志物的水平与参照水平进行比较,其中参照水平以上的水平增加表明个体可能经历与基于IL-2的疗法相关的不良事件,并且其中与参照水平相比水平的降低或不改变表明个体可能不会经历与基于IL-2的疗法相关的不良事件。
在另一个变化中,该方法涉及用基于IL-2的疗法来治疗个体的癌症,该方法包括在来自个体中的生物样品中相比参照水平至少两种生物标志物的表达水平增加时,对个体施用有效量的基于IL-2的疗法,其中(1)个体已接受至少一剂基于IL-2的疗法或(2)样品在体外与IL-2组合并且其中所述生物标志物组包含用于细胞衰老的生物标志物。
如果生物标志物以升高的水平存在,则表明存在SEN MSC的存在,并且表明用IL-2进一步治疗可能导致不利影响(例如促进个体中的肿瘤生成,侵入或转移)的可能性。在此基础上,可以确定个体不应该接受基于IL-2的疗法。或者,如果在实施这些方法时,确定基于IL-2的疗法的使用可能不会导致不利影响(例如可能不促进肿瘤生成、侵入或转移),基于一组特定生物标志物的表达,则可以确定施用基于IL-2的疗法是可接受的,并且任选地将施用基于 IL-2的疗法。
本文所使用的,“基于IL-2的疗法”是涉及单独施用IL-2或与另一种试剂组合施用IL-2的疗法。IL-2的施用考虑单独施用IL-2的活性部分或与其它基序融合。基于IL-2的疗法可以通过任何形式的注射施用,包括静脉内(IV),肌肉内(IM)或透皮或皮下(SC)注射;通过口腔或鼻腔途径;或通过局部施用(霜剂,滴剂等)。在本发明的具体变化中,IL-2用作持续释放制剂或使用持续释放装置施用的制剂。这样的装置在本领域中是公知的,并且包括例如透皮贴剂和微型可植入泵,其可以以连续,稳态的方式随时间以各种剂量提供药物递送以实现持续释放效果。舌下或滴眼剂也可以考虑。
如本文所提供的,用于表达分析的样品可以是任何样品,包括但不限于组织、活检、血液、血浆、血清、尿液、唾液、CSF、粪便、淋巴液、精液和汗液。在具体的变化中,样品是血液、血浆或血清样品;在一个示例性的变化中,样本是血液。不受任何理论束缚,因为MSC位于血管周围区室中,MSC响应于IL-2施用产生的因子可以是全身/循环的,并且可以容易地在血液样品中测量。
在本文提供的变化中,样品的表达水平可以在基于IL-2的疗法施用至个体之后的任何时间或在IL-2的体外混合后(单独将IL-2的活性部分或与其他基序融合的IL-2的活性部分与样品混合)的任何时间测量,例如,其后的15 分钟、30分钟、1小时、2、3、4、6、12、15、24、36、48、72或甚至96 小时。
在一些变化中,在测量之前对个体施用多剂量的基于IL-2的疗法。在一些变化中,在测量之前,对个体施用单剂量的基于IL-2的疗法。通常,IL-2 的剂量取决于具体的IL-2产物选择。可以施用大约0.001至0.1mg/kg患者体重;在一些变化中,可以施用约0.005、0.01、0.05mg/kg。在一些变化中,施用600,000IU/kg(IU可以通过淋巴细胞增殖生物测定来确定,并且以世界卫生组织第一国际标准确立的人IL-2的国际单位(IU)表示)。在一些变化中,IL-2 的剂量范围为0.01MIU/天到3.0MIU/天/患者(MIU是百万国际单位)。基于IL-2 的疗法可以每天施用一次或多次至每周施用一次或多次;包括每两天一次。本领域的技术人员能够理解,某些因素可能影响有效治疗受试者所需的剂量和时间,包括但不限于疾病或病症的严重程度、先前的治疗、受试者的一般健康和/或年龄以及存在的其他疾病。而且,用治疗有效量的IL-2治疗受试者可以包括单次治疗,或者可以包括一系列治疗。在一个变化中,组合物每8 小时施用5天,然后休息2至14天,例如9天,然后每8小时再施用额外5 天。
鉴于基于IL-2的治疗剂广泛用于癌症治疗,本文提供的用于IL-2治疗的伴随方法可特别适合作为癌症的伴随方法。然而,所描述的方法不限于癌症治疗剂,并且适用于IL-2被批准或候选治疗的任何疾病。然而,在一些变化中,个体已经接受了基于IL-2的治疗癌症的疗法。在一些变化中,癌症选自肾细胞癌、黑素瘤、乳腺癌、胰腺癌、卵巢癌、结肠癌、肺癌、非小细胞肺癌、原位癌(ISC)、鳞状细胞癌(SCC)、甲状腺癌、宫颈癌、子宫癌、前列腺癌、睾丸癌、脑癌、膀胱癌、胃癌、肝癌、黑素瘤、神经胶质瘤、成视网膜细胞瘤、间皮瘤、骨髓瘤、淋巴瘤和白血病。在一些实例中,癌症是晚期癌症、转移性癌症或复发性癌症。在其他变化中,IL-2治疗针对与不期望的免疫应答相关或由其引起的任何病况,例如针对炎症、免疫相关或自身免疫性疾病,其包括但不限于HCV相关性血管炎、葡萄膜炎、肌炎、I型糖尿病、系统性红斑狼疮、系统性血管炎、牛皮癣、过敏、哮喘、克罗恩氏病、多发性硬化、类风湿性关节炎、动脉粥样硬化、自身免疫性甲状腺疾病、神经退行性疾病、阿尔茨海默病、移植物抗宿主病、自然流产和异体移植排斥。
在确定个体适合接受基于IL-2的疗法的情况下,可基于样品中检测到的生物标志物的确定水平相对于参考样品改变治疗。基于样品中生物标志物相对于参考样品的确定水平,该方法可用于修饰治疗方案(例如升级剂量或给药方案)。
在特定的变化中,如果确定个体可能不会(例如可能不)经历基于IL-2的疗法的不利影响,然后施用基于IL-2的疗法,则可以随后再次对个体进行测试以监测不利影响。因此,在这种变化中,在治疗之前和一旦开始治疗之前,对个体进行潜在不利影响的可能性进行测试。施用的剂量和方案可以相应调整。例如,用于IL-2治疗的低剂量方案可以在临床上实施。除了在本发明中描述的伴随方法之外,IL-2治疗效果可以通过另外的测量来监测,例如基于 IL-2的疗法对T细胞体内分化的影响。
图1B示出了通过查询MSC的复制性衰老状态使用IL-2治疗患的示例性方法。在该实例中,患者用一个或多个剂量的IL-2 101治疗,并在预定的时间段内(例如,在1小时、2小时、3小时、4小时、5小时、6小时、7小时、 8小时、9小时、10小时、11小时、12小时等的起始时间,和12小时、13 小时、14小时、15小时、16小时、17小时、18小时、19小时、20小时、 21小时、22小时、23小时、24小时、30小时、36小时、42小时、48小时、 72小时或96小时等的终止时间之间),从所述或者取样103。样品可以是如本文提供的任何合适的流体或组织(例如血液、血浆、血清、尿液等)。然后可以检查该样品以检测生物标志物组的存在/不存在和/或水平105。
6.在基于细胞的疗法中使用MSC之前的质量控制
施用(移植)MSC用于多种适应症。本发明的一个重要方面是在施用之前确定哪个MSC适合施用。具体而言,所提供的方法允许在测试时选择适于施用的MSC群,以避免或降低可能是促炎症或否则不利的在体内环境中与移植的MSC相关的抗凋亡,血管生成和致瘤活性的可能性。
因此,本文提供的另一方面是用于评估样品中干细胞的质量和潜力的方法。此类方法和试剂盒在用于个人之前有助于确保MSC群的安全性和质量。
在一个变化中,确定MSC群是否适合施用于个体进行基于干细胞的疗法的方法包括(a)将MSC群与IL-2温育(单独与IL-2的活性部分温育与跟其他基序融合的IL-2的活性部分温育);(b)测量与细胞衰老相关的生物标志物组在细胞中的表达水平,其中生物标志物组是抗细胞凋亡,血管生成,肿瘤生成,导致血管发育,负责侵入性生长、转移、细胞运动性、迁移等;(c)将生物标志物的水平与参照水平进行比较,其中参照水平以上的水平增加表明干细胞对于施用于个体不是最佳的,并且如果施用可能导致不利影响。然而,参照水平以下的水平没有变化或降低可能表明干细胞适合施用于个体。一般而言,通过合适的方式,意在表明细胞很少或不会引起不良事件,例如肿瘤生成、转移促进,抗凋亡等。
在一些变化中,细胞群旨在自体使用。在其他变化中,细胞群旨在用于同种异体使用。在一些变化中,细胞群包含同源的细胞,例如来自单一个体。在一些变化中,细胞群包含异源来源的细胞,例如由多种来源的细胞构成。
在本文提供的变化中,样品的表达水平可以在IL-2温育后的任何时间测量,例如与IL-2温育后15分钟、30分钟、1小时、2、3、4、6、12、15、 24、36、48、72或甚至96小时。
II.试剂盒和制品
本申请还提供了用于测量样品中生物标志物水平的试剂盒。
在一个变化中,本发明的试剂盒用于评估MSC群移植的适宜性。
在另一个变化中,本发明的试剂盒用于确定基于IL-2的疗法是否应施用至有需要的个体。
在一个变化中,试剂盒包含用于测量样品中至少两种生物标志物的RNA 表达水平的试剂。例如,试剂盒可以包含探针或引物,例如,Q-PCR引物,其对选自本文所述的任何生物标志物的至少两种生物标志物具有特异性。
在一个特定的变化方案中,所述试剂盒包括特异性用于测量选自以下的生物标志物的至少两种试剂:TIE-1、TIE-2、TIMP-4、FGF1、FGF11、FGF14、 LIF、TGFBR2、CSF1、TGFα、TGFβ1,IL17D、SDF2、TGFBRAP1、TNFSF13B、 IL1B、IL-11、IL-32、IL-6、IL1RN、IL-20RB、IL-21R、PLAU、GNB2L1、 PLEKHA6、PLEKHA1、CTSB、FERMT1、CRMP1、VEGFB和SIVA1和 VEGFA。在一些变化中,引物包含标签,例如荧光标签。在一些变化中,试剂盒包含至少3、至少4、至少5、至少6、至少7、至少8、至少9、至少10、至少11、至少12、至少12、至少13、至少14、至少15、至少16、至少17、至少18、至少19或甚至至少20种试剂,例如探针或引物,用于测量样品中生物标志物的RNA表达水平。
在其它变化中,试剂盒包含用于测量样品中至少两种生物标志物的蛋白质表达水平的试剂。例如,试剂盒可以包含特异性针对选自以下的至少两种生物标志物的抗体:TIE-1、TIE-2、TIMP-4、FGF1、FGF11、FGF14、LIF、 TGFBR2、CSF1、TGFα、TGFβ1、IL17D、SDF2、TGFBRAP1、TNFSF13B、 IL1B、IL-11、IL-32、IL-6、IL1RN、IL-20RB、IL-21R、PLAU、GNB2L1、 PLEKHA6、PLEKHA1、CTSB、FERMT1、CRMP1、VEGFB和SIVA1和 VEGFA。在一些变化中,抗体包含标签,例如荧光标签。在一些变化中,试剂盒包含阵列或ELISA板,其包含至少3、至少4、至少5、至少6、至少7、至少8、至少9、至少10、至少11、至少12种,至少13、至少14、至少15、至少16、至少17、至少18、至少19种或甚至至少20种试剂,例如抗体,用于测量样品中生物标志物的蛋白质表达水平。
在一些变化中,试剂盒进一步包含IL-2组合物(包含全长IL-2或单独的或融合到其他基序的IL-2的一部分以及样品的组合物)。这种IL-2组合物可以用于体外测试样品或用于施用入个体,以实施本发明的方法。
在一些变化中,试剂盒进一步包含用于测定中使用的参照标准(同时待测试的样品,在相同条件下生成以确定参照水平)。在一些变化中,试剂盒进一步包含用作参照水平的书面值列表,例如来自健康个体群体或未用IL-2治疗的个体的参照水平,其提供针对其可检查结果的参考。
在本文所考虑的一些变化中,试剂盒提供了多种测定方法,用于测量可以平行或连续使用的特定生物标志物的表达水平。例如,试剂盒可以包含具有Q-PCR引物或抗体的三个测定板,一个指向检测生长因子生物标志物,一个指向检测抗凋亡生物标志物,一个指向检测参与细胞运动和迁移的因子。在另一个变化中,试剂盒可以包含三个测定板,用于在三个不同的时间点测定测试样品。可以理解的是,试剂盒可以包含四、五个或更多个这样的板,用于连续或平行检测生物标志物的目的。
本申请还提供了包含本文所述的试剂盒中的任何一种的制品。
应该理解的是,这里使用的术语仅用于描述特定变化的目的,而不是限制性的,因为本发明的范围将仅由所附权利要求及其等同物来限制。下面的例子是为了说明的目的。这些意在表示本发明的某些方面和变化,但不意图以任何方式限制本发明。
实施例
实施例1:材料和方法
这个实施例提供了本发明的示例性方法和实施例2-10中随后使用的材料和方法。
MSC的分离、培养和表征
本研究中使用的MSC是从年龄32岁和49岁的健康成年女性供体获得的人类脂肪组织中分离的,在加利福尼亚州圣地亚哥的UCSD医疗中心进行常规吸脂手术。MSC分离方案经当地伦理委员会批准并按前述方式进行。分离的脂肪来源的干细胞系在DMEM/F12培养基(Life Technologies)中生长。根据国际细胞治疗协会设定的MSC最低定义标准,流式细胞术分析显示hADSC 表达CD29,CD73,CD90和CD105但不表达CD11b,CD14,CD19,CD34, CD45,CD80,CD86(抗体来自eBiosciense,USA)。形态学分析显示,细胞呈现成纤维细胞样形态,是塑料粘附的,并且在使用市售分化培养基 (Invitrogen,USA)的体外条件下能够成脂肪,软骨形成和成骨分化。在多次传代中累积群倍增(PD)计算为PD=log(N/NO)x 3.33,作为培养物生长天数的函数,其中NO是烧瓶中的细胞数,N是在这代收获的细胞数目。在所有实验中使用hADSC PD 4或PD 6SR群和SEN群的PD 41和45。如所述进行重组IL-2(Peprotech,USA)的治疗(Deenick EK,Gett AV,Hodgkin PD(2003).J Immunol 170:4963-4972)。在37℃下将20U/ml的IL-2加入到培养基中24小时。
衰老相关的SA-β半乳糖苷酶测定
如制造商试剂盒(BioVision)中和先前Wang J,Geesman GJ,Hostikka SL, Atallah M,Blackwell B,et al.(2011)Inhibition of activated pericentromeric SINE/ALU repeat transcription in SEN human adult stem cells reinstates self-renewal.Cell cycle 10:3016-3030公开所述实施了监测pH依赖性衰老相关 (3-β-半乳糖苷酶活性(SA-(βGal)表达的测定。培养的hADSC用PBS在室温洗涤15分钟,用PBS洗涤2次,并用含有X-Gal的补充液37℃过夜染色。用PBS洗涤细胞2次,使用显微镜(日本Nikon,TE300,DXM1200数码相机) 拍摄图像。
迁移和侵入测定
Transwell过滤器来自Corning Incorporated(Acton,MA,USA),且使用的所有细胞因子均得自Peprotech Inc.(Rocky Hill,NJ,USA)。如Perez LM, Bernal A,San Martin N,Galvez BG(2013),Arch Physiol Biochem 119:195-201 中所述使用8mm厚的Transwell室进行迁移测定。对于Transwell迁移测定,将1.0×104细胞悬浮于80ul无血清α-MEM中,并接种在含有8mm孔径过滤器的24孔Transwell板的上室中(Corning,Costar,USA)。在下室中,加入 600ul含有细胞因子的DMEM或培养基:添加了IL-2、IL-6、IL-8、TNF-α、 HMGβ1。使用的浓度是:50ng/ml IL-2、IL-6、IL-8和HMGβ1;30ng/ml TNF-α如(Perez et al.,2013,Arch Physiol Biochem 119:195-201)中所述。hADSC在37 ℃温育16h。保留在上室中的细胞通过拭子去除,并且已经迁移通过过滤器的那些在室温用4%多聚甲醛固定20分钟,并用5%甲苯胺蓝染色过夜。细胞在下侧计数;在使用明视野显微镜(Nikons,TE300,DXM1200Digital Camera, Japan)的五个不同的随机选择的10x场视野中。这些实验由两位年龄分别为 32岁和41岁的捐赠者的hADSC完成,其中每个捐赠者采样三次以上。
酶联免疫吸附测定(ELISA)
如之前Deenick EK,Gett AV,Hodgkin PD(2003)Stochastic model of T cell proliferation:a calculus revealing IL-2regulation of precursor frequencies,cell cycle time,and survival.J Immunol 170:4963-4972中所述,将hADSC(SR或 SEN)以105细胞每10cm2培养皿的密度铺板并用20U/mL的IL-2处理24小时,伴随未处理的对照。随后,使用Mem-PER Plus#89842(ThermoFisher Scientific)根据制造商的方案制备细胞膜相关蛋白部分。分别使用人IL-2Rα和人IL-2RβELISA试剂盒#ELH-IL-2Ra和#ELH-IL-2Rb(RayBiotech,Inc) 获得IL-2受体α和β浓度的测量。通过SPECTRA Max Plus(Molecular Devices) 在450nm下测量标准物(重组IL-2受体α和β)以及实验样品的光密度,并如制造商的方案中所述计算浓度。
实时定量聚合酶链式反应
使用RNeasy Mini Kit(Qiagen,Germany)从hADSC分离总RNA。随后使用RevertAid第一链cDNA合成试剂盒(Fermentas,USA)合成cDNA。使用TaqMan仪器进行实时定量聚合酶链式反应(qPCR)。表达水平计算为2-ΔΔCt,其中相对表达通过相对β-肌动蛋白基因表达进行标准化来确定。所有测定一式三份进行,使用无cDNA的阴性对照样品。qPCR的引物如下:
IL-2受体α链(IL-2Rα)正向:5'-CTGCCACTCGGAACACAAC-3'和反向: 5'-TGGTCCACTGGCTGCATT-3'.
IL-2受体β链(IL-2Rβ)正向:5'-ACTCGAGAGCCAACATCTCC-3'和反向:5'-TCCGAGGATCAGGTTGCAG-3'.
IL-2受体γ1链(IL-2Rγ1)正向:5'-TGGATGGGCAGAAACGCTA-3'和反向:5'-GGCTTCCAATGCAAACAGGA-3'.
STAT 5A正向:5'-ACGCAGGACACAGAGAATGA-3'和反向:5'- CTGGGCAAACTGAGCTTGG-3'.
STAT 5B正向:5'-ACACAGCTCCAGAACACGT-3'和反向:5'- TGTTGGCTTCTCGGACCAA-3'.
VEGF A正向:5'-GGAGGAGGGCAGAATCATCA-3'和反向:5'- ATCAGGGGCACACAGGATG-3'。
转录组分析
如之前Deenick EK,Gett AV,Hodgkin PD(2003)Stochastic model of T cell proliferation:a calculus revealing IL-2regulation of precursor frequencies,cell cycle time,and survival.J Immunol 170:4963-4972中所述,用IL-2处理的和未处理的(对照组)SR和SEN-hADSC进行转录组分析。图3A中显示的两种基因型分别用于分析四种不同的条件:SR或SEN细胞,具有或不具有IL-2刺激。对于每个实验条件,将相同量的(106)细胞接种于DMEM F12培养基中,并通过将20U/m1的重组IL-2(Peprotech,USA)直接添加入培养基24小时实施IL-2处理,如之前Deernick et al.2003中所述。根据制造商的说明使用 TRIzol试剂(Invitrogen,USA)从样品中分离总RNA。将来自两个不同患者的样品组合在一起用于相关条件,并使用RNA HS测定试剂盒(Invitrogen,Life technologies,USA),用Qubit 2.0荧光计测量RNA浓度。
按照制造商的说明,使用每个样品100ng的总RNA构建在Ion ProtonTM系统(Life technologies,USA)上进行测序的文库。在rRNA去除和RNA-seq 文库构建之前,将ERCC RNA Spike-In对照混合物(Ambion,Life Technologies) 加入总RNA用于质量控制分析。ERCC RNA Spike-In对照混合物含有长度为 250-2000nt的92个转录物,其模拟天然的真核mRNA。根据制造商提供的方案,将100ng总RNA加入2ul Mix1,其中以1:1000稀释加标。之后,用 Low Input Ribominus Eukaryote System v2(Ambion,Life technologies,USA)进行rRNA消耗。用Ion total RNA-seq kit v2(Ambion,Life technologies,USA)构建cDNA文库,并用Ion Xpress RNA-seq条码(Ambion,Life technologies)进行条码化。在Bioanalyzer 2100(Agilent technologies,USA)上进行文库的大小分布和定量。用P1芯片在Ion ProtonTM系统上进行文库测序,每个文库测序 3次。
RNA-seq数据分析
针对四个条件的每一种组合来自单独的Ion ProtonTM系统测序运行的 RNA-seq读取。使用Torrent Mapping Alignment Program(TMAP,Life technologies)将序列读取映射到参照人类基因组组件hg19(GRCh37)。通过将从制造商的网站获得的ERCC加标RNA序列的预期计数与映射到相同序列的RNA-seq标签的观察到的计数进行比较,评估了四个条件特异性组合的 RNA-seq运行的质量。将初始基因表达水平作为单个NCBI RefSeq基因模型 (c)的外显子映射读取的总和,并且从随后的分析中去除低表达基因(每百万读取计数<1)。对于每个文库,使用β-肌动蛋白(ACTB)表达水平(cACTB)和每个基因的总外显子长度l对单个基因表达水平进行标准化。对于文库j,β肌动蛋白标准化因子sj计算为:
且用于在文库j中基因i中的最终标准化的表达值计算为
使用程序GFOLD v1.1.3,Feng J,Meyer CA,Wang Q,Liu JS,Shirley Liu X, et al.(2012)GFOLD:a generalized fold change for ranking differentially expressed genes from RNA-seq data.Bioinformatics 28:2782-2788进行了成对文库之间的差异基因表达分析。选择GFOLD是基于其在没有重复数据集合的情况下在表征差异表达基因方面表现出的优越性能。GFOLD分析产生的分数可以测量不同条件间基因表达差异的程度;此处推荐的±0.01的GFOLD 分数界限用于定义差异表达的基因。使用GSEA v2.1.0程序对文库对之间的差异表达基因进行功能富集分析。具体而言,以这种方式鉴定了SR、SEN或两者中IL-2处理时含有多个上调或下调的基因的单独的通路。对于差异调节基因的特定集合(SR和/或SEN IL-2+上调的和SR和/或SEN IL-2+下调的) 的单独通路使用网络相关,其中节点对应于通路且边对应于通路之间共享的基因的存在。
图9显示用于RNA-seq实验质量控制的外部RNA控制联合体(ERCC,一组常见的外部RNA对照)剂量响应。对于四个条件特异性RNA-seq集合中的每一个,ERCC加标RNA序列的预期计数针对映射到相同序列的RNA-seq 标签观察到的计数回归。观察到与预期的计数高度相关,如回归形状和 Pearson相关性r值所示,与高质量RNA-seq结果一致。
实施例2:MSC衰老表型的表征
在该实施例中描述了进行评估复制衰老对响应于IL-2信号传导对人脂肪来源的MSC(hADSC)的转录活性的影响的研究。
IL-2通过特异性受体发出信号,具有由三种IL-2R亚基(IL-2Rα(CD25), IL-2Rβ(CD122)和IL-2Rg(CD132))的各种组合形成的三类细胞表面受体。实验结果表明,hADSC转录表达全部三种受体,然而hADSC中IL-2Rα(IL-2Ra) 的蛋白表达低于IL-2Rβ所见。这些观察结果表明由IL-2Rβ和IL-2Rγ同种型组成的IL-2受体组合物可以介导hADSC对IL-2细胞因子识别的主要形式。随着hADSC的复制衰老,受体组成仅轻微改变,表明hADSC对IL-2的响应性在其衰老时不发生改变。
如上所述分离和培养hADSC。离体复制衰老导致增殖减少,DNA损伤积聚和形态学改变:hADSC变大,形状不规则,形态扁平,相差显微镜观察到细胞核变得更加明显,其中胞浆内有许多内含物和累积。图3A显示了来自两个不同患者的hADSC的生长曲线。在线性生长速率SR中,或者当细胞系停止其增殖的SEN中,典型的衰老相关的SA-β半乳糖苷酶活性染色显示在图3B中。
实施例3:SEN-MSC表现出迁移倾向较高
该实施例显示了复制衰老影响hADSC的迁移潜力。使用一系列细胞因子和生长因子,使用Transwell系统进行迁移测定,如下文的材料和方法部分所述。观察到经历复制衰老的脂肪来源的MSC表现出更高的迁移倾向。据观察, SEN-hADSC显示出与其SR对应物相比显着更高的基础迁移能力(图3C)。图 3C显示SR(左)和SEN(右)hADSC的离体迁移测定。黑线表示中值,须线表示值的范围。如所描绘的,通过具有p值(p)的T检验来评估统计学差异。
另外,测量了SEN-hADSC对不同细胞因子化学引诱剂的响应。据观察,与早期传代相比,对于晚期传代hADSC具有提高的迁移能力(图3D),表明复制衰老增加了hADSC响应于测试的化学引诱剂的迁移特性。在这些实验中 IL-2是SEN-MSC上最有效的趋化刺激剂,而在这些实验中,TNF-α在测试化疗-引诱剂中效力较弱(图3D)。图3D显示自我更新SR(左)和衰老 SEN(右)hADSC的迁移。在不同细胞因子(50ng/ml IL-2,IL-6,IL-8,HMGB1; 30ng/ml TNF)存在下诱导hADSC迁移。图形代表十个独立实验的平均值(n= 10)。图中列出了与实验测量相关的P值(p)。
总的来说,这些数据表明复制性衰老改变了hADSC的迁移特性,并可能影响MSC对炎症环境的反应并影响其免疫调节输出。
实施例4:在复制性衰老时人脂肪来源的MSC对Il-2刺激的不同响应
通过Q-PCR评估IL-2受体同种型表达显示,与在离体复制性衰老时IL-2Rγ和IL-2Rβ相比,IL-2Rα同种型的表达显着改变(图4B)。图4B显示了在未刺激的(IL-2)SR细胞(第一条形)和SEN细胞(第三条形)中以及用20ug/ml 重组IL-2(IL-2+)(SR细胞,第二条形;SEN细胞,第四条形)刺激时通过定量PCR(Q-PCR)评估的IL-2受体α,β和γ。数据显示为倍数变化(ΔΔCT)。显示了来自三个独立实验的平均值±SD。值得注意的是,在SR和SEN-hADSC 中IL-2处理后,记录到IL-2Rβ和IL-2Ra转录物的积累增加,而当衰老细胞进行类似处理时,IL-2Ra的表达被消除(图4B)。
然而,数据表明细胞膜相关的IL-2Rα受体的蛋白质水平表达显示出相反的模式(图4C)。图4C显示了IL-2Rα和IL-2Rβ的细胞膜相关的水平。通过 ELISA在未刺激的(IL-2-)SEN(第三条形)和SR(第一条形)hADSC中和用 20ug/ml的重组IL-2(IL-2+)SEN(第四条形)和SR(第二条形)刺激时定量水平。数据表示为每毫升的象形图。结果是三次独立实验的平均值(平均值±SD)。统计显着性通过t检验估计,其中***p<0.001,**p<0.01,*p<0.05。
尽管IL-2受体同种型的转录状态在两种不同的细胞状态(SR和SEN)之间确实不同,但它似乎不依赖于IL-2暴露(诱导),如通过ELISA测定法所测量(描述于材料和方法,上文)。数据还表明,编码IL-2α受体链的蛋白质比IL-2Rβ同种型的丰度低(在离体复制衰老时,比较120pg/ml的IL-2Rα与350pg/ml的 IL-2Rβ对150pg/ml的IL-2Rα和440pg/ml IL-2Rβ),如图4C所示。这些数据表明hADSC对IL-2刺激的应答通过由IL-2Rβ(CD122)和通用IL-2Rγ(CD132) 组成的中间亲和性受体二聚体发生。
IL-2通过JAK1和JAK3信号来激活STAT5A和STAT5B,并另外使用 Ras-MAP激酶和磷酸肌醇3-激酶依赖性信号传导途径。IL-2、STAT5下游靶标的表达见图5、7A和7B以及图10A和10B的表。在hADSC中,STAT5A 和STAT5B基因转录遵循IL-2/STAT5信号轴。
图5说明用IL-2刺激SR和SEN-hADSC的效果。IL-2上调IL-2信号转导STAT5基因的调节物的mRNA。通过定量RT-PCR在未刺激的(IL-2-)SR(第一条形)和SEN细胞(第三条形)和用20ug/ml的重组IL-2(IL-2+)刺激时(SR+ IL-2,第二条形;SEN+IL-2,第三条形)评估STAT5A和STAT5B mRNA表达。数据显示为倍数变化(ΔΔCT)。显示了来自三个独立实验的平均值±SD。图形描绘了Q-PCR引物的位置。统计显着性通过t检验估计,其中***p <0.001,**p<0.01。
接下来研究了IL-2及其下游靶点STAT5如何影响其离体复制衰老时 hADSC的转录结果。
在复制衰老时,暴露于IL-2导致人MCS中的基因表达改变。为了说明离体hADSC复制性老化后对IL-2/STAT5轴的转录响应如何变化,使用Ion ProtonTM系统进行RNA-seq转录组分析,如实施例1所述,并在图8A中显示。在四个条件下(文库)对hADSC中的基因表达水平进行比较:正常离体培养时的自我更新(SR IL-2-),24小时重组IL-2刺激时的自我更新(SR IL-2+),正常离体培养的复制性衰老(SEN IL-2-)和24小时重组IL-2刺激的复制衰老 (SEN IL-2+)。在图8B中示出了代表每个条件的四个条件的总读取计数的分布。
β-肌动蛋白表达水平用于使条件之间的基因表达水平标准化(如实施例1 所述)。采取这种方法是为了考虑到在IL-2处理后总体基因表达水平可能改变的事实。β-肌动蛋白标准化的基因表达分布揭示了在SR和SEN两种状态下 IL-2处理后基因表达的总体上调(图8D)。然而,在四种条件中个体基因表达水平的比较表明与SR-hADSC相比,IL-2处理更显着地影响SEN-(图6A)。图6A示出了基于条件特异性基因表达谱的比较显示条件之间的配对距离的分级群聚。当比较单独的基因表达水平时,随后是SEN IL-2-条件时,SR IL-2- 和SR IL-2+条件组紧密地结合在一起。SEN IL-2+条件是显示个别基因表达水平的基本不同模式的四个条件中的异常值。这表明衰老时hADSC对IL-2 处理的生物学应答可能通过IL-2响应的全局转录失调而显着阻碍MSC功能。
在条件之间进一步比较表达水平,以便鉴定响应于IL-2处理在SR和SEN 状态中而差异表达,上调和下调的单个基因(图6B)。图6B是显示在IL-2处理后上调和下调的基因数目的维恩图。在SR和SEN-hADSC中,与IL-2处理下调(2,296)相比,还有多个上调的基因(8,866)。与两种状态下调的基因(4%) 相比,在SR和SEN-hADSC中上调的基因比例(35%)也显着更高。对于IL-2 治疗后SEN-hADSC下调的基因,可见最大的不对称性(1,739);对于SR IL-2 +条件,还有更多这样的基因(649)。这种差异表明SEN IL-2+条件的总体发散度很大程度上归因于IL-2处理下调的基因,由于IL-2处理时SR和SEN两者总体上调该结果是意想不到的(图6B和图8D)。
图6C-6D显示了显示在IL-2处理后上调(图6C)和下调(图6D)的基因的表达水平的热图。标准化的基因表达水平显示为灰度热图。组对应于在仅SR,仅SEN或两种条件下上调或下调的基因。
总之,这些数据表明,SEN-hADSC已经失去了产生响应于IL-2处理的协调调节变化的能力,这与活跃增殖的SR细胞程度相同。与SEN IL-2-相比, SR IL-2+所见到的上调基因的数量更多与这种解释是一致的。
本文提供了IL处理时富集的通络。图10A显示了表示SR和SEN-hADSC 中IL-2处理后上调的基因富集的生物途径的表格(图10A)。在图10A中,显示了富集的途径以及属于途径的单独IL-2+上调基因和途径富集显著水平。在SR中具有上调基因成员的通路显示在左栏中,并且在SEN中具有上调基因成员的通路显示在右栏中。在SR和SEN中具有上调的基因成员的通路显示在第一排,随后是仅在SEN中具有上调基因成员的通路,并且最终是仅在 SR中具有上调基因成员的通路。显示的网络是SR(左列)上调的通路和SEN(右列)上调的通路。网络节点表示途径,并且节点的大小对应于该途径中上调基因的数目。如果通路共享上调基因,则通路节点通过边连接,并且边权重对应于通路之间共享的上调基因的数量。
图10B是表(图10B),其显示了在SR和SEN-hADSC中对IL-2处理下调的基因富集的生物途径。显示富集的途径以及属于途径的单独的IL-2+下调的基因和途径富集显着性水平。在SR中具有下调基因成员的通路显示在左栏中,并且在SEN中具有下调基因成员的通路显示在右栏中。在SR和SEN 中具有下调基因成员的途径显示在第一行,其次是仅在SEN中具有下调基因成员的途径,最后是仅在SR中具有下调基因成员的途径。显示的网络与 SEN(左列)下调的路径有关。网络节点表示途径,并且节点的大小对应于该途径中SEN下调基因的数目。如果通路共享SEN下调的基因,则通路节点通过边连接,并且边权重对应于通路之间共享的下调基因的数量。
实施例5:Il-2刺激后hADSC的营养特性离体对复制老化敏感
图7A-7D说明在功能上一致的基因集合中,在IL-2处理下SR和SEN细胞的基因表达水平。显示了如下表征的基因集合的表达水平:(在图7A中) 营养因子、(在图7B中)抗炎和免疫调节、(如图7C所示)抗凋亡和转移促进和 (如图7D所示)迁移和血管生成促进。标准化的基因表达水平显示为灰度热图。
IL-2暴露后MSC的营养特性易于在体外复制老化(例如,图7A,表1)。广泛的生物活性分子的分泌被认为是MSC实现其治疗效果的主要机制。 MSC在许多类型的免疫细胞中分泌一系列具有复杂反馈机制的生长因子和抗炎蛋白。
表1显示了在SEN和SR细胞中IL-2处理后营养因子的差异表达。SR GFold值表示用IL-2处理的SR细胞相对于未用IL-2处理的SR细胞的倍数差异;SEN GFold值表示用IL-2处理的SEN细胞相对于未用IL-2处理的SEN 细胞的倍数差异。
表1:IL-2治疗后营养因子的差异表达
数据表明用IL-2刺激hADSC中生长因子的表达在离体复制衰老时经历显着变化。当活性增殖的(SR)hADSC暴露于IL-2导致促有丝分裂蛋白例如基质细胞来源的因子2(SDF2)和SDFL2以及前列腺素E合成酶2(PTGES2)的表达增加时,SR和SEN-hADSC标记为转化生长因子α和β(TGFα,TGFβ1和 TGFβ2),转化生长因子β受体TGFBR2和转化生长因子β受体相关蛋白 TGFBRAP1以及转化生长因子β诱导的(TGFBI)的显着增加,已知当在全身性环境中分泌时,其增加成纤维细胞、上皮细胞和内皮细胞分裂(图7A和表 5A-5D)。
另外,SR和SEN IL-2刺激的hADSC均标记为集落刺激因子1(CSF-1)、 LIF、IL-11、IL-17D、IL-1β和肿瘤坏死因子(配体)超家族TNFSF13B(刺激B 细胞和T细胞功能的细胞因子编码基因)的上调(图7A,7B和图10A-10B)。
考虑到旁分泌IL-17D诱导内皮细胞表达IL-6、IL-8和GM-CSF基因, IL-1β以自分泌和旁分泌的方式刺激成纤维细胞生长因子活性(在IL-2暴露的 hADSC中TGFα、TGFβ1和TGFβ2基因显着上调),以及通过诱导IL-2从这些细胞释放使胸腺细胞和B细胞增殖和成熟,数据表明SR和SEN-hADSC 的转录状态可能指向通过复杂的调节性反馈回路在IL-2暴露后这些细胞增强的免疫调节性质。
暴露于IL-2的SR和SEN-hADSC标记为转化生长因子α和β(TGFα, TGFβ1和TGFβ2),转化生长因子β受体TGFBR2和转化生长因子β受体相关蛋白TGFBRAP1,以及转化生长因子β诱导的(TGFBI)基因的表达显着增加(图7A)。
本文提供TGFβ生物标志物。通过促进CD+4T细胞的分化和抑制免疫监视,TGFβ被认为在调节免疫系统中是重要的,从而强加免疫抑制。然而,在暴露于IL-2后脂肪来源的人MSC中TGFβ表达水平较高可能促进癌发生。此外,还注意到在SR细胞中尚未观察到的hADSC衰老时生长因子的IL-2 依赖性表达的差异。这包括上调成纤维细胞生长因子家族成员(FGF1,FGF11, FGF14)的一个子集并伴随着其他成员如FGF2,FGF5,FGF7(图7A,表1 和表5A-5D)的下调。
IL-2暴露的SEN-hADSC标记为EGF mRNA上调,但对其受体EGFR的 mRNA下调,同时血清应答因子SRF和WNT信号分泌调节因子SFRP1的表达降低。有趣的是,与受IL-2暴露的SR细胞相比,在促进伤口愈合的间充质来源细胞的有力的丝裂原PDGFA及其受体PDGFRA的表达在SEN-hADSC 中均显着受到抑制(图7A,图10A,表1,和表5A-5D)。
这些数据揭示了hADSC中IL-2介导的转录应答的性质与衰老有关的差异,其可离体和最终在体内阻碍这些细胞的免疫调节性质。
显示了一组用于IL-2治疗、IL-2与其他药物组合和IL-2暴露的人MSC 的抗炎和免疫调节标记物(表2)。
本发明还考虑确定响应IL治疗时哪条通路受到调节。使用集成的基因集合富集和途径网络方式捕获对IL-2刺激的协调的细胞应答的生物学现实,分析了IL-2处理的SR和SEN-hADSC中指定为上调或下调的基因。为此,鉴定出上调或下调基因统计学上富集的途径,随后基于它们共有的差异表达的基因进行选择(图10A-10B)。根据每个途径中差异表达基因的数目以及不同途径共享差异表达基因集合的程度对通路网络表示进行加权。这种方法允许识别具有许多功能相关的路径以及功能相关的网络子结构的高度连接的网络结构。
当hADSC衰老时,IL-2对下述基因途径具有较少刺激性:促进增殖(细胞周期途径,q值=1.54e-5),施加G2检查点(G2途径,q值=5.94e-4),p53 通路(q值=1.18e-2),主要信号转导MAPK通路(MAPK,q值=2.42e-4)及其主要亚群ERK通路(ERK,q值=2.62e-2),其调节诸如存活、迁移和增殖的重要细胞功能。
这些数据还提供了关于MSC在致癌环境中的功能的信息。暴露于IL-2 的SR和SEN-hADSC标记为转化生长因子α和β(TGFα,TGFβ1和TGFβ2),转化生长因子β受体TGFBR2和转化生长因子β受体相关蛋白TGFBRAP1,以及转化生长因子β诱导的(TGFBI)基因的表达显着增加(图7A)。
IL-2处理的SEN-hADSC显示与炎症(IL-6途径,q值=5.55e-3)和已证明为MSC提供生存优势的EGF信号传导(q值=2.33e-4)相关的途径富集了突出的上调基因。暴露于IL-2的SEN-hADSC标记为IL-1R'IL-6和IL-12的表达增加(图7B)
观察到的与血管生成性VEGF途径的连接(q值=5.24e-3)(图10A,右侧和图7D)和SEN-hADSC迁移的增强能力(图3A,3B)可以表明IL-2暴露的 SEN-MSC可以获得支持致瘤环境和转移所必需的特性。此外,上调hADSC 中包括在一氧化氮合酶途径(iNOS)NOSl途径的基因(q值=8.32e-2)在复制衰老时再次支持了经历衰老的MSC可以通过免疫抑制获得转移促进性能。
衰老过程中hADCSs中对增殖和DNA修复支持起重要作用的途径下调:细胞周期途径(q值=2.52e-5),MCM途径(q值=1.62e-8),RB途径(q-值=6.97e-5),ATM途径(q值=3.28e-2),p53途径(q值=1.86e-2),如图10B中所示。总体而言,数据表明,更多的生物途径在衰老和随后的自我更新中经历IL-2触发的下调,且这些生物途径是相互连接的(图10B),进一步将hADSC 复制老化时IL-2应答的生理损伤连接在一起因此,表明这种损伤可能是体内和临床应用中脂肪来源的干细胞偏离功能的组成部分。
该数据提供了一系列分子标记靶标,其对于评估免疫调节和抗炎事件至关重要,并为临床应用中优先考虑自体或同种异体MSC的使用做出信息性决定,和/或用作在临床环境中用IL-2试剂和/或IL-2与细胞疗法监测癌症治疗的伴随诊断(表2)。
表2显示了在SEN和SR细胞中抗炎和免疫调节因子对IL-2处理的差异表达。SR GFold值表示用IL-2处理的SR细胞相对于未用IL-2处理的SR细胞的倍数差异;SEN GFold值表示用IL-2处理的SEN细胞相对于未用IL-2 处理的SEN细胞的倍数差异。
表2:IL-2治疗后抗炎和免疫调节因子的差异表达
实施例6:IL-2暴露的人MSC的抗炎和免疫调节性质
接下来,研究了当对复制性老化施加IL-2促炎症环境时如何影响指定用于提供hADSC的免疫调节性质的基因的表达(例如,IL-2暴露的人MSC的抗炎和免疫调节性质)。数据表明,免疫调节的能力受离体传代过程中人脂肪来源的MCS的复制老化的影响(图7B和表2)。
SR-hADSC中的IL-2暴露激活了归因于T细胞调节的不同组的基因。自我更新的hADSC的IL-2暴露导致基因如TNFRSF21(参与T细胞分化),IL12A(T细胞活化剂),ILF2(T细胞活化过程中IL-2基因转录过程中有效的调节因子),IL33(T辅助细胞2型相关细胞因子的旁分泌诱导剂)的上调和 CCL28(CD+4,CD+8T细胞的趋化因子),CD320(具有自分泌和旁分泌功能以增加浆细胞的增殖的受体分子)的下调,如图7B,表2和表5A-5D中所示。
与此相反,IL-2暴露的SEN-hADSC的特征在于下述的显著转录上调: CD320、许多可能涉及调节T细胞功能的整合素(ITG 11,ITGA V,ITFG 1) 和编码重要调节性分子的基因如:T细胞粘附受体(CD99)、归因于维持未处理T细胞的因子(CHST3)、T细胞活化因子(HIVEP1和HIVEP2)、参与T细胞信号途径的基因(CMIP)和自分泌/旁分泌因子PTGER1,其参与抑制CD+ 细胞增殖(图7B,表2和表5A-5D)。
数据还表明暴露于IL-2的SR-hADSC触发编码在B细胞增殖和分化 (CD72)和有角巨噬细胞(CD68)中发挥作用的表面受体的基因的转录活性的下调。在类似的处理下,这些基因在衰老细胞中显着转录上调(图7B,表2,表5A-5D)。此外,IL-2处理的SEN-hADSC与类似处理的SR细胞通过调节多种非粘附性骨髓祖细胞的促B至前B转换所需的基因(LRRC8A和PEAR1基因)的转录下调而分开。相反,涉及淋巴细胞活化和稳态(CD83和TNFRSF25) 以及白细胞迁移(CERCAM)的基因和负责内皮细胞-白细胞相互作用的基因 (ESM1)以及对于控制单核细胞/巨噬细胞介导的免疫过程(TNFSF13)重要的基因在SEN-hADSC中上调(图7B,表2和表5A-5D)。
IL-2暴露导致许多细胞因子和趋化性关键因子的差异表达(如图7B和表 2所示)。
SR-hADSC标记为IL-33,IL-12A,IL10RB,IL1RAP,IL7R,ILF2和 NOS3基因表达上调,而IL-16和CSF1R基因表达在这些细胞中下调。
在与IL-2类似的条件下处理的SEN-hADSC中,编码细胞因子IL-32, IL-6,IL1RN,IL-20RB,IL-21R和炎症诱导剂TNFSF13和TNFSF12的基因,以及编码细胞外基质重塑PLAU的基因上调。
同时,如MYL9,KIF14,IRAC3等胞质分裂所必需的多种因子,以及吸引单核细胞和嗜碱性粒细胞的趋化因子基因(CCL2)和调控造血前体细胞增殖分化的CLEC11A基因下调(图7B)。
数种白细胞介素受体编码基因IL7R,IL1R1,IL15RA和白细胞介素增强子结合因子ILF2和ILF3也有类似的下调。
这些观察结果与SEN-hADSC中(IL-32,IL-6,PLAU基因的上调;CCL2, CLEC11A,ILF3,IRAK3,KIF14,MYL9基因的下调)和SR-hADSC中(IL12A, IL7R,IRAK1,NOS3基因的上调;IL16,CSF1R基因的下调)的细胞因子的 IL-2依赖的差异转录表达表明hADSC的免疫调节性能易受衰老施加的变化的影响。
观察到的与血管生成性VEGF途径(q值=5.24e-3)(图10A,右侧和图7D) 的连接和SEN-hADSC迁移的增强能力(图4A,B)表明IL-2暴露的SEN-MSC 可以获得支持致瘤环境和转移所必需的特性。另外,复制衰老时hADSC中一氧化氮合酶途径(iNOS)NOS1途径(q值=8.32e-2)中包括的基因的上调也表明经历衰老的MSC可以通过免疫抑制获得转移促进特性。
实施例7:复制衰老时IL-2刺激的hADSC的抗凋亡和转移促进特性
这些实验也用于检查在复制衰老时IL-2暴露的MSC的抗凋亡和转移促进特性。
表3显示了IL-2处理、IL-2与其他药物的组合或IL或IL-2与MSC的组合的抗凋亡和转移促进标志物组。这些数据提供了对评估抗凋亡和转移促进事件重要的分子标记物靶标的列表,并且为临床应用优先考虑自体或同种异体MSC的使用做出信息性决定,和/或用作在临床环境中用IL-2试剂和/或 IL-2与细胞疗法监测癌症治疗的伴随诊断(表3)。。
表3显示了在SEN和SR细胞中IL-2处理后抗凋亡和转移因子的差异表达。SR GFold值表示用IL-2处理的SR细胞相对于未用IL-2处理的SR细胞的倍数差异;SEN GFold值表示用IL-2处理的SEN细胞相对于未用IL-2处理的SEN细胞的倍数差异。
表3:IL-2处理后抗凋亡和转移因子的差异表达
例如,已经证明MSC辅助逆转缺血后的心肌细胞以及受损的神经元和肺成纤维细胞的细胞凋亡。斯钙素-1(STC1)已经被鉴定为能够在由UV和酸性损伤的成纤维细胞中有效的凋亡逆转的基本因子。
数据表明,IL-2暴露转录上调STC1和STC2基因,并且这种激活至少离体不依赖于hADSC的复制老化(表5A-5D)。此外,VEGF和TGFB1等旁分泌效应器也参与了内皮细胞中凋亡的逆转。在IL-2处理时,编码这两种因子的基因的表达在SR和SEN-hADSC中上调(图7C,图5,表3和表5A-5D)。
图5的第三幅图显示,当hADSC复制衰老时,IL-2上调VEGFA基因的转录。通过定量qPCR在未刺激的(IL-2-)衰老(暗)和自我更新(亮)hADSC中并且用20ug/ml的重组IL-2(IL-2+)刺激时来评估VEFGA基因表达。数据显示为来自三个独立实验的倍数变化ΔΔCT平均值±SD。图形描绘了q-PCR引物的位置。统计显着性通过t检验估计,其中***p<0.001,**p<0.01。
然而,通过图7C中所示的qPCR分析进一步验证,VEGFA的转录活性在衰老中显着高于活跃增殖的细胞。值得注意的是,与增殖的hADSC相比,在IL-2处理的衰老细胞中编码促细胞凋亡因子和有效的T淋巴细胞凋亡诱导剂的SIVA1基因显着下调(图7C,表3和表5A和5D)。SIVA1不是严格的促凋亡因子,而且是肿瘤转移的有效抑制因子。重要的是,与相似处理的SR 细胞(图7C和表3)相比,在暴露至IL-2的SEN-hADSC中,负责侵袭性生长和转移的许多因子显着上调。这包括RACKI,PLEKHA1,PLEKHA6,CTSB, CRMP1,FERMT1基因。这些数据表明一般而言用IL-2预处理/暴露hADSC 可以增强这些细胞的抗细胞凋亡特性,并且这种增强至少在培养中受到复制性衰老的影响。
结果表明,在IL-2处理的SEN-hADSC中,显着上调的基因富集在与炎症(IL-6途径,q值=5.55e-3)和已被证明为MSC提供了生存优势的EGF信号传导(q值=2.3 3 e-4)相关的途径。暴露于IL-2的SEN-hADSC也标记为已知刺激来自淋巴细胞的IL-17的细胞因子IL-1β,IL-6和IL-12(图7B)的表达增加。
数据还表明,淋巴细胞是IL-17产生的唯一来源,并且那些MSC,特别是在其衰老时,在经历促炎环境时显示出高的IL-17转录活性(图7A)。MCS 衍生的IL-17与MCS衍生的CSF-1一起可诱导全身中性粒细胞扩增和巨噬细胞浸润,类似于研究表明的这些因子在促进癌症进展和转移以及包括牛皮癣在内的许多炎性疾病中的关键作用。
实施例8:转录概貌表明在复制性衰老时调节IL-2刺激的hADSC中增强的迁移和血管生成的基因靶标
显示了在老化时IL-2处理中指示增强的迁移和血管生成的标记物组(表 4)
对于评估迁移和血管生成促进事件至关重要的分子标记物靶标列表可以帮助做出用于临床应用优先考虑自体或同种异体MSC的用途的信息性决策,和/或用作在临床环境中监测用IL-2试剂和/或IL-2与细胞疗法的癌症治疗的伴随诊断(表4)。转录概貌表明调控复制衰老时IL-2刺激的ADSC中增强的迁移和血管生成的基因靶标。对转录应答的进一步分析表明,SEN-hADSC的 IL-2刺激增强参与与血管生成相关的血管发育和重塑的基因的表达。观察到 VEGFA,VEGFB,FBLNS,FBLN7,PGF,ANGPT1,ANGPT2,ANGPTL2, ANGPTL6,TNFSF12,PRKCA,PIK3CA,HRAS基因以及编码内皮细胞- 白细胞粘着的有效调节剂ESM1的基因的显着上调(图7D,图10A-10B,表4 和表5A-5D)。
表4显示了在SEN和SR细胞中IL-2处理后迁移和血管生成因子的差异表达。SR GFold值表示用IL-2处理的SR细胞相对于未用IL-2处理的SR细胞的倍数差异;SEN GFold值表示用IL-2处理的SEN细胞相对于未用IL-2 处理的SEN细胞的倍数差异。
表4:IL-2处理后迁移和血管生成促进因子的差异表达
由MCS释放的血管内皮生长因子VEGF,使得内皮谱系细胞募集和血管生成启动,如先前报道的那样。进一步证明,通过定量RT-PCR分析可以检测到SEN-hADSC中VEGFA基因表达的上调,并且IL-2暴露导致SR和 SEN-hADSC中VEGFA基因转录的统计学显着增加(图7D和表4)。
响应于IL-2暴露,仅在经历复制衰老的hADSC中显著上调的是负责细胞运动、迁移和侵袭性生长的一组基因:CGNL1,CGREF1,CRMP1,FGD6, TNK2,PTGS1,TNFAIP8,CTSB,CTSO,FAP,FERMT1,PLEKHA1, PLEKHA6,ROCK1,ROCK2。下调了一组促进细胞粘附的基因,如CHD24, CYR61,ILK,NEDD9,MYL9,PPAP2B,RELN和TLN2(图7D,表4和表 5A-5D)。这些数据进一步支持了图3B所示的SEN-hADSC迁移能力增强的实验证据。
实施例9:蛋白质组抗体阵列数据
表6提供了所有蛋白质组抗体阵列数据的原始值。
将来自38岁患者的MSC在含有10%PRP的StemPro MSC SFM无Xeno 培养基中铺板于基质上。将如实施例1中所述测定的SR或SEN hADSC以 2500个细胞/cm2的密度接种在700ul/cm2的含有10%PRP的StemPro MSC SFM无Xeno培养基中。用IL-2刺激SEN和SR hADSCs 24小时或保持不用 IL-2(IL-2-)刺激,之后将培养基更换为含有10%PRP的StemPro MSC SFM无 Xeno培养基。将细胞在37℃和5%CO2下保持24、48和72小时,之后收集并分析培养基。在RayBio C-Series Human Cytokine Antibody Array AAH-CYT-2000(RayBiotech,Inc)上分析等体积的培养基。C-Series Human Cytokine Antibody Array AAH-CYT-2000基于化学发光测定原理并含有针对 174种目的蛋白的抗体。使用LI-COR Biosciences光密度测定软件(Li COR) 从膜中提取数据。通过取给定蛋白质信号的平均强度/平均强度阴性对照之间的比率来标准化原始数据,以考虑暴露和阵列与阵列变化的差异。数据显示在图11-90和表6中,其显示了IL-2暴露时分泌的蛋白质因子。这些蛋白质包括但不限于图7A-7D的表中所示的因子和分泌谱概括转录数据。
图11-17显示了仅在用含有10%PRP(富血小板血浆)的培养基温育后24 小时,来自SR-hADSC的下述命名蛋白质(因子)的分泌增加(无IL-2刺激)。显示了相对于用于hADSC支持的含有10%PRP的培养基中基础水平存在的相应蛋白质的量的分泌水平。图11显示白细胞介素5(IL5)和白细胞介素6(IL6) 的分泌增加。图12显示白细胞介素1受体4(IL1R4)的分泌增加。图13显示神经营养因子3(NT3)、血小板来源的生长因子Aα(PDGF AA)、血小板来源的生长因子Aβ(PDGF AB)和促血小板碱性蛋白(pro-platelet basic protein,PPBP) 的分泌增加。图14显示趋化因子(C-C基序)配体18(CCL18)、趋化因子(C-C 基序)配体25(CCL25)、趋化因子(C-C基序)配体27(CCL27)和CXC趋化因子配体11(CXCL11)的分泌增加。图15显示细胞间粘附分子1(ICAM-1)和金属蛋白酶抑制剂2(TIMP-2)的分泌增加。图16显示了金属蛋白酶抑制剂 1(TIMP-1)的分泌增加。图17显示了血管上皮(VE)钙粘蛋白(钙依赖性细胞粘附蛋白)的分泌增加。
图18-19显示了仅与10%PRP温育24小时后,来自SR-hADSC的以下命名的蛋白质(因子)的分泌增加(无IL-2刺激)。发现这些蛋白质不存在于PRP 中。图18显示白细胞介素4(IL4)的分泌增加。图19显示胰岛素样生长因子结合蛋白-1(IGFBP1)的分泌增加。
图20-31显示了在仅与10%PRP温育48小时后(无IL-2刺激),来自 SR-hADSC的以下命名的蛋白(因子)的增加。显示了相对于用于hADSC支持的10%含PRP的培养基中以基础水平存在的相应蛋白质的量的分泌水平。图 20显示白细胞介素9(IL9)和白细胞介素18结合蛋白α(IL18BPa)的分泌增加。图。图21显示了白细胞介素1受体II型(IL1R2),白细胞介素2受体β(IL-2Rb),白细胞介素2受体γ(IL-2Rg),白细胞介素5受体α(IL5Ra),白细胞介素10 受体β(IL10Rb),白细胞介素18受体辅助蛋白(IL18Rb)和白细胞介素21受体 (IL-21R)的分泌的增加。图22显示胰岛素样生长因子2(IGF2),转化生长因子α(TGFα),转化生长因子β1/潜伏相关肽(LAP)(TGFb1)和转化生长因子β 2(TGFb2)的分泌的增加。图23显示了受体酪氨酸蛋白激酶ErbB-3(ErbB3), Fas配体(Fas LG),白血病抑制因子(LIF),催乳素(PRL)因子,血小板衍生生长因子受体α(PDGFRa),血小板衍生生长因子受体β(PDGFRb),干细胞因子试剂盒受体(SCFR)和唾液酸结合Ig样凝集素5(Siglec 5)的分泌增加。图24 显示了CXC趋化因子配体16(CXCL16)的分泌增加。图25显示了活化的白细胞粘附分子(ALCAM),E选择素(免疫粘附中的细胞表面糖蛋白),细胞间粘附分子2(ICAM2),L选择素(淋巴细胞粘附分子)和血小板内皮细胞粘附分子 (PECAM 1)的分泌增加。图26显示活化素A(INHBA),胰岛素样生长因子 2(IGF-2)和瘦素受体(LEPR)的分泌增加。图27显示了骨形态发生蛋白 5(BMP5),骨形态发生蛋白7(BMP7),巨噬细胞集落刺激因子1受体(MCSFR),基质金属蛋白酶1(MMP1),基质金属蛋白酶3(MMP3),基质金属蛋白酶 9(MMP9)和基质金属蛋白酶13(MMP13)的分泌增加。图28显示了单核细胞分化抗原(CD14),细胞分化抗原(CD80),心肌营养素-1(CT-1)和白血病抑制因子(LIF)的分泌增加。图29显示内皮糖蛋白(ENG)的分泌增加。图30显示具有免疫球蛋白样和EGF样结构域1的酪氨酸激酶(TIE1)和具有免疫球蛋白样和EGF样结构域2的酪氨酸激酶(TIE2)的分泌增加。图31显示活化素A(抑制素βA,INHBA),瘦素受体(瘦素R)和转化生长因子β1(TGFβ1)的分泌增加。
图32显示了在仅与10%PRP温育48小时后,从SR-MSC分泌的神经生长因子受体(NGFR)的增加(无IL-2刺激)。发现NGFR不存在于PRP中。
图33-39显示了在仅与单独的10%PRP温育72小时后,从SR-hADSC分泌的以下命名蛋白质(因子)的增加(无IL-2刺激)。显示了相对于用于hADSC 支持的含有10%PRP的培养基中以基础水平存在的相应蛋白质的量的分泌水平。图33显示了白细胞介素1β(IL1b)、白细胞介素3(IL3)、白细胞介素-13 受体亚单元α-2(IL13Rα2)和白细胞介素1受体α(IL1Rα)的分泌增加。图34显示促β细胞素(BTC)、集落刺激因子(CSF1)、成纤维细胞生长因子6(FGF6)、神经胶质细胞系来源的神经营养因子(GDNF)、胰岛素样生长因子1(IGF-1)、瘦素和血小板来源的生长因子Bβ(PDGF BB)的分泌增加。图35显示了干细胞因子/c-kit配体(SCF)、基质细胞来源的因子-1α(SDF1a)、基质细胞来源的因子-1β(SDF1b)、转化生长因子β1(TGFb1)、转化生长因子β3(TGFb3)和肿瘤坏死因子超家族成员14(TNFSF14)的分泌增加。图36显示胰岛素样生长因子 1(IGF1)的分泌增加。图37显示了转化生长因子β1(TGFb1)和血小板来源的生长因子Bβ(PDGF BB)的分泌增加。图38显示了趋化因子(C-C基序)配体 2(CCL2)、趋化因子(C-C基序)配体5(CCL5)、趋化因子(C-C基序)配体7(CCL7)、趋化因子(C-C基序)配体8(CCL8)和趋化因子(C-C基序)配体 11(CCL11)的分泌增加。图39显示了趋化因子(C-C基序)配体13(CCL13)、趋化因子(C-C基序)配体22(CCL22)、趋化因子(C-C基序)配体23(CCL23)、趋化因子(C-C基序)配体24(CCL24)和CXC趋化因子配体10(CXCL10)的分泌增加。
图40-42显示了在仅与10%PRP温育72小时后,从SR-hADSC分泌的以下命名蛋白质(因子)的增加(无IL-2刺激)。发现这些因子被发现不在PRP中。图40显示了脑源性神经营养因子(BDNF)、骨形态发生蛋白4(BMP4)、骨形态发生蛋白6(BMP6)、睫状神经细胞营养因子(CNTF)、表皮生长因子(EGF)、成纤维细胞生长因子7(FGF7)和胰岛素样生长因子结合蛋白-4(IGFBP4)的分泌增加。图41显示了趋化因子(C-X-C基序)配体13(BLC)、趋化因子(C-C基序)配体23(CCL23)、趋化因子(C-C基序)配体28(CCL28)、趋化因子(C-C基序)配体11(嗜铬细胞活化趋化因子1)、趋化因子(C-X-C基序)配体6(GCP-2)、FLT3LG(Fms相关的酪氨酸激酶3配体)和Fractalkine(CX3CL1)的分泌增加。图42显示血管紧张素(ANG)和集落刺激因子2(CSF2)的分泌增加。
图43显示用IL-2刺激24小时后,趋化因子(C-C基序)配体27(CCL27) 和TNFRSF1B(肿瘤坏死因子受体超家族,成员1B)的分泌增加。显示了相对于用于hADSC支持的含有10%PRP的培养基中以基础水平存在的相应蛋白质的量的分泌水平。
图44-53显示了用IL-2刺激48小时后,来自SR-hADSC的以下命名的蛋白质(因子)的增加。显示了相对于用于hADSC支持的含有10%PRP的培养基中以基础水平存在的相应蛋白质的量的分泌水平。图44显示了白细胞介素 9(IL9)、白细胞介素11(IL11)、白细胞介素12α(IL12a)、白细胞介素12β(IL12b) 和白细胞介素18结合蛋白α(IL18BPa)的分泌增加。图45显示了白细胞介素 1受体I型(IL1R1)、白细胞介素1受体II型(IL1R2)、白细胞介素1受体IV 型(IL1R4)、白细胞介素2受体β(IL-2Rb)、白细胞介素受体γ(IL-2Rg)、白细胞介素5受体α(IL5Ra)白细胞介素10受体β(IL10Rb)、白细胞介素18受体β(IL18Rb)和白细胞介素21受体(IL-21R)的分泌增加。图46显示了成纤维细胞生长因子4(FGF4)、FGF9、MSPα/HGF样因子(HGF样)、胰岛素样生长因子1(IGF1)、IGF2、胰岛素样生长因子结合蛋白-6(IGFBP6)、LAP(TGFβ家族) 和血小板来源的生长因子Aα(PDGFAA)的分泌增加。图47显示了血小板来源的生长因子Aβ(PDGFAB)、血小板来源的生长因子Bβ(PDGFBB)、基质细胞来源的因子-1α(SDF1a)、结合唾液酸的Ig样凝集素5(Siglec 5)、转化生长因子α(TGFa)、转化生长因子β2(TGFb2)、血管内皮生长因子(VEGF)和血管内皮生长因子D(VEGFD)的分泌增加。图47还显示DR6、Dtk、EGFR、内皮因子、ErbB3、Fas、Fas LG和IGF1sr的分泌增加。图48显示了瘦素(LEP)、瘦素受体(LEPR)、巨噬细胞集落刺激因子1受体(MCSFR)、神经营养因子 4(NT4)、骨保护素(OPG)、血小板来源的生长因子受体α(PDGFRα)、血小板来源的生长因子受体β(PDGFRb)和催乳素(PRL)的分泌增加。图49显示干细胞因子受体(SCFR)、血管生成素1受体(TIE1)、血管生成素1受体(TIE2)、TNF 超家族成员10C(TNFSF10C)、TNF超家族成员10D(TNFSF10D)、TNF超家族成员14(TNFSF14)、尿激酶纤溶酶原激活物受体(uPAR)和血管内皮生长因子受体-2(VEGFR2)的分泌增加。图50显示了趋化因子(C-C基序)配体 2(CCL2)、CCL3、CCL5、CCL8、CCL17、CCL20、CCL25、CXC趋化因子配体5(CXCL5)、CXCL11和CXCL16的分泌增加。图51显示活化的白细胞粘附分子(ALCAM)、骨形态发生蛋白5(BMP5)、BMP7、E选择素(内皮细胞粘附分子)、细胞间粘附分子2(ICAM2)、ICAM3、L选择素(淋巴细胞粘附分子)和基质金属蛋白酶1(MMP1)的分泌增加。图52显示了基质金属蛋白酶 13(MMP13)、MMP3、MMP9、血小板内皮细胞粘附分子(PECAM1)、金属蛋白酶抑制剂TIMP1、TIMP2、TIMP4和血管上皮(VE)钙粘蛋白(钙依赖性细胞粘附蛋白)的分泌增加。图53显示了单核细胞分化抗原(CD14)、细胞分化抗原(CD80)、心肌营养素-1(CT-1)、白血病抑制因子(LIF)、巨噬细胞迁移抑制因子(MIF)、血小板生成素(THPO)和淋巴细胞趋化蛋白(XCL1)的分泌增加。
图54显示用IL-2刺激24或48小时后来自SR-hADSC的神经生长因子受体(NGFR)的分泌增加。图54还显示IL8和TNFRSF1A的分泌增加。图54 中的这些因子发现不存在于PRP中。
图55-57显示了用IL-2刺激72小时后来自SR-hADSC的以下命名的蛋白质(因子)的分泌增加。显示了相对于用于hADSC支持的含有10%PRP的培养基中基础水平存在的相应蛋白质的量的分泌水平。图55显示了白细胞介素 1受体α(IL1Ra)、白细胞介素6(IL6)和白细胞介素-13受体亚单元α-2(IL13Ra2) 的分泌增加。图56显示了成纤维细胞生长因子6(FGF6)、原血小板碱性蛋白 (PPBP)、干细胞因子(SCF)和血管内皮生长因子受体-3(VEGFR3)的分泌增加。图57显示了趋化因子(C-C基序)配体22(CCL22)、CCL23、CCL24、CCL26 和CXC趋化因子配体10(CXCL10)的分泌增加。
图58显示了用IL-2刺激72小时后来自SR-hADSC的血管紧张素(ANG)、脑源性神经营养因子(BDNF)、骨形态发生蛋白4(BMP4)、集落刺激因子 2(CSF2)、表皮生长因子(EGF)、成纤维细胞生长因子7(FGF-7)、干扰素γ(IFN γ),胰岛素样生长因子结合蛋白-1(IGFBP1)和IGFBP2的分泌增加。发现这些因子不存在于PRP中
图59显示仅与10%PRP(无IL-2刺激)温育24小时后来自SEN-hADSC 的成纤维细胞生长因子6(FGF6)、CXC趋化因子配体16(CXCL16)和基质细胞来源的因子-1α(SDF1a)的分泌增加。显示了相对于用于hADSC支持的含有 10%PRP的培养基中基础水平存在的相应蛋白质的量的分泌水平。
图60显示了仅与10%PRP(无IL-2刺激)温育24小时后来自SEN-hADSC 的脑源性神经营养因子(BDNF)、B淋巴细胞趋化因子(CXCL13;BLC)、趋化因子(C-C基序)配体1(CCL1)、Flt-3LG(Fms相关的酪氨酸激酶3配体)、 Fractalkine(T细胞趋化因子CX3CL1)、粒细胞趋化蛋白2(GCP-2)/CXCL6、白细胞介素1α(IL1a)、白细胞介素4(IL4)、IL15和干扰素γ(IFNγ)的分泌增加。发现这些因子不存在于PRP中。
图61-70显示了仅与10%PRP(无IL-2刺激)温育48小时后来自 SEN-hADSC的下述命名蛋白(因子)的分泌增加。显示了相对于用于hADSC 支持的含有10%PRP的培养基中基础水平存在的相应蛋白质的量的分泌水平。图61显示白细胞介素2β(IL-2b)、IL3、IL5和IL6的分泌增加。图62显示白细胞介素1受体II(IL1R2)、白细胞介素2受体γ(IL-2Rg)、白细胞介素5 受体α(IL5Ra)、白细胞介素10受体β(IL10Rb)、白细胞介素18受体结合蛋白α(IL18BPa)、白细胞介素18受体β(IL18Rb)和白细胞介素21受体(IL-21R)的分泌增加。图63显示了胰岛素样生长因子1(IGF1)、IGF2、LAP(TGFβ家族)、瘦素(LEP)、瘦素受体(LEPR)、血小板来源的生长因子Aα(PDGFAA)、血小板来源的生长因子Aβ(PDGFAB)和血小板衍生生长因子Bβ(PDGFBB)的分泌增加。图64显示了血小板来源的生长因子受体α(PDGFRα)、干细胞因子(SCF)、干细胞因子受体(SCFR)、转化生长因子β1(TGFb1)、转化生长因子β2(TGF b2)、转化生长因子α(TGFa)、血管内皮生长因子受体-2(VEGFR2)和VEGFR3 的分泌增加。图65显示了死亡受体6(DR6;TNF受体超家族成员21)、神经胶质细胞系衍生的神经营养因子(GDNF)、神经营养因子3(NT3)、具有免疫球蛋白样和EGF-样结构域1的酪氨酸激酶(TIE1)、TIE2和TNF超家族成员 14(TNFSF14)的分泌增加。图66显示了趋化因子(C-C基序)配体2(CCL2)、 CCL5、CCL8、CCL17、CCL18和CCL23的分泌增加。图67显示了趋化因子(C-C基序)配体24(CCL24)、CCL25、CCL26、CCL27、CXC趋化因子配体10(CXCL10)和CXCL11的分泌增加。图68显示了活化的白细胞粘附分子 (ALCAM)、骨形态发生蛋白5(BMP5)、BMP7、E选择素(内皮细胞粘附分子)、细胞间粘附分子1(ICAM1)、ICAM2、L选择素(淋巴细胞粘附分子)和基质金属蛋白酶1(MMP1)的分泌增加。图69显示基质金属蛋白酶3(MMP3)、MMP9、 MMP13、血小板内皮细胞粘附分子(PECAM1)、金属蛋白酶抑制剂TIMP1、 TIMP2和TIMP4的分泌增加。图70显示了单核细胞分化抗原(CD14)、单核细胞分化抗原(CD80)、心肌营养素-1(CT-1)和白血病抑制因子(LIF)的分泌增加。图71-72显示了仅与10%PRP(无IL-2刺激)温育48小时后来自 SEN-hADSC的以下命名的蛋白质(因子)的分泌增加。发现这些因子不存在于 PRP中。图71显示了骨形态发生蛋白4(BMP4)、趋化因子(C-C基序)配体 11(CCL11)、CCL23、睫状节神经细胞营养因子(CNTF)、表皮生长因子(EGF)、成纤维细胞生长因子7(FGF7)、胰岛素样生长因子结合蛋白-1(IGFBP1)、 IGFBP2、IGFBP4和神经生长因子受体(NGFR)的分泌增加。图72显示白细胞介素7(IL7)、IL10、IL13和IL16的分泌增加。
图73显示仅与10%PRP(无IL-2刺激)温育72小时后来自SEN-hADSC 的促β细胞素(BTC)、白细胞介素-13受体亚单元α-2(IL13Ra2)和基质细胞衍生因子-1β(SDF1b)的分泌增加。显示了相对于用于hADSC支持的含有 10%PRP的培养基中基础水平存在的相应蛋白质的量的分泌水平。
图74显示仅与10%PRP(无IL-2刺激)温育72小时后来自SEN-hADSC 的肝细胞生长因子(HGF)、白细胞介素8(IL8)和TNFRSF1A(肿瘤坏死因子受体超家族1A成员)的分泌增加。发现这些因子不存在于PRP中。
图75显示用IL-2刺激24小时后来自SEN-hADSC的趋化因子(C-C基序) 配体23(CCL23)、睫状节神经细胞营养因子(CNTF)、表皮生长因子(EGF)、 CCL11(嗜酸细胞活化趋化因子1)、IL4和神经生长因子受体(NGFR)的分泌增加。发现这些因子不存在于PRP中。
图75还显示了在IL-2刺激24h后CXCL16、HCC4、sgp130和TNFRSF1B 的分泌增加。显示了相对于用于hADSC支持的含有10%PRP的培养基中基础水平存在的相应蛋白质的量的分泌水平。
图76-86显示了在用IL-2刺激48小时后来自SEN-hADSC的以下命名的蛋白(因子)的分泌增加。显示了相对于用于hADSC支持的含有10%PRP的培养基中基础水平存在的相应蛋白质的量的分泌水平。图76显示了白细胞介素 1β(IL1b)、IL3、IL5、IL6、IL9、IL10、IL12b和白细胞介素18结合蛋白α(IL18BPa) 的分泌增加。图77显示白细胞介素1受体α(IL1Ra)、IL1R4、IL10Rb、IL18Rb、 IL1R2、IL-21R、IL-2Rβ、IL-2Rγ和IL5Ra的分泌增加。图78显示了成纤维细胞生长因子6(FGF6)、胰岛素样生长因子IGF1和IGF2、LAP(TGFβ家族)、神经营养因子3(NT3)、血小板来源的生长因子Aα(PDGFAA)、血小板来源的物生长因子Aβ(PDGFAB)和血小板来源的生长因子受体α(PDGFRα)的分泌增加。图79显示干细胞因子(SCF)、转化生长因子2(TGF2)、TGFα、TGFβ1、 TGFb3、肿瘤坏死因子β(TNFb)、血管内皮生长因子受体-2(VEGFR2)和VEGF R3的分泌增加。图80显示了DR6(TNF受体超家族成员21)、内皮因子(ENG)、受体酪氨酸蛋白激酶erbB-3(ErbB3)、Fas配体(Fas LG)、神经胶质细胞系来源的物的神经营养因子(GDNF)、GITR配体(GITR LG)和瘦素受体(LEPR)的分泌增加。图81显示催乳素(PRL)、干细胞因子受体(SCFR)、结合唾液酸的Ig样凝集素5(Siglec 5)、血管生成素1受体(TIE1)和血管生成素1受体(TIE2)的分泌增加。图82显示了趋化因子(C-C基序)配体8(CCL8)、CCL13、CCL15、 CCL17、CCL18和CCL20的分泌增加。图83显示了趋化因子(C-C基序)配体 22(CCL22)、CCL24、CCL26、CXC趋化因子配体9(CXCL9)和CXCL11的分泌增加。图84显示活化素A(INHBA)、骨形态发生蛋白5(BMP5)、E选择素(内皮细胞粘附分子)、细胞间粘附分子1(ICAM 1)、ICAM 2、L选择素(淋巴细胞粘附分子)和巨噬细胞集落刺激因子(MCSF)的分泌增加。图85显示基质金属蛋白酶1(MMP1)、MMP13、MMP3、MMP9、血小板内皮细胞粘附分子 (PECAM1)和金属蛋白酶抑制剂4(TIMP-4)的分泌增加。图86显示了单核细胞分化抗原(CD14)、淋巴细胞分泌素(XCL1)、心肌营养素-1(CT-1)、白血病抑制因子(LIF)、巨噬细胞迁移抑制因子(MIF)和原血小板碱性蛋白(PPBP)的分泌增加。
图87显示了在用IL-2刺激48小时后来自SEN-hADSC的脑源性神经营养因子(BDNF)、骨形态发生蛋白4(BMP4)、成纤维细胞生长因子7(FGF7)、胰岛素样生长因子结合蛋白-2(IGFBP2)、IL-2、IL16和干扰素γ(INFγ)的分泌增加。发现这些因子不存在于PRP中。
图88-89显示了在用IL-2刺激72小时后来自SEN-hADSC的下述蛋白质 (因子)的分泌增加。显示了相对于用于hADSC支持的含有10%PRP的培养基中基础水平存在的相应蛋白质的量的分泌水平。图88显示了脂联素(Acrp30)、刺鼠相关蛋白(AgRP)、ANGPT2(血管生成素2)、碱性成纤维细胞生长因子 (bFGF)、促β细胞素(BTC)、白细胞介素-13受体亚单元α-2(IL13Ra2)、瘦素 (LEP)、神经营养因子4(NT4)和基质细胞来源的因子-1α(SDF1a)的分泌增加。图89显示了趋化因子(C-C基序)配体2(CCL2)、CCL4、CCL5、CCL23、CCL25、 CCL27、CXC趋化因子配体10(CXCL10)、基质细胞来源的因子-1β(SDF1b)、金属蛋白酶抑制剂1(TIMP1)、TIMP2和肿瘤坏死因子超家族成员14(TNFSF14) 的分泌增加。
图90显示了在用IL-2刺激72小时后来自SEN-hADSC的粒细胞-巨噬细胞集落刺激因子(GM-CSF)和IL13的分泌增加。发现这些因子不存在于PRP 中。
表5A:SR+IL-2中差异上调的基因
表5B:SEN+IL-2中差异上调的基因
表5C:SR+IL-2中差异下调的基因
表5D:SEN+IL-2中差异下调的基因
从上述可以理解的是,尽管为了说明的目的在这里描述了本发明的具体变化,但是在不偏离本发明的精神和范围的情况下可以进行各种修改。因此,除了所附权利要求之外,本发明不受限制。
- 还没有人留言评论。精彩留言会获得点赞!