用于高效将分子递送至单细胞中的高通量反馈控制型电穿孔微型装置的制作方法
本申请要求2015年9月4日提交的美国申请号62/214,665的优先权,将所述申请通过引用以其全文结合在此。
关于联邦政府资助的研究的声明
本发明部分由国家科学基金会(nsf)通过idbr奖项#1959918和cbet奖项#0967598赞助。
本披露总体上涉及细胞电穿孔和分子递送领域,使用智能的反馈控制型微型电穿孔系统以用于以连续流方式转染单细胞。
背景技术:
将小分子和大分子-包括例如dna、药物分子、成像剂、肽、抗体和酶-递送到细胞中对于实现它们在一系列研究和治疗应用中的全部潜力至关重要;然而,细胞内递送和转染仍然是困难的任务。成功的转染在许多类型的生物医学研究和生物生产工作流程中是一个限速步骤,控制着包括生物制药、rna干扰筛选和干细胞研究在内的市场。然而,这种潜力尚未实现,主要是因为难以安全、有效和高效地转染细胞。挑战包括可变和差的转染效率,尤其是难以转染的细胞系,如原代细胞系和干细胞系,所述细胞系对发育动力学、药物发现和再生医学研究具有重要意义。
在电穿孔过程中,基因或其他大分子与活细胞在缓冲介质中混合,并施加高电场的短脉冲。细胞膜瞬时变成多孔,且基因或大分子进入细胞。然而,电穿孔经常达不到所需的效率和可靠性,主要是因为两个缺陷。首先,电穿孔后控制分子运输的机制尚未清楚了解。其次,透化阈值随群体内不同细胞和不同种类的细胞而变化,这些细胞在由于过度暴露于电信号而透化的情况下存活的能力也如此变化。此外,由于所述程序是在群体中单个细胞特性不同的大量细胞群中进行的,因此只能选择电穿孔条件来处理平均数量的细胞群;目前实施的程序不能适应单个细胞的特定特征,同时也无法针对高通量和自动化进行定制。
因此,存在对于能够解决上述挑战的新型改进的微流体电穿孔装置的需要。
技术实现要素:
在一个方面,本发明提供了用于对生物细胞进行电穿孔的系统,所述系统包括:微流体通道,其适于接收缓冲溶液中的多个生物细胞的流,其中所述微流体通道包括检测区域;一对适于跨检测区域施加电场的电极;信号发生器单元,其中所述信号发生器单元能够通过电极生成细胞检测信号和透化信号;感测单元,其中所述感测单元适于检测检测区域的阻抗;以及控制器单元,其中所述控制器单元适于根据由感测单元检测到的阻抗来控制信号发生器单元。
在一个实施例中,信号发生器单元能够同时生成细胞检测信号和透化信号。在另一个实施例中,信号发生器单元能够生成交流电(ac)波形以及单个或一系列直流电(dc)脉冲波形。在一个实施例中,信号发生器单元能够在所述对电极之间生成低振幅的基于正弦波的感测电场。在一个实施例中,信号发生器单元能够生成单个以及一系列dc脉冲。
在一个实施例中,感测单元包括锁定放大器。在另一个实施例中,感测单元能够同时解析细胞检测信号和透化信号。在另一个实施例中,感测单元还包括能够测量检测区域内细胞荧光的成像装置。
在一个实施例中,微流体通道能够借助流体动力学使多个生物细胞的流集中通过检测区域。在另一个实施例中,所述系统还包括适于接收缓冲液流的第二微流体通道,并且其中所述第二微流体通道包括第二检测区域。在一个实施例中,感测单元适于检测第二检测区域的阻抗。
在一个实施例中,信号发生器单元能够生成递送信号。在一个实施例中,控制器单元根据感测单元检测到的阻抗控制信号发生器单元生成透化信号。在另一个实施例中,控制器单元根据感测单元检测到的阻抗控制信号发生器单元停止生成透化信号并生成递送信号。
在另一方面,本发明提供了一种用于在缓冲溶液中对生物细胞进行电穿孔的方法,所述方法包括借助流体动力学将生物细胞集中到检测区域;生成第一电信号;使用第一电信号监测检测区域的阻抗值,其中检测区域的阻抗值增加超过基线阈值指示存在生物细胞;响应于检测区域阻抗的增加生成第二电信号;确定检测区域的阻抗值是否大于透化阈值;并且响应于确定检测区域的阻抗值,调整第二脉冲信号的至少一个参数。
在一个实施例中,第一电信号包括连续低振幅正弦波形。在另一个实施例中,第二电信号包括dc脉冲波形,其中dc脉冲波形包括固定频率下的一个脉冲或多个脉冲。
在一个实施例中,所述方法还包括响应于确定测量的阻抗值约等于透化阈值停止第二电信号;和生成第三电信号,其中第三电信号有助于将分子递送到集中在所述检测区域内的细胞中。在另一个实施例中,所述方法还包括确定所述检测区域的阻抗值是否约等于透化阈值;并且响应于确定检测区域的阻抗值不约等于透化阈值而调整第三电信号的至少一个参数。
在一个实施例中,所述方法还包括响应于确定所述检测区域的阻抗值是以下一者停止所述第三电信号:小于或等于活力阈值,或等于基线阈值。在一个实施例中,响应于确定所述检测区域的阻抗值小于或等于活力阈值,停止所述第三电信号。在另一个实施例中,响应于确定所述检测区域的阻抗值等于基线阈值,停止所述第三电信号。
在一个实施例中,基线阈值是通过连续监测只流过缓冲溶液的第二检测区域的阻抗值确定。
在一个实施例中,所述第二电信号的至少一个参数选自以下项的组:电场振幅、脉冲持续时间、脉冲序列频率、占空比和循环次数。在另一个实施例中,所述第三电信号的至少一个参数选自以下项的组:电场振幅、脉冲持续时间、脉冲序列频率、占空比和循环次数。
在一个实施例中,透化阈值是通过实验确定。在另一个实施例中,透化阈值是使用数学模型确定。在一个实施例中,透化阈值对应于不引起细胞死亡的最佳细胞透化。
在另一方面,本发明提供了一种对多个生物细胞进行电穿孔的方法,所述方法包括借助流体动力学将多个生物细胞的连续流集中为单行流,其中所述单行流使所述多个生物细胞中的每一个通过检测区域;生成第一电信号;使用所述第一电信号监测检测区域的阻抗值,其中检测区域的阻抗值增加超过基线阈值指示存在所述多个生物细胞中的每一个;响应于检测区域的阻抗的增加,生成第二电信号;确定检测区域的阻抗值是否大于透化阈值;响应于确定检测区域的阻抗值调整第二脉冲信号的至少一个参数。
在一个实施例中,所述方法还包括响应于确定测量的阻抗值约等于透化阈值停止第二电信号;并且生成第三电信号,其中所述第三电信号引起将分子递送到集中在所述检测区域内的多个生物细胞中的每一个中。在另一个实施例中,所述方法还包括确定所述检测区域的阻抗值是否约等于透化阈值;并且响应于确定检测区域的阻抗值不等于透化阈值而调整第三电信号的至少一个参数。
在一个实施例中,所述方法还包括响应于确定所述检测区域的阻抗值是以下一者停止所述第三电信号:小于或等于活力阈值,或等于基线阈值。在一个实施例中,响应于确定所述检测区域的阻抗值小于或等于活力阈值,停止所述第三脉冲。在另一个实施例中,响应于确定所述检测区域的阻抗值约等于基线阈值,停止所述第三电信号。
在一个实施例中,基线阈值是通过连续监测只流过缓冲溶液的第二检测区域的阻抗值确定。
在一个实施例中,所述第二电信号的至少一个参数选自以下项的组:电场振幅、脉冲持续时间、脉冲序列频率、占空比和循环次数。在另一个实施例中,所述第三电信号的至少一个参数选自以下项的组:电场振幅、脉冲持续时间、脉冲序列频率、占空比和循环次数。
在一个实施例中,透化阈值是通过实验确定。在另一个实施例中,透化阈值是使用数学模型确定。在一个实施例中,透化阈值对应于不引起细胞死亡的最佳细胞透化。
附图说明
将参考以下附图来描述实施例,其中在所有图中相同的编号表示相同的项目,并且其中:
图1a和图1b图示出根据一个实施例的透化和递送电穿孔信号的示意图;
图2a、图2b和图2c图示出根据一个实施例,当细胞进入检测区域和当细胞透化时,阻抗随时间推移的变化;
图3a-图3g图示出根据多个实施例,智能电穿孔系统的示意图;
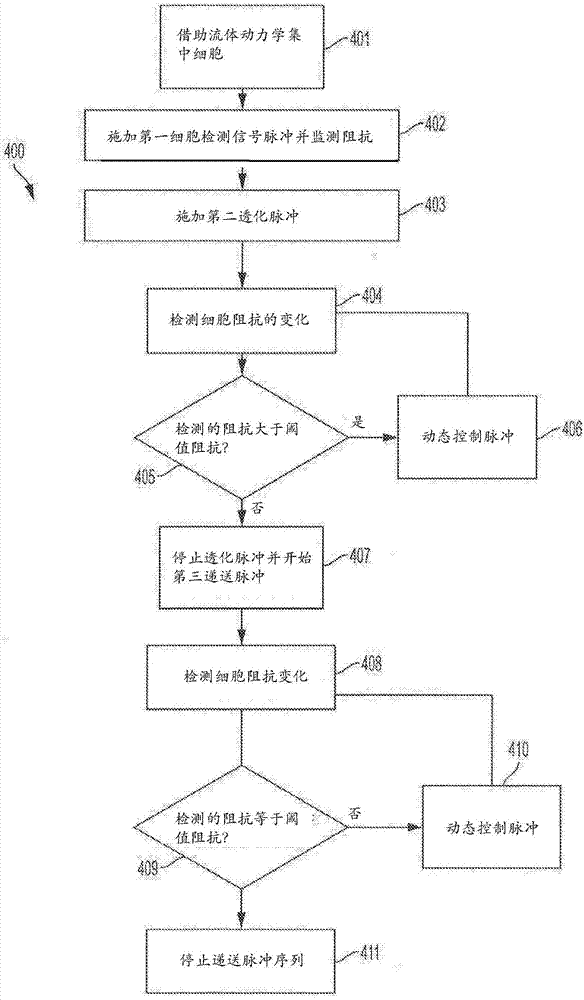
图4a图示出根据一个实施例,对连续流中的细胞进行电穿孔的流程图方法。
图4b示出根据一个实施例,图示出执行图4a的步骤的自动电穿孔控制算法的操作的状态图。
图5a和图5b图示出根据一个实施例,示出细胞检测的阻抗图的变化的电流幅值对时间图。
图6a示出电流幅值对时间曲线图,其图示出细胞膜透化电流幅值在捕获细胞实验的连续阻抗追踪下显著增加。
图6b图示出被设计用于捕获单细胞并扫描阻抗信息的微流体细胞捕获通道。
图7a和图7b分别代表根据一个实施例的阈值阻抗建模和相应实验数据。
图7c代表根据一个实施例的模型电池/电解质等效电路。
图8a-图8d图示出根据一个实施例,示出细胞检测、透化和递送的阻抗图的变化的电流对时间图。
图9是可用于理解能够实施本文所述方法的示例性计算机硬件的框图。
图10示出根据一个实施例,根据持续时间对细胞膜响应的表征。
图11示出根据一个实施例,根据电场强度和持续时间二者对细胞膜响应的完全表征。
图12示出根据一个实施例,根据电场强度和持续时间二者以及光学碘化丙啶荧光验证对细胞膜响应的表征。
图13a-图13f示出根据一个实施例,用各种电场强度和持续时间参数处理的细胞群体的直方图。
图14示出根据一个实施例,细胞针对不同电穿孔条件的活力。
具体实施方式
披露了在使用用于转染流动单细胞的智能反馈控制型微型电穿孔系统中的细胞电穿孔和分子递送方法和系统。
将容易理解的是,如在此大体描述和在附图中示出的实施例的组分可以以各种不同的配置来安排和设计。因此,如图中所表示的各种实施例的以下更详细的描述并非旨在限制本披露的范围,而仅仅代表各种实施例。虽然在图中呈现了实施例的各个方面,但所述图不一定按比例绘制,除非明确指出。
本披露可以在不脱离其精神或实质特征的情况下以其他具体形式来实施。所描述的实施例在所有方面均被视为说明性的。因此,本披露的范围由所附权利要求书指示。
贯穿本说明书对特征、优点或类似语言的引用并不意味着可以用本披露实现的所有特征和优点应是或者在本披露的任何单个实施例中。而是,引用特征和优点的语句应理解为意指结合实施例描述的特定特征、优点或特性被包括在本披露的至少一个实施例中。因此,整个说明书中的特征和优点以及类似语言的讨论可以但不一定涉及相同的实施例。
此外,本披露所描述的特征、优点和特性可在一个或多个实施例中以任何合适方式组合。根据本文的描述,相关领域的技术人员将认识到,可以在没有特定实施例的一个或多个特定特征或优点的情况下实践本披露。在其他情况下,在某些实施例中可以认识到附加特征和优点,所述附加特征和优点可能不存在于本披露的所有实施例中。
贯穿本说明书对“一个实施例(oneembodiment、anembodiment)”的提及意味着结合所示实施例描述的特定特征、结构或特性包括在本披露的至少一个实施例中。因此,整个说明书中的短语“在一个实施例中(inoneembodiment、inanembodiment)”和类似语言可以但不一定全部涉及相同的实施例。
除非上下文另外明确规定,否则如本文件中所用,单数形式“一个/种(a)”、“一个/种(an)”以及“所述(the)”包括复数指代物。除非另外定义,否则在此所用的所有技术性和科学性术语具有与本领域中普通技术人员通常所理解的相同含义。如本文件中所用,术语“包括”是指“包括但不限于”。
电穿孔是进入细胞的细胞质以递送分子的手段。在所述技术中,可以在体外或体内施加的电场瞬时透过细胞膜,生物活性分子如dna、rna和氨基酸可以通过所述细胞膜进入细胞。本披露描述了用于检测和电穿孔细胞的基于流的自动化细胞检测和电穿孔信号系统的系统和方法。
在一个实施例中,本发明的系统连续监测流过检测区域的电流,以确定单细胞在电穿孔之前、期间和之后流过微流体通道的细胞膜阻抗。所述系统还包括感测单元,所述感测单元可以包括细胞膜透化反馈控制回路,所述细胞膜透化反馈控制回路使用第一电检测信号来监测微流体通道的检测区域的阻抗,以确定单细胞何时进入检测区域。在一个实施例中,第一电检测信号是低振幅ac正弦波形。进入检测区域的单细胞可以表示为阻抗增加超过基线阈值,类似于例如库尔特计数器中的脉冲电阻传感器。施加第二电透化信号透过单细胞的细胞膜。所述系统可以自动调整第二透化信号的参数,直到满足预定的亚致死透化阈值。连续监测检测到的细胞的阻抗以确定何时达到亚致死透化阈值。施加第三电递送信号,以将分子递送至细胞质中。所述系统可以自动调整第三递送信号的参数。在此过程中,可连续监测检测区域的阻抗和检测到的单细胞,以检测阻抗变化是否超过预定的最大阈值,这可能导致可能不可逆的细胞损伤,于是反馈控制回路关闭第三电递送信号并为下一个通过的细胞重置系统。基于检测到的细胞的细胞群体的细胞大小和类型,上述阈值可以选自数据库,包括预先执行的校准结果的数据集和/或使用计算模型实时导出的数据集。
在一个实施例中,连续流微通道中的一对电极施加低振幅ac正弦波,以感测电极之间的检测区域中的阻抗变化。当由于电流因通过的细胞而移位,阻抗增加时,信号发生器单元输出dc脉冲波形,以透过细胞的细胞膜。感测单元监测在细胞的膜导电性变大(由于细胞膜因透化dc脉冲波形而透化)时细胞阻抗的变化。这种膜透化反映为针对预定阈值监测和检查的电阻抗读数,以确保尚未超过与特定细胞的细胞死亡相关联的阻抗阈值。反馈回路监测是否不超过阈值,施加透化dc脉冲波形,并且如果达到阈值,则将透化dc脉冲波形停止。然后施加递送dc脉冲波形,以驱动外源分子进入细胞,与膜透化dc脉冲波形相比,其振幅较低,但持续时间较长,以保持膜开放并以电泳方式驱动递送。在此过程中,感测单元保持连续监测细胞的阻抗,以确保透化读数未超过指示即将发生细胞死亡的阈值。
如本文所用,信号是任何时变波形,且可包括例如交流电(ac)波形或直流电(dc)波形。在一些实施例中,本发明的信号可以是ac正弦波波形、单个dc脉冲波形或一系列dc脉冲波形。在一些实施例中,第一电检测信号可以是ac波形。在其他实施例中,第一电检测信号可以是一系列dc脉冲波形。在其他实施例中,第二电透化信号可以是dc脉冲波形或一系列dc脉冲波形。在一些实施例中,第三电递送信号可以是dc脉冲波形或一系列dc脉冲波形。
图1a和1b示出了如上所述的透化信号和递送信号:透化的第一信号101,马上随后分子递送的第二信号102。施加第一高场(“hv”)信号通常是膜透化以克服跨膜电势的临界阈值的必要条件。另一方面,一旦实现透化,可以使用低场(“lv”)信号来有效地递送小分子和大分子,同时减少由于场暴露而造成的损害。因此,双信号电穿孔系统可以独特设计,其中第一信号是高振幅,持续时间短,用于透化细胞膜而不会不可逆地破坏细胞,并且第二信号持续时间更长且振幅更低,用于保持膜孔开放和以电泳方式驱动分子进入细胞。通过以这种方式利用一系列信号,与已知的电穿孔技术相比,细胞电穿孔和分子运输效率同时提高,且细胞活力增加。在整个自动电穿孔系统的背景下,透化信号和递送信号二者均可以由包括中央处理算法的控制器单元来监测、执行和/或调节,所述算法控制何时施加上述信号以及施加多少。中央处理算法也能够在细胞膜阻抗监测期间的任何时候启动或终止透化或递送信号,同时仍观察到单细胞的存在。
使用本领域技术人员已知的技术,电场强度和持续时间可针对目标分子定制以提高整体性能。在一些实施例中,施加的透化信号的场强度可以在0.1至5kv/cm的范围内,持续时间在0.1与100ms之间。在另一个实施例中,施加的递送信号的场强度可以在0.1至5kv/cm的范围内,持续时间在0.1和100ms之间。在一个实施例中,透化信号经设计,透化信号的振幅高(例如,>1kv/cm)但持续时间短(例如,<1ms)以使细胞膜电透化;且递送信号的振幅低(<0.6kv/cm),但持续时间长,其用于保持来自第一信号的孔开放并以电泳方式将分子运输到细胞中。例如,在一个实施例中,对于经历这种电穿孔的任何选择的细胞类型,可以基于文献中已知的设定值来选择两个信号的初始输出振幅和持续时间信息,并且可以在系统执行之前由操作员输入。在一些实施例中,常见细胞类型的参数可以存储在系统中。在其他实施例中,取决于在施加两个信号中的任何一个信号期间对细胞膜阻抗信息的感官扫描,中央控制算法保留基于细胞膜状态的连续追踪/扫描修改任一信号(例如,改变诸如振幅的参数、终止或延长)的能力,以保持细胞活力。
例如,在一个实施例中,第一信号可以分别在vi=100v(e1=100,000v/m)和t1=0.001s下以在所有时间处的强度和持续时间编程,以促进明显透化,不同细胞和分子类型具有低递送和高活力。第二lv信号参数可以被编程以靶向分子的尺寸和电荷、细胞类型和hv信号参数。例如,在一个实施例中,第二信号可以在l~10v/m和t1=0-0.1s下以强度和持续时间编程。也可以针对手边处理的各种细胞类型动态地自动调整电信号振幅和持续时间值。在自动电穿孔系统的情况下,对于经历这种电穿孔的任何选择的细胞类型,操作员可以选择允许系统在检测到单细胞时确定透化信号的初始参数,并通过使振幅从基础值如0kv/cm电场,以等于或低于10kv/cm电场/毫秒的最大增量速率逐渐增加,直到系统检测到细胞膜透化指示信号确定其阻抗读数。第一信号的电场和持续时间可以被记录和存储以备未来用作这类细胞的参考。
此外,第二信号的施加可以基于第一脉冲的电场强度,其中可以使用与第一信号相比具有降低的电场强度的信号。例如,如果使用1kv/cm电场强度通过第一信号使细胞透化,则系统可以启动具有用户可定义的减少(如40%)的第二信号,以输出0.6kv/cm电场强度的脉冲。细胞膜状态的连续追踪也可以提供关于细胞活力的信息,并且第二信号可以基于细胞活力接近达到不可逆损伤点(通过预校准确定的阈值)或递送材料的饱和(通过预校准确定的阈值)来终止。
在一个实施例中,双信号电穿孔系统可以被设计成在微米级操作,并且两个信号可以在可调频率(1hz–1ghz,0–100%占空比)下被“切割”成dc脉冲串,进行适当的振幅调整以满足透化需求,以便在电穿孔过程中测量细胞膜透化响应而不产生电解。在一个实施例中,可以基于细胞类型、结构、缓冲特性、微流体通道特征等来创建数据库,其包括透化信号的实验表征和/或计算建模。如下所讨论,然后可以基于检测到的细胞和其他特性,使用数据库和/或基于所述数据库的计算建模来设计信号。
在一些实施例中,本发明的系统监测微流体通道的检测区域,以检测微流体通道的检测区域内的细胞,并且通过阻抗监测来监测检测到的细胞的透化状态。图2a和图2b示出当细胞移动通过微流体通道时,总体通道阻抗的变化。将交流电检测信号施加到微流体通道上,且当细胞210通过微流体通道200时,它使周围电解质移位,引起电阻抗在液体的交流电传感器检测202下轻微增加(像电阻脉冲),这是根据欧姆定律通过所述通道上的电流203的变化监测。这允许通过电阻脉冲的数量来给细胞计数,并根据脉冲幅值确定信息的大小,这又取决于移位的电解质的体积。阻抗增加是因为包含细胞膜的非导电脂质双层是完整的并且阻止细胞内和细胞间溶液的开放连通。但是,一旦透化220,细胞就会变得导电,并且阻抗降低204(并且电流增加)。可以检测阻抗的变化,以提供如图2中所示细胞的透化状态的标记,且可以急剧调整施加的电场,以切换至低强度耐受性良好的针对特定细胞类型和尺寸的自定义场,以使递送最大化,如上所述。图2c图示出利用类似原理,利用阻抗下降来检测细胞进入和透化的连续流过程。
图3a至图3c图示出了本披露的“智能”电穿孔系统的一个实施例,其识别每个细胞的透化状态,并动态地调整透化信号以防止过度暴露于高强度场,然后施加特定设计用于驱动一种或多种期望的分子进入细胞的递送信号。
图3a提供了智能电穿孔系统300的示意图。所述系统可以包括微流体细胞处理系统310,其与电透化测量设备320整合形成用于透化不同类型的细胞的完全自主同步性阻抗反馈控制型微电穿孔平台。
微流体细胞处理系统310可以包括适于接收缓冲溶液中的多个生物细胞的流的微流体通道,其中微流体通道包括检测区域。电透化设备320可以包括一对适于跨检测区域施加电场的电极;信号发生器单元,其中所述信号发生器单元能够通过所述电极生成细胞检测信号和透化信号;感测单元,其中所述感测单元适于检测检测区域的阻抗;和控制器单元,其中所述控制器单元适于根据感测单元检测到的阻抗控制信号发生器单元。在一些实施例中,使用锁定放大器325检测和监测电穿孔期间发生在细胞膜中的阻抗变化,并将其用作透化的指标。在一个实施例中,信号发生器单元可以包括一个或多个电信号发生器。在一些实施例中,信号发生器单元可以包括与一个或多个电信号发生器整合的电记录设备,并且控制器单元(这里未示出)可以使用细胞阻抗反馈信息,根据中央处理算法,被编程为动态地调整信号参数。在一个实施例中,电透化设备320可以利用反馈控制回路301将由控制器单元生成的信号反馈控制信号传输至电极312(a)和312(b),以基于阻抗变化的严重程度调整信号的持续时间和幅值,以改善分子递送和细胞活力。在一个实施例中,控制器单元可以利用来自锁定放大器325的阻抗读数和来自信号发生器单元326的信号特性来生成控制信号。信号发生器单元可以用于生成信号和/或经由反馈回路与电极通信。透化设备320还可以包括用于分析和确定透化阈值的感测单元327。透化设备320还可以包括dut328,其是各种设计的封闭微流体通道,其允许单细胞流过有限空间以允许可识别或增强的细胞整体阻抗或膜透化信号。
细胞处理系统310可包括微流体设备311,其被设计用于将单细胞以流体动力学方式集中在定义的检测区域312中。在检测区域312内检测到细胞时,可以仅通过智能电穿孔仪施加信号,并且可以监测细胞膜阻抗并与各种阈值进行比较,所述阈值如基线阈值(指示检测区域中不存在细胞)、使效率和细胞活力最大化的亚致死透化阈值和最大透化阈值(超过它,细胞活力降至低于可接受量)。可以在校准期间预先建立电穿孔设备和细胞类型的阈值或在使用期间实时确定,以防止过度电透化。一旦满足阈值条件,系统可以被配置为施加、终止或改变各种信号。
图3b示出根据一个实施例的智能电穿孔系统的微流体细胞处理系统310。所述系统可以使用本领域技术人员已知的微制造技术来设计。如图3b所示,可以使用诸如光刻的技术将微流体通道313的图案形成于载玻片上,并且可以被配置用于借助流体动力学集中(使用流体微通道315)单细胞316,以在电极之间递送。使用来自侧入口的流体流借助流体动力学将细胞集中成单行允许连续引入细胞,并且优于窄的单个通道,这是因为这些通道有堵塞的倾向。可以控制细胞浓度和流速以提供细胞之间的最佳间隔。在一个实施例中,电极312(a)和312(b)是使用剥离技术在干净的载玻片上制造的,并且可以用于共面感测、透化细胞和递送促进运输的电场。在示例性实施例中,使用光刻定义的光致抗蚀剂掩膜层(evg620暴露系统)来图案化电极,以限定电极区域,接着溅镀
如图3c中所示,在一个实施例中,所述系统还可以包括具有电极的第二相同微通道350。第二相同微通道可以与缓冲溶液一起流动但没有细胞,并且第二相同微通道的阻抗值可以与细胞流过的第一微通道并行取样,以提供用于差异化的理想参考信号,并帮助检测快速移动的单细胞。来自两个微通道中的每一个的微电极可以各自连接到电流-电压转换器318(a)和318(b),它们又连接到锁定放大器325。
所述系统还可以包括能够对智能电穿孔系统的透化阶段和递送阶段成像的成像装置(例如,荧光成像装置)。例如,可以使用cooke科学cmos相机,其能够以100fps拍摄全场(2560×2160像素)落射荧光图像,并且能够以接近2000fps拍摄部分场(100×2160)。在细胞处于电极内时,将触发相机拍摄落射荧光图像。
图3e-3g图示出根据本披露的智能电穿孔系统的各种实施例。
图4a提供了使用图3a至图3c的智能电穿孔系统,使连续流中的单细胞透化的方法。如图4a所示,在步骤401中,连续流系统中的细胞借助流体动力学集中,使得单细胞被引入限定的检测区域,其可以触发智能电穿孔系统施加信号并触发锁定放大器记录细胞阻抗。有关流体动力学集中的概念对于本领域技术人员是已知的。
如本文所述,可以使用智能电穿孔系统对不同的细胞类型进行电穿孔。实例可以包括而不限于3t3成纤维细胞、人真皮成纤维细胞(hdf)和类淋巴母细胞(lcl)。可以使用本领域技术人员已知的技术制备用于电穿孔的细胞。例如,可以将3t3成纤维细胞维持在完全细胞培养基中,并在收获用于实验之前培养至80%汇合度。在电穿孔之前,细胞经胰蛋白酶处理,并重新悬浮在电穿孔缓冲液中。电穿孔缓冲液是250mm蔗糖、10mmhepes和选定浓度的mgcl2盐的等渗溶液(ph7.4)。加入的mgcl2的量(范围从0.4-11.2mm)决定了所述细胞外缓冲溶液的最终电导率(范围从100–2000μs/cm)。使用advanced渗压计3d3(先进仪器公司(advancedinstrument),norwood,ma)将溶液的同渗容摩调节至与细胞相容的310mosm/kg。通过注射泵(哈佛仪器公司(harvardapparatus),坎布里奇(cambridge),ma)将胰蛋白酶处理的细胞引入3入口微型装置的中间入口。3入口方式借助流体动力学将细胞集中到约20-25μm的宽度,以确保细胞以单行进入装置操作区域的中心。
本披露中描述的系统和方法可用于递送尺寸跨越数百道尔顿至数十万道尔顿的各种分子。可以高效地递送较小的分子,同时保持高水平的细胞存活。另一方面,较大的分子可能需要较高的场强或较长的脉冲来驱动它们进入细胞,这是以更大的细胞死亡为代价的。通过使用本披露的“智能”电穿孔仪系统,递送可以被最大化,同时保持活力。可以使用本文所述的系统和方法递送到细胞中的分子的实例包括而不限于小的有机化合物,如药物和分子探针、通常用作干扰rna(sirna)的小rna链、mirna、蛋白质和用于直接转染的质粒dna。
在步骤402中,在检测区域上施加第一细胞检测信号,并监测阻抗。在一些实施例中,第一细胞检测信号可以是从模拟模型或已知文献获得的ac检测波形。ac检测波形可以用于监测检测区域内存在或不存在细胞。
在步骤403中,当通过阻抗值增加超过基线阈值检测到生物细胞时,在检测区域上施加第二透化信号。在一些实施例中,如上所述,第二透化信号包括短持续时间、高频dc脉冲。ac检测信号和dc脉冲序列波形通过两个波形的简单叠加同时施加在检测区域中。以这种方式,当施加电穿孔信号时,可以连续监测检测区域的阻抗和检测到的细胞的细胞透化状态。在某些实施例中,ac检测波形可以与高频dc脉冲序列分开,并且可以在基于阻抗改变检测到检测区内的细胞时仅施加高频dc脉冲序列。在一些实施例中,当开始透化信号时,暂时停止检测,直到dc脉冲序列施加结束。固态开关可控制信号路径以防止从透化信号生成锁定放大器传感器中的电伪迹(electricalartifact)。
在一个实施例中,ac检测波形和高频dc脉冲序列的脉冲参数可以基于从在固定化细胞(对于特定细胞类型)上使用电穿孔系统接收的实验数据来选择。例如,适当的阈值水平、ac波形参数和dc脉冲序列参数可以是,细胞可以被捕获在具有在一对电极内的小细胞捕获区域(<5×5×10μm)的微流体装置中。图6示出锁定放大器对被捕获细胞的阻抗检测响应。在一个实施例中,可以在连续2vdc,100khz,50%占空比透化脉冲序列内施加连续的叠加0.2vpp15khz检测信号。线601示出只有溶液流过通道时的阻抗。将细胞引入捕获器后,阻抗急剧下降(线602)。也可以连续施加低幅(0.2kv/cm)场,以便几秒钟后细胞经历不可逆的电透化。脉冲去除后,电流保持增加(与阻抗下降一致)(线609)。插图610示出细胞被捕获的通道,以及透化期间的电流增加。然后可以进行两个独立的研究来评估电穿孔期间阻抗变化检测的灵敏度和一致性。首先,可以施加具有不同场强度和持续时间的100khz脉冲序列,同时保持占空比恒定。施加的场强可以在0.1至1kv/cm的范围内,并且施加的总脉冲的持续时间可以在10至100ms范围内,以在此参数空间内获得透化结果谱,范围从无透化到完全永久透化。对于场强和持续时间的每种组合,还可以记录电流变化的幅值。可以针对每个条件鉴定指示膜透化的电流变化,并检查所有条件下的一致性。
接下来,在验证了电透化的检测之后,可以使用细胞捕获器来校准智能电穿孔仪,以经由施加脉冲序列期间的阻抗改变来检测可逆透化。可以施加一系列场强为1kv/cm(l0vdc,100khz,50%占空比)的脉冲序列,但每次总脉冲持续时间可以限制在1与20ms之间,使得这个范围的下限可以产生可逆透化,而上限可以产生显著细胞死亡。以上脉冲参数和形成它们的方法只是为了举例而提供,且可以在不脱离本披露的原理的情况下进行调整。
当施加的脉冲序列是亚致死时,脉冲序列期间的膜阻抗下降,表示细胞透化,但是一旦脉冲终止就恢复,并且膜重新密封。然而,如果细胞被脉冲序列杀死,阻抗将不会恢复。因此,通过改变总脉冲长度,可以确定指示细胞死亡的活力阈值阻抗变化。活力阈值阻抗变化可以用于确定用于实施连续流动调查的最佳脉冲参数,即可以确定特定细胞类型的ac检测波形和高频dc脉冲序列的设计。捕获细胞中检查的参数空间的子集可应用于连续流智能电穿孔仪中,且也可用于评价细胞行为的任何差异和灵敏度变化。
在捕获的细胞中,细胞周围存在有限的缓冲液,且细胞对总阻抗的贡献率很高。然而,当细胞借助流体动力学集中时,细胞任一侧可能存在大量流体。因此,细胞膜电流的变化可能比来自溶液电流位移的整个细胞的检测信号小几个数量级。细胞相对于电极内的溶液缓冲液的体积越大,细胞(或细胞的变化)对电流信号的贡献将越大。在一个实施例中,为了减少细胞周围的导电流体的总量,可以用电和化学惰性的、低表面张力的溶液(如卤化碳油)作为两个外侧入口中的防护流,以借助流体动力学集中含有细胞的电穿孔缓冲液溶液,其位于中央入口中(参见图3c)。这可以通过在具有流体动力学可控宽度的通道的中间提供窄的导电流来消除来自缓冲溶液的大部分电流噪声。可替代地和/或另外,可以采用由逐渐变窄的收缩(constriction)(图3d)组成的微通道设计。这种微通道收缩设计用于增加细胞体积分数,检测信噪比,并且由于通过收缩使电场集中而放大施加的电场。微通道收缩的长度提供了增加检测区域中的细胞通过时间的手段,其允许在可逆或不可逆电穿孔之前、期间和之后有更长时间来表征来自细胞膜的详细电信息。例如,250μm长收缩加上0.3μl/min的总细胞流速可以提供在200–400ms范围内的通过时间。收缩的宽度根据细胞大小来定制,以提供良好适配,从而允许高电解质电流位移以及单细胞平稳连续通过收缩通道。例如,对于平均直径为10–15μm的nih3t3成纤维细胞,使用20–25μm的宽度来使防护流体和细胞二者能通过。通道的宽度在微通道制造的光刻步骤是可裁剪的。可以将通道的深度定义为10μm深度以将溶液体积限制在同时是检测和脉冲区域的收缩区域。平面电极可以放置在通道收缩的外面以便放大所施加的电场。对于250μm的收缩长度,可以使用大于260μm的电极距。
基于实验数据,在一个实施例中,可以通过施加1vp-p、20khzac用于细胞电流检测以及透化脉冲序列获得重叠的检测/透化波形,电场强度从静态细胞捕获实验测得(例如,1kv/cm,10khz)。
通过实施步骤401至403,可以使用基于原型信号差分微流体通道的信号检测器来检测和增强细胞膜阻抗变化,并标识微通道内借助流体动力学集中的单细胞的存在,并触发将透化信号施加于借助流体动力学集中的细胞。图5a和图5b中示出证明这种检测和触发信号的实验数据。图5a示出了使用差分信号传感器的单细胞检测峰值。图5a的结果是通过在15khz下将100mvp-p的ac电压施加到具有100μs/cm的溶液电导率的细胞缓冲液,所述缓冲液以0.5μl/min的流速流过微通道。信号中的尖峰是由平面电极之间的细胞引起导电缓冲液的体积位移(因此,电流的位移)导致的。在一个实施例中,细胞检测的电测量还可以通过与智能电穿孔仪集成的可视化系统,通过细胞(未示出)的光学可视化来验证。
图5b示出了自动实时单细胞检测和触发信号追踪曲线图的另一个实例,所述曲线图示出了在连续流中检测到每个细胞时阻抗的变化。在所示的电流-时间曲线图中,随着每个单细胞通过检测区域(收缩长度),获得高37db信噪比,并且每个下降(dip)501(n)提供关于细胞的持续时间、速度和阻抗幅值的信息。
回到图4,在步骤404中,可以通过使用感测单元连续监测阻抗来检测细胞阻抗的变化。在一些实施例中,感测单元包括锁定放大器。可以实施频率锁定放大技术来区分细胞特异性信号。锁定放大器充当参考信号频率附近的带通滤波器。可以通过在参考信号携带的频率和相位下对输入信号执行傅里叶变换来去除噪声。参考信号与输入信号相乘产生两个输出分量:一个的频率等于内部参考和信号分量的频率之差(wr-ws),另一个的等于两个频率之和(wr+ws)。当频率相等时(wr=ws),第一个分量产生dc信号,第二个分量将是参考频率的两倍(2wr)。低通滤波器排斥除了dc分量的一切。所述信号分别乘以独立的参考正弦波和余弦波以提取计算最终信号的振幅所需的相位信息。
为了确定锁定放大器的最佳感测频率,可以使用阻抗分析仪。阻抗分析仪可以根据电穿孔之前和之后的频率确定细胞阻抗。通过表征电穿孔之前和之后的阻抗,可以确定锁定放大器感测因膜破裂引起的阻抗的最大变化的最佳频率。然后可以将检测频率设置为期望的频率范围,以锁定通道中的细胞膜阻抗变化,以优化由电穿孔诱导的细胞膜透化导致的膜电导率增加的检测和定量。
对于叠加的检测/透化脉冲,可以使用两个不同的最佳频率来区分细胞检测阻抗变化与透化检测阻抗变化,并且所施加的频率范围可以在感测细胞时从用于检测检测区域中的细胞的最佳频率快速调整到检测透化的最佳频率。例如,具有函数发生器的90vn-通道快速切换powertrenchmosfet(fds6298,飞兆半导体公司(fairchildsemiconductor),亨茨维尔(huntsville),al)模块可以被配置为一旦检测到细胞信号则以纳秒速度在两个预定频率之间切换(从针对细胞检测的20khz到针对膜阻抗变化的mhz范围)。
虽然本披露利用锁定放大器来监测电池阻抗变化,但是现在或以后已知的其他用于监测阻抗变化的方法也在本披露的范围内。
在步骤405中,可以将检测到的阻抗值与透化阈值阻抗进行比较,其中阈值阻抗指示细胞的期望透化水平。可以选择阈值阻抗值以确保细胞活力(即,亚致死透化)。可以使用特定细胞的捕获细胞实验数据或使用数学模型来计算阈值阻抗。如果发现检测到的阻抗值大于阈值阻抗,则可以使用控制信号动态控制(406)步骤403的dc透化信号的脉冲参数,并且可以重复所述步骤直到检测到期望的阈值阻抗。可以使用特定细胞的捕获细胞实验数据(如上所讨论)或使用数学模型来生成控制信号以改变信号参数。在期望的阈值阻抗下,细胞可透化至期望水平,即亚致死透化。期望的透化水平可对应于最大的膜透化而细胞不死亡。对于dc脉冲序列,存在几个相关的参数,所述参数可能会影响电穿孔期间的递送效率,其可以被改变以实现期望的通透性:电场振幅、脉冲持续时间、脉冲序列频率、占空比和循环次数。例如,50khz脉冲序列具有20μs脉冲周期,和50%占空比,每个脉冲长度为10μs。要获得10ms的总脉冲施加,在50khz频率下施加1000个周期持续20ms。占空比控制每个脉冲之后的间歇时间量。可以改变上述任何参数,以达到所需的透化水平而不引起细胞电解。例如,在一个实施例中,可以调整占空比以增加脉冲宽度,以电解为代价增加递送时间,其中脉冲序列变得更像单个dc脉冲,或者减少以减少递送时间,同时增加脉冲的数量以使电解最小化。
在步骤407中,在步骤405中检测亚致死透化,可以停止透化信号,并且可以在检测区域中引入离散递送信号。递送信号可以是诱导带电物质流入的低强度电场。在一个实施例中,递送信号可以包括dc脉冲序列,其幅值范围可以在0.1–1kv/cm,持续时间为10–100ms。ac检测信号和递送dc脉冲序列波形可以通过两个波形的简单叠加同时施加在检测区域中。以这种方式,当施加递送信号时,可以连续监测检测区域的阻抗和检测到的细胞的细胞透化状态。
递送脉冲序列可以基于如上文针对透化信号所讨论的检测和透化信号的脉冲特征、细胞类型、细胞大小、缓冲液特性和其他特性预先设计。也可以使用反馈控制动态控制410递送脉冲序列,反馈控制持续监测阻抗变化(408)并将其与透化阈值阻抗(对应于亚致死透化)进行比较(409),以便将场强保持在方案内,其中孔保持开放以允许分子递送而不会达到指示细胞死亡的阻抗的过度变化。如此,可以动态地改变第二脉冲序列特征以最大化递送潜力。例如,可以基于智能电穿孔仪系统中的捕获细胞实验、数学模型和/或先前执行的连续流测量监测阻抗特征,以检测孔闭合、稳定性和持久性。
当达到过度暴露的活力阈值,即使场降低,或当阻抗值回到指示细胞已经流过检测区域的基线阈值,将终止场411。在一个实施例中,可以通过锁定放大器以100khz获取细胞内电流读数来监测阻抗变化,并且相对于预测的透化状态来迭代地检查。
图4b示出了用于执行图4a的至少一些步骤的算法的状态图。
图8a-图8d中示出利用本披露的系统和方法的示例性数据。图8a-图8d示出了总体细胞电流位移和细胞膜阻抗变化曲线以及对应的脉冲。图8a示出了自动实时单细胞检测和触发脉冲追踪图,其示出了上述系统和方法以高准确度检测和电穿孔每个经过的单细胞。每条竖直线801表示自动施加具有预定义脉冲参数的5-ms脉冲序列,在这种情况下,施加0.6kv/cm场强dc脉冲序列。阻抗曲线802上的每个下降809代表通过单个细胞,并且说明自动电穿孔准确度为93.7%,准确度为1.3个细胞/s。
图8b是来自图8a的8s-14s时隙中的五个细胞的放大图,并且示出了透化信号施加之前和之后关于细胞状态的独特信息。对于电流-时间图,电流信号的每个急剧下降表明脉冲区内存在单细胞,并且这个下降回到其原始基线表示细胞离开脉冲区。对于这五个细胞,施加信号后,观察到约900ms的平均通过时间,伴随着电流上升。
图8c图示出来自图8b的单细胞的放大图。δic表示电流位移信号,对于这种情况是0.72na,并且δip表示透化信号的变化,其随着施加到细胞的脉冲的幅值和持续时间而变化。δir表示对于接受非致死脉冲的细胞,可以将膜重新密封的膜重新密封电流。
图8d图示出了递送到流动单细胞(底部条带)中的核酸结合染料(碘化丙啶)的时间追踪。在20ms时标下,施加0.6kv/cm场幅的5ms脉冲序列,并且持续追踪荧光强度的速率,显示由于膜孔开放而稳定增加,并且在使观察到的透化峰通过后的强度速率减慢,我们认为这表明膜孔重新密封。
图9描绘了可用于容纳或实施如上所讨论的各种计算机程序和系统的内部硬件的实例。例如,上面讨论的智能电穿孔可以包括诸如图9所示的硬件。电总线900作为互连硬件的其他所示部件的信息高速公路。cpu905是系统的中央处理单元,实施执行程序所需的计算和逻辑操作。cpu905,单独或结合一个或多个其他元件,是处理装置、计算装置或处理器,因为本披露中使用此类术语。cpu或“处理器”是执行程序设计指令的电子装置部件。术语“处理器”可以指单个处理器或一起实现各个处理步骤的多个处理器。除非上下文明确指出需要单个处理器或需要多个处理器,否则术语“处理器”包括单数和复数实施例二者。只读存储器(rom)910和随机存取存储器(ram)915构成存储装置的实例。术语“存储装置”和类似的术语包括单个装置实施例,一起存储编程或数据的多个装置,或此类装置的单个扇区。
控制器920与一个或多个可选存储装置925接合,所述存储装置作为系统总线900的日期存储设施。这些存储装置925可以包括例如外部或内部磁盘驱动器、硬盘驱动器、闪存、usb驱动器或另一类充当数据存储设施的装置。如前所指示,这些各种驱动器和控制器都是可选装置。此外,存储装置925可以被配置为包括用于存储任何软件模块或指令、辅助数据、事件数据的单独文件,用于存储列联表和/或回归模型组的通用文件,或用于存储如上所讨论信息的一个或多个数据库。
用于执行与如上所述过程相关联的任何功能步骤的程序指令、软件或交互式模块可以存储在rom910和/或ram915中。任选地,程序指令可以存储在非瞬态计算机可读介质上,诸如光盘、数字磁盘、闪存、存储卡、usb驱动器、光盘存储介质和/或其他记录介质。
可选的显示器接口940可允许来自总线900的信息以音频、视频、图形或字母数字格式显示在显示器945上。可以使用各种通信端口950与外部装置进行通信。通信端口950可以连接到通信网络,如因特网、局域网或蜂窝电话数据网络。
硬件还可以包括接口955,其允许从诸如扫描仪的成像传感器960或诸如键盘、鼠标、操纵杆、触摸屏、遥控器、指向装置、视频输入装置和/或音频输入装置的其他输入装置965的输入装置接收数据。
实例
通过以下非限制性实例更充分地描述本发明。这些实例的修改对于本领域的技术人员而言将是清楚的。
实例1
为了确定检测细胞膜透化所需的最佳通道几何形状和感测频率,构建了细胞/电解质等效电路以对微型流式细胞仪中的单细胞电阻抗响应进行建模。此电路模型根据以前的模型进行修改,以解释电穿孔过程中细胞膜电导率的急剧增加。所述模型允许确定悬浮在缓冲液中的细胞在一对电极之间的阻抗,如图7c所示,其中cdl是双层电容。rm和cm分别是细胞外介质的电阻和电容。cmem是细胞膜的电容,并且ri是细胞内电阻。为了反映由于电穿孔进行的细胞膜透化导致的整体阻抗变化,将变量rmem与cmem并行实施。描述膜透化细胞且包括双层效应的最终总阻抗公式示于公式1中。
|z|是单细胞的阻抗幅值,ω是角频率,并且除了rmem之外,用于计算各个电子部件的值的公式对于本领域技术人员而言是已知的。rmem是基于典型膜片的电阻,rm=10000ω/cm2,并且假设球形细胞半径为r,可以如下计算:
绘制未处理细胞的阻抗幅值并与电穿孔细胞重叠(图7a)。由于rmem从完整(高rmem)变化为透化细胞膜状态(低rmem),阻抗变化δ|z|落在1与10khz之间的频率区域内。在电穿孔之前和之后对悬浮于100μs/cm缓冲液中的单个细胞进行频率扫描(100hz至100khz)的相应实验数据(图7b)显示出在由模型预测的频率范围中,阻抗变化相当。
为了确定电穿孔后影响δ|z|的因素,细胞体积分数和细胞外缓冲液电导率根据扫描频率发生系统性变化。已经确定,在较低频谱下电穿孔后的最大δ|z|由细胞体积分数(v细胞/v通道)和缓冲液电导率决定。通过使用微收缩通道提供5%的细胞体积分数和100μs/cm下的细胞外缓冲液电导率,可以使用1至10khz的频率范围找到电穿孔后细胞膜透化的最大变化。
实例2
方法和材料
装置由玻璃基底上的一对平面电极和通过软光刻制造的聚二甲基硅氧烷(pdms)微通道组成。采用标准光刻程序制造具有装置特征的硅母模。装置主通道长1mm,宽150μm,且深10μm,并入尺寸为250μm(l)×25μm(w)×10μm(d)的收缩。简而言之,将pdms聚合物和硬化剂的10:1混合物倒在模具上,以产生负性复制品,并使其在65℃下过夜固化。在pdms中打孔以产生到进口通道(直径0.5mm)和出口储器(直径1.5mm)的通路。钛/铂(ti/pt)平面电极通过金属‘剥离’工艺制造。将电极迹线在玻璃基板上光刻图案化,将凹槽用10:1缓冲氢氟酸蚀刻1分钟至约
在每次实验之前,在室温下用10%牛血清白蛋白(bsa)溶液预处理微通道1小时以防止到通道表面的非期望的细胞粘附。然后排空微通道,并将过量的bsa溶液从出口储器中移出并用10μl杜氏改良伊格尔培养基(dmem)培养基代替。在补充有10%v/v胎牛血清、1%v/v青霉素-链霉素和1%1-谷氨酰胺(西格玛奥德里奇公司(sigma-aldrich),圣路易斯(st.louis),密苏里州)的dmem中培养nih3t3小鼠成纤维细胞。在收获用于实验之前将细胞培养至约70%汇合度。将收获的细胞悬浮于由250mm蔗糖、10mmhepes和0.4mmmgcl2盐组成的等渗电穿孔缓冲液中以提供100μs/cm的电导率。使用精确微流体注射器泵(picoplus,哈佛仪器公司(harvardapparatus))以0.1μl/min的流速灌注细胞,导致整个微通道收缩的平均细胞通过时间为250ms。一旦建立稳定的单细胞流,电穿孔系统就根据用户的指令启动。分别在五个脉冲持续时间(0.2、0.8、1.0、3.0、5.0ms)下研究五个电场(0.44、0.58、0.70、0.87、1.05kv/cm,在细胞处测量)以施加不同程度的细胞膜透化。进行两种细胞测定以验证电穿孔系统。在第一测定期间,将一种在与胞质核酸结合后发荧光的细胞膜不透性染料碘化丙锭(pi)(p3566,生命技术公司(lifetechnologies))以100μm总浓度添加到电穿孔缓冲液中,以光学地指示膜透化。为每个单独细胞记录来自锁定放大器(hf2li锁定放大器,苏黎世仪器公司(zurichinstruments))的电信号和pi递送的荧光强度。在第二测定中,单细胞经历相同的电穿孔处理而不添加pi。在每次规定的脉冲处理之后,从出口储器经过20分钟收集约2000个细胞以用于活力评估。收集的细胞在1×pbs缓冲液中通过以2000rpm离心2分钟进行洗涤,然后在冰上用2μm7-氨基放线菌素d(7aad)(7aad,赛默飞世尔科技(thermofisherscientific))孵育20分钟,以允许细胞活力染色。然后在1×pbs缓冲液中再次洗涤细胞,之后在荧光显微镜下成像。使用matlab(matlabr2012b,mathworks)中编写的半自动化细胞扫描和处理算法来处理收集的细胞的荧光强度。
用锁定放大器动态提取信号并施加电穿孔脉冲。将定制的labview控制算法加载到锁定放大器的嵌入式系统中进行实时处理。一个装置电极通过导线i与锁定放大器的波形发生器输出连接,以递送1vp-p的感测激励信号,另一个电极通过导线ii与低噪声电流前置放大器输入(hf2ca电流前置放大器,苏黎世仪器公司)连接,然后将信号传递给锁定放大器传感器。选择1.224khz的频率以通过基于导数的峰值检测算法提供最佳细胞检测,并提供具有最高snr的最灵敏细胞膜透化检测。当在电穿孔区内检测到细胞时,电穿孔脉冲通过导线i由函数发生器(33220a波形发生器,安捷伦)立即递送,通过导线iii递送到监测示波器。所述脉冲在函数发生器中编程并馈送到高电压放大器(型号2350,tegam),以提供范围从0.44到1.05kv/cm的电场脉冲,持续时间在0.2到5.0ms之间。加入与函数发生器同步的cmos开关(df419dj+模拟开关,美信集成(maximintegrated))与锁定放大器的前置放大器输入串联,以防止电穿孔脉冲产生的测量伪迹。脉冲触发信号也被分配到安装显微镜的cmos相机(powerview1.4mp,tsi)的外部触发输入端,以便在每个脉冲之后同时拍摄pi进入细胞的图像。
结果
自动细胞检测和电穿孔
获得单细胞的自动检测和对每个细胞的即时脉冲施加,吞吐量为1.3个细胞/秒。由于通道中的体积位移不变,跨收缩长度的细胞通过产生稳定的基线电流。250ms的估计细胞通过时间为电穿孔和脉冲后阻抗测量提供了充足的时间窗口。在这个代表性的曲线图中,竖直的红线描绘了施加规定的电穿孔脉冲,在这种情况下,1.05kv/cm电场持续5.0ms。施用脉冲后立即观察到电流急剧升高。这种电流跳跃是细胞膜电导率增加导致,并且是由于电穿孔诱导的细胞膜透化而形成孔的特征。当细胞离开通道收缩时,电信号返回到缓冲溶液基线。每个穿过电穿孔区的细胞都重复此过程。测量单细胞检测的信噪比(snr)为37db。与光学观察相比,所述系统在检测和脉动每个细胞时保持97%的准确度。错误主要归因于多个细胞的偶尔追尾,导致对正在通过的每个细胞施加多个脉冲。
细胞膜透化分析
通过改变电穿孔脉冲的强度和持续时间,我们证明细胞阻抗的变化是细胞膜透化程度的特征。如图10所示,在施加脉冲时,测量的五个代表性细胞的细胞电流响应被叠加。通过保持电场恒定为1.05kv/cm,同时将脉冲持续时间从0变成5.0ms,更长的脉冲持续时间似乎在电极之间产生更大的电流跳跃,表明膜透化程度更高。图11示出了细胞膜响应与电场强度和持续时间二者的函数关系的完整表征。为了说明由于尺寸差异引起的细胞间变异,将透化电流与细胞基线相比的变化(δip)首先通过总细胞电流位移归一化(δic),并表示为与所检测细胞电流基线相比的百分比增加。当根据脉冲持续时间绘图时,归一化的透化电流与脉冲持续时间之间(δip/δic)存在强烈的依赖性,对于给定的电场强度,更长的脉冲持续时间导致更高的透化。当不同的强度被施加持续相同的脉冲持续时间时,也观察到对电场幅值的强烈依赖性,更强的电场导致更高的透化。对于从0.58到1.05kv/cm范围的电场,当脉冲持续时间达到并超过1.0ms时,我们观察到透化信号发生中的快速转变。由于系统允许连续流动和对电流进行动态测量,每个脉冲条件下至少测量200个细胞,总计分析5,000个单独细胞。
透化验证-碘化丙啶荧光追踪
还通过记录pi与细胞间核酸结合时发生的荧光强度变化目测验证以电学方法观察到的细胞膜透化(图12)。光学相机与锁定放大器传感器同步以在每次施加脉冲之后捕获脉冲细胞的图像序列。然后以单独细胞为基础评估这些图像的荧光强度。较大的脉冲强度和持续时间导致更大的细胞膜透化,这进而允许更多的pi进入穿孔的细胞膜,以与细胞质空间中的核酸结合,导致荧光强度升高。
由于电系统的灵敏度更高,因此需要更高的脉冲阈值来产生目测可区分的荧光强度。经目测,需要长于1.0ms的脉冲持续时间以可靠地将细胞膜透化程度与电参数相关联。例如,与透化信号的电测量一致的,在0.8ms脉冲持续时间之后观察到荧光强度的明显跳跃。通过绘制针对所有脉冲强度和持续时间的电-透化信号(δip/δic)与荧光强度,进一步验证了这种关系,这证明在膜孔开放度和细胞内部递送的pi量之间存在线性依赖关系。大开孔程度的标记是较高的δip/δic值,这对应于在处理的细胞内测量的较大程度的pi荧光强度。这些数据显示了pi递送量和膜透化程度之间的直接相关性,两者都与电脉冲参数成比例。
细胞活力研究-收集
通过7aad染色,经历规定的电穿孔处理的单细胞的活力也与电穿孔脉冲参数相关。细胞在暴露于电穿孔脉冲20分钟后恢复,使得活细胞有时间进行膜重新密封。我们发现最高的电场强度(1.05kv/cm)和脉冲持续时间(5ms)的组合导致了朝着来自死细胞的分布发生最大迁移。这是预期得到的,因为强电穿孔处理更可能不可逆地破坏细胞膜,阻碍重新密封。降低脉冲强度或持续时间可降低迁移幅值。在0.7kv/cm下进行电穿孔处理的所有细胞保持与对照活细胞相当的荧光,指示透化后20分钟内细胞膜完全重新密封。通过计算死细胞群体的平均荧光强度的95%置信下限,确定每个细胞群体的活力阈值,如图13d-13f中的竖直线所示。图14示出了每种电穿孔条件的细胞活力。整体细胞活力随着电场强度和脉冲持续时间单调减少。更强的脉冲条件更可能导致不可逆的细胞膜损伤,导致细胞死亡,而用中等条件(0.7kv/cm)处理的细胞可能恢复,显示更高的群体活力。
可以将上文披露的特征和功能及替代方案组合到许多其他不同的系统或应用中。本领域技术人员可以进行各种当前未预见的或未预期的替代、修改、变化或改进,它们各自也旨在由所披露的实施例包括在内。
- 还没有人留言评论。精彩留言会获得点赞!