一种核酸载体及其用途的制作方法
本发明属于生物医药领域,涉及一种核酸载体及其用途。本发明还涉及含有所述核酸载体和核酸分子的复合物,以及所述核酸载体/核酸分子复合物的制备方法及用途。
背景技术:
美国食品药品管理局(fda)将基因治疗定义为通过转录或翻译、转运和/或整合到宿主基因组中的外源基因进行治疗疾病的一种治疗方法。基因治疗是治疗癌症、单基因疾病、心血管疾病和神经性疾病等的潜在的最有效的治疗方法。自1990年,基因治疗第一次进入临床试验开始,全球已经有超过1800例基因治疗临床试验开展。我国更是在2004年,成为第一个在市场上引进基因药物(gendicine)的国家。由于用于基因治疗的核酸药物分子具有分子量大、富含大量负电荷以及极易降解等特点,目前基因治疗面临的最大难题是缺乏理想的转运载体,因此寻找高效、安全的基因转运载体成为研究的重点。
目前开展的临床试验大多采用腺病毒和逆转录病毒作为基因药物的载体,但病毒载体的缺点在于转运能力低、使用成本高昂和潜在的安全性问题等。在1994年,因为在临床试验中使用病毒基因载体造成病人死亡,致使基因治疗研究一度陷入停滞。因此,近些年非病毒类载体研究发展迅速,包括脂质体、阳离子聚合物和多肽等。非病毒载体转运基因药物多数通过自身的阳离子与基因药物的阴离子之间的离子相互作用负载dna或rna,形成较小尺度的纳米颗粒,转运dna或rna进入宿主细胞,进而整合到宿主基因组中进行表达。多肽以其较好的生物相容性、功能多样性和易于合成等特点成为基因治疗载体的较好选择。
细胞透膜肽(cell-penetratingpeptides,cpps)是一类能够高效介导核酸、蛋白等生物大分子透过细胞膜进入细胞的一类短肽,一般肽序列长度不超过30个氨基酸,大部分透膜肽富含赖氨酸和精氨酸等碱性氨基酸。其中,tat(49-57)(hivtatprotein)是细胞透膜蛋白肽片段中可完全行使细胞透膜功能且无细胞毒性的最小片段,tat(49-57)肽序列为arg-lys-lys-arg-arg-gln-arg-arg-arg(rkkrrqrrr,seqidno:7)。该段透膜肽可以通过在生理条件下其碱性氨基酸的正电荷与核酸的负电荷结合,负载核酸进而通过内吞作用介导核酸进入细胞,并且tat肽片段有一定的细胞核靶向能力。然而,通过内吞作用进入细胞的tat/dna或rna复合体首先进入内涵体(endosome,一种内部呈酸性环境的脂膜结构),最终运送至溶酶体降解。富含精氨酸的透膜肽肽序列rn(n=6-10)也具有和tat相似的特性。由于tat和rn缺乏逃逸内涵体的能力,因此很难单独作为递送dna的载体达到理想的转染效率。
实现内涵体逃逸的方法主要有两种,一种是利用酸性环境(ph<6.0)下具有离子缓冲作用的材料,通过质子泵作用破坏内涵体,使dna或rna复合体逃逸;另一种是利用带有α-螺旋双亲性结构的多肽与脂膜作用,形成空洞,释放出来dna或rna复合体。组氨酸能够在酸性的内涵体中不断吸收质子,通过“质子海绵”效应涨破内涵体,进而起到破坏内涵体脂质囊泡的作用。
层粘连蛋白(laminin,ln)是一种大分子胶原糖蛋白。随着对ln的深入研究,发现ln具有多种生物学作用:促进细胞的粘着、铺展、有丝分裂、加速神经轴突生长及细胞移动,并诱导细胞分化,还与形态发生和肿瘤转移有关。层粘连蛋白受体(ln-r)广泛存在于上皮细胞、内皮细胞、周围神经细胞、巨噬细胞以及大部分肿瘤细胞表面,在体外与ln的结合表现出高亲和性、竞争性、浓度与时间依赖性。当恶性肿瘤发生转移时,细胞表面的ln-r与ln粘附是肿瘤细胞与基底膜相互作用关键的一步,为肿瘤黏附、侵袭突破基底膜提供了分子基础;同时ln-r不仅能促进细胞在ln基质上黏附,而且能诱导细胞的趋化性迁移和iv型胶原酶的分泌;也发现早期阶段的ln-r和ln对肿瘤的新生血管形成至关重要。
目前,尚需要开发转染效率高、细胞毒性低的新的核酸载体。
技术实现要素:
本发明人经过深入的研究和创造性的劳动,得到了一种核酸载体即式i化合物。本发明人惊奇地发现,该核酸载体具有较高转染效率并且细胞毒性较低。此外,该核酸载体还能够较好地实现内涵体逃逸。由此提供了下述发明:
本发明的一个方面涉及式i所示的化合物,或其药学上可接受的盐,
a–b–c–d
式i
其中,
a表示细胞透膜肽,
b表示内涵体逃逸片段,
c表示一个或多个lys,和/或一个或多个arg,或者c缺失,
d表示层粘连蛋白受体靶向片段,并且
a和b之间,b和c之间,和/或c和d之间,为直接连接或者通过连接接头连接;
优选地,式i化合物还连接有一个或多个疏水分子e,并且所述疏水分子e连接在所述式i化合物中的lys和/或arg的侧链的氨基上。
所述直接连接可以是,例如a和b之中的一个的羧基和另一个的氨基之间形成酰胺键。b和c之间、c和d之间也可做类似理解。
所述连接接头,包括但不限于:一个或多个gly、一个或多个lys、和/或者一个或多个cys。所述多个可以是例如2-20个、2-15个、2-10个、2-8个、2-6个、2个、3个、4个、5个或6个。所述a和b之间,b和c之间,以及c和d之间的连接接头可以相同或不同。连接接头与a、b、c或d的连接也是通过羧基和氨基形成酰胺键连接。
在本发明的一个实施方案中,所述的式i化合物或其药学上可接受的盐,其特征在于如下的(1)-(5)项中的任意一项或者多项:
(1)所述细胞透膜肽选自tat、rn(n=6、7、8、9或10)、penetratin、map、pvec、mpg、mpgδnls、stearyl-r8、eb1和tat-drbd中的任意一种或者多种;
(2)所述内涵体逃逸片段为质子泵内涵体逃逸片段,优选地,为一个或多个his,例如4-10、4-8、4-6、4、5、6、7或8个his;优选为6个his;
(3)所述层粘连蛋白受体靶向片段为yigsr(seqidno:17)或yigsk(seqidno:18);
(4)所述疏水分子选自碳原子数大于或等于12的脂肪酸(例如硬脂酸、棕榈酸、油酸、亚油酸、软脂酸)、胆固醇和磷脂;
(5)所述疏水分子连接在c中的lys和/或arg的侧链的氨基上。
在本发明的一个实施方案中,所述的式i化合物或其药学上可接受的盐,其中,所述化合物如seqidno:1、seqidno:2或seqidno:4所示。
在本发明的一个实施方案中,所述的式i化合物或其药学上可接受的盐,其中,氨基酸序列的n末端乙酰化和/或c末端酰胺化。
根据本发明中任一项所述的式i化合物或其可药用盐或者本发明的复合物,其用于基因治疗。
在本发明中,组氨酸中咪唑基的pka约为6.0,能够在酸性内涵体中大量吸收质子,形成“质子海绵”效应,造成内涵体的破裂。
不拘于理论的限制,通过连接疏水性分子,提供疏水性环境,有利于带正电荷的亲水性氨基酸与带负电荷的核酸药物充分接触,进而形成稳定致密的纳米复合物,有利于细胞的摄取,可以通过疏水相互作用提高聚集体的局部浓度,进而提高局部电荷密度,提高dna或rna的负载能力、提高核酸载体/dna或rna复合体的稳定性,同时,通过其疏水性烷基链与细胞膜的融合作用,进而有效提高透膜效率和破坏内涵体的能力。
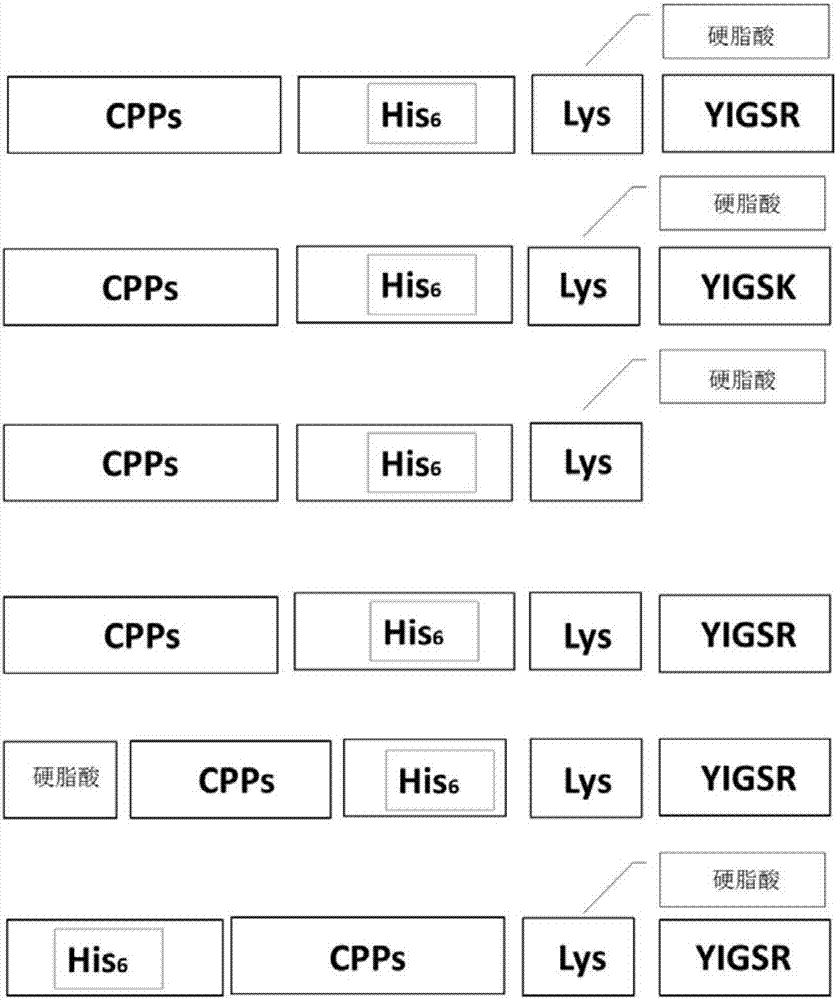
在本发明的一个实施方案中,所述核酸载体的序列为gly-arg-lys-lys-arg-arg-gln-arg-arg-arg-his-his-his-his-his-his-lys(c18)-tyr-ile-gly-ser-arg(seqidno:1)。
在本发明的一个实施方案中,所述核酸载体的序列为gly-arg-lys-lys-arg-arg-gln-arg-arg-arg-his-his-his-his-his-his--lys(c18)-tyr-ile-gly-ser-lys(seqidno:2)。
在本发明的一个实施方案中,所述核酸载体的序列为gly-arg-lys-lys-arg-arg-gln-arg-arg-arg-his-his-his-his-his-his--lys(c18)(seqidno:3)。
在本发明的一个实施方案中,所述核酸载体的序列为gly-arg-lys-lys-arg-arg-gln-arg-arg-arg-his-his-his-his-his-his-lys-tyr-ile-gly-ser-arg(seqidno:4)。
在本发明的一个实施方案中,所述核酸载体的序列为c18-gly-arg-lys-lys-arg-arg-gln-arg-arg-arg-his-his-his-his-his-his-lys-tyr-ile-gly-ser-arg(seqidno:5)。
在本发明的一个实施方案中,所述核酸载体的序列为his-his-his-his-his-his-gly-arg-lys-lys-arg-arg-gln-arg-arg-arg-lys(c18)-tyr-ile-gly-ser-arg(seqidno:6)。
在本发明中,如果没有特别说明,所述c18是指硬脂酸(通过硬脂酸的羧基连接到arg或lys的侧链的氨基上)。
在本发明的一个实施方案中,所述细胞透膜肽为tat。在本发明的具体实施方案中,所述tat的序列为arg-lys-lys-arg-arg-gln-arg-arg-arg(rkkrrqrrr,seqidno:7)或gly-arg-lys-lys-arg-arg-gln-arg-arg-arg(grkkrrqrrr,seqidno:8)。
在本发明的一个实施方案中,其中所述细胞透膜肽选自tat、rn(n=6-10)(表示6-10个精氨酸组成的肽)、penetratin(rqikiwfqnrrmkwkk,seqidno:9)、map(klalklalkalkaalkla,seqidno:10)、pvec(lliilrrrirkqahahsk,seqidno:11)、mpg(ac-galflgflgaagstmgawsqpkkkrkv-nh2,seqidno:12)、mpgδnls(ac-galflgflgaagstmgawsqpkskrkv-nh2,seqidno:13)、stearyl-r8(st-rrrrrrrr-nh2,seqidno:14)、eb1(liklwshlihiwfqnrrlkwkkk-nh2,seqidno:15)和tat-drbd(grkkrrqrrrpq-drbd,seqidno:16)。
在本发明中,所述磷脂主要包括甘油磷脂和鞘磷脂两大类,其中所述甘油磷脂又可分为磷脂酰胆碱、磷脂酰乙醇胺、磷脂酰丝氨酸、磷脂酰甘油、二磷脂酰甘油及磷脂酰肌醇等几类,每一类中又可因组成的脂肪酸不同而有若干种。
本发明的另一方面涉及一种复合物,其包含本发明中任一项所述的式i化合物或其药学上可接受的盐,以及核酸分子例如dna或rna。
在本发明的一个实施方案中,所述的复合物,其中,所述式i化合物或其药学上可接受的盐与核酸分子的电荷比为(1-10):1,例如为(2-8):1、1:1、1.5:1、2:1、2.5:1、3:1、3.5:1、4:1、4.5:1、5:1、6:1、7:1或8:1。
在本发明中,所述的核酸载体带有正电荷,核酸分子带有负电荷,核酸载体与核酸分子之间通过正负电荷间的吸引作用形成复合物。
本发明的再一方面涉及一种宿主细胞,其含有本发明中任一项所述的式i化合物或其可药用盐或者本发明的复合物。
在本发明中,所述宿主细胞可以为原核细胞或真核细胞,所述原核细胞例如为大肠杆菌细胞,所述真核细胞例如为酵母细胞或哺乳动物细胞,所述哺乳动物细胞例如为来源于人、小鼠、大鼠、猴等的细胞。在本发明的实施方案中,所述哺乳动物细胞为293t细胞或b16f10细胞。
本发明的再一方面涉及一种转染真核细胞的方法,包括将目标核酸分子(例如dna或rna)负载至本发明中任一项所述的式i化合物或其可药用盐的步骤。
在本发明中,将所述核酸载体或复合物导入细胞得到宿主细胞的方法为本领域所公知,例如,可通过将核酸载体或复合物与细胞孵育的方式将其引入细胞中。
本发明的再一方面涉及一种药物组合物,其含有本发明中任一项所述的式i化合物或其可药用盐或者本发明的复合物,以及至少一种药学上可接受的辅料。
本发明的再一方面涉及一种试剂盒,其含有本发明中任一项所述的式i化合物或其可药用盐或者本发明的复合物,以及目标核酸。
在本发明中,所述组合物或试剂盒用于负载或转运核酸(例如dna或rna)分子进入细胞,因此其可以含有相应的缓冲液、检测试剂、或药学上可接受的辅料等。
本发明的再一方面涉及yigsr(seqidno:17)或yigsk(seqidno:18)在制备负载和/或转运核酸(例如dna或rna)的药物或试剂中的用途。
本发明的再一方面涉及本发明中任一项所述的式i化合物或其可药用盐在制备用于负载和/或转运核酸(例如dna或rna)的药物或试剂或者基因治疗药物中的用途。
本发明的再一方面涉及一种负载和/或转运核酸(例如dna或rna)的方法,或者一种制备本发明的复合物的方法,包括使本发明中任一项所述的式i化合物或其可药用盐与核酸分子(例如dna或rna)接触的步骤;
优选地,所述化合物或其药学上可接受的盐与核酸分子的电荷比为(1-10):1,例如为(2-8):1、1:1、1.5:1、2:1、2.5:1、3:1、3.5:1、4:1、4.5:1、5:1、6:1、7:1或8:1;
优选地,所述接触的条件为,36-38℃(例如37℃)条件下孵育20min以上(例如30min);
优选地,在孵育之前,将式i化合物或其可药用盐与核酸分子进行混合;优选地,进行涡旋或搅拌。
本发明的再一方面涉及一种基因治疗方法,所述方法包括给予有需要的受试者有效量的本发明中任一项所述的式i化合物或其可药用盐或者本发明的复合物的步骤。
在本发明中,所述负载核酸分子(例如dna或rna)是指使核酸载体与核酸(dna或rna)分子结合。
在本发明中,所述转运核酸(dna或rna)分子是指将核酸分子转入或导入细胞。
在本发明中,所述受试者为哺乳动物,例如牛科动物、马科动物、羊科动物、猪科动物、犬科动物、猫科动物、啮齿类动物、灵长类动物;其中优选的受试者为人。
在本发明中,当用于哺乳动物的基因治疗时,可以通过多种途径将本发明的核酸载体或者本发明的复合物导入哺乳动物体内或者需要治疗的组织或器官,例如通过静脉注射、局部注射等方式。
在本发明中,所述基因治疗是指将外源核酸分子(如正常基因、功能核酸分子等)导入有需要的受试者的体内或细胞中以达到治疗疾病的方法。所述核酸分子可以为dna分子或rna分子。所述dna分子例如可以为编码酶(例如腺苷脱氨酶)的基因、能够杀死肿瘤细胞的分子(例如肿瘤坏死因子)的基因、功能蛋白的基因等。所述rna分例如可以为反义寡核苷酸分子等。在本发明中,所述细胞透膜肽是指一类以非受体依赖方式,非经典内吞方式直接穿过细胞膜进入细胞的多肽,它们的长度一般不超过30个氨基酸且富含碱性氨基酸,氨基酸序列通常带正电荷,例如前面所列举的例子。
在本发明中,所述核酸包括dna或rna分子。所述核酸分子可以为载体、报告基因、效应基因(例如抗癌基因)或者具有其它功能的dna或rna分子。在本发明中,对核酸的长度没有特别要求,例如可以在几个碱基-几千个碱基的范围内。本领域技术人员可以根据核酸长度的大小调节核酸载体的用量,即当核酸的长度较小时,需要较少摩尔数的核酸载体,当核酸的长度较大时,需要较多摩尔数的核酸载体。
在本发明中,核酸载体和核酸分子的电荷比是通过计算核酸载体和核酸分子各自所带的电荷数计算出来的。其中,核酸载体所带的电荷数是指多肽携带的正电荷数,是指多肽序列中带正电荷的lys和arg的数量,定义为n,即一个lys或一个arg带一个正电荷;核酸分子所带的电荷数是指核酸碱基的磷酸基团数,定义为p,即一个磷酸基团带一个负电荷。
有益效果
本发明设计合成了一系列含有细胞透膜肽、富含组氨酸的内涵体逃逸结构、受体靶向结构以及任选的疏水性分子的多肽类核酸载体,有效解决了基因转运过程中的负载、转运、细胞内内涵体逃逸等问题,实现了比商业化的lipofectamine2000更高的转染效率,同时具有更低的毒副作用。
附图说明
图1:多肽基因载体结构示意图。
图2:载体/dna复合物琼脂糖凝胶电泳图,其中电泳图上方的数字例如0、1.0、1.5、2.0、2.5、3.0等分别表示载体与dna的电荷比。
图2a为tat-h6-k(c18)-yigsr/dna复合物;图2b为tat-h6-k(c18)-yigsk/dna复合物;图2c为tat-h6-k(c18)/dna复合物;图2d为tat-h6-k-yigsr/dna复合物;图2e为c18-tat-h6-k-yigsr/dna复合物;图2f为h6-tat-k(c18)-yigsr/dna复合物。
图3:载体/dna复合物流体粒径和zeta电位图,其中横坐标为多肽与dna的电荷比,纵坐标分别为颗粒粒径(a)和zeta电位(b)。
图4:多肽/dna电荷比为6的复合物投射电镜图(图中的比例表示100nm)。图4a至图4f中的样品依次如下:
4a为tat-h6-k(c18)-yigsr/dna复合物;
4b为tat-h6-k(c18)-yigsk/dna复合物;
4c为tat-h6-k(c18)/dna复合物;
4d为tat-h6-k-yigsr/dna复合物;
4e为c18-tat-h6-k-yigsr/dna复合物;
4f为h6-tat-k(c18)-yigsr/dna复合物。
图5:载体/dna复合物体外转染效率图,其中横坐标为多肽与dna的电荷比,纵坐标为荧光素酶活性(即rlu)。其中,
图5a为载体/dna复合物在293t细胞的转染效率;图5b为载体/dna复合物在b16f10细胞的转染效率。
图6:载体/dna复合物的293t细胞毒性评价,其中横坐标为载体与dna的电荷比,纵坐标为细胞存活率。
具体实施方式
下面将结合实施例对本发明的实施方案进行详细描述,但是本领域技术人员将会理解,下列实施例仅用于说明本发明,而不应视为限定本发明的范围。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规产品。
制备例所用固相合成载体rink-酰胺树脂为天津南开合成责任有限公司产品hobt、hbtu、diea以及fmoc-保护的氨基酸由上海吉尔生化公司提供。
缩写词的含义
arg表示精氨酸
ser表示丝氨酸
gln表示谷氨酰胺
gly表示甘氨酸
tyr表示酪氨酸
lys表示赖氨酸
ile表示异亮氨酸
his表示组氨酸
fmoc表示芴甲氧羰基
dmf表示二甲基甲酰胺
hbtu表示2-(1h-1-羟基苯并三唑)-1,1,3,3-四甲基脲六氟磷酸盐
hobt表示1-羟基苯并三唑
diea表示n,n-二异丙基乙胺
tfa表示三氟乙酸
rp-hplc表示反相高效液相色谱
tae-buffer表示三羟甲基氨基甲烷-乙酸-乙二胺四乙酸缓冲液
其它未标示的缩写具有本领域公知的含义。
制备例1-6:不同核酸载体的制备和表征
(1)tat-h6-k(c18)-yigsr的合成
根据tat-h6-k(c18)-yigsr的氨基酸序列,合成ac-gly-arg-lys-lys-arg-arg-gln-arg-arg-arg-his-his-his-his-his-his-lys(c18)-tyr-ile-gly-ser-arg-nh2,以rink-酰胺树脂为固相载体,以hbtu-hobt为缩合剂,采取标准fmoc策略(其中特殊氨基酸为dde保护的赖氨酸),利用微波多肽合成仪(cem,usa)合成目标肽序列。以5ml2%水合肼作为脱保护试剂,室温反应三分钟,重复三次。通过茚三酮反应检测脱保护是否成功。确认脱保护成功后,以dic为缩合剂,投入硬脂酸的dmf溶液,室温反应4h以上。通过茚三酮反应检测硬脂酸连接是否成功。确认成功后,以20ml三氟乙酸:苯甲硫醚:间甲酚:乙二硫醇:水(8.25:0.5:0.5:0.25:0.5,体积比)作裂解液,0℃反应30分钟,室温反应150分钟,将肽脱除保护基并从树脂上裂解下来。溶液经rp-hplc纯化,rp-hplc条件,a相:0.05%tfa/水;b相:0.05%tfa/70%acn/水;色谱柱:c8。maldi-tof-ms:3232.835。
(2)tat-h6-k(c18)-yigsk的合成
根据tat-h6-k(c18)-yigsk的氨基酸序列,合成ac-gly-arg-lys-lys-arg-arg-gln-arg-arg-arg-his-his-his-his-his-his-lys(c18)-tyr-ile-gly-ser-lys-nh2,以rink-酰胺树脂为固相载体,以hbtu-hobt为缩合剂,采取标准fmoc策略(其中特殊氨基酸为dde保护的赖氨酸),利用微波多肽合成仪(cem,usa)合成目标肽序列。以5ml2%水合肼作为脱保护试剂,室温反应三分钟,重复三次。通过茚三酮反应检测脱保护是否成功。确认脱保护成功后,以dic为缩合剂,投入硬脂酸的dmf溶液,室温反应4h以上。通过茚三酮反应检测硬脂酸连接是否成功。确认成功后,以20ml三氟乙酸:苯甲硫醚:间甲酚:乙二硫醇:水(8.25:0.5:0.5:0.25:0.5,体积比)作裂解液,0℃反应30分钟,室温反应150分钟,将肽脱除保护基并从树脂上裂解下来。溶液经rp-hplc纯化,rp-hplc条件,a相:0.05%tfa/水;b相:0.05%tfa/70%acn/水;色谱柱:c8。maldi-tof-ms:3203.83。
(3)tat-h6-k(c18)的合成
根据tat-h6-k(c18)的氨基酸序列,合成ac-gly-arg-lys-lys-arg-arg-gln-arg-arg-arg-his-his-his-his-his-his-lys(c18)-nh2(其中c18为硬脂酸),以rink-酰胺树脂为固相载体,以hbtu-hobt为缩合剂,采取标准fmoc策略(其中特殊氨基酸为dde保护的赖氨酸),利用微波多肽合成仪(cem,usa)合成目标肽序列。以5ml2%水合肼作为脱保护试剂,室温反应三分钟,重复三次。通过茚三酮反应检测脱保护是否成功。确认脱保护成功后,以dic为缩合剂,投入硬脂酸的dmf溶液,室温反应4h以上。通过茚三酮反应检测硬脂酸连接是否成功。确认成功后,以20ml三氟乙酸:苯甲硫醚:间甲酚:乙二硫醇:水(8.25:0.5:0.5:0.25:0.5,体积比)作裂解液,0℃反应30分钟,室温反应150分钟,将肽脱除保护基并从树脂上裂解下来。溶液经rp-hplc纯化,rp-hplc条件,a相:0.05%tfa/水;b相:0.05%tfa/70%acn/水;色谱柱:c8。maldi-tof-ms:2655.2。
(4)tat-h6-k-yigsr的合成
根据tat-h6-k-yigsr的氨基酸序列,合成ac-gly-arg-lys-lys-arg-arg-gln-arg-arg-arg-his-his-his-his-his-his-lys-tyr-ile-gly-ser-arg-nh2,以rink-酰胺树脂为固相载体,以hbtu-hobt为缩合剂,采取标准fmoc策略,利用微波多肽合成仪(cem,usa)合成目标肽序列。以20ml三氟乙酸:苯甲硫醚:间甲酚:乙二硫醇:水(8.25:0.5:0.5:0.25:0.5,体积比)作裂解液,0℃反应30分钟,室温反应150分钟,将肽脱除保护基并从树脂上裂解下来。溶液经rp-hplc纯化,rp-hplc条件,a相:0.05%tfa/水;b相:0.05%tfa/70%acn/水;色谱柱:c8。maldi-tof-ms:2965.36。
(5)c18-tat-h6-k-yigsr的合成
根据c18-tat-h6-k-yigsr的氨基酸序列,合成c18-gly-arg-lys-lys-arg-arg-gln-arg-arg-arg-his-his-his-his-his-his-lys-tyr-ile-arg-ser-arg-nh2,以rink-酰胺树脂为固相载体,以hbtu-hobt为缩合剂,采取标准fmoc策略,利用微波多肽合成仪(cem,usa)合成目标肽序列。以dic为缩合剂,投入硬脂酸dmf溶液,室温反应4h以上。通过茚三酮反应检测硬脂酸连接是否成功(硬脂酸连载肽链的n端裸露的氨基上)。以20ml三氟乙酸:苯甲硫醚:间甲酚:乙二硫醇:水(8.25:0.5:0.5:0.25:0.5,体积比)作裂解液,0℃反应30分钟,室温反应150分钟,将肽脱除保护基并从树脂上裂解下来。溶液经rp-hplc纯化,rp-hplc条件,a相:0.05%tfa/水;b相:0.05%tfa/70%acn/水;色谱柱:c8。maldi-tof-ms:3189.81。
(6)h6-tat-k(c18)-yigsr的合成
根据h6-tat-k(c18)-yigsr的氨基酸序列,合成ac-his-his-his-his-his-his-gly-arg-lys-lys-arg-arg-gln-arg-arg-arg-lys(c18)-tyr-ile-gly-ser-arg-nh2,以rink-酰胺树脂为固相载体,以hbtu-hobt为缩合剂,采取标准fmoc策略(其中特殊氨基酸为dde保护的赖氨酸),利用微波多肽合成仪(cem,usa)合成目标肽序列。以5ml2%水合肼作为脱保护试剂,室温反应三分钟,重复三次。通过茚三酮反应检测脱保护是否成功。确认脱保护成功后,以dic为缩合剂,投入硬脂酸的dmf溶液,室温反应4h以上。通过茚三酮反应检测硬脂酸连接是否成功。确认成功后,以20ml三氟乙酸:苯甲硫醚:间甲酚:乙二硫醇:水(8.25:0.5:0.5:0.25:0.5,体积比)作裂解液,0℃反应30分钟,室温反应150分钟,将肽脱除保护基并从树脂上裂解下来。溶液经rp-hplc纯化,rp-hplc条件,a相:0.05%tfa/水;b相:0.05%tfa/70%acn/水;色谱柱:c8。maldi-tof-ms:3232.835。
备注:上面的制备例1-6中,氨基酸序列自左至右为从n末端至c末端。其中,对氨基酸序列n端的氨基进行了乙酰化修饰,对c端的羧基进行了酰胺化修饰。这是因为,化学合成的肽往往携带游离的氨基和游离的羧基,而肽的序列往往代表了母本蛋白的序列,为了与母本蛋白更为接近,肽末端往往进行封闭,即n端乙酰化和c端酰胺化,这些修饰会减少多肽的总电荷,降低多肽的溶解度,也可以使肽模拟它在母本蛋白中α氨基和羧基的原始状态。因此氨基酸序列依然是左端为n末端,右端为c末端。这些修饰不会对多肽的生物学活性产生显著的影响。
以上制备的核酸载体应用于下面的制备例7-12。
制备例7-12:不同核酸载体/dna复合物的制备
(1)tat-h6-k(c18)-yigsr/dna复合物的制备
取pgl-3质粒dna(购自promega公司)1μg,稀释到25μl,tat-h6-k(c18)-yigsr配成1mg/ml的溶液,分别按照peptide/dna电荷比(n/p)0、1、2、2.5、3、3.5、4、6、8吸取不同体积的肽溶液,稀释到25μl,将肽和dna溶液混合,涡旋10s,在37℃孵育30min,形成不同电荷比的tat-h6-k(c18)-yigsr/dna复合物。
(2)tat-h6-k(c18)-yigsk/dna复合物的制备
取pgl-3质粒dna,1μg,稀释到25μl,tat-h6-k(c18)-yigsk配成1mg/ml的溶液,分别按照peptide/dna电荷比(n/p)0、1、2、2.5、3、3.5、4、6、8吸取不同体积的肽溶液,稀释到25μl,将肽和dna溶液混合,涡旋10s,在37℃孵育30min,形成不同电荷比的tat-h6-k(c18)-yigsk复合物。
(3)tat-h6-k(c18)/dna复合物的制备
取pgl-3质粒dna1μg,稀释到25μl,tat-h6-k(c18)配成1mg/ml的溶液,按照peptide/dna电荷比(n/p)0、1、2、2.5、3、3.5、4、6、8吸取不同体积的肽溶液,稀释到25μl,将肽和dna溶液混合,涡旋10s,在37℃孵育30min,形成不同电荷比的tat-h6-k(c18)/dna复合物。
(4)tat-h6-k-yigsr/dna复合物的制备
取pgl-3质粒dna1μg,稀释到25μl,tat-h6-k-yigsr配成1mg/ml的溶液,分别按照peptide/dna电荷比(n/p)0、1、2、2.5、3、3.5、4、6、8吸取不同体积的肽溶液,稀释到25μl,将肽和dna溶液混合,涡旋10s,在37℃孵育30min,形成不同电荷比的tat-h6-k-yigsr/dna复合物。
(5)c18-tat-h6-k-yigsr/dna复合物的制备
取pgl-3质粒dna(购自promega公司)1μg,稀释到25μl,c18-tat-h6-k-yigsr配成1mg/ml的溶液,分别按照peptide/dna电荷比(n/p)0、2、3、4、5、6、7、8吸取不同体积的肽溶液,稀释到25μl,将肽和dna溶液混合,涡旋10s,在37℃孵育30min,形成不同电荷比的c18-tat-h6-k-yigsr/dna复合物。
(6)h6-tat-k(c18)-yigsr/dna复合物的制备
取pgl-3质粒dna(购自promega公司)1μg,稀释到25μl,tat-h6-k(c18)-yigsr配成1mg/ml的溶液,分别按照peptide/dna电荷比(n/p)0、2、3、4、5、6、7、8吸取不同体积的肽溶液,稀释到25μl,将肽和dna溶液混合,涡旋10s,在37℃孵育30min,形成不同电荷比的h6-tat-k(c18)-yigsr/dna复合物。
如果没有特别说明,下面的实验例1-5所用的核酸载体/dna复合物为参照制备例7-12所制备;其中,具体的电荷比亦可适当调整。
实验例1:核酸载体负载能力的测定
为了评价核酸载体1-6载体负载dna的能力,本发明研究了核酸载体/dna复合物的琼脂糖凝胶电泳。
配制质量/体积比为1%的琼脂糖/tae缓冲溶液,在微波炉中加热溶解,倒入电泳槽模具中冷却30min,放入电泳槽中,加入10×tae缓冲液。取按照上述方法制备的核酸载体/dna复合物,其中dna为0.1μg,体积10μl上样,电压100v,60min。在eb染色液中染色15min,然后在凝胶成像仪下拍照,观察电泳中dna迁移条带。
结果如图2所示。
图2a显示,tat-h6-k(c18)-yigsr/dna复合物电荷比在3时可以完全负载dna(多肽完全负载dna形成纳米复合物无法进入琼脂糖凝胶,因此没有迁移条带;而未负载的dna进入琼脂糖凝胶,经过eb染色在紫外灯下呈现明亮的dna条带)。
图2b显示,tat-h6-k(c18)-yigsk/dna复合物电荷比在3.5时可以完全负载dna,说明序列中yigsr变为yigsk对核酸载体负载dna的影响很小。
图2c显示,tat-h6-k(c18)/dna复合物电荷比在3.0时可以完全负载dna。说明靶向序列yigsr的存在对复合物负载dna能力影响很小。
图2d显示,tat-h6-k-yigsr/dna复合物电荷比在2.5时可以完全负载dna。
图2e显示,c18-tat-h6-k-yigsr/dna复合物电荷比在7时可以完全负载dna。透膜肽放置于肽链中间会影响碱性氨基酸的正电荷与核酸的负电荷结合,从而影响载体负载dna的能力。
图2f显示,h6-tat-k(c18)-yigsr/dna复合物电荷比在6时可以完全负载dna。透膜肽放置于肽链中间会影响碱性氨基酸的正电荷与核酸的负电荷结合,从而影响载体负载dna的能力。
实验例2:核酸载体dna复合物的粒径和zeta电位分析
粒径和zeta电位检测采用zetasizernanozs90,malvern激光粒度仪,检测温度25℃,每个样品重复三次,检测结果如图3所示。
结果显示:
tat-h6-k(c18)-yigsr/dna复合物的粒径随着电荷比增大,先由114.51nm升至211nm,然后降至126.53nm。zeta电位随着电荷比增加由-8.08mv升至15.57mv。
tat-h6-k(c18)-yigsk/dna复合物的粒径随着电荷比增大,先由144.97nm升至161.63nm,然后降至105.94nm,从结果可以看出靶向序列由yigsr变为yigsk对复合物粒径的影响并不大。同时,zeta电位也无明显变化,zeta电位随着正负电荷比增加由-11.68mv升至14.63mv。
tat-h6-k(c18)/dna复合物的粒径随着电荷比增大,先由133.23nm升至441.7nm,然后降至76.24nm。zeta电位随着正负电荷比增加由-8.24mv升至14.9mv。
tat-h6-k-yigsr/dna复合物的粒径随着电荷比增大,先由589.86nm升至657.63nm,然后降至140.43nm。zeta电位随着正负电荷比增加由5.74mv升至14mv。
c18-tat-h6-k-yigsr/dna复合物的粒径随着电荷比增大,先由439.4升至540.33nm,然后降至107nm。zeta电位随着正负电荷比增加由5.56mv升至15.86mv。
h6-tat-k(c18)-yigsr/dna复合物的粒径随着电荷比增大,先由454.9降至622nm,然后稍微升至86.48nm。zeta电位随着正负电荷比增加由3.71mv升至15.3mv。
实验例3:核酸载体/dna复合物的透射电镜表征
测试的样品为多肽/dna电荷比为6的复合物。tat-h6-k(c18)-yigsr/dna为例,将制备好的tat-h6-k(c18)-yigsr/dna复合物溶液5μl滴加在铜网上,30min后用滤纸吸干,在hitachih-7650显微镜下拍照。类似地,对其余5种复合物进行显微拍照。
结果如图4所示。
如图4a所示,tat-h6-k(c18)-yigsr/dna复合物为约55nm的纳米颗粒,这一尺度比dls(动态光散射)所测的结果较小,是因为测试透射电镜时的复合物为晾干后的样品,比其在水溶液中测试的流体粒径尺度偏小。
如图4b所示,tat-h6-k(c18)-yigsk/dna复合物为约55nm的纳米颗粒,与tat-h6-k(c18)-yigsr/dna复合物的纳米颗粒尺度相当。同样,这一尺度比dls所测的结果较小,是因为测试透射电镜时的复合物为晾干后的样品,比其在水溶液中测试的流体粒径尺度偏小。
如图4c所示,tat-h6-k(c18)/dna复合物为约65nm的纳米颗粒,比tat-h6-k(c18)/dna复合物纳米颗粒更大,可见在多肽中引入靶向基团yigsr,促进双亲性α-螺旋构象形成有利于和dna形成更加致密的纳米颗粒。同样,这一尺度比dls所测的结果较小,是因为测试透射电镜时的复合物为晾干后的样品,比其在水溶液中测试的流体粒径尺度偏小。
如图4d所示,tat-h6-k-yigsr/dna复合物为约78nm的纳米颗粒,比tat-h6-k(c18)-yigsr/dna复合物纳米颗粒更大,可见在多肽中引入疏水性基团,更有利于促进双亲性α-螺旋构象形成,并且和dna形成更加致密的纳米颗粒。这一尺度比dls所测的结果较小,是因为测试透射电镜时的复合物为晾干后的样品,比其在水溶液中测试的流体粒径尺度偏小。
如图4e所示,c18-tat-h6-k-yigsr/dna复合物为约45nm的纳米颗粒,这一尺度比dls(动态光散射)所测的结果较小,是因为测试透射电镜时的复合物为晾干后的样品,比其在水溶液中测试的流体粒径尺度偏小。
如图4f所示,h6-tat-k(c18)-yigsr/dna复合物为约35nm的纳米颗粒,这一尺度比dls(动态光散射)所测的结果较小,是因为测试透射电镜时的复合物为晾干后的样品,比其在水溶液中测试的流体粒径尺度偏小。
实验例4:转染效率测定
(1)tat-h6-k(c18)-yigsr/dna复合物的转染效率
本发明的peptide/dna复合物的细胞转染效率在两种细胞系293t和b16f10细胞(购自协和细胞库,即中国医学科学院基础医学研究所细胞资源中心)中评价。
将293t和b16f10细胞分别接种于48孔板中,每孔接种3×104(500μldmem细胞悬液)个细胞,24小时后细胞汇合度达到80%,吸出培养基。将tat-h6-k(c18)-yigsr/dna复合物(每孔pgl-3质粒dna0.6μg,电荷比(n/p)分别为4、6、8)用dmem培养基稀释到300μl,分别加入到细胞培养板,在37℃,5%co2的细胞培养箱中孵育4小时。4小时后吸出培养基,加入300μl含10%fbs的dmem培养基再培养44小时,然后检测细胞内荧光素酶表达。测试采用promega公司的荧光素酶检测试剂盒,利用
(2)tat-h6-k(c18)-yigsk/dna复合物的转染效率
将293t和b16f10细胞分别接种于48孔板中,每孔接种3×104(500μldmem细胞悬液)个细胞,24小时后细胞汇合度达到80%,吸出培养基。将tat-h6-k(c18)-yigsk/dna复合物(每孔pgl-3质粒dna0.6μg,电荷比(n/p)4-8)用dmem培养基稀释到300μl,分别加入到细胞培养板,在37℃,5%co2的细胞培养箱中孵育4小时。4小时后吸出培养基,加入300μl含10%fbs的dmem培养基再培养44小时,然后检测细胞内荧光素酶表达。测试采用promega公司的荧光素酶检测试剂盒,利用
(3)tat-h6-k(c18)/dna复合物的转染效率
将293t和b16f10细胞分别接种于48孔板中,每孔接种3×104(500μldmem细胞悬液)个细胞,24小时后细胞汇合度达到80%,吸出培养基。将tat-h6-k(c18)/dna复合物(每孔pgl-3质粒dna0.6μg,电荷比(n/p)4-8)用dmem培养基稀释到300μl,分别加入到细胞培养板,在37℃,5%co2的细胞培养箱中孵育4小时。4小时后吸出培养基,加入300μl含10%fbs的dmem培养基再培养44小时,然后检测细胞内荧光素酶表达。测试采用promega公司的荧光素酶检测试剂盒,利用
(4)tat-h6-k-yigsr/dna复合物的转染效率
将293t和b16f10细胞分别接种于48孔板中,每孔接种3×104(500μldmem细胞悬液)个细胞,24小时后细胞汇合度达到80%,吸出培养基。将tat-h6-k-yigsr/dna复合物(每孔pgl-3质粒dna0.6μg,电荷比(n/p)4-8)用dmem培养基稀释到300μl,分别加入到细胞培养板,在37℃,5%co2的细胞培养箱中孵育4小时。4小时后吸出培养基,加入300μl含10%fbs的dmem培养基再培养44小时,然后检测细胞内荧光素酶表达。测试采用promega公司的荧光素酶检测试剂盒,利用
(5)c18-tat-h6-k-yigsr/dna复合物的转染效率
本发明的peptide/dna复合物的细胞转染效率在两种细胞系293t和b16f10细胞(购自协和细胞库,即中国医学科学院基础医学研究所细胞资源中心)中评价。
将293t和b16f10细胞分别接种于48孔板中,每孔接种3×104(500μldmem细胞悬液)个细胞,24小时后细胞汇合度达到80%,吸出培养基。将c18-tat-h6-k-yigsr/dna复合物(每孔pgl-3质粒dna0.6μg,电荷比(n/p)4-8)用dmem培养基稀释到300μl,分别加入到细胞培养板,在37℃,5%co2的细胞培养箱中孵育4小时。4小时后吸出培养基,加入300μl含10%fbs的dmem培养基再培养44小时,然后检测细胞内荧光素酶表达。测试采用promega公司的荧光素酶检测试剂盒,利用
(6)h6-tat-k(c18)-yigsr/dna复合物的转染效率
本发明的peptide/dna复合物的细胞转染效率在两种细胞系293t和b16f10细胞(购自协和细胞库,即中国医学科学院基础医学研究所细胞资源中心)中评价。
将293t和b16f10细胞分别接种于48孔板中,每孔接种3×104(500μldmem细胞悬液)个细胞,24小时后细胞汇合度达到80%,吸出培养基。将h6-tat-k(c18)-yigsr/dna复合物(每孔pgl-3质粒dna0.6μg,电荷比(n/p)4-8)用dmem培养基稀释到300μl,分别加入到细胞培养板,在37℃,5%co2的细胞培养箱中孵育4小时。4小时后吸出培养基,加入300μl含10%fbs的dmem培养基再培养44小时,然后检测细胞内荧光素酶表达。测试采用promega公司的荧光素酶检测试剂盒,利用
综合上述实验结果可见,在本发明,所合成的除了tat-h6-k(c18)-yigsr和tat-h6-k(c18)-yigsk以外的多肽,即使含有yigsr片段,转染dna的效率也相对很低,例如tat-h6-k-yigsr和h6-tat-k(c18)-yigsr等。这些结果说明,即使含有可以和受体结合的yigsr片段,如果缺乏其他功能片段或者改变功能片段序列,基因递送效率仍旧不够理想。因此,这些载体的高转染效率不仅仅是一个功能片段的作用,更主要的是各个功能片段有机结合,发挥协同作用的结果。
实验例5:核酸载体dna复合物的细胞毒性评价
本发明的细胞毒性评价实验在293t细胞中评价,实验采用promega公司的celltiter
将293t细胞接种于96孔板中,每孔1×104个细胞,在37℃,5%co2条件下培养24小时后,细胞汇合度达到70%-80%。吸出培养基,加入按制备例7-12中所得tat-h6-k(c18)-yigsr/dna复合物100μl,孵育4个小时。4小时后吸出培养基,换成新鲜的含10%fbs的dmem,再培养20小时,然后按照cck方法检测细胞存活率。
结果如图6所示。
tat-h6-k(c18)-yigsr/dna复合物:在不同的条件下,细胞的存活率都达到了90%以上,可见本发明的tat-h6-k(c18)-yigsr/dna复合物具有较低的细胞毒性。与阳性对照lipo200080%的细胞毒性相比,本发明的核酸载体具有明显的优势。
tat-h6-k(c18)-yigsk/dna复合物:在不同的条件下,细胞的存活率都达到了90%以上,可见本发明的tat-h6-k(c18)-yigsk/dna复合物具有较低的细胞毒性。与阳性对照lipo200080%的细胞毒性相比,本发明的核酸载体具有明显的优势。
tat-h6-k(c18)/dna复合物:在不同的条件下,细胞的存活率都达到了85%以上,可见本发明的tat-h6-k(c18)/dna复合物具有较低的细胞毒性。
tat-h6-k-yigsr/dna复合物:在不同的条件下,细胞的存活率都达到了90%以上,可见本发明的tat-h6-k-yigsr/dna复合物具有较低的细胞毒性。
c18-tat-h6-k-yigsr/dna复合物:在不同的条件下,细胞的存活率都达到了75%以上,可见本发明的c18-tat-h6-k-yigsr/dna相对于复合物tat-h6-k(c18)-yigsr具有较高的细胞毒性。
h6-tat-k(c18)-yigsr/dna复合物:在不同的条件下,细胞的存活率都达到了70%以上,可见本发明的h6-tat-k(c18)-yigsr/dna复合物相对于复合物tat-h6-k(c18)-yigsr具有较高的细胞毒性。
尽管本发明的具体实施方式已经得到详细的描述,本领域技术人员将会理解。根据已经公开的所有教导,可以对那些细节进行各种修改和替换,这些改变均在本发明的保护范围之内。本发明的全部范围由所附权利要求及其任何等同物给出。
sequencelisting
<110>中国人民解放军军事医学科学院毒物药物研究所
<120>一种核酸载体及其用途
<130>idc170077
<160>18
<170>patentinversion3.2
<210>1
<211>22
<212>prt
<213>artificial
<220>
<223>核酸载体1
<220>
<221>mod_res
<222>(17)..(17)
<223>第17位的赖氨酸的侧链氨基与硬脂酸的羧基形成酰胺键
<400>1
glyarglyslysargargglnargargarghishishishishishis
151015
lystyrileglyserarg
20
<210>2
<211>22
<212>prt
<213>artificial
<220>
<223>核酸载体2
<220>
<221>mod_res
<222>(17)..(17)
<223>第17位赖氨酸的侧链氨基与硬脂酸的羧基形成酰胺键
<400>2
glyarglyslysargargglnargargarghishishishishishis
151015
lystyrileglyserlys
20
<210>3
<211>17
<212>prt
<213>artificial
<220>
<223>核酸载体3
<220>
<221>mod_res
<222>(17)..(17)
<223>第17位的赖氨酸的侧链氨基与硬脂酸的羧基形成酰胺键
<400>3
glyarglyslysargargglnargargarghishishishishishis
151015
lys
<210>4
<211>22
<212>prt
<213>artificial
<220>
<223>核酸载体4
<400>4
glyarglyslysargargglnargargarghishishishishishis
151015
lystyrileglyserarg
20
<210>5
<211>22
<212>prt
<213>artificial
<220>
<223>核酸载体5
<220>
<221>mod_res
<222>(1)..(1)
<223>第一位的甘氨酸的游离的氨基与硬脂酸形成酰胺键
<400>5
glyarglyslysargargglnargargarghishishishishishis
151015
lystyrileglyserarg
20
<210>6
<211>22
<212>prt
<213>artificial
<220>
<223>核酸载体6
<220>
<221>mod_res
<222>(17)..(17)
<223>第17位的赖氨酸的侧链的氨基与硬脂酸的羧基形成酰胺键
<400>6
hishishishishishisglyarglyslysargargglnargargarg
151015
lystyrileglyserarg
20
<210>7
<211>9
<212>prt
<213>artificial
<220>
<223>细胞透膜肽tat
<400>7
arglyslysargargglnargargarg
15
<210>8
<211>10
<212>prt
<213>artificial
<220>
<223>细胞透膜肽tat的另一序列
<400>8
glyarglyslysargargglnargargarg
1510
<210>9
<211>16
<212>prt
<213>artificial
<220>
<223>细胞透膜肽penetratin
<400>9
argglnilelysiletrppheglnasnargargmetlystrplyslys
151015
<210>10
<211>18
<212>prt
<213>artificial
<220>
<223>细胞透膜肽map
<400>10
lysleualaleulysleualaleulysalaleulysalaalaleulys
151015
leuala
<210>11
<211>18
<212>prt
<213>artificial
<220>
<223>细胞透膜肽pvec
<400>11
leuleuileileleuargargargilearglysglnalahisalahis
151015
serlys
<210>12
<211>27
<212>prt
<213>artificial
<220>
<223>细胞透膜肽mpg
<220>
<221>mod_res
<222>(1)..(1)
<223>氮末端被羧基封闭
<220>
<221>mod_res
<222>(27)..(27)
<223>碳末端的羧基被封闭
<400>12
glyalaleupheleuglypheleuglyalaalaglyserthrmetgly
151015
alatrpserglnprolyslyslysarglysval
2025
<210>13
<211>27
<212>prt
<213>artificial
<220>
<223>透膜肽mpgδnls
<220>
<221>mod_res
<222>(1)..(1)
<223>氮末端被羧基封闭
<220>
<221>mod_res
<222>(27)..(27)
<223>碳末端被氨基封闭
<400>13
glyalaleupheleuglypheleuglyalaalaglyserthrmetgly
151015
alatrpserglnprolysserlysarglysval
2025
<210>14
<211>8
<212>prt
<213>artificial
<220>
<223>stearyl-r8
<220>
<221>mod_res
<222>(1)..(1)
<223>氮末端被硬脂酰封闭
<220>
<221>mod_res
<222>(8)..(8)
<223>碳末端被氨基封闭
<400>14
argargargargargargargarg
15
<210>15
<211>23
<212>prt
<213>artificial
<220>
<223>细胞透膜肽eb1
<220>
<221>mod_res
<222>(23)..(23)
<223>碳末端被氨基封闭
<400>15
leuilelysleutrpserhisleuilehisiletrppheglnasnarg
151015
argleulystrplyslyslys
20
<210>16
<211>16
<212>prt
<213>artificial
<220>
<223>细胞透膜肽tat-drbd
<400>16
glyarglyslysargargglnargargargproglnaspargasxasp
151015
<210>17
<211>5
<212>prt
<213>artificial
<220>
<223>层粘连蛋白受体靶向片段1
<400>17
tyrileglyserarg
15
<210>18
<211>5
<212>prt
<213>artificial
<220>
<223>层粘连蛋白受体靶向片段2
<400>18
tyrileglyserlys
15
- 还没有人留言评论。精彩留言会获得点赞!