控制了重链与轻链的缔合的抗原结合分子的制作方法
本发明涉及控制了重链与轻链的缔合的抗体、控制了重链与轻链的缔合的抗体的制备方法、抗体的重链与轻链的缔合控制方法、以及含有该抗体作为有效成分的药物组合物等。
背景技术:
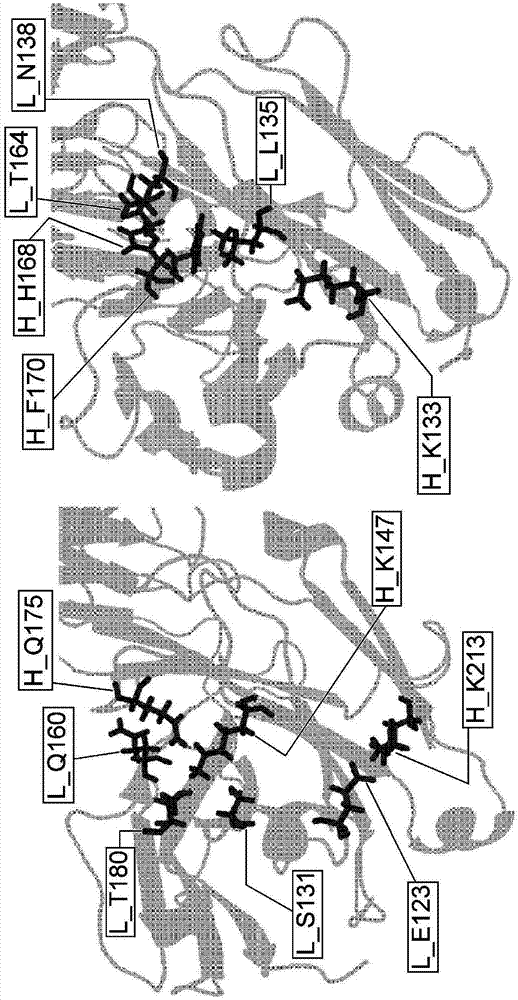
:作为具有人恒定区的igg型双特异性抗体(单臂具有针对抗原a的结合特异性、而另一单臂具有针对抗原b的结合特异性的具有人恒定区的igg型抗体)的制作方法,迄今为止报道了几种方法。通常,igg型双特异性抗体包含两种h链(即针对抗原a的h链和针对抗原b的h链)和两种l链(即针对抗原a的l链和针对抗原b的l链)。使这样的igg型双特异性抗体表达时,由于使两种h链和两种l链表达,所以作为h2l2的组合,认为有10种组合。其中一种是具有目标结合特异性(单臂具有针对抗原a的结合特异性、另一单臂具有针对抗原b的结合特异性的igg)的组合。因此,为了获得目标双特异性抗体,需要从10种抗体中纯化出一种目标抗体,纯化的效率非常低且难以进行。作为解决该问题的方法,有人报道了通过对iggh链的ch3区实施氨基酸取代,使针对抗原a的h链和针对抗原b的h链的异源组合的igg优先分泌的方法(专利文献1、2、3、4和非专利文献1、2)。在这些方法中,有人报道了利用“突起;knob”和“空隙;hole”的物理障碍的方法、或利用电荷排斥的方法。为了进一步高效地获得目标分子,有人报道了使用使针对抗原a的l链和针对抗原b的l链形成相同的氨基酸序列的共通l链的方法(专利文献5、6)。但是,通过使用共通l链,对抗原的亲和性有可能大幅降低,未必是最佳的方法。因此,为了使双特异性抗体以强亲和力与两个抗原结合,优选只有针对抗原a的h链与l链缔合、以及只有针对抗原b的h链与l链缔合。而且,为了使针对各自的抗原的h链与l链缔合而与可变区无关,有人报道了不是对可变区而是对作为恒定区的ch1和cl结构域实施氨基酸取代的方法(专利文献2、7)。但是,还不足以有效地生产目标双特异性抗体。现有技术文献专利文献专利文献1:wo96/27011;专利文献2:wo2006/106905;专利文献3:wo2009/089004;专利文献4:wo2010/129304;专利文献5:wo98/050431;专利文献6:wo2006/109592;专利文献7:wo2007/147901;非专利文献非专利文献1:ridgwayjb等人著,proteinengineering,1996年,第9卷,第617-621页;非专利文献2:merchantam等人著,naturebiotechnology,1998年,第16卷,第677-681页。技术实现要素:发明所要解决的课题本发明鉴于上述状况而设,其目的在于提供:控制了重链与轻链的缔合的抗体、控制了重链与轻链的缔合的抗体的制备方法、以及抗体的重链与轻链的缔合控制方法。另外,作为本发明的一个方案,其目的还在于提供:控制了ch1和cl的界面上的缔合的双特异性抗体、控制ch1和cl的界面上的缔合以高效率制备双特异性抗体的方法。用于解决课题的方法本发明人选择作为重链恒定区的ch1和轻链恒定区(cl)作为经受缔合控制的重链和轻链的区域,对这些ch1和cl的缔合控制进行了深入研究。结果发现:通过将存在于ch1和cl的界面的氨基酸残基取代成电荷相互排斥或不排斥的氨基酸残基,可以抑制ch1与cl的缔合,与使用向上述的ch3中单独导入knob和hole的修饰相比,高效率地形成了异源分子(heterologousmolecules)。即,根据本发明人所发现的知识,可以控制ch1与cl的缔合。另外,本发明不仅可适用于控制ch1与cl的缔合,还可用于控制任意的多肽间的缔合。而且,本发明人还确认到:本发明的控制了重链与轻链的缔合的双特异性抗体实际上保持着功能。如上所述,本发明人成功开发了控制了重链与轻链的缔合的抗原结合分子,完成了本发明。本发明涉及控制了重链与轻链的缔合的抗原结合分子、控制了重链与轻链的缔合的抗原结合分子的制备方法、以及抗原结合分子的重链与轻链的缔合控制方法,更具体而言,本发明涉及下述内容。[1]抗原结合分子,其是控制了重链与轻链的缔合的抗原结合分子,在该抗原结合分子中,重链和轻链中的选自以下的(a)~(c)所示氨基酸残基组的一组或两组以上的氨基酸残基是电荷相互排斥的氨基酸残基:(a)重链恒定区(ch1)所包含的氨基酸残基且eu编号第147位的氨基酸残基、和轻链恒定区(cl)所包含的氨基酸残基且eu编号第180位的氨基酸残基;(b)ch1所包含的氨基酸残基且eu编号第147位的氨基酸残基、和cl所包含的氨基酸残基且eu编号第131位的氨基酸残基;(c)ch1所包含的氨基酸残基且eu编号第175位的氨基酸残基、和cl所包含的氨基酸残基且eu编号第160位的氨基酸残基。[2][1]所述的抗原结合分子,而且,以下的(d)所示氨基酸残基组的氨基酸残基是电荷相互排斥的氨基酸残基:(d)ch1所包含的氨基酸残基且eu编号第213位的氨基酸残基、和cl所包含的氨基酸残基且eu编号第123位的氨基酸残基。[3][1]或[2]所述的抗原结合分子,其中,上述电荷相互排斥的氨基酸残基选自以下的(x)或(y)的任一组所包含的氨基酸残基:(x)谷氨酸(e)或天冬氨酸(d);(y)赖氨酸(k)、精氨酸(r)或组氨酸(h)。[4][1]~[3]中任一项所述的抗原结合分子,而且,形成重链可变区和轻链可变区的界面的两个残基以上的氨基酸残基是电荷相互排斥的氨基酸残基。[5][4]所述的抗原结合分子,其中,上述电荷相互排斥的氨基酸残基是选自以下的(a)或(b)所示氨基酸残基组的一组或两组氨基酸残基:(a)重链可变区所包含的氨基酸残基且kabat编号第39位的氨基酸残基、和轻链可变区所包含的氨基酸残基且kabat编号第38位的氨基酸残基;(b)重链可变区所包含的氨基酸残基且kabat编号第45位的氨基酸残基、和轻链可变区所包含的氨基酸残基且kabat编号第44位的氨基酸残基。[6][4]或[5]所述的抗原结合分子,其中,上述电荷相互排斥的氨基酸残基选自以下的(x)或(y)的任一组所包含的氨基酸残基:(x)谷氨酸(e)、天冬氨酸(d);(y)赖氨酸(k)、精氨酸(r)、组氨酸(h)。[7]抗原结合分子,其是控制了重链与轻链的缔合的抗原结合分子,在该抗原结合分子中,预缔合的重链和轻链中的选自以下的(a)~(c)所示氨基酸残基组的一组或两组以上的氨基酸残基是电荷相互不排斥的氨基酸残基:(a)重链恒定区(ch1)所包含的氨基酸残基且eu编号第147位的氨基酸残基、和轻链恒定区(cl)所包含的氨基酸残基且eu编号第180位的氨基酸残基;(b)ch1所包含的氨基酸残基且eu编号第147位的氨基酸残基、和cl所包含的氨基酸残基且eu编号第131位的氨基酸残基;(c)ch1所包含的氨基酸残基且eu编号第175位的氨基酸残基、和cl所包含的氨基酸残基且eu编号第160位的氨基酸残基。[8][7]所述的抗原结合分子,而且,以下的(d)所示氨基酸残基组的氨基酸残基是电荷相互不排斥的氨基酸残基:(d)ch1所包含的氨基酸残基且eu编号第213位的氨基酸残基、和cl所包含的氨基酸残基且eu编号第123位的氨基酸残基。[9][7]或[8]所述的抗原结合分子,其中,上述电荷相互不排斥的氨基酸残基是从选自以下的(x)~(z)的两组中分别选出的氨基酸残基,所述的两组选自(x)和(y)、(x)和(z)、(y)和(z)、或(z)和(z)的组合:(x)谷氨酸(e)或天冬氨酸(d);(y)赖氨酸(k)、精氨酸(r)或组氨酸(h);(z)丙氨酸(a)、天冬酰胺(n)、半胱氨酸(c)、谷氨酰胺(q)、甘氨酸(g)、异亮氨酸(i)、亮氨酸(l)、甲硫氨酸(m)、苯丙氨酸(f)、脯氨酸(p)、丝氨酸(s)、苏氨酸(t)、色氨酸(w)、酪氨酸(y)或缬氨酸(v)。[10][7]~[9]中任一项所述的抗原结合分子,其中,上述电荷相互不排斥的氨基酸残基中,ch1所包含的氨基酸残基且eu编号第175位的氨基酸残基为赖氨酸(k)、而cl所包含的氨基酸残基且eu编号第180位、第131位和第160位的氨基酸残基均为谷氨酸(e)。[11][7]~[9]中任一项所述的抗原结合分子,其中,上述电荷相互不排斥的氨基酸残基中,ch1所包含的氨基酸残基且eu编号第147位和第175位的氨基酸残基为谷氨酸(e)、而cl所包含的氨基酸残基且eu编号第180位、第131位和第160位的氨基酸残基均为赖氨酸(k)。[12][11]所述的抗原结合分子,而且,ch1所包含的氨基酸残基且eu编号第213位的氨基酸残基为谷氨酸(e)、而cl所包含的氨基酸残基且eu编号第123位的氨基酸残基为赖氨酸(k)。[13][7]~[12]中任一项所述的抗原结合分子,而且,形成重链可变区和轻链可变区的界面的两个残基以上的氨基酸残基是电荷相互不排斥的氨基酸残基。[14][13]所述的抗原结合分子,其中,上述电荷相互不排斥的氨基酸残基是选自以下的(a)或(b)所示氨基酸残基组的一组或两组氨基酸残基:(a)重链可变区所包含的氨基酸残基且kabat编号第39位的氨基酸残基、和轻链可变区所包含的氨基酸残基且kabat编号第38位的氨基酸残基;(b)重链可变区所包含的氨基酸残基且kabat编号第45位的氨基酸残基、和轻链可变区所包含的氨基酸残基且kabat编号第44位的氨基酸残基。[15][13]或[14]所述的抗原结合分子,其中,上述电荷相互不排斥的氨基酸残基是从选自以下的(x)~(z)的两组中分别选出的氨基酸残基,所述的两组选自(x)和(y)、(x)和(z)、(y)和(z)、或(z)和(z)的组合:(x)谷氨酸(e)、天冬氨酸(d);(y)赖氨酸(k)、精氨酸(r)、组氨酸(h);(z)丙氨酸(a)、天冬酰胺(n)、半胱氨酸(c)、谷氨酰胺(q)、甘氨酸(g)、异亮氨酸(i)、亮氨酸(l)、甲硫氨酸(m)、苯丙氨酸(f)、脯氨酸(p)、丝氨酸(s)、苏氨酸(t)、色氨酸(w)、酪氨酸(y)或缬氨酸(v)。[16][1]~[15]中任一项所述的抗原结合分子,该抗原结合分子为双特异性抗体。[17]控制了重链与轻链的缔合的抗原结合分子的制备方法,该制备方法包括下述的步骤(,1)~(3):步骤(1),修饰编码重链恒定区(ch1)和轻链恒定区(cl)的核酸,使选自以下的(a)~(c)所示氨基酸残基组的一组或两组以上的氨基酸残基电荷相互排斥:(a)ch1所包含的氨基酸残基且eu编号第147位的氨基酸残基、和cl所包含的氨基酸残基且eu编号第180位的氨基酸残基;(b)ch1所包含的氨基酸残基且eu编号第147位的氨基酸残基、和cl所包含的氨基酸残基且eu编号第131位的氨基酸残基;(c)ch1所包含的氨基酸残基且eu编号第175位的氨基酸残基、和cl所包含的氨基酸残基且eu编号第160位的氨基酸残基;步骤(2),将上述修饰了的核酸导入宿主细胞中,并培养宿主细胞,使该核酸表达;步骤(3),从上述宿主细胞的培养物中回收抗原结合分子。[18][17]所述的抗原结合分子的制备方法,其中,在上述步骤(1)中进一步包括如下步骤:修饰核酸,使以下的(d)所示氨基酸残基组的氨基酸残基电荷相互排斥,(d)ch1所包含的氨基酸残基且eu编号第213位的氨基酸残基、和cl所包含的氨基酸残基且eu编号第123位的氨基酸残基。[19][17]或[18]所述的抗原结合分子的制备方法,其中,在上述步骤(1)中包括如下步骤:修饰核酸,使电荷相互排斥的氨基酸残基选自以下的(x)或(y)的任一组所包含的氨基酸残基,(x)谷氨酸(e)、天冬氨酸(d);(y)赖氨酸(k)、精氨酸(r)、组氨酸(h)。[20][17]~[19]中任一项所述的抗原结合分子的制备方法,其中,在上述步骤(1)中进一步包括如下步骤:修饰核酸,使形成重链可变区和轻链可变区的界面的两个残基以上的氨基酸残基是电荷相互排斥的氨基酸残基。[21][20]所述的抗原结合分子的制备方法,其中,上述电荷相互排斥的氨基酸残基是选自以下的(a)或(b)所示氨基酸残基组的任意一组氨基酸残基:(a)重链可变区所包含的氨基酸残基且kabat编号第39位的氨基酸残基、和轻链可变区所包含的氨基酸残基且kabat编号第38位的氨基酸残基;(b)重链可变区所包含的氨基酸残基且kabat编号第45位的氨基酸残基、和轻链可变区所包含的氨基酸残基且kabat编号第44位的氨基酸残基。[22][20]或[21]所述的抗原结合分子的制备方法,其中,上述电荷相互排斥的氨基酸残基选自以下的(x)或(y)的任一组所包含的氨基酸残基:(x)谷氨酸(e)、天冬氨酸(d);(y)赖氨酸(k)、精氨酸(r)、组氨酸(h)。[23]控制了重链与轻链的缔合的抗原结合分子的制备方法,该制备方法包括下述的步骤(1)~(3):步骤(1),修饰编码重链恒定区(ch1)和轻链恒定区(cl)的核酸,使选自以下的(a)~(c)所示氨基酸残基组的一组或两组以上的氨基酸残基电荷相互不排斥:(a)重链恒定区(ch1)所包含的氨基酸残基且eu编号第147位的氨基酸残基、和轻链恒定区(cl)所包含的氨基酸残基且eu编号第180位的氨基酸残基;(b)ch1所包含的氨基酸残基且eu编号第147位的氨基酸残基、和cl所包含的氨基酸残基且eu编号第131位的氨基酸残基;(c)ch1所包含的氨基酸残基且eu编号第175位的氨基酸残基、和cl所包含的氨基酸残基且eu编号第160位的氨基酸残基;步骤(2),将上述修饰了的核酸导入宿主细胞中,并培养宿主细胞,使该核酸表达;步骤(3),从上述宿主细胞的培养物中回收抗原结合分子。[24][23]所述的抗原结合分子的制备方法,其中,在上述步骤(1)中进一步包括如下步骤:修饰核酸,以使以下的(d)所示氨基酸残基组的氨基酸残基电荷相互不排斥,(d)ch1所包含的氨基酸残基且eu编号第213位的氨基酸残基、和cl所包含的氨基酸残基且eu编号第123位的氨基酸残基。[25][23]或[24]所述的抗原结合分子的制备方法,其中,在上述步骤(1)中包括如下步骤:修饰核酸,以使电荷相互不排斥的氨基酸残基是从选自以下的(x)~(z)的两组中分别选出的氨基酸残基,所述的两组选自(x)和(y)、(x)和(z)、(y)和(z)、或(z)和(z)的组合,(x)谷氨酸(e)或天冬氨酸(d);(y)赖氨酸(k)、精氨酸(r)或组氨酸(h);(z)丙氨酸(a)、天冬酰胺(n)、半胱氨酸(c)、谷氨酰胺(q)、甘氨酸(g)、异亮氨酸(i)、亮氨酸(l)、甲硫氨酸(m)、苯丙氨酸(f)、脯氨酸(p)、丝氨酸(s)、苏氨酸(t)、色氨酸(w)、酪氨酸(y)或缬氨酸(v)。[26][23]~[25]中任一项所述的抗原结合分子的制备方法,其中,在上述步骤(1)中包括如下步骤:修饰核酸,使在电荷相互不排斥的氨基酸残基中,ch1所包含的氨基酸残基且eu编号第175位的氨基酸残基为赖氨酸(k)、而cl所包含的氨基酸残基且eu编号第180位、第131位和第160位的氨基酸残基均为谷氨酸(e)。[27][23]~[25]中任一项所述的抗原结合分子的制备方法,其中,在上述步骤(1)中包括如下步骤:修饰核酸,使在电荷相互不排斥的氨基酸残基中,ch1所包含的氨基酸残基且eu编号第147位和第175位的氨基酸残基为谷氨酸(e)、而cl所包含的氨基酸残基且eu编号第180位、第131位和第160位的氨基酸残基均为赖氨酸(k)。[28][27]所述的抗原结合分子的制备方法,该方法进一步包括如下步骤:修饰核酸,使ch1所包含的氨基酸残基且eu编号第213位的氨基酸残基为谷氨酸(e)、而cl所包含的氨基酸残基且eu编号第123位的氨基酸残基为赖氨酸(k)。[29][23]~[28]中任一项所述的抗原结合分子的制备方法,其中,在上述步骤(1)中进一步包括如下步骤:修饰核酸,使形成重链可变区和轻链可变区的界面的两个残基以上的氨基酸残基是电荷相互不排斥的氨基酸残基。[30][29]所述的抗原结合分子的制备方法,其中,上述电荷相互不排斥的氨基酸残基是选自以下的(a)或(b)所示氨基酸残基组的任意一组氨基酸残基:(a)重链可变区所包含的氨基酸残基且kabat编号第39位的氨基酸残基、和轻链可变区所包含的氨基酸残基且kabat编号第38位的氨基酸残基;(b)重链可变区所包含的氨基酸残基且kabat编号第45位的氨基酸残基、和轻链可变区所包含的氨基酸残基且kabat编号第44位的氨基酸残基。[31][29]或[30]所述的抗原结合分子的制备方法,其中,上述电荷相互不排斥的氨基酸残基是从选自以下的(x)~(z)的两组中分别选出的氨基酸残基,所述的两组选自(x)和(y)、(x)和(z)、(y)和(z)、或(z)和(z)的组合:(x)谷氨酸(e)、天冬氨酸(d);(y)赖氨酸(k)、精氨酸(r)、组氨酸(h);(z)丙氨酸(a)、天冬酰胺(n)、半胱氨酸(c)、谷氨酰胺(q)、甘氨酸(g)、异亮氨酸(i)、亮氨酸(l)、甲硫氨酸(m)、苯丙氨酸(f)、脯氨酸(p)、丝氨酸(s)、苏氨酸(t)、色氨酸(w)、酪氨酸(y)或缬氨酸(v)。[32]抗原结合分子,该抗原结合分子是通过[17]~[31]中任一项所述的抗原结合分子的制备方法来制备的。[33][32]所述的抗原结合分子,该抗原结合分子为双特异性抗体。[34]抗原结合分子的重链与轻链的缔合控制方法,该方法包括:修饰核酸,使选自以下的(a)~(c)所示氨基酸残基组的一组或两组以上的氨基酸残基成为电荷相互排斥的氨基酸残基,(a)ch1所包含的氨基酸残基且eu编号第147位的氨基酸残基、和cl所包含的氨基酸残基且eu编号第180位的氨基酸残基;(b)ch1所包含的氨基酸残基且eu编号第147位的氨基酸残基、和cl所包含的氨基酸残基且eu编号第131位的氨基酸残基;(c)ch1所包含的氨基酸残基且eu编号第175位的氨基酸残基、和cl所包含的氨基酸残基且eu编号第160位的氨基酸残基。[35][34]所述的方法,该方法还包括:修饰核酸,使以下的(d)所示氨基酸残基组的氨基酸残基成为电荷相互排斥的氨基酸残基,(d)ch1所包含的氨基酸残基且eu编号第213位的氨基酸残基、和cl所包含的氨基酸残基且eu编号第123位的氨基酸残基。[36][34]或[35]所述的方法,其中,上述电荷相互排斥的氨基酸残基选自以下的(x)或(y)的任一组所包含的氨基酸残基:(x)谷氨酸(e)、天冬氨酸(d);(y)赖氨酸(k)、精氨酸(r)、组氨酸(h)。[37][34]~[36]中任一项所述的方法,而且,形成重链可变区和轻链可变区的界面的两个残基以上的氨基酸残基是电荷相互排斥的氨基酸残基。[38][37]所述的方法,其中,上述电荷相互排斥的氨基酸残基是选自以下的(a)或(b)所示氨基酸残基组的任意一组氨基酸残基:(a)重链可变区所包含的氨基酸残基且kabat编号第39位的氨基酸残基、和轻链可变区所包含的氨基酸残基且kabat编号第38位的氨基酸残基;(b)重链可变区所包含的氨基酸残基且kabat编号第45位的氨基酸残基、和轻链可变区所包含的氨基酸残基且kabat编号第44位的氨基酸残基。[39][37]或[38]所述的方法,其中,上述电荷相互排斥的氨基酸残基选自以下的(x)或(y)的任一组所包含的氨基酸残基:(x)谷氨酸(e)、天冬氨酸(d);(y)赖氨酸(k)、精氨酸(r)、组氨酸(h)。[40]抗原结合分子的重链与轻链的缔合控制方法,该方法包括:修饰核酸,使选自以下的(a)~(c)所示氨基酸残基组的一组或两组以上的氨基酸残基成为电荷相互不排斥的氨基酸残基,(a)ch1所包含的氨基酸残基且eu编号第147位的氨基酸残基、和cl所包含的氨基酸残基且eu编号第180位的氨基酸残基;(b)ch1所包含的氨基酸残基且eu编号第147位的氨基酸残基、和cl所包含的氨基酸残基且eu编号第131位的氨基酸残基;(c)ch1所包含的氨基酸残基且eu编号第175位的氨基酸残基、和cl所包含的氨基酸残基且eu编号第160位的氨基酸残基。[41][40]所述的方法,该方法还包括:修饰核酸,使以下的(d)所示氨基酸残基组的氨基酸残基成为电荷相互不排斥的氨基酸残基,(d)ch1所包含的氨基酸残基且eu编号第213位的氨基酸残基、和cl所包含的氨基酸残基且eu编号第123位的氨基酸残基。[42][40]或[41]所述的方法,其中,上述电荷相互不排斥的氨基酸残基是从选自以下的(x)~(z)的两组中分别选出的氨基酸残基,所述的两组选自(x)和(y)、(x)和(z)、(y)和(z)、或(z)和(z)的组合:(x)谷氨酸(e)、天冬氨酸(d);(y)赖氨酸(k)、精氨酸(r)、组氨酸(h);(z)丙氨酸(a)、天冬酰胺(n)、半胱氨酸(c)、谷氨酰胺(q)、甘氨酸(g)、异亮氨酸(i)、亮氨酸(l)、甲硫氨酸(m)、苯丙氨酸(f)、脯氨酸(p)、丝氨酸(s)、苏氨酸(t)、色氨酸(w)、酪氨酸(y)或缬氨酸(v)。[43][40]~[42]中任一项所述的方法,其中,上述电荷相互不排斥的氨基酸残基中,chl所包含的氨基酸残基且eu编号第175位的氨基酸残基为赖氨酸(k)、而cl所包含的氨基酸残基且eu编号第180位、第131位和第160位的氨基酸残基均为谷氨酸(e)。[44][40]~[42]中任一项所述的方法,其中,上述电荷相互不排斥的氨基酸残基中,ch1所包含的氨基酸残基且eu编号第147位和第175位的氨基酸残基为谷氨酸(e)、而cl所包含的氨基酸残基且eu编号第180位、第131位和第160位的氨基酸残基均为赖氨酸(k)。[45][44]所述的方法,而且,ch1所包含的氨基酸残基且eu编号第213位的氨基酸残基为谷氨酸(e)、而cl所包含的氨基酸残基且eu编号第123位的氨基酸残基为赖氨酸(k)。[46][34]~[45]中任一项所述的方法,其中,抗原结合分子为双特异性抗体。[47]组合物,该组合物包含[1]~[16]、[32]或[33]中任一项所述的抗原结合分子和药学上可接受的载体。[48]核酸,该核酸编码[1]~[16]、[32]或[33]中任一项所述的抗原结合分子。[49]宿主细胞,该宿主细胞具有[48]所述的核酸。附图说明图1是ch1/cl的界面的模型图;图2是在混合一种h链和两种l链来制备抗体时,显示预计的h链和l链的组合的抗体的概念图。认为导入了突变的位点发生电荷相互作用,在所述位点处组合有用正方形围起来的e、k的抗体的比例多;图3是显示各抗体的aiex分析结果的图;图4是显示各抗体的aiex分析结果的图;图5是显示各抗体的aiex分析结果的图;图6是显示各抗体的aiex分析结果的图;图7是显示各抗体的ciex分析结果的图;图8是显示各抗体的ciex分析结果的图;图9-1是显示各抗体的ciex分析结果的图;图9-2是图9-1的续图;图10是显示各抗体的ciex分析结果的图;图11是显示各抗体的ciex分析结果的图;图12是通过比对人的iga1(seqidno:63)、iga2(seqidno:64)、igd(seqidno:65)、ige(seqidno:66)、igg1(seqidno:67)、igg2(seqidno:68)、igg3(seqidno:69)、igg4(seqidno:70)、igm(seqidno:71)的氨基酸序列来比较h链的ch1、以及通过比对人的igk(kappa)(seqidno:72)、igl1(seqidno:73)、igl2(seqidno:74)、igl3(seqidno:75)、igl6(seqidno:76)、igl7(seqidno:77)(λ)的氨基酸序列来比较l链的cl的图。具体实施方式本发明涉及控制了重链与轻链的缔合的抗体、控制了重链与轻链的缔合的抗体的制备方法、以及抗体的重链与轻链的缔合控制方法。在本发明中,“抗体”一词和“抗原结合分子”以相同的意义使用。即,在本发明中,“抗体”或“抗原结合分子”一词取其最广泛的意义使用,只要显示出所期望的抗原结合活性、生物学活性即可,包括单克隆抗体、多克隆抗体、抗体突变体(嵌合抗体、人源化抗体、小分子抗体(还包括可以任意添加其他分子的抗体片段)、多特异性抗体等)。例如,作为本发明中的“抗体”或“抗原结合分子”,可以列举在fab中添加了结合有has的支架的分子(仅fab部分为普通的抗体)。另外,在本发明中,“抗体”可以是多肽或异源多聚体中的任一种。优选的抗体为单克隆抗体、嵌合抗体、人源化抗体、人抗体、fc-融合抗体、以及抗体片段等小分子抗体。本发明的抗体是控制了重链与轻链的缔合的抗体,其中,构成抗体的重链和轻链是目标的重链与轻链的组合,重链恒定区(ch1)和轻链恒定区的规定位置的氨基酸残基是电荷相互排斥的氨基酸残基(是同种电荷)。在本发明中,通过使非目标的重链和轻链的组合的重链恒定区(ch1)和轻链恒定区的规定位置的氨基酸残基成为电荷相互排斥的氨基酸残基(形成同种电荷),利用电荷排斥可以防止形成非目标的重链和轻链的组合,其结果,可以形成目标的重链和轻链的组合。作为本发明抗体的另一方案,涉及控制了重链与轻链的缔合的抗体,其中,构成抗体的重链和轻链通过目标的重链和轻链的组合进行缔合,重链恒定区(ch1)和轻链恒定区的规定位置的氨基酸残基电荷相互不排斥。通过使目标的重链和轻链的组合的重链恒定区(ch1)和轻链恒定区的规定位置的氨基酸残基成为电荷相互不排斥的氨基酸残基,例如可以利用电荷引力形成目标的重链和轻链的组合。本发明中的多肽,通常是指具有大约10个氨基酸以上长度的肽和蛋白。另外,通常是指来源于生物的多肽,但没有特别限定,例如可以是包含人工设计的序列的多肽。另外,还可以是天然多肽或合成多肽、重组多肽等中的任一种。而且,上述多肽的片段也包括在本发明的多肽内。在本发明中,“控制缔合”、“缔合被控制”是指控制成所期望的缔合状态,更具体而言,是指控制成在重链和轻链之间不形成不希望的缔合。本发明中的“界面”通常是指缔合(相互作用)时的缔合面。形成界面的氨基酸残基通常是指经受该缔合的多肽区所含的一个或多个氨基酸残基,更优选缔合时接近并参与相互作用的氨基酸残基。该相互作用具体包括:缔合时接近的氨基酸残基之间形成氢键、静电相互作用、盐桥的情况等。本发明中的“形成界面的氨基酸残基”详细而言是指在构成界面的多肽区中,该多肽区所含的氨基酸残基。构成界面的多肽区的例子有:在抗体、配体、受体、底物等中,在其分子间担负选择性键合的多肽区。具体而言,在抗体中可以例示:重链恒定区、重链可变区、轻链恒定区、轻链可变区等。本发明中的氨基酸残基的“修饰”具体是指:将原始氨基酸残基取代成其他氨基酸残基、使原始氨基酸残基缺失、以及添加新的氨基酸残基等,优选是指将原始氨基酸残基取代成其他氨基酸残基。本发明抗体的优选方案是,缔合控制前的非目标的重链和轻链的组合的重链恒定区(ch1)和轻链恒定区的规定位置的氨基酸残基为具有电荷排斥的氨基酸残基(具有同种电荷)的抗体。认为通过将上述抗体中的氨基酸残基修饰成电荷相互排斥(具有同种电荷)的氨基酸残基,从而利用该电荷排斥来抑制这些氨基酸残基之间的缔合。本发明抗体的又一优选方案是,在多肽界面参与缔合的氨基酸残基为具有电荷相互不排斥的氨基酸残基的抗体。在上述抗体中,认为通过将在多肽界面参与缔合的氨基酸残基修饰成电荷相互不排斥的氨基酸残基,从而例如利用其电荷引力来促进这些氨基酸残基之间的缔合。因此,在上述抗体中,修饰的氨基酸残基优选为在形成界面的多肽区间,缔合时相互接近的氨基酸残基。缔合时接近的氨基酸残基,例如可以通过分析多肽的立体结构,研究该多肽缔合时形成界面的多肽区的氨基酸序列来识别。界面上相互接近的氨基酸残基成为本发明的抗体中“修饰”的优选目标。氨基酸中已知有带电荷的氨基酸。通常,作为带正电荷的氨基酸(正电荷氨基酸),已知有赖氨酸(k)、精氨酸(r)、组氨酸(h)。作为带负电荷的氨基酸(负电荷氨基酸),已知有天冬氨酸(d)、谷氨酸(e)等。另外,作为不带电荷的氨基酸或非极性氨基酸,已知有丙氨酸(a)、天冬酰胺(n)、半胱氨酸(c)、谷氨酰胺(q)、甘氨酸(g)、异亮氨酸(i)、亮氨酸(l)、甲硫氨酸(m)、苯丙氨酸(f)、脯氨酸(p)、丝氨酸(s)、苏氨酸(t)、色氨酸(w)、酪氨酸(y)或缬氨酸(v)等。因此,在本发明中,电荷相互排斥(具有同种电荷)的氨基酸是指:(1)一方的氨基酸为正电荷的氨基酸、另一方的氨基酸也为正电荷的氨基酸;(2)一方的氨基酸为负电荷的氨基酸、另一方的氨基酸也为负电荷的氨基酸。另外,在本发明中,电荷相互不排斥的氨基酸是指:(1)一方的氨基酸为正电荷的氨基酸、另一方的氨基酸为负电荷的氨基酸;(2)一方的氨基酸为正电荷的氨基酸、另一方的氨基酸为不带电荷的氨基酸或非极性氨基酸;(3)一方的氨基酸为负电荷的氨基酸、另一方的氨基酸为不带电荷的氨基酸或非极性氨基酸;(4)双方的氨基酸均为不带电荷的氨基酸或非极性氨基酸。氨基酸的修饰可以利用本领域公知的各种方法来进行。在这些方法中,并不限于以下的方法,但可以通过位点特异性诱变法(hashimoto-gotoh,t,mizuno,t,ogasahara,y和nakagawa,m.(1995)anoligodeoxyribonucleotide-directeddualambermethodforsite-directedmutagenesis.gene152,271-275;zoller,mj和smith,m.(1983)oligonucleotide-directedmutagenesisofdnafragmentsclonedintom13vectors.methodsenzymol.100,468-500;kramer,w,drutsa,v,jansen,hw,kramer,b,pflugfelder,m和fritz,hj(1984)thegappedduplexdnaapproachtooligonucleotide-directedmutationconstruction.nucleicacidsres.12,9441-9456;kramerw.和fritzhj(1987)oligonucleotide-directedconstructionofmutationsviagappedduplexdnamethods.enzymol.154,350-367;kunkel,ta(1985)rapidandefficientsite-specificmutagenesiswithoutphenotypicselection.procnatlacadsciusa.82,488-492)、pcr突变法、盒式突变法等方法来进行。氨基酸的修饰例如可以列举:将不带电荷的氨基酸或非极性氨基酸修饰成正电荷氨基酸、将不带电荷的氨基酸或非极性氨基酸修饰成负电荷氨基酸、将正电荷氨基酸修饰成负电荷氨基酸、将负电荷氨基酸修饰成正电荷氨基酸。需要说明的是,本发明中的氨基酸的修饰还包括:将不带电荷的氨基酸或非极性氨基酸修饰成其他的不带电荷的氨基酸或非极性氨基酸、将正电荷氨基酸修饰成其他的正电荷氨基酸、将负电荷氨基酸修饰成其他的负电荷氨基酸。本发明中,在重链和轻链中可以分别各加入1个、也可以各加入多个氨基酸的修饰。另外,重链和轻链中所加入的修饰的数目彼此可以相同也可以不同。本发明中,关于氨基酸的修饰,可以在重链或轻链的一方中加入多个修饰成正电荷氨基酸的修饰、在另一方中加入多个修饰成负电荷氨基酸的修饰。另外,在重链或轻链的相同链中可以加入多个修饰成正电荷氨基酸的修饰和修饰成负电荷氨基酸的修饰。需要说明的是,在该修饰中,可以将修饰成不带电荷氨基酸或非极性氨基酸的修饰、不带电荷氨基酸或非极性氨基酸的修饰适当组合。在本发明的修饰中,例如,还可以不修饰一条链的氨基酸而直接使用,此时未必在重链和轻链中均加入修饰,可以只在一条链中加入修饰。本发明的抗体中,对经受修饰的氨基酸残基数没有特别限定,但例如当修饰抗体恒定区时,为了不降低所得抗体与抗原的结合活性以及不提高其免疫原性,优选修饰尽量少数的氨基酸残基。上述“少数”是指例如1~30个左右的数,优选1~20个左右的数,进一步优选1~15个的数,最优选1~5个的数。在本发明中,“抗体”一词以其最广泛的意义使用,只要显示出所期望的生物学活性即可,包括单克隆抗体、多克隆抗体、抗体突变体(嵌合抗体、人源化抗体、小分子抗体(还包括抗体片段)、多特异性抗体等)。另外,在本发明中,“抗体”可以是多肽或异源多聚体中的任一种。优选的抗体为:单克隆抗体、嵌合抗体、人源化抗体、人抗体、fc-融合抗体、以及抗体片段等小分子抗体。本发明中,“多特异性抗体(multispecificantibody)”(在本说明书中,和“多种特异性抗体(polyspecificantibody)”意思相同)是指能够与多种不同表位进行特异性结合的抗体。即,多特异性抗体是对至少两种不同表位具有特异性的抗体,除了识别不同抗原的抗体以外,还包括识别同一抗原上的不同表位的抗体。(例如,当抗原为异源受体(heterologousreceptor)时,多特异性抗体识别构成异源受体的不同结构域;或者当抗原为单体时,多特异性抗体识别单体抗原的多个位点)。通常,这种分子和两个抗原结合(双特异性抗体(bispecificantibody),在本说明书中和“双重特异性抗体”(dual-specifcantibody)意思相同),但是可以对两种以上(例如三种)的抗原具有特异性。本发明中的“抗体”包括:通过对上述抗体进一步进行氨基酸的取代、缺失、添加和/或插入、或嵌合或人源化等,使其氨基酸序列被修饰的抗体。氨基酸的取代、缺失、添加和/或插入以及人源化或嵌合等氨基酸序列的修饰,可以通过本领域技术人员所公知的方法来进行。同样,制作本发明的抗体作为重组抗体时,也可以通过对所用抗体的可变区和恒定区进行氨基酸的取代、缺失、添加和/或插入或者嵌合或人源化等,来修饰其氨基酸序列。本发明中的抗体可以是小鼠抗体、人抗体、大鼠抗体、兔抗体、山羊抗体、骆驼抗体等来源于任一种动物的抗体。而且,可以是例如嵌合抗体、其中特别是人源化抗体等取代了氨基酸序列的修饰抗体。还可以是结合有各种分子的抗体修饰物、抗体片段、小分子抗体等任何抗体。“嵌合抗体”是指将来源于不同动物的序列组合而制作的抗体。例如可以例示:包括小鼠抗体的重链、轻链的可变(v)区和人抗体的重链、轻链的恒定(c)区的抗体。嵌合抗体的制作众所周知,例如将编码抗体v区的dna和编码人抗体恒定区的dna连接,将其插入表达载体中并导入到宿主中产生抗体,从而可以得到嵌合抗体。“人源化抗体”也称作重构(reshaped)人抗体,是将来源于人以外的哺乳动物的抗体例如小鼠抗体的互补性决定区(cdr;complementaritydeterminingregion)移植到人抗体的cdr中而得到的抗体。用于鉴定cdr的方法众所周知(kabat等人,sequenceofproteinsofimmunologicalinterest(1987),nationalinstituteofhealth,bethesda,md.;chothia等人,nature(1989)342:877)。另外,其通常的基因重组方法也是公知的(参照欧洲专利申请公开号ep125023号公报、wo96/02576号公报)。因此,可以利用公知的方法例如确定小鼠抗体的cdr,获得编码抗体的dna,上述抗体连接有小鼠抗体的cdr和人抗体的构架区(frameworkregion;fr),之后通过使用通常的表达载体的系统产生人源化抗体。上述dna可以使用多个寡核苷酸作为引物,通过pcr法来合成,上述寡核苷酸制作成在cdr和fr的末端区均具有重叠部分(参照wo98/13388号公报中记载的方法)。选择经由cdr连接的人抗体的fr,使cdr形成良好的抗原结合位点。根据需要,可以修饰抗体可变区中的fr的氨基酸,使重构人抗体的cdr形成合适的抗原结合位点(sato等人,cancerres.(1993)53:851-6)。可修饰的fr中的氨基酸残基包括:通过非共价键直接与抗原结合的部分(amit等人,science(1986)233:747-53)、影响或作用于cdr结构的部分(chothia等人,j.mol.biol.(1987)196:901-17)和与vh-vl相互作用有关的部分(ep239400号专利公报)。本发明的抗体的重链恒定区优选为人重链恒定区。另外,抗体的重链恒定区中存在例如iga1、iga2、igd、ige、igg1、igg2、igg3、igg4、igm型的恒定区。对本发明的抗体的重链恒定区没有特别限定,优选igg1型恒定区,特别优选人igg1恒定区。作为人igg1恒定区,通过遗传多态性得到的多个同种异型序列记载在sequencesofproteinsofimmunologicalinterest,nihpublicationno.91-3242中,但在本发明中可以是其中的任一个序列。另外,本发明的抗体的轻链恒定区优选为人轻链恒定区。另外,抗体的轻链恒定区中存在例如igk(kappa)、igl1、igl2、igl3、igl6、igl7(λ)型的恒定区。对本发明的抗体的轻链恒定区没有特别限定,但优选人igk(kappa)恒定区。人igk(kappa)恒定区的氨基酸序列是公知的(seqidno:72)。作为人igk(kappa)恒定区和人igl7(λ)恒定区,通过遗传多态性得到的多个同种异型序列记载在sequencesofproteinsofimmunologicalinterest,nihpublicationno.91-3242中,但在本发明中可以是其中的任一个序列。为了改善抗体的功能或抗体的稳定性,根据需要,可以修饰抗体恒定区、特别是重链恒定区。作为用于改善抗体功能的修饰,例如可以列举:增强或减弱抗体与fcγ受体(fcγr)的结合的修饰、增强或减弱抗体与fcrn的结合的修饰、增强或减弱抗体的细胞毒活性(例如adcc活性、cdc活性等)的修饰等。另外,还可以包括改善抗体的异质性的修饰、改善免疫原性和/或药物动力学的修饰。另外,作为igg抗体的重链c末端序列的异质性,有人报道了:由c末端氨基酸的赖氨酸残基的缺乏和c末端的两个氨基酸的甘氨酸、赖氨酸双方的缺乏引起的c末端羧基的酰胺化(analbiochem.2007jan1;360(1):75-83.)。因此,在本发明中,为了降低重链c末端的异质性,优选使用缺乏了c末端的赖氨酸或c末端的赖氨酸和甘氨酸的igg。使用了来源于人的序列的嵌合抗体和人源化抗体,由于其在人体内的抗原性已经减弱,所以认为在为了治疗等而对人进行给药时实用。另外,关于小分子抗体,无论从其体内动力学性质方面考虑,还是从可以使用大肠杆菌、植物细胞等低成本地进行制备方面考虑,其作为抗体都是有用的。抗体片段是一种小分子抗体。小分子抗体还包括以抗体片段作为其一部分结构的抗体。本发明中的小分子抗体只要具有抗原结合能即可,对其结构、制备方法等没有特别限定。小分子抗体中,还存在具有高于全长抗体的活性的抗体(orita等人,blood(2005)105:562-566)。本说明书中,“抗体片段”只要是全长抗体(例如全长igg等)的一部分即可,没有特别限定,优选包括重链可变区(vh)或轻链可变区(vl),进一步包括ch1或cl。作为优选的抗体片段的例子,例如可以列举fab、f(ab’)2、fab’等。抗体片段中的vh、vl、ch1和cl的氨基酸序列,可以通过取代、缺失、添加和/或插入来修饰。并且,只要保持抗原结合能力即可,可以缺乏ch1、cl、vh和vl的一部分,为了增强药物动力学(pk)或药效,可以添加scfv、fab、结构域抗体(domainantibody:dab)、vhh等抗体片段、结合有has的支架(hasbindingscaffold)、peg、白蛋白、细胞因子、毒素等(biodrugs2009;23(2):93-109;methodsmolmed.2005;109:347-74.;aapsj.2006aug18;8(3):e532-51.等中记载的分子)。抗体片段可以通过将抗体用酶例如木瓜蛋白酶、胃蛋白酶等蛋白酶进行处理而得到(参照morimoto等人,j.biochem.biophys.methods(1992)24:107-17;brennan等,science(1985)229:81)。还可以根据该抗体片段的氨基酸序列,通过基因重组来制备。具有修饰了抗体片段的结构的小分子抗体,可以利用通过酶处理或基因重组而得到的抗体片段来构建。或者,还可以构建编码小分子抗体整体的基因,将其导入表达载体中,之后使之在适当的宿主细胞中表达(例如参照co等人,j.immunol.(1994)152:2968-76;betterandhorwitz,methodsenzymol.(1989)178:476-96;pluckthun和skerra,methodsenzymol.(1989)178:497-515;lamoyi,methodsenzymol.(1986)121:652-63;rousseaux等人,methodsenzymol.(1986)121:663-9;bird和walker,trendsbiotechnol.(1991)9:132-7)。作为本发明的优选的抗体,例如可以列举:具有两种以上的ch1和两种以上的cl的异源多聚体。该异源多聚体优选识别两种以上的表位的异源多聚体,例如可以例示多特异性抗体。作为本发明的多特异性抗体,可以优选列举双特异性抗体。即,作为本发明的抗体的优选方案,例如可以列举:由两种重链(第一重链和第二重链)和两种轻链(第一轻链和第二轻链)构成的双特异性抗体。进一步对本发明抗体的优选方案的“双特异性抗体”进行详述,上述“第一重链”是指形成抗体的两条重链(h链)中的一条h链,第二h链是指不同于第一h链的另一条h链。即,两条h链中,可以将任意一条作为第一h链,将另一条作为第二h链。同样,“第一轻链”是指形成双特异性抗体的两条轻链(l链)中的一条l链,第二l链是指不同于第一l链的另一条l链,两条l链中,可以将任意一条作为第一l链,将另一条作为第二l链。通常,第一l链和第一h链来源于识别某种抗原(或表位)的同一抗体,而第二l链和第二h链也来源于识别某种抗原(或表位)的同一抗体。这里,将由第一h链和l链形成的l链-h链对称为第一对,将由第二h链和l链形成的l链-h链对称为第二对。制作第二对来源的抗体时所使用的抗原(或表位)优选不同于制作第一对来源的抗体时所使用的抗原(或表位)。即,第一对和第二对所识别的抗原可以相同,但优选识别不同的抗原(或表位)。这种情况下,第一对和第二对的h链和l链优选具有互不相同的氨基酸序列。当第一对和第二对识别不同的表位时,该第一对和第二对可以识别完全不同的抗原,也可以识别同一抗原上的不同位点(不同表位)。其中一对识别蛋白、肽、基因、糖等抗原,另一对可以识别放射性物质、化疗试剂、来源于细胞的毒素等细胞毒性物质等。但是,当准备制作具有以特定的h链和l链的组合形成的对的抗体时,可以任意确定其特定的h链和l链作为第一对和第二对。本发明中的编码导入突变之前的抗体(本说明书中有时仅记作“本发明的抗体”)的h链或l链的基因也可以使用已知的序列,还可以按照本领域技术人员所公知的方法而获得。例如,既可以由抗体文库获得,也可以由产生单克隆抗体的杂交瘤克隆编码抗体的基因而获得。关于抗体文库,已经有多个抗体文库为人所公知,另外抗体文库的制作方法也众所周知,因此本领域技术人员可以获取适当的抗体文库。例如,关于噬菌体抗体文库,可以参照clackson等人,nature1991,352:624-8;marks等人,j.mol.biol.1991,222:581-97;waterhouses等人,nucleicacidsres.1993,21:2265-6;griffiths等人,emboj.1994,13:3245-60;vaughan等人,naturebiotechnology1996,14:309-14和日本特表平10-504970号公报等文献。此外,可以使用以真核细胞作为文库的方法(wo95/15393号小册子)或核糖体提示法等公知方法。而且,还已知使用人抗体文库,通过淘选获得人抗体的技术。例如,可以以人抗体的可变区作为单链抗体(scfv),通过噬菌体展示法使之在噬菌体表面表达,来选择与抗原结合的噬菌体。分析所选择的噬菌体的基因,可以确定编码与抗原结合的人抗体可变区的dna序列。一旦清楚了与抗原结合的scfv的dna序列,就可以根据该序列制作适当的表达载体,获得人抗体。上述方法已经众所周知,可以参考wo92/01047、wo92/20791、wo93/06213、wo93/11236、wo93/19172、wo95/01438、wo95/15388。由杂交瘤获得编码抗体的基因的方法,基本上使用公知技术,使用所期望的抗原或表达所期望的抗原的细胞作为致敏抗原,按照通常的免疫方法对其进行免疫,利用通常的细胞融合法使所得免疫细胞和公知的亲本细胞融合,再利用通常的筛选法筛选单克隆抗体产生细胞(杂交瘤),并使用逆转录酶由所得杂交瘤的mrna合成抗体可变区(v区)的cdna,将该cdna和编码所期望的抗体恒定区的dna连接而得到。用于得到上述编码h链和l链的抗体基因的致敏抗原并不特别限于以下例子,包括具有免疫原性的完全抗原和不具有免疫原性的不完全抗原两者,上述不完全抗原包括半抗原等。对本发明抗体的抗原没有特别限定,例如,已知目标蛋白的全长蛋白或部分肽等能够成为抗原。可以使用由多糖类、核酸、脂质等构成的物质。抗原的制备可以按照例如使用杆状病毒的方法(例如wo98/46777等)等本领域技术人员所公知的方法来进行。杂交瘤的制作,例如可以按照milstein等人的方法(g.kohler和c.milstein,methodsenzymol.1981,73:3-46)等来进行。当抗原的免疫原性低时,可以使之和白蛋白等具免疫原性的大分子结合来进行免疫。根据需要,还可以使抗原和其他分子结合,从而成为可溶性抗原。当使用受体这样的跨膜分子作为抗原时,可以使用受体的胞外区部分作为片段,或者使用在细胞表面上表达跨膜分子的细胞作为免疫原。产生抗体的细胞可以通过使用上述适当的致敏抗原,对动物进行免疫而得到。或者,在体外对能够产生抗体的淋巴细胞进行免疫而形成产生抗体的细胞。进行免疫的动物可以使用各种哺乳动物,但通常使用啮齿类、兔形目、灵长类动物。具体而言,可以例示:小鼠、大鼠、仓鼠等啮齿类;兔等兔形目;食蟹猴、恒河猴、狒狒、黑猩猩等灵长类动物。还已知具有人抗体基因的所有组成部分(repertories)的转基因动物,通过使用这样的动物,也可以得到人抗体(参照wo96/34096;mendez等人,nat.genet.1997,15:146-56)。不使用上述转基因动物,而是例如通过在体外用所期望的抗原或表达所期望的抗原的细胞致敏人淋巴细胞,并使致敏淋巴细胞和人骨髓瘤细胞例如u266融合,也可以得到具有抗原结合活性的所期望的人抗体(参照日本特公平1-59878号公报)。另外,还可以通过用所期望的抗原对具有人抗体基因的全部的所有组成部分的转基因动物进行免疫得到所期望的人抗体(参照wo93/12227、wo92/03918、wo94/02602、wo96/34096、wo96/33735)。动物的免疫可如下进行:将致敏抗原用磷酸盐缓冲液(pbs)或生理盐水等适当稀释并悬浮,根据需要混合佐剂并进行乳化,然后注射到动物的腹腔内或皮下来进行免疫。之后,优选每4~21天给予数次混合在弗式不完全佐剂中的致敏抗原。可以通过常规方法测定动物血清中的目标抗体效价来确认抗体的产生。杂交瘤可如下制备:使用常用融合剂(例如聚乙二醇),使自动物或淋巴细胞得到的抗体产生细胞和骨髓瘤细胞融合来制备,上述动物经所期望的抗原免疫(golding,monoclonalantibodies(单克隆抗体):principlesandpractice,academicpress,1986,59-103)。然后,根据需要培养、增殖杂交瘤细胞,并通过免疫沉淀、放射免疫分析(ria)、酶联免疫吸附分析(elisa)等公知的分析方法,测定由该杂交瘤产生的抗体的结合特异性、亲和性或活性。之后,根据需要,可以利用极限稀释法等方法亚克隆产生抗体的杂交瘤,上述抗体的目标结合特异性、亲和性或活性已测定。接下来,可以使用能够与抗体特异性结合的探针(例如,与编码抗体恒定区的序列互补的寡核苷酸等),由杂交瘤或抗体产生细胞(致敏淋巴细胞等)克隆编码目标抗体的基因。还可以通过rt-pcr由mrna进行克隆。免疫球蛋白分为iga、igd、ige、igg和igm五个不同类别。而且,这些类别分成几个亚类(同工型)(例如,igg-1、igg-2、igg-3和igg-4;iga-1和iga-2等)。在本发明中,对抗体制备中使用的h链和l链没有特别限定,可以来源于属于上述任一类别和亚类的抗体,特别优选igg。这里,还可以通过基因工程技术修饰编码h链和l链的基因。例如,对于小鼠抗体、大鼠抗体、兔抗体、仓鼠抗体、山羊抗体、骆驼抗体等抗体,为了减弱其对人的异种抗原性等,可以适当制作人工修饰的基因重组型抗体,例如嵌合抗体、人源化抗体等。嵌合抗体是含有除了人以外的哺乳动物例如小鼠抗体的h链、l链的可变区和人抗体的h链、l链的恒定区的抗体,可以通过将编码小鼠抗体可变区的dna和编码人抗体恒定区的dna连接,将其插入表达载体中,并导入宿主中而产生嵌合抗体。人源化抗体也称作重构(reshaped)人抗体。可通过pcr法由多个寡核苷酸合成,上述寡核苷酸制作成在dna序列的末端具有重叠部分,上述dna序列设计成连接除人以外的哺乳动物(例如小鼠)的抗体的互补性决定区(cdr;complementarydeterminingregion),将所得dna和编码人抗体恒定区的dna连接,然后插入表达载体中,并将其导入宿主中而产生人源化抗体(参照ep239400;wo96/02576)。经由cdr连接的人抗体的fr,选择互补性决定区形成良好的抗原结合位点的fr。根据需要,可以取代抗体可变区的构架区氨基酸,使重构人抗体的互补性决定区形成适当的抗原结合位点(k.sato等人,cancerres.1993,53:851-856)。除上述人源化以外,例如还可以进行改善与抗原的结合性等抗体的生物学特性的修饰。上述修饰可以通过位点特异性诱变(参照例如kunkel(1985)proc.natl.acad.sci.usa82:488)、pcr诱变、盒式诱变等方法来进行。通常,生物学特性得到改善的抗体突变体,其相对于原始抗体可变区的氨基酸序列,具有70%以上、更优选80%以上、进一步优选90%以上(例如95%以上、97%、98%、99%等)的氨基酸序列同源性和/或相似性。在本说明书中,序列同源性和/或相似性定义为:根据需要进行序列排比和间隙导入(gapintroduction),使序列同源性达到最大值,之后与原始抗体残基相同(相同残基)或相似(根据一般的氨基酸侧链的特性分类为同一组的氨基酸残基)的氨基酸残基的比例。通常,天然氨基酸残基根据其侧链的性质分为以下几组:(1)疏水性:丙氨酸、异亮氨酸、正亮氨酸、缬氨酸、甲硫氨酸和亮氨酸;(2)中性亲水性:天冬酰胺、谷氨酰胺、半胱氨酸、苏氨酸和丝氨酸;(3)酸性:天冬氨酸和谷氨酸;(4)碱性:精氨酸、组氨酸和赖氨酸;(5)影响链取向的残基:甘氨酸和脯氨酸;以及(6)芳族性:酪氨酸、色氨酸和苯丙氨酸。通常,存在于h链和l链的可变区的共6个互补性决定区(超可变区;cdr)相互作用,形成抗体的抗原结合位点。已知即使是其中一个可变区,尽管与包括所有结合位点时相比亲和性低,但也具有识别并结合抗原的能力。因此,本发明的编码h链和l链的抗体基因,其只要编码包括h链和l链的各抗原结合位点的片段部分即可,由该基因编码的多肽只要维持与所期望的抗原的结合性即可。以下,对igg型双特异性抗体的情况进行更详细的说明,该抗体具有两种重链恒定区ch1(ch1-a和ch1-b)和两种轻链恒定区(cl-a和cl-b),其他抗体也同样可以适用本发明。当准备获得通过第一ch1-a和第一cl-a识别其中一个表位、并通过第二ch1-b和第二cl-b识别另一个表位的双特异性抗体时,若在该抗体的生产中表达了4种中的每一种链,则理论上可以生产10种抗体分子。这种情况下,若进行控制以抑制例如ch1-a和cl-b和/或ch1-b和cl-a之间的缔合,则可以优先获得所期望的抗体分子。例如,可以举例如下:将形成ch1-a和cl-b之间的界面的氨基酸残基修饰成带有正电荷的氨基酸残基,将形成ch1-b和cl-a之间的界面的氨基酸残基修饰成带有负电荷的氨基酸残基。通过该修饰,非目标的ch1-a与cl-b的缔合因形成界面的氨基酸残基均带有正电荷而被抑制,ch1-b与cl-a的缔合也因形成界面的氨基酸残基均带有负电荷而被抑制,非目标的ch1-a与cl-b的缔合以及ch1-b与cl-a的缔合因形成界面的氨基酸残基彼此带有相同电荷而被抑制。其结果,可以有效获得发生了目标的ch1-a与cl-a的缔合以及目标的ch1-b与cl-b的缔合的抗体。另外,目标的ch1-a与cl-a的缔合因形成界面的氨基酸残基带有互不相同的电荷而得到促进,目标的ch1-b与cl-b的缔合也因形成界面的氨基酸残基带有互不相同的电荷而得到促进。其结果,可以有效获得发生了目标缔合的抗体。另外,当形成cl-a和ch1-b之间的界面的氨基酸残基是彼此不带电荷的氨基酸或非极性氨基酸时,可以举例如下:将形成ch1-a和cl-b之间的界面的氨基酸残基修饰成带有正电荷的氨基酸残基。通过该修饰,非目标的ch1-a与cl-b的缔合因形成界面的氨基酸残基均带有正电荷而被抑制。另一方面,目标的ch1-a与cl-a的缔合以及目标的ch1-b与cl-b的缔合,因形成界面的氨基酸残基是电荷相互不排斥的氨基酸,所以与身为电荷排斥的氨基酸时相比容易发生缔合。其结果,可以有效获得发生了目标的ch1-a与cl-a的缔合以及目标的ch1-b与cl-b的缔合的抗体。尚需说明的是,在这个例子中,当形成cl-a和ch1-b之间的界面的氨基酸残基不是相互不带电荷的氨基酸或非极性氨基酸时,可以进行修饰以使其成为相互不带电荷的氨基酸或非极性氨基酸。另外,当形成cl-b和ch1-b之间的界面的氨基酸残基是相互不带电荷的氨基酸或非极性氨基酸时,可以举例如下:将形成ch1-a和cl-a之间的界面的氨基酸残基中的一方修饰成带有正电荷的氨基酸残基、而将另一方修饰成带有负电荷的氨基酸残基。通过该修饰,目标的ch1-a与cl-a的缔合因形成界面的氨基酸残基是正电荷与负电荷的组合而得到促进,另一方面,目标的ch1-b与cl-b的缔合因形成界面的氨基酸残基是电荷相互不排斥的氨基酸而被抑制。其结果,可以有效获得发生了目标的ch1-a与cl-a的缔合以及目标的ch1-b与cl-b的缔合的抗体。尚需说明的是,在这个例子中,当形成cl-b和ch1-b之间的界面的氨基酸残基是相互不带电荷的氨基酸或非极性氨基酸时,可以进行修饰以使其成为相互不带电荷的氨基酸或非极性氨基酸。另外,在ch1-b中,当形成cl-b和ch1-b之间的界面的氨基酸残基是不带电荷的氨基酸或非极性氨基酸时,可以举例如下:将形成ch1-a和cl-a之间的界面的氨基酸残基中的一方修饰成带有正电荷的氨基酸残基、而将另一方修饰成带有负电荷的氨基酸残基,而在cl-b中,将形成cl-b和ch1-b之间的界面的氨基酸残基修饰成带有与对ch1-a所作的修饰相同的电荷。通过该修饰,目标的ch1-a与cl-a的缔合因形成界面的氨基酸残基是正电荷与负电荷的组合而得到促进,另一方面,目标的ch1-b与cl-b的缔合因形成界面的氨基酸残基是电荷相互不排斥的氨基酸而被抑制。其结果,可有效获得发生了目标的ch1-a与cl-a的缔合以及目标的ch1-b与cl-b的缔合的抗体。尚需说明的是,这个例子中,在ch1-b中当形成cl-b和ch1-b之间的界面的氨基酸残基不是不带电荷的氨基酸或非极性氨基酸时,可以进行修饰,使其成为不带电荷的氨基酸或非极性氨基酸。另外,通过利用本发明的缔合控制,还可以抑制ch1之间(ch1-a和ch1-b)或cl之间(cl-a和cl-b)的缔合。根据本发明,关于准备控制缔合的所期望的多肽,本领域技术人员可以适当了解缔合时的在ch1和cl的界面接近的氨基酸残基的种类。另外,在人、猴、小鼠和兔等生物中,本领域技术人员可以利用公共的数据库等,适当获得可用作抗体的ch1或cl的序列。更具体而言,可以利用后述实施例中记载的方法,获得ch1或cl的氨基酸序列信息。例如,关于后述的实施例所示的双特异性抗体,作为在缔合时的ch1和cl的界面接近(相对或接触)的氨基酸残基的具体例子,可以列举以下的组合。·ch1的eu编号第147位(例如,seqidno:1中记载的氨基酸序列中的第147位)的赖氨酸(k)和相对(接触)的cl的eu编号第180位的苏氨酸(t)·ch1的eu编号第147位的赖氨酸(k)和相对(接触)的cl的eu编号第131位的丝氨酸(s)·ch1的eu编号第175位的谷氨酰胺(q)和相对(接触)的cl的eu编号第160位的谷氨酰胺(q)·ch1的eu编号第213位的赖氨酸(k)和相对(接触)的cl的eu编号第123位的谷氨酸(e)本发明中的以eu编号来记载的编号是指,按照eu编号(sequencesofproteinsofimmunologicalinterest,nihpublicationno.91-3242)来记载的编号。需要说明的是,在本发明中,“eu编号第x位的氨基酸残基”、“eu编号第x位的氨基酸”(x为任意的数)还可以理解成“相当于eu编号第x位的氨基酸残基”、“相当于eu编号第x位的氨基酸”。如后述的实施例所示,通过修饰这些氨基酸残基,并实施本发明的方法,可以优先获得所期望的抗体。即,本发明提供抗体,所述抗体是控制了重链与轻链的缔合的抗体,在该抗体中,重链和轻链中的选自以下的(a)~(c)所示氨基酸残基组的一组或两组以上的氨基酸残基是电荷相互排斥的氨基酸残基:(a)重链恒定区(ch1)所包含的氨基酸残基且eu编号第147位的氨基酸残基、和轻链恒定区(cl)所包含的氨基酸残基且eu编号第180位的氨基酸残基;(b)ch1所包含的氨基酸残基且eu编号第147位的氨基酸残基、和cl所包含的氨基酸残基且eu编号第131位的氨基酸残基;(c)ch1所包含的氨基酸残基且eu编号第175位的氨基酸残基、和cl所包含的氨基酸残基且eu编号第160位的氨基酸残基。本发明的又一方案还提供抗体,其中,以下的(d)所示氨基酸残基组的氨基酸残基是电荷相互排斥的氨基酸残基:(d)ch1所包含的氨基酸残基且eu编号第213位的氨基酸残基、和cl所包含的氨基酸残基且eu编号第123位的氨基酸残基。在上述抗体中,“电荷相互排斥的氨基酸残基”或“带有同种电荷的氨基酸残基”例如优选选自以下的(x)或(y)的任一组所包含的氨基酸残基:(x)谷氨酸(e)或天冬氨酸(d);(y)赖氨酸(k)、精氨酸(r)或组氨酸(h)。在上述抗体中,作为电荷相互排斥的氨基酸残基,具体而言,可以列举以下的氨基酸残基:·ch1所包含的氨基酸残基且eu编号第175位的氨基酸残基为赖氨酸(k),cl所包含的氨基酸残基且eu编号第180位、第131位和第160位的氨基酸残基均为谷氨酸(e);·ch1所包含的氨基酸残基且eu编号第147位和第175位的氨基酸残基为谷氨酸(e),cl所包含的氨基酸残基且eu编号第180位、第131位和第160位的氨基酸残基均为赖氨酸(k)。在上述抗体中,作为电荷不排斥的氨基酸残基,还可以列举:ch1所包含的氨基酸残基且eu编号第213位的氨基酸残基为谷氨酸(e)、cl所包含的氨基酸残基且eu编号第123位的氨基酸残基为赖氨酸(k)。另外,本发明的优选方案还涉及:关于上述抗体的制备方法和本发明的缔合控制方法,后者是将上述的(a)~(d)所示氨基酸残基组的氨基酸残基修饰成电荷相互排斥的氨基酸残基。另外,本发明还提供抗体,所述抗体是控制了重链与轻链的缔合的抗体,在该抗体中,预缔合的重链和轻链中的选自以下的(a)~(c)所示氨基酸残基组的一组或两组以上的氨基酸残基是电荷相互不排斥的氨基酸残基:(a)ch1所包含的氨基酸残基且eu编号第147位的氨基酸残基、和cl所包含的氨基酸残基且eu编号第180位的氨基酸残基;(b)ch1所包含的氨基酸残基且eu编号第147位的氨基酸残基、和cl所包含的氨基酸残基且eu编号第131位的氨基酸残基;(c)ch1所包含的氨基酸残基且eu编号第175位的氨基酸残基、和cl所包含的氨基酸残基且eu编号第160位的氨基酸残基。本发明的又一方案还提供抗体,其中,以下的(d)所示氨基酸残基组的氨基酸残基是电荷相互不排斥的氨基酸残基:(d)ch1所包含的氨基酸残基且eu编号第213位的氨基酸残基、和cl所包含的氨基酸残基且eu编号第123位的氨基酸残基。如后述的实施例和图1所示,上述组合中记载的各氨基酸残基在缔合时相互接近。关于所期望的ch1或cl,本领域技术人员可以通过使用市售软件进行同源模建等,找到对应于上述(a)~(d)中记载的氨基酸残基的位点,可以使该位点的氨基酸残基适当地经受修饰。在上述抗体中,优选“电荷相互不排斥的氨基酸残基”例如是从选自以下的(x)~(z)的两组中分别选出的氨基酸残基,所述的两组选自(x)和(y)、(x)和(z)、(y)和(z)、或(z)和(z)的组合:(x)谷氨酸(e)或天冬氨酸(d);(y)赖氨酸(k)、精氨酸(r)或组氨酸(h);(z)丙氨酸(a)、天冬酰胺(n)、半胱氨酸(c)、谷氨酰胺(q)、甘氨酸(g)、异亮氨酸(i)、亮氨酸(l)、甲硫氨酸(m)、苯丙氨酸(f)、脯氨酸(p)、丝氨酸(s)、苏氨酸(t)、色氨酸(w)、酪氨酸(y)或缬氨酸(v)。例如,可以列举下述情形:从(x)~(z)中选择(x)和(y),从(x)选择谷氨酸,从(y)中选择赖氨酸(k),并将ch1所包含的氨基酸残基且eu编号第147位的氨基酸残基修饰成谷氨酸(e),将cl所包含的氨基酸残基且eu编号第180位的氨基酸残基修饰成赖氨酸(k)。这种情况下,例如当ch1所包含的氨基酸残基且eu编号第147位的氨基酸残基在修饰之前就是谷氨酸(e)时,则无需进行修饰。上述抗体中,作为电荷相互不排斥的氨基酸残基,具体而言,可以列举以下的氨基酸残基:·ch1所包含的氨基酸残基且eu编号第175位的氨基酸残基为赖氨酸(k),cl所包含的氨基酸残基且eu编号第180位、第131位和第160位的氨基酸残基均为谷氨酸(e);·ch1所包含的氨基酸残基且eu编号第147位和第175位的氨基酸残基为谷氨酸(e),cl所包含的氨基酸残基且eu编号第180位、第131位和第160位的氨基酸残基均为赖氨酸(k)。在上述抗体中,作为电荷不排斥的氨基酸残基,还可以列举:ch1所包含的氨基酸残基且eu编号第213位的氨基酸残基为谷氨酸(e),cl所包含的氨基酸残基且eu编号第123位的氨基酸残基为赖氨酸(k)。另外,本发明的优选方案还涉及:关于上述抗体的制备方法和本发明的缔合控制方法,后者是将上述(a)~(d)所示氨基酸残基组的氨基酸残基修饰成电荷相互不排斥的氨基酸残基。对于本发明的抗体,还可以应用以下的技术:向重链的第二恒定区(ch2)或重链的第三恒定区(ch3)的界面导入电荷排斥,以抑制非目标的重链之间的缔合的技术;向重链可变区和轻链可变区的界面导入电荷排斥,以抑制非目标的重链与轻链的缔合的技术;以及将存在于重链可变区和轻链可变区的界面的形成疏水核的氨基酸残基修饰成带有电荷的极性氨基酸,以抑制非目标的重链与轻链的缔合的技术(参照wo2006/106905)。在向ch2或ch3的界面导入电荷排斥以抑制不期望的重链之间的缔合的技术中,作为在重链的其他恒定区的界面进行接触的氨基酸残基,例如可以列举与ch3区中的377位(356位)和470位(439位)、378位(357位)和393位(370位)、427位(399位)和440位(409位)相对的区。关于抗体恒定区的编号,参考kabat等人的文献(kabatea等人.1991.sequencesofproteinsofimmunologicalinterest.nih),关于重链恒定区的编号,其eu编号如括弧内所示。可以将以下的技术与上述技术组合来应用于本发明的抗体,所述技术为将作为与igg和蛋白a的结合有关的位点的eu编号第435位的氨基酸残基修饰成arg等与蛋白a的结合力不同的氨基酸。通过使用该技术,改变h链与蛋白a的相互作用,并使用蛋白a柱,从而可以有效地只纯化异源二聚化抗体。尚需说明的是,该技术也可以不与上述技术组合,而是单独来使用。更具体而言,例如,在包含两种重链ch3区的抗体中,第1重链ch3区中的选自以下的(1)~(3)所示氨基酸残基组的1组~3组的氨基酸残基电荷相互排斥:(1)重链ch3区所包含的氨基酸残基且eu编号第356位和第439位的氨基酸残基;(2)重链ch3区所包含的氨基酸残基且eu编号第357位和第370位的氨基酸残基;(3)重链ch3区所包含的氨基酸残基且eu编号第399位和第409位的氨基酸残基。而且,还可以形成下述抗体:选自不同于上述第1重链ch3区的第2重链ch3区中的上述(1)~(3)所示氨基酸残基组的氨基酸残基组且在上述第1重链ch3区中电荷相互排斥的对应于上述(1)~(3)所示氨基酸残基组的1组~3组氨基酸残基、与上述第1重链ch3区中的对应的氨基酸残基电荷不排斥的抗体。上述(1)~(3)中记载的各氨基酸残基在缔合时相互接近。关于所期望的重链ch3区或重链恒定区,本领域技术人员可以通过使用市售软件进行同源模建等,找到对应于上述(1)~(3)中记载的氨基酸残基的位点,可以使该位点的氨基酸残基适当地经受修饰。在上述抗体中,“电荷排斥”或“带有同种电荷”是指,例如两个以上的氨基酸残基均具有上述(x)或(y)中的任一组所包含的氨基酸残基。另一方面,“电荷不排斥”是指,例如氨基酸残基是从选自上述(x)或(y)、或以下的(z)的两组中分别选出的氨基酸残基,所述的两组具有选自(x)和(y)、(x)和(z)、(y)和(z)、或(z)和(z)的组合的氨基酸残基。(z)丙氨酸(a)、天冬酰胺(n)、半胱氨酸(c)、谷氨酰胺(q)、甘氨酸(g)、异亮氨酸(i)、亮氨酸(l)、甲硫氨酸(m)、苯丙氨酸(f)、脯氨酸(p)、丝氨酸(s)、苏氨酸(t)、色氨酸(w)、酪氨酸(y)或缬氨酸(v)。在优选方案中,上述抗体的第1重链ch3区和第2重链ch3区可以通过二硫键进行交联。在本发明中,经受“修饰”的氨基酸残基并不限于上述的抗体可变区或抗体恒定区的氨基酸残基。关于多肽突变体或异源多聚体,本领域技术人员可以通过使用市售软件进行同源模建等,找到形成界面的氨基酸残基,可以使该位点的氨基酸残基经受修饰,以便控制缔合。同源模建是指使用市售软件来预测蛋白的立体结构的一种方法。当构建立体结构未知的蛋白的结构时,首先,探索与其同源性高且确定了立体结构的蛋白。接下来,以该立体结构为模板,构建结构未知的蛋白的结构,再通过分子动力学方法等将结构最优化,来预测未知的蛋白的立体结构。在向重链可变区和轻链可变区的界面导入电荷排斥以抑制非目标的重链与轻链的缔合的技术中,作为在重链可变区(vh)和轻链可变区(vl)的界面进行接触的氨基酸残基,例如可以列举:重链可变区上的kabat编号第39位(fr2区)的谷氨酰胺(q)和相对(接触)的轻链可变区上的kabat编号第38位(fr2区)的谷氨酰胺(q)。还可以优选例示:重链可变区上的kabat编号第45位(fr2)的亮氨酸(l)和相对的轻链可变区上的kabat编号第44位(fr2)的脯氨酸(p)。需要说明的是,这些位点的编号参考kabat等人的文献(kabatea等人.1991.sequenceofproteinsofimmunologicalinterest.nih)。已知这些氨基酸残基在人和小鼠中高度保留(j.mol.recognit.2003;16:113-120),所以关于实施例所示的抗体以外的vh与vl的缔合,也可以通过修饰对应于上述氨基酸残基的氨基酸残基,来控制抗体可变区的缔合。具体而言,可以列举:形成重链可变区和轻链可变区的界面的两个残基以上的氨基酸残基为电荷相互排斥的氨基酸残基的抗体。更具体而言,可以列举:是选自以下的(a)或(b)所示氨基酸残基组的一组或两组氨基酸残基的抗体:(a)重链可变区所包含的氨基酸残基且(1)kabat编号第39位的氨基酸残基、和轻链所包含的氨基酸残基且(2)kabat编号第38位的氨基酸残基;(b)重链可变区所包含的氨基酸残基且(3)kabat编号第45位的氨基酸残基、和轻链可变区所包含的氨基酸残基且(4)kabat编号第44位的氨基酸残基。上述(a)或(b)中记载的各氨基酸残基在缔合时相互接近。关于所期望的重链可变区或轻链可变区,本领域技术人员可以通过使用市售软件进行同源模建等,找到对应于上述(a)或(b)中记载的氨基酸残基的位点,可以使该位点的氨基酸残基适当地经受修饰。在上述抗体中,“电荷相互排斥的氨基酸残基”例如优选选自以下的(x)或(y)的任一组所包含的氨基酸残基:(x)谷氨酸(e)或天冬氨酸(d);(y)赖氨酸(k)、精氨酸(r)或组氨酸(h)。另外,作为本发明的抗体的又一方案,可以列举:形成重链可变区和轻链可变区的界面的两个残基以上的氨基酸残基是电荷相互不排斥的氨基酸残基的抗体。作为这样的抗体,具体而言,可以列举:是选自上述(a)或(b)所示氨基酸残基组的一组或两组氨基酸残基的抗体。上述(a)或(b)中记载的各氨基酸残基在缔合时相互接近。关于所期望的重链可变区或轻链可变区,本领域技术人员可以通过使用市售软件进行同源模建等,找到对应于上述(a)或(b)中记载的氨基酸残基的位点,可以使该位点的氨基酸残基适当地经受修饰。在上述抗体中,“电荷相互不排斥的氨基酸残基”例如是指从选自上述(x)~(z)的两组中分别选出的氨基酸残基,所述的两组选自(x)和(y)、(x)和(z)、(y)和(z)、或(z)和(z)的组合。通常,在人和小鼠中,上述(a)或(b)中记载的氨基酸残基分别为:(1)谷氨酰胺(q);(2)谷氨酰胺(q);(3)亮氨酸(l);(4)脯氨酸(p)。因此,在本发明的优选方案中,使这些氨基酸残基经受修饰(例如,取代成带电荷的氨基酸)。需要说明的是,上述(a)或(b)的氨基酸残基的种类未必限于上述的氨基酸残基,还可以是相当于该氨基酸的其他氨基酸。例如,当为人时,轻链可变区上的kabat编号第38位的氨基酸例如可以是组氨酸(h)。在将存在于重链可变区和轻链可变区的界面的形成疏水核的氨基酸残基修饰成带电荷的极性氨基酸,以抑制非目标的重链与轻链的缔合的技术中,作为在重链可变区(vh)和轻链可变区(vl)的界面能够形成疏水核的氨基酸残基,例如可以优选例示:重链可变区上的kabat编号第45位(fr2)的亮氨酸(l)和相对的轻链可变区上的kabat编号第44位(fr2)的脯氨酸(p)。需要说明的是,关于这些位点的编号,参考kabat等人的文献(kabatea等人.1991.sequenceofproteinsofimmunologicalinterest.nih)。通常,“疏水核(hydrophobiccore)”是指在缔合的多肽内侧,疏水性氨基酸的侧链聚集而形成的部分。疏水性氨基酸包括:丙氨酸、异亮氨酸、亮氨酸、甲硫氨酸、苯丙氨酸、脯氨酸、色氨酸、缬氨酸等。另外,除疏水性氨基酸以外的氨基酸残基(例如酪氨酸)有时也参与疏水核的形成。该疏水核和亲水性表面一起成为促进水溶性多肽缔合的驱动力,在上述亲水性表面亲水性氨基酸的侧链暴露在外侧。若两个不同结构域的疏水性氨基酸存在于分子表面并暴露在水分子中,则熵增加、自由能增加。因此,两个结构域相互缔合,以减少自由能和实现稳定化,而界面的疏水性氨基酸被埋入分子内部,形成疏水核。发生多肽的缔合时,通过将形成疏水核的疏水性氨基酸修饰成带电荷的极性氨基酸,来抑制疏水核的形成,其结果,认为多肽的缔合被抑制。本领域技术人员通过对所期望的多肽进行氨基酸序列分析,可以得知是否存在疏水核、以及形成位点(区)等。即,本发明的抗体例如是具有如下特征的抗体,所述特征为将在界面能够形成疏水核的氨基酸残基修饰成带电荷的氨基酸残基。更具体而言,可以列举:以下的(1)和(2)中的任一方是带电荷的氨基酸残基的抗体。以下的(1)和(2)中所示的氨基酸残基的侧链接近并能够形成疏水核。(1)重链可变区所包含的氨基酸残基且kabat编号第45位的氨基酸残基;(2)轻链可变区所包含的氨基酸残基且kabat编号第44位的氨基酸残基。作为上述抗体中的带电荷的氨基酸残基,可以优选列举谷氨酸(e)、天冬氨酸(d)、赖氨酸(k)、精氨酸(r)、组氨酸(h)。更优选为谷氨酸(e)、赖氨酸(k)。通常,在人和小鼠中,上述(1)和(2)中记载的氨基酸残基分别为:(1)亮氨酸(l)、(2)脯氨酸(p)。因此,在本发明的优选方案中,使这些氨基酸残基经受修饰(例如,取代成带电荷的氨基酸)。需要说明的是,上述(1)和(2)的氨基酸残基的种类未必限于上述的氨基酸残基,还可以是相当于该氨基酸的其他氨基酸。对于本发明的抗体,还可以应用其他的公知技术。例如,可以以促进第一vh(vh1)和第一vl(vl1)、和/或第二vh(vh2)和第二vl(vl2)的缔合的方式,将存在于一条h链的可变区的氨基酸侧链取代成更大的侧链(knob,突起)、将存在于另一条h链的相对可变区的氨基酸侧链取代成更小的侧链(hole,空隙),从而使突起能够配置在间隙中,以促进vh1和vl1、和/或vh2和vl2的缔合,结果,可以进一步抑制vh1和vl2和/或vh2和vl1的缔合(,wo1996/027011;ridgwayjb等人,proteinengineering(1996)9,617-621;merchantam等人.naturebiotechnology(1998)16,677-681)。例如,当为人igg1时,可以列举下述情形:为了使位于一条h链的ch3区的氨基酸侧链形成更大的侧链(knob;突起)而进行y349c、t366w的修饰,为了使位于另一条h链的ch3区的氨基酸侧链形成更小的侧链而进行d356c、t336s、l368a、y407v的修饰。对于本发明的抗体,还可以应用其他的公知技术。通过使用以抗体的一条h链的ch3的一部分作为对应于该部分的来源于iga的序列、并向另一条h链的ch3的互补部分导入对应于该部分的来源于iga的序列的链交换工程化结构域ch3(strand-exchangeengineereddomainch3),从而可以通过ch3的互补性缔合化来有效制作目标抗体(proteinengineeringdesign&selection,23;195-202,2010)。对于本发明的抗体,还可以应用其他的公知技术。在双特异性抗体的制作中,例如通过在两种h链的可变区中分别加入不同的氨基酸修饰,来赋予等电点之差,再利用该等电点之差,通过离子交换层析进行纯化,从而可以制作目标双特异性抗体(wo2007/114325)。对于如下所述的抗体,也可以应用本发明的修饰。例如,可以例举具有如下结构的抗体:以促进第一vh(vh1)和第一vl(vl1)、和/或第二vh(vh2)和第二vl(vl2)的缔合的方式,vh1经由第一ch1与一个fc区连接、vl1与第一cl连接,而vh2经由第二cl与另一个fc区连接、vl2与第二ch1连接的结构(wo09/80254)。对于本发明的抗体,可以将多个、例如两个以上的上述公知技术组合使用。需要说明的是,本发明的抗体可以根据进行了上述公知技术的修饰的抗体来制作。通过利用后述的本发明的缔合控制方法,例如可以有效制作具有活性的抗体或多肽。上述活性例如有:结合活性、中和活性、细胞毒活性、激动剂活性、拮抗剂活性、酶活性等。激动剂活性是指通过抗体与受体等抗原结合,向细胞内传递信号等,诱导某种生理活性的变化的活性。生理活性例如有:增殖活性、存活活性、分化活性、转录活性、膜转运活性、结合活性、蛋白酶解活性、磷酸化/脱磷酸化活性、氧化还原活性、转移活性、溶核活性、脱水活性、诱导细胞死亡的活性、诱导细胞凋亡的活性等,但并不限于这些。根据本发明的方法,可以有效制作识别所期望的抗原或与所期望的受体结合的抗体或多肽。对本发明的抗原没有特别限定,可以是任一种抗原。作为抗原的例子,例如可以列举受体或其片段、癌抗原、mhc抗原、分化抗原等,但并不特别限于这些。另外,作为本发明的受体的例子,例如可以列举属于造血因子受体家族、细胞因子受体家族、酪氨酸激酶型受体家族、丝氨酸/苏氨酸激酶型受体家族、tnf受体家族、g-蛋白偶联型受体家族、gpi锚定型受体家族、酪氨酸磷酸酶型受体家族、粘着因子家族、激素受体家族等受体家族的受体等。有关属于上述受体家族的受体及其特征,已有多篇文献报道,例如可以列举cookeba.,kingrjb.,vandermolenhj.ed.newcomprehensivebiochemistry第18b卷“hormonesandtheiractionspartii(激素及其作用第ii部分)”第1-46页(1988);elseviersciencepublishersbv.,newyork,usa,patthyl.(1990)cell,61:13-14.;ullricha.等人.(1990)cell,61:203-212.;massagulj.(1992)cell,69:1067-1070.;miyajimaa.等人.(1992)annu.rev.immunol.,10:295-331.;tagat和kishimotot.(1992)fasebj.,7:3387-3396.;fantlwi.等人.(1993)annu.rev.biochem.,62:453-481;smithca.等人.(1994)cell,76:959-962.;flowerdr.(1999)biochim.biophys.acta,1422:207-234.;宫阪昌之監修,细胞工学别冊ハンドブックシリ一ズ[接着因子ハンドブック」(细胞工程增刊小册子系列“粘着因子小册子”)(1994)(秀润社,东京,日本)等。作为属于上述受体家族的具体受体,例如可以例示:人或小鼠红细胞生成素(epo)受体、人或小鼠粒细胞集落刺激因子(g-csf)受体、人或小鼠血小板生成素(tpo)受体、人或小鼠胰岛素受体、人或小鼠flt-3配体受体、人或小鼠血小板源性生长因子(pdgf)受体、人或小鼠干扰素(ifn)-α、β受体、人或小鼠瘦蛋白受体、人或小鼠生长激素(gh)受体、人或小鼠白细胞介素(il)-10受体、人或小鼠胰岛素样生长因子(igf)-i受体、人或小鼠白血病抑制因子(lif)受体、人或小鼠睫状神经营养因子(cntf)受体等(hepor:simon,s.等人.(1990)blood76,31-35.;mepor:d′andrea,ad.等人.(1989)cell57,277-285.;hg-csfr:fukunaga,r.等人.(1990)proc.natl.acad.sci.usa.87,8702-8706.;mg-csfr:fukunaga,r.等人.(1990)cell61,341-350.;htpor:vigon,i.等人.(1992)89,5640-5644.;mtpor:skoda,rc.等人.(1993)12,2645-2653.;hinsr:ullrich,a.等人.(1985)nature313,756-761.;hflt-3:small,d.等人.(1994)proc.natl.acad.sci.usa.91,459-463.;hpdgfr:gronwald,rgk.等人.(1988)proc.natl.acad.sci.usa.85,3435-3439.;hifnα/βr:uze,g.等人.(1990)cell60,225-234.和novick,d.等人.(1994)cell77,391-400.)。癌抗原是随着细胞的恶化而表达的抗原,又被称作肿瘤特异性抗原。另外,细胞癌变时细胞表面或蛋白分子上出现的异常糖链也是癌抗原,还被称作癌糖链抗原。作为癌抗原的例子,例如可以优选列举:在以肺癌为代表的多种癌中表达的epcam(procnatlacadsciusa.(1989)86(1),27-31)(其多核苷酸序列记载在refseq注册号nm_002354.2(seqidno:78)中,其多肽序列记载在refseq注册号np_002345.2(seqidno:79)中。)、ca19-9、ca15-3、唾液酸ssea-1(slx)等。mhc抗原大致区分为:mhc类别i抗原和mhc类别ii抗原,mhc类别i抗原包括:hla-a,-b,-c,-e,-f,-g,-h;mhc类别ii抗原包括:hla-dr,-dq,-dp。分化抗原包括:cd1、cd2、cd3、cd4、cd5、cd6、cd7、cd8、cd10、cd11a、cd11b、cd11c、cd13、cd14、cd15s、cd16、cd18、cd19、cd20、cd21、cd23、cd25、cd28、cd29、cd30、cd32、cd33、cd34、cd35、cd38、cd40、cd41a、cd41b、cd42a、cd42b、cd43、cd44、cd45、cd45ro、cd48、cd49a、cd49b、cd49c、cd49d、cd49e、cd49f、cd51、cd54、cd55、cd56、cd57、cd58、cd61、cd62e、cd62l、cd62p、cd64、cd69、cd71、cd73、cd95、cd102、cd106、cd122、cd126、cdw130等。本发明的抗体可以是双特异性抗体,这种情况下,该抗体所识别的抗原(或表位)可以从上述受体或其片段、癌抗原、mhc抗原、分化抗原等中任意选择两个。例如,可以从受体或其片段中选择两个、从癌抗原中选择两个、从mhc抗原中选择两个、从分化抗原中选择两个。另外,例如还可以从任意选自受体或其片段、癌抗原、mhc抗原和分化抗原的两个中分别选择一个。本发明还提供控制了重链与轻链的缔合的抗体的制备方法。本发明的制备方法的优选方案为:控制了重链与轻链的缔合的抗体的制备方法,该方法包括如下步骤:步骤(1),修饰编码ch1和cl的核酸,使选自以下的(a)~(c)所示氨基酸残基组的一组或两组以上的氨基酸残基成为电荷相互排斥的氨基酸残基:(a)ch1所包含的氨基酸残基且eu编号第147位的氨基酸残基、和cl所包含的氨基酸残基且eu编号第180位的氨基酸残基;(b)ch1所包含的氨基酸残基且eu编号第147位的氨基酸残基、和cl所包含的氨基酸残基且eu编号第131位的氨基酸残基;(c)ch1所包含的氨基酸残基且eu编号第175位的氨基酸残基、和cl所包含的氨基酸残基且eu编号第160位的氨基酸残基;步骤(2),将上述修饰了的核酸导入宿主细胞中,培养宿主细胞,使该核酸表达;步骤(3),从上述宿主细胞的培养细胞物中回收抗体。作为本发明的制备方法的另一方案,可以列举抗体的制备方法,其中,在上述制备方法的步骤(1)中,进一步包含如下步骤:修饰核酸,使以下的(d)所示氨基酸残基组的氨基酸残基成为电荷相互排斥的氨基酸残基,(d)ch1所包含的氨基酸残基且eu编号第213位的氨基酸残基、和cl所包含的氨基酸残基且eu编号第123位的氨基酸残基。另外,本发明还涉及一种制备方法,其中,在上述步骤(1)中包含如下步骤:修饰核酸,使电荷相互排斥的氨基酸残基选自上述(x)或(y)的任一组所包含的氨基酸残基。而且,本发明还涉及一种制备方法,其中,在上述步骤(1)中包括如下步骤:修饰核酸,使形成重链可变区和轻链可变区的界面的两个残基以上的氨基酸残基为电荷相互排斥的氨基酸残基。这里,优选电荷相互排斥的氨基酸残基为选自例如以下的(a)或(b)所示氨基酸残基组的任一组氨基酸残基:(a)重链可变区所包含的氨基酸残基且kabat编号第39位的氨基酸残基、和轻链可变区所包含的氨基酸残基且kabat编号第38位的氨基酸残基;(b)重链可变区所包含的氨基酸残基且kabat编号第45位的氨基酸残基、和轻链可变区所包含的氨基酸残基且kabat编号第44位的氨基酸残基。上述的电荷相互排斥的氨基酸残基优选选自上述(x)或(y)的任一组所包含的氨基酸残基。作为本发明的制备方法的又一优选方案,可以列举控制了重链与轻链的缔合的抗体的制备方法,该方法包括如下步骤:步骤(1),修饰编码ch1和cl的核酸,使选自以下的(a)~(c)所示氨基酸残基组的一组或两组以上的氨基酸残基成为电荷相互不排斥的氨基酸残基:(a)ch1所包含的氨基酸残基且eu编号第147位的氨基酸残基、和cl所包含的氨基酸残基且eu编号第180位的氨基酸残基;(b)ch1所包含的氨基酸残基且eu编号第147位的氨基酸残基、和cl所包含的氨基酸残基且eu编号第131位的氨基酸残基;(c)ch1所包含的氨基酸残基且eu编号第175位的氨基酸残基、和cl所包含的氨基酸残基且eu编号第160位的氨基酸残基;步骤(2),将上述修饰了的核酸导入宿主细胞中,培养宿主细胞,使该核酸表达;步骤(3),从上述宿主细胞的培养物中回收抗体。作为本发明的制备方法的又一方案,可以列举抗体的制备方法,其中,在上述制备方法的步骤(1)中,进一步包含如下步骤:修饰核酸,使以下的(d)所示氨基酸残基组的氨基酸残基成为电荷相互不排斥的氨基酸残基,(d)ch1所包含的氨基酸残基且eu编号第213位的氨基酸残基、和cl所包含的氨基酸残基且eu编号第123位的氨基酸残基。另外,本发明还涉及一种制备方法,其中,在上述步骤(1)中包括如下步骤:修饰核酸,使电荷相互不排斥的氨基酸残基为从选自上述(x)~(z)的两组中分别选出的氨基酸残基,所述的两组选自(x)和(y)、(x)和(z)、(y)和(z)、或(z)和(z)的组合。另外,在本发明的上述步骤(1)中,作为电荷相互不排斥的氨基酸残基,具体可以列举以下的氨基酸残基:·ch1所包含的氨基酸残基且eu编号第175位的氨基酸残基为赖氨酸(k),cl所包含的氨基酸残基且eu编号第180位、第131位和第160位的氨基酸残基均为谷氨酸(e);·ch1所包含的氨基酸残基且eu编号第147位和第175位的氨基酸残基为谷氨酸(e),cl所包含的氨基酸残基且eu编号第180位、第131位和第160位的氨基酸残基均为赖氨酸(k)。而且,ch1所包含的氨基酸残基且eu编号第213位的氨基酸残基为谷氨酸(e),cl所包含的氨基酸残基且eu编号第123位的氨基酸残基为赖氨酸(k)。而且,本发明还涉及一种制备方法,其中,在上述步骤(1)中包含如下步骤:修饰核酸,使形成重链可变区和轻链可变区的界面的两个残基以上的氨基酸残基成为电荷相互不排斥的氨基酸残基。这里,优选电荷相互不排斥的氨基酸残基例如是选自以下的(a)或(b)所示氨基酸残基组的任一组氨基酸残基:(a)重链可变区所包含的氨基酸残基且kabat编号第39位的氨基酸残基、和轻链可变区所包含的氨基酸残基且kabat编号第38位的氨基酸残基;(b)重链可变区所包含的氨基酸残基且kabat编号第45位的氨基酸残基、和轻链可变区所包含的氨基酸残基且kabat编号第44位的氨基酸残基。优选上述的电荷相互不排斥的氨基酸残基为从选自上述的(x)~(z)的两组中分别选出的氨基酸残基,所述的两组选自(x)和(y)、(x)和(z)、(y)和(z)、或(z)和(z)的组合。另外,本发明还提供抗体的重链与轻链的缔合控制方法。本发明的缔合控制方法的优选方案为抗体的重链与轻链的缔合控制方法,该方法包括:修饰核酸,使选自以下的(a)~(c)所示氨基酸残基组的一组或两组以上的氨基酸残基成为电荷相互排斥的氨基酸残基:(a)ch1所包含的氨基酸残基且eu编号第147位的氨基酸残基、和cl所包含的氨基酸残基且eu编号第180位的氨基酸残基;(b)ch1所包含的氨基酸残基且eu编号第147位的氨基酸残基、和cl所包含的氨基酸残基且eu编号第131位的氨基酸残基;(c)ch1所包含的氨基酸残基且eu编号第175位的氨基酸残基、和cl所包含的氨基酸残基且eu编号第160位的氨基酸残基。本发明的另一方案还提供抗体的缔合控制方法,该方法包括:修饰核酸,使以下的(d)所示氨基酸残基组的氨基酸残基成为电荷相互排斥的氨基酸残基,(d)ch1所包含的氨基酸残基且eu编号第213位的氨基酸残基、和cl所包含的氨基酸残基且eu编号第123位的氨基酸残基。本发明的缔合控制方法的又一优选方案为抗体的重链与轻链的缔合控制方法,该方法包括:修饰核酸,使选自以下的(a)~(c)所示氨基酸残基组的一组或两组以上的氨基酸残基成为电荷相互不排斥的氨基酸残基:(a)ch1所包含的氨基酸残基且eu编号第147位的氨基酸残基、和cl所包含的氨基酸残基且eu编号第180位的氨基酸残基;(b)ch1所包含的氨基酸残基且eu编号第147位的氨基酸残基、和cl所包含的氨基酸残基且eu编号第131位的氨基酸残基;(c)ch1所包含的氨基酸残基且eu编号第175位的氨基酸残基、和cl所包含的氨基酸残基且eu编号第160位的氨基酸残基。本发明的又一方案还提供抗体的缔合控制方法,该方法包括:修饰核酸,使以下的(d)所示氨基酸残基组的氨基酸残基成为电荷相互不排斥的氨基酸残基,(d)ch1所包含的氨基酸残基且eu编号第213位的氨基酸残基、和cl所包含的氨基酸残基且eu编号第123位的氨基酸残基。如上所述,根据本发明的缔合控制方法,例如可以优先且有效地获得所期望的双特异性抗体。即,可以有效地由单体混合物形成作为所期望的异源多聚体的双特异性抗体。在本发明的上述方法中,“修饰核酸”是指修饰核酸以使之对应于通过本发明的“修饰”而导入的氨基酸残基。更具体而言,是指将编码原始(修饰前)氨基酸残基的核酸修饰成编码通过修饰而导入的氨基酸残基的核酸。通常是指对原始核酸进行插入、缺失或取代至少一个核苷酸等基因操作或突变处理,以形成编码目标氨基酸残基的密码子。即,编码原始氨基酸残基的密码子被编码通过修饰而导入的氨基酸残基的密码子取代。上述核酸的修饰,可由本领域技术人员利用公知技术例如位点特异性诱变法、pcr诱变法等适当实施。另外,本发明还提供核酸,所述核酸编码本发明的抗体。本发明还包含担载该核酸的载体。通常将本发明的核酸担载(插入)到适当的载体上,并导入到宿主细胞中。对该载体没有特别限定,只要稳定保持插入的核酸即可,例如使用大肠杆菌作为宿主时,克隆用载体优选pbluescript载体(stratagene公司制)等,但也可以使用各种市售载体。当为了生产本发明的多肽而使用载体时,表达载体特别实用。对表达载体没有特别限定,只要是在试管内、大肠杆菌内、培养细胞内、生物个体内表达多肽的载体即可,例如,在试管内表达多肽时,优选pbest载体(promega公司制);在大肠杆菌内表达多肽时,优选pet载体(invitrogen公司制);在培养细胞内表达多肽时,优选pme18s-fl3载体(genbankaccessionno.ab009864);在生物个体内表达多肽时,优选pme18s载体(molcellbiol.8:466-472(1988))等。向载体中插入本发明的dna,例如可以使用in-fusionadvantagepcr克隆试剂盒(clontech公司制)来进行。本发明还提供具有上述核酸的宿主细胞。对该宿主细胞没有特别限定,根据需要,例如使用大肠杆菌或各种动物细胞等各种宿主细胞。宿主细胞可以用作例如用于制备或表达本发明的抗体或多肽的产生系统。用于制备多肽的产生系统包括:体外(invitro)和体内(invivo)产生系统。作为体外产生系统,可以列举使用真核细胞的产生系统和使用原核细胞的产生系统。作为可用作宿主细胞的真核细胞,例如可以列举动物细胞、植物细胞、真菌细胞。作为动物细胞,例示哺乳动物细胞例如cho(j.exp.med.(1995)108:945)、cos、3t3、骨髓瘤细胞、bhk(幼仓鼠肾)、hela、c127、hek293、bowes骨髓瘤细胞、vero等;两栖动物细胞例如非洲爪蟾卵母细胞(xenopuslaevisoocytes)(valle等人,nature(1981)291:338-340);以及昆虫细胞例如果蝇s2、sf9、sf21、tn5。本发明的抗体表达中适合使用cho-dg44、cho-dx11b、cos7细胞、bhk细胞。动物细胞中,以大量表达为目的时,特别优选cho细胞。关于向宿主细胞内导入载体,例如可以通过以下方法来进行:磷酸钙法、deae-葡聚糖法、使用阳离子性的脂质体dotap(boehringermannheim制)的方法、电穿孔法(currentprotocolsinmolecularbiologyedit.ausubel等人.(1987)publish.johnwiley&sons.section9.1-9.9)、脂质转染法(gibco-brl公司制)、显微注射法等公知的方法。另外,使用freestyle293表达系统(invitrogen公司制),也可以进行从基因导入至多肽的表达。作为植物细胞,例如有来源于烟草的细胞,其作为蛋白质产生系统而众所周知,利用愈伤组织培养该细胞的方法可以产生本发明的抗体。作为真菌细胞,使用酵母例如酵母菌(saccharomyces)属的细胞(啤酒酵母(saccharomycescerevisiae)、粟酒裂殖酵母(saccharmycespombe)等);以及丝状菌,例如曲霉属(aspergillus)的细胞(黑曲霉(aspergillusniger)等)的蛋白表达系统是公知的,这些真菌细胞可以用作产生本发明抗体的宿主。使用原核细胞时,有使用细菌细胞的产生系统。作为细菌细胞,除了上述大肠杆菌(e.coli)以外,还已知有使用链球菌、葡萄球菌、大肠杆菌、链霉菌、枯草菌的产生系统,这些细菌细胞可以用于产生本发明的抗体。使用本发明的宿主细胞来产生抗体时,可以通过培养经表达载体转化的宿主细胞来表达多核苷酸,上述表达载体含有编码本发明抗体的多核苷酸。可以按照公知方法进行培养。例如,以动物细胞作为宿主时,可以使用例如dmem、mem、rpmi1640或imdm作为培养液。此时,可以结合使用fbs、胎牛血清(fcs)等血清补充液,也可以通过无血清培养来培养细胞。培养时的ph优选为约6~8。通常是在约30~40℃下培养约15~200小时,根据需要可以交换培养基或进行通气、搅拌。另一方面,作为在体内产生多肽的系统,例如可以列举:使用动物的产生系统或使用植物的产生系统。向这些动物或植物中导入目标多核苷酸,使在动物或植物体内产生多肽并回收。本发明的“宿主”包括上述的动物和植物。可以向目标多肽中插入适当的分泌信号,以使在宿主细胞中表达的多肽分泌到内质网的内腔、周质间隙或胞外环境中。相对于目标多肽而言,上述信号可以是内源性信号,也可以是异源信号。关于上述制备方法中的多肽的回收,若本发明的多肽分泌到培养基中,则回收培养基。若本发明的多肽在细胞内产生,则首先溶解该细胞,之后再回收多肽。使用动物时,有使用哺乳动物和昆虫的产生系统。作为哺乳动物,可以使用山羊、猪、绵羊、小鼠、牛等(vickiglaser,spectrumbiotechnologyapplications(1993))。另外,使用哺乳动物时,可以使用转基因动物。例如,制备编码本发明抗体的多核苷酸,将其作为和山羊β-酪素等乳汁中固有产生的编码多肽的基因的融合基因。然后,将包含该融合基因的多核苷酸片段注入到山羊胚胎中,将该胚胎移植到雌山羊体内。接受了胚胎的山羊生出转基因山羊,从该转基因山羊或其后代产生的乳汁中可以得到目标抗体。为了使转基因山羊产生的含有抗体的乳汁量增加,可以给予上述转基因山羊适当的激素(ebert等人,bio/technology(1994)12:699-702)。另外,作为产生本发明抗体的昆虫,例如可以使用蚕。使用蚕时,通过使蚕感染插入有编码目标抗体的多核苷酸的杆状病毒,可以从该蚕的体液中得到目标抗体(susumu等人,nature(1985)315:592-4)。而且,在将植物用于产生本发明的抗体时,例如可以使用烟草(tabacoo)。使用烟草时,将编码目标抗体的多核苷酸插入到植物表达用载体例如pmon530中,将该载体导入到根瘤土壤杆菌(agrobacteriumtumefaciens)等细菌中。用该细菌感染烟草例如烟草(nicotianatabacum),可以从该烟草的叶中得到所期望的抗体(ma等人,eur.j.immunol.(1994)24:131-8)。如此操作而得到的抗体,可以将其从宿主细胞内或细胞外(培养基、乳汁等)分离,并纯化成实质上纯粹且均匀的抗体。抗体的分离、纯化可以使用通常多肽的纯化中所使用的分离、纯化方法,但没有任何限制。例如,可以适当选择、组合硫酸铵或乙醇沉淀、酸提取、层析柱、过滤器、超滤、盐析、溶剂沉淀、溶剂提取、蒸馏、免疫沉淀、sds-聚丙烯酰胺凝胶电泳、等电点电泳法、透析、重结晶等来分离、纯化抗体。作为层析,例如可以列举:亲合层析、阴离子交换层析或阳离子交换层析等离子交换层析、磷酸纤维素层析、疏水性(相互作用)层析、凝胶过滤、反相层析、吸附层析、羟基磷灰石层析、凝集素层析等(strategiesforproteinpurificationandcharacterization(蛋白质纯化与鉴定实验指南):alaboratorycoursemanual.eddanielr.marshark等(1996)coldspringharborlaboratorypress)。上述层析可以使用液相层析例如hplc、fplc等液相层析来进行。用于亲合层析的柱有蛋白a柱、蛋白g柱。例如,使用蛋白a的柱有hyperd、poros、sepharosef.f.(pharmacia制)等。根据需要,可以在纯化抗体之前或之后,使适当的蛋白修饰酶和抗体作用,来任意地进行修饰或部分性地去除肽。作为蛋白修饰酶,例如使用胰蛋白酶、糜蛋白酶、赖氨酰内肽酶、蛋白激酶、糖苷酶等。本发明的抗体的制备方法也是本发明的优选方案之一,所述制备方法包括下述步骤:如上所述培养本发明的宿主细胞,从该细胞培养物中回收抗体。另外,本发明还涉及一种药物组合物(药物),该组合物包含本发明的抗体和药学上可接受的载体。在本发明中,药物组合物通常是指用于疾病的治疗或预防或者检查、诊断的药物。本发明的药物组合物,可以按照本领域技术人员所公知的方法制成制剂。另外,根据需要,还可以将本发明的抗体和其他药物成分组合制成制剂。例如,可以制成和水或水以外的药学上可接受的液体的无菌溶液或悬浮液,以注射剂形式进行非胃肠道给药。例如,可以考虑和药理学上可接受的载体或介质,具体而言,和灭菌水或生理盐水、植物油、乳化剂、悬浮剂、表面活性剂、稳定剂、香味剂、赋形剂、媒介物(vehicle)、防腐剂、结合剂等适当组合,以通常认可的制药实施所要求的单位用量形态进行混合以制成制剂。上述制剂中的有效成分量设定为得到所指示的范围的适当容量。用于注射的无菌组合物,可以使用注射用蒸馏水等媒介物,按照通常的制剂流程进行配制。作为注射用水溶液,例如可以列举生理盐水和等渗溶液,所述等渗溶液中包括葡萄糖或其他辅药(例如,d-山梨醇、d-甘露糖、d-甘露糖醇、氯化钠)。可以结合使用适当的助溶剂,例如醇(乙醇等)、多元醇(丙二醇、聚乙二醇等)、非离子表面活性剂(吐温80(tm)、hco-50等)。作为油性液体,可以列举芝麻油、大豆油,可以结合使用苯甲酸苄酯和/或苄醇作为助溶剂。还可以和缓冲剂(例如,磷酸盐缓冲液和乙酸钠缓冲液)、无痛剂(例如,盐酸普鲁卡因)、稳定剂(例如,苄醇和苯酚)、抗氧化剂混合。所制备的注射液通常填充到适当的安瓿中。本发明的药物组合物,优选通过非胃肠道进行给药。例如,可以制成注射剂型、经鼻给药剂型、经肺给药剂型、经皮给药型的组合物。例如,可以通过静脉注射、肌肉注射、腹腔内注射、皮下注射等进行全身或局部给药。给药方法可以根据患者的年龄、症状而适当选择。含有抗体或编码抗体的多核苷酸的药物组合物,其给药量例如可以设定为:每次每1kg体重0.0001mg~1000mg的范围。或者,给药量可以是例如每位患者0.001~100000mg,但本发明未必限于上述数值。给药量和给药方法根据患者的体重、年龄、症状等而变化,本领域技术人员可以考虑上述条件,设定适当的给药量和给药方法。需要说明的是,本发明中记载的氨基酸序列中所包含的氨基酸在翻译后有时还会接受修饰(例如,n末端的谷氨酰胺通过焦谷氨酰化而被修饰成焦谷氨酸的修饰是本领域技术人员所熟知的修饰),但即使是象这样地氨基酸在翻译后被修饰的情形,当然也包括在本发明所记载的氨基酸序列中。需要说明的是,本说明书中引用的所有的现有技术文献,均作为参照而纳入本说明书。实施例以下,通过实施例来具体地说明本发明,但本发明并不受限于这些实施例。[实施例1]探索控制ch1/cl的界面的位点认为通过向双特异性抗体的各ch1和cl结构域中导入突变,并利用ch1/cl的界面的电荷来控制ch1/cl的界面,从而只使针对抗原a的h链与l链缔合、以及只使针对抗原b的h链与l链进行特异性缔合。以后,记作ch1/cl界面控制。于是,由晶体结构模型探索可以进行ch1/cl界面控制的位点。氨基酸通过疏水性相互作用、电荷相互作用、氢键等来维持侧链间的相互作用。已知上述相互作用产生于约的范围内所存在的侧链之间。因此,由pdb模型1hzh,在ch1和cl的界面找到了存在于ch1的氨基酸和位于cl的氨基酸的距离为约的氨基酸。已找到的氨基酸的位点分别汇总在图1、表1(修饰位点的汇总)中。表1中记载的氨基酸编号根据eu编号(sequencesofproteinsofimmunologicalinterest,nihpublicationno.91-3242)来记载。另外,以后的氨基酸编号也根据eu编号来记载。在本实施例中,h链使用igg1、l链使用igk(kappa)。[表1]chcl1k147t1802q175q1603k213e1234k133n1385k147s1316h168t1647f170l135为了利用氨基酸的电荷来进行ch1/cl界面控制,将在表1的h链的ch1或l链的cl栏中看到的氨基酸取代成正电荷的lys或his、负电荷的glu或asp。具体而言,制作将人g1d(seqidno:1)的ch1的氨基酸分别取代成了带正电荷的lys的th2、th11、以及取代成了带负电荷的glu或asp的th1、th3、th4、th9、th10、th12的恒定区。同样,制作将人cl(seqidno:13)的氨基酸分别取代成了带正电荷的lys的tl2、tl4、tl5、tl6、tl8、tl12、以及取代成了his的tl11、取代成了带负电荷的glu或asp的tl1、tl3、tl7、tl9、tl10、tl13的恒定区。所制作的恒定区的名称(名称)、突变位点(突变)、seqidno汇总在表2(修饰位点的汇总)中。[表2][实施例2]实施ch1/cl界面控制的位点的筛选方法和各抗体的制作和分析利用下述方法确认已找到的氨基酸的ch1/cl界面控制效果。使用抗-gpc3抗体来进行筛选。首先,构建h链、l链的表达载体。按照参考实施例1分别构建:持有作为h链可变区的gph7(seqidno:34)和实施例1中制作的h链恒定区的h链的表达载体、持有作为l链可变区的gpl16(seqidno::35)和实施例1中制作的l链恒定区的l链的表达载体。接下来,如下选择所制作的h链、l链的表达载体的组合。在实施例1制作的恒定区中选择一条h链,该h链中已找到的位点的氨基酸带有正电荷或负电荷。这种情况下,未必要导入突变。例如,虽然th1的第147位被取代成了glu,但g1d的第147位氨基酸为lys,原本就带有正电荷,所以没有导入突变。接下来,从表2中选择与表1中选择的h链ch1的突变位点对应的位点具有突变的l链。例如,预计ch1的第147位的氨基酸和cl的第180位的氨基酸在ch1/cl的界面进行接触,所以选择th1作为h链时,选择tl1、tl2作为l链。接着,将所选择的两条l链与所选择的一条h链混合,按照参考实施例1使抗体表达。最后,按照参考实施例3或4分析所表达的抗体,根据各抗体的表达比率,筛选对ch1/cl界面控制有效的修饰。将一种h链和两种l链混合进行表达时,由于igg由两条h链和两条l链的复合体构成,所以预计有三个组合进行表达。例如,使作为h链的th1和作为l链的tl1和tl2的组合表达时,有以下3个组合表达(图2):h链_1:h链_2:l链_1:l链_2=th1:th1:tl1:tl1(将其记作th1/tl1);h链_1:h链_2:l链_1:l链_2=th1:th1:tl1:tl2(将其记作th1/tl1_tl2);h链_1:h链_2:l链_1:l链_2=th1:th1:tl2:tl2(将其记作th1/tl2)。当h链与l链的缔合没有选择性时,两个l链处于等量,所以预计以th1/tl1、th1/tl1_tl2、th1/tl2=1∶2∶1的比例进行表达。但是,当在ch1/cl的界面h链优先只与任意一条l链结合时,认为只有该组合优先表达。例如,使作为h链的th1、作为l链的tl1和tl2表达时,在ch1的第147位氨基酸和cl的第180位氨基酸在ch1/cl的界面进行接触的情况下,预计ch1的第147位氨基酸为glu(负电荷)的th1和l链cl的第180位氨基酸为lys(正电荷)的tl2的组合优先表达。但是,在ch1的第147位氨基酸和cl的第180位氨基酸在ch1/cl的界面不进行接触的情况下,由于在h链与l链的缔合中没有产生选择性,所以预计以th1/tl1、th1/tl1_tl2、th1/tl2=1∶2∶1的比例进行表达。这样,将一种h链和两种l链混合进行表达,以其表达均衡为指标,筛选具有ch1/cl界面控制效果的修饰(在ch1/cl的界面进行接触的修饰)。将h链和l链的组合汇总在表3(表达中使用的h链、l链的组合。还记载h链、l链突变位点)中。[表3]按照该表3的组合,实施抗体的表达,确认所选择的ch1/cl界面控制的效果。此时,一种h链和一种l链的抗体也同时表达,将其作为分析时的对照。抗体的表达按照参考实施例1的方法进行。按照参考实施例3的方法,对已制作的抗体进行aiex分析。aiex分析的数据汇总在图3中。在aiex分析中,由于使用阴离子交换柱,所以带负电荷的抗体迅速被洗脱。分析的数据汇总记载在表4中。洗脱时间早的峰的顺序分别为峰1、2、3。以各峰面积的总计作为100%,算出各峰的比例。如图2所示,当导入了突变的位点发生电荷相互作用时,涂成灰色的峰的位置的抗体的比例增多。即,认为涂成灰色的抗体的比例多于25%的突变位点发生了电荷相互作用。[表4]如此地对各修饰位点进行了研究,结果认为:在h链中第147、175、213位对ch1/cl界面控制有效,在l链中第123、131、160、180位对ch1/cl界面控制有效。另外还发现:只在wo2006/106905、wo2007/147901所报道的h链的第147位和l链的第123位的修饰中,还不足以使h链和l链进行特异性缔合,通过组合本实施例中所找到的修饰,可以开始缔合。[实施例3]组合有修饰位点的抗体的制作和分析考虑将实施例2中找到的、认为ch1/cl界面控制效果大的位于ch1的k147、q175、k213的位点和位于cl的e123、s131、q160、t180的位点组合,以更有效地进行ch1/cl界面控制。所制作的抗体的修饰的组合和所表达的抗体汇总在表5(修饰位点的汇总)中。[表5]导入了突变的h链或l链的表达载体的制作和抗体的表达按照参考实施例1的方法进行,所制作的抗体的分析按照参考实施例3或4的方法进行。结果汇总在表6中。[表6]比较表4和表6时可知:与导入一个修饰时相比,通过将修饰组合,目标的h链和l链的组合的比例增加。由此认为:通过组合修饰,可以高效率地制作仅目标的h链和l链缔合的抗体。[实施例4]双特异性抗体的表达和分析在实施例3中,考虑就ch1/cl界面控制效果大的h链的th2、th13、th15、l链的tl16、tl17、tl19、tl20制作双特异性抗体(bispecificab)。在本实施例中,使用抗-il6r抗体和抗-gpc3抗体来制作双特异性抗体。将识别抗-il6r的h链(seqidno:59)和l链(seqidno:60)、识别抗-gpc3的h链(seqidno:61)和l链(seqidno:62)的恒定区取代成h链恒定区的th2、th13、th15、以及l链cl的tl16、tl17、tl19、tl20。为了进一步进行h链之间的缔合,制作导入了knobintohole(kih)(wo96/27011)的修饰的h链。已制作的这些抗体的突变位点、已表达的抗体汇总在表7(各双特异性抗体的h链、l链的组合)中。[表7]上述表7中,在向h链中导入了knob(突起)的修饰的恒定区中,在修饰体名称后附上“k”,在导入了hole(空隙)的修饰的恒定区中,在修饰体名称后附上“h”。例如,th1k表明除了导入th1的突变外还导入knob的修饰,th1h表明除了导入th1的突变外还导入hole的修饰。导入了突变的h链或l链的表达载体的制作和抗体的表达按照参考实施例1的方法进行,所制作的抗体的分析按照参考实施例4所示的ciex分析方法进行。双特异性抗体中使用的抗-il6r抗体和抗-gpc3抗体的h链和l链的组合汇总在表8中。[表8]这里,以4ch_001、4ch_002、4ch_003、4ch_004、4ch_011、4ch_012为例,对各组合进行说明。ch1/cl界面控制的修饰汇总在表8中。4ch_001用未导入ch1/cl界面控制的修饰和kih的修饰的h链、l链来表达。4ch_002用导入有kih的修饰的h链、l链来表达。4ch_003用导入了ch1/cl界面控制修饰的h链、l链来表达。4ch_004用导入了kih的修饰和ch1/cl界面控制修饰的h链、l链来表达。另外,4ch_011用导入了kih的修饰和ch1/cl界面控制修饰的抗-il6r抗体的h链和抗-gpc3抗体的h链、导入了ch1/cl界面控制的修饰的抗-il6r抗体的l链来表达。4ch_012用导入了kih的修饰和ch1/cl界面控制修饰的抗-il6r抗体的h链和抗-gpc3抗体的h链、导入了ch1/cl界面控制的修饰的抗-gpc3抗体的l链来表达。按照参考实施例1来表达各抗体,按照参考实施例4实施ciex分析,其结果汇总在图9-1和9-2中。使用抗-il6r抗体的h链可变区时记作mh0,使用抗-gpc3抗体的h链可变区时记作gph7,使用抗-il6r抗体的l链可变区时记作ml0,使用抗-gpc3抗体的l链可变区时记作gpl16。在未导入ch1/cl界面控制的修饰和kih的修饰的4ch_001中,在层析上检测到多个认为是h链和l链的各种组合的异源成分。相对于此,在导入了kih的修饰的4ch_002中,由于h链之间的缔合被抑制,所以认为是杂质的层析上的峰数减少。另外,在使用导入了ch1/cl界面控制的修饰的h链的th2、th13、l链的tl16、tl17的4ch_003中,由于h链与l链的缔合被抑制,所以认为是杂质的层析上的峰数减少。而且,关于组合有kih和ch1/cl界面控制的修饰的4ch_004,可知大部分是主要的峰。4ch_004的层析上的峰和4ch_011的层析上的峰基本一致,认为这是由于各抗体的等电点(pi)相近,所以在层析上无法分离。利用与4ch_003、4ch_004、4ch_011、4ch_012相同的方法,对不同于4ch_004的进行了ch1/cl界面控制的4ch_005、4ch_006、4ch_015、4ch_016、和在抗-gpc3抗体和抗-il6r抗体间交换了导入到4ch_004中的ch1/cl界面控制的修饰的4ch_007、4ch_008、4ch_013、4ch_014、以及在抗-gpc3抗体和抗-il6r抗体间交换了导入到4ch_006中的ch1/cl界面控制的修饰的4ch_009、4ch_010、4ch_017、4ch_018也进行了研究。其结果,与4ch_001相比,层析上的异源成分大幅减少。由以上结果可知:通过组合ch1/cl界面控制修饰和kih的修饰,高效率地制作了双特异性抗体。[实施例5]使用了不同抗体的ch1/cl界面控制修饰的效果由实施例4可知:使用了ch1/cl的界面控制对于制作双特异性抗体有用。因此,使用作为抗-cd3抗体的m12和(h链、seqidno:54、l链、seqidno:57)、作为抗-gpc3的gc33(2)(h链、seqidno:55、l链、seqidno:58)来确认ch1/cl界面控制效果。与实施例4一样,使用ch1/cl界面控制效果大的h链的th2、th13、th15、l链的tl16、tl17、tl19来制作双特异性抗体。将作为识别cd3的抗体的m12的h链(seqidno:54)和l链(seqidno:57)、作为识别gpc3的抗体gc33(2)的h链(seqidno:55)和l链(seqidno:58)的恒定区取代成h链的ch1为th2、th13、th15、以及取代成l链的cl为tl16、tl17、tl19。为了进一步进行h链之间的缔合,制作了导入有knobintohole(kih)(专利文献1)的修饰的h链。所制作的这些抗体的突变位点、已表达的抗体汇总在表9(修饰位点的汇总)中。[表9]导入了突变的h链或l链的表达载体的制作和抗体的表达按照参考实施例1来进行,所制作的抗体的分析按照参考实施例4所示的ciex分析方法来进行。可知:即使使用抗-cd3和抗-gpc3抗体,ch1/cl界面控制对制作双特异性抗体也有用。[实施例6]ch1/cl界面控制和可变区的界面控制的组合制备双特异性抗体时,作为只使目标的h链和l链特异性缔合的技术,已知有向可变区的vh和vl中导入电荷排斥的技术(专利文献wo2006/106905)。因此,为了更高效地只表达目标成分,认为除了ch1/cl界面控制外,还使h链和l链的可变区之间产生排斥。将其称作vh/vl界面控制。制作了将抗-il6r的h链的kabat编号第39位的gln取代成lys的mh01(seqidno::46)和取代成glu的mh02(seqidno::47)、将l链的kabat编号第38位的gln取代成glu的ml01(seqidno:50)和取代成lys的ml02(seqidno:51)。还分别制作了将抗-gpc3的h链的kabat编号第39位的gln取代成lys的gph71(seqidno:48)和取代成glu的gph72(seqidno:49)、将l链的kabat编号第38位的gln取代成glu的gpl161(seqidno:52)和取代成lys的gpl162(seqidno:53)。抗体的表达载体的制作按照参考实施例1的方法进行。使用制作的抗体来表达双特异性抗体。所制作的抗体的修饰的组合和已表达的抗体汇总在表10中。[表10]抗体的表达按照参考实施例1的方法进行,所制作的抗体的分析按照参考实施例4的方法进行。在导入了ch1/cl界面控制的突变的4ch_006、4ch_008的层析上观察到的认为是异源成分的峰,其在导入了vh/vl界面控制的突变的4ch_1、2_006、4ch_2、1_008中消失,由此可知:除进行ch1/cl界面控制外,还进行vh/vl界面控制,从而可以更有效地只制作目标成分(图10和图11)。另外,在认为只能纯化认为是目标成分的成分的、只向ch1/cl中导入了突变的4ch_004、4ch_010中,即使进一步导入vh/vl界面控制的突变,也没有检测到新的认为是异源成分的峰(图10和图11)。由以上可知:通过在ch1/cl界面控制中加入vh/vl界面控制,可以更容易地纯化目标成分,另一方面,在已经认为只能纯化目标成分的情况下,不会对其纯化带来不良影响。[实施例7]组合有修饰位点的抗体的tm测定认为ch1/cl界面控制的修饰有可能对fab的稳定性产生影响。于是,对于th2/tl17、th13/tl16、th15/tl19的组合,按照参考实施例2的方法测定fab的稳定性、tm。使用抗-il6r抗体,制作了h链/l链包含th2/tl17、th13/tl16、th15/tl19的抗体。抗体的修饰的组合和已表达的抗体汇总在表11中。[表11]抗体的表达按照参考实施例1进行测定,所制作的各抗体的tm(℃)按照参考实施例2来测定。其结果,未导入突变的g1d/ko和向ch1/cl中导入了突变的th2/tl17、th13/tl16、th15/tl19的fab的tm分别为95.0℃、93.1℃、95.1℃、94.8℃。由此可知:ch1/cl界面控制的突变不会对fab的稳定性产生影响。[实施例8]导入ch1/cl界面控制的突变对结合活性的影响还无法断言ch1/cl界面控制的修饰不可能对与抗原的结合产生影响。于是,为了测定与il-6r、gpc3的结合活性,对于th2/tl17、th13/tl16、th15/tl19的组合,按照参考实施例5的方法测定结合活性(表12)。导入了ch1/cl界面控制的突变的th2/tl17、th13/tl16、th15/tl19与il-6r和gpc3的结合活性和天然型的g1d/ko与il-6r和gpc3的结合活性没有变化,由此可知:ch1/cl界面控制的修饰对结合活性没有影响。而且,使用实施例4中制作的4ch_004、4ch_006、4ch_008、4ch_010,按照参考实施例5测定与il-6r和gpc3这两种抗原的结合活性时,与表12所示的天然型g1d/ko的结合活性相同(表13、14)。由实施例1~8的研究可知:通过向ch1/cl中导入突变,不会降低fab的稳定性,也不会降低结合活性,可以高效率地只纯化目标成分。[表12][表13][表14][实施例9]将h链的ch1与人的iga1(seqidno:63)、iga2(seqidno:64)、igd(seqidno:65)、ige(seqidno:66)、igg1(seqidno:67)、igg2(seqidno:68)、igg3(seqidno:69)、igg4(seqidno:70)、igm(seqidno:71)的氨基酸序列进行比对,将l链的cl与人的igk(kappa)(seqidno:72)、igl1(seqidno:73)、igl2(seqidno:74)、igl3(seqidno:75)、igl6(seqidno:76)、igl7(seqidno:77)(lambda)的氨基酸序列进行比对,分别进行比较。结果见图12。在本实施例中找到的修饰用箭头表示。如本实施例所示,认为通过向h链和l链中导入用箭头表记的带不同电荷的氨基酸使h链的ch1和l链的cl发生排斥,可以使目标的h链和l链进行特异性缔合。[参考实施例1]抗体的表达载体的制作和抗体的表达和纯化使用quikchange位点特异性诱变试剂盒(stratagene)、pcr或infusionadvantagepcr克隆试剂盒(takara)等,利用本领域技术人员所公知的方法进行氨基酸取代的导入,构建表达载体。得到的表达载体的核苷酸序列通过本领域技术人员所公知的方法来确定。将已制作的质粒一过性地导入来自人胚肾癌细胞的hek293h株(invitrogen)、或freestyle293细胞(invitrogen公司)中,进行抗体的表达。使用rproteinasepharosetmfastflow(gehealthcare),利用本领域技术人员所公知的方法从得到的培养上清中纯化抗体。关于纯化抗体浓度,使用分光光度计测定在280nm下的吸光度,由所得的值通过pace法算出吸光系数,再使用该吸光系数算出抗体浓度(proteinscience1995;4:2411-2423)。[参考实施例2]利用差示扫描型量热法评价修饰抗体的热变性中点(tm)在本研究中,通过使用作为示差扫描型量热法的microcalcapillarydsc(dksh)测定抗体的热变性中点(tm),来评价热稳定性。将每500μl的各抗体溶液放在测定用板上,使温度从20℃升至115℃。升温速度为120℃/小时,观测热容量的变化。使用origin7(lightstone)对数据进行分析,算出确认到热容量变化的温度,将该值作为tm值。[参考实施例3]利用阴离子交换层析(aiex)法进行分析通过使用alliance系统(waters)的aiex法,对制作抗体进行分析。分析柱使用tsk-geldeae-npr(tosoh),流动相a使用10mmol/l的tris-hcl(ph7.5)、流动相b使用10mmno/l的tris-hcl/500mmol/l的nacl(ph7.5),实施双液梯度法。测定在280nm的波长下进行。使用empower2(waters)进行数据分析,算出所检测到的各峰的比率。[参考实施例4]利用阳离子交换层析(ciex)法进行分析通过使用alliance系统(waters)的ciex法,对制作抗体进行分析。分析柱使用wcx-10(dionex),流动相a使用25mmol/l的mes(ph6.1)、流动相b使用25mmo/l的mes/500mmol/l的nacl(ph6.1),实施双液梯度法。测定在280nm的波长下进行。使用empower2(waters)进行数据分析,算出所检测到的各峰的比率。[参考实施例5]目标抗体与il6r和gpc3的亲和性测定使用biacoret100(gehealthcare),分析目标抗体与hil6r和gpc3的相互作用。运行缓冲液使用hbs-ep+(gehealthcare),测定温度为25℃。s系列传感器芯片cm5(gehealthcare)使用通过胺偶联法固定有蛋白a/g(thermoscientific)的芯片。将目标抗体捕获到芯片上,使其与用运行缓冲液稀释的各抗原发生相互作用。通过与10mm的甘氨酸-hcl(ph1.5)发生反应,清洗捕获到芯片上的抗体,使芯片再生,进行反复利用。关于各抗体相对于抗原的解离常数(kd),通过对biacore的测定结果进行动力学分析而算出。具体而言,将通过biacore评估软件测定得到的传感图在1∶1langmuir结合模型中进行全局拟合,算出结合速度常数ka(l/mol/s)、解离速度常数kd(1/s),由该值算出解离常数kd(mol/l)。产业实用性通过本发明提供的方法,只需取代少数的氨基酸,即可控制缔合而不改变原始多肽(抗体)的结构、功能、活性等,实用性非常高。另外,对抗原性的影响亦少。通过应用本发明,可以有效获得实际上保持活性的双特异性抗体。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1