可用于甘油葡萄糖苷生产的蓝细菌菌株及其应用的制作方法
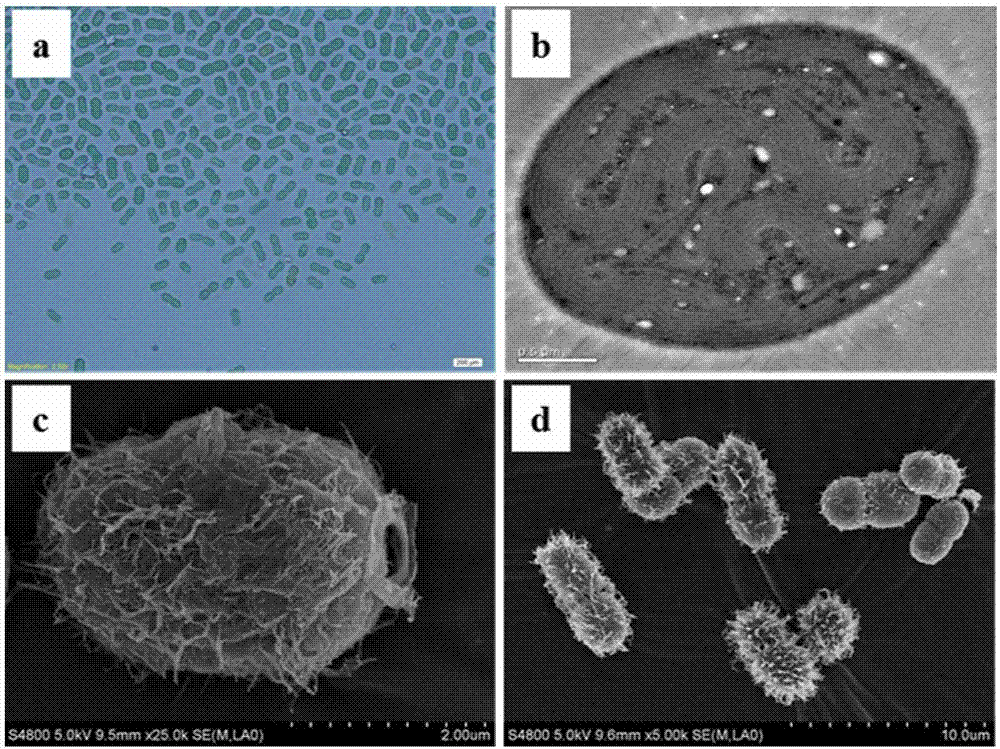
本发明涉及微生物合成高附加值化学品领域。具体而言是提供了一种生产甘油葡萄糖苷的蓝细菌菌株及其应用。
背景技术:
蓝藻(蓝细菌)是一种能进行植物型放氧光合作用的原核微生物,是海洋生态系统的重要初级生产者(hernandez-prieto,semeniuketal.2014)。与高等植物相比,蓝细菌具有生长速度快、光合效率高、容易进行遗传改造等优势(zhouandli2010)。另外,水生的蓝细菌可以用放置在不适宜耕种土地甚至漂浮在海洋中的培养器中进行培养。基于这些优势,蓝细菌已经在生产生物燃料、生物基化学品及糖类物质方面展现了其巨大的潜力,具有广泛的应用前景(gupta,rathaetal.2013,angermayr,roviraetal.2015,haysandducat2015,sarkarandshimizu2015)。从2009年起通过基因工程改造蓝细菌生产生物燃料和一些重要的化学品已经成为研究热点(angermayr,hellingwerfetal.2009)。通过基因工程改造,蓝细菌已经能够合成氢气、乙烯、异戊二烯、乙醇、丁醇、丙酮、异丁醛、异丁醇、2,3-丁二醇、2-甲基-1-丁醇、1,2-丙二醇、脂肪酸、脂肪醇、脂肪烃、蔗糖、乳酸和3-羟基丁酸等多种重要的生物燃料和化学品(quintana,vanderkooyetal.2011)。虽然相关研究已经取得了一定进展,展现了蓝细菌生物合成的巨大潜力,然而当前仍然没有能够商业化应用的项目。主要原因一方面是蓝细菌生产的各种产物产量较低,生产成本较高,没有经济可行性;另一方面蓝细菌规模化培养技术仍有待突破(amyt.ma2014)。这限制了基因工程蓝细菌合成生物燃料和化学品相关产业的发展。在这种情况下,尝试建立蓝细菌生产高附加值化学品的技术路线,有利于打通从实验室菌株到规模化应用之间的技术障碍,推动光合蓝细菌生物制造的产业化应用。甘油葡萄糖苷(gg)是一类由甘油和葡萄糖通过糖苷键结合形成的物质。它具有保湿功能,能消除洁面后皮肤的紧绷感,可作为化妆品添加剂使用;同时它也是一种大分子稳定剂,能抑制细菌真菌生长,可用于蛋白药物等的长期保存;此外,在一些日本传统发酵食品(如清酒、味增)中也发现含有活性成分的gg,具有降血糖、减肥、治疗过敏性呼吸系统疾病等功能,可以用作保健品。在盐胁迫条件下,许多蓝细菌会在胞内合成相应的相容性物质,以抵抗外界的逆环境,维持胞内外渗透压平衡。根据耐盐能力和合成相容性物质的种类,这些蓝细菌可以分为三类:一类是耐盐能力较低的蓝细菌,它们合成的相容性物质主要是蔗糖和海藻糖;另一类是耐盐能力中等的蓝细菌,这类蓝细菌合成的相容性物质主要是甘油葡萄糖苷;最后一类是耐盐能力很高的蓝细菌,这类蓝细菌合成的相容性物质主要是甜菜碱及其衍生物(friederikeengelbrecht1999)。因此,研究蓝细菌的gg合成并将其应用于工业化生产具有重要的经济价值。通过基因工程手段,敲除集胞藻pcc6803gg转运蛋白基因ggtcd,能够使得细胞在盐胁迫下积累gg产物的~50%分泌到胞外,且增加gg产量;而在此基础上敲除gg合成抑制基因ggpr,能够进一步提高gg产量(tan,duetal.2015)。阻断糖原合成途径,也能够显著提高聚球藻pcc7002盐胁迫下gg的积累(xu,tiagoguerraetal.2012)。通过替换培养基的方式,半连续培养产gg藻株,也被证明是一种有效提高gg产量的方法(tan,duetal.2015)。此外,受到盐胁迫的蓝细菌细胞,在受到低渗胁迫的时候,会迅速将胞内的相容性物质如gg,分泌到胞外(reed,warretal.1986,tan,duetal.2015),这一特性有利于gg产物的分离。虽然半连续培养方式和低渗胁迫都能够有助于蓝细菌gg的生产,但是需要它们通过离心方式多次收集藻细胞;离心操作又将会带来工业生产中成本的增加。进一步研究发现,在培养之前被琼脂胶封装的产gg蓝细菌,也能够在胶内增殖、合成并分泌gg产物;在半连续培养过程中也不需要离心收集细胞,是一种理想的产gg蓝细菌培养方式(tan,duetal.2015)。综上,目前关于模式蓝细菌生产甘油葡萄糖苷研究证明了技术路线的可行性,但是其产业化应用仍然受到生产成本、菌株野外环境耐受性和规模培养技术等因素的限制。因此,在这种情况下,进一步筛选和挖掘蓝细菌种质资源,寻找更合适工业化生产甘油葡萄糖苷的蓝细菌菌株,对于推动蓝细菌生物合成产业化应用具有重要的意义。技术实现要素:本发明的目的是提供一种适合生产甘油葡萄糖苷的蓝细菌菌株及其应用。为实现上述目的,本发明采用技术方案为:一种可用于甘油葡萄糖苷生产的蓝细菌菌株,菌株为蓝细菌(cyanobacteriumaponinum)1b1,已于2017-3-2保藏于中国微生物菌种保藏管理委员会普通微生物中心(chinageneralmicrobiologicalculturecollectioncenter,cgmcc),保藏编号为cgmccno.13785。一种可用于甘油葡萄糖苷生产的蓝细菌菌株的应用,所述蓝细菌(cyanobacteriumaponinum)1b1在生产甘油葡萄糖苷、糖原中的应用。所述蓝细菌(cyanobacteriumaponinum)1b1在盐胁迫条件下生产糖原或在胞内合成并积累生产甘油葡萄糖苷中的应用。一种甘油葡萄糖苷的制备方法,将所述的蓝细菌(cyanobacteriumaponinum)1b1经盐胁迫处理,使其在胞内合成并积累制备甘油葡萄糖苷。所述经盐胁迫处理为将菌株在bg11培养基培养至对数后期,然后加入nacl至终浓度为0.3-0.9m的中,并继续培养3天。一种糖原的制备方法,将所述的蓝细菌(cyanobacteriumaponinum)1b1经光照培养,进而在细胞内合成积累糖原。所述经光照培养为将菌株接种至bg11培养基中,于100μe/m2/s光照、通入5%co2条件下培养。相关术语蓝藻(也称为蓝细菌)是一类光合自养的原核微生物,其能够利用太阳能,固定二氧化碳。耐盐能力是生物对胞外高盐环境的耐受能力,本发明中指对氯化钠的耐受能力;生长速率是用于衡量微生物在特定条件下的生长快慢的指标;产量是衡量微生物一定条件下在特定时间内某种代谢产物的生产能力。本发明所具有的优点:本发明所筛选的藻株分离自山西运城盐湖自然生态环境,与模式蓝细菌集胞藻pcc6803相比具有更强的gg合成能力和环境适应能力;该藻株在盐胁迫时合成的相容性物质只有甘油葡萄糖苷这一种,有利于产物的分离。因此很适合作为甘油葡萄糖苷的生产菌株,并将其应用于工业化生产。附图说明图1是本发明实施例提供的藻株1b1分别在光学显微镜(a)、透射电镜(b)和扫描电镜(c和d)下的实物照片。图2是本发明实施例提供的藻株16srrna序列系统发育分析图。由图可知藻株1b1的16srdna序列与am238427最相近,而该藻株是cyanobacteriumaponinum,所以藻株1b1很有可能也是cyanobateriumaponinum。图3是本发明实施例提供的集胞藻pcc6803(a)与鉴定藻株1b1(b)耐盐能力比较情况图。图4是本发明实施例的藻株1b1和对照藻株集胞藻pcc6803在柱式光反应器(tan,yaoetal.2011)中培养的生长曲线图(a)、盐胁迫条件下的糖原产量图(b)、甘油葡萄糖苷产量图(c)和甘油葡萄糖苷产率图(d)。其中图4a中,箭头所示为加600mmnacl胁迫的时间;图4c和d横轴为盐胁迫后的时间。图5是本发明实施例提供的集胞藻pcc6803和1b1藻株在盐胁迫三天时,胞外(a和b)和胞内(c和d)的相容性物质峰谱图。具体实施方式下面结合说明书附图对本发明作进一步的解释说明。实施例1:藻株的形态学鉴定1.光学显微镜观察方法1)打开光学显微镜(bx51,olympus,日本)电源,调整聚光镜至视野亮度合适。2)将生长至od730=1.0(培养约4d)的藻液取1滴,滴在干净的载玻片上后,盖上盖玻片。3)先在40倍物镜下找到藻株细胞,然后在盖玻片上滴1滴香柏油,在100倍物镜下观察藻株细胞形态,拍摄细胞显微照片(参见图1)。2.扫描电镜制样方法1)取样:取15ml1b1藻液(od730=1.0-1.5)4000rpm离心1min,去除上清液,加入1mlph=7.3的pbs磷酸盐缓冲液(8gl-1nacl,0.24gl-1kh2po4,0.2gl-1kcl,1.44gl-1na2hpo4)重悬细胞,清洗三遍,每次清洗后,4000rpm离心1min,去上清;2)固定:用2.5%(v/v)的戊二醛1ml重悬细胞,固定1.5h;4000rpm离心1min后去除戊二醛,之后用相同的pbs磷酸盐缓冲液1ml重悬细胞,清洗三遍,每遍静置10min,4000rpm离心1min后去上清;用1%(v/v)的锇酸1ml重悬细胞,固定1h,4000rpm离心1min后去除锇酸,pbs磷酸盐缓冲液1ml重悬细胞,清洗三遍,每遍静置10min,4000rpm离心1min后去上清;3)依次用乙醇的水溶液1ml按30%、50%、70%、90%的浓度梯度对样品进行脱水,每步15min,之后用1ml100%乙醇溶液脱水15min,共2次;之后将样品置于乙醇和叔丁醇1:1混合液1ml中15min;最后置样品于1ml叔丁醇中15min,共2次;期间都不用重悬细胞,静置后用移液枪取出脱水溶液即可;4)将样品置于1ml叔丁醇中重悬细胞,放入冷冻干燥机中进行冷冻干燥;样品充分干燥后,通过导电胶带粘于样品台上,喷金粉后置于冷场发射扫描电子显微镜(s-4800,日立高新技术株式会社,日本)下观察。3.透射电镜制样方法1)取材与固定(1)取15ml1b1藻液(od730=1.0-1.5),4000rpm离心1min,去除上清液,使用pbs磷酸盐缓冲液(ph=7.5)1ml重悬细胞,清洗三遍,清洗后4000rpm离心1min,去上清,然后迅速投入1ml前固定液2.5%(v/v)戊二醛中,重悬细胞,使所取材料完全浸没于固定液中,4℃过夜;(2)用1ml上述pbs磷酸盐缓冲液重悬细胞,清洗3次,每次静置30min,然后4000rpm离心1min,去除上清;(3)将清洗后的材料放入1ml后固定液1%(v/v)锇酸中,重悬细胞,静置2h;(4)用1mlpbs磷酸盐缓冲液重悬细胞,清洗3次,每次30min,然后4000rpm离心1min,去除上清;2)脱水(1)将冲洗后的材料依次用1ml的30%,50%,70%,80%,90%,95%(v/v)的丙酮水溶液脱水,每次静置15min;(2)1ml无水丙酮脱水3次,每次静置10min;整个脱水步骤不用重悬细胞,静置后用移液枪取出脱水液即可;3)浸透和包埋(1)将无水丙酮与spurr树脂(spi-chem,上海意果科技有限公司)按7:3体积比混合,加入1ml混合液于样品中(不需重悬细胞),室温放置5h;(2)将无水丙酮与spurr树脂按3:7体积比混匀,加入1ml混合液于样品中(不需重悬细胞),室温放置过夜;(3)纯spurr树脂500μl加入样品中(不重悬细胞),室温放置5h;(4)将组织块用纯spurr树脂包埋在多孔橡胶包埋模板中,把包埋板放入烘箱烘烤,聚合硬化,65℃,24h,形成包埋块,切片后置于透射电子显微镜(h-7650,日立高新技术株式会社,日本)下观察。从光学显微照片(图1a)可见,有的1b1细胞呈蓝绿色,有的则呈苍白颜色;细胞大小约是1-2μm,呈不规则球形或圆柱形。从一些正在分裂的细胞可知,该藻株与大多数原核微生物一样实行二分裂。透射电镜照片(图1b)显示,细胞内类囊体膜呈不规则排列,而且还有一些类似多聚磷酸的白色不溶物;细胞表面密布纤毛状结构。扫描电镜照片(图1c和d)显示该藻株细胞外有黏液状胶鞘,这可能是细胞在生长过程中会发生聚集的原因。1b1藻株的形态与文献报道的cyanobacteriumaponinum藻株(moro,rascioetal.2007)非常相似。实施例2:基于16s核糖体dna序列的藻株种属鉴定1.1b1藻株16s核糖体rdna序列的扩增和测序取1ml1b1藻细胞培养物(od730=1.0),离心收集细胞;用20μl无菌水重悬,并于液氮和65℃反复冻融6次。8000rpm离心1分钟。取1.5μl上清液用作pcr反应的模板,以sgf/sgr为引物对,pcr扩增16srdna片段(pcr反应成分和程序分别如表1和2所示)。得到的pcr片段直接送测序公司测定,得到如序列表1所示的dna序列。表1pcr反应体系表2pcr反应程序表3所用引物2.1b1藻株的系统发育分析利用blastn程序(altschul1990)在genebank(https://blast.ncbi.nlm.nih.gov/blast.cgi)中比对测定得到的16srrna序列,结果发现该序列与cyanobacteriumaponinumpcc10605藻株的16srrna序列一致性高达100%。从genebank中下载表4中所列其他代表性蓝细菌的16srrna序列(moro,rascioetal.2007),与1b1藻株的16srrna序列一起通过clustalx程序(larkin,blackshieldsetal.2007)进行多序列比对,得到的比对文件用mega6软件中的邻接算法(neighborjoiningalgorithm)进行进化树的绘制(saitouandnei1987,kumar2004),进化树如附图2所示。系统发育分析结果进一步证实1b1藻株就是cyanobacteriumaponinum,因此将该藻株命名为cyanobacteriumaponinum1b1。表4用于系统发育分析的蓝藻藻株及其16srrna检索号序列表seqidno:11b116sdna序列:acgggctcttcggagctagtggcggacgggtgaggaacgcgtgagaacctgcctcaaggtcggggacaacagttggaaacgactgctaataccggatgagccgaataggtaaaagatttatcgcctagagaggggctcgcgtctgattagctagatggtgaggtaaaggcttaccatggcgacgatcagtagctggtctgagaggatgagcagccacactgggactgagacacggcccagactcctacgggaggcagcagtggggaattttccgcaatgggcgaaagcctgacggagcaataccgcgtgagggaggaaggctcttgggttgtaaacctcaaaacttagggaagaaaaaaatgacggtacctaatgtaagcatcggctaactccgtgccagcagccgcggtaatacggaggatgcaagcgttatccggaatcattgggcgtaaagagtccgtaggtggcacttcaagtctgctttcaaagaccgaagctcaacttcggaaagggagtggaaactgaagagctagagtatagtaggggtagagggaattcctagtgtagcggtgaaatgcgtagagattaggaagaacaccagtggcgaaggcgctctactgggcatatactgacactgagggacgaaagctaggggagcgaaagggattagatacccctgtagtcctagcggtaaacgatggatactaggcgtagtgctgttagaaggactgtgccgaagctaacgcgttaagtatcccgcctggggagtacgcacgcaagtgtgaaactcaaaggaattgacggggacccgcacaagcggtggagtatgtggtttaattcgatgcaacgcgaagaaccttaccaaggcttgacatcctgcgaatcttggagaaatctgagagtgcctaagggaacgcagagacaggtggtgcatggctgtcgtcagctcgtgtcgtgagatgttgggttaagtcccgcaacgagcgcaaccctcgtccttagttgccagcattaagttggggactctagggagaccgccggggagaactcggaggaaggtggggatgacgtcaagtcagcatgccccttacgtcttgggctacacacgtactacaatggttgggacaaaggggagcgaaaccgcgaggtggagcgaatctcatcaaacccagccacagttcagattgcaggctgaaactcgcctgcatgaaggaggaatcgctagtaatcgcaggtcagcatactgcggtgaatccgttcccgggtcttgtacacaccgcccgtcacaccatggaagttggtcacgcccgaagtcgttattctaacccaagtggaaggagacgccgaaggtgggactagtgactggggtgaag(a)序列特征:●长度:1373碱基对●类型:核糖核酸(dna)●链型:单链●拓扑结构:线性(b)分子类型:dna(c)假设:否(d)反义:否(e)最初来源:1b1实施例3:1b1藻株的耐盐能力、生长速度、相容性物质合成能力的评价1.藻株耐盐能力的评价将1b1藻株和集胞藻pcc6803藻株分别接入含有0mm、300mm、600mm和900mm氯化钠的bg11培养基中,30℃,30μe/m2/s光强,150rpm的摇床上培养一周,观察藻株的生长情况。其中bg11培养基成分为1.5gl-1nano3,40mgl-1k2hpo4·3h2o,36mgl-1cacl2·2h2o,6mgl-1柠檬酸,6mgl-1柠檬酸铁铵,1mgl-1edta二钠盐,20mgl-1naco3,2.9mgl-1h3bo3,1.8mgl-1mncl2·4h2o,0.22mgl-1znso4·7h2o,0.39mgl-1namoo4·2h2o,0.079mgl-1cuso4·5h2o和0.01mgl-1cocl2·6h2o。2.藻株生长速率的评价将1b1藻株和集胞藻pcc6803藻株分别接入30mlbg11培养基中,30℃,30μe/m2/s光强,150rpm摇床种子培养一周;按1:100(体积比)的接种比例转接入400ml新鲜bg11培养基中,30℃通空气培养至od730达到1.0左右;将藻液分成3份,每份120ml转移到柱式光反应器(tan,yaoetal.2011)中,在通5%co2、30℃、30μe/m2/s光强的培养条件下培养至接近平台期,期间测定藻株0d、2d和3d的od730,根据代时计算公式g=(t2-t1)/[(lgodt2-lgodt1)/lg2]计算出藻株的最大生长速率。3.藻株糖原的处理及测定1)糖原处理:取上述耐盐能力评价中盐胁迫0d和4d时的藻液2ml,用超纯水洗涤3次,重悬于400μl30%(w/v)的氢氧化钾溶液中,95℃温育2h,然后加入冷的无水乙醇1.2ml,-20℃过夜;4℃条件下,13000rpm离心15min,去除上清,糖原沉淀分别用70%(v/v)乙醇和无水乙醇各洗涤两次;60℃用真空浓缩机(concentratorplus,eppendorf,德国)干燥20min,沉淀用500μl100mm醋酸钠溶液(ph=4.5)溶解;加入经过10倍逐级稀释至1000倍的糖化酶(amylaseag300l,诺维信,丹麦)20μl,60℃糖化2h。2)糖原测定:糖原测定使用葡萄糖分析仪(sba-40c,国产),根据已有经验,将处理后的糖化液稀释0—10倍不等,用10mg/ml的葡萄糖标样定标,每次测定用样25μl。4.藻株甘油葡萄糖苷的产量测定1)藻株的盐胁迫培养。将1b1藻株和集胞藻pcc6803藻株分别接种在含有bg11培养基的柱式光反应器中,在通5%co2、30℃、30μe/m2/s光强的培养条件下培养至接近平台期;加入氯化钠至培养基中其终浓度为600mm下胁迫培养,加盐后0d、1d、2d、3d各取样1ml用于甘油葡萄糖苷含量的测定。2)甘油葡萄糖苷样品的制备。将1ml藻液样品,8000rpm离心5min,将沉淀与上清分开。上清用超纯水稀释一定倍数后,用过滤器过滤至离子色谱测样瓶中。向细胞沉淀加入1ml80%乙醇混匀,65℃水浴4h。8000rpm离心5min,弃沉淀,上清在55℃用n2吹干,加入合适的ddh2o稀释后,用过滤器过滤到离子色谱测样瓶中。3)甘油葡萄糖苷样品的测定。甘油葡萄糖苷的测定用离子色谱(ics-5000,thermo,美国);分析柱:dionexcarbopactm-pa10(4*250mm,productno.046110);流动相为200mmnaoh溶液,流速1ml/min。从图3可以看出,cyanobacteriumaponinum1b1藻株(a)的最高耐盐能力为900mm,但是在600mm浓度下它的生长已受到抑制,而且细胞出现聚集的现象;而集胞藻pcc6803(b)在600和900mm的nacl浓度下依然可以生长,只是在900mm浓度下出现生长缓慢、颜色发黄的现象。因此,1b1藻株的最高耐盐能力低于集胞藻pcc6803。根据生长代时计算公式,在非盐胁迫条件下,1b1藻株的生长代时是1.122,而集胞藻pcc6803的生长代时是2.997,可以看出藻株1b1的生长速率低于集胞藻pcc6803(图4a)。然而,盐胁迫第四天时,1b1藻株的糖原产量是153.555mg/l,而集胞藻pcc6803的糖原产量是116.444mg/l(图4b),可见藻株1b1的糖原产量高于集胞藻pcc6803。与文献报道(desplats,folcoetal.2005)一致,集胞藻pcc6803会在盐胁迫早期在胞内积累蔗糖,而2天后胞内gg含量达到最高值,并一直保持在这一水平;而且其胞外的甘油含量逐渐增多(图5a)。1b1藻株中未见到有蔗糖合成,甘油含量也几乎没有。在盐胁迫后第3天1b1藻株gg含量达到164.979mg/l,是集胞藻pcc6803的1.5倍(图4c)。而且由于1b1藻株生物量少,因此单位细胞gg产率达到39.164mg/l/od,是集胞藻pcc6803的2.9倍(图4d)。因此,与集胞藻pcc6803相比,1b1藻株具有更高的gg合成能力。生物材料样品保藏信息菌株保藏号保藏时间蓝细菌cyanobacteriumaponinum1b1137852017-3-2上述菌株均保藏于中国微生物菌种保藏管理委员会普通微生物中心(chinageneralmicrobiologicalculturecollectioncenter,cgmcc);地址:北京市朝阳区北辰西路1号院3号。参考文献altschul,s.f.,gish,w,miller,w,myers,e.w,lipman,d.j.(1990)."basiclocalalignmentsearchtool."j.mol.biol.:403-410.amyt.ma,c.m.s.,jamesw.golden(2014)."regulationofgeneexpressionindiversecyanobacterialspeciesbyusingtheophylline-responsiveriboswitches."appliedandenvironmentalmicrobiology80:6704-6713.angermayr,s.a.,k.j.hellingwerf,p.lindbladandm.j.demattos(2009)."energybiotechnologywithcyanobacteria."curropinbiotechnol20(3):257-263.angermayr,s.a.,a.g.roviraandk.j.hellingwerf(2015)."metabolicengineeringofcyanobacteriaforthesynthesisofcommodityproducts."trendsinbiotechnology33(6):352-361.desplats,p.,e.folcoandg.l.salerno(2005)."sucrosemayplayanadditionalroletothatofanosmolyteinsynechocystissp.pcc6803salt-shockedcells."plantphysiolbiochem43(2):133-138.friederikeengelbrecht,k.m.,martinhagemann(1999)."expressionoftheggpsgene,involvedinosmolytesynthesisinthemarinecyanobacteriumsynechococcussp.strainpcc7002,revealedregulatorydifferencesbetweenthisstrainandthefreshwaterstrainsynechocystissp.strainpcc6803."appliedandenvironmentalmicrobiology65:4822-4829.gupta,v.,s.k.ratha,a.sood,v.chaudharyandr.prasanna(2013)."newinsightsintothebiodiversityandapplicationsofcyanobacteria(blue-greenalgae)—prospectsandchallenges."algalresearch2(2):79-97.hays,s.g.andd.c.ducat(2015)."engineeringcyanobacteriaasphotosyntheticfeedstockfactories."photosynthesisresearch123(3):285-295.hernandez-prieto,m.a.,t.a.semeniukandm.e.futschik(2014)."towardasystems-levelunderstandingofgeneregulatory,proteininteraction,andmetabolicnetworksincyanobacteria."frontgenet5:191.kumar,s.(2004)."mega3:integratedsoftwareformolecularevolutionarygeneticsanalysisandsequencealignment."briefingsinbioinformatics5(2):150-163.larkin,m.a.,g.blackshields,n.p.brown,r.chenna,p.a.mcgettigan,h.mcwilliam,f.valentin,i.m.wallace,a.wilm,r.lopez,j.d.thompson,t.j.gibsonandd.g.higgins(2007)."clustalwandclustalxversion2.0."bioinformatics23(21):2947-2948.moro,i.,n.rascio,n.larocca,m.dibellaandc.andreoli(2007)."<i>cyanobacteriumaponinum</i>,anewcyanoprokaryotefromthemicrobialmatofeuganeanthermalsprings(padua,italy)."algologicalstudies123(1):1-15.quintana,n.,f.vanderkooy,m.d.vanderhee,g.p.vosholandr.verpoorte(2011)."renewableenergyfromcyanobacteria:energyproductionoptimizationbymetabolicpathwayengineering."applmicrobiolbiotechnol91(3):471-490.reed,r.h.,s.r.c.warr,n.w.kerbyandw.d.p.stewart(1986)."osmoticshock-inducedreleaseoflow-molecular-weightmetabolitesfromfree-livingandimmobilizedcyanobacteria."enzymeandmicrobialtechnology8(2):101-104.saitou,n.andm.nei(1987)."theneighbor-joiningmethod:anewmethodforreconstructingphylogenetictrees."molecularbiologyandevolution4(4):406-425.sarkar,d.andk.shimizu(2015)."anoverviewonbiofuelandbiochemicalproductionbyphotosyntheticmicroorganismswithunderstandingofthemetabolismandbymetabolicengineeringtogetherwithefficientcultivationanddownstreamprocessing."bioresourcesandbioprocessing2(1):17.tan,x.,w.duandx.lu(2015)."photosyntheticandextracellularproductionofglucosylglycerolbygeneticallyengineeredandgel-encapsulatedcyanobacteria."applmicrobiolbiotechnol99(5):2147-2154.tan,x.,l.yao,q.gao,w.wang,f.qiandx.lu(2011)."photosynthesisdrivenconversionofcarbondioxidetofattyalcoholsandhydrocarbonsincyanobacteria."metabeng13(2):169-176.xu,y.,l.tiagoguerra,z.li,m.ludwig,g.charlesdismukesandd.a.bryant(2012)."alteredcarbohydratemetabolisminglycogensynthasemutantsofsynechococcussp.strainpcc7002:cellfactoriesforsolublesugars."metabolicengineering16c:56-67.zhou,j.andy.li(2010)."engineeringcyanobacteriaforfuelsandchemicalsproduction."proteincell1(3):207-210.sequencelisting<110>中国科学院青岛生物能源与过程研究所<120>可用于甘油葡萄糖苷生产的蓝细菌菌株及其应用<130><160>1<170>patentinversion3.1<210>1<211>1373<212>dna<213>蓝细菌cyanobacteriumaponinum1b1<220><221>gene<222>(1)..(1373)<223><400>1acgggctcttcggagctagtggcggacgggtgaggaacgcgtgagaacctgcctcaaggt60cggggacaacagttggaaacgactgctaataccggatgagccgaataggtaaaagattta120tcgcctagagaggggctcgcgtctgattagctagatggtgaggtaaaggcttaccatggc180gacgatcagtagctggtctgagaggatgagcagccacactgggactgagacacggcccag240actcctacgggaggcagcagtggggaattttccgcaatgggcgaaagcctgacggagcaa300taccgcgtgagggaggaaggctcttgggttgtaaacctcaaaacttagggaagaaaaaaa360tgacggtacctaatgtaagcatcggctaactccgtgccagcagccgcggtaatacggagg420atgcaagcgttatccggaatcattgggcgtaaagagtccgtaggtggcacttcaagtctg480ctttcaaagaccgaagctcaacttcggaaagggagtggaaactgaagagctagagtatag540taggggtagagggaattcctagtgtagcggtgaaatgcgtagagattaggaagaacacca600gtggcgaaggcgctctactgggcatatactgacactgagggacgaaagctaggggagcga660aagggattagatacccctgtagtcctagcggtaaacgatggatactaggcgtagtgctgt720tagaaggactgtgccgaagctaacgcgttaagtatcccgcctggggagtacgcacgcaag780tgtgaaactcaaaggaattgacggggacccgcacaagcggtggagtatgtggtttaattc840gatgcaacgcgaagaaccttaccaaggcttgacatcctgcgaatcttggagaaatctgag900agtgcctaagggaacgcagagacaggtggtgcatggctgtcgtcagctcgtgtcgtgaga960tgttgggttaagtcccgcaacgagcgcaaccctcgtccttagttgccagcattaagttgg1020ggactctagggagaccgccggggagaactcggaggaaggtggggatgacgtcaagtcagc1080atgccccttacgtcttgggctacacacgtactacaatggttgggacaaaggggagcgaaa1140ccgcgaggtggagcgaatctcatcaaacccagccacagttcagattgcaggctgaaactc1200gcctgcatgaaggaggaatcgctagtaatcgcaggtcagcatactgcggtgaatccgttc1260ccgggtcttgtacacaccgcccgtcacaccatggaagttggtcacgcccgaagtcgttat1320tctaacccaagtggaaggagacgccgaaggtgggactagtgactggggtgaag1373当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1