一种用于检测猪源性成分的试剂盒和方法与流程
本发明属于分子生物学领域,具体涉及一种用于检测猪源性成分的试剂盒和方法。
背景技术:
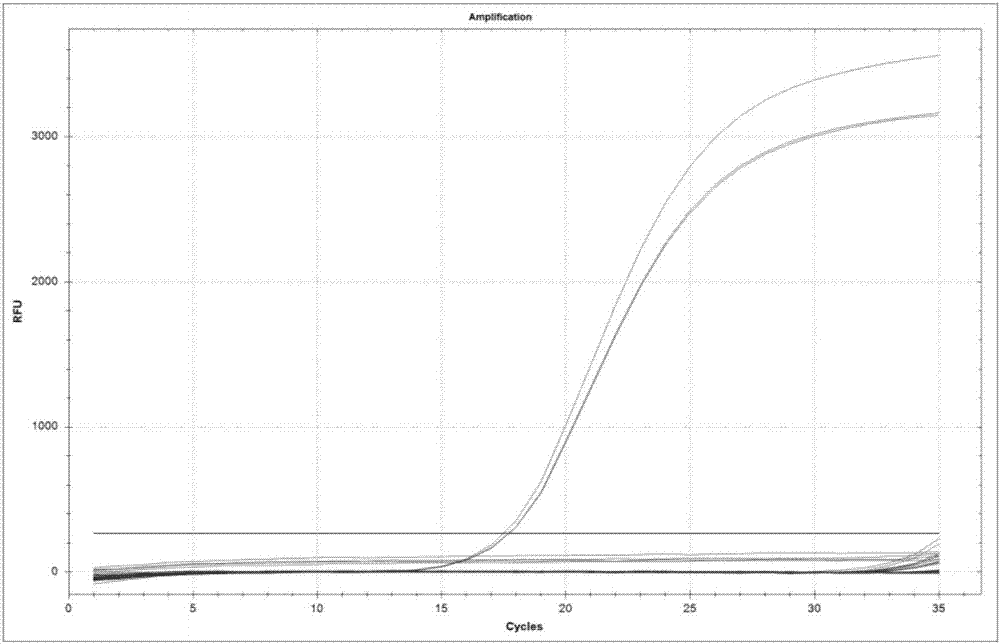
:近年来,伴随着肉类市场的急剧扩大,肉类掺假的事件频频发生,掺假的方式越来越多,形式越来越复杂,已成为全球食品行业的一个突出问题。肉制品掺假不仅会引起个体的健康风险,包括疾病感染、代谢紊乱、过敏反应等,而且肉制品的掺假更易引起经济、宗教、道德的问题。例如清真食品中混有配料表中未标明的猪源性成分,会严重侵犯我国少数民族和阿拉伯等伊斯兰教国家的宗教信仰和民族习惯,并且侵犯了消费者的知情权。目前,肉类掺假常见的检测技术有elisa法、显微判定法、电子鼻法、质谱法等,但都存在灵敏度低、周期长、不能检测熟肉等缺点而未被广泛使用。pcr技术具有灵敏度高、操作简便、抗干扰能力强等优势,越来越多被用于动物源性成分检测。现有标准《sn/t3730-2013食品及饲料中常见畜类品种的鉴定方法》的第8部分为利用实时荧光pcr法检测食品及饲料中的猪源性成分,但我们在检测过程中发现,该方法在检测时会出现假阳性,例如根据鹅类成分的ct值可能会被判定为猪源性成分,无法保证判定结果的准确性。王颖(王颖等,荧光定量pcr方法检测畜肉食品中猪源性成分[j],食品安全质量检测学报,2013,5:100-104)报道的检测猪源性成分的pcr方法,其结果中扩增曲线不佳,大多无典型s型曲线,引物结合效率差,同样无法保证结果的准确性。姜洁(姜洁等,应用实时荧光pcr技术量化检测羊肉中猪源性和鸡源性成份[j],食品安全质量检测学报,2015,9:3701-3707)、李楠(李楠等,北京地区牛_羊肉片中鸭_鸡_猪源性成分调查[j],中国中国食品卫生杂志,2014,3:227-232)报道的定量pcr引物及方法也存在pcr扩增曲线不理想、扩增效率不稳定等缺点。技术实现要素:本发明的目的在于提供一种用于检测猪源性成分的试剂盒和方法。本发明提供了seqidno.1、seqidno.2所示的引物对、seqidno.3所示的探针。本发明还提供了seqidno.1、seqidno.2所示的引物对和seqidno.3所示的探针在制备检测猪源性成分的试剂中的用途。其中,所述试剂是检测肉及肉制品中猪源性成分的试剂。本发明还提供了一种用于检测猪源性成分的试剂盒,它包括seqidno.1、seqidno.2所示的引物对和seqidno.3所示的探针。其中,它还包括实时荧光pcr预混液。其中,它还包括taqdna聚合酶、mgcl2、dntp和反应缓冲液。其中,所述试剂盒的组成为:pcr反应总体积为20μl时,其中,模板dna的浓度为1ng/μl~100ng/μl;引物的浓度为10μmol/l;探针的浓度为10μmol/l。本发明还提供了上述试剂盒在用于检测肉及肉制品中猪源性成分中的用途。本发明还提供了一种检测猪源性成分的方法,它包括如下步骤:(1)提取样本dna:取待检样品,提取其中的dna;(2)基因扩增:用上述试剂盒对待检样品中的dna进行扩增;(3)结果检测:对dna扩增结果进行检测;其中,所述待检组织为肉及肉制品。综上,本发明试剂盒及方法可以准确检测猪源性成分,特别适用于肉及肉制品中的猪源性成分检测,检测快速、准确,成本低,特异性好,灵敏度高,有广泛的应用前景。显然,根据本发明的上述内容,按照本领域的普通技术知识和惯用手段,在不脱离本发明上述基本技术思想前提下,还可以做出其它多种形式的修改、替换或变更。以下通过实施例形式的具体实施方式,对本发明的上述内容再作进一步的详细说明。但不应将此理解为本发明上述主题的范围仅限于以下的实例。凡基于本发明上述内容所实现的技术均属于本发明的范围。附图说明图1猪源性成分的特异性验证图。图2猪源性成分的适用性验证图。图3猪源性成分dna浓度与ct值关系图。图4猪源性成分灵敏度验证图。图5猪源性检出限验证图。具体实施方式下面以实施例作进一步说明,但本发明不局限于这些实施例。本发明所用的实验试剂与仪器,均可通过商业途径购买得到。具体试剂如下:(1)ctab裂解液:2%(w/v)ctab,1.4mol/lnacl,20mmol/ledta,100mmol/ltris,用10%盐酸调节ph至8.0,121℃高压灭菌20min,备用。(2)蛋白酶k:20mg/ml。(3)苯酚:氯仿:异戊醇(体积比25:24:1)。(4)异丙醇。(5)70%乙醇。(6)实时荧光pcr预混液(以2×预混液为例):pcr缓冲液(终浓度1×),氯化镁(终浓度2.5mmol/l),dntp(终浓度0.2mmol/l),taqdna聚合酶(终浓度1u)。(7)te缓冲液(tris-hcl、edta缓冲液):10mmol/ltris-hcl(ph8.0),1mmol/ledta(ph8.0)。具体仪器如下:(1)电子天平(sartoriuscpa225d),感量0.01g。(2)组织捣碎器(retschmm400)。(3)恒温水浴锅(精宏xmtd-8222)。(4)离心机(eppendorfcentrifuge5810r),最大离心力≥12000g。(5)微量移液器(eppendorfresearchplus),量程分别为0.1μl~2.5μl、0.5μl~10μl、10μl~100μl、20μl~200μl、100μl~1000μl。(6)ph计(mettlertoledofe20)。(7)核酸蛋白分析仪(implenp330)。(8)实时荧光pcr仪(bio-radcfx96)。实施例1本发明检测猪源性成分的试剂盒和检测方法一、本发明试剂盒成分包含seqidno.1、seqidno.2所示的引物对和seqidno.3所示的探针;如表1所示:表1本发明引物及探针注:f为5’端引物,r为3’端引物,p为探针。二、采用本发明试剂盒检测猪源性成分1、dna提取将样品均质后称取0.1g~0.2g,置于2ml离心管中,加入600μlctab裂解液和20μl蛋白酶k,振荡混匀,65℃孵育1h~2h,期间每隔10min振荡混匀;加入500μl的苯酚:氯仿:异戊醇(25:24:1),充分振荡混匀,12000g离心5min;小心吸取上清液至洁净的1.5ml离心管内,加入等体积的异丙醇,振荡混匀,12000g离心5min;弃去上清液,500μl70%乙醇洗涤2次,12000g离心5min,弃上清液,晾干;加入50μl~100μlte缓冲液或无菌双蒸水,溶解dna,-20℃保存备用。也可用等效商品化试剂盒提取dna。2、dna浓度和纯度的测定使用核酸蛋白分析仪检测dna浓度及纯度,dna浓度在1ng/μl~100ng/μl之间,a260/a280值在1.7~2.0之间时,适宜于本方法。3、实时荧光pcr扩增猪源性成分pcr扩增采用20μl的反应体系:包括pcr反应预混液(2×)10μl,5’端、3’端引物(10μmol/l)各0.2μl,探针(10μmol/l)0.1μl,dna模板(1ng/μl~100ng/μl)1μl,用无菌双蒸水补足20μl。每个样品设置两个平行反应体系。pcr扩增反应程序为:95℃5min;35个循环反应(95℃15s,58℃1min,收集荧光)。也可用等效的商品化试剂盒进行扩增。4、实验对照实验过程分别设阳性对照、阴性对照、空白对照。用含有猪源性成分的样品作为阳性对照,用不含猪源性成分的样品作为阴性对照,用等体积的无菌双蒸水代替模板dna作为空白对照。5、结果判断与表述:5.1质量控制以下条件有一条不满足时,实验视为无效:(a)空白对照:无fam荧光信号检出;(b)阴性对照:无fam荧光信号检出;(c)阳性对照:有fam荧光信号检出,且出现典型的扩增曲线,ct值≤30.0。5.2结果判定(a)如有fam荧光信号检出,ct值≤30.0,且出现典型的扩增曲线,则判定为被检样品阳性;(b)如ct值≥35.0或无ct值,则判定为被检样品阴性;(c)如有fam荧光信号检出,且30.0<ct值<35.0,则重新进行实验。如再次扩增后ct值仍<35.0,且有典型的扩增曲线,则判定被检样品阳性;否则判定被检样品阴性。5.3结果表述结果为阳性者,表述为“检出猪源性成分”。结果为阴性者,表述为“未检出猪源性成分”。以下通过试验例具体说明本发明的有益效果:试验例1本发明试剂盒及方法的特异性检测分别以小鼠、海狸鼠、猫、鸡、鸭、鹅、鹌鹑、水牛、黄牛、牦牛、马、狐狸、貂、貉、兔、猪、山羊、绵羊、驴、鹿共计20种物种的基因组dna为模板,用实施例1的试剂盒及方法,进行实时荧光pcr扩增。扩增结束后,通过观察对不同模板dna的扩增曲线及ct值来判定其特异性。检测结果为2个平行样品的平均ct值。若有fam荧光信号检出,ct值≤30.0,且出现典型的扩增曲线,则判定为被检样品阳性。若有fam荧光信号检出,且30.0<ct值<35.0,则重新进行实验。如再次扩增后ct值仍<35.0,且有典型的扩增曲线,则判定被检样品阳性;否则判定被检样品阴性。若ct值≥35.0或无ct值,判定被检样品为阴性。实验结果见图1。结果显示,猪源性检测体系中,20种动物源性成分检测仅有猪源性样品有ct值,有典型扩增曲线且平均ct值为17.62,小于30,判定为含有猪源性成分,其它物种均未检出,特异性验证结果理想,实验结果均能达到检测要求。可见,本发明方法和试剂盒的检测结果与样本的实际情况一致,说明本发明方法和试剂盒特异性好,可以准确检测猪源性成分。试验例2本发明试剂盒及方法的适用性检测对不同产地、不同基质的肉及肉制品(样品信息见表2和图2)进行dna提取,按照本发明试剂盒及方法对其进行检测,确定方法的适用性。表2样品具体信息、测序结果及实时荧光判定结果结果显示,猪源性检测的10个样品在3个浓度水平上ct值均小于30,且扩增曲线理想,判定为含有猪源性成分,判定结果与实际样本测序结果相符合,适用性试验结果符合预期,满足检测要求。可见,本发明方法和试剂盒的检测结果与样本的实际情况一致,说明本发明方法和试剂盒适用性好,可以准确检测不同基质肉类的猪源性成分。试验例3本发明试剂盒及方法的灵敏度检测对猪源性dna进行倍比稀释(模板dna浓度设定:10-4ng/μl、10-3ng/μl、10-2ng/μl、10-1ng/μl、100ng/μl、101ng/μl),用实施例1的试剂盒及方法,进行扩增反应。确定模板dna浓度范围与ct值线性关系,同时根据扩增效率计算公式,计算检测方法的扩增效率,以确定模板dna的灵敏度。扩增效率计算公式为:当灵敏度达到或低于1ng/μl,线性范围内r2>0.99,扩增效率在80%~120%之间时,可满足检测要求(结果见表3和图4)。表3不同浓度模板的ct值模板浓度10-4ng/μl10-3ng/μl10-2ng/μl10-1ng/μl100ng/μl101ng/μlct值33.7030.3526.7723.2919.8916.35结果显示,当模板dna浓度在101ng/μl至10-4ng/μl间时,模板dna浓度和获得的ct值之间线性关系好(相关系数99.9%),扩增效率为95.6%。当阈值设为30个循环时,dna检测的灵敏度为10-2ng/μl。可见,本发明方法在线性范围均有良好的线性关系,r2>0.99;在线性范围内,扩增效率均在80%~120%之间,扩增效率满足检测要求;灵敏度可达到10-2ng/μl,满足检测要求。。试验例4本发明试剂盒及方法的检出限检测分别将猪肉样品以1%、0.1%、0.01%三个水平掺入鸡肉样品中,充分混匀后,提取混合样品的基因组dna,作为检测模板,用实施例1的试剂盒及方法,进行检出限实验(结果见表4和图5)。表4混合肉样检出限验证及检测结果试验结果显示,猪源性实时荧光pcr检测体系能准确检测0.1%猪肉,而在掺入0.01%猪肉试验时,相应ct值接近甚至超过30个循环,对其判定会出现偏差,为了统一检测方法的检出限,规定本方法的检出限为0.1%。综上,本发明试剂盒及方法可以准确检测猪源性成分,检测快速、准确,成本低,特异性好,灵敏度高,有广泛的应用前景。sequencelisting<110>成都市食品药品检验研究院中国科学院成都生物研究所<120>一种用于检测猪源性成分的试剂盒和方法<130>gy392-17p1277<160>3<170>patentinversion3.5<210>1<211>25<212>dna<213>猪源性检测的5'端引物<400>1gcactttatcctgccattcatcatt25<210>2<211>23<212>dna<213>猪源性检测的3'端引物<400>2gtacaaggattagtaggattagt23<210>3<211>25<212>dna<213>猪源性检测的探针序列<400>3cgccctcgcagccgtacatctccta25当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1