激素诱导锌指状蛋白多肽及其制备方法和在制药中的应用与流程
本发明属生物技术领域,涉及激素诱导锌指状蛋白多肽及其制备方法和药用用途,尤其是化学合成的激素诱导锌指状蛋白多肽在制备抑制炎症反应药物中的用途。
背景技术:
现有技术公开了人体内激素作用广泛,其参与物质的新陈代谢,调控机体多个器官的生长发育及维持器官的正常功能,还参与机体应对各种刺激时的应激反应等,是维持机体内稳态不可或缺的一类重要物质;其中以糖皮质激素在临床上的应用最为广泛,研究显示了其免疫抑制能够帮助机体对抗各种原因引起的炎症反应,已成为治疗疾病、挽救生命必不可少的药物。
临床实践中,糖皮质激素被广泛的应用于治疗多种感染性及非感染性的疾病,并获得显著的临床效果,但是其伴随的药物副作用也对机体造成较为严重的损害,包括代谢紊乱、骨质疏松等。如,在眼部疾患治疗中,即使糖皮质激素局部使用也会导致严重的并发症,比如激素性青光眼,激素性白内障等,这些并发症均能导致严重的不可逆的视力损害。鉴于糖皮质激素的显著临床效果及严重的并发症,本领域技术人员拟探寻一种新型激素替代药物,使即能发挥激素的抗炎效果又无激素的药物副作用。
在1997年d'adamiof等研究人员利用地塞米松刺激胸腺细胞研究中发现了一种具有锌指状结构的蛋白,并命名为激素诱导锌指状蛋白(gilz)。作为一种激素诱导蛋白,gilz的抗炎活性在多种动物模型中均被探索过,包括:利用炎症性肠病模型,发现过表达gilz的转基因小鼠结肠部位炎症显著较野生鼠轻;gilz过表达转基因小鼠还可以减轻脊索损伤后炎症反应,表现为在gilz过表达的小鼠中脊索损伤部位t细胞的激活被抑制、促炎症因子如il-1β和tnf-α的释放减少;同样在自身免疫性大脑脊髓炎的小鼠动物模型中,gilz能够跟nf-kb相互作用减轻炎症反应;在lps诱导的内毒素血症中gilz过表达能通过减轻炎症因子的释放进而减轻机体炎症反应;在小鼠关节炎模型中,gilz过表达可以模拟激素发挥抗炎效果,而gilz-knockout鼠关节炎炎症反应显著加重;本申请的前期研究在内毒素诱导的葡萄膜炎模型中,用慢病毒过表达载体诱导视网膜gilz过表达后显著抑制了内毒素诱导的眼内炎症反应。
综上众多试验结果均证实gilz抑制炎症反应的活性,然而这些试验或是通过构建gilz-/-或者gilzoverexpression转基因小鼠,或者是通过构建gilz的overexpression或者silence质粒或者病毒载体转导细胞或者组织,由于该些技术本身具有危险性及伦理的缺陷,限制了其临床应用。
技术实现要素:
本发明的目的在于通过体外化学合成合成新的有生物学活性的激素诱导锌指状蛋白多肽及其药用用途。
基于现有技术公开的激素诱导锌指状蛋白是一条由135个氨基酸构成的蛋白链,由于化学合成蛋白对多肽链长度得限制,在合成过程中多肽过长到常导致肽链结构异常而影响肽链的正确合成,本发明仅选取了其脯氨酸富集的结构域(第98至第135号氨基酸:ktlaspeqlekfqsrlspeepapepetpeapggsav),在多肽的n’端接入穿膜肽ygrkkrrqrrr,然后化学合成所述的激素诱导锌指状蛋白多肽链:ygrkkrrqrrrktlaspeqlekfqsrlspeepapepetpeapggsav;该体外化学合成的多肽链具有很好的水溶性,能够彻底溶于水,能够促进该多肽进入细胞,pbs或者是细胞培养基,而不需要辅助任何有机溶剂,且能保证多肽的给药方式及给药途径的安全性。
具体的,本发明采用的化学合成技术方案是:
选取位于gilz的c’端脯氨酸富聚结构域的氨基酸序列(从98位氨基酸至135位氨基酸),在该序列的n’端连接上穿膜肽,使该多肽段等顺利进入细胞,所述的多肽序列为:ygrkkrrqrrrktlaspeqlekfqsrlspeepapepetpeapggsav。
本发明的进一步目的是提供合成的激素诱导锌指状蛋白多肽在制备抑制炎症药物中的应用。
本发明中,进行了sd大鼠眼内炎症模型的激素诱导锌指状蛋白多肽的干预实验,结果显示,在穿膜肽的引导下激素诱导锌指状蛋白多肽能够成功的进入到müller细胞;激素诱导锌指状蛋白多肽能显著抑制内毒素诱导眼前节炎症反应;显著抑制内毒素诱导眼内炎症细胞渗出,包括前房及玻璃体腔内;以及抑制内毒素诱导视网膜mcp-1的分泌,抑制内毒素诱导视网膜tnf-α的分泌,抑制内毒素诱导视网膜il-1β的分泌,抑制内毒素诱导视网膜icam-1的分泌,抑制内毒素诱导视网膜müller细胞胶质化,抑制内毒素诱导视网膜gfap及vimentin的量以及抑制内毒素诱导视网膜müller细胞apq4表达异常,抑制内毒素诱导视网膜aqp4的量以及抑制内毒素诱导的nf-kbp65核转移以及抑制内毒素诱导的nf-kbp65磷酸化。
本发明通过体内动物试验及体外细胞试验证实体外合成的激素诱导锌指状蛋白多肽具有显著的抗炎活性。可用于制备治疗炎症性疾病的药物。
本发明的体内动物试验及体外细胞试验包括:内毒素(lps)玻璃体腔干预制作眼内炎症模型(sd大鼠);内毒素玻璃体腔干预后2小时,激素诱导锌指状蛋白多肽玻璃体腔为治疗组(gilz-p),同浓度的对照多肽作对照组(control-p);在内毒素干预后的24,48,72及96小时,评估激素诱导锌指状蛋白多肽治疗组及对照肽处理组大鼠眼前节炎症反应;在内毒素干预后24小时,取大鼠眼球做石蜡切片及he染色,评估激素诱导锌指状蛋白多肽治疗组及对照肽处理组大鼠眼内炎症细胞渗出情况;在内毒素注射后24,48,72及96小时,取大鼠视网膜神经上皮组织行westernblot检测,检测激素诱导锌指状蛋白多肽治疗组及对照肽处理组视网膜内炎症因子的分泌;在内毒素干预后24,48,72及96小时,取大鼠视网膜神经上皮组织行westernblot检测,检测激素诱导锌指状蛋白多肽治疗组及对照肽处理组大鼠视网膜müller细胞胶质化情况;在内毒素干预后24,48,72及96小时,取大鼠眼球制作冰冻切片,免疫荧光检测激素诱导锌指状蛋白多肽治疗组及对照肽处理组大鼠视网膜müller细胞的胶质化标记gfap及müller细胞功能蛋白aqp4的表达及分布;原代培养的视网膜müller细胞,不同浓度的激素诱导锌指状蛋白多肽刺激24小时,用cck8试剂盒检测其细胞毒性;原代培养的视网膜müller细胞,不同浓度的激素诱导锌指状蛋白多肽刺激24小时,流式细胞技术检测成功被激素诱导锌指状蛋白多肽穿膜的细胞比例;原代培养的视网膜müller细胞,内毒素刺激2小时后加入不同浓度的激素诱导锌指状蛋白多肽,培养后收集细胞,westernblot检测细胞核及细胞浆内nf-kbp65的量,细胞内磷酸化p65的量;原代培养的视网膜müller细胞,内毒素刺激2小时后加入不同浓度的激素诱导锌指状蛋白多肽,培养24小时后收集细胞,免疫荧光检测nf-kbp65等的蛋白表达。
本发明的实施例中,利用原代培养的视网膜müller细胞细胞检测激素诱导锌指状蛋白多肽的细胞毒经,发现正常培养的müller细胞在不同浓度的激素诱导锌指状蛋白多肽刺激后并不会改变细胞活性,即该多肽不具有细胞毒性。具有药物安全性;进而利用内毒素诱导的眼内炎症模型检验激素诱导锌指状蛋白多肽的有效性,激素诱导锌指状蛋白多肽(1mm,2μl)玻璃体腔注射显著抑制内毒素诱导的眼内炎症反应,表现为眼前节炎症反应显著减轻、眼内炎症细胞渗出显著减少、视网膜神经上皮层能炎症因子的量显著下降、视网膜müller细胞胶质化被显著抑制等,表明体外合成的蛋白多肽具有抗炎活性;进一步利用原代培养的视网膜müller细胞研究激素诱导锌指状蛋白多肽抑制炎症的机制,结果显示该多肽能够显著抑制内毒素诱导的核转录因子nf-kbp65磷酸化,进而抑制p65核转移。
本发明从多个角度证实体外合成的激素诱导锌指状蛋白多肽具有显著的抗炎活性,为治疗炎症性疾病提供新的治疗手段。
附图说明
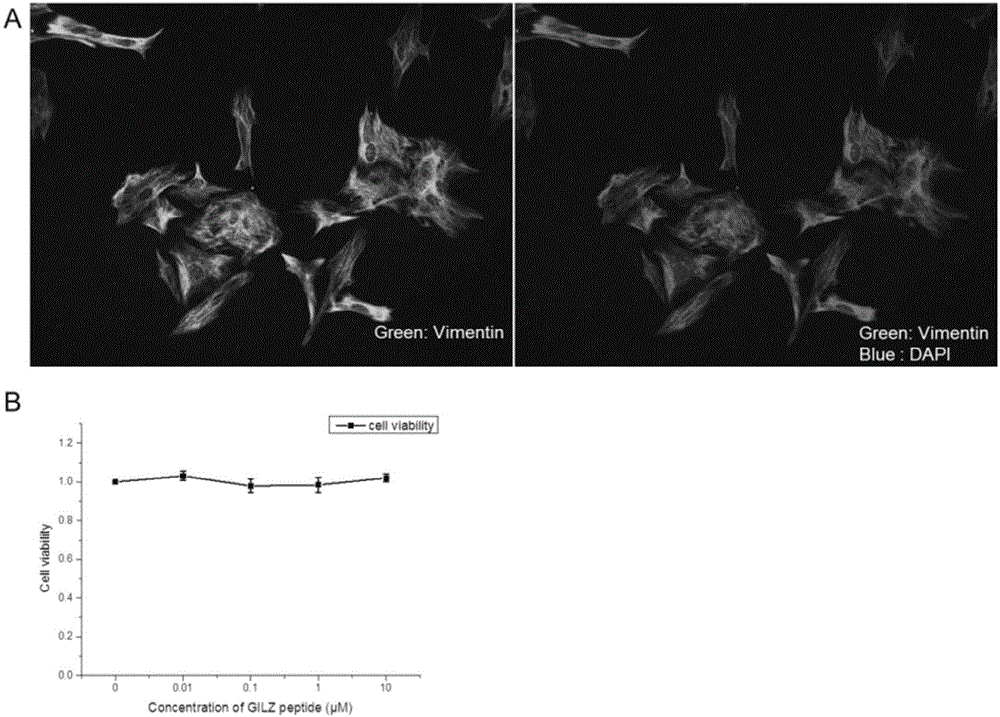
图1:免疫荧光染色vimentin鉴定原代培养的müller细胞(a),green:vimentin;blue:dapi;(b)经鉴定后的原代视网膜müller细胞经不同浓度的激素诱导锌指状蛋白多肽刺激24小时,cck8试剂盒检测müller细胞的活性,评估激素诱导锌指状蛋白多肽的细胞毒性。
图2:流式细胞检测经激素诱导锌指状蛋白多肽成功穿膜的müller细胞比例,随着激素诱导锌指状蛋白多肽浓度的增加,被多肽穿膜的müller细胞比例也逐渐增加,提示在穿膜肽的引导下激素诱导锌指状蛋白多肽能够成功的进入到müller细胞。
图3:内毒素玻璃体腔注射后,眼前节的炎症反应在24小时达到高峰,后逐渐减轻并持续至96小时,与对照肽(control-p)相比,1mm激素诱导锌指状蛋白多肽(gilz-p,2μl)玻璃体腔注射显著抑制内毒素诱导眼前节炎症反应。
图4:westernblot检测发现,1mm激素诱导锌指状蛋白多肽(2μl)玻璃体腔注射显著抑制内毒素诱导眼内炎症细胞渗出,包括前房及玻璃体腔内。
图5:westernblot检测发现,1mm激素诱导锌指状蛋白多肽(2μl)玻璃体腔注射显著抑制内毒素诱导视网膜mcp-1的分泌。
图6:westernblot检测发现,1mm激素诱导锌指状蛋白多肽(2μl)玻璃体腔注射显著抑制内毒素诱导视网膜tnf-α的分泌。
图7:westernblot检测发现,1mm激素诱导锌指状蛋白多肽(2μl)玻璃体腔注射显著抑制内毒素诱导视网膜il-1β的分泌。
图8:westernblot检测发现,1mm激素诱导锌指状蛋白多肽(2μl)玻璃体腔注射显著抑制内毒素诱导视网膜icam-1的分泌。
图9:免疫荧光检测发现1mm激素诱导锌指状蛋白多肽(2μl)玻璃体腔注射显著抑制内毒素诱导视网膜müller细胞胶质化。red:gfap,blue:dapi。
图10:westernblot检测发现,1mm激素诱导锌指状蛋白多肽(2μl)玻璃体腔注射显著抑制内毒素诱导视网膜gfap及vimentin的量。
图11:免疫荧光检测技术发现,1mm激素诱导锌指状蛋白多肽(2μl)玻璃体腔注射显著抑制内毒素诱导视网膜müller细胞apq4表达异常。green:aqp4,blue:dapi.
图12:westernblot检测发现1mm激素诱导锌指状蛋白多肽(2μl)玻璃体腔注射显著抑制内毒素诱导视网膜aqp4的量。
图13:原代培养的视网膜müller细胞,westernblot检测发现激素诱导锌指状蛋白多肽能够显著抑制内毒素诱导的nf-kbp65核转移。
图14:原代培养的视网膜müller细胞,免疫荧光检测发现激素诱导锌指状蛋白多肽能够显著抑制内毒素诱导的nf-kbp65核转移。red:p65;blue:dapi
图15:原代培养的视网膜müller细胞,激素诱导锌指状蛋白多肽能够显著抑制内毒素诱导的nf-kbp65磷酸化。
下面结合附图对本发明提供的具体实施方式作详细说明
具体实施方式
实施例1
主要试剂:激素诱导锌指状蛋白多肽链1:
ygrkkrrqrrrktlaspeqlekfqsrlspeepapepetpeapggsav多肽链2:
ygrkkrrqrrrktlaspeqlekfqsrlspeepapepetpeapggsakfitc(在c端带fitc标签,用于做流式细胞检测),对照多肽为ygrkkrrqrrr,所有多肽链的合成均委托苏州强耀生物科技有限公司,纯度高于95%。gilz、tnf-α抗体购买于proteintech公司,nf-kbp65、磷酸化p65抗体购买于cellsignaling公司,il-1β、mcp-1、icam-1、vimentin和gfap抗体购买于abcam公司。
动物实验:
取正常饲养的成年大鼠,10%水合氯醛腹腔注射(100g/2ml)诱导大鼠全身麻醉,复方托吡卡胺滴眼液点眼扩瞳、盐酸奥布卡因滴眼液点眼诱导局部麻醉后,调整显微镜至最清晰状态;取33g微量注射器,抽取注射液(125ug/ml内毒素,或者是1mm的激素诱导锌指状蛋白多肽链或者等浓度的对照多肽链,2ul)于角巩膜缘1mm斜45°进针,透过瞳孔看到针尖至玻璃体腔后开始推针,结束后针尖停留在玻璃体腔50秒后退针,涂迪可罗眼膏后保暖至苏醒后送回动物房饲养;
玻璃体腔注射内毒素后2小时后再注射多肽链溶解液,在注射内毒素后24,48,72及96小时,对大鼠的前节炎症进行评分,大鼠用10%水合氯醛腹腔注射(100g/2ml)诱导全身麻醉,然后置于裂隙灯下按照下表的方法对大鼠前节炎症反应进行评估并拍照记录;
石蜡切片及he染色:玻璃体腔注射内毒素后2小时后再注射多肽链溶解液,在注射内毒素后24小时,取眼球进行he染色计数渗出炎症细胞,大鼠用10%水合氯醛腹腔注射(100g/2ml)诱导大鼠全身麻醉并颈椎脱臼后致死,显微镜下取眼球置于眼球固定液中,取材是小心,保持眼球的完整性;取固定好的眼球,酒精梯度脱水(由低浓度到高浓度:70%,80%及90%浓,每个浓度脱水30分钟)后,再用纯酒精和二甲苯等量混合液浸泡15分钟、二甲苯115分钟、二甲苯ii15分钟,至眼球组织完全变透明为止;将已透明的眼球块置于已溶化的石蜡中,放入溶蜡箱保温;待石蜡完全浸入组织块后进行包埋。将包埋好的蜡块固定于切片机上,切成厚度为5μm薄片,贴到载玻片上,放45℃恒温箱中烘干;将烘干的片子放入苏木精水溶液中染色数分钟;酸水及氨水中分色,各数秒钟;流水冲洗1小时后入蒸馏水片刻;入70%和90%酒精中脱水各10分钟;入酒精伊红染色液染色2~3分钟;染色后的切片经纯酒精脱水,再经二甲苯使切片透明,标记封片后常温保存观察。经he染色的片子,显微镜下计数前房及玻璃体腔渗出细胞数目,渗出细胞计数采用第三人进行盲法计数同统计;
视网膜冰冻切片及免疫荧光检测:玻璃体腔注射内毒素后2小时后再注射多肽链溶解液,在注射内毒素后72小时,取眼球进行冰冻切片。10%水合氯醛将大鼠过量麻醉致死,在显微镜下取大鼠的眼球浸泡在眼球固定液中2小时,依次用20%蔗糖、30%蔗糖梯度脱水2小时;梯度脱水后的眼球置于显微镜下,用显微剪去除角膜、晶体,制成视杯。眼球置于包埋盒中,用oct包埋剂包埋后置于-80°冰箱冰冻30分钟,后冰冻切片机切厚度10μm的切片并粘附至防脱载玻片,切片在室温下放置2小时,4%多聚甲醛在室温下固定2小时,pbs冲洗30分钟,0.1%triton-x100(0.1%柠檬酸钠配制)穿膜30分钟,山羊血清封闭液封闭切片30分钟,4°冰箱孵育一抗(rabbitantigilzpolyclonalantibody,1:500)过夜,pbs冲洗3次,每次五分钟,37°孵二抗2小时(alexafluor488affinipuregoatanti-rabbitigg;alexafluor555affinipuregoatanti-rabbitigg),pbs冲洗3次,每次五分钟,dapi染色3分钟(1:10000),pbs冲洗3次,每次五分钟后封片,置于荧光显微镜下观察并拍照;
大鼠视网膜原代muller细胞培养:新生sd大鼠(2-3天),断头处死后用安尔碘消毒浸泡5分钟,在超菌台显微镜下取眼球并分离视网膜组织,0.25%的胰酶消化分钟后用培养基终止消化,1200rpm离心5分钟,弃上清,用新鲜培养基重悬细胞后分装至t75培养瓶内(10只新生鼠分装5瓶),置于细胞培养箱内常规培养,用还有20%fps的dmemf12培养基培养,隔天换液,待muller细胞长至80%融合后进行传代,传至三代后进行鉴定后可用于后续试验;
muller细胞鉴定:将生长良好的muller细胞传代至细胞爬片上并培养过夜,4%多聚甲醛固定30分钟,pbs清洗后加入0.1%triton-x100(0.1%柠檬酸钠配制)穿膜30分钟,山羊血清封闭液封闭切片30分钟,4°冰箱孵育一抗(vimentin,1:500)过夜,pbs冲洗3次,每次五分钟,37°孵二抗2小时(alexafluor488affinipuregoatanti-rabbitigg),pbs冲洗3次,每次五分钟,dapi染色3分钟(1:10000),pbs冲洗3次,每次五分钟后封片,置于荧光显微镜下观察并拍照。vimentin阳性的细胞即为muller细胞,原代培养的muller细胞,传至3代后纯度可达95%以上;
cck8实验:检测不同浓度的激素诱导锌指状多肽对muller细胞的细胞毒性,以每孔20000个细胞接种于96孔板中,分别用终浓度为0.01、0.1、1和10mm的激素诱导锌指状蛋白多肽处理细胞。24小时后,向每孔中加入0.1mgcck8,37℃孵育4小时,在分光光度计490nm处检测标本吸光度值。每个药物浓度设6复孔,并重复3次实验;
流式细胞仪检:六孔板内正常培养的muller细胞,加入不同浓度的还有fitc标记的激素诱导锌指状蛋白多肽(0.01,0.1,1,和10mm),继续培养24小时后收集细胞,流式细胞仪检测还有fitc信号的muller细胞;
westernblot免疫印迹分析:将收集的视网膜神经上皮层或原代培养的视网膜muller细胞,根据细胞的量加入适量单去污剂裂解液裂(含pmsf),bsa试剂盒测量蛋白浓度。将提取的蛋白上清与5ⅹ蛋白上样缓冲液(0.25mtris-hcl,ph6.8,50%甘油,20%-巯基乙醇,10%sds,0.0012%溴酚蓝),放入沸水中进行沸水浴10min。取40ug蛋白样在含sds的5%-12%聚丙烯酰胺凝胶中电泳,然后转移至pvdf膜上;pvdf膜用tbs(20mmtris-hclph7.4,150mmnacl),用含5%脱脂奶粉的tbst浸泡pvdf膜,室温摇床封闭2小时;用封闭液稀释相应的一抗并4℃孵育过夜;tbst充分洗涤pvdf膜5-6次,5min/次;二抗37℃摇床孵育2小时。洗去多余二抗后用ecl试剂中增强液与稳定的过氧化物酶溶液按1:1比例混匀,滴加工作液于pvdf膜上,反应数分钟待荧光带明显后,用滤纸吸去多余的底物液,覆上保鲜膜,x光胶片压片后依次放入显影液显影、定影液定影;冲洗胶片分析结果;晾干胶片,扫描胶片,用bandscan分析胶片灰度值,分析结果;
实验结果采用三次及三次以上独立实验的平均值和标准差表示,用t检验比较差异,p值小于认为有统计学差异,所有统计采用spss16.0软件;
试验结果显示:
激素诱导锌指状蛋白多肽无细胞毒性:经免疫荧光vimentin染色,鉴定为原代培养的大鼠视网膜müller细胞(图1a),传代至96孔板,用不同浓度的激素诱导锌指状蛋白多肽刺激24小时,用cck8细胞毒试剂盒检测激素诱导锌指状蛋白多肽本身是否有细胞毒性。如图1b所示,不同浓度的激素诱导锌指状蛋白多肽刺激müller细胞24小时后,müller细胞的活性并不受影响,也就是说激素诱导锌指状蛋白多肽本身不具有细胞毒经;
激素诱导锌指状蛋白多肽能够成功与müller细胞结合:为了能够促进激素诱导锌指状蛋白多肽成功突破细胞膜进入细胞,我们在该多肽的n’端接上一段穿膜肽,同时在c’端连接上能够发荧光的fitc方便我们用流式细胞技术检测与müller成功相互接触并进入müller的激素诱导锌指状蛋白多肽。如图2所示,不同浓度的激素诱导锌指状蛋白多肽处理müller细胞2小时后,即可以一定程度的与müller细胞结合;
激素诱导锌指状蛋白多肽抑制内毒诱导的眼前节炎症反应:如图3所示,内毒素玻璃体腔注射显著诱导大鼠眼前节炎症反应,表现为虹膜充血、前房渗出、前房积脓及瞳孔缩小等,炎症反应在24小时达到高峰并持续至96小时。与对照肽相比,炎症反应在激素诱导锌指状蛋白蛋白多肽处理组显著减轻,在24、48、72及96小时,炎症评分有显著差异。
激素诱导锌指状蛋白多肽抑制内毒素诱导的眼内炎症细胞渗出:如图4所示,在内毒素玻璃体腔注射后的24小时,大量的炎症细胞渗出广泛的分布在虹膜睫状体及玻璃体腔内。通过对眼球内渗出炎症细胞的计数,发现激素诱导锌指状蛋白多肽的干预显著抑制了眼球内炎症细胞的数量;
激素诱导锌指状蛋白多肽抑制内毒素诱导的视网膜炎症因子的分泌:单核细胞趋化因子mcp-1、肿瘤坏死因子tnf-α、白介素il-1β及细胞间粘附分子icam-1,是介导眼内非常重要的媒介,参与眼内炎症的级联放大。如图5-8所示,内毒素玻璃体腔注射后视网膜内mcp-1、tnf-α、il-1β和icam-1的量均逐渐升高,而激素诱导锌指状蛋白多肽能够一定程度上抑制这些炎症因子的分泌。以上这些结果均表明,激素诱导锌指状蛋白多肽能够抑制内毒诱导的炎症反应。
激素诱导锌指状蛋白多肽抑制内毒素诱导的视网膜müller细胞的胶质化:病理环境能够诱导视网膜müller细胞胶质化,胶质化的标志为胶质纤维酸性蛋白gfap表达增加,视网膜müller细胞的胶质化是视网膜内环境稳态的标志,胶质化的müller细胞不仅功能下降,同时分泌大量的炎症因子,导致视网膜炎症级联反应。如图9所示,内毒素玻璃体腔注射后72小时后视网膜müller细胞内gfap显著增加并延伸至视外核层,与对照肽相比,激素诱导锌指状蛋白多肽显著抑制müller细胞gfap的表达,提示激素诱导锌指状蛋白多肽能够抑制视网膜müller细胞的胶质化,即在一定程度上维持了视网膜内环境的稳态。与免疫荧光结果相吻合的是,如图10所示的westernblot也证实内毒素诱导视网膜内gfap、vimentin的表达量增加,而激素诱导锌指状蛋白多肽在内毒素注射后的24,48,72及96小时均能在一定程度上抑制gfap的表达。正常视网膜müller细胞表达大量的水通道蛋(aqp4),主要分布在与玻璃体腔接触的müller细胞足突终板以及与视网膜血管接触的müller细胞胞体,视网膜组织内的水通过aqp4通道向玻璃体腔及视网膜血管内转移,müller细胞的aqp4是维持视网膜内水平衡的关键。当aqp4通道异常的时候,大量的水聚集在视网膜组织内导致视网膜水肿。如图11所示,内毒素玻璃体腔注射后视网膜müller细胞aqp4的表达下降且分布紊乱异常,而激素诱导锌指状蛋白多肽可以在一定程度上恢复aqp4的排布。wessternblot也进一步证实,内毒素玻璃体腔注射后导致视网膜aqp4的表达量逐渐下降,而激素诱导锌指状蛋白多肽的玻璃体腔注射在一定程度上恢复视网膜aqp4的量(如图12所示):
激素诱导锌指状蛋白多肽抑制内毒素诱导的nf-kbp65核转移:进一步利用原代培养的视网膜müller细胞探索激素诱导锌指状蛋白多肽抗炎的机制。内毒素刺激的müller细胞,其nf-kbp65显著的核转移,变现为胞浆内p65量下降同时胞核内p65的量增加,而激素诱导锌指状蛋白多肽能够显著抑制nf-kbp65核转移,这一结论同时被免疫荧光及westernblot证实(如图13、14所示);
激素诱导锌指状蛋白多肽抑制内毒素诱导的nf-kbp65磷酸化:nf-kbp65磷酸化是p65核转移的动力,因此我们利用原代培养的müller细胞进一步探索激素诱导锌指状蛋白多肽是否可以抑制p65的磷酸化,如图15所示,激素诱导锌指状蛋白多肽成功抑制了内毒素所诱导的p65磷酸化。
- 还没有人留言评论。精彩留言会获得点赞!