含有C‑端通用标签的pENTR4Gateway中间入门载体及其构建方法与流程
本发明属于生物技术领域,具体涉及一种携带c-端常见蛋白表达标签的gatewaypentr4中间入门载体。
背景技术:
gateway技术是克隆和亚克隆dna序列的一项新颖的通用系统,便于功能靶基因的分析和蛋白质的表达。一旦进入这个多功能的操作系统,靶dna片段可以通过位点特异的重组在载体之间转移[1]。
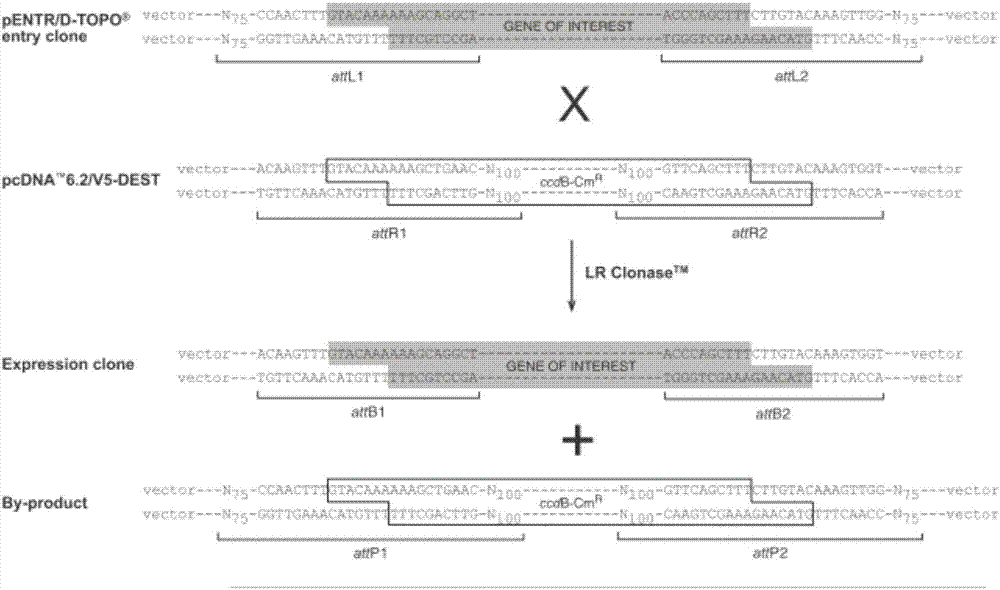
具体来讲,gateway技术是基于研究非常清楚的λ嗜菌体位点特异重组系统(attbxattp→attlxattr)(图1)。bp和lr两个反应就构成了gateway技术,其中bp反应是在噬菌体和细菌的整合因子(inf、int)的作用下,一个attbdna片段或表达克隆和一个attp供体载体(pdonor)之间的重组反应,创建一个入门克隆(pentr)。在构建入门载体后,不再需要使用限制性内切酶和连接酶,可以通过位点特异重组lr反应多次使用,lr反应是在噬菌体编码蛋白xis和ihf、int的共同介导下,一个attl入门克隆和一个attr目的载体(pdest)之间的重组反应,用来在平行的反应中转移靶序列到一个或更多个目的载体(pdest)(图2)。由于所有目的载体携带自杀基因(ccdb),确保靶基因在目的载体中重组克隆,分离效率高于95%。而且当靶基因在不同目的表达载体之间快速简便穿梭时,可以保证正确的方向和阅读框。通过上述gatewaybp/lr技术,极大地简化了基因克隆和亚克隆的步骤,使靶基因快速地转移到各种目的表达载体,从而在体外、细菌、酵母、昆虫或哺乳动物细胞进行表达和分析(图3)。
构建入门克隆载体(entryclone),除了用gatewaybp反应将含有attb位点的dna片段或表达克隆与含attp供体载体(pdonor)重组获得之外[2],还包括pcr产物通过定向topo克隆至入门载体[3],和限制性内切酶消化和连接进入入门载体(图2-3)。对于传统的限制性内切酶消化和连接方法,有相当数量的入门空白载体,其中最重要的是pentr4系列入门空载体(相关信息参考www.addgene.org网站)[4]。而在这些pentr4系列入门空载体中,目前只有n-端常用蛋白表达标签可供选择,包括flag和v5(addgene#17423,#17425等)(图4)。但是缺少c-端常用蛋白标签入门空载体,目前c端标签pentr4载体有pentr4-nuc-myc(addgene#20026)和pentr-ha-nuc-myc(addgene#20025),前者c-端标签为核定位(nls)和myc双标签,后者除了c端双标签外,还有n端ha标签。由于这个c端双标签带有核定位(nls)标签,使用受到限制,而且c端标签没有办法通过酶切方法替换成常用标签;同时这两个载体的多克隆位点选择少,只有ncoi,xcmi,sali,xhoi,noti,使用受到进一步限制,无法满足使用需要。尽管目前有前述n-端常用蛋白表达标签pentr4入门空载体可供基因克隆和蛋白表达,但是考虑到许多蛋白具有n-端定位信号,n-端标签可能会干扰信号序列的功能,从而干扰表达蛋白的正确细胞定位;还有蛋白质定位信号序列在翻译后阶段也可能被切除,从而n-端蛋白标签也相应丢失。为避免n-端蛋白标签的上述问题,需要研制出常用c-端蛋白标签的pentr4入门空载体。我们注意到n端flag和v5标签pentr4入门空载体具有多克隆位点xmni,sali,hincii,kpni,ecori,noti,xhoi,ecorv,xbai,可以满足一般克隆的需要;重要的是,n端标签flag或者v5序列可以通过两侧的ncoi位点酶切消除,而且酶切消除n端标签后只保留单个ncoi,可以用于后续克隆使用。在此基础上,我们进一步通过上面多克隆位点c末端的ecorv位点引入常见蛋白标签序列如flag,v5或ha。通过上面两个独特的步骤和方法,就可以获得满足使用需求的新型c端常用标签pentr4入门空载体。
本专利在n-端标签入门空载体pentr4-flag的基础上,首先利用ncoi切除n端flag标签序列,其次在多克隆位点c末端的ecorv位点插入常用蛋白表达标签flag,v5或者ha序列,从而发明c-端标签的入门空载体pentr4-3xflag,pentr4-v5和pentr4-2xha。这些c端标签入门空载体基本保留了原有的多克隆酶切位点,方便克隆外源基因,并和c端常用标签融合表达,满足了实验使用需求。
参考文献:
1.earleykw,haagjr,ponteso,opperk,juehnet,songk,pikaardcs.gateway-compatiblevectorsforplantfunctionalgenomicsandproteomics.plantj.2006feb;45(4):616-29.
2.liangx,pengl,baekch,katzenf.singlestepbp/lrcombinedgatewayreactions.biotechniques.2013nov;55(5):265-8.
3.xur,liqq.protocol:streamlinecloningofgenesintobinaryvectorsinagrobacteriumviathegateway(r)topovectorsystem.plantmethods.2008jan22;4:4.
4.campeaue,ruhlve,rodierf,smithcl,rahmbergbl,fussjo,campisij,yaswenp,cooperpk,kaufmanpd.aversatileviralsystemforexpressionanddepletionofproteinsinmammaliancells.plosone.2009aug6;4(8):e6529.
技术实现要素:
为避免n-端蛋白标签的潜在应用问题,本发明提供一种c-端常用蛋白标签的入门空载体。
本发明所述的一种含有c-端通用标签的pentr4gateway中间入门载体,是在载体pentr4的多克隆位点c末端的ecorv位点插入有蛋白表达标签序列。
具体地,所述的蛋白表达标签可以是flag、v5或ha,分别得到入门空载体pentr4-3xflag,pentr4-v5和pentr4-2xha。
这些c端标签入门空载体基本保留了原有的多克隆酶切位点,方便克隆外源基因,并且外源基因和c-端标签融合表达,满足了实验使用需求。事实上本发明成功基础上,可以在c末端的ecorv位点插入任何蛋白标签序列,进一步扩展所发明c-端蛋白标签入门空载体的使用范围。
本发明还提供了所述的含有c-端通用标签的pentr4gateway中间入门载体的构建方法,是以载体pentr4为骨架,在pentr4的多克隆位点c末端的ecorv位点插入蛋白表达标签序列。其中,所述载体pentr4可以通过直接购买获得(www.addgene.org);也可以是在pentr4的n-端标签入门空载体的基础上切除n端标签序列而获得,所述pentr4的n-端标签入门空载体可以是pentr4-flag、pentr4-v5等。更具体地,可以先利用ncoi切除载体pentr4-flag的n端flag标签序列得到pentr4,再在c端ecorv位点插入蛋白表达标签;方法如下:
(1)n-端flag标签的切除:
入门空载体pentr4-n-flag(优宝生物,www.youbio.cn产品编号:vt2038)(图4)质粒扩增后,用ncoi酶切,琼脂糖胶回收酶切大片段,t4连接酶连接,转化top10感受态细胞,涂布卡那霉素(kanamycin)琼脂培养板。从转化菌落中提取质粒,dna测序确定得到去除n-端flag标签的质粒pentr4。
(2)c末端的ecorv位点插入常用蛋白表达标签,分别以flag、v5和ha为例:
c-端3xflagpentr4入门空载体(pentr4-c-3xflag)的构建:
合成序列atcgactacaaagaccatgacggtgattataaagatcatgacatcgactacaaggatgacgatgacaagtag(seqidno.1)及其互补序列,变性退火形成双链平端dna(dsdna)。质粒pentr4用ecorv酶切,碱性磷酸酶(ap)去磷酸化处理,和上述平端dna用t4连接酶连接,连接产物转化top10感受态细胞,涂布卡那霉素琼脂培养板。从转化菌落中提取质粒,ecorv酶切并dna测序鉴定。所合成的dna序列为3xflag标签编码序列,5端加atc,3端加终止密码子tag。正确连接的flag标签序列上游保留了ecorv位点,下游是合成的终止密码子tag。(见图5)
c-端v5pentr4入门空载体(pentr4-c-v5)的构建:
合成序列atcggtaagcctatccctaaccctctcctcggtctcgattctacgtag(seqidno.2)及其互补序列,变性退火形成双链平端dna(dsdna)。质粒pentr4用ecorv酶切,碱性磷酸酶(ap)去磷酸化处理,和上述平端dna用t4连接酶连接,连接产物转化top10感受态细胞,涂布卡那霉素琼脂培养板。从转化菌落中提取质粒,ecorv酶切并dna测序鉴定。所合成的dna序列为v5标签编码序列,5端加atc,3端加终止密码子tag。正确连接的v5标签序列上游保留了ecorv,下游是合成的终止密码子tag。(见图5)
c-端2xhapentr4入门空载体(pentr4-c-2xha)的构建:
合成序列atcaccagctacccatacgatgttcctgactatgcgggctatccctatgacgtcccggactatgcatag(seqidno.3)及其互补序列,变性退火形成双链平端dna(dsdna)。质粒pentr4用ecorv酶切,碱性磷酸酶(ap)去磷酸化处理,和上述平端dna用t4连接酶连接,连接产物转化top10感受态细胞,涂布卡那霉素琼脂培养板。从转化菌落中提取质粒,ecorv酶切并dna测序鉴定。所合成的dna序列为2xha标签编码序列,5端加atcaccagc,3端加终止密码子tag。正确连接的ha标签序列上游保留了ecorv,下游是合成的终止密码子tag。(见图5)
本发明的有益效果体现在;能有效地避免n-端蛋白标签和信号肽相互干扰的潜在应用问题。天然免疫受体nlrp3蛋白全长编码序列克隆进入上述三种c端表达标签入门载体,并通过后续lr反应转移到目的pcdna表达载体中,nlrp3在目的表达载体转染细胞中成功地表达了带相应标签的特异蛋白条带,结果符合预期(图6)。同时可以在pentr4载体c末端的ecorv位点插入任何蛋白标签序列,进一步扩展本发明c-端蛋白标签入门空载体pentr4的使用范围。
附图说明
图1是gateway技术bp和lr两个反应系统特性。
图2是在lrclonsae作用下的gatewaylr反应。
图3是靶基因通过gatewaylr反应从入门载体快速转移到各种目的表达载体。
图4是现有的n-端的flag标签pentr4中间入门载体(n-端v5标签pentr4载体与此相同)。
图5是c-端常用标签的入门空载体pentr4-flag,pentr4-v5和pentr4-ha多克隆位点及下游标签序列测序结果。
图6是猪天然免疫受体nlrp3基因克隆在三种c端常用标签入门载体中,经lr反应转移到目的pcdna真核表达载体。western-blotting检测pcdnanlrp3转染细胞表明细胞都成功地表达了带相应蛋白表达标签的nlrp3蛋白。
具体实施方式
实施例1:c-端3xflagpentr4入门空载体(pentr4-c-3xflag)的构建
(1)入门空载体pentr4-n-flagn-端flag标签的切除:
入门空载体pentr4-n-flag(优宝生物,www.youbio.cn产品编号:vt2038)质粒扩增后,用限制性内切酶ncoi(neb,货号r3193)酶切,琼脂糖胶回收酶切大片段,t4连接酶(neb,货号m0202)常温连接2小时,转化top10感受态细胞,并涂布卡那霉素(kanamycin)琼脂培养板。从转化菌落中提取质粒,dna测序确定得到去除n-端flag标签的质粒pentr4。
(2)c-端3xflagpentr4入门空载体(pentr4-c-3xflag)的构建:
合成序列atcgactacaaagaccatgacggtgattataaagatcatgacatcgactacaaggatgacgatgacaagtag(seqidno.1)及其互补序列,变性退火形成双链平端dna(dsdna)。质粒pentr4用ecorv酶切,小牛肠碱性磷酸酶(ciap,neb货号m0290)去磷酸化处理,和上述平端dna用t4连接酶连接,连接产物转化top10感受态细胞,涂布卡那霉素琼脂培养板。从转化菌落中提取质粒,ecorv酶切并dna测序鉴定。所合成的dna序列为3xflag标签编码序列,5端加atc,3端加终止密码子tag。正确连接的flag标签序列上游保留了ecorv位点,下游是合成的终止密码子tag。(见图5)
实施例2:c-端v5pentr4入门空载体(pentr4-c-v5)的构建
步骤(1)同实施例1,步骤(2)如下:
合成序列atcggtaagcctatccctaaccctctcctcggtctcgattctacgtag(seqidno.2)及其互补序列,变性退火形成双链平端dna(dsdna)。质粒pentr4用ecorv酶切,小牛肠碱性磷酸酶(ciap)去磷酸化处理,和上述平端dna用t4连接酶连接,连接产物转化top10感受态细胞,涂布卡那霉素琼脂培养板。从转化菌落中提取质粒,ecorv酶切并dna测序鉴定。所合成的dna序列为v5标签编码序列,5端加atc,3端加终止密码子tag。正确连接的v5标签序列上游保留了ecorv,下游是合成的终止密码子tag。(见图5)
实施例3:c-端2xhapentr4入门空载体(pentr4-c-2xha)的构建
步骤(1)同实施例1,步骤(2)如下:
合成序列atcaccagctacccatacgatgttcctgactatgcgggctatccctatgacgtcccggactatgcatag(seqidno.3)及其互补序列,变性退火形成双链平端dna(dsdna)。质粒pentr4用ecorv酶切,小牛肠碱性磷酸酶(ciap)去磷酸化处理,和上述平端dna用t4连接酶连接,连接产物转化top10感受态细胞,涂布卡那霉素琼脂培养板。从转化菌落中提取质粒,ecorv酶切并dna测序鉴定。所合成的dna序列为2xha标签编码序列,5端加atcaccagc,3端加终止密码子tag。正确连接的ha标签序列上游保留了ecorv,下游是合成的终止密码子tag。(见图5)
实施例4:
猪天然免疫受体nlrp3基因的克隆、重组入门载体和目的载体的lr反应:
设计一对pcr引物从猪pk15细胞总rna中rt-pcr扩增nlrp3基因编码区全长:上游引物(含sali位点),ttcgcgtcgacatgagcatggcaagcgtccgctgcttcgcgatatcctgggaaggctcaaagacaatggtcaactcaggc(seqidno.4);下游引物(含ecorv位点)ttcgcgatatcctgggaaggctcaaagacaatggtcaactcaggc(seqidno.5)。rt-pcr扩增得到大小为3.1kb的dna片段,pcr产物经纯化后用sali和ecorv双酶切,与同样双酶切的入门载体pentr4-c-2xha在t4连接酶作用下连接,转化top10感受态细菌细胞,涂布卡那霉素琼脂培养板。从转化菌落中提取质粒,双酶切并dna测序鉴定。序列正确的重组载体pentr4-nlrp3-2xha与目的载体pcdnadest47(addgene,货号#36139)在lrclonsae(thermofisher,货号12538120)作用下进行lr反应,反应产物转化感受态dh5α并涂布氨苄青霉素(ampicillin)琼脂培养板,从转化dh5α菌落提取质粒获得重组目的表达质粒pcdna-nlrp3-2xha。
nlrp3从序列正确的重组入门载体pentr4-nlrp3-2xha中通过sali和ecorv双酶切亚克隆到入门载体pentr4-c-v5和pentr4-c-3xflag中,分别获得重组入门载体pentr4-nlrp3-v5和pentr4-nlrp3-3xflag。上述重组入门载体和目的载体pcdnadest47在lrclonsae作用下进行lr反应,反应产物转化感受态dh5α并涂布氨苄青霉素(ampicillin)琼脂培养板,从转化dh5α菌落提取质粒分别获得重组目的表达质粒pcdna-nlrp3-v5和pcdna-nlrp3-3xflag。
nlrp3在转染细胞中的表达检测:
293t细胞以0.3x106细胞/孔分到12孔培养板,第二天重组目的表达质粒pcdna-nlrp3-2xha,pcdna-nlrp3-v5和pcdna-nlrp3-3xflag分别1μg用转染试剂lipofeactamine2000转染293t细胞。转染48小时后,收集细胞,加入裂解液裂解细胞,细胞裂解上清上样电泳,跑sds-page,蛋白从胶转印到pvdf膜,用相应的抗ha、抗flag、抗v5抗体孵育,洗涤后用hrp标记的二抗孵育,洗涤后用化学发光试剂显色成像。最后western-blotting结果见图6。nlrp3cdna克隆进三种c端常用标签入门载体,经lr反应转移到目的pcdna真核表达载体。和pcdna空载体转染对照相比,pcdnanlrp3转染细胞都成功地表达了带相应蛋白表达标签的nlrp3蛋白。这一结果表明本发明构建载体的的有效性。
sequencelisting
<110>扬州大学
<120>含有c-端通用标签的pentr4gateway中间入门载体及其构建方法
<130>
<160>5
<170>patentinversion3.3
<210>1
<211>72
<212>dna
<213>人工序列
<400>1
atcgactacaaagaccatgacggtgattataaagatcatgacatcgactacaaggatgac60
gatgacaagtag72
<210>2
<211>48
<212>dna
<213>人工序列
<400>2
atcggtaagcctatccctaaccctctcctcggtctcgattctacgtag48
<210>3
<211>69
<212>dna
<213>人工序列
<400>3
atcaccagctacccatacgatgttcctgactatgcgggctatccctatgacgtcccggac60
tatgcatag69
<210>4
<211>80
<212>dna
<213>人工序列
<400>4
ttcgcgtcgacatgagcatggcaagcgtccgctgcttcgcgatatcctgggaaggctcaa60
agacaatggtcaactcaggc80
<210>5
<211>45
<212>dna
<213>人工序列
<400>5
ttcgcgatatcctgggaaggctcaaagacaatggtcaactcaggc45
- 还没有人留言评论。精彩留言会获得点赞!