一种提高青霉素生物发酵产量的方法与流程
本发明属于生物工程领域,更具体地,本发明涉及一种提高青霉素生物发酵产量的方法。
背景技术:
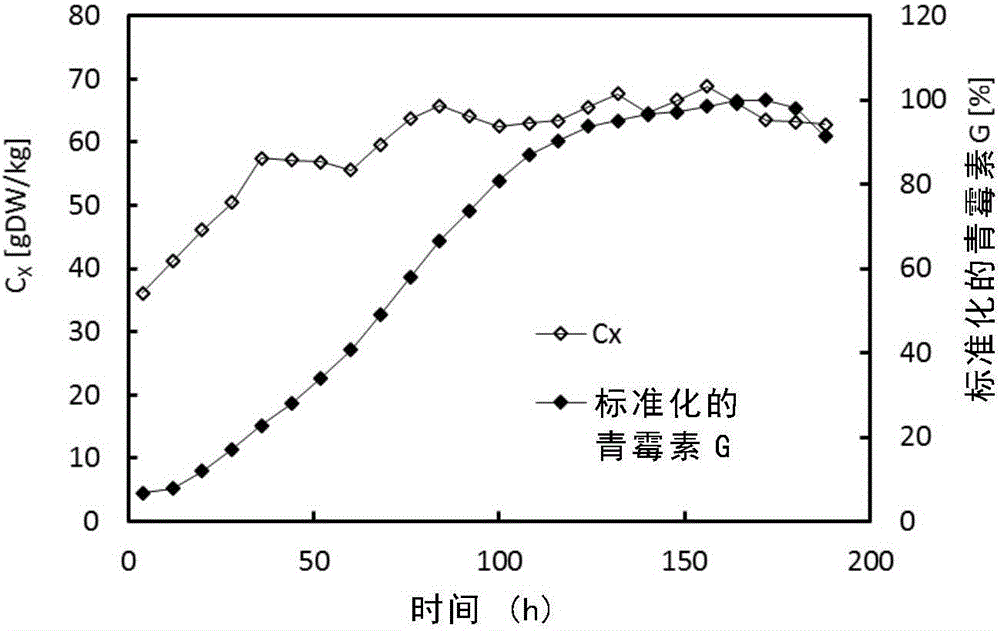
:自1929年弗莱明首次发现青霉素,距今已有近90年历史,作为第一个被发现的β-内酰胺类抗生素,青霉素仍然发挥着极其重要的作用。2003年,β-内酰胺类抗生素的年产值已经达到了150亿美元,青霉素类产品占其中的三分之一。青霉素的工业化生产也已经进行了60多年,通过菌种改造和发酵工艺的优化,现在青霉素产率较最初发现的原始菌株提高了100000倍以上。其成本也有了大幅度降低,由最初的每十亿单位数百美元到现在的不足十美元。青霉素也由一种昂贵的珍稀化工产品变为现在廉价的大宗化工产品。青霉素的工业生产方式采用多级补料分批发酵工艺,在发酵过程中流加补入葡萄糖、苯乙酸、硫酸铵等料液,同时控制发酵体积。通过控制流加培养液的速率,维持发酵液中的葡萄糖浓度始终处于极低浓度水平,既可以保证菌体生长,同时又不会对青霉素代谢形成阻遏作用。青霉素的合成受溶解氧、溶解二氧化碳、ph、氨氮、碳源的调控,这些调控的产生不仅与搅拌、通气、培养基组分有关,更受补料方式的影响。当溶氧浓度低于5%~10%氧饱和度(0.013~0.026mmol/l)时,青霉素的合成将受到不可逆的损害。另外,青霉素合成的中间代谢物,如δ-(l-α-氨基己二酰)-l-半胱酰胺-d-缬氨酸(lld-acv)、异青霉素n(ipn)、6-氨基青霉烷酸(6-apa)等物质在胞内的浓度也随溶氧浓度的降低而降低。高浓度的葡萄糖显著阻遏产黄青霉合成三肽合成酶和异青霉素n合成酶而不抑制它们的活性,还会导致乙酰辅酶a合成酶失活而影响侧链前体的活化。硫酸盐作为前体氨基酸半胱氨酸的合成原料,在青霉素的生物合成中起着重要作用,但高浓度的硫酸盐在某种程度上阻遏产黄青霉的硫酸盐通透酶而影响其摄取。有研究表明,菌体的形态与其所处的微观及宏观环境密切相关,环境的改变会导致细胞形态和生理代谢发生全局性的改变。由于上述发酵过程中的种种变化,使得青霉素生物发酵的发酵时间受限,产量受限。因此,本领域需要开发进一步改进的发酵方法,以延长发酵的时间,提高发酵的产量。技术实现要素:本发明的目的在于提供一种提高青霉素生物发酵产量的方法。在本发明的第一方面,提供一种提高青霉素生物发酵产量的方法,所述方法包括:在青霉素发酵的中后期,进行选自下组的操作:(a)在发酵进行到80~100小时的时候,排出按照体积40~60%的发酵液,补入(如一次性补入)同等体积的新鲜培养基;以及,在发酵进行到140~160小时的时候,排出按照体积15~35%的发酵液,同时补入(如一次性补入)同等体积的新鲜培养基;或(b)从发酵进行到70~90小时起,通过流加的方式补入磷酸盐溶液;以及,从发酵进行到110~130小时起,通过流加的方式补入包含磷酸盐以及金属盐的溶液,所述金属包括:fe、cu、mn、zn、mg。在一个优选例中,步骤(a)中,在发酵进行到85~95小时的时候,排出按照体积45~55%的发酵液,补入同等体积的新鲜培养基;以及,在发酵进行到145~155小时的时候,排出按照体积20~30%的发酵液,同时补入同等体积的新鲜培养基。在另一优选例中,步骤(b)中,从发酵进行到75~85小时起,通过流加的方式补入磷酸盐溶液;以及,从发酵进行到115~125小时起,通过流加的方式补入包含磷酸盐以及金属盐的溶液,所述金属包括:fe、cu、mn、zn、mg。在另一优选例中,所述的磷酸盐溶液包括:kh2po415±5g/l,较佳地为15±2g/l;(nh4)h2po48.4±2g/l,较佳地为8.4±1g/l。在另一优选例中,流加磷酸盐的速率为1±0.3g/min;较佳地,流加磷酸盐的速率为1±0.2g/l;在另一优选例中,所述的包含磷酸盐以及金属盐的溶液包括:kh2po415±5g/l,较佳地为15±2g/l;(nh4)h2po48.4±2g/l,较佳地为8.4±1g/l;柠檬酸·2h2o15±5g/l,较佳地为15±2g/l;feso4·7h2o3.5±1g/l,较佳地为3.5±0.5g/l;cuso4·5h2o1±0.3g/l,较佳地为1±0.1g/l;mnso41±0.3g/l,较佳地为1±0.1g/l;znso4·7h2o1±0.3g/l,较佳地为1±0.1g/l;mgso4·2h2o13±3g/l,较佳地为13±1g/l。在另一优选例中,流加包含磷酸盐以及金属盐的溶液的速率为1±0.3g/min,较佳地为1±0.2g/l。在另一优选例中,发酵培养基含有:柠檬酸,玉米浆,feso4·7h2o,cuso4·5h2o,mnso4,znso4·7h2o,mgso4·2h2o,na2so4,(nh4)2so4,kh2po4,玉米蛋白粉,caco3,玉米油。在另一优选例中,发酵过程的补料液含有:葡萄糖,苯乙酸、硫酸铵,氨水。在另一优选例中,采用的青霉素生产菌株是产黄青霉菌。在另一优选例中,发酵过程中,ph在6.5±0.2,温度25±1℃,罐压0.08±0.01mpa。本发明的其它方面由于本发明的公开内容,对本领域的技术人员而言是显而易见的。附图说明图1、补料分批发酵菌浓与青霉素浓度变化。其中,标准化的青霉素(penicilling)含量是青霉素在每一时间点时的浓度/发酵过程的最高浓度。图2、不同调控策略下青霉素浓度比较。其中,标准化的青霉素(penicilling)含量是青霉素在每一时间点时的浓度/实施例1发酵过程(传统工艺)的最高浓度。图3、不同调控策略下总青霉素产量的比较。其中,标准化的青霉素(penicilling)总含量是青霉素在每一时间点时的总量/实施例1发酵过程(传统工艺)的最高总产量。图4、不同调控策略下青霉素比合成速率的比较。其中,标准化的qpeng含量是青霉素在每一时间点时的比产率/实施例1发酵过程(传统工艺)的最高比产率。图5、不同调控策略在不同发酵周期菌丝形态的比较。图6、传统工艺组和实验组得率对比。(a)不同调控策略中菌体对糖得率的比较;(b)不同调控策略中青霉素g对糖得率;(c)不同调控策略中青霉素g对苯乙酸得率。图7、青霉素合成途径的示意图。具体实施方式本发明人经过深入的研究,揭示了青霉素发酵过程中新的调控策略,主要涉及对优化发酵过程中后期的调控,本发明的方法可以极为显著地提高青霉素生物发酵产量的方法,青霉素产量提高约42%。如本发明所用,所述的“一级发酵”、“二级发酵”是指种子罐发酵。所述的“三级发酵”是以生产青霉素为目的的发酵。除非另外说明,本发明权利要求及说明书中所述的“发酵”、“培养”是指“三级发酵”。除非另外说明,本发明权利要求及说明书中各个时间点的计算以“三级发酵”起始的时间点作为起始(0小时)。青霉素作为第一个被应用的β-内酰胺类抗生素,至今仍在医疗健康领域发挥着重要作用。本发明人发现,在产黄青霉菌补料分批发酵中,青霉素合成速率在发酵后期并不理想。针对这一问题,本发明人深入地研究了发酵过程中各个时间点的菌体状态的变化以及产量变化,设计了在合适的时间点进行“减菌加料”和后期补盐的工艺优化策略,从而大大提升了青霉素发酵的有效发酵时间,大大提高了青霉素产量。同时,根据“减菌加料”操作结果,本发明人发现,传统发酵工艺后期青霉素合成速率降低的主因并不是菌体的自衰亡或退化,而是由于发酵液内供青霉菌利用的营养物质不足和某些有毒代谢物质的过量积累。本发明提供了一种提高青霉素生物发酵产量的方法,所述方法包括:在青霉素发酵的中后期,进行选自下组的操作:(a)在发酵进行到80~100小时的时候,排出按照体积40~60%的发酵液,补入同等体积的新鲜培养基;以及,在发酵进行到140~160小时的时候,排出按照体积15~35%的发酵液,同时补入同等体积的新鲜培养基;或(b)从发酵进行到70~90小时起,通过流加的方式补入磷酸盐溶液;以及,从发酵进行到110~130小时起,通过流加的方式补入包含磷酸盐以及金属盐的溶液,所述金属包括:fe、cu、mn、zn、mg。上述的两种操作分别从“减菌加料”和后期补盐作为出发点,进行发酵工艺的优化。作为本发明的优选方式,所述的磷酸盐溶液包括:kh2po415±5g/l,较佳地为15±2g/l;以及(nh4)h2po48.4±2g/l,较佳地为8.4±1g/l。在此基础上,控制合适的流加速率。优选地,流加磷酸盐的速率为1±0.3g/min,较佳地为1±0.2g/l。作为本发明的优选方式,所述的包含磷酸盐以及金属盐的溶液包括:kh2po415±5g/l,较佳地为15±2g/l;(nh4)h2po48.4±2g/l,较佳地为8.4±1g/l;柠檬酸·2h2o15±5g/l,较佳地为15±2g/l;feso4·7h2o3.5±1g/l,较佳地为3.5±0.5g/l;cuso4·5h2o1±0.3g/l,较佳地为1±0.1g/l;mnso41±0.3g/l,较佳地为1±0.1g/l;znso4·7h2o1±0.3g/l,较佳地为1±0.1g/l;mgso4·2h2o13±3g/l,较佳地为13±1g/l。优选地,流加包含磷酸盐以及金属盐的溶液的速率为1±0.3g/min,较佳地为1±0.2g/l。上述的补盐配方配合本发明的发酵操作过程,为菌体生长以及青霉素的生产提供了良好的营养环境基础。本发明的方法中,可以采用常规的青霉素发酵培养基进行产黄庆霉素的培养。作为本发明的优选方式,所述的发酵培养基含有:柠檬酸,玉米浆,feso4·7h2o,cuso4·5h2o,mnso4,znso4·7h2o,mgso4·2h2o,na2so4,(nh4)2so4,kh2po4,玉米蛋白粉,caco3,玉米油。这一培养基配方配合本发明的发酵操作过程,为菌体生长以及青霉素的生产提供了良好的营养环境基础。在发酵的过程中,为了满足菌体生长以及生产所需,发酵过程中还进行补料,补料液含有:葡萄糖,苯乙酸、硫酸铵,氨水。整个过程中一直采用流加的方式补加该补料液。在发酵的过程中ph、温度以及罐压等条件,可以采用本领域中常用的产黄青霉菌培养的条件。作为本发明的优选方式,ph在6.5±0.2,温度25±1℃,罐压0.08±0.01mpa。尽管“减菌加料”会造成大量具有较强青霉素合成能力的菌体流失,造成浪费。但是,令人出乎意料的是,通过该操作后,后期“减菌加料”工艺在发酵250h后仍具有较高的青霉素合成速率,后期补盐工艺中发酵终末青霉素总产量、菌体对糖得率以及产物对糖得率分别较原始工艺提高了42%、27%和22%(图3、图6a、图6b)。对细胞代谢途径及菌体形态等的进一步探讨表明,发酵过程中包括磷源及金属离子在内的与菌体生长相关的痕量营养物质的不足可能是导致传统工艺中发酵效率中后期显著降低的主要原因,菌株自身的发酵效率潜力依旧可以挖掘。传统青霉素发酵周期约为150小时,至菌丝自溶前发酵单位基本达到最高时放罐产量得率最大。通常在发酵至150小时后菌体形态开始发生明显变化,包括菌体对于糖的利用度、菌量合成以及发酵液流变特性都随之发生变化,并且此阶段青霉素合成速率快速降低。所以在发酵后期遏制菌体自溶,尽可能维持高产物合成速率与产率对提高整体发酵经济效益至关重要。本发明通过在青霉素补料分批发酵中后期进行“减菌加料”操作和额外补加金属盐溶液以及磷酸盐溶液,研究发酵液环境的改变对青霉素合成的影响。指出传统发酵工艺后期青霉素产率降低的主要原因是发酵液内供菌体生长代谢的营养物质的缺乏和有毒代谢物质的积累。“减菌加料”和补盐操作可以有效的缓解这一问题,这为青霉素发酵工艺的优化提供了新思路,对青霉素的工业生产起到指导作用。对于青霉素发酵这一已经进行多年的工艺而言,本发明的方法可以如此显著地提高青霉素产量,这是出乎意料的。下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件如j.萨姆布鲁克等编著,分子克隆实验指南,第三版,科学出版社,2002中所述的条件,或按照制造厂商所建议的条件。材料与方法菌种产黄青霉菌pl221819。主要仪器及软件30l、50l高级生物反应器(上海国强);lc-20a高效液相色谱仪(agilent);c18色谱柱(5μm,250mm×4.6mm,thermo);biostar在线监控软件(华东理工大学);dp-25显微镜(olympus);shi-d(ⅲ)型循环水式真空泵(上海瑞兹)。初始培养基组分及补料液组分一级种子罐培养基:玉米浆140ml/l蔗糖30g/l(nh4)2so43.6g/lcaco34.4g/l玉米油1ml/l消泡剂0.5ml/l二级种子罐、三级发酵初始培养基(发酵培养基):柠檬酸·2h2o1.6g/l玉米浆10ml/lfeso4·7h2o0.13g/lcuso4·5h2o0.002g/lmnso40.02g/lznso4·7h2o0.02g/lmgso4·2h2o2.5g/lna2so43.5g/l(nh4)2so41.5g/lkh2po43.1g/l玉米蛋白粉1.6g/lcaco32.6g/l玉米油0.4ml/l消泡剂0.04ml/l二、三级发酵过程补料料液成分(w/w):葡萄糖70%苯乙酸35%硫酸铵28%氨水17%菌浓测定测细胞干重法确定菌浓(kleijnrj等,cytosolicnadphmetabolisminpenicillin-gproducingandnon-producingchemostatculturesofpenicilliumchrysogenum[j].metabolicengineering,2007,9(1):112)。每个取样点重复测定三次取平均值。青霉素浓度、苯乙酸浓度测定原始发酵液样品离心取上清后按预估样品浓度稀释,使用高效液相色谱法(christensenlh,mandrupg,nielsenj,etal.arobustliquidchromatographicmethodformeasurementofmediumcomponentsduringpenicillinfermentations[j].analyticachimicaacta,1994,296(1):51-62)检测样品中青霉素g、苯乙酸浓度。实施例1、产黄青霉补料分批发酵本实施例中,利用传统的产黄青霉补料分批发酵工艺进行发酵。米孢子(小米孢子,将菌体孢子培养在小米上获得,可直接用于接种)在火焰保护下接种到30l一级发酵罐,发酵体积为20kg。一级种子罐不进行ph调控,待ph由下降转为升高时移入50l二级种子罐。二级种子罐发酵体积30l,开始增加过程补料。由于补入苯乙酸,二级种子罐中菌体已经开始分化并合成青霉素。当二级种子罐中青霉素效价达到10000u/ml时移入三级发酵罐,以保证接入三级发酵的高菌量和菌体分化特性。三级发酵体积为30l,整个发酵过程使用氨水控制ph在6.5,温度25℃,罐压0.08mpa。使用质谱仪监测发酵过程中尾碳、尾氧浓度,并通过biostar软件在线监测our、cer、rq、ph、do、温度等。发酵过程中,每8小时取样一次,检测菌浓、青霉素浓度、paa浓度。经过二级发酵,终末青霉素浓度达到10000u/ml,此时总发酵周期约为110小时(其中一级发酵70小时,二级发酵40小时)。在三级发酵初期流加补入葡萄糖、苯乙酸、氨水及硫酸铵溶液,发酵44h后发酵质量达到35kg,并在随后开始以8小时为周期通过带放操作(该操作一般每次放出按照体积6%-8%的发酵液)维持体积在34-35kg。发酵过程中菌体干重及青霉素浓度变化如图1,可见发酵至中期,即发酵100h(三级发酵后100h)以后,青霉素浓度增长速率变缓,在164h达到峰值,随后开始快速下降。此时成青霉素的合成速率已经低于其在发酵液中分解的速率,至188h放罐时较最高值下降了约16%。并且,在发酵后期菌体浓度出现轻微的下降,可能也是导致青霉素浓度降低的原因。上述实验中,不同发酵阶段对应的一些参数(比青霉素合成速率及得率对比)列于表1中。表1其中,标准化的qpeng含量是在每一时间点的比青霉素生产速率/本发酵过程最大比青霉素生产速率(specificpenicillinproductionratesateachtimepoint/themaximumspecificpenicillinproductionrates)。由该表可看出,在发酵后期比青霉素合成速率(qpeng)已经降为负值,且菌体对葡萄糖得率(yx/glu)、产物对葡萄糖得率(ypeng/glu)以及产物对苯乙酸得率(ypeng/paa)出现不同程度的下降。结合菌浓及青霉素浓度的变化情况,说明在发酵后期菌体的生长及代谢均受到了严重的影响。发酵后期青霉素浓度的降低一方面是到菌体自溶,菌浓降低导致,另一方面则与菌体合成青霉素能力下降有关,底物葡萄糖的消耗可能更多地被用于与青霉素合成无关的代谢途径中去,另外也可能是后期发酵液中营养物质的不足和有毒代谢物的过度积累。实施例2、发酵过程中进行“减菌加料”或补盐对于发酵的影响在实施例1的基础上,本发明人探索了各种发酵条件、菌体培养条件、培养基等方方面面的改进,以期找到最为有效的改进生产工艺的方法。研究结果发现,在发酵的适当时期进行至少一次的“减菌加料”,或在合适的时间点进行合适的补盐,有利于改善青霉素生产菌的菌体的生长条件,提高发酵效率。1、“减菌加料”操作每次“减菌加料”操作为放出一定质量的发酵液并一次性补入等量的初始培养基。在“减菌加料”操作中,发酵至90小时(三级发酵起的90小时)进行第一次“减菌加料”操作,即放出约50%发酵体积(15kg)的发酵液,并同时补入等量的新鲜培养基。发酵150h进行第二次“减菌加料”,“减菌加料”量为约25%发酵体积(7.5kg)。其它的发酵过程操作条件同实施例1的方法。也即:在发酵进行到90及150小时(三级发酵起的90小时、150小时)时分别进行两次“减菌加料”操作,体积分别为15kg及7.5kg。所有“减菌加料”后的补糖的控制依据均以生物量的实际稀释倍数为准,即若“减菌加料”后发酵液稀释率为原液的70%,则当前“减菌加料”后补糖速率为“减菌加料”前补糖速率的70%。“减菌加料”放掉的发酵液中生成的青霉素计入整个发酵过程的青霉素总量中。如图2,与实施例1的发酵结果比较,增加了“减菌加料”的过程后,发酵周期得到了显著延长。在发酵264h(三级发酵起的264小时)放罐时,产物浓度依旧能够保持快速增长的趋势,说明菌体仍然保持着很强的青霉素合成能力。“减菌加料”操作尽管大量减少和降低了罐内的总菌体量以及青霉素浓度,但同时也稀释了可能的胞外有毒物质的积累。加之新鲜培养基的补入,使得菌体能够维持正常生长以及较高青霉素合成速率。2、补盐操作补盐操作大致流程为:发酵至80-120h,流加补入磷酸盐溶液,120h之后增加金属盐溶液的补入。从发酵进行到80小时开始,通过流加方式连续补入磷酸盐溶液,其配方为:kh2po415g/l;(nh4)h2po48.4g/l,磷酸盐补料速率为1g/min。120h至发酵结束,在补入的料液中加入包括磷酸盐在内的其他金属盐类,具体包括:柠檬酸·2h2o15g/l、feso4·7h2o3.5g/l、cuso4·5h2o1g/l、mnso41g/l、znso4·7h2o1g/l、mgso4·2h2o13g/l(补料液中kh2po415g/l;(nh4)h2po48.4g/l用量不变,磷酸盐补料速率不变)。如图2,与实施例1的发酵结果比较,增加了发酵后期补盐的过程后,发酵周期得到了显著延长。在发酵200h(三级发酵起的200小时)左右效价才开始降低,且降低趋势缓慢,整个有效发酵周期比传统实验延长了50小时以上。3、青霉素累计总产量图3为单批次青霉素累计总产量,可以看出在170h后,传统实验(实施例1的方法)青霉素总量开始下降,而“减菌加料”和后期补盐操作在170h处仍在继续增加,并在之后很长时间内保持这一趋势。至188h,传统实验发酵终止,此时“减菌加料”操作和后期补盐操作中青霉素总量较传统实验分别高出17.46%和28.46%。由于“减菌加料”和后期补盐操作均能够显著地延长发酵时间,因此在“减菌加料”处理的发酵过程终止时,整体产量及单位时间产量提高了67.8%和33.2%,如图3和图2,这一产量的显著提高是非常令人意外的。根据图3,后期补盐工艺中发酵终末青霉素总产量较对照实验提高42%,该数值即后期补盐实验发酵终末230h对比传统工艺发酵终末188h处的青霉素总量的提高百分比。4、qpeng的变化情况图4反映了三组实验在整个发酵过程中qpeng的变化情况。三组实验qpeng均在50-100h之间达到最大值,随后传统实验(实施例1的方法)和后期补盐操作qpeng开始下降,但后期补盐操作的下降速率更加缓慢,且直至发酵结束始终高于传统实验,说明发酵后期补入的盐溶液对维持青霉素继续合成起到了显著效果。而“减菌加料”操作整个发酵过程中qpeng均高于其他两组实验值,且并未出现明显下降,可见“减菌加料”操作使发酵液质量得到了巨大的改善,不仅通过补加新鲜培养基稀释发酵液给菌体提供了更好的生长代谢环境,也利用带放操作去除了培养液中可能积累的有害物质,使其能够长时间维持较强的青霉素合成能力。实施例3、后期“减菌加料”和后期补盐工艺对产黄青霉菌丝形态的影响青霉素的合成与菌丝形态之间存在密切关系,菌丝分化形成孢子阶段也是产物快速合成时期。要使细胞分化和生长朝着有利于次级代谢产物的积累方向发展,必须要有足够数量的菌丝体并能长期维持下去,才能使次级代谢产物的产量提高。本发明人观察到,发酵后期,菌丝体逐渐形成膨大的短杆状或球状的异化菌丝,这种异化菌丝的青霉素合成能力下降,对发酵有不利影响。如图5,a、c、e分别为发酵24h三组实验细胞形态,b、d、f分别为发酵152h三组实验细胞形态。可见发酵前期菌体均呈细长丝状,各组之间无明显差异;发酵至152h,传统工艺菌体异化现象严重,而两个实验组则具有较好的菌丝形态。实施例4、后期“减菌加料”和后期补盐工艺对菌体及产物得率的影响对发酵过程中菌体和产物得率进行计算,结果如图6图。图6a中,三组实验在发酵前期菌体对糖得率迅速下降,100h后开始趋于稳定,说明后期菌体生长变慢,细胞代谢活动开始逐渐转变为以合成产物为主。150h开始,实验组菌体对糖得率稍稍高于传统工艺组,验证了“减菌加料”和后期补盐操作对菌体生长起到了积极作用。从产物对糖率(图6b)和产物对苯乙酸得率(提6c)可以明显看出,发酵前期三组实验的得率基本相同,均呈增长趋势,并在100h左右达到最大值。随后,传统工艺得率降低,后期补盐操作虽然也开始下降,但其下降速率远低于传统工艺。而“减菌加料”操作则在整个发酵过程中均能保持产物对糖得率在最高值,发酵250h之后仍未降低,且产物对苯乙酸得率基本维持在100%左右。说明发酵中后期两次“减菌加料”操作给产黄青霉菌的合成代谢提供了更好的环境,提高了菌体对底物及前体的利用率,确保底物及前体最大限度的参与到青霉素合成相关的次级代谢中。两批实验组的对比发现,“减菌加料”操作组较后期补盐操作组对抑制发酵后期菌体老化,促进产物合成有更优秀的效果。本发明人认为,这是由于“减菌加料”操作不仅一次性补入菌体生长需要的其他营养物质,同时还放掉大量的原发酵液,降低了发酵液内有毒代谢物的浓度。而“减菌加料”后仍进行正常的带放操作,则保证了在相当长时间内,发酵液都能给菌体提供良好的代谢环境,维持青霉素合成能力在较高水平。实施例5、不同工艺操作下产黄青霉菌代谢分析霉素合成途径图7。青霉素的产率与初级代谢具有密切关系,初级代谢对青霉素合成的限制主要体现在三个方面:三个氨基酸前体(α-氨基己二酸,缬氨酸和半胱氨酸)的合成、nadph和atp的供应。初级代谢中氨基酸和辅助因子的大量合成有利于提高青霉素的产量;另外,青霉素合成过程中需要消耗大量的nadph用于还原硫酸根中的硫元素至半胱氨酸中的巯基,acv合成酶在利用氨基酸前体合成acv的过程中需要消耗大量的atp,菌体生长受限可能导致atp及nadph的供给不足。所以,保证活跃的中心碳代谢对青霉素发酵具有重要作用。“减菌加料”操作和发酵后期补盐操作为青霉素初级代谢提供了充足的营养物质,能够维持发酵后期菌体的正常生长,使得青霉素的合成速率保持较高水平。在青霉素的发酵过程中,一些代谢物的积累也会对青霉素合成造成不利影响。高浓度的赖氨酸对其合成途径的高柠檬酸合酶具有反馈抑制作用,最终影响α-氨基己二酸的合成,同时对三肽合成酶具有直接的抑制作用。另一方面,半胱氨酸、谷氨酸与甘氨酸能够在相关酶催化下合成谷胱甘肽。谷胱甘肽作为一种acv类似物,可能抑制异青霉素n合成酶(ipns)的活性。前期研究表明ipns是青霉素合成的主要限速酶之一,因此谷胱甘肽在胞内/胞外的逐渐积累会抑制青霉素合成途径的酶活性,从而降低其合成速率。本发明的“减菌加料”操作,解除了高浓度的有毒代谢物对青霉素合成的抑制作用。发酵后期补盐操作由于额外增加了补料量,使得发酵后期的稀释率得到提高,一定程度上缓解了有毒代谢物的积累,使得青霉素的合成速率得以维持。结论在产黄青霉菌补料分批发酵的传统工艺中,存在青霉素合成速率过早下降的问题。本发明通过在发酵中后期进行两次“减菌加料”操作有效地缓解了这一现象的发生,使青霉素合成速率始终维持在较高水平,发酵周期较传统工艺延长了近一倍,整体产量及单位时间产量提高了67.8%和33.2%。发酵后期额外补加磷酸盐及其他金属离子,也能在比较显著地缓解青霉素合成速率的下降,对提高青霉素总产量、延长发酵时间起到积极作用。在本发明提及的所有文献都在本申请中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1