抗人雄激素受体剪接变异体7的单克隆抗体及其应用的制作方法
本发明涉及分子生物学领域,具体涉及了一种抗人雄激素受体剪接变异体7的单克隆抗体及其应用。
背景技术:
前列腺癌是泌尿系统常见的恶性肿瘤之一,在全球范围内其发病率居男性恶性肿瘤的第2位,死亡率居第5位。雄激素受体(androgenreceptor,ar)在被雄激素激活后,可与细丝蛋白a相互作用,增强了细胞的运动性,这可能与前列腺癌的侵袭转移有关,其在前列腺癌的发生发展过程中起着重要的作用。因此,ar是前列腺癌诊断中的重要标记物。
在晚期前列腺癌的治疗过程中,常使用雄激素剥夺疗法,但这种方法会导致癌细胞产生耐药,从而发展为去势抵抗性前列腺癌(castration-resistantprostatecancer,crpc)。有研究表明,前列腺癌细胞及crpc的发生发展,均与ar信号通路的再活化有关。其中,雄激素受体剪接变异体7(androgenreceptorsplicevariant7,ar-v7)是雄激素受体剪接变异体的一种,结构与ar类似,但其缺乏雄激素配体结合域,可以不依赖雄激素而持续活化。ar-v7在ar信号通路的再活化中起关键作用,进一步解释了前列腺癌治疗过程中对化疗药物产生抗药性的原因,ar-v7的表达水平还反应了患者对治疗前列腺癌的化学治疗的耐药性差异以及化学药物对前列腺癌的治疗效果。因此,有必要寻求一种能够稳定、便捷的特异性检测ar-v7的方法。
技术实现要素:
基于此,本发明的目的在于提供一种可以特异性识别ar-v7的单克隆抗体。
为了实现上述目的,提供具体技术方案如下:
一种特异性结合人ar-v7的抗体,所述抗体为使用ar-v7多肽片段作为免疫原,制备得到的且能与ar-v7特异性结合的单克隆抗体;所述ar-v7多肽片段的氨基酸序列组成如seqidno.3所示
在其中一些实施例中,上述抗体的制备方法包括以下步骤:
(1)将seqidno.3多肽片段免疫小鼠;
(2)将免疫后的小鼠脾细胞与sp2/0骨髓瘤细胞融合,得到杂交瘤细胞;
(3)由所述杂交瘤细胞分泌后、分离纯化,即得。
在其中一些实施例中,上述抗体的制备方法包括以下步骤:
(1)将seqidno.3多肽片段免疫小鼠;
(2)将免疫后的小鼠脾细胞与sp2/0骨髓瘤细胞融合;
(3)使用hat选择培养基筛选获得分泌抗人ar-v7的阳性杂交瘤细胞;
(4)使用有限稀释法对获得的阳性细胞株进行克隆,得到产生高效价的抗人ar-v7单克隆抗体杂交瘤细胞;
(5)由所述高效价的抗人ar-v7单克隆抗体杂交瘤细胞分泌后、分离纯化,即得。
在其中一些实施例中,上述制备方法包括以下步骤:
(1)选择并制备得到氨基酸序列为seqidno.3的多肽片段;
(2)将seqidno.3多肽片段免疫小鼠;
(3)将免疫后的小鼠脾细胞与sp2/0骨髓瘤细胞融合,得到杂交瘤细胞;
(4)使用hat选择培养基筛选获得分泌抗人ar-v7的阳性杂交瘤细胞;
(5)使用有限稀释法对获得的阳性细胞株进行克隆,得到产生高效价的抗人ar-v7单克隆抗体杂交瘤细胞;
(6)向balb/c小鼠进行腹腔注射上述杂交瘤细胞,取腹水;
(7)采用proteing亲和层析法从上述腹水中分离、纯化得到特异性结合人ar-v7的抗体。
本发明还提供一种高稳定性抗体试剂,包括由抗体稳定剂稀释的上述抗体,所述抗体稳定剂选自:biostabantibodystabilizer,sigma-55514。
在其中一些实施例中,上述高稳定性抗体试剂中,抗体的浓度为1-2μg/ml。
本发明的另一目的是提供一种上述单克隆抗体的应用。具体技术方案如下:
上述高稳定性抗体试剂在制备检测人ar-v7的免疫组化试剂盒中的应用。
本发明的另一目的在于提供一种检测人ar-v7的免疫组化试剂盒。
为实现上述目的,具体技术方案如下:
一种检测人ar-v7的免疫组化试剂盒,该免疫组化试剂盒包括有上述抗体或上述高稳定性抗体试剂。
在其中一些实施例中,上述检测人ar-v7的免疫组化试剂盒还包括hrp-羊抗小鼠igg工作液和dab显色液。
在其中一些实施例中,上述检测人ar-v7的免疫组化试剂盒还包括内源性过氧化物酶阻断剂、封闭液和抗体稀释液。
本发明的另一目的在于提供一种上述免疫组化试剂盒的应用,具体技术方案如下:
上述免疫组化试剂盒在制备预测前列腺癌治疗效果的产品中的应用。
本发明提供的抗人ar-v7单克隆抗体及其应用具有如下优点和效果:
本发明所述抗人ar-v7单克隆抗体,是根据ar、ar-v7及ar其他剪接变异体序列的异同点,针对人ar-v7设计并制备的,其能够特异性识别并ar-v7,且不与ar及其它ar简介变异体结合,具有高度特异性。
本发明还提供了ar-v7单克隆抗体在制备检测前列腺癌的ar-v7免疫组化试剂盒中应用,即提供了一种检测组织或细胞中ar-v7的免疫组化试剂盒,该试剂盒中的抗体由sigmaantibody-stab稳定剂稀释至1-2μg/ml,该浓度即为工作浓度,无需在使用时稀释,使用方便;同时,可在室温下存放较长时间仍具有特异性结合ar-v7的活性,具有稳定性。
本发明所述试剂盒,一方面其包含的单克隆抗体能够特异性识别ar-v7,提供了一种ar-v7的检测方法,另一方面对免疫组化检测ar-v7时所需试剂进行了整合,使ar-v7的免疫组化检测更直观、更方便快捷。
附图说明
图1是实施例3中使用抗人ar-v7免疫组化试剂盒对前列腺癌组织检测的结果图;
图2是实施例4使用抗人ar-v7免疫组化试剂盒对vcap细胞及pc3细胞片的免疫组化检测的结果图;
图3是实施例5使用抗人ar-v7免疫组化试剂盒对vcap细胞及h1975细胞片的免疫组化检测
图4是实施例6中pbs稀释的ar-v7单克隆抗体作为一抗用于免疫组化实验染色结果;
图5是实施例6中sigmabiostabantibodystabilizer稀释的ar-v7作为一抗用于免疫组化实验结果染色结果;
图6是实施例6中antibodystabilizerpbs稀释的ar-v7作为一抗用于免疫组化实验结果染色结果;
图7是实施例6中
图8是实施例7中vcap细胞的免疫组化染色结果;
图9是实施例7中pc3细胞的免疫组化染色结果。
具体实施方式
根据下述实施例,可以更好地理解本发明。然而,本领域技术人员容易理解,实施例所描述的内容仅用于说明本发明,并不限制本发明地范围。
实施例1
根据对比表达ar、ar-v7及其它ar剪接变异体的mrna序列,得到ar-v7的特异性mrna序列cds区的结果,从而从ar-v7全序列seqidno.1中,选取seqidno.2,合成抗原决定簇多肽片段,所述序列如下:
seqidno.1:
mhhhhhhevqlglgrvyprppsktyrgafqnlfqsvreviqnpgprhpeaasaappgaslllqqqqqqqqqqqqqqqqqqqqqqqqqqqqqetsprqqqqqqgedgspqahrrgptgylvldeeqqpsqpqsalechpergcvpepgaavaaskglpqqlpappdeddsaapstlsllgptfpglsscsadlkdilseastmqllqqqqqeavsegsssgrareasgaptsskdnylggtstisdnakelckavsvsmglgvealehlspgeqlrgdcmyapllgvppavrptpcaplaeckgsllddsagkstedtaeyspfkggytkglegeslgcsgsaaagssgtlelpstlslyksgaldeaaayqsrdyynfplalagpppppppphphariklenpldygsawaaaaaqcrygdlaslhgagaagpgsgspsaaassswhtlftaeegqlygpcgggggggggggggggggggeagavapygytrppqglagqesdftapdvwypggmvsrvpypsptcvksemgpwmdsysgpygdmrletardhvlpidyyfppqktclicgdeasgchygaltcgsckvffkraaegkqkylcasrndctidkfrrkncpscrlrkcyeagmtlgekfrvgnckhlkmtrp
seqidno.2:ekfrvgnckhlkmtrp
采用常见方法,如多肽合成仪,制备得到如seqidno.2序列的多肽。
实施例2
将实施例1制备得到的抗原决定簇多肽片段(aa1)与钥孔血蓝蛋白(klh载体蛋白)连接,形成偶联蛋白aa1-klh-aa(简称偶联蛋白)。并使用该偶联蛋白作为抗原免疫动物,制备ar-v7特异性单克隆抗体。所述钥孔血蓝蛋白的作用为增强如seqidno.2序列的多肽的免疫原性。
1、动物免疫:将偶联蛋白与弗氏佐剂等量混合充分乳化后注射3只balb/c小鼠,每只小鼠25μg,共免疫3次,间隔时间15天。
2、细胞融合、选择性培养、筛选:融合前3天,小鼠腹腔注射无佐剂偶联蛋白25μg,取出免疫小鼠的脾脏细胞,将2.0×107个sp2/0骨髓瘤细胞与2.0×108个经步骤(1)免疫的balb/c小鼠的脾细胞混匀,离心,弃上清,轻微振荡混匀,于37℃水浴中,在90秒内滴加1ml体积浓度为50%的peg-1500水溶液,然后滴加20mldmem培养基,离心,弃上清,再洗一次,离心,弃上清,得到杂交瘤细胞。使用hat选择培养基在96孔细胞培养板上选择杂交瘤细胞,镜下检测总融合率>95%。镜下选择单克隆细胞孔的上清进行检测,挑取od450>0.8的孔内细胞进行亚克隆,最终获得对ar-v7反应阳性率>99%的细胞克隆,作为分泌抗人ar-v7单克隆抗体的杂交瘤细胞株。
3、细胞克隆:对获得的阳性细胞株进行克隆,使用有限稀释法,克隆3次,最后得到产生高效价的抗人ar-v7单克隆抗体杂交瘤细胞系7株,扩大培养,冻存。
4、腹水制备:6-8周龄雌性balb/c小鼠用石蜡油处理10天后,取杂交瘤细胞以2×106个细胞/只进行腹腔注射。10天后从小鼠腹腔中获取富含抗体的腹水,测定腹水效价>105。
5、纯化鉴定:采用proteing亲和层析法。首先制备proteing亲和层析柱,用pbs平衡柱子后,取腹水过柱,然后用pbs清洗柱子,至od值接近于零,以50nmol/l的甘氨酸盐酸盐溶液洗脱,收集洗脱液,测定各收集管的od值,保留峰值区的洗脱液,洗脱液经透析后收集。经sds-page电泳鉴定为纯化的单克隆抗体,纯度为98%以上。经测定,ar-v7抗体浓度为6.02mg/ml。
实施例3:抗人ar-v7单克隆抗体免疫组化试剂盒用于前列腺癌组织检测
本实施例提供一种免疫组化试剂盒及其应用,该试剂盒包括如下试剂:
内源性过氧化物酶阻断剂,3%(v/v)的h2o2溶液,保存于2-8℃;
封闭液,磷酸盐缓冲液pbs作为溶剂配制的5%(w/v)牛血清白蛋白(bsa)溶液;
抗ar-v7单克隆抗体,由实施例2所述方法制备得到,由pbs稀释至1mg/ml后,用sigmabiostabantibodystabilizer稳定剂稀释至1μg/ml,保存于2-8℃;
hrp-羊抗小鼠igg工作液,购买于迈新生物技术开发有限公司;
20×dab显色液a,购买于迈新生物技术开发有限公司;
20×dab显色液b,购买于迈新生物技术开发有限公司;
dab缓冲液,购买于迈新生物技术开发有限公司。
所述试剂盒的检测原理如下:利用免疫学抗原与抗体基于两者分子间的结构互补性和高度亲和性能够特异性结合,通过氧化还原反应使标记抗体的酶显色剂显色来确定组织细胞内抗原,对其进行定位、定性。
首先是连接ar-v7单克隆抗体和组织上的ar-v7抗原;
第二是hrp-羊抗小鼠igg聚合物识别已经连接上的ar-v7单克隆抗体;
第三是加入显色底物,聚合物上的辣根过氧化物酶可以催化dab显色液中的h2o2分解,使联苯胺氧化成联苯亚胺,从而使组织切片中抗原位点上显现黄色或棕黄色着色;
最后对样本进行复染和封片。
通过显微镜观测显色情况,推断组织切片上ar-v7的存在位点和情况。
从医院病理科获取已被诊断为前列腺癌的组织甲醛固定石蜡包埋的组织切片两张,一张作为阴性对照,一张使用本实施例所述试剂盒用于检测ar-v7蛋白表达。
1、脱蜡水化
1)将待检测的前列腺癌的石蜡组织切片60℃烤片30分钟后,置于二甲苯中浸包3次,每次10分钟;
3)置于无水乙醇中浸泡2次,每次5分钟;
4)依次置于95%、85%、70%乙醇中浸泡,各5分钟;
5)置于蒸馏水中浸泡5分钟;
6)pbs冲洗2次,每次3分钟。
2、抗原修复
将玻片置于煮沸的1mmedta抗原修复溶液中(ph=9.0),微波炉中低火加热10min,自然冷却至室温。
注意抗原修复时修复液的量必须保证切片始终浸泡在液体内,加热完冷却至室温过程中切片必须始终保持在液体内,不可将切片取出在空气中冷却。
3、阻断内源性过氧化物酶
1)将抗原修复后的组织切片用pbs冲洗3次,每次5分钟;
2)取出切片,甩掉并擦干组织周围液体,免疫组化笔圈定切片上的待测组织区域;
3)在组织区域内加入100~200μl内源性过氧化物酶阻断剂,室温孵育10分钟;
4)pbs溶液冲洗3次,每次5分钟。
4、封闭:
在组织待测区域上滴加封闭液,至覆盖待测区域,室温放置30min后,甩去多余液体。
5、ar-v7抗体孵育
1)去除pbs溶液,加入100μl抗ar-v7单克隆抗体,阴性对照组织切片加入pbs溶液,室温孵育60分钟;
2)pbs溶液冲洗3次,每次5分钟。
6、酶标聚合物孵育
1)去除pbs溶液,加入100μlhrp-羊抗小鼠igg工作液,室温孵育20分钟;
2)pbs溶液冲洗3次,每次5分钟。
7、显色
dab显色液的配制:在小试管中依次滴加dab缓冲液1ml,20×dab显色液a50-100μl,20×dab显色液b50-100μl,以配制dab显色液,混匀,避光。
去除pbs溶液,加入100~200μl新鲜配制好的dab显色液,室温下避光孵育3-10分钟;显色完后,蒸馏水冲洗样本终止显色。
如有必要,可进行苏木素复染。
自来水冲洗,加100~200μl苏木素体细胞染色液孵育10~30秒;pbs溶液或自来水冲洗返蓝。
注意:依据作用的苏木素染色液的强度和孵育时间的长短:对比染色结果导致细胞核呈现淡蓝到深蓝颜色的反应,而过染或是不足染色都有可能危及正确结果的判断。
8、脱水、透明、封片
1)置95%乙醇中,浸泡3分钟;
2)置无水乙醇中,浸泡3分钟;
3)二甲苯透明;
4)中性树胶和盖玻片封片。
9、生物显微镜阅片及结果判断
结果判断标准如下:
阳性:组织切片中特定细胞的细胞膜核上有黄色或棕黄色着色,且无非特异性的背景染色;
阴性:组织内预期细胞中未见黄色或棕黄色着色。
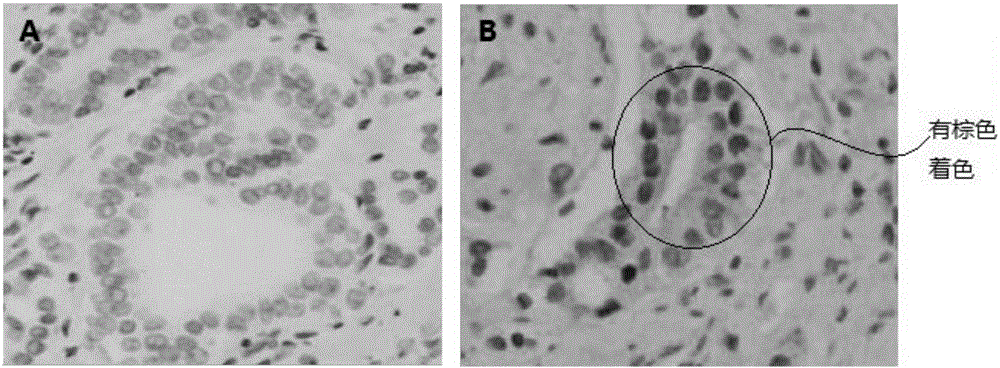
染色结果见图1,图1a为阴性对照,图1b为ar-v7单克隆抗体免疫染色结果(ar-v7着色为棕色着色部分)。可以看到在图1阴性对照中无任何棕色着色,只有蓝色着色,表明实验体系没有问题,可有效避免非特异性背景着色即假阳性。图1b中棕色部分即为阳性着色,ar-v7主要表达在肿瘤组织肿瘤细胞的细胞核中,并且可以看到棕色着色大部分覆盖蓝色的细胞核分布。而正常的免疫细胞中则没有ar-v7着色,是正常的阴性结果,同样没有出现假阳性和假阴性。表明ar-v7呈特异性分布在前列腺癌组织肿瘤细胞胞核中,呈强阳性着色分布。
实施例4:利用免疫组织化试剂盒对前列腺癌细胞系vcap细胞及pc3细胞片的免疫组化检测
以培养的前列腺癌细胞系vcap和pc3为检测样本,使用实施例3所述免疫组化试剂盒,按以下方法进行免疫组化检测:
1、固定、涂片:加入4%(v/v)多聚甲醛溶液,室温放置15分钟,蒸馏水洗涤3次;细胞悬液涂在防脱载玻片上,60℃烤片1h,pbs洗涤3次。
2、抗原修复
将玻片置于煮沸的1mmedta抗原修复溶液中(ph=9.0),微波炉中低火加热10min,自然冷却至室温。
注意抗原修复时修复液的量必须保证切片始终浸泡在液体内,加热完冷却至室温过程中切片必须始终保持在液体内,不可将切片取出在空气中冷却。
3、阻断内源性过氧化物酶
1)将抗原修复后的组织切片用pbs冲洗3次,每次5分钟;
2)取出切片,甩掉并擦干组织周围液体,免疫组化笔圈定切片上的待测组织区域;
3)在组织区域内加入100~200μl内源性过氧化物酶阻断剂,室温孵育10分钟;
4)pbs溶液冲洗3次,每次5分钟。
4、ar-v7抗体孵育
1)去除pbs溶液,加入1μg/ml的100μlar-v7抗体试剂,室温孵育60分钟;
2)pbs溶液冲洗3次,每次5分钟。
5、酶标聚合物孵育
1)去除pbs溶液,加入100μlhrp-羊抗小鼠igg工作液,室温孵育20分钟;
2)pbs溶液冲洗3次,每次5分钟。
6、显色
去除pbs溶液,加入100~200μl新鲜配制好的dab显色液,室温下避光孵育3-10分钟;显色完后,蒸馏水冲洗样本终止显色。
如有必要,可进行苏木素复染。
自来水冲洗,加100~200μl苏木素体细胞染色液孵育10~30秒;pbs溶液或自来水冲洗返蓝。
注意:依据作用的苏木素染色液的强度和孵育时间的长短:对比染色结果导致细胞核呈现淡蓝到深蓝颜色的反应,而过染或是不足染色都有可能危及正确结果的判断。
7、脱水、透明、封片
1)置95%乙醇中,浸泡3分钟;
2)置无水乙醇中,浸泡3分钟;
3)二甲苯透明;
4)中性树胶和盖玻片封片。
8、待中性树脂凝固后,显微镜下观察切片染色效果。
染色结果见图2,图2a为阴性对照,图2a为使用实施例5所述试剂盒对pc3细胞的免疫组化实验结果,其中着色部分为蓝色,无棕色着色,图2b为对vcap细胞中的免疫组化结果,其中可见明显棕色着色部分。因pc3细胞中表达ar,但无表达ar-v7,而vcap细胞中高表达ar-v7,故本实验结果表明,本发明提供的ar-v7抗体及其免疫组化试剂盒,对ar-v7具有高度特异性,可有效避免非特异性背景着色,即假阳性结果。
实施例5利用免疫组织化试剂盒对vcap细胞及h1975细胞片的免疫组化检测
以培养的前列腺癌细胞系vcap和肺腺癌细胞h1975为样本,采用与实施例4相同的步骤,使用实施例3所述的试剂盒对vcap和h1975细胞进行免疫组化检测。
结果如图3所示,图3a为h1975细胞片的免疫组化结果图,着色呈蓝色,即ar-v7抗体呈阴性。图3b为vcap细胞的免疫组化实验结果图,着色层较深棕色,即ar-v7抗体呈阳性。ar-v7在前列腺癌细胞株vcap中高表达,而在肺癌细胞株h1975中不表达,因此可见本发明所述的抗ar-v7单克隆抗体及免疫组化试剂盒具有高度特异性,在其他癌细胞中未出现假阳性结果。
实施例6:抗体稳定剂对抗体稳定性影响研究
用磷酸盐缓冲液(pbs)将实施例2制备得到的6.08mg/ml抗体,稀释为1mg/ml后,用sigma的biostabantibodystabilizer(55514)、candorbioscience的antibodystabilizerpbs(131500)和
1、固定、涂片:加入4%(v/v)多聚甲醛溶液,室温放置15分钟,蒸馏水洗涤3次;细胞悬液涂在防脱载玻片上,60℃烤片1h,pbs洗涤3次。
2.抗原修复
将玻片置于煮沸的1mmedta抗原修复溶液中(ph=9.0),微波炉中低火加热10min,自然冷却至室温。
注意抗原修复时修复液的量必须保证切片始终浸泡在液体内,加热完冷却至室温过程中切片必须始终保持在液体内,不可将切片取出在空气中冷却。
3.阻断内源性过氧化物酶
1)将抗原修复后的组织切片用pbs冲洗3次,每次5分钟;
2)取出切片,甩掉并擦干组织周围液体,免疫组化笔圈定切片上的待测组织区域;
3)在组织区域内加入100~200μl内源性过氧化物酶阻断剂,室温孵育10分钟;
4)pbs溶液冲洗3次,每次5分钟。
4.ar-v7抗体孵育
1)去除pbs溶液,加入各种抗体稳定剂稀释的一抗溶液,室温孵育60分钟;
2)pbs溶液冲洗3次,每次5分钟。
5、酶标聚合物孵育
1)去除pbs溶液,加入100μlhrp标记hrp-羊抗小鼠igg工作液,室温孵育20分钟;
2)pbs溶液冲洗3次,每次5分钟。
6、显色
去除pbs溶液,加入100~200μl新鲜配制好的dab显色液,室温下避光孵育3-10分钟;显色完后,蒸馏水冲洗样本终止显色。
如有必要,可进行苏木素复染。
自来水冲洗,加100~200μl苏木素体细胞染色液孵育10~30秒;pbs溶液或自来水冲洗返蓝。
注意:依据作用的苏木素染色液的强度和孵育时间的长短:对比染色结果导致细胞核呈现淡蓝到深蓝颜色的反应,而过染或是不足染色都有可能危及正确结果的判断。
7、脱水、透明、封片
1)置95%乙醇中,浸泡3分钟;
2)置无水乙醇中,浸泡3分钟;
3)二甲苯透明;
4)中性树胶和盖玻片封片。
8.生物显微镜阅片及结果判断
结果判断标准如下:
阳性:组织切片中特定细胞的细胞核上有黄色或棕黄色着色,且无非特异性的背景染色;
阴性:组织内预期细胞中未见黄色或棕黄色着色。
染色结果如图4-7所示,其中图4为pbs稀释的ar-v7单克隆抗体作为一抗用于免疫组化实验染色结果,图5为sigmabiostabantibodystabilizer、图6为antibodystabilizerpbs、图7为
由于ar-v7在vcap细胞中高表达,而在pc3细胞中不表达,图4-7中的pc3细胞均无明显棕色或黄色着色,而为蓝紫色着色,有效排除假阳性结果。在vcap的结果中,使用sigmabiostabantibodystabilizer稀释得到工作浓度的ar-v7单克隆抗体,用于免疫组化试验后,其染色效果为明显的深棕色,效果稳定。
而使用candorbioscience的antibodystabilizerpbs和
实施例7:抗体浓度对免疫组化检测效果的影响
用实施例3所述的抗体稀释液,将实施例2制备得到的单克隆抗体稀释至1mg/ml,ar-v7抗体母液为1mg/ml浓度,用biostabantibodystabilizer抗体稀释液分别稀释1000倍、500倍、250倍、100倍,得到ar-v7抗体的浓度分别为:1μg/ml、2μg/ml、4μg/ml和10μg/ml,室温放置7天后作为一抗进行免疫组化实验。
以培养的前列腺癌细胞系vcap和pc3切片各8张,分为4组,每组中pc3石蜡切片作为阴性对照,vcap切片用于检测ar-v7蛋白表达。现根据本试剂盒提供实验方法进行ar-v7检测操作。
1、固定、涂片:加入4%(v/v)多聚甲醛溶液,室温放置15分钟,蒸馏水洗涤3次;细胞悬液涂在防脱载玻片上,60℃烤片1h,pbs洗涤3次。
2、抗原修复
将玻片置于煮沸的1mmedta抗原修复溶液中(ph=9.0),微波炉中低火加热10min,自然冷却至室温。
注意抗原修复时修复液的量必须保证切片始终浸泡在液体内,加热完冷却至室温过程中切片必须始终保持在液体内,不可将切片取出在空气中冷却。
3、阻断内源性过氧化物酶
1)将抗原修复后的组织切片用pbs冲洗3次,每次5分钟;
2)取出切片,甩掉并擦干组织周围液体,免疫组化笔圈定切片上的待测组织区域;
3)在组织区域内加入100~200μl内源性过氧化物酶阻断剂,室温孵育10分钟;
4)pbs溶液冲洗3次,每次5分钟。
4、ar-v7抗体孵育
1)去除pbs溶液,加入按不同稀释倍数稀释的ar-v7抗体试剂,室温孵育60分钟;
2)pbs溶液冲洗3次,每次5分钟。
5、酶标聚合物孵育
1)去除pbs溶液,加入100μlhrp标记hrp-羊抗小鼠igg工作液,室温孵育20分钟;
2)pbs溶液冲洗3次,每次5分钟。
6、显色
去除pbs溶液,加入100~200μl新鲜配制好的dab显色液,室温下避光孵育3-10分钟;显色完后,蒸馏水冲洗样本终止显色。
如有必要,可进行苏木素复染。
自来水冲洗,加100~200μl苏木素体细胞染色液孵育10~30秒;pbs溶液或自来水冲洗返蓝。
注意:依据作用的苏木素染色液的强度和孵育时间的长短:对比染色结果导致细胞核呈现淡蓝到深蓝颜色的反应,而过染或是不足染色都有可能危及正确结果的判断。
7、脱水、透明、封片
1)置95%乙醇中,浸泡3分钟;
2)置无水乙醇中,浸泡3分钟;
3)二甲苯透明;
4)中性树胶和盖玻片封片。
8、生物显微镜阅片及结果判断
待中性树脂凝固后,显微镜下观察切片染色效果。
如图8与图9所示,其中图8为vcap细胞的免疫组化染色结果,图9为pc3细胞的免疫组化染色结果,a为对抗ar-v7单克隆抗体母液(1mg/ml)稀释1000倍后(抗体工作浓度为1μg/ml、)检测的结果示意图;b为稀释500倍(抗体工作浓度为2μg/ml);c为稀释250倍(抗体工作浓度为4μg/ml);d为稀释100倍后(抗体工作浓度为10μg/ml)检测的染色结果图。
染色结果显示:ar-v7单克隆抗体稀释100、250、500和1000倍时,pc3细胞中均无任何棕色着色,表明实验体系没有问题,可有效避免非特异性背景着色即假阳性,而ar-v7单克隆抗体稀释1000倍和500倍时vcap细胞免疫染色有明显棕色着色,稀释250倍、100倍时ar-v7单克隆抗体免疫染色的vcap细胞切片无明显的棕色着色,表明阳性染色效果差。表明ar-v7单克隆抗体稀释1000倍和500倍时,即抗体浓度为1μg/ml和2μg/ml时,ar-v7的免疫检测效果较为合适。因此,1μg/ml为最佳的抗ar-v7抗体的工作浓度。
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
- 还没有人留言评论。精彩留言会获得点赞!