一系列多米诺芳炔前体及其合成方法与流程
本发明属于有机化学的
技术领域:
,具体涉及一系列多米诺芳炔前体以及其合成方法。
背景技术:
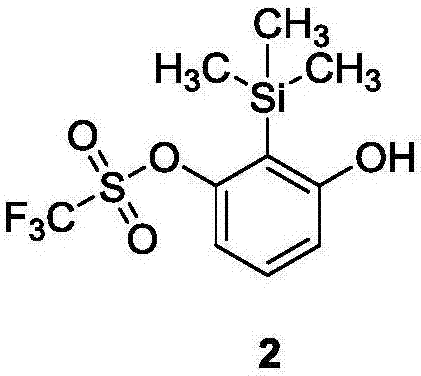
:以苯环为核心骨架的结构广泛存在于有生物活性的天然化合物及合成的药物分子中,因而发展高效的合成多取代苯衍生物的方法一直以来是合成有机化学研究的重点之一。芳炔作为一种高活性中间体,因其可以一次在苯环上引入两个官能团,在天然产物合成及制药等领域具有广泛的用途。此前,本领域技术人员曾用多米诺芳炔前体2-(三甲基硅烷基)-1,3-二三氟甲磺酸苯酯(tpbt)实现了苯环的1,2-双亲核,1,3-二胺基化和1,2-二胺基化。但tpbt作为对称性的芳炔前体,生成芳炔时两个otf的离去性是一致的。针对这一问题,本发明致力于合成不对称的芳炔前体,使生成芳炔时离去基团的离去性具有差异,从而调控多米诺过程,拓展芳炔前体在合成有机化学及药物分子合成中的应用范围。技术实现要素:针对多米诺芳炔前体的这一问题,本发明所要解决的问题就是提供一系列芳炔前体及其合成方法,该芳炔前体具备在苯环的1,3位置上进行双亲核官能化反应的性能。为了解决上述技术问题,本发明提供的一系列芳炔前体的结构式a1~a6如下:本发明的芳炔前体的合成方法包括以下步骤:步骤一,3-羟基-2-(三甲基硅基)苯基-三氟甲磺酸酯的制备将2-溴-1,3-间苯二酚溶于四氢呋喃,加入六甲基二硅胺烷(hmds),60℃搅拌12h;完全反应后处理后,溶于四氢呋喃,在-78℃~-100℃缓慢滴加正丁基锂(n-buli),随后加入三氟甲磺酸酐(tf2o);待完全反应后,低温条件下加入3%的稀盐酸,后处理并经硅胶柱层析纯化得到3-羟基-2-(三甲基硅基)苯基-三氟甲磺酸酯。步骤二,芳炔前体的制备将步骤一所得的3-羟基-2-(三甲基硅基)苯基-三氟甲磺酸酯溶于二氯甲烷,室温下加入三乙胺和对甲苯磺酰氯,搅拌至完全反应,粗品经硅胶柱层析纯化得到芳炔前体a1。芳炔前体a2~a6的制备同芳炔前体a1的制备。与现有技术相比,本发明具有如下的技术效果:首先,芳炔前体具有在苯环的1,3位置上进行双亲核官能化反应的性能,该性能在有机物合成和药物合成领域具有广阔的应用前景;其次,芳炔前体的合成方法以2-溴-1,3-间苯二酚为原料,通过三甲基硅烷基保护、brook重排、三氟甲磺酸酐保护等反应一锅煮得到3-羟基-2-(三甲基硅基)苯基-三氟甲磺酸酯,再用对甲苯磺酰基等一系列保护基将另一个羟基保护而得,芳炔前体的合成方法简便,能大量制备,所得芳炔前体的化学性质稳定、在有机溶剂中溶解度很好。具体实施方式:下面结合实施例对本发明作进一步说明:本发明的芳炔前体结构式a1~a6如下:实施例本发明的芳炔前体合成分两步:第一步,3-羟基-2-(三甲基硅基)苯基-三氟甲磺酸酯的合成3-羟基-2-(三甲基硅基)苯基-三氟甲磺酸酯的结构式2如下:该3-羟基-2-(三甲基硅基)苯基-三氟甲磺酸酯的合成反应过程:i)将结构式1的2-溴-1,3-间苯二酚(3.0g,15.9mmol,1.0equiv.)溶入四氢呋喃(30ml),室温下加入六甲基二硅胺烷(hmds)(7.3ml,34.9mmol,2.2equiv.),升温到60℃,反应12小时;ii)将i)得到的混合物完全蒸干,并溶于40ml四氢呋喃,将混合物冷却至-78℃~-100℃,缓慢加入正丁基锂(n-buli)(2.5m正己烷溶液,7.0ml,17.5mmol,1.1equiv.),反应5分钟;然后低温下加入三氟甲磺酸酐(tf2o)(4ml,23.9mmol,1.5equiv.),反应10分钟;iii)在低于-20℃条件下加入3%的稀盐酸,搅拌至温度回升到室温;后处理经硅胶柱层析纯化得到4.4克3-羟基-2-(三甲基硅基)苯基-三氟甲磺酸酯2,产率88%。所得3-羟基-2-(三甲基硅基)苯基-三氟甲磺酸酯2的物理性质及表征数据:浅黄色液体,1hnmr(400mhz,cdcl3)δ7.26(dd,j1=8.4,j2=8.0hz,1h),6.93(d,j=8.0hz,1h),6.69(d,j=8.4hz,1h),5.28(s,1h),0.42(s,9h)ppm;13cnmr(125mhz,cdcl3)δ161.9,155.4,131.7,118.8(q,j=318.9hz),118.70,114.9,112.7,0.9ppm;ir(thinfilm)3559,3554,1602,1437,1412,1275,1250,1217,1139,1115,950,862,844(cm-1);hrms-maldi(m/z)calcdfor[c10h12f3o4ssi]-,313.0183;found,313.0178.第二步,芳炔前体的合成以a1的合成为例,芳炔前体的合成反应过程:将结构式2的3-羟基-2-(三甲基硅基)苯基-三氟甲磺酸酯溶于二氯甲烷(40ml),室温下加入三乙胺(et3n)(2.9ml,21mmol,1.5equiv.)和对甲苯磺酰氯(tscl)(2.67g,14mmol,1.0equiv.)。完全反应后处理经硅胶柱层析纯化得到6.1克芳炔前体,产率93%。从结构式1的化合物到结构式a1的化合物总产率为82%。其他几种芳炔前体a2~a6的合成与芳炔前体a1的合成相同。所得结构式a1的芳炔前体的物理性质及表征数据:白色固体,mp:72-74℃;1hnmr(400mhz,cdcl3)1hnmr(400mhz,cdcl3)δ7.76(d,j=8.4hz,2h),7.37-7.33(m,3h),7.25(d,j=7.6hz,1h),7.14(d,j=8.0hz,1h),2.47(s,3h),0.33(s,9h)ppm;13cnmr(125mhz,cdcl3)δ155.5,155.0,146.1,133.1,131.6,130.2,128.7,126.6,120.3,118.7(q,j=319.1hz)118.3,21.9,0.961ppm;ir(thinfilm)3101,2923,1585,1535,1434,1412,1384,1353,1185,1144,954,783,613,588,527,458(cm-1);hrms-maldi(m/z)calcdfor[c17h19f3nao6s2si]+,491.0237;found,491.0240.所得结构式a2的芳炔前体的物理性质及表征数据:无色液体,1hnmr(500mhz,cdcl3)δ7.89(d,j=8.5,2h),7.74-7.70(m,1h),7.57(dd,j1=8.5,j2=7.5hz,2h),7.36(t,j1=8.0,j2=8.5hz,1h),7.26(d,j=8.5hz,1h),7.12(d,j=8.0hz,1h),0.33(s,9h)ppm;13cnmr(125mhz,cdcl3)δ155.3,155.0,136.1,134.8,131.6,129.6,128.6,126.7,120.4,118.6(q,j=317.8hz),118.4,0.9ppm;ir(thinfilm)1429,1380,1214,1139,951,846,781,584,561(cm-1);hrms-maldi(m/z)calcdfor[c16h17f3nao6s2si]+,477.0080;found,477.0083.所得结构式a3的芳炔前体的物理性质及表征数据:白色固体,mp:71-73℃;1hnmr(400mhz,cdcl3)δ7.82(d,j=8.8hz,2h),7.55(d,j=8.8hz,2h),7.36(dd,j1=8.4,j2=8.0hz,1h),7.27(d,j=8.4hz,1h),7.08(d,j=8.0hz,1h),0.34(s,9h)ppm;13cnmr(125mhz,cdcl3)δ155.2,155.1,141.7,134.5,131.7,130.1,130.0,126.9,120.3,118.7(q,j=318.1hz),118.6,1.0ppm;ir(thinfilm)3101,2954,1592,1568,1477,1438,1253,1143,1089,1058,985,846,801,617,501(cm-1);hrms-maldi(m/z)calcdfor[c16h16clf3nao6s2si]+,510.9690;found,510.9692.所得结构式a4的芳炔前体的物理性质及表征数据:白色固体,mp:126-128℃;1hnmr(400mhz,cdcl3)δ8.43(d,j=8.8hz,2h),8.12(d,j=8.8hz,2h),7.39(dd,j1=8.4,j2=8.0hz,1h),7.31(d,j=8.4hz,1h),7.05(d,j=8.0hz,1h),0.36(s,9h)ppm;13cnmr(125mhz,cdcl3)δ155.1,154.8,151.4,141.6,131.9,130.1,127.1,124.8,122.4,119.1,118.6(q,j=318.5hz),1.0ppm;ir(thinfilm)3101,1585,1535,1412,1384,1353,1257,1185,1144,954,783,613,588(cm-1);hrms-maldi(m/z)calcdfor[c16h16f3nnao8s2si]+,521.9931;found,521.9937.所得结构式a5的芳炔前体的物理性质及表征数据:白色固体,mp:39-41℃;1hnmr(400mhz,cdcl3)δ7.81(d,j=8.8hz,2h),7.35(t,j1=8.4,j2=8.0hz,1h),7.25(d,j=8.4hz,1h),7.14(d,j=8.0hz,1h),7.01(d,j=8.8hz,2h),3.90(s,3h),0.34(s,9h)ppm;13cnmr(125mhz,cdcl3)δ164.6,155.5,155.0,131.6,131.0,127.3,126.7,120.4,118.7(q,j=318.8hz),118.2,114.7,56.0,1.0ppm;ir(thinfilm)3103,3084,2997,1598,1437,1412,1285,1167,1141,957,845,777,752,569,504(cm-1);hrms-maldi(m/z)calcdfor[c17h19f3nao7s2si]+,507.0185;found,507.0186.所得结构式a6的芳炔前体的物理性质及表征数据:白色固体,mp:37-39℃;1hnmr(400mhz,cdcl3)δ7.53-7.46(m,2h),7.31(d,j=8.0hz,1h),3.22(s,3h),0.46(s,9h)ppm;13cnmr(125mhz,cdcl3)δ155.1,154.6,132.1,126.1,120.3,118.7(q,j=318.6hz),118.6,38.8,1.0ppm;ir(thinfilm)3444,2949,1601,1423,1374,1215,1158,948,846,811,747,601,518(cm-1);hrms-maldi(m/z)calcdfor[c11h15f3nao6s2si]+,414.9924;found,414.9927.上述结构式1的2-溴-1,3-间苯二酚为已知化合物,其合成反应参见“引用文献”。“towardsallostericreceptors-synthesisofresorcinarene-functionalized2,2'-bipyridinesandtheirmetalcomplexes”(向变构受体-间苯二酚芳烃-官能化2,2'-联吡啶及其金属配合物的合成),staats,h.;eggers,f.;haβ,o.;fahrenkrug,f.;matthey,j.;lüning,u.;lützen,a.eur.j.org.chem.2009,4777-4792.本发明的芳炔前体a1的1,3-二胺基化反应的实例:将对甲基苯磺酰基保护的结构式b的苯胺(123.5mg,0.5mmol,1.0equiv.)、碳酸钾(k2co3)(241.9mg,1.75mmol,3.5equiv.)和18-冠醚-6(133.5mg,0.5mmol,1.0equiv.)称入圆底烧瓶中,加入甲苯(tolyene)(10ml)。在100℃下,将结构式a1的芳炔前体(176.7mg,0.375mmol,0.75equiv.)的甲苯(tolyene)(10ml)溶液用缓慢注射泵经10小时加入此反应体系中。待反应完全,将甲苯除掉,反应粗品直接经硅胶柱层析纯化,得到68.3毫克结构式c的产物,产率为48%。所得结构式c的1,3-二氨基化产物为已知化合物,其物理性质及表征数据参见:“diaminationofdominoaryneprecursorwithsulfonamides”(利用多米诺芳炔前体与磺酰胺反应实现的芳环二胺基化),qiu,d.;he,j.;yue,x.;shi,j.;li,y.org.lett.2016,18,3130-3133.附图说明图1为本发明合成一系列多米诺芳炔前体的结构通式图2为3-羟基-2-(三甲基硅基)苯基-三氟甲磺酸酯的结构式图3为3-羟基-2-(三甲基硅基)苯基-三氟甲磺酸酯的合成反应路线图4为芳炔前体a1的具体合成步骤示例图5为芳炔前体a1的1,3-二胺基化反应的实例以上各化合反应所用的原料来源列表如下:试剂名称cas号纯度规格厂家苯胺62-53-3ar500ml科龙间苯二酚108-46-399%100g科龙氯仿67-66-3ar500ml科龙溴7726-95-6ar500ml科龙甲醇67-56-1ar500ml科龙氢氧化钠1310-73-2ar500g科龙亚硫酸钠7757-83-7ar500g科龙二氯甲烷75-09-2ar500ml科龙四氢呋喃109-99-9ar500ml科龙六甲基二硅胺烷999-97-3ar500ml阿拉丁正丁基锂(2.5m)109-72-82.5m100mlacros三氟甲磺酸酐358-23-6rg500gadamas三乙胺121-44-8ar500ml科龙碳酸钾584-08-7ar500g科龙甲苯108-88-3ar500ml科龙当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1