一种蚊虫足样本DNA提取方法及系统与流程
本发明属于基因提取技术领域,尤其涉及一种蚊虫足样本dna提取方法及系统。
背景技术:
蚊科(culicidae)昆虫是最重要的医学昆虫类群,它能传播疟疾、登革热、流行性乙型脑炎等多种传染病。蚊媒病是人类健康的主要威胁,每年全球有7亿人受感染,其中有上百万人死亡。世界卫生组织(who)估计2015年有2.14亿人感染疟疾,43.8万人因疟疾死亡,每年约0.67~1.36亿人感染登革热。目前,疟疾仍是中国主要的公共健康问题。近些年来,尽管疟疾病例明显减少,但输入性恶性疟疾病例逐年增多。登革热正在成为中国人类健康新的威胁,例如:2014年7—10月在广东爆发登革热,病例达到44497例。
蚊虫分子生物学发明是蚊虫控制措施发明的基础,而这些发明往往需要使用大量的蚊虫微量样本提取dna。蚊虫存在大量隐存种,因此蚊虫分类学者不仅要做蚊虫形态学鉴定,还需要进一步的分子鉴定。传统的分子鉴定使用整只蚊虫提取dna,不仅破坏稀少的样本,而且不利于后续的分子数据与形态特征对应。因此,急需探索一个高效的、微量组织样本的dna提取技术。另外在功能基因组的发明方面,往往需要发明不同组织样本的基因表达,由于蚊虫个体小,组织样本不易获得,同样也急需微量组织样本的dna提取技术。
chelex-100是一种螯合型离子交换树脂。它是由苯乙烯和苯乙二烯组成的聚合物,可以与二价金属离子螯合,高选择性地去除样品和缓冲液中的金属离子,从而避免样品中存在的金属离子在高温和低离子强度溶液中作为催化剂使dna降解。chelex-100悬液在碱性和100℃水浴条件下可使细胞膜破裂,dna因而可从细胞核中释放出来。walsh等人最早使用chelex-100用于法医生物材料的dna提取和检验,随后一些报道确认chelex-100可高效提取微量生物材料的dna。传统的分子鉴定使用整只蚊虫提取dna,不仅破坏稀少的样本,而且不利于后续的分子数据与形态特征对应。
综上所述,现有技术存在的问题是:现有的微量组织提取方法复杂、成本高,且对于蚊虫标本保存的方法要求高,单只足用于dna提取会影响对剩下的部分开展形态学分析。
技术实现要素:
针对现有技术存在的问题,本发明提供了一种蚊虫足样本dna提取方法及系统。本发明的提取方法基于chelex-100和蛋白酶k进行蚊虫足样本dna提取。
本发明是这样实现的,一种蚊虫足样本dna提取方法,所述蚊虫足样本dna提取方法采用chelex-100溶液和蛋白酶k结合的方法用于单只蚊虫足的微量dna的提取;具体包括:
试剂添加:将枪头用剪刀剪去尖部,取chelex-100溶液加入到ep管中,另取蛋白酶k2μl加入到所述ep管中;
样品处理:取蚊虫的单个后足或中足置于混有chelex-100溶液和蛋白酶k的ep管中,并用枪头或研磨棒将整根蚊腿捣碎后,涡旋震荡,并离心混匀;
裂解:将经过处理的样品置于恒温水浴锅中水浴,然后升温水浴,最后以离心,取上清液作为所提取的基因组dna模板。
进一步,试剂添加中,具体包括:将100μl的枪头用剪刀剪去尖部,取质量分数为5%的chelex-100溶液加入到50μl~250μlep管中。
进一步,样品处理中,具体包括:取蚊虫的单个后足或中足置于混有chelex-100溶液和蛋白酶k的250μlep管中,并用枪头或研磨棒将整根蚊腿捣碎后,涡旋震荡30s,并离心混匀。
进一步,裂解中,具体包括:将经过处理的样品置于56℃恒温水浴锅中水浴6h,然后升温到95℃水浴3min,最后以14000r/min离心3min,取上清液作为所提取的基因组dna模板。
本发明的另一目的在于提供一种蚊虫足样本dna提取系统。
本发明的优点及积极效果为:结果表明与以往的微量组织提取方法如微量dna提取试剂盒相比,该方法更加简单、快捷、廉价,且对于蚊虫标本保存的方法要求低,可以作为蚊虫分子生物学分析中获取dna模版的重要方法,减少了对蚊虫样本的依赖。单只足用于dna提取不影响对剩下的部分开展形态学等发明,可以作为蚊虫分子生物学分析中微量dna样本提取的重要方法,也为其他昆虫微量dna的提取提供理论依据。
附图说明
图1是本发明实施例提供的蚊虫足样本dna提取方法流程图。
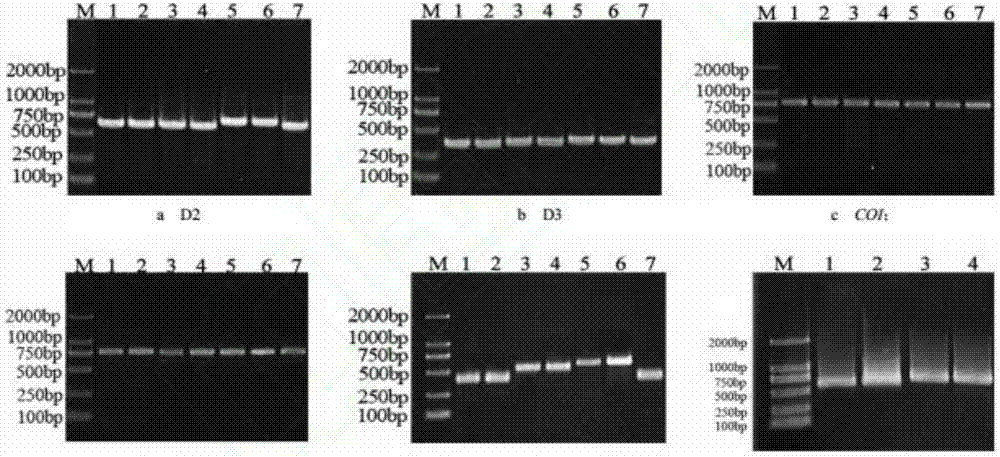
图2是本发明实施例提供的5个基因片段扩增产物琼脂糖凝胶电泳图。
具体实施方式
为了使本发明的目的、技术方案及优点更加清楚明白,以下结合实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
下面结合附图对本发明的应用原理作进一步描述。
如图1所示,本发明实施例提供的蚊虫足样本dna提取方法包括以下步骤:
s101:试剂添加:将100μl的枪头用剪刀剪去尖部,取质量分数为5%的chelex-100溶液加入到50μl~250μlep管中,另取2μl蛋白酶k加入所述ep管中;
s102:样品处理:取蚊虫的单个后足或中足置于上述混有chelex-100溶液和蛋白酶k的ep管中,并用枪头或研磨棒将整根蚊腿捣碎后,涡旋震荡30s,并离心混匀;
s103:裂解:将经过处理的样品置于56℃恒温水浴锅中水浴6h,然后95℃水浴3min,最后以14000r/min离心3min,取上清液作为所提取的基因组dna模板。
下面结合具体实施例对本发明作进一步描述。
本发明将不同方法保存的不同蚊种的足作为实验材料,从中提取蚊虫基因组dna;将提取蚊虫基因组dna作为模板,扩增核糖体dna的d2,d3和its2区,以及线粒体coi和coii基因,并对pcr扩增产物进行测序。具体包括:
1、材料与方法
1.1供试材料
用于实验的9个样本取自重庆师范大学昆虫与分子生物发明所常年野外采集及实验室饲养种群的蚊虫,具体样品信息及编号见表1。
表
1用于蚊虫dna提取的样品
tab.1mosquitosamplesusedfordnaextraction
1.2试剂
本发明中的主要试剂有:chelex-100(c7901,sigma公司),蛋白酶k(规格:20mg·ml-1,takara公司),无菌水(双蒸水,121℃灭菌),2×taqmastermix(北京康为世纪生物科技有限公司),chelex-100溶液(称取一定质量的chelex-100用无菌水配成质量分数为5%的溶液,4℃冰箱保存)。
1.3主要实验仪器及设备
本发明中的主要实验仪器及设备参见表2。
表2主要实验仪器及设备
tab.2maininstrumentandequipmentfortheexperiment
1.4微量组织dna的提取
1.4.1试剂添加
将100μl的枪头用剪刀剪去尖部少许,取质量分数为5%的chelex-100溶液(预先摇匀)50μl到250μlep管中,另取2μl蛋白酶k加入其中。
1.4.2样品处理
取蚊虫的单个后足或中足置于上述ep管中,并用枪头或研磨棒将整根蚊腿捣碎后,轻微涡旋震荡30s,并离心混匀。
1.4.3裂解
将经过处理的样品置于56℃恒温水浴锅中水浴6h,然后95℃水浴3min,最后以14000r·min-1离心3min,取上清液作为所提取的基因组dna模板。
1.5pcr扩增和测序
pcr反应总体积为25μl,pcr扩增的反应体系为:模板dna1μl,正反向引物(10μmol·l-1)各1μl,ddh2o9.5μl,再加入taqmastermix12.5μl到25μl。pcr扩增反应的引物及扩增条件见表3。扩增的pcr产物经质量分数为1%的琼脂糖凝胶电泳检测,后送往上海生物工程有限公司测序。所述pcr扩增反应的引物分别为:
d2正向的cp12dna序列为:seqidno:1,
5′-gtggatccagtcgtgttgcttgatagtgcag-3′;
d2反向的cp15dna序列为:seqidno2,
15′-gtgaattcttggtccgtgtttcaagacggg-3;
d3正向的d3adna序列为:seqidn,3:
15′-gacccgtcttgaaacacgga-3′;
d3反向的d3bdna序列为:seqidno4,
15′-tcggaaggaaccagctacta-3′;
its2正向的its2adna序列为:seqidno5,
15′-tgtgaactgcaggacacat-3′;
its2反向的its2bdna序列为:seqidno6,
15′-tatgcttaaattcagggggt-3′;
coi正向的lco1490dna序列为:seqidno7:
15′-ggtcaacaaatcataaagatattgg-3′;
coi反向的hc02198dna序列为:seqidno8:
15′-taaacttcagggtgaccaaaaaatca-3′;
coii正向的leudna序列为:seqidno9,
15′-tctaatatggcagattagtgca-3′;
coii反向的lysdna序列为:seqidno10,
15′-acttgctttcagtcatct。
表3pcr扩增反应的引物及扩增条件
2、结果与分析
2.1基因组dna提取及吸光值测定
对从9只蚊虫样本单只后足中提取到的基因组dna的质量浓度和纯度进行检测。由于dna提取量少,用琼脂糖凝胶电泳直接检测无法检测出条带,故用nanodrop检测dna的a260/a280值及质量浓度。表4显示,从在2015年采集的样本中提取到的dna样品a260/a280值大多处在1.5~1.9之间,说明dna纯度较高;而从在2011年和2012年采集的样本an-3和an-4中提取到的微量dna样品a260/a280的值分别只有1.02和1.23,说明dna纯度较低。从表4还可以看出,标本的保存年限和保存方式对从标本中提取到的dna质量浓度影响不大。
2.2模板dnapcr的扩增效果
对提取到的微量dna开展了核糖体dna的d2,d3和its2区,以及线粒体基因coi和coii的pcr扩增并检测扩增效果。从pcr产物的电泳条带和测序结果来看,电泳条带都比较明亮单一,且测序结果较好(图2)。在ncbi进行blast比对后,最终确认相关结果与之前形态学鉴定的种类完全一致。
表4从单只蚊足提取的基因组dna的紫外吸光度值及质量浓度
3、下面结合具体分析对本发明作进一步描述。
chelex-100是一种由苯乙烯、二乙烯苯共聚体组成的化学螯合树脂,含有成对的亚氨基二乙酸盐离子,可螯合多价离子,特别是对高价金属离子有很高的亲和力和螯合作用。在低离子强度、碱性及煮沸的条件下,可以使细胞膜破裂,并使蛋白质变性,通过离心除去chelex颗粒,使结合的物质与dna分离。用chelex-100法提取dna,提取过程始终在同一个试管内进行,不涉及转移,可减少污染机会,同时也降低了检材的损失,很适合微量检材的dna提取。虽然该方法的提取纯度不高,但作为pcr反应模板制备拥有良好的效果。
如图2中a-e图:m为marker,编号1—7分别为样本ad-1,ad-2,cx-1,cx-2,an-1,an-2,ar-1;图f中:m为marker,编号1,2分别为样an-3和an-4的coi,编号3,4分别为样本an-3和an-4的its2。
3.1提取效果
对于生物学材料中dna的提取,一般采用的sds裂解材料、有机溶剂抽提的方法。但这样的方法步骤繁琐,费时费力,达不到微量提取的效果,且在提取过程中加入的sds等裂解物质会严重干扰pcr反应,可能出现假阳性的结果。除了传统的生物学提取方法外,为了满足法医dna检验中对原始检材需求量小、pcr扩增良好、检验结果准确等多方面的要求,chelex-100法被广泛应用于医学检验。本发明采用了chelex-100溶液与蛋白酶k结合的方法提取蚊虫微量组织dna。对所提取的dna纯度与质量浓度、pcr产物和测序结果进行分析,发现蚊虫标本保存方式与时长对dna提取的效果影响不大,所以整体来看应用该技术提取微量dna时间较短、质量较高,不失为一种操作简单、节省成本的方法。
3.2适用范围
本发明中使用的chelex-100现已被广泛应用于法医鉴定,但是在昆虫标本材料的分子鉴定方面也逐步被应用,邹等人曾用质量分数为5%的chelex-100溶液提取单头螨虫的dna,并成功应用于coi基因的pcr扩增,随后湛孝东等人也将该方法用于单头螨线粒体基因组提取并用于扩增coi基因,效果较好。
应用chelex-100的方法进行蚊虫微量dna的提取目前尚未见报道。本发明采用chelex-100溶液与蛋白酶k结合的方法成功提取了不同种属、不同保存方法及保存年限的单只蚊足基因组dna,并使用较少的dna模板进行了线粒体基因、核基因等基因片段的扩增,均获得了良好的扩增和测序效果。综合以上几点,本发明可作为分子生物学分析提取中小型昆虫样本微量dna的一个重要方法。
3.3裂解试剂与时长
本发明中选取的材料为单只蚊足。由于昆虫腿部组织含角质层和肌蛋白较多,不易研磨破碎,不利于dna的释放;因此在放有蚊足的ep管中加入质量分数为5%的chelex-100悬浮液后,还要加入蛋白酶k,并用尖锐的枪头将蚊足捣碎,并保证在56℃水浴保温裂解过程中蚊足浸没于液面下方。同时,由于腿足组织断裂效果较差,本发明也对保温裂解的时间进行了梯度摸索,分别采用2,4,6和10h共4个时间梯度,最后确定6h为最佳裂解时间。对于其他昆虫或节肢动物而言,应根据材料的组成成分、裂解的难易程度来摸索裂解的时间。
3.4纯化与保存
如要对提取到的dna进行纯化,需要去除其中蛋白质、脂类和离子等物质的污染。先用终质量浓度为50μg·ml-1的rnase在37℃下水浴1h,然后采用混合的有机溶剂(其中酚︰氯仿︰异丙醇的体积比为25︰24︰1)抽提去除蛋白质得到纯净的dna。但由于该方法提取出来的dna量较少,一般情况下不建议进行纯化。对提取到的dna进行保存时应注意:1)如是在近期内需要使用,应在-20℃进行存放;2)如长时间不需要使用而仅是作为样品存留时,应放置在-80℃的超低温冰箱中保存。
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!