制备软骨细胞悬液的方法及其用途与流程
发明背景
受试者膝或踝或肩或腕或肘或髋的软骨缺损是由于软骨退化/损伤引起的。关节软骨是由II型胶原蛋白网络(软骨细胞)组成的复杂活组织。软骨在骨骼的末端提供光滑的表面,从而允许关节内几乎无摩擦的运动。运动损伤、跌倒等创伤、直接打击或旋转力量或疾病如骨坏死(Osteonecrosis)或剥脱性骨软骨炎(Osteochondritis dissecans)可导致软骨损伤。
损伤的软骨可以用非侵入性或侵入性疗法来治疗。
非侵入性疗法包括休息、冷/热敷、非甾体抗炎药(NSAID)和关节内类固醇注射。
侵入性疗法包括
A.关节镜下灌洗和清创,其暂时缓解症状,并不会阻止进展。
B.骨髓刺激诸如磨削成形术钻孔和微骨折,其导致关节连接恢复,但由于含有I型胶原的不规则和紊乱的纤维软骨从长远来看产生不希望的结果。
C.接种在胶原膜移植物上的细胞、骨膜和软骨膜,鉴于再生软骨与原始软骨相比低质量的生物物理性质,其提供不希望的结果。
D.自体骨软骨移植(autologous osterochondral transplantation)。
Brittberg M等人,The New England Journal of Medicine(《新英格兰医学杂志》),第331卷第14期,1994年10月6日教导了治疗年龄从14岁到48岁范围内具有大小在1.6cm2至6.5cm2范围内的全层软骨缺损的患者。然而,需要收获达到300mg至500mg的软骨切片,培养后细胞仅增加10倍。本发明的用于制备软骨细胞悬液的方法需要从膝收获约40mg至100mg软骨,并且培养能够使细胞数量增加300倍而不丧失活力和细胞特征。此外,待治疗的软骨缺损大小可以是1cm2至20cm2。
自体骨软骨移植被认为是一种可以完全生成软骨的方法,并于1997年被美国FDA批准。然而,它需要使用关节镜检查从膝的非负重区收获约200mg健康关节软骨,并将培养的细胞嵌入I/III型胶原蛋白膜上。本发明的用于制备软骨细胞悬液的方法需要从膝收获约40mg至100mg软骨。
Nam-Yong Chai等人,BMC Musculoskeletal Disorders(《BMC肌肉骨骼失调》)2010,11:103公开了不使用骨膜或膜的凝胶型自体软骨细胞植入。该方法基于将体外培养的自体软骨细胞与纤维蛋白胶混合移植到膝软骨缺损中。然而,它需要使用关节镜检查从膝的非负重区收获约200-300mg健康关节软骨。当将每个小瓶1200万个软骨细胞培养四至六周后进行植入。然而,本发明的用于制备软骨细胞悬液的方法需要从膝收获约40mg至100mg软骨,并且培养能够在四周内得到不少于4800万个细胞而不丧失活力和细胞特征。
欧洲专利号1181908B1(转让给M/s Verigen Transplantation Service International)公开了使用粘附在胶原蛋白支持物上的软骨细胞进行软骨修复。然而,本发明的方法将避免使用胶原蛋白支持物进行软骨修复。
PCT公开号2007/011094(申请人Sewon Cellontech Co.Ltd)公开了用于自体软骨细胞移植的可注射软骨细胞,其包括混合纤维蛋白、透明质酸和胶原蛋白。然而,本发明的方法将避免使用透明质酸和胶原蛋白进行自体软骨细胞移植。
发明目的
本发明的目的是提供一种制备软骨细胞悬液的方法。
另一个目的是通过使用关节镜检查或微创关节切开术将任选地与凝胶混合的软骨细胞悬液植入受试者膝或踝或肩或腕或肘或髋的缺损部位。
技术实现要素:
一种制备软骨细胞悬液的方法,包括:
(a)从受试者的膝的非负重区收获40mg至100mg重量的软骨组织;
(b)将来自(a)的组织切碎,接着用一种或多种酶消化以分离软骨细胞;
(c)将软骨细胞与营养培养基、血清和任选的生长因子混合;
(d)任选地接种以实现细胞增殖直至P2阶段以在四周内获得不少于4800万个细胞;
(e)离心、弃去上清液;
(f)与营养培养基混合;
(g)分析和表征软骨细胞悬液;
(h)将经表征的软骨细胞悬液灌装到透明V形1ml小瓶中;并且任选地运送到与(a)中相同的受试者。
一种植入用于自体软骨细胞移植的软骨细胞悬液的方法,包括:
(i)从小瓶1中取出1ml营养培养基,与小瓶2中的纤维蛋白(浓度72至110mg)混合,将内容物抽吸到注射器A中;
(ii)从小瓶1中取出1ml营养培养基,添加到小瓶3中的凝血酶(浓度500IU/ml)中并混合;
(iii)从小瓶3中取出0.2ml并注入空小瓶4中;
(iv)随后从软骨细胞悬液的一个或多个小瓶中取0.4ml+0.4ml,注入小瓶4中,并将内容物抽吸到注射器B中;
(v)将注射器A和B置于施用装置/支架上;
(vi)将包括钝针的Y形双注射器施用装置固定到两个注射器;以及
(vii)使用关节镜检查或微创关节切开术植入受试者的缺损部位。
发明描述
我们惊奇地发现,使用由少量软骨组织制备的软骨细胞悬液可以进行自体软骨细胞移植。在损伤时脱离的软骨松散碎片(如果有的话)也可以培养以提供软骨细胞悬液。
根据本发明的一个实施方案是一种制备软骨细胞悬液的方法,该方法包括:从受试者膝的非负重区收获40mg至100mg软骨组织,切碎组织,接着用一种或多种酶消化以实现软骨细胞的分离,将软骨细胞与营养培养基、血清和任选的生长因子混合,任选地接种以实现细胞增殖直至P2阶段以在四周内获得不少于4800万个细胞,离心、弃去上清液,与营养培养基混合,分析和表征软骨细胞悬液,将软骨细胞悬液灌装到透明的V形1ml小瓶中,并且任选地运送至相同的受试者。
或者,在损伤时脱离的软骨松散碎片(如果有的话)可代替软骨组织。
受试者是成人。
培养时低重量的组织或软骨松散碎片提供的细胞的活力和特征与通过使用更高重量的组织所获得的类似。
可以将收获的软骨组织或软骨松散碎片切碎并用选自胰蛋白酶、分散酶、胶原酶、胰蛋白酶-EDTA、链霉蛋白酶、透明质酸酶、弹性蛋白酶、木瓜蛋白酶和胰酶的一种或多种酶处理。使用的胰蛋白酶的量可以是单位体积的溶液5%至0.1%,优选2.5%至0.25%,最优选0.5%。样品经受胰蛋白酶溶液处理的时间段可以根据软骨组织或软骨松散碎片的大小而变化,优选足够的时间以减弱内聚粘结(cohensive bonding),最优选在2-8℃下进行16至18小时。然后将细胞与选自DMEM(杜尔贝科氏改性伊格尔氏培养基)、EMEM(伊格尔氏最低必需培养基)、F12、IMDM(伊斯科夫氏改性杜尔贝科氏培养基)等的营养培养基、血清和任选的生长因子混合。
在该方法中使用的营养培养基应该能够通过稀释或中和而显著减少并且更优选地去除胰蛋白酶的作用。该方法中使用的营养培养基可以优选地具有以下特征:(i)能够维持细胞的活力直至应用于患者,以及(ii)适合直接应用于进行移植的患者的区域。该溶液可以是从碱性盐溶液到更复杂的营养液中的任何溶液。优选地,营养培养基应含有类似于体液中存在的物质的各种盐;这种类型的溶液通常被称为生理盐水。磷酸盐或其他无毒物质也可对溶液进行缓冲以将pH保持在大约生理水平。特别优选的合适的营养培养基是DMEM溶液。
生长因子可以选自IGF、TGF、FGF等。
接种可以在T-25烧瓶和/或T-75和/或T-150烧瓶等中进行;并将细胞培养直至P2阶段以获得不少于4800万个细胞。对培养的悬液离心,弃去上清液,并将沉淀与营养培养基混合以获得软骨细胞悬液。分析软骨细胞悬液并将其灌装到透明的V形小瓶中,且任选地运送至相同的受试者。
软骨细胞悬液的典型分析涉及外观、无菌性、支原体、内毒素、细胞计数、细胞活力、细胞纯度测试、细胞表征和核型分析。
通过CD44+和CD151+标记物表达进行细胞表征并通过流式细胞术测试。CD44+和CD151+是能够结合到细胞外基质组分特别是软骨细胞的II型胶原蛋白的糖蛋白,并因此被认为是软骨细胞的显著标记物。
制备本发明的软骨细胞悬液的方法产生在生物化学和机械上优于纤维软骨的透明软骨。使用软骨细胞悬液,通过检测和扩增软骨细胞II型胶原的CAP-1和AGGERCAN基因表达,进行RT-PCR分析以确认透明状软骨的生成。
本发明的软骨细胞悬液任选地与凝胶混合,同时在关节镜下或在微创关节切开术下将软骨细胞悬液移植到受试者的膝或踝或肩或腕或肘或髋的缺损部位。
缺损大小范围可以从1cm2到20cm2(包括受试者的膝或踝或肩或腕或肘或髋的负重和/或非负重区)。
根据本发明的另一个实施方案是一种植入用于自体软骨细胞移植的软骨细胞悬液的方法,该方法包括:从小瓶1中取出1ml营养培养基,与小瓶2中的纤维蛋白(浓度范围为72mg至110mg)混合,将内容物抽吸到注射器A中;从小瓶1中取1ml营养培养基,加到小瓶3中的凝血酶(浓度为500Iu/ml)中并混合;从小瓶3中取出0.2ml并注入空小瓶4中;随后从软骨细胞悬液的一个或多个小瓶中取0.4ml+0.4ml,注入小瓶4中并将内容物抽吸到注射器B中;将注射器A和B置于施用装置/支架上;将包括钝针的Y形双注射器施用装置固定到两个注射器;以及使用关节镜检查或微创关节切开术植入受试者的缺损部位。
该软骨细胞悬液包括:从受试者膝的非负重区收获40mg至100mg软骨组织,切碎组织,接着用一种或多种酶消化以实现软骨细胞的分离,将软骨细胞与营养培养基、血清和任选的生长因子混合,任选地接种以实现细胞增殖直至P2阶段以在四周内获得不少于4800万个细胞,离心、弃去上清液,与营养培养基混合,分析和表征软骨细胞悬液,将软骨细胞悬液灌装到透明的V形1ml小瓶中,并且任选地运送至相同的受试者。
或者,在损伤时脱离的软骨松散碎片(如果有的话)可代替软骨组织。
受试者是成人。
培养时低重量的组织或软骨松散碎片提供的细胞的活力和特征与通过使用更高重量的所用组织所获得的类似。
可以将收获的软骨组织或软骨松散碎片切碎并用选自胰蛋白酶、分散酶、胶原酶、胰蛋白酶-EDTA、链霉蛋白酶、透明质酸酶、弹性蛋白酶、木瓜蛋白酶和胰酶的一种或多种酶处理。使用的胰蛋白酶的量可以是单位体积的溶液5%至0.1%,优选2.5%至0.25%,最优选0.5%。样品经受胰蛋白酶溶液处理的时间段可以根据软骨组织或软骨松散碎片的大小而变化,优选足够的时间以减弱内聚粘结,最优选在2-8℃下进行16至18小时。然后将细胞与选自DMEM(杜尔贝科氏改性伊格尔氏培养基)、EMEM(伊格尔氏最低必需培养基)、F12、IMDM(伊斯科夫氏改性杜尔贝科氏培养基)等的营养培养基、血清和任选的生长因子混合。
在该方法中使用的营养培养基应该能够通过稀释或中和而显著减少并且更优选地去除胰蛋白酶的作用。该方法中使用的营养培养基可以优选地具有以下特征:(i)能够维持细胞的活力直至应用于患者,以及(ii)适合直接应用于进行移植的患者的区域。该溶液可以是从碱性盐溶液到更复杂的营养液中的任何溶液。优选地,营养培养基应含有类似于体液中存在的物质的各种盐;这种类型的溶液通常被称为生理盐水。磷酸盐或其他无毒物质也可对溶液进行缓冲以将pH保持在大约生理水平。特别优选的合适的营养培养基是DMEM溶液。
生长因子可以选自IGF、TGF、FGF等。
接种可以在T-25烧瓶和/或T-75和/或T-150烧瓶等中进行;并将细胞培养直至P2阶段以获得不少于4800万个细胞。对培养的悬液离心,弃去上清液,并将沉淀与营养培养基混合以获得软骨细胞悬液。分析软骨细胞悬液并将其灌装到透明的V形小瓶中,且任选地运送至相同的受试者。
软骨细胞悬液的典型分析涉及外观、无菌性、支原体、内毒素、细胞计数、细胞活力、细胞纯度测试、细胞表征和核型分析。
通过CD44+和CD151+标记物表达进行细胞表征并通过流式细胞术测试。CD44+和CD151+是能够结合到细胞外基质组分特别是软骨细胞的II型胶原蛋白的糖蛋白,并因此被认为是软骨细胞的显著标记物。
制备本发明的软骨细胞悬液的方法产生在生物化学和机械上优于纤维软骨的透明软骨。使用软骨细胞悬液,通过检测和扩增软骨细胞II型胶原蛋白的CAP-1和AGGERCAN基因表达,进行RT-PCR分析以确认透明状软骨的生成。
本发明的软骨细胞悬液任选地与凝胶混合,同时在关节镜下或在微创关节切开术下将软骨细胞悬液移植到受试者的膝或踝或肩或腕或肘或髋的缺损部位。
缺损大小范围可以从1cm2到20cm2(包括受试者的膝或踝或肩或腕或肘或髋的负重和/或非负重区)。
优选地,软骨细胞悬液与选自纤维蛋白、凝血酶、热可逆凝胶等的凝胶混合。
优选地,使用包括钝针的Y形双注射器施用装置进行植入。
具体地讲,本发明包括一种植入用于自体软骨细胞移植的软骨细胞悬液的方法,该方法包括:从小瓶1中取出1ml营养培养基,与小瓶2中的纤维蛋白(浓度范围为72mg至110mg)混合,将内容物抽吸到注射器A中;从小瓶1中取1ml营养培养基,加到小瓶3中的凝血酶(浓度为500IU/ml)中并混合;从小瓶3中取出0.2ml并注入空小瓶4中;随后从软骨细胞悬液的一个或多个小瓶中取0.4ml+0.4ml,注入小瓶4中并将内容物抽吸到注射器B中;将注射器A和B置于施用装置/支架上;将包括钝针的Y形双注射器施用装置固定到两个注射器;以及使用关节镜检查或微创关节切开术植入受试者的缺损部位,其中软骨细胞悬液通过包括以下步骤的方法制备:
(a)从成人受试者的膝的非负重区收获40mg至100mg重量的软骨组织;
(b)将来自(a)的组织切碎,随后用一种或多种酶消化以分离软骨细胞,其中所述一种或多种酶选自胰蛋白酶-EDTA、胶原酶等;
(c)将软骨细胞与营养培养基、血清和任选的生长因子混合,其中所述营养培养基选自IMDM、EMEM、DMEM等;
(d)任选地接种以实现细胞增殖直至P2阶段以在四周内获得不少于4800万个细胞,其中接种在T-25烧瓶和/或T-75和/或T-150烧瓶等中进行;
(e)离心、弃去上清液;
(f)与营养培养基混合;
(g)分析和表征软骨细胞悬液;其中进行的分析是外观、无菌性、支原体、内毒素、细胞计数、细胞活力、细胞纯度测试、细胞表征和核型分析;进一步地,其中通过CD44+和CD151+标记物表达分析软骨细胞的细胞表征;
(h)将经表征的软骨细胞悬液灌装到透明V形1ml小瓶中;并且任选地在2至8℃下运送到与(a)中相同的受试者。
典型地,用于植入的方法可以如下进行-
A.使用关节镜检查的植入手术:
1.通过关节镜检查评估或鉴定缺损。
2.用关节镜刀和环状刮匙进行可能已在软骨缺损部位生长的纤维组织的关节镜清创术。
3.使用关节镜刀和环状刮匙仔细界定边缘,渐渐磨削。
4.任选地,使用2mm钻头将钻孔制成每平方厘米4-5个孔,确保孔深度为2mm。
5.一旦缺损准备好,尽可能将缺损带入重力消除位置。
6.停止盐水流动,并进行干燥关节镜检查。二氧化碳吹入器也可用于更好地查看缺损区域。
7.在干燥关节镜检查下,实现止血,如果可能的话,用长针头灌注正常的无菌生理盐水以检查重力消除位置并测量缺损面积或体积。
8.使用具有标识尺的关节镜探头,测量缺损区域。
9.计算所需的细胞-凝胶混合物的大致量。因此,利用两个或四个小瓶的软骨细胞悬液(包含2400万或4800万个细胞)与植入凝胶混合。
10.再次,使缺损区域变干并实现止血。
11.在干燥关节镜检查中,创建一个新的入口,插入长针头,并将细胞-凝胶混合物植入缺损部位,确保细胞-凝胶应流过缺损区域以形成浅浅的细胞-凝胶混合物均匀薄层,而不是填充整个缺损。
12.在20-30秒后,插入长针头,穿透浅浅的细胞-凝胶混合物均匀薄膜,并且根据需要再次开始植入细胞-凝胶混合物,以填充整个缺损区域并产生关节轮廓。
13.在相同重力消除位置保持缺损长达8分钟(如果使用2400万个细胞)和长达12分钟(如果使用4800万个细胞),进行相应关节的轻轻弯曲和伸展和/或跖屈和背屈和/或外展和内收/或内转和侧向旋转,以检查细胞-凝胶混合物的稳定性,并在手术后缝合关节开口。
B.使用微创关节切开术的植入手术:
1.测量缺损区域。
2.用小的锐匙清除可能已在软骨损伤部位生长的纤维组织,直至软骨下骨。
3.在手术刀帮助下仔细界定和逐渐磨削边缘。
4.使用2mm钻头将钻孔制成每平方厘米4-5个孔,确保孔深度为2mm。
5.进行盐水清洗以清除所有纤维组织。
6.在关节弯曲的帮助下,将缺损带入重力消除位置。
7.将正常的无菌生理盐水溶液注入缺损区域以检查重力消除位置并测量缺损的面积或体积。
8.用无菌标尺测量缺损区域,并计算所需的细胞-凝胶混合物的大致量。因此,利用两个或四个小瓶的软骨细胞悬液(包含2400万或4800万个细胞)与植入凝胶混合。
9.再次,使缺损区域变干并实现止血。如果出血,可暂时使用骨蜡或肾上腺素纱布止血。
10.将细胞凝胶混合物从中心到周边以及从周边到中心逐渐植入以填充孔。
11.用细胞凝胶混合物填充缺损,直至在缺损区域上形成良好的轮廓。
12.在相同重力消除位置保持缺损长达8分钟(如果使用2400万个细胞)和长达12分钟(如果使用4800万个细胞),进行相应关节的轻轻弯曲和伸展和/或跖屈和背屈和/或外展和内收/或内转和侧向旋转,以检查细胞-凝胶混合物的稳定性,并在手术后缝合关节开口。
附图说明
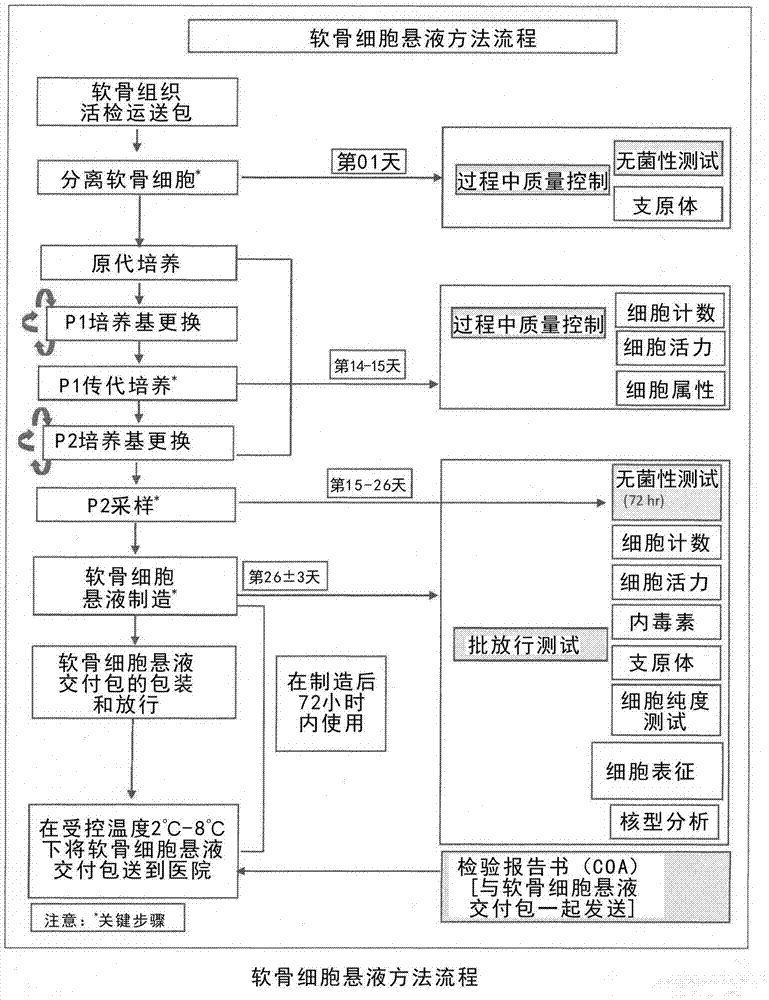
图1:软骨细胞悬浮方法流程。
图2:用于制备软骨细胞悬液的方法步骤。
图3:在原代培养步骤和最终制造步骤中的软骨细胞悬液的图形表示-
说明QC参数的结果,这些参数即:分别在原代培养和最终方法步骤中获得的细胞数量以及在最终方法步骤中的细胞活力和细胞表征;以及活检重量的结果,这些结果是植入所必需的。
图4:CAP-1和AGGERCAN基因表达的基于实时PCR的定性检测
RT-PCR允许检测基因或样品之间表达的轻微变化,并且也允许分析极低表达的基因。
图5:使用荧光显微镜观察软骨细胞的活/死染色-
软骨细胞的荧光染色比用血细胞计数法计算细胞活力的标准方法更可靠。荧光染色为我们提供了活细胞以及非活细胞的清晰图像。由于其特异性高,因此可靠性更高,并且可以检测低表达。标准方法依赖于手动细胞计数,存在操作错误和人工取样错误的可能,这对于活细胞计数的准确性不是理想的。
图6:混合程序:包括钝针的Y形双注射器施用装置的示意图-
根据缺损面积(cm2),将制备2ml或4ml细胞-凝胶混合物。如果缺损大小在1cm2至10cm2之间,则应制备2ml细胞-凝胶混合物。而如果缺损大小在7cm2至20cm2之间,则应制备4ml细胞-凝胶混合物。
图7.膝关节非负重区的软骨组织活检程序的代表性图像。
图8.在膝关节缺损区域使用软骨细胞悬液的关节镜手术的代表性图像。
图9.在膝关节缺损区域使用软骨细胞悬液的微创关节切开术的代表性图像。
图10.在踝关节缺损区域使用软骨细胞悬液的关节镜手术的代表性图像。
图11.在踝关节缺损区域使用软骨细胞悬液的微创关节切开术的代表性图像。
图12.在肩关节缺损区域使用软骨细胞悬液的微创关节切开术的代表性图像。
图13.在膝关节缺损区域用软骨细胞悬液处理的患者的术前MRI与术后MRI(T2测绘图)之间进行的比较的代表性图像。
以下实施例说明了根据本发明的优选实施方案,但不限制本发明的范围。
实施例
实施例1
通过关节镜检查从成人受损膝的内侧股骨髁的非负重区收获49mg软骨样本。将收获的软骨组织放入含有pH 7.0-7.5的HBSS的无菌小瓶中,并运送至细胞培养实验室。将软骨用补充有抗生素的缓冲溶液洗涤,称重并切碎成小块,再次用缓冲溶液洗涤。
将切碎的软骨用胰蛋白酶消化并收集分离的细胞。将细胞悬液以1300rpm离心5分钟。弃去上清液,将细胞重悬于含有血清和FGF的培养基中,用库尔特计数器计数并接种到25cm2培养瓶中。
将细胞在加湿的95%O2/5%CO2气氛中在CO2调节培养箱中培养。每天通过倒置相差显微镜观察培养物。培养基每周更换3次。原代培养物变汇合后,将细胞用胰蛋白酶-EDTA溶液分离、离心、计数、重悬于DMEM中并接种到T-150培养瓶中。
隔天更换培养基以饲养细胞,并且当细胞汇合度达到约80-90%时,在酶的帮助下收获细胞单层,该酶可以是胰蛋白酶-EDTA。使细胞悬液接受离心并弃去上清液。将沉淀与DMEM混合,并且可以通过库尔特计数器进行细胞计数。
通过台盼蓝染料拒染试验测量细胞活力。高于80%的细胞活力适于植入目的。在放行细胞以进行植入前,进行外观、无菌性、支原体、内毒素、细胞计数、细胞活力、细胞纯度测试、细胞表征和核型分析等质量控制测试。
为了表征软骨细胞,通过流式细胞术测试CD44+和CD151+标记物表达。在流式细胞术中,将细胞与荧光标记的抗体混合并在室温下在暗室中温育30分钟。然后用FACS Flow Solution将细胞洗涤两次。将样品离心,弃去上清液。样品运行流式细胞术并记录读数。
将通过指定限值的细胞悬浮在DMEM中,无菌灌装到透明V形小瓶中以供使用。
实施例2:待用于膝缺损的软骨细胞悬液的分析
PC:原代培养步骤
FP:最终方法步骤
支原体和内毒素测试结果呈阴性
表格展示了用重量为约40mg至60mg的软骨组织制备软骨细胞悬液的方法的效率,在4周细胞培养期中产生了不少于4800万个细胞,经表征的细胞足以覆盖膝关节中1cm2至20cm2的软骨缺损。
实施例3:培养软骨松散碎片后分析软骨细胞悬液
表格展示了用重量约大于100mg的软骨组织制备软骨细胞悬液的方法的效率,在4周细胞培养期中产生了不少于4800万个细胞,经表征的细胞足以覆盖膝关节中1cm2至20cm2的软骨缺损。
实施例4:待用于踝缺损的软骨细胞悬液的分析
表格展示了用重量约为52mg的软骨组织制备软骨细胞悬液的方法的效率,在4周细胞培养期中产生了4885万个细胞,经表征的细胞足以覆盖踝关节中3.9cm2的软骨缺损。
实施例5:待用于肩缺损的软骨细胞悬液的分析
表格展示了用重量约为53mg的软骨组织制备软骨细胞悬液的方法的效率,在4周细胞培养期中产生了4845万个细胞,经表征的细胞足以覆盖肩关节中20cm2的软骨缺损。
实施例6:
III期临床试验:一项前瞻性、开放性、多中心的研究,评估自体软骨细胞悬液在一个或多个关节处关节软骨缺损的受试者中的安全性和疗效。
目标和目的:
主要目标:评估自体软骨细胞植入在一个或多个关节处关节软骨缺损的安全性。
次要目标:评估自体软骨细胞植入在一个或多个关节处关节软骨缺损的疗效。
患者数量:本研究共有14名患者登记参加。14名患者均完成了研究。
产品详情:自体培养的软骨细胞小瓶(0.4mL)
外观:无色透明小瓶产品,其含有混合沉淀的淡白色自体成人活培养软骨细胞和红色流体。该流体在振摇时变混浊。
研究持续时间:研究中每名受试者的总持续时间约为28周。
总登记持续时间:大约16周
总研究持续时间:大约44周
评估标准:
安全性端点是:
·与治疗相关的不良事件(AE)的发生率
疗效终点是:
·依据国际膝关节论证委员会(IKDC)(主观和客观),第7次访视时相对于第1次访视时的变化。
·MRI变化(不低于1.5T MRI)的结果。
·依据视觉模拟评分(VAS),第7次访视时相对于第1次访视时的变化
疗效评估
·从IKDC(国际膝关节论证委员会)评分和VAS(视觉模拟评分)进行的疗效评估
疗效评估
a.第07次访视时国际膝关节论证委员会评分相对于基线访视时的变化。
国际膝关节论证委员会评分详情(IKDC评分在增加时为正值)
结论:在基线与第7次访视之间IKDC评分的总体变化指出为118.40%,因此可以得出结论,在基线与第7次访视之间存在具有高度统计显著性的平均差。在14名患者中,所有患者在缺损部位的关节软骨再生方面都显示出显著的MRI改善,与基线相比,新的关节软骨完全充满缺损,记录结果提示缺损区域被完全修复并显示出周围关节软骨的连续性,没有形成裂缝、没有形成裂隙,也无周围组织中的任何其他不规则性。
b.根据第07次访视时视觉模拟评分(VAS)相对于基线访视时的变化的疼痛缓解
视觉模拟评分详情(VAS评分在降低时为正)
结论:在基线与第7次访视之间VAS评分的总体变化指出为-75.12%,因此可以得出结论,在基线与第7次访视之间存在具有高度统计显著性的平均差。在14名患者中,在第7次访视时(植入后24周),与基线评分相比,所有患者的VAS评分和国际膝关节论证委员会评分均有所改善。
安全性评估
在安全性评估期间,所有14名受试者在研究期间均未发现不良事件和严重不良事件,提示自体成人活培养软骨细胞植入是关节软骨缺损患者的安全治疗选择。
- 还没有人留言评论。精彩留言会获得点赞!