肽类似物的制作方法
本申请要求2016年1月4日提交的美国临时专利申请号62/274,638的权益,所述申请以引用的方式整体并入本文。本发明实施方案涉及肽激素的肾上腺髓质素(adm)/降钙素基因相关肽(cgrp)/垂体中叶素(肾上腺髓质素2,imd)家族的超激动剂和超拮抗剂及其治疗性用途。
背景技术:
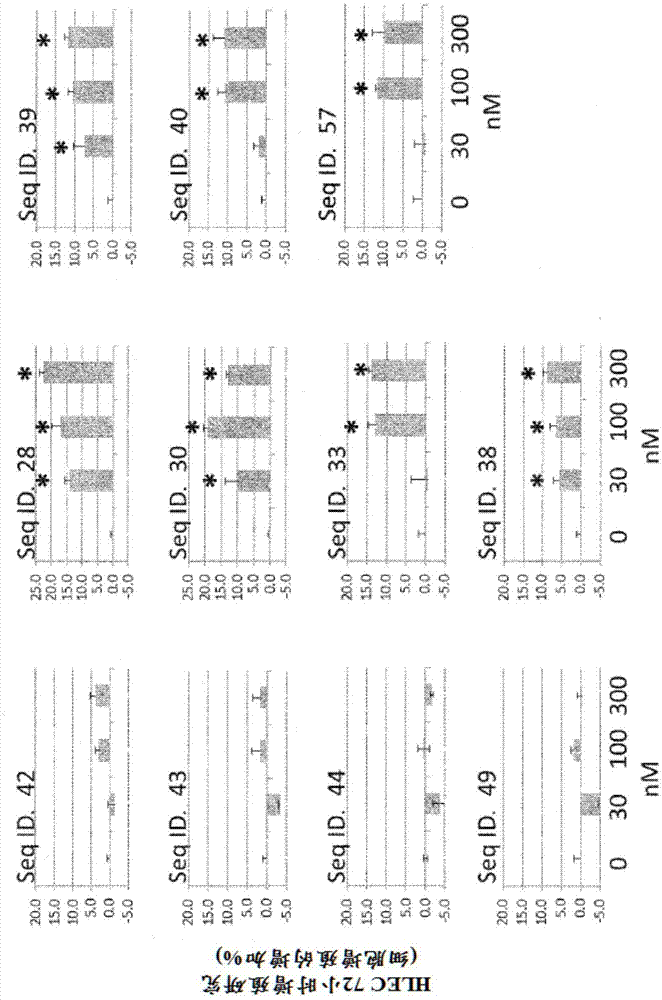
:g蛋白偶联受体(gpcr)是细胞表面受体并且代表人类基因组中最大蛋白质家族之一。基于系统发育标准,人gpcr的大型超家族可细分为五个主要亚家族:谷氨酸酯、视紫红质、粘附、卷曲/味觉和促胰液素(‘grafs'命名法),其中促胰液素家族(类似于kolakowski/nc-iuphar扩展命名系统中的b类gpcr家族)是研究最多的亚类之一。到目前为止,超过三分之一的所有药物都靶向gpcr。gpcr信号转导的规范观点集中于细胞内异三聚体鸟嘌呤核苷酸结合蛋白(g蛋白)的活化(等人(2008)natrevdrugdiscov;7:339-357)。配体引发受体介导的细胞反应的能力通过术语“功效”来解决(kenakin(2013)brjpharmacol168:554-575;rajagopal(2013)natrevdrugdiscov12:483)。历史上,配体的功效源自浓度-效应曲线,并通过相对于标准化合物(如内源性配体)的emax的功效浓度(ec50)和最大效应(emax)来量化(langmead和christopoulos(2013)brjpharmacol169:353-356)。然而,在系统中诱导最大反应的药物可在功效上不同,因为激动剂结合所需的受体部分可取决于受体活化的个体功效。因此,反应通常具有一定的测定依赖性限制。gpcr配体通常根据其功效(即引发受体介导的药理学反应的能力)进行分类(smith等人(2011)molcellendocrinol331:241-247)。使用活性状态的gpcr的晶体学研究表明,激动剂结合和g蛋白的结合对于捕获完全活性状态的蛋白质来说是重要的(rasmussen等人(2011)nature477:549-555)。此外,最近的研究表明,gpcr激动剂仅稳定可能的构象状态的子集(kobilka和deupi(2007)trendspharmacolsci28:397-406;kenakin(2013)brjpharmacol168:554-575)。因此,给定受体蛋白的各种激动剂可稳定对特定信号传导途径的活化具有不同功效的构象的不同子集(kenakin(2013)brjpharmacol168:554-575)。因此,‘强’激动剂可构成类似于由高效激动剂产生的更均匀和完全活性构象的一组构象。因此,稳定比内源性激动剂更均匀的构象的化合物的超生理功效代表超激动剂(schrage等人(2015)brjpharmacoldoi:10.1111/bph.13278)。在最大和最‘可药化’的gpcr(视紫红质样类或a类)中,已经描述了表现出比内源性配体更大的内在功效的一些合成化合物。这些化合物包括生长抑素sst4受体、生长素释放肽受体、α2a-肾上腺素受体、促甲状腺激素释放激素trh1受体和毒蕈碱m2胆碱受体的那些化合物(schrage等人(2015)brjpharmacoldoi:10.1111/bph.13278)。在配体门控离子通道处也存在超生理学激动剂功效的实例(carlier等人(2002)bioorgmedchemlett12:1985-1988;lhara等人(2004)bioscibiotechnolbiochem68:761-763)。实例包括gaba受体。adm/cgrp/imd肽家族包括降钙素基因相关肽(cgrpα和cgrpβ)、肾上腺髓质素(adm)、垂体中叶素(im)、降钙素(ct)和淀粉不溶素。其中,cgrp、adm和imd在结构上相似,并且通过由两种跨膜组分,即降钙素受体样受体(clr)和三种受体活性修饰蛋白(ramp1、2和3)中的一种组成的受体复合物发出信号。降钙素受体样受体(clr)和受体活性修饰蛋白(ramp)的共表达是产生cgrp、adm和imd的功能性受体所需的。cgrp主要通过clr/ramp1受体起作用,而adm对clr/ramp2和3受体具有高亲和力。另一方面,imd未表现出对三种clr/ramp受体的明显偏爱。52-氨基酸adm在肾上腺、肺、肾、心肌和其他器官中产生;而cgrp肽是神经递质。adm、cgrp和imd的血浆水平在皮摩尔范围内。clr/ramp受体的活化导致携带受体的细胞中腺苷3',5'-环一磷酸(camp)的细胞内升高。clr/ramp受体存在于几乎所有器官(包括内皮细胞)中的不同细胞类型上。认为这些肽通过中性肽链内切酶代谢,并且主要通过肾清除,或者在clr/ramp受体高度表达的肺中清除[gibbonsc,dackorr,dunworthw,fritz-sixk,caronkm,molendocrinol21(4),783-796(2007)]。虽然adm和imd最初被表征为有效的血管内皮机能调节剂,但随后的研究表明这些肽的功能远远超出降压作用,并且它们在各种器官中表现出多效性效应。对转基因小鼠的研究表明,adm、clr和ramp2对胚胎发育和成人期期间的血液和淋巴脉管系统的正常发育至关重要。已经显示adm或imd的输注减轻血管收缩、外周血管阻力和水肿,并且增加动物的心输出量和肾小球滤过率。这些肽还已经显示对人、绵羊和啮齿类动物的心力衰竭和心肌梗塞;人、猪和大鼠的肺动脉高压具有有益作用。此外,普遍认为adm和imd是在疾病状态下作为对损伤和缺氧的代偿性反应而增加的反调节激素。此外,已显示adm在多种动物模型中改善由脂多糖(lps)、弹性蛋白酶、野百合碱、博来霉素、缺血再灌注和角叉菜胶诱导的急性或慢性肺损伤。此外,已显示外源性adm和imd在体外刺激内皮和淋巴内皮细胞的增殖和迁移,以及在各种动物模型中使受损的淋巴和血管再血管化。此外,这些激素通过改善内皮细胞存活、血管生成和血管完整性、心输出量和肾小球滤过率在患有心力衰竭、心肌梗塞、中风、顽固性高血压、肺动脉高压、先兆子痫、继发性淋巴水肿和糖尿病性溃疡的动物中表现出有神经保护、肾脏保护、利尿和/或尿钠排泄作用。此外,adm可动员并增强各种干细胞/祖细胞的存活、分化和血管生成效力。cgrp是具有有效血管舒张、强心和疼痛传递作用的感觉神经肽,如evans等人的美国专利号4,530,838中所描述。cgrp存在于中枢神经系统和外周神经系统中,并且集中在身体的接收来自背角的感觉输入的那些区域中,其具有与自主输入相关的有限量。在脑中,所述肽存在于感觉和运动颅神经的细胞核中以及下丘脑、视前区、腹内侧丘脑、海马体等的细胞体中(poyner,d.1992,pharmac.ther.56:23-51)。此外,已知adm/cgrp/imd家族肽对内皮细胞的增殖具有有效的刺激作用,所述内皮细胞充当血管、血管生成和血管重构的起始材料。因为adm、cgrp和imd是人中已知最有效的血管舒张剂之一,所以这些肽对于在正常生理学和妊娠期间维持高流量/低阻力循环和胎儿-胎盘组织发育可能是功能上重要的。已经假定针对cgrp、adm或imd的受体水平的激动剂适用于其中发生内皮功能障碍、血管发育不足和异常血管舒张调节的病理生理学病状。clr/ramp受体超激动剂可用作刺激血管clr/ramp受体的工具,并且因此刺激病理病状如心力衰竭、心肌梗塞、顽固性高血压、恶性高血压、血管痉挛、中风、血管痉挛、支气管肺发育不良、肺动脉高压、淋巴水肿、伤口愈合、急性肺损伤、压迫性溃疡、年龄相关性黄斑变性、多发性硬化症、阿尔茨海默病、帕金森病、癫痫、视网膜病变、器官保存、子痫和先兆子痫下的组织再生。ct/cgrp家族中激素肽的生理功能由受体结合特异性和单独配体及其相应受体的组织表达谱决定,并且已显示参与心血管形态发生、感觉神经传递、炎症反应、伤害感受行为和葡萄糖稳态(参见例如,hay,等人2001,trendspharmacol.sci.22:57-59;shindo,等人2001,circulation104:1964-1971;zhang等人2001,pain89:265-273;salmon等人(1999)neuroreport10:849-854;salmon,等人2001,nat.neurosci.4:357-358;以及mulder,等人2000,am./.physiol.278:e684-e691)。假定针对cgrp和adm的受体水平的抑制剂适用于发生过量cgrp和/或adm受体活化的病理生理学病状。这些中的一些包括神经源性血管舒张、神经源性炎症、偏头痛、丛集性头痛和其他头痛、热损伤、循环休克、绝经期潮红和哮喘。cgrp受体活化尤其牵涉于偏头痛的发病机制中(edvinssonl.2001,cnsdrugs15(10):745-53;williamson,d.j.2001microsc.res.tech.53:167-178.;grant,a.d.2002,brit.jpharmacol.135:356-362)。与偏头痛相关的头痛被认为是与偏头痛事件相关的深度脑血管舒张的结果(moskowitz1992,trendspharmacol.sci.13:307-311)。与对照相比,偏头痛患者表现出升高的基础cgrp水平(ashina,等人,2000,pain86(1-2)133-8),并且cgrp的血清水平在偏头痛期间升高(goadsby,等人1990,ann.neurol.28:183-7)。用抗偏头痛治疗候选物治疗使cgrp水平恢复至正常,同时减轻头痛(gallai,等人1995,cephalalgia15:384-90);而静脉内cgrp施用在偏头痛患者导致头痛(lassen,等人2002,cephalalgia22(1):54-61)。因此,cgrp拮抗剂可适用于阻断脑血管cgrp受体并因此阻断偏头痛。cgrp受体的小分子和肽拮抗剂,如静脉内奥塞吉泮(olcegepant)(bibn4096bs、boehringeringelheim)和口服替卡吉泮(telcagepant)(mk-0974,merck&co.,inc.)已被证明在治疗偏头痛的临床试验中有效。(参见,tepper和stillman,2008,headache48(8):1259-1268;以及durham和vause2010,cnsdrugs24(7):539-548。)然而,选择小分子cgrp拮抗剂如mk-3207一直与一些患者的无症状的肝脏检查异常相关。cgrp受体的肽拮抗剂包括含有cgrp的序列但至少缺少37个氨基酸cgrp序列的前7个氨基酸的肽(例如,cgrp(8-37)、cgrp(28-37)、[tyr°]cgrp(28-37)、cgrp(12-37)、h-a-cgrp(9-37)、h-a-cgrp(10-37)、h-a-cgrp(11-37)、[ala9]-h-a-cgrp(8-37)、[ala10]-h-a-cgrp(8-37)、[alan]-h-a-cgrp(8-37)、[ala12]-h-a-cgrp(8-37)、h-a-cgrp(19-37)、h-a-cgrp(23-37)和酰基-h-a-cgrp(19-37);mimeault,m.等人,1992,med.chem.35:2163-2168;rovero,p.等人1992,peptides13:1025-1027)。尽管已经显示许多cgrp受体肽拮抗剂在体外与cgrp有效竞争,但由于低生物活性,这些拮抗剂在偏头痛样病理学的体内模型中表现不佳。针对adm的受体水平的抑制剂包括adm22-52。三级结构分析表明adm家族肽的结合结构域的特征在于非结构化的串。因为(1)adm充当具有肺、乳腺、结肠、脑、胰腺、子宫内膜、卵巢、肾或前列腺起源的肿瘤中的肿瘤细胞和周围血管的促有丝分裂因子,(2)肿瘤中的adm表达与肿瘤的侵袭性、远处转移和患者预后不良相关,以及(3)阻断clr/ramp受体信号传导降低肿瘤异种移植物的生长、微血管密度、肿瘤相关的巨噬细胞诱导的血管生成和转移,所以clr/ramp2和/或clr/ramp3受体拮抗剂是用于癌症治疗的抗血管生成药物候选物。总体而言,已采取四种方法来阻断clr/ramp受体信号传导。这些策略包括使用(1)合成肽拮抗剂(例如,cgrp8-37和adm22-52,其分别对cgrp介导的clr/ramp1和adm介导的clr/ramp2信号传导具有特异性),(2)小分子cgrp受体拮抗剂(例如,替卡吉泮),(3)抗配体抗体(例如,抗cgrp或抗adm抗体),以及(4)抗受体抗体(例如,抗clr或抗ramp抗体)。然而,现有治疗候选物与功效或安全性问题相关。首先,肽拮抗剂如cgrp8-37和adm22-52具有极短的半衰期和低效力,并且是受体特异性的。其次,小分子clr/ramp1受体拮抗剂在人中遭受肝脏毒性。第三,抗配体和抗受体抗体对配体或受体组分中的一种具有特异性;因此,它们仅作用于一小部分的靶标。第四,抗体对中枢神经系统中的clr/ramp受体具有有限接触。因此,泛特异性或clr/ramp受体1、2或3特异性超拮抗剂代表优异的抗clr/ramp受体治疗药物候选物,因为已显示当与小分子clr/ramp1拮抗剂和抗cgrp抗体相比时,肽拮抗剂如cgrp8-37可有效穿过血液脑屏障(bbb)。此外,由于新发明的超拮抗剂是相当亲脂性的,与野生型类似物相比,它们可更好地进入脑室。已知最广泛研究的clr/ramp受体激动剂adm在用于心力衰竭和肺动脉高压的急性治疗的早期临床试验中是安全、有效和良好耐受的。然而,由于激动剂的效力有限,药理作用不足。出版物(其各自以引用的方式明确地并入本文)包括:·hong等人(2012)brjpharmacol166:110-120·watkins等人(2013)brjpharmacol170:1308-1322·booe等人(2015)molcell58:1040-1052·hinson等人(2000)endocrrev21:138-167(2000)·takei等人(2004)febslett556:53-58.·mclatchie等人(1998).nature393:333-339·bell,d.&mcdermott,b.j.(2008)brjpharmacol153suppl1,s247-262·muff,r.等人(1998).febslett441,366-368·hay等人(2005)molpharmacol67:1655-1665·robinson等人(2009)jpharmacolexpther331:513-521·yin等人(2009)jbiolchem284:12328-12338·vanderlee等人(2008)jbiomolscreen13:986-998技术实现要素:提供了涉及肾上腺髓质素和垂体中叶素类似物的组合物和方法,所述类似物对clr/ramp受体(即clr/ramp1、2和3)表现出超激动或超拮抗活性。基于clr/ramp受体信号传导和人淋巴内皮细胞系统,本文显示当与肾上腺髓质素、cgrp或垂体中叶素相比时,肾上腺髓质素和垂体中叶素的含有嵌合序列和n-末端酰化且任选地包含微型-peg部分的类似物就ec50或最大内在活性而言表现出针对clr/ramp1、clr/ramp2和/或clr/ramp3受体的优异激动受体-活化活性。此类嵌合肽在本文中可被称为泛特异性超激动剂。在本发明的一些实施方案中,提供了肾上腺髓质素类似物,所述类似物含有n-末端微型-peg和酰化部分,当与野生型配体相比时,所述类似物表现出针对clr/ramp2和/或clr/ramp3受体的超激动活性。此类类似物在本文中可被称为clr/ramp2-受体特异性超激动剂。在其他实施方案中,提供了具有n-末端酰化的包含肾上腺髓质素和垂体中叶素的嵌合序列的拮抗类似物,当与已知的clr/ramp受体拮抗剂相比时,所述类似物就ic50而言表现出针对clr/ramp1、clr/ramp2和/或clr/ramp3受体的优异拮抗活性。此类嵌合肽在本文中可被称为泛特异性、clr/ramp1特异性或clr/ramp2特异性超激动剂。不受作用机制限制,当与野生型配体相比时,这些类似物表现出的超激动作用和超拮抗作用可部分地通过形成稳定的配体-受体复合物来解释。已经出人意料地发现,如本文所公开和描述的,adm的n-末端部分和垂体中叶素的c-末端部分中的某些选择氨基酸负责肽激动剂活性的特异性和效力。本文显示,取代adm的n-末端部分中的某些氨基酸和修饰可调节从clr/ramp受体的正常激动剂到超激动剂的活性。另外的取代或修饰可为本发明的肽提供额外的令人希望的特征。附图说明当结合附图阅读时,从以下详细描述中可最透彻地理解本发明。要强调的是,按照惯例,附图的各种特征不成比例。相反,为清楚起见,各种特征的尺寸任意地放大或缩小。在附图中包括以下各图。图1.通过超激动剂刺激具有2%fbs培养基中的人淋巴内皮细胞增殖。用clr/ramp受体的超激动剂(seqidno:28、30、33、38、39、40和69)处理原代人淋巴内皮细胞(hlec)显著促进纳摩尔范围的hlec增殖。对于体外细胞生长测定,将hlec在补充有2%胎牛血清(fbs)和不同浓度的所述激动剂(30、100和300nm)的内皮细胞基础培养基中孵育。将细胞培养72小时,并用mts测定法(promega)来测定细胞活力。相比之下,正常激动剂(seqidno:52、53、54和59)在相同培养条件下对hlec增殖具有可忽略不计的影响。条形图上方的星号表示细胞增殖的显著差异(%)。图2.通过超激动剂刺激具有0.1%fbs培养基中的人淋巴内皮细胞存活。用clr/ramp受体的超激动剂(seqidno:28、30、33、38、39、40和69)处理原代人淋巴内皮细胞(hlec)显著促进纳摩尔范围的hlec存活。对于体外细胞存活测定,将hlec在补充有0.1%胎牛血清(fbs)和不同浓度的所述激动剂(30、100和300nm)的内皮细胞基础培养基中孵育。将细胞培养72小时,并用mts测定法(promega)来测定细胞活力。相比之下,正常激动剂(seqidno:52、53、54和59)在相同培养条件下对hlec增殖具有可忽略不计的影响。条形图上方的星号表示细胞存活的显著差异(%)。具体实施方式定义阐述以下定义以说明和定义用于描述实施方案的各种术语的含义和范围。如本文所用,“激动剂”是指与其互补的生物活性受体结合并活化后者以在所述受体中引起生物反应或增强所述受体的预先存在的生物活性的生物活性配体。拮抗剂是指与生物活性受体结合并降低反应的生物活性配体。如本文所用,“拮抗剂”是指抑制受体的生理反应的生物活性配体。如本文所用,超激动剂是具有比天然配体更大的生物活性的激动剂,包括但不限于野生型人垂体中叶素、肾上腺髓质素或降钙素基因相关肽(cgrp)。可参考特定配体/受体对的活性,例如降钙素受体样受体(clr)和三种受体活性修饰蛋白(ramp1、2和3)中的一种。降钙素受体样受体(clr)和受体活性修饰蛋白(ramp)的共表达是产生cgrp、adm和imd的功能性受体所需的。cgrp主要通过clr/ramp1受体起作用,而adm对clr/ramp2和3受体具有高亲和力。imd未表现出对三种clr/ramp受体的明显偏爱。肽可以是相对于特定受体的天然配体,所述受体的超激动剂,或者可以是关于多种受体的超激动剂,以及所述受体中的一种的任何天然配体。在一些实施方案中,超激动剂具有相对于一种或多种受体的天然配体,大于约105%、110%、125%、150%、175%、2倍、3倍、5倍或更多的活性。特异性超激动剂。特异性超激动剂对选定受体具有高活性,其中所述超激动剂可针对clr/ramp受体家族的一个成员具有大于约5倍、大于约10倍、大于约20倍或更多的活性。在一些实施方案中,超激动剂相对于clr/ramp2对clr/ramp1具有特异性。在其他实施方案中,超激动剂相对于clr/ramp1对clr/ramp2具有特异性。本文的超拮抗剂或拮抗剂抑制一种或多种受体,特别是由adm、imd和cgrp活化的受体的生物活性。超拮抗剂可将活性抑制至大于天然配体的抑制的程度。拮抗剂或超拮抗剂可例如在天然配体存在下使受体活性抑制105%、110%、125%、150%、175%、2倍、3倍、5倍或更多。超拮抗剂或拮抗剂可以是泛特异性的。泛特异性超激动剂、激动剂或拮抗剂对两种或更多种受体具有活性。在一些实施方案中,所述受体包括clr/ramp1、clr/ramp2和clr/ramp3中的两种或更多种。在一些实施方案中,所述受体是clr/ramp1、clr/ramp2和/或clr/ramp3。微型-peg。微型-peg部分可被定义为cas编号:166108-71-0;fmoc-nh-(peg)-cooh,或fmoc-8-氨基-3,6-二噁辛酸;分子量:385.42g/mol;具有结构:在偶联反应中,微型-peg与氨基酸表现相似:微型-peg的游离酸末-端将与最后一个n-末端氨基酸的游离氨基(在我们的情况下,lys残基)反应以形成肽键。在以下脱保护程序中,使保护基团fmoc裂解掉以暴露微型-peg的游离氨基。天然肾上腺髓质素、垂体中叶素或降钙素基因相关肽(cgrp)。如本文所用,所述术语是指本领域中已知的这些肽的常见野生型对应物。包括野生型人肽,但是也可使用其他哺乳动物对应物,例如,非人灵长类动物、猿、犬、马、鼠科动物、猫科动物、兔类动物、牛、绵羊、猪等。如本文所用,“药学上可接受的盐”是指制药工业中常用的无毒碱金属盐、碱土金属盐和铵盐,包括钠、钾、锂、钙、镁、钡、铵和鱼精蛋白锌盐。所述术语还包括无毒酸加成盐,所述无毒酸加成盐通常通过使本文公开的clr/ramp受体超激动剂与合适的有机或无机酸反应来制备。代表性的盐包括盐酸盐、氢溴酸盐、硫酸盐、硫酸氢盐、乙酸盐、草酸盐、戊酸盐、油酸盐、月桂酸盐、硼酸盐、苯甲酸盐、乳酸盐、磷酸盐、甲苯磺酸盐、柠檬酸盐、马来酸盐、富马酸盐、琥珀酸盐、酒石酸盐、萘磺酸盐等。因此,所述术语是指保留游离碱的生物有效性和性质并且不是在生物学或其他方面不合乎需要的那些盐,所述盐是与以下形成的:无机酸,如盐酸、氢溴酸、硫酸、硝酸、磷酸等;以及有机酸,如乙酸、丙酸、乙醇酸、丙酮酸、草酸、苹果酸、丙二酸、琥珀酸、马来酸、富马酸、酒石酸、柠檬酸、苯甲酸、肉桂酸、扁桃酸、甲磺酸、乙磺酸、对甲苯磺酸、水杨酸等。关于作为前药的药学上可接受的盐的描述,参见bundgaard,h.编著,1985designofprodrugs,elseviersciencepublishers,amsterdam。如本文所用,“药学上可接受的酯”是指在酯键水解后保留羧酸或醇的生物有效性和性质并且不是在生物学上或其他方面不合需要的那些酯。关于作为前药的药学上可接受的酯的描述,参见bundgaard,h.编著,1985designofprodrugs,elseviersciencepublishers,amsterdam。所述酯的醇组分通常将包含(i)c2-c12脂族醇,其可或不可含有一个或多个双键,并且可或不可含有支链碳;或(ii)c7-c12芳族或杂芳族醇。如本文所用,“c-末端酰胺”是指替代通常存在于多肽的羧基末端的c-末端羟基部分以使得所述多肽以羧酰胺结束(即,c(=o)-nh2而不是c-末端羧基(即c(=o)-oh)部分结束的酰胺部分。这些酰胺通常由相应的羧酸和胺形成。通常,酰胺形成可经由常规合成技术来完成。参见例如,mark,等人1980encyclopediaofchemicaltechnology,johnwiley&sons,newyork。如本文所用,“药学上可接受的载体”是指不会干扰活性成分的生物活性的有效性并且对宿主或患者无毒的载体介质。如本文所用,“立体异构体”是指具有与另一个相同的分子量、化学组成和键合顺序、但其原子在空间上围绕一个或多个手性中心不同地分组的实体。也就是说,同一化学式的立体异构体将含有位于围绕至少一个手性中心的不同空间取向中的相同化学部分。当纯净时,立体异构体具有使平面偏振光旋转的能力。本文公开的肽可具有一个或多个不对称碳原子,并且因此包括各种立体异构体。所有立体异构体都包括在实施方案的范围内。如本文所用,应用于如本文公开的组合物的“治疗上”或“药学上有效量”是指组合物的足以诱导所需生物学结果的量。所述结果可以是疾病的体征、症状或病因缓解,或生物系统的任何其他所需改变。如本文所用,术语“肽残基”和“肽结构”意图包括由天然存在的l-氨基酸和相应的d-氨基酸组成的肽,以及天然存在的l-氨基酸的肽衍生物、肽类似物和肽模拟物,结构。设计肽类似物、衍生物和模拟物的方法是本领域中已知的。例如,参见veber和freidinger1985tins第392页;evans,等人1987j.med.chem.30:229。结构上与治疗上有用的肽类似的肽模拟物可通过本领域中已知并在以下参考文献中进一步描述的方法用于产生等效的或增强的治疗或预防作用:spatola,a.f.1983于:chemistryandbiochemistryofaminoacids,peptides,andproteins,b.weinstein,编著,marceldekker,newyork,第267页中;holladay,等人1983tetrahedronlett.24:4401-4404。用同一类型的d-氨基酸(例如d-赖氨酸而非l-赖氨酸)对共有序列的一个或多个氨基酸进行系统取代可用于产生更稳定的肽。此外,可通过本领域中已知的方法来产生包含共有序列或基本相同的共有序列变异的限制性肽(rizo,等人1992ann.rev.biochem.61:387,以引用的方式整体并入本文);例如,通过添加能够形成使肽环化的分子内二硫桥键的内部半胱氨酸残基、添加环状内酰胺桥或使用柔性6-氨基己酸(ahx)、刚性氨基异丁酸(aib)或d-氨基酸残基以改变螺旋的稳定性。如本文所用,化合物,例如肽或氨基酸的“衍生物”是指所述化合物的一种形式,其中所述化合物中的一个或多个反应性基团已用取代基衍生化。肽衍生物的实例包括其中氨基酸侧链、肽主链或氨基-或羧基-末端已衍生化的肽(例如,具有甲基化酰胺键联或羟基化氨基酸或氨基酸残基的肽化合物)。如本文所用,化合物的“类似物”是指保留所述化合物的功能活性所必需的参考化合物的化学结构但仍含有与参考化合物不同的某些化学结构的化合物。如本文所用,化合物的“模拟物”是指其中所述化合物的功能活性所必需的参考化合物的化学结构已被模拟参考化合物的构象的其他化学结构所替代的化合物。肽模拟物的实例包括其中肽主链被一个或多个苯并二氮杂卓分子取代的肽化合物、其中所有l-氨基酸被相应的d-氨基酸取代的肽以及“逆向-反转”肽(参见sisto的美国专利号4,522,752;james,g.l.等人1993science260:1937-1942;以及goodman等人1981perspectivesinpeptidechemistry第283-294页)。其他衍生物包括c-末端羟甲基衍生物、o-修饰的衍生物(例如,c-末端羟甲基苄基醚)和n-末端修饰的衍生物,包括取代的酰胺如烷基酰胺和酰肼。如本文所用,术语“氨基酸结构”意图包括氨基酸,以及维持化合物的功能活性的氨基酸的类似物、衍生物和模拟物。例如,术语“苯丙氨酸结构”意图包括苯丙氨酸以及吡啶基丙氨酸和高苯丙氨酸。术语“亮氨酸结构”意图包括亮氨酸,以及用缬氨酸、异亮氨酸或具有脂肪族侧链的其他天然或非天然氨基酸如正亮氨酸取代。本文公开的肽化合物的氨基-和/或羧基-末端可以是标准氨基和羧基末端,如在大多数蛋白质中所见。或者,肽化合物的氨基-和/或羧基-末端可通过衍生物基团的添加或替代而进行化学修饰。可存在于肽化合物的n-末端的氨基衍生物基团包括乙酰基、芳基、芳烷基、酰基、环氧琥珀酰基和胆固醇基。可存在于肽化合物的c-末端的羧基衍生物基团包括醇、醛、环氧琥珀酸酯、酰卤、羰基、卤代甲烷、重氮甲烷基团和羧酰胺。羧酰胺是优选的。如本文所用,“显像剂”是指当与化合物共价连接时允许检测化合物的材料,包括但不限于已施用clr/ramp受体超激动剂的患者的体内检测。合适的显像剂是本领域熟知的,并且包括例如,放射性同位素、荧光标记(例如,荧光素)等。相对于此类因素选择标记完全在本领域的技术范围内。可检测标记与肽或肽模拟物的共价连接通过本领域熟知的常规方法来完成。例如,当使用125i放射性同位素作为显像剂时,可通过将氨基酸酪氨酸并入肽或肽模拟物中且然后使所述肽碘化来实现125i与所述肽或肽模拟物的共价连接(参见例如,weaner,等人1994synthesisandapplicationsofisotopicallylabelledcompounds;第137-140页)。如本文所用,术语“治疗剂”是指能够对特定疾病适应症具有所需治疗作用的药剂,包括但不限于心力衰竭或降血压剂。如本文所用,“修饰的”是指保留相关多肽的总体结构但与所述相关多肽相差至少一个残基的多肽。如本文所用,“修饰的c-末端”是多肽的具有除标准肽羧基以外的化学结构的c-末端,这种修饰的c-末端的实例是c-末端羧酰胺。如本文所用,“药学上可接受的载体”是指不会干扰活性成分的生物活性的有效性并且对宿主或患者无毒的载体介质。如本文所用,术语“肽残基”和“肽结构”意图包括由天然存在的l-氨基酸和相应的d-氨基酸组成的肽,以及天然存在的l-氨基酸的肽衍生物、肽类似物和肽模拟物,结构。设计肽类似物、衍生物和模拟物的方法是本领域已知的(参见farmer,p.s.于:drugdesigne.j.ariens,编著academicpress,newyork,1980,第10卷,第119-143页;ballj.b.和alewood,p.f.1990/.mol.recognition3:55;luthman,等人1996atextbookofdrugdesignanddevelopment,14:386-406,第2版,harwoodacademicpublishers;joachimgrante,angew.1994chem.int.ed.engl.33:1699-1720)。结构上与治疗上有用的肽类似的肽模拟物可通过本领域中已知的方法用于产生等效或增强的治疗或预防作用(参见spatola,a.f.1983于:chemistryandbiochemistryofaminoacids,peptides,andproteins,b.weinstein,编著,marceldekker,newyork,第267页中;spatola,a.f.1983vegadata,第1卷,第3期,peptidebackbonemodifications(一般性综述);jennings-white,等人1982tetrahedronlett.23:2533;holladay,等人1983tetrahedronlett.24:4401-4404;以及hruby,1982lifesci.31:189-199)。此外,可通过本领域中已知的方法来产生包含共有序列或基本相同的共有序列变异的限制性肽(rizo,等人1992ann.rev.biochem.61:387);例如,通过添加能够形成使肽环化的分子内桥键的内部半胱氨酸残基或有机接头、添加环状内酰胺桥或使用柔性6-氨基己酸(ahx)、刚性氨基异丁酸(aib)或d-氨基酸残基以改变螺旋的稳定性。合成或非天然存在的氨基酸是指不在体内天然存在、但仍可并入本文描述的肽结构中的氨基酸。本文所述的修饰的肽可通过例如使用标准固相技术来制备(参见merrifield,1963.am.chem.soc.85:2149;j.m.stewart和j.d.young,1984solidphasepeptidesyntheses第2版,piercechemicalcompany)。这些程序也可用于合成其中除20种天然存在的遗传编码的氨基酸之外的氨基酸在如本文公开的任何修饰肽的一个、两个或多个位置处被取代的肽。例如,萘基丙氨酸可取代色氨酸,从而促进合成。可被取代成本发明实施方案的肽的其他合成氨基酸包括l-羟丙基、l-3,4-二羟基-苯丙氨酰基、d氨基酸如l-d-羟赖氨酰基和d-d-甲基丙氨酰基、l-a-甲基丙氨酰基、β-氨基酸以及异喹啉基。d氨基酸和非天然存在的合成氨基酸也可并入本发明实施方案的肽中(参见roberts,等人1983unusualamino/acidsinpeptidesynthesis5:341-449)。在一些实施方案中,20种遗传编码的氨基酸的天然存在的侧链或如本文公开的任何其他侧链可转座至氨基酸的氮,而不是通常在肽中发现的α-碳。一些实施方案提供了修饰的肽激动剂,所述肽激动剂与如本文公开的全长多肽序列(例如,seqidno:28-51、69-70、92、94、101、103和110)或如本文公开的全长多肽序列的任何其他具体定义的片段具有60%-99%氨基酸序列同一性。关于本文鉴定多肽序列的“氨基酸序列同一性百分比(%)”被定义为在比对序列并且必要时引入空位以实现最大序列同一性百分比,并且不考虑任何保守取代作为序列同一性的一部分之后,候选序列中与特定多肽序列中的氨基酸残基相同的氨基酸残基的百分比。出于测定氨基酸序列同一性百分比的目的的比对可以属于本领域中的技能的多种方式实现,所述方式例如使用可公开获得的计算机软件,如blast、blast-2、align或megalign(dnastar)软件。本领域技术人员可确定用于测量比对的适当参数,包括为在所比较序列的全长上实现最大比对所需的任何算法。本文所述的激动剂或拮抗剂肽的序列的变化可例如使用例如在美国专利号5,364,934(drayna等人,1994年11月15日发布)中阐述的用于保守和非保守突变的任何技术和准则来进行。变化可以是激动剂或拮抗剂肽的取代、缺失或插入,所述取代、缺失或插入导致与参考激动剂或拮抗剂肽序列相比,所述激动剂或拮抗剂肽的氨基酸序列的改变。提供了稳定化的超激动和超拮抗肽衍生物,其中肽衍生物的序列和/或侧链被改变。所述衍生物针对clr/ramp受体的生物活性当与wtadm、cgrp或imd相比时优异。稳定的超拮抗肽基于它们对内皮细胞增殖和/或体外存活力的特异性作用与wt肽相比时也显示出优异的药理作用。任选地,这些修饰的肽衍生物与异源部分共价连接,所述异源部分可包含聚合物、fc、fcrn结合配体、免疫球蛋白、白蛋白、胶原结合基序、rgd基序以及白蛋白结合配体,或通过n-甲基化。共价连接的聚合物可选自由以下组成的组:任选取代的、饱和的或单-或二-不饱和的直链或支链c3-c100羧酸,优选c4-c30羧酸(脂化);聚乙二醇(peg)部分;聚丙二醇(ppg)部分;pas部分,其是主要包含丙氨酸和丝氨酸残基或主要包含丙氨酸、丝氨酸和脯氨酸残基的氨基酸序列,所述氨基酸序列在生理条件下形成无规卷曲构象[us号2010/0292130和wo2008/155134];和羟乙基淀粉(hes)部分[wo02/080979];fc;fcrn结合配体;白蛋白和白蛋白结合配体以及xten部分(参见schellenberger,等人,2009,naturebiotechnology27(12):1186-1192)。当共价键联是至peg时,peg分子量可介于约1kda与约100kda之间,以便于处理和制造。例如,peg可具有约200、500、1000、2000、4000、8000、16,000、32,000、64,000或100,000kda的平均分子量。在一些实施方案中,peg可具有支化结构(美国专利号5,643,575;morpurgo等人appl.biochem.biotechnol.56:59-72(1996);vorobjev等人,nucleosidesnucleotides18:2745-2750(1999);以及caliceti等人,bioconjug.chem.10:638-646(1999))。任选地,修饰的肽衍生物包含二硫键与内酰胺桥的一个或多个取代,以增加肽的代谢稳定性。胱硫醚对硫醇还原具有抗性。因此,用硫醚或硒硫化物、二硒化物和二碲化物桥取代二硫化物可提供针对还原的保护[knerr等人,acschembiol,6(7),753-760,2011;muttenthaler等人jmedchem.,53(24),8585-8596,2010]。基于二氨基二酸的肽二硫键模拟物也可用于提高类似物的稳定性(cui等人,angewchem,125,9737-9741,2013)。二硫桥键也可通过插入不同性质的接头或桥来进行修饰。含有处于非共价结合状态的药物分子的聚合物基质可作为溶液、水凝胶、微粒或胶束注射[d.h.lee等人,j.contr.rel.,92,291-299,2003]。肽或蛋白质的永久聚乙二醇化以增强其溶解度、降低免疫原性并通过降低肾清除率来增加半衰期是本领域中已知的[calicetip.,veronesef.m.,adv.drugdeliv.rev.,55,1261-1277,2003;t.peleg-shulman等人,j.med.chem.,47,4897-4904,2004]。任选地,通过添加一个或多个烷烃、胆固醇或peg-胆固醇部分来修饰经修饰的肽衍生物,以增加肽的代谢稳定性。经由引入合成支架(钉),可使用闭环复分解来合成钉合肽,以将肽锁定在特定构象中并减少构象熵。本发明还包括式(i)、(ii)和(iii)化合物的前药,即本身可以是生物活性或非活性的、但在体内被转化(例如代谢或水解)成式(i)、(ii)和(iii)的化合物的化合物。前药可以是基于掩蔽胺官能团或掩蔽酪氨酸的酚基团(内部亲核试剂辅助裂解酚基团上的氨基甲酸酯)等。提供了基于聚合物的前药,所述前药包含本文所述的超激动或超拮抗肽。前药是在显示其药理作用之前经历生物转化的任何化合物。载体连接的前药(载体前药)包含给定活性物质与瞬时载体基团的临时连接,所述连接产生改善的物理化学或药物代谢动力学性质,并且可通过生物化学裂解在体内除去。基于peg的载体前药需要活性药物与载体之间的接头的酶活化,主要通过酶水解引发。通常使用的级联接头在肽或蛋白质中连接胺官能团。在级联接头中,除去掩蔽基团作为级联中的限速步骤。这活化接头以在第二位置分解来释放肽或蛋白质。通常,可通过酶促机制除去掩蔽基团[r.b.greenwald等人于wo2002/089789中;greenwald,等人,j.med.chem.1999,42,3657-3667;f.m.h.degroot等人于wo2002/083180和wo2004/043493中;以及d.shabat等人于wo2004/019993中]。不依赖于酶活化的替代方案(参见wo2005/099768)利用苯酚上的掩蔽基团,其通过内部亲核试剂的攻击以纯ph依赖性方式除去。这活化接头以进一步分解(参见us8,680,315)。在ph触发的分解后,药物被释放。另一种针对苯酚(例如酪氨酸)优化的方法是基于氨基甲酸酯,所述氨基甲酸酯在苯酚释放下被亲核胺ph依赖性地攻击并且产生连接至大分子的环脲,如wo2013/064455中所描述。肽的药物代谢动力学性质可通过脂化来进行调节。脂化可发生在肽序列内的n-末端或氨基酸的侧链官能团。在出版物和专利中描述了脂化(zhang等人currmed19:1602-18,2012;gerauer等人wileyencyclopediaofchemicalbiology,第2卷,520-530,2009,(hrsg.begley,t.p.).johnwiley&sons,hoboken,nj.。adm序列的脂化在wo2012/138867中进行了描述。用作显像剂以及还有治疗剂的标记的adm衍生物是已知的[j.depuis等人在ca2567478和wo2008/138141中]。在这些adm衍生物中,能够结合放射性同位素的络合笼状分子结构以直接方式或经由可能还包括短peg间隔物的间隔单元连接至adm的n末端。这些药物的诊断或治疗价值来自放射性分子的靶向递送。本发明还包括根据本发明的式(i)、(ii)和(iii)化合物的所有合适的同位素变体。化合物的同位素变体应理解为是指其中根据本发明的化合物内的至少一个原子已被交换为具有相同原子序数但具有与通常或主要在自然界中存在的原子质量不同的原子质量的另一原子的化合物。可并入化合物中的同位素的实例是氢、碳、氮、氧、磷、硫、氟、氯、溴和碘,如2h(氘)、3h(氚)、13c、14c、15n、170、180、32p、33p、33s、34s、35s、36s、18f、36c1、82br、123i、124i、129i和131i化合物的特定同位素变体可例如,有益于检查体内作用机制或活性化合物分布。此外,(例如氘的)同位素的并入可由于化合物的更高代谢稳定性而产生特定的治疗益处,例如延长体内半衰期或减少所需的活性剂量。肽组合物和制剂本文提供了式(i)、(ii)和(ii)的化合物及其盐、其溶剂化物和其盐的溶剂化物。所述化合物可具体地作为工作实例阐述。本文所述的肽任选地作为微型化分子量提供,其促进分子在体内的渗透和扩散,以及进入中枢神经系统,从而提高疾病治疗的效用。微型化受体激动剂或拮抗剂的产生不仅促进肽在细胞外液中的扩散,而且允许分子进入太小而不允许更大的类似物进入的有限空间。先前adm或imd类似物分别是39和40个氨基酸长;并且cgrp类似物的长度是37个氨基酸。本文提供的肽包括长度为35-36个氨基酸的微型化超激动剂,以及长度为17-28个氨基酸的微型化超拮抗剂的实例。微型化类似物也是独特的,在于先前没有描述在野生型肽的连续序列的中间含有截短的clr/ramp受体配体。激动剂和超激动剂在一些实施方案中,提供了一种clr/ramp受体超激动剂,其具有式i的结构:ba-ca-da(i)其中ba是肾上腺髓质素肽家族成员的修饰的n-末端片段,所述片段包含二十至二十八个氨基酸残基,其中所述n-末端片段的两个氨基酸残基是半胱氨酸(cys),并且其中所述片段的c-末端残基是苏氨酸(thr)。ba可由以下结构表示:(b0-b1-b2-c-b4-b5-g-b7-c-b9-b10-b11-b12-b13-b14-b15-b16-b17-b18-b19-b20-b21);ca是由3-12个氨基酸组成的中心核心;并且da是垂体中叶素(imd)的修饰的c-末端片段,所述片段包含3-6个氨基酸残基与c-末端酰胺,其中da的至少一个氨基酸是选自组氨酸(his)、脯氨酸(p)、丝氨酸(ser)和酪氨酸(tyr)。在一些实施方案中,ba的特征在于序列中存在形成二硫键的两个半胱氨酸。二硫键中涉及的两个cys残基之间的残基在顺序上是不受约束的。上述二硫键使ba-ca-da的结构稳定,从而促进α-螺旋的形成以及ba-ca-da与靶受体的跨膜组分的结合。当与野生型adm(seqidno:53-54)、imd(seqidno:52)或具有不适当序列的嵌合肽(seqidno:55-68)相比时,在式i的肽的n-末端引入微型-peg和酰化修饰或在所述n-末端在微型-peg不存在下的酰化修饰产生分子与clr/ramp1或clr/ramp2受体相互作用的超激动剂活性。在不存在这种酰化/或聚乙二醇化的情况下,当与野生型adm、imd或嵌合配体相比时,此类修饰产生占据受体并活化信号转导途径的分子,其中受体活化效力增加大于约5倍。在一些实施方案中,超激动剂包含在微型-peg不存在下的酰化修饰。向ba-ca-da的第一个半胱氨酸的n-末端添加残基可能不会影响多肽的超激动特征。在一些实施方案中,所述肽在式i的肽的第一个半胱氨酸的n-末端残基处连接至氨基酸残基或多肽。式i的肽可连接至与多肽,例如,血清多肽如白蛋白、免疫球蛋白,包括免疫球蛋白恒定区等。在一些实施方案中,式i的clr/ramp受体超激动剂包含选自由以下组成的组的氨基酸序列、由其组成或基本上由其组成(其中“pal”表示棕榈酸酯部分,并且“ace”表示乙酰化末端):所述肽可包含源自adm和/或imd的片段,如通过所述序列的比对显而易见的。在一些实施方案中,一个或多个氨基酸残基在n-末端融合至b1,从而产生相对于b1具有n-末端残基延伸的多肽。在一些实施方案中,所述延伸不会影响超激动剂的生物活性。在一些实施方案中,如本文公开的式i的超激动剂包含含有3至12个氨基酸残基的中心核心ca。所述中心核心的长度不受残基数量限制,但受需要定位ba和da以使得它们可与细胞膜表面处的靶受体相互作用的空间考虑因素限制。在具有式i的结构的clr/ramp受体超激动剂的一些实施方案中,所述中心核心包含来自一系列物种中的任一种的肾上腺髓质素或垂体中叶素的片段,包括但不限于哺乳动物物种。在一些实施方案中,ca与序列dkdkdnvaprsk(seqidno:18)、dkdkdnsapvdp(seqidno:19)、pagrqdsapvdp(seqidno:20)、dkdkdnvapvdp(seqidno:21)、dkdkqdsapvdp(seqidno:22)、dkgrqdsapvdp(seqidno:23)、dkdkdsapvdp(seqidno:24)、dkdksapvdp(seqidno:25)或dkdsapvdp(seqidno:26)具有至少60%、至少85%、至少90%、至少95%、至少99%或100%的序列同一性。在一些实施方案中,ca与seqidno:18-26中的任一个具有60%或更大序列同一性。da是imd肽的c-末端片段,所述片段包含来自垂体中叶素的c-末端的3、4、5、6或更多个氨基酸残基。da具有c-末端酰胺。da的至少一个氨基酸是选自脯氨酸(pro)、组氨酸(his)、酪氨酸(tyr)和丝氨酸(ser)。与上述ca一样,da不受其序列的限制,但受其与clr/ramp1和clr/ramp2受体相互作用的能力限制。在da的情况下,要求是它在其细胞外结构域中的位点处与靶受体相互作用,以使得当激动剂结合时,所述受体变得活化。在一些实施方案中,da包含至少一个酪氨酸残基。在一些实施方案中,对da的c-末端进行修饰,以使得其包含酰胺化的羧基(—c(=o)nh2)部分。在一些实施方案中,clr/ramp2受体特异性超激动剂包含seqidno:69、70、94、202、103或110的肽,由其组成或基本上由其组成。在本文的一些实施方案中,本文提供了clr/ramp受体超激动剂,其保留了结合细胞膜处的clr/ramp受体的激动剂的序列,但与所述激动剂序列相差至少一个氨基酸残基。在一个优选的实施方案中,源自adm和imd的嵌合超激动剂是用于增加超激动剂或超拮抗剂的功效的结构的一部分。在一些实施方案中,ba是选自由seqidno:1-16的肽组成的组。在一些实施方案中,式i的clr/ramp受体超激动剂包含第一肽片段,所述第一肽片段具有来自adm序列(包括但不限于人adm)的约十九个氨基酸残基或更多;第二肽片段,所述第二肽片段具有来自adm和imd(包括但不限于人adm和imd)的约三个氨基酸残基或更多;以及来自imd(包括但不限于人imd)的第三肽片段。在一些实施方案中,式i的clr/ramp受体超激动剂包含连续的第二和第三肽片段。拮抗剂和超拮抗剂adm/cgrp/imd家族肽的n-末端部分中的某些选定氨基酸负责肽激动剂活性。截短或取代这些肽的n-末端部分中的某些氨基酸可调节从激动剂到拮抗剂的活性。已经发现,另外的取代或修饰可为拮抗剂提供额外的所需特征。例如,阻断cgrp信号传导可适用于预防偏头痛的发展或进展;而clr/ramp2信号传导的阻断代表减少肿瘤生长和癌症进展的抗血管生成方法。然而,现有clr/ramp受体拮抗剂与功效问题相关。肽拮抗剂如cgrp8-37和adm22-52具有极短的半衰期和低效力,并且是受体特异性的。在一些实施方案中,提供了一种clr/ramp受体超拮抗剂,所述拮抗剂具有式ii的结构:bb-cb-db(ii)其中bb是肾上腺髓质素肽家族成员的n-末端片段,所述片段包含十二至十三个氨基酸残基,其中bb可由以下结构表示:(b0-b1-b2-b3-b4-b5-b6-b7-b8-b9-b10-b11-b12);cb是由约3、约4、约5、约6、约7、约8、约9、约10、约11、约12个氨基酸组成的中心核心;并且db是垂体中叶素(imd)的修饰的c-末端片段,所述片段包含约3、约4、约5、约6个氨基酸残基与c-末端酰胺,其中所述c-末端片段的至少一个氨基酸是选自组氨酸(his)、脯氨酸(p)、丝氨酸(ser)、酪氨酸(tyr)。在一些实施方案中,泛特异性、clr/ramp1特异性和clr/ramp2特异性受体超拮抗剂包含以下、由以下组成或基本上由以下组成:在一些实施方案中,clr/ramp受体超拮抗剂包含与seqidno:77-78、112、114、119、120-125或139的氨基酸序列具有大于60%、大于70%、大于870%、大于90%、大于95%序列同一性的氨基酸序列,其中所述肽保留拮抗剂活性。clr/ramp受体超拮抗剂可包含seqidno:77-78、112、114、119、120-125或139的氨基酸序列的立体异构体、衍生物或肽模拟物。在具有式ii的结构的clr/ramp受体超拮抗剂的一些实施方案中,所述拮抗剂包含具有6个氨基酸残基或更少的第三肽片段(db),其中所述第三肽片段具有来自adm或imd的序列。在具有式ii的结构的clr/ramp受体超拮抗剂的一些实施方案中,所述第二肽片段和第三肽片段是连续的。在具有式ii或iii的结构的修饰的超拮抗剂的一些实施方案中,所述序列包含来自一系列物种中的任一种的adm或imd的片段。在一些实施方案中,所述类似物可与seqidno:77-78、112、114、119、120-125或139具有60%、65%、70%、75%、80%、85%、90%或95%序列同一性。在具有式ii的结构的clr/ramp受体超拮抗剂的一些实施方案中:bb是adm和imd肽家族成员的修饰的n-末端片段,所述片段包含四至十三个氨基酸残基;cb是包含三至六个氨基酸残基的中心核心;并且db是imd的c-末端片段,所述片段包含三至六个氨基酸残基与c-末端酰胺,其中所述c-末端片段的至少一个氨基酸是组氨酸(his)、脯氨酸(p)、丝氨酸(ser)或酪氨酸(tyr)或其药学上可接受的盐。bb、cb和db的长度不受残基本身数量的限制,但受允许类似物分别与野生型adm/cgrp/imd家族肽竞争与细胞膜表面和细胞外结构域处的靶受体相互作用的空间考虑因素(即,功能要求)限制。在一些实施方案中,与野生型分子相比,所述clr/ramp受体超拮抗剂在与clr/ramp受体或与降钙素/cgrp受体家族的成员相互作用中具有分子的活化活性的丧失,但是可能不会影响与所述受体的结合。结果,所述clr/ramp受体超拮抗剂代表可占据受体、但通过使受体不可用于通过信号转导激动剂或通过排斥配体的亲水性结合来拮抗而不是活化信号转导途径。在一些实施方案中,超拮抗剂具有式ii的结构,其中所述bb片段包含:(b0-b1-b2-b3-b4-b5-b6-b7-b8-b9-b10-b11-b12(seqidno:16),其中:b0可选自由天然氨基酸或不存在组成的组;b1、b2、b3、b4、b5、b6、b7、b8、b9、b10、b11和b12可选自由以下组成的组:缬氨酸(val)、亮氨酸(leu)、丙氨酸(ala)、异亮氨酸(ile)、半胱氨酸(cys)、丝氨酸(ser)和酪氨酸(tyr)、精氨酸(arg)、天冬酰胺(asn)、天冬氨酸(asp)、谷氨酸(glu)、谷氨酰胺(gin)、组氨酸(his)、赖氨酸(lys)和酪氨酸(tyr)、苯丙氨酸(f)或不存在。在一些实施方案中,超拮抗剂具有式iii的结构:b0-b1-b2-b3-b4-b5-b6-b7-b8-b9-b10-b11-b12-b13-b14-b15-b16-b17-b18-b19-b20-b21-b22-b23-b24-b25-b26-b27-b28-nh2(iii)其中:b0是选自由以下组成的组:空残基、酰化组氨酸(acy-his)、酰化精氨酸(acy-arg)、酰化赖氨酸(acy-lys)、酰化丝氨酸(acy-ser)、酰化苏氨酸(acy-thr)、酰化酪氨酸(acy-tyr)、酰化天冬氨酸(acy-asp)、酰化谷氨酸(acy-glu)、酰化谷氨酰胺(acy-gln)、酰化天冬酰胺(acy-asn)、酰化缬氨酸(acy-val)、酰化丙氨酸(acy-ala)、酰化甘氨酸(acy-gly)、酰化异亮氨酸(acy-ile)、酰化亮氨酸(acy-leu)、酰化苯丙氨酸(acy-phe)、酰化色氨酸(acy-trp)、酰化脯氨酸(acy-pro)、酰化甲硫氨酸(acy-met)、酰化半胱氨酸(acy-cys)、双酰化组氨酸(acy-his(acy))、ace-组氨酸(acy)(ace-his(acy))、微型-peg-酰化-组氨酸(微型-peg-his(acy))、双酰化精氨酸(acy-arg(acy))、ace-精氨酸(acy)(ace-arg(acy))、微型-peg-酰化-精氨酸(微型-peg-arg(acy))、赖氨酸(lys)、双酰化赖氨酸(acy-lys(acy))、ace-赖氨酸(acy)(ace-lys(acy))以及微型-peg-酰化-赖氨酸(微型-peg-lys(acy);b1是选自由空残基、val、ala、gly、ile和leu组成的组b2是选自由空残基、gln、glu、asp和asn组成的组;b3是选自由空残基、his、arg、lys、gln和asp组成的组;b4是选自由空残基、val、ala、gly、ile和leu组成的组;b5是选自由空残基、val、ala、gly、ile、leu、ser、th和tyr组成的组;b6是选自由空残基、his、arg和lys组成的组;b7是选自由空残基、gln和asn、his、arg以及lys组成的组;b8是选自由空残基、val、ala、gly、ile和leu组成的组;b9是选自由空残基、trp、phe、ser、thr和tyr组成的组;b10是选自由空残基、gln、glu、asp和asn组成的组;b11是选自由空残基、trp、phe、val、ala、gly、ile和leu组成的组;b12是选自由空残基、ser、thr和tyr、met、trp以及phe组成的组;b13是选自由空残基、gln、glu、asp和asn、val、ala、gly、ile以及leu组成的组;b14是选自由空残基、his、arg、lys、val、ala、gly、ile、leu和pro组成的组;b15是选自由空残基、gln、glu、asp、asn、val、ala、gly、ile和leu组成的组;b16是选自由空残基、val、ala、gly、ile和leu组成的组;b17是选自由空残基、ser、thr和tyr组成的组;b18是选自由空残基、val、ala、gly、ile和leu组成的组;b19是选自由空残基、val、ala、gly、ile、leu和pro组成的组;b20是选自由空残基、his、arg、lys、val、ala、gly、ile和leu组成的组;b21是选自由空残基、ser、thr、tyr、gln、glu、asp和asn组成的组;b22是选自由空残基、his、arg、lys、val、ala、gly、ile、leu和pro组成的组;b23是选自由空残基、ser、thr、tyr、val、ala、gly、ile和leu组成的组;b24是选自由空残基、ser、thr和tyr组成的组;b25是选自由空残基、val、ala、gly、ile、leu和pro组成的组;b26是选自由空残基、his、arg、lys、gln、glu、asp和asn组成的组;b27是选自由空残基、val、ala、gly、ile、leu、ser、thr和tyr组成的组;b28是选自由空残基、ser、thr和tyr组成的组。可提供超拮抗剂作为包含超拮抗剂肽中的一种的药物组合物。所述药物组合物可用于治疗个体的头痛、偏头痛、关节炎疼痛、肿瘤相关疼痛、神经性疼痛、子宫内膜异位症、吗啡耐受、黄斑变性、肿瘤血管发生、肿瘤转移或血管性水肿的方法,所述方法包括向个体施用有效量的clr/ramp受体超拮抗剂。一些实施方案提供一种药物组合物,其包含药学上可接受的赋形剂以及如本文公开和描述的超拮抗剂。一些实施方案提供一种治疗个体的头痛或肿瘤的方法,所述方法包括向所述个体施用有效量的如本文公开和描述的超拮抗剂。在一些实施方案中,所述方法还可包括鉴定患有头痛或肿瘤的受试者。在一些实施方案中,头痛是偏头痛。一些实施方案提供了一种治疗与cgrp的异常水平相关的病状的方法,所述方法包括向个体施用如本文公开和描述的超拮抗剂,所述方法包括向所述个体施用有效量的如本文公开和描述的超拮抗剂。在一些实施方案中,所述病状是偏头痛。一般肽修饰在一些实施方案中,一个或多个残基在n末端融合至式i中的激动剂以及式ii和iii中的拮抗剂的bb,从而产生相对于所述类似物具有n-末端延伸的多肽。在一些实施方案中,这种延伸影响在施用后激动剂或拮抗剂的稳定性。在一些实施方案中,向所述激动剂或拮抗剂的bb的n-末端或c-末端添加残基,例如包含ala、glu、gly、pro、ser和thr的xtens序列,可延长类似物的稳定性(schellenberger等人,2009,naturebiotechnology27(12):1186-1192)。在一些实施方案中,n-末端或c-末端残基的添加可增加所施用药物的半衰期。这些变化在本文中考虑;本领域普通技术人员将知道如何可做到这一点。一些实施方案提供了一种通过以下方式来鉴定clr/ramp受体结合配体的方法:提供与clr/ramp受体结合的超拮抗剂,提供测试化合物或测试化合物的文库,以及鉴定能够使所述超拮抗剂与所述clr/ramp受体解离的化合物。通过这种方法鉴定的此类化合物可进一步针对其他clr/ramp受体结合剂进行筛选,以鉴定选择性clr/ramp受体结合配体。在本发明的一些实施方案中,提供了一种clr/ramp受体超激动剂或超拮抗剂肽,其中所述肽包含与seqidno:28-51、69-70、77-78、92、94、101、103、110、112、114、119、120-125和139的氨基酸序列具有至少60%、至少70%、至少80%、至少90%、至少95%或更高序列同一性的氨基酸序列,其中所述肽保留激动剂或拮抗剂活性。还提供了与本发明的clr/ramp受体超激动剂或超拮抗剂连接的治疗剂,例如药物、治疗性多肽等,其中所述clr/ramp受体超激动剂或超拮抗剂充当治疗剂的靶向部分。还提供了递送与本发明的clr/ramp受体超激动剂或超拮抗剂连接的治疗剂的方法,所述方法包括向有需要的个体施用有效剂量的所述连接的治疗剂。在一些实施方案中,所述治疗剂是显像剂。标记的clr/ramp受体配体(例如,用作显像以及还有治疗剂的肾上腺髓质素衍生物)由j.depuis等人在ca2567478和wo2008/138141中进行了描述。在这些adm衍生物中,能够结合放射性同位素的络合笼状分子结构以直接方式或经由可能还包括短peg间隔物的间隔单元连接至adm的n末端。这些药物的诊断或治疗价值来自放射性分子的靶向递送。一些实施方案提供了一种通过提供与clr/ramp受体结合的clr/ramp受体超激动剂或超拮抗剂、提供测试化合物或测试化合物的文库来鉴定clr/ramp受体,以及用于使clr/ramp受体在体内显像的方法。在一些实施方案中,异源部分与超激动剂或超拮抗剂连接。在一些实施方案中,所述异源部分是pas序列。如本文所用的pas序列是指主要包含丙氨酸和丝氨酸残基或主要包含丙氨酸、丝氨酸和脯氨酸残基的氨基酸序列,所述氨基酸序列在生理条件下形成无规卷曲构象。本领域技术人员应意识到,当将除丙氨酸、丝氨酸和脯氨酸以外的残基作为次要成分添加于pas序列中时,氨基酸聚合物也可形成无规卷曲构象。不同于丙氨酸、丝氨酸和脯氨酸的氨基酸可选自由以下组成的组:arg、asn、asp、cys、gin、glu、gly、his、he、leu、lys、met、phe、thr、trp、tyr和val。在生理条件下,pas序列伸展段形成无规卷曲构象并且由此可介导增加的体内和/或体外稳定性。在其他实施方案中,形成无规卷曲结构域的pas序列是生物学插入物,尤其相对于血浆的蛋白水解、免疫原性、等电点/静电行为、结合至细胞表面受体或内化而言,然而其仍为生物可降解的,其提供超过诸如peg的合成聚合物的明显优势。形成无规卷曲构象的pas序列的非限制性实例包含选自由aspaapapaspaapapsapa、aapaspapaapsapapaaps和asaaapaaasaaasapsaaa或其任何组合组成的组(参见美国专利公布号2010/0292130al和pct申请公布号wo2008/155134al)。在某些实施方案中,与超激动剂或超拮抗剂连接的异源部分是羟乙基淀粉(hes)或其衍生物。hes是天然存在的支链淀粉的衍生物,并且在体内被α淀粉酶降解,并且表现出有利的生物学特性。它被用作血容量置换剂且在临床上用于血液稀释疗法(sommermeyer等人,krankenhauspharmazie,8(8),271-278(1987);以及weidler等人,arzneim.-forschung/drugres.,41,494-498(1991))。在某些实施方案中,连接至所述超激动剂或超拮抗剂的异源部分是具有不同平均分子量和/或不同取代度和/或不同c2:c6取代比率的羟乙基淀粉的混合物。在某些实施方案中,与超激动剂或超拮抗剂连接的异源部分是聚唾液酸(psa)或其衍生物。聚唾液酸(psa)是天然存在的未分支唾液酸聚合物,其由某些细菌菌株或在哺乳动物中在某些细胞中产生,rothj.,等人(1993)于polysialicacid:frommicrobestoman,编著rothj.,rutishauseru.,troyf.a.(birkhauserverlag,basel,switzerland),第335-348页。唾液酸也可发现于具有除唾液酸以外的单体的交替共聚物中。唾液酸具有重要的生物功能,包括通过病原菌逃避免疫和补体系统和在胎儿发育期间调节不成熟神经元的神经胶质粘着力(其中聚合物具有抗粘着功能;cho和troy,p.n.a.s.,usa,91(1994)11427-11431)。已经描述了将聚唾液酸连接或缀合至肽或多肽的各种方法(参见美国专利号5,846,951;wo-a-0187922和us2007/0191597al)。在某些实施方案中,与超激动剂或超拮抗剂连接的异源部分是富含甘氨酸的同源氨基酸聚合物(hap)。hap序列可包含甘氨酸的重复序列,所述序列具有至少50个氨基酸、至少100个氨基酸、200个氨基酸或500个氨基酸的长度。在一个实施方案中,所述hap序列能够延长融合或连接至hap序列的部分的半衰期。hap序列的非限制性实例包括但不限于(gly)n、(gly4ser)n或s(gly4ser)n,其中n是1-200。在某些方面,本发明的化合物与至少一个异源部分共价连接,所述异源部分是或包含xten多肽或其片段、变体或衍生物。如在此所用,“xten多肽”是指具有非天然存在、基本上非重复、主要由小亲水性氨基酸组成的序列的长度延长多肽,所述序列在生理条件下具有低程度二级或三级结构或无二级或三级结构。作为异源部分,xten可充当半衰期延长部分。此外,xten可提供令人希望的性质,包括但不限于增强的药物代谢动力学参数和可溶性特征。在某些方面,xten部分可增加药代动力学性质,如更长的体内半衰期或增加的曲线下面积(auc),以使得与具有相同但不含xten异源部分的化合物或缀合物相比,本发明的化合物或缀合物保持在体内并具有促凝血活性持续增加的时间段(参见国际专利公布号wo2010091122al、wo2010144502a2、wo2010144508al、wo2011028228al、wo2011028229al或wo2011028344a2)。在本发明的含义内,术语“fc”应理解为免疫球蛋白恒定区或其部分,如fc区或fcrn结合配偶体。在某些实施方案中,所述化合物或缀合物与一个或多个截短的fc区连接,所述fc区仍然足以赋予fc区fc受体(fcr)结合特性。例如,结合至fcrn的fc区的部分(即,fcrn结合部分)包含igg1的约氨基酸282-438,eu编号(主要接触位点是ch2结构域的氨基酸248、250-257、272、285、288、290-291、308-311和314以及ch3结构域的氨基酸残基385-387、428和433-436。因此,本发明的生物活性肽衍生物中的fc区可包含fcrn结合部分或由其组成。fcrn结合部分可源自任何同种型,包括igg1、igg2、igg3和igg4的重链。在一个实施方案中,使用来自人同种型igg1的抗体的fcrn结合部分。在另一个实施方案中,使用来自人同种型igg4的抗体的fcrn结合部分。在某些实施方案中,fc区包含以下中的至少一个:铰链(例如,上部、中部和/或下部铰链区)结构域(根据eu编号,抗体fc区的约氨基酸216-230)、ch2结构域(根据eu编号,抗体fc区的约氨基酸231-340)、ch3结构域(根据eu编号,抗体fc区的约氨基酸341-438)、ch4结构域或其变体、部分或片段。在其他实施方案中,fc区包含完整fc结构域(即,铰链结构域、ch2结构域和ch3结构域)。在一些实施方案中,fc区包含融合至ch3结构域(或其部分)的铰链结构域(或其部分)、融合至ch2结构域(或其部分)的铰链结构域(或其部分)、融合至ch3结构域(或其部分)的ch2结构域(或其部分)、融合至铰链结构域(或其部分)和ch3结构域(或其部分)的ch2结构域(或其部分),基本上由其组成或由其组成。在其他实施方案中,fc区缺少ch2结构域的至少一部分(例如,ch2结构域的全部或部分)。在一个特定实施方案中,fc区包含对应于eu编号221至447的氨基酸或由其组成。本发明的生物活性肽衍生物中的fc可包括,例如,在国际pct公布wo88/07089a1、w096/14339a1、wo98/05787a1、w098/23289a1、w099/51642a1、w099/58572a1、wo00/09560a2、wo00/32767a1、wo00/42072a2、wo02/44215a2、wo02/060919a2、wo04/099249a2、wo05/040217a2、wo04/044859、wo05/070963a1、wo05/077981a2、wo05/092925a2、wo05/123780a2、wo06/019447a1、wo06/047350a2和wo06/085967a2;美国专利公布号us2007/0237766、us2007/0237767、us2007/0243188、us2007/0248603、us2007/0286859、us2008/0057056中公开的氨基酸位置中的一个或多个处的变化(例如,取代)。在一个实施方案中,可在所公开的氨基酸位置中的一个或多个处进行特定改变(例如,本领域公开的一种或多种氨基酸的特异性取代)。在另一个实施方案中,可进行所公开的氨基酸位置中的一个或多个处的不同变化(例如,本领域中公开的一个或多个氨基酸位置的不同取代)。本发明中使用的fc区还可包含改变其糖基化的本领域公认的氨基酸取代。例如,所述fc具有导致糖基化(例如n-联糖基化或o-联糖基化)减少的突变或可包含改变的野生型fc部分的糖型(例如低海藻糖或无海藻糖聚糖)。在某些实施方案中,本发明的化合物或缀合物与包含白蛋白或其功能片段的异源部分连接。人血清白蛋白(hsa或ha)(呈其全长形式的具有609个氨基酸的蛋白质)引起显著比例的血清渗透压且也充当内源性和外源性配体的载体。如本文所用的术语“白蛋白”包括全长白蛋白或其功能性片段、变体、衍生物或类似物。白蛋白或其片段或变体的实例公开于美国专利公布号2008/0194481al、2008/0261877al或2008/0153751al或pct申请公布号2008/033413a2、2009/058322al或2007/021494a2中。在一个实施方案中,所述异源部分是白蛋白、其片段或变体,其进一步连接至选自由免疫球蛋白恒定区或其部分(例如,fc区)、pas序列、hes和peg组成的组的异源部分。在某些实施方案中,所述异源部分是包含白蛋白结合肽、细菌白蛋白结合结构域、白蛋白结合抗体片段或其任何组合的白蛋白结合部分。例如,所述白蛋白结合蛋白可以是细菌白蛋白结合蛋白、抗体或抗体片段,包括结构域抗体(参见美国专利号6,696,245)。例如,白蛋白结合蛋白可以是细菌白蛋白结合结构域,诸如链球菌蛋白g的白蛋白结合结构域(konig,t.和skerra,a.(1998)j.immunol.methods218,73-83)。可用作缀合配偶体的白蛋白结合肽的其他实例是例如,如在美国专利申请2003/0069395或dennis等人(dennis等人(2002)j.biol.chem.277,35035-35043)中描述的那些。白蛋白结合肽的实例包括一系列具有核心序列diclprwgclw的肽(参见,dennis等人,2002.j.biol.chem277:35035-35043),白蛋白结合抗体片段公开于muller和kontermann,curr.opin.mol.ther.9:319-326(2007)和holt等人,prot.eng.designsci.,21:283-288(2008)中。所描述的超激动剂和超拮抗剂可以环化形式存在,在另外的半胱氨酸的硫醇基团之间具有分子内二硫键。其他实施方案包括这些二硫化物衍生物的类似物,其中一个硫已被c3/4基团或硫的其他等排体替代。这些类似物可使用本领域已知的方法经由分子内或分子间置换来制备。或者,肽的氨基-末端可用α-取代的乙酸封端,其中所述α取代基是离去基团,如oc-卤代乙酸,例如,oc-氯乙酸、oc-溴乙酸或oc-碘乙酸。本发明实施方案的肽可经由半胱氨酸或高半胱氨酸残基的硫置换离去基团而环化或二聚化。参见例如,andreu,等人1994,meth.mol.bio.35(7):91-169;barker,等人1992,med.chem.35:2040-2048;以及or,等人1991,org.chem.56:3146-3149)。根据本发明的一个实施方案,式(i)、(ii)或(iii)的化合物可通过至少一个酰胺键的n-甲基化进一步修饰。n-甲基化对肽的代谢稳定性的影响已针对各种肽进行了描述。例如,环孢菌素是天然存在的环状多重n-甲基化肽,其表现出优异的药物代谢动力学特征。n-甲基化通常阻止酶促降解--通过蛋白酶,因为它们不能裂解n-甲基化肽键。多重n-甲基化显示改善肽的代谢稳定性和肠道通透性[chatterjeej,gilonc,hoffmana,kesslerh,n-methylationofpeptides:anewperspectiveinmedicinalchemistry,accchemres.,41(10),1331-1342,2008]。环化与af-甲基化组合用于调节肽的物理化学性质,包括代谢稳定性、膜通透性和口服生物利用度[chatterjeej,lauferb,kesslerh,synthesisofaf-methylatedcyclicpeptides,natprotoc,7(3),432-444,2012]。dongqg,zhangy,wangms,fengj,zhanghh,wuyg,gutj,yuxh,jiangcl,cheny,liw,kongw,improvementofenzymaticstabilityandintestinalpermeabilityofdeuterohemin-peptideconjugatesbyspecificmulti-siteaf-methylation,aminoacids.,43(6),2431-2441,2012描述了选定位点处的af-甲基化显示针对蛋白质降解的高抗性。在稀释的血清和肠制剂中,观察到高50至140倍的半衰期值。然而,lindey,ovadiao,safraie,xiangz,portillofp,shalevde,haskell-luevanoc,hoffmana,gilonc,structure-activityrelationshipandmetabolicstabilitystudiesofbackbonecyclizationandaf-methylationofmelanocortinpeptides,biopolymers.,90(5),671-682,2008描述了a-促黑素细胞激素的环状af-甲基化类似物更稳定,然而生物活性低于亲本肽。将理解,两种或更多种此类修饰可在一种肽模拟物结构中偶联。在一些实施方案中,如本文公开和描述的修饰的肽激动剂或拮抗剂也可代表前药:前药是在显示其药理作用之前经历生物转化的任何化合物。前药也可包括载体连接的前药、多级前药。使用方法本发明进一步提供了一种使用活性量的根据本发明的化合物治疗和/或预防病症,特别是上述病症的方法,包括但不限于内皮病症、心血管病症、肺病症、淋巴病症、水肿病症和/或炎性病症。一些实施方案提供了一种治疗与cgrp、adm或imd的异常水平相关的病状的方法,所述方法包括向个体施用如本文公开和描述的clr/ramp受体超激动剂,所述方法包括向所述个体施用有效量的如本文公开和描述的clr/ramp受体超激动剂。对于本发明,术语“治疗(treatment)”或“治疗(treating)”包括抑制、延迟、缓解、缓和、阻止、减轻疾病、病症、病状或状态、其发展和/或进展和/或其症状,或引起所述疾病、病症、病状或状态、其发展和/或进展和/或其症状的消退。术语“预防(prevention)”或“预防(preventing)”包括降低患有、感染或经历疾病、病症、病状或状态、其发展和/或进展和/或其症状的风险。术语预防包括防治。治疗或预防疾病、病症、病状或状态可以是部分或完全的。鉴于clr/ramp激动剂和拮抗剂的药理学活性,许多临床适应症是明显的,并且包括但不限于高血压,例如妊娠高血压;先兆子痫;子痫;恶性高血压、肺动脉高压、与糖尿病相关的高血压等;心力衰竭、中风、心肌梗塞;心脏肥大;骨关节炎;支气管肺发育不良(bpd);慢性阻塞性肺病(copd);肺气肿;肺纤维化;溃疡性结肠炎;伤口愈合;糖尿病性溃疡;淋巴水肿;类风湿性关节炎;神经保护等。例如,可使用本发明的超激动剂的临床适应症尤其包括治疗恶性高血压。本发明的肽提供血压,例如收缩压降低至少约5%、至少约10%、至少约15%、至少约20%或更多,而不影响心率。在使用方法中,本发明的肽的有效剂量单独施用或以肽的混合物施用,或与另外的活性剂组合施用以治疗如上文所列的病状。有效剂量可以是约1ng/kg重量、10ng/kg重量、100ng/kg重量、1μg/kg重量、10μg/kg重量、25μg/kg重量、50μg/kg重量、100μg/kg重量、250μg/kg重量、500μg/kg重量、750μg/kg重量、1mg/kg重量、5mg/kg重量、10mg/kg重量、25mg/kg重量、50mg/kg重量、75mg/kg重量、100mg/kg重量、250mg/kg重量、500mg/kg重量、750mg/kg重量等。剂量可根据需要多次施用,例如,每30分钟、每小时、每2小时、每4小时、每6小时、每8小时、每12小时、每18小时、每天、每2天、每3天、每周等。剂量也可作为连续输注施用,例如,在急性治疗方法中。本发明的肽可用于降低与先兆子痫和子痫相关的高血压,并且可施用足以稳定受试者并允许安全妊娠分娩的一段时间。先兆子痫是妊娠20周后的新发高血压和蛋白尿。子痫是先兆子痫患者中原因不明的全身癫痫发作。诊断是临床和通过尿蛋白测量。常规治疗通常使用iv硫酸镁和足月分娩。先兆子痫影响3%至7%的孕妇。在妊娠20周后发展先兆子痫和子痫;达25%的病例在产后发展,最常见于产后前4天但有时长达6周。未治疗的先兆子痫通常郁积可变时间,然后突然进展为子痫,这在1/200的患有先兆子痫的患者中发生。未治疗的子痫通常是致命的。先兆子痫可无症状或可导致水肿或体重过度增加。非依赖性水肿,如面部或手部肿胀(患者的戒指可不再适合她的手指)比依赖性水肿更具特异性。可增加反射反应性,从而表明神经肌肉应激性,其可进展为癫痫发作(子痫)。出血点可能发展,也可能发展凝血病的其他病征。诊断为20周后的新发高血压(bp>140/90mmhg)加上新的原因不明的蛋白尿>300mg/24小时。诊断通过高血压的症状或存在提出,其定义为收缩压>140mmhg,舒张压>90mmhg,或两者。除紧急情况外,高血压应在间隔至少4小时的>2次测量中记录。在24小时的收集中测量尿蛋白排泄。蛋白尿被定义为>300mg/24小时。或者,蛋白尿是基于蛋白质:肌酸酐比率≥0.3或试纸读数为1+(仅在没有其他定量方法时使用)进行诊断。不太准确的测试(例如,尿液试纸测试,常规尿分析)缺乏蛋白尿并不排除先兆子痫。在不存在蛋白尿的情况下,如果孕妇患有新发高血压加上以下任何一种的新发病,则也被诊断为先兆子痫:血小板减少(血小板<100,000/μl);肾功能不全(血清肌酸酐>1.1mg/dl或无肾脏疾病的女性中血清肌酸酐加倍)、肝功能受损(氨基转移酶>正常的2倍)、肺水肿、脑或视觉症状。高血压是如果未经治疗则强烈易患动脉粥样硬化性心血管疾病的疾病。据估计,多达四分之一的美国成年人患有高血压。在患有糖尿病的人中高血压比没有糖尿病的人常见大约两倍。高血压的患病率随年龄增长而增加。不应基于单次测量来诊断高血压。初始升高的读数应基于一周或更长时间内的至少两次随后随访确诊,其中平均舒张压为90mmhg或更高或收缩压为140mmhg或更高是高血压的诊断所需的。在诊断糖尿病患者的高血压时需要特别注意,因为血压变异性更大,并且单纯收缩期高血压的可能性更大。对于这些患者,建议目标血压低于130/85mmhg。除了饮食改变之外,可能需要药物治疗来控制高血压。可施用主题肽以降低动脉血压。此外,降低高血压的继发效应是减少水肿和炎性渗出物体积。含有本发明的肽的药物组合物可用作心脏保护剂,例如,以改善心肌缺血后的缺血性损伤或心肌梗塞面积。能够限制急性心肌缺血后心肌损伤的程度,即心肌梗塞的程度的新治疗剂的开发是现代心脏病学的主要关注点。由于回顾性流行病学研究表明梗塞后最初几年期间的死亡率似乎与原始梗塞面积相关,因此人们也开始关注能够提供额外心肌保护的疗法的开发,所述疗法可与溶栓治疗联合施用或单独施用。心肌缺血是心肌供氧和需求不平衡的结果,并且包括劳累性和血管痉挛性心肌功能障碍。劳累性缺血通常归因于涉及大冠状动脉的关键性动脉粥样硬化狭窄的存在,从而导致心内膜下流量减少。血管痉挛性缺血与各种局灶性痉挛相关,其发作与活动或应力无关。痉挛被更好地定义为血管紧张度的突然增加。在需要心脏保护治疗的患者的治疗中,本发明的化合物通常可口服或胃肠外施用。剂量方案是确保最大治疗反应直到获得改善的剂量方案,并且然后是得到缓解的最小有效水平。因此,通常,剂量是在产生心脏保护作用,即改善心肌缺血后的缺血性损伤或心肌梗塞面积中在治疗上有效的那些剂量。还预期所述肽将适用作可注射剂型,其可在紧急情况下施用至患有心肌缺血等的患者。本发明的肽还可用于减轻水肿,例如淋巴水肿、类风湿性关节炎、继发于脑肿瘤或癌症照射的水肿、由中风引起的水肿、头部创伤或脊髓损伤、术后水肿、哮喘和其他呼吸系统疾病以及眼睛的囊样黄斑水肿。基于它们的药理学性质,根据本发明的化合物可用于治疗和/或预防心血管疾病,特别是心力衰竭,尤其是慢性和急性心力衰竭、心力衰竭恶化、舒张和收缩(充血性)心力衰竭、急性代偿失调性心力衰竭,心功能不全,冠心病,心绞痛,心肌梗死,缺血再灌注损伤,缺血性和出血性中风,动脉硬化,动脉粥样硬化,高血压,尤其是原发性高血压、恶性原发性高血压、继发性高血压、肾血管性高血压以及继发于肾病症和内分泌病症的高血压,高血压性心脏病,高血压性肾病,肺动脉高压,尤其是继发性肺动脉高压、伴或不伴急性肺心病的肺栓塞后肺动脉高压、原发性肺动脉高压,以及外周动脉闭塞疾病。根据本发明的化合物此外适用于治疗和/或预防肺病症,如慢性阻塞性肺病,哮喘,急性和慢性肺水肿,过敏性肺泡炎和由于吸入的有机粉尘和真菌、放线菌或其他来源的颗粒引起的肺炎,急性化学性支气管炎,急性和慢性化学性肺水肿,神经源性肺水肿,由于放射所致的急性和慢性肺部表现,急性和慢性间质性肺病症,成人或儿童(包括新生儿)的急性肺损伤/急性呼吸窘迫综合征(ali/ards),继发于肺炎和败血症的ali/ards,吸入性肺炎和继发于吸入的ali/ards,继发于烟气吸入的ali/ards,输血相关的急性肺损伤(trali),手术、创伤或烧伤后ali/ards或急性肺动脉瓣关闭不全,呼吸机诱导的肺损伤(vili),肺纤维化以及高山病。根据本发明的化合物此外适用于治疗和/或预防伴和不伴高血压的妊娠[妊娠诱导的]水肿和蛋白尿(先兆子痫和子痫)。根据本发明的化合物此外适用于治疗和/或预防慢性肾病、肾功能不全、糖尿病性肾病变、高血压慢性肾病、肾小球性肾炎、迅速进展性和慢性肾病综合征、非特异性肾病综合征、肾病综合征、遗传性肾病、急性和慢性肾小管-间质性肾炎、急性肾损伤、急性肾衰竭、创伤和术后肾损伤、心肾综合征以及肾移植物的保护和功能改善。所述化合物此外适用于治疗和/或预防糖尿病及其连续症状,例如像糖尿病大血管病变和微血管病变、糖尿病性肾病和神经病变。根据本发明的化合物可用于治疗和/或预防中枢和外周神经系统的病症,如偏头痛、丛集性头痛、癫痫、中风、血管痉挛、病毒和细菌性脑膜炎和脑炎(例如带状疱疹脑炎)、创伤性和中毒性脑损伤、脑和脊髓原发性或继发性恶性肿瘤、脊神经根炎和多神经根炎、格林-巴利综合征[急性或感染后多神经炎、米勒费雪综合征]、帕金森病、急性和慢性多发性神经病、疼痛、脑水肿、阿尔茨海默病、神经系统的退行性疾病和中枢神经系统的脱髓鞘疾病,如但不限于多发性硬化症。根据本发明的化合物此外适用于治疗和/或预防门静脉高压和肝纤维化[肝硬化]及其后遗症如食管静脉曲张和腹水,用于治疗和/或预防继发于恶性肿瘤或炎症的胸腔积液,以及用于治疗和/或预防原发性和继发性淋巴水肿和继发于脉管曲张的水肿。根据本发明的化合物此外适用于治疗和/或预防胃肠道的炎性病症,如炎性肠病、克罗恩病、溃疡性结肠炎以及肠的毒性和血管病症。根据本发明的化合物此外适用于治疗和/或预防败血症、出血性休克或多器官衰竭(mof)、创伤性休克和血管神经性水肿[巨荨麻疹,昆克氏水肿]。根据本发明的化合物此外适用于治疗与血管功能紊乱相关的一种或多种水肿性眼病症,包括但不限于年龄相关性黄斑变性(amd)、糖尿病性视网膜病,特别是糖尿病性黄斑水肿(dme)、视网膜下水肿和视网膜内水肿。在本发明的上下文中,术语年龄相关性黄斑变性(amd)包括amd的湿性(或渗出性,新生血管性)和干性(或非渗出性,非新生血管性)表现。根据本发明的化合物此外适用于治疗高眼压(青光眼)。根据本发明的化合物此外可用于治疗和/或预防外科手术后局部缺血及其连续症状的手术相关状态,特别是使用心肺机对心脏进行干预,对颈动脉、主动脉的干预,或使用颅盖的器械开口或穿透。在外科手术的情况下,所述化合物此外适用于一般治疗和/或预防,目的是加速伤口愈合和缩短恢复时间。它们进一步适用于促进伤口愈合。所述化合物此外适用于治疗和/或预防骨密度和结构的病症,如但不限于骨质疏松症、骨软化症和甲状旁腺功能亢进相关的骨病症。本发明进一步提供了根据本发明的化合物用于制备用于治疗和/或预防病症,特别是上述病症的药物的用途。本发明进一步提供特别是用于治疗和/或预防上述病症的药物,所述药物包含根据本发明的化合物和一种或多种其他活性成分。示例性和优选的活性成分组合是:ace抑制剂、血管紧张素受体拮抗剂、β-2受体激动剂、磷酸二酯酶抑制剂、糖皮质激素受体激动剂、利尿剂或血管紧张素转化酶-2或乙酰水杨酸(阿司匹林)。在本发明的一个优选实施方案中,根据本发明的化合物与ace抑制剂组合施用,所述ace抑制剂是如作为举例并优选依那普利、喹那普利、卡托普利、赖诺普利、雷米普利、地拉普利、福辛普利、培哚普利、西拉普利、咪达普利、贝那普利、莫昔普利、螺普利或泉多普利。在本发明的一个优选实施方案中,根据本发明的化合物与血管紧张素受体拮抗剂组合施用,所述血管紧张素受体拮抗剂如作为举例并优选氯沙坦、坎地沙坦、缬沙坦、替米沙坦或恩布沙坦。在本发明的一个实施方案中,根据本发明的化合物与β-2受体激动剂组合施用,所述β-2受体激动剂如作为举例并优选沙丁胺醇、吡布特罗、沙美特罗、特布他林、非诺特罗、妥洛特罗、克伦特罗、瑞普特罗或福莫特罗。在本发明的一个实施方案中,根据本发明的化合物与磷酸二酯酶(pde)抑制剂组合施用,所述磷酸二酯酶如作为举例并优选米力农、氨吡酮、匹莫苯、西洛他唑、西地那非、伐地那非或他达拉非。在本发明的一个实施方案中,根据本发明的化合物与糖皮质激素受体激动剂组合施用,所述糖皮质激素受体激动剂如作为举例并优选皮质醇、可的松、氢化可的松、泼尼松、甲基-泼尼松龙、泼尼立定、地夫可特、氟可龙、曲安西龙、地塞米松或倍他米松。在本发明的一个实施方案中,根据本发明的化合物与利尿剂组合施用,所述利尿剂如作为举例并优选呋塞米、托拉塞米和氢氯噻嗪。在本发明的一个实施方案中,根据本发明的化合物与利尿钠肽组合施用,所述利尿钠肽如奈西立肽(人b型利尿钠肽(hbnp))和卡培立肽(α-人心房利尿钠多肽(hanp))。在本发明的一个实施方案中,根据本发明的化合物与尿舒张素组合施用,尿舒张素是仍在开发中用于急性心力衰竭的anp的衍生物。在本发明的一个实施方案中,根据本发明的化合物与lcz696(entresto)组合施用,所述lcz696是一种脑啡肽酶(脑啡肽酶、中性肽链内切酶、nep,也参与adm的代谢)抑制剂。在本发明的一个实施方案中,根据本发明的化合物用于在体外或体内刺激来自人或动物的内皮细胞或淋巴内皮细胞的增殖。内皮功能障碍是各种危及生命的疾病中微血管和大血管并发症的主要原因,所述微血管和大血管并发症包括动脉粥样硬化、心肌病、中风、顽固性高血压、先兆子痫、肺动脉高压和糖尿病性溃疡。内皮功能障碍代表这些疾病的自然过程中的早期事件。血管内皮的功能包括调节血管紧张度、抑制血小板聚集和控制血管细胞的增殖的物质的合成。内皮的损伤可导致内皮源性的收缩因子增加、一氧化氮产生减少和内皮屏障破坏,从而导致许多器官的高血压、动脉粥样硬化、血栓形成、炎症、血管阻力、血管渗漏、水肿和功能损伤。因此,对寻找改善内皮功能障碍的方法具有显著兴趣。在过去的几十年中,几类抗高血压药物和血管保护药物(包括血管紧张素转化酶(ace)抑制剂、血管紧张素受体拮抗剂(arb)、盐皮质激素受体拮抗剂、β-阻滞剂、利尿剂和钙通道拮抗剂)的开发已通过降低氧化应激、内皮素活性、纤溶酶原激活剂活性或血小板活化而显著改善患有一些内皮功能障碍相关疾病的患者的结果。此外,他汀类和抗糖尿病药物二甲双胍以及黄嘌呤氧化酶的抑制剂如别嘌呤醇已被证明改善患者的内皮功能。然而,许多内皮功能障碍相关疾病的进展不能通过现有药物来预防,所述现有药物主要被开发用于阻断信号传导过程,而不是主动刺激内皮功能。本发明可用于预防或治疗多种疾病中的内皮功能障碍,并促进内皮细胞的有效繁殖,其本身可用于治疗内皮功能障碍。制剂提供了制剂和药物,其包含至少一种根据本发明的化合物,通常与一种或多种惰性、无毒、药学上合适的赋形剂一起;以及其用于上述目的的用途。为此目的,它们可以合适的方式施用,例如通过胃肠外、肺、鼻、舌下、舌、颊、皮肤、透皮、结膜、光学途径或作为植入物或支架。活性剂可以是本文公开的单一肽;或者可被配制成一种或多种肽(例如,1、2、3、4、5、6、7、8、9、10或更多种不同的肽)的混合物,例如包含表1的肽序列的结构、由其组成或基本上由其组成的肽;或包含与seqidno:28-51、69-70、92、94、101、103和110的氨基酸序列具有至少60%、至少70%、至少80%、至少90%、至少95%或更高序列同一性的氨基酸序列、由其组成或基本上由其组成的肽,其中所述肽保留激动剂或超激动剂活性。肽可作为药学上可接受的盐提供。一些实施方案包括药物组合物,其包含至少一种本文公开的本发明的修饰肽(d-氨基酸或肽模拟物)作为活性成分以及药物载体或稀释剂。这些药物组合物可通过本领域技术人员已知且包括但不限于口服、肺部、胃肠外(肌肉内、腹膜内、静脉内或皮下注射),吸入(经由细粉制剂或气溶胶)、透皮、鼻内或舌下施用途径的任何方式施用,并且可被配制成适合于每种施用途径的剂型。所述化合物还可以缓释剂型或控释剂型的形式施用,包括但不限于长效注射剂、渗透泵、透皮(包括电转运)贴剂等,以用于以预定速率进行长时间的和/或定时的、脉冲式施用。可以本身已知的方式,例如借助于常规混合、溶解、造粒、制糖衣丸、磨细、乳化、囊封、包埋或压片方法的方式制造本发明实施方案的药物组合物。因此根据本发明实施方案使用的药物组合物可以常规方式使用包含赋形剂和辅助剂的一种或多种生理上可接受的载体来配制,所述载体有助于将活性化合物加工成可药学上使用的制剂。当适合时且如本领域中所了解,可使用任何熟知技术、载体和赋形剂。可制备呈常规形式的注射剂,如液体溶液或悬浮液、适合用于在注射前在液体中溶解或悬浮的固体形式或乳液。适合的赋形剂是(例如)水、盐水、葡萄糖、甘露糖醇、乳糖、卵磷脂、白蛋白、谷氨酸钠、盐酸半胱氨酸等。此外,如果需要,可注射的药物组合物可包含微量的无毒助剂物质,如润湿剂、ph缓冲剂等。生理学上相容的缓冲液包括但不限于,汉克斯氏溶液(hanks'ssolution)、林格氏溶液(ringer'ssolution)或生理盐水缓冲液。如果需要,可使用吸收增强制剂(例如,脂质体)。对于透粘膜施用,可在制剂中使用适于待渗透的屏障的渗透剂。用于胃肠外施用(例如,通过弹丸注射或持续输注)的药物制剂包含呈水溶性形式的活性化合物的水溶液。此外,活性化合物的悬浮液可被制备为适当的油性注射悬浮液。合适的亲脂性溶剂或媒介物包括脂肪油(如芝麻油),或其他有机油(如大豆、葡萄柚或杏仁油),或合成脂肪酸酯(如油酸乙酯或甘油三酯)或脂质体。水性注射悬浮液可含有增加悬浮液粘度的物质,如羧甲基纤维素钠、山梨糖醇或葡聚糖。任选地,悬浮液还可含有适合的稳定剂,或增加化合物的溶解度以便允许制备高度浓缩溶液的药剂。注射用制剂可以单位剂量呈现,例如在安瓿中或在多剂量容器中,并加有防腐剂。所述组合物可采用诸如在油性或水性媒剂中的悬浮液、溶液或乳液的形式,且可含有诸如悬浮剂、稳定剂和/或分散剂的配制剂。或者,活性成分可呈在使用前用合适媒介物(例如无菌无热原质水)复原的粉末形式。对于吸入施用,根据本发明实施方案使用的本发明组合物使用适合的推进剂(例如,二氯二氟甲烷、三氯氟甲烷、二氯四氟乙烷、二氧化碳或其他合适的气体)从加压包装或喷雾器以气溶胶喷雾剂呈现形式方便地递送。在加压气雾剂的情况下,可以通过提供阀门以便递送计量的量来确定剂量单位。可配制含有化合物与合适的粉末基质(如乳糖或淀粉)的粉末混合物的用于在吸入器或吹入器中使用的(例如)明胶的胶囊和药筒。作为一个实例,可根据quay等人,美国专利号7,812,120b2的教义来制备用于吸入施用的制剂。本文中进一步公开的是用于包括眼内、鼻内以及耳内递送的用途的药物领域中熟知的不同药物组合物。用于这些用途的合适的渗透剂是本领域中公知的。用于眼内递送的药物组合物包括呈水溶性形式的活性化合物的水性眼用溶液,如滴眼剂或结冷胶;眼用软膏;眼用悬浮液,如微粒、悬浮在液体载体介质中的含药物的小聚合物颗粒、脂溶性制剂;以及眼用嵌入剂。所有上述参考文献以引用的方式整体并入本文。出于稳定性和舒适性,所述适合的药物制剂最经常并且优选被配制成为无菌的、等渗的以及缓冲的。用于鼻内递送的药物组合物还可包括通常制备成在许多方面模拟鼻分泌物以确保维持正常纤毛作用的滴剂和喷雾剂,此类组合物包括,例如但不限于,azria等人在美国专利号5,733,569中公开的鼻用溶液。用于耳内递送的药物制剂包含用于在耳中局部施加的悬浮液和软膏。用于此类耳制剂的常见溶剂包含甘油和水。除前述制剂以外,本发明化合物还可配制为贮库型制剂。此类长效制剂可通过植入(例如皮下或肌内)或通过肌内注射来施用。因此,例如,化合物可与合适的聚合材料或疏水性材料(例如配制为在可接受的油中的乳液)或离子交换树脂一起配制,或配制为略微可溶的衍生物,例如,为微溶盐。施用方法的非限制性实例尤其包括(a)通过非口服途径如眼内、鼻内或耳内施用,所述施用包括作为水性悬浮液、油性制剂等或作为滴出物、喷雾剂、药膏、软膏等施用;(b)经由注射、皮下、腹膜内、静脉内、肌内、皮内、眼内等施用,包括输液泵递送;(c)局部施用,如通过直接颅内注射,例如通过贮库植入;以及(e)局部施用;如本领域技术人员认为适合于使本发明实施方案的肽与活组织接触。可由个体医师鉴于患者的病状来选择本发明实施方案的药物组合物的确切制剂、施用途径以及剂量。通常,向患者施用的组合物的剂量范围可以是约0.000001至100mg/kg的患者体重。根据患者的需要,所述剂量可以是在一天或多天的疗程中给予的单一剂量或两个或更多个的一系列剂量。在已经针对至少一些病状确立化合物的人剂量的情况下,本发明实施方案将使用所确立的人剂量的那些相同的剂量或所确立的人剂量的约0.1%与500%之间、更优选约25%与250%之间的剂量。在未确立人剂量时,如在新发现的药物化合物的情况下,合适的人剂量可从ed50或id50值或源自体外或体内研究的其他适当值推定(当在动物中通过毒性研究和功效研究证明合格时)。虽然确切剂量将在各药物的基础上确定,但在大多数情况下,可作出关于剂量的一些概括。成人患者的每日剂量方案可以是,例如,每种活性成分在0.001mg与100mg之间的示例性范围或在0.005mg与5mg之间的示例性范围下的静脉内、皮下或肌内剂量。在施用药学上可接受的盐的情况下,剂量可根据游离碱来进行计算。在一些实施方案中,所述组合物每天施用0.1至4次或作为单一急性剂量施用,例如以改善高血压。或者,如本文所述的组合物可通过持续静脉内输注,优选以达1000mg每天的每种活性成分的剂量施用。如本领域技术人员将了解,在某些情况下可能必需以超过或甚至远远超过上述示例性剂量范围的量施用本文所公开的肽,以便有效地和积极地治疗特别具有侵袭性的疾病或感染。在一些实施方案中,将施用所述肽持续一定时期的连续疗法,例如持续一周或多于一周,或持续数月或数年。在局部施用或选择性摄取的情况下,有效的局部药物浓度可能不涉及血浆浓度。所施用的本发明组合物的量可取决于所治疗的受试者、受试者的体重、折磨的严重程度以及施用方式。可使用已知方法针对功效和毒性来评估本文所公开的化合物。此类研究的结果经常预示动物(如哺乳动物,或更具体地说,人)中的功效。或者,可使用已知方法测定特定化合物在动物模型(如小鼠、大鼠、兔或猴)中的功效。含有所述化合物的组合物可出于预防性和/或治疗性治疗施用。在治疗应用中,向已经罹患如上所述的疾病的患者施用组合物,其量足以治愈或至少部分地阻止所述疾病以及其并发症的症状。将足以实现此目标的量定义为“治疗有效剂量”。本文所描述的组合物还可通过例如tice和bibi(在:treatiseoncontrolleddrugdelivery,编著a.kydonieus,marceldekker,n.y.1992,第315-339页中)的方法微囊化。当以例如每天约0.01μg至约50mg/kg体重的示例性剂量范围施用时,本文所述的激动剂肽和肽模拟物可有效治疗clr/ramp受体介导的病状。所采用的具体剂量通过所治疗的特定病状、施用途径以及主治临床医师根据诸如病状的严重程度、患者的年龄和一般病状等因素所作的判断进行调节。此类剂量可容易地由本领域技术人员确定。可制备呈常规形式的注射剂,如液体溶液、悬浮液、适合用于在注射前在液体中溶解或悬浮的固体形式、乳液或与药学上可接受的胃肠外媒介物缔合的冻干粉末。此类媒介物的实例是水、盐水、林格氏溶液(ringer'ssolution)、右旋糖溶液以及5%人血清白蛋白。也可使用脂质体和非水性媒介物,如不挥发性油类。媒介物或冻干粉末可包含维持等渗性(例如,氯化钠、甘露醇)和化学稳定性(例如,缓冲剂和防腐剂)的添加剂。通过常用技术对制剂进行灭菌。例如,通过将1.5重量%的活性成分溶解在0.9%氯化钠溶液中来制备适于注射施用的胃肠外组合物。可在延时释放制剂中,例如在包含缓释聚合物的组合物中施用化合物。活性化合物可用将防止化合物快速释放的载体制备,如控制释放制剂,包括植入物和微囊封递送系统。可使用生物可降解、生物相容的聚合物,诸如乙烯乙酸乙烯酯、聚酸酐、聚乙醇酸、胶原、聚原酯、聚乳酸(pla)、聚乳酸、聚乙醇酸共聚物(plg)或聚(乳酸-乙醇酸)共聚物(plga)。许多用于制备此类制剂的方法通常是本领域技术人员已知的。合适的赋形剂是(例如)水、盐水、葡萄糖、甘露糖醇、乳糖、卵磷脂、白蛋白、谷氨酸钠、盐酸半胱氨酸等。此外,如果需要,可注射的药物组合物可包含微量的无毒助剂物质,如润湿剂、ph缓冲剂等。如果需要,可使用吸收增强制剂(例如,脂质体)。所述组合物可采用诸如在油性或水性媒介物中的悬浮液、溶液或乳液的形式,且可含有诸如悬浮剂、稳定剂和/或分散剂的配制剂。水性注射悬浮液可含有增加悬浮液粘度的物质,如羧甲基纤维素钠、山梨糖醇或葡聚糖。对于透粘膜施用,可在制剂中使用适于待渗透的屏障的渗透剂。合适的亲脂性溶剂或媒介物包括脂肪油(如芝麻油),或其他有机油(如大豆、葡萄柚或杏仁油),或合成脂肪酸酯(如油酸乙酯或甘油三酯)或脂质体。对于吸入施用,根据本发明实施方案使用的本发明组合物使用适合的推进剂(例如,二氯二氟甲烷、三氯氟甲烷、二氯四氟乙烷、二氧化碳或其他合适的气体)从加压包装或喷雾器以气溶胶喷雾剂呈现形式方便地递送。在加压气雾剂的情况下,可以通过提供阀门以便递送计量的量来确定剂量单位。作为一个实例,可根据quay等人,2010年10月12日发布的美国专利号7,812,120b2的教义来制备用于吸入施用的制剂。本文所描述的组合物还可通过例如tice和bibi(在:treatiseoncontrolleddrugdelivery,编著a.kydonieus,marceldekker,n.y.1992,第315-339页中)的方法微囊化。本文中进一步公开的是用于包括眼内、鼻内以及耳内递送的用途的药物领域中熟知的不同药物组合物。用于眼内递送的药物组合物包括水溶形式的活性化合物的水性眼用溶液,如滴眼剂或结冷胶(shedden等人,2001,clin.ther.,23(3):440-50)或水凝胶(mayer等人,1996,ophthalmologica,210(2):101-3);眼用软膏剂;眼用悬浮液,如微粒、悬浮在液体载体介质中的含药物的小聚合物颗粒(joshi,a.,1994.ocul.pharmacol,10(1):29-45);脂溶性制剂(aim等人,1989prog.clin.biol.res.,312:447-58);和微球(mordenti,1999,toxicol.sci.,52(1):101-6);以及眼用嵌入剂。用于鼻内递送的药物组合物还可包括通常制备成在许多方面模拟鼻分泌物以确保维持正常纤毛作用的滴剂和喷雾剂,此类组合物包括,例如但不限于,azria等人在1998年3月31日发布的美国专利号5,733,569中公开的鼻用溶液。如remington'spharmaceuticalsciences,第18版,mackpublishingco.,easton,pa(1990)中所公开,并且最常见且优选包括抗微生物防腐剂和合适的药物稳定剂。用于耳内递送的药物制剂包含用于在耳中局部施加的悬浮液和软膏。用于此类耳制剂的常见溶剂包含甘油和水。除前述制剂以外,所述化合物还可配制为贮库型制剂。此类长效制剂可通过植入(例如皮下或肌内)或通过肌内注射来施用。因此,例如,化合物可与合适的聚合材料或疏水性材料(例如配制为在可接受的油中的乳液)或离子交换树脂一起配制,或配制为略微可溶的衍生物,例如,为微溶盐。施用方法的非限制性实例尤其包括(a)经由注射、皮下、腹膜内、静脉内、肌内、皮内、眼内等施用,包括输液泵递送;(b)局部施用,如通过直接颅内注射,例如通过贮库植入;以及(c)局部施用;如本领域技术人员认为适合于使本发明实施方案的肽与活组织接触。通常,向患者施用的组合物的剂量范围可以是约0.000001至100mg/kg的患者体重。根据患者的需要,所述剂量可以是在一天或多天的疗程中给予的单一剂量或两个或更多个的一系列剂量。可单独地调整剂量的量和间隔时间以便提供足以维持调节作用的活性部分的血浆水平或最小有效浓度(mec)。还可使用mec值确定剂量间隔时间。应使用在10%至90%的时间内维持血浆水平高于mec的方案施用组合物。在整个说明书中,对特定化合物的任何叙述应理解为包括化合物及其任何(其他)药学上可接受的盐。一些实施方案提供clr/ramp受体超激动剂或超拮抗剂,其具有选自表1中列出的以下肽序列的结构。表1.合成clr/ramp受体激动剂和拮抗剂序列的列表肽和肽模拟物的制备固相合成。本文所述的clr/ramp受体超激动剂、激动剂、超拮抗剂和拮抗剂可通过本领域已知的经典方法制备,例如,通过使用标准固相技术。参见例如,merrifield,1963j.am.chem.soc.85:2149。这些固相肽合成程序是本领域中熟知的并且进一步由j.m.stewart和j.d.young,1984solidphasepeptidesyntheses第2版,piercechemicalcompany描述。合成氨基酸。这些程序也可用于合成其中除20种天然存在的遗传编码的氨基酸之外的氨基酸在如本文公开的本发明的肽的一个、两个或多个位置处被取代的肽。例如,萘基丙氨酸可取代色氨酸,从而促进合成。可被取代成本发明实施方案的肽的其他合成氨基酸包括l-羟丙基、l-3,4-二羟基-苯丙氨酰基、d氨基酸如l-d-羟赖氨酰基和d-d-甲基丙氨酰基、l-α-甲基丙氨酰基、β-氨基酸以及异喹啉基。d氨基酸和非天然存在的合成氨基酸也可并入本发明实施方案的肽中(参见例如,roberts,等人1983unusualamino/acidsinpeptidesynthesis5:341-449)。在一些实施方案中,20种遗传编码的氨基酸的天然存在的侧链或如本文公开的任何其他侧链可转座至氨基酸的氮,而不是通常在肽中发现的α-碳。在一些实施方案中,可相对于seqidno:28-51、69-70、92、94、101、103和110的序列修饰clr/ramp受体超激动剂的氨基酸序列,以使得所述修饰降低对酶蛋白水解的敏感性。在一些实施方案中,这种修饰包括包含人血清白蛋白或免疫球蛋白的全部或部分的序列的n-末端添加。在一些实施方案中,本发明的肽包含一个或多个d-氨基酸残基。在一些实施方案中,相对于seqidno:28-51、69-70、92、94、101、103和110的序列对本发明的肽的氨基酸序列进行修饰,以使得所述修饰包括用相应的d-氨基酸残基替代一个或多个l-氨基酸残基。在一些实施方案中,相对于seqidno:28-51、69-70、92、94、101、103和110的序列,对本发明的肽的氨基酸序列进行修饰,以使得所述修饰是用保守氨基酸取代一个或多个氨基酸。天然存在的残基可基于共同侧链特性分成以下类别:疏水性:正亮氨酸(nor)、met、ala、val、leu、de;中性亲水性:cys、ser、thr、asn、gln;酸性:asp、glu;碱性:his、lys、arg;影响链取向的残基:gly、pro;以及芳香族:trp、tyr、phe。保守性氨基酸取代可涉及一种类别的成员与同一类别的另一成员交换。保守性氨基酸取代可涵盖通常通过化学肽合成而非通过在生物系统中合成而并入的非天然存在的氨基酸残基。这些包括肽模拟物和氨基酸的其他逆向或反向形式。在一些实施方案中,保守取代可包括将一个非极性(疏水性)氨基酸残基(如异亮氨酸、缬氨酸、亮氨酸、正亮氨酸、丙氨酸或甲硫氨酸)取代为另一个,将一个极性(亲水性)氨基酸残基取代为另一个(如精氨酸与赖氨酸之间,谷氨酰胺与天冬酰胺之间,苏氨酸与丝氨酸之间),将一个碱性氨基酸残基(如赖氨酸、精氨酸或组氨酸)取代为另一个,或将一个酸性残基(如天冬氨酸或谷氨酸)取代为另一个(表3)。短语“保守氨基酸取代”还包括使用化学衍生的残基代替非衍生化的残基,条件是这种多肽显示出必需的激动剂活性。可根据本发明实施方案使用的氨基酸残基取代的实例包括以下:原始残基取代alaval、leu、ile、aibarglys、gln、asn、高精氨酸asnglnaspglucysser、alaglnasngluaspglypro、alahisasn、gln、lys、argileleu、val、met、ala、phe、正亮氨酸leu正亮氨酸、ile、val、met、ala、phelysarg、1,4-二氨基-丁酸、gln、asn、鸟氨酸metleu、phe、ilepheleu、val、ile、ala、tyrproalaserthr、ala、cysthrser、val、iletrptyr、phetyrtrp、phe、thr、servalile、met、leu、phe、ala、正亮氨酸在一些实施方案中,如本文公开的氨基酸的碱性部分(如arg的胍)可被碱性生物电子等排体取代。还可通过其他方法容易地修饰本发明实施方案的肽,以用于制备本发明实施方案的化合物的肽衍生物,如描述于hruby,等人1990biochem.j.268:249-262中。因此,如本文公开的肽还充当制备具有类似生物活性的肽模拟物的基础。末端修饰本领域技术人员认识到,多种技术可供用于构建具有与相应的clr/ramp受体超激动剂相同或相似的所需生物活性、但在溶解度、稳定性以及对水解和蛋白水解的敏感性方面具有比参考肽更有利的活性的肽模拟物。参见例如,morgan,等人1989ann.rep.med.chem.24:243-252。以下描述了用于制备在n-末端氨基、c-末端羧基处修饰的肽模拟物和/或将所述肽中的一个或多个酰胺基键联改变为非酰胺基键联的方法。应理解,两种或更多种此类修饰可在一种肽模拟物结构中偶联(例如,在c-末端羧基处的修饰和在肽中的两个氨基酸之间包含—ch2-氨基甲酸酯键联)。n-末端修饰肽通常以游离酸的形式合成,但如上所述,可容易地制备成酰胺或酯。还可修饰肽化合物的氨基和/或羧基末端以产生其他有用的化合物。氨基末端修饰包括甲基化(即,—nhch3或—nh(ch3)2)、乙酰化、添加苄氧基羰基、或用任何含有由rcoo—定义的羧酸酯官能团的封闭基团封闭氨基末端,其中r是选自由萘基、吖啶基、类固醇基和类似基团组成的组。氨基末端修饰如上所述并包括烷基化、乙酰化、添加羧基苯甲酰基、形成琥珀酰亚胺基团等。参见,例如,murray,等人1995burger'smedicinalchemistryanddrugdiscovery第5版,第1卷,manfrede.wolf,编著,johnwileyandsons,inc。还可通过在ba片段的n-末端添加至少一个残基来修饰n-末端。用于评估n-末端延伸对肽的影响的技术是本领域中已知的,例如schellenberger,等人,2009,naturebiotechnology27(12):1186-1192。c-末端修饰羧基末端修饰包括用羧酰胺基团替代游离酸或在羧基末端形成环状内酰胺以引入结构限制。在制备其中c-末端羧基被酰胺—c(o)nr3r4替代的肽模拟物中,使用二苯甲基胺树脂作为肽合成的固相载体。在合成完成后,从载体上释放肽的氟化氢处理直接产生游离肽酰胺(即,c-末端是—c(o)nh2)。或者,在肽合成期间使用氯甲基化树脂与同氨反应结合以从载体上裂解侧链保护的肽得到游离肽酰胺,并且与烷基胺或二烷基胺反应得到侧链保护的烷基酰胺或二烷基酰胺。然后通过用氟化氢处理以常规方式除去侧链保护,以得到游离酰胺、烷基酰胺或二烷基酰胺。除了前述n-末端修饰之外,本文所述的修饰的肽激动剂(包括肽模拟物)可有利地用多种亲水性聚合物中的一种或多种修饰或与多种亲水性聚合物中的一种或多种共价偶联。已经发现,当用亲水性聚合物衍生化肽化合物时,它们的溶解度和循环半衰期增加并且它们的免疫原性被掩蔽。在一些实施方案中,如本文公开和描述的clr/ramp受体超激动剂可使用在zallipsky,s.1995bioconjugatechem6:150-165;monfardini,c,等人1995bioconjugatechem6:62-69中阐述的方法中的任一种用此类聚合物衍生化或与此类聚合物偶联。主链修饰用于制备化合物的肽衍生物的其他方法描述于hruby,等人1990biochem.j.268(2):249-262中。因此,所述肽化合物也充当具有相似生物活性的非肽化合物的结构模型。本领域技术人员认识到,多种技术可用于构建具有与前导肽化合物相同或相似的所需生物活性、但在溶解度、稳定性以及对水解和蛋白水解的敏感性方面具有比前导肽化合物更有利的活性的化合物。参见morgan,等人1989ann.rep.med.chem.24:243-252,其以引用的方式整体并入本文。二硫键形成所述化合物可以环化形式存在,在半胱氨酸的硫醇基团之间具有一个或多个分子内二硫键。其他实施方案包括这些二硫化物衍生物的类似物,其中一个硫已被ch2基团或硫的其他等排体替代。这些类似物可使用本领域已知的方法经由分子内或分子间置换来制备。或者,肽的氨基-末端可用α-取代的乙酸封端,其中所述α取代基是离去基团,如α-卤代乙酸,例如,α-氯乙酸、α-溴乙酸或α-碘乙酸。本发明实施方案的肽可经由半胱氨酸或高半胱氨酸残基的硫置换离去基团而环化或二聚化。参见例如,andreu,等人1994,meth.mol.bio.35(7):91-169。在一些实施方案中,如本文公开和描述的本发明的肽以及它们的融合蛋白也可通过本领域熟知的重组dna技术来制备。所述融合蛋白可包括但不限于与人血清白蛋白、免疫球蛋白、fc、fc衍生物、微球蛋白或其他血清蛋白的融合蛋白。其他效用本文所述的化合物可用作选择性检测活细胞上、固定细胞上、生物学流体中、组织匀浆中、人体中等的clr/ramp受体的试剂。特异性地结合至一种或多种本文所述的肽的抗体可通过本领域技术人员已知的方法来产生,所述抗体可例如用于本文所述的肽的检测和分析。实验提出以下实施例以便向本领域的普通技术人员提供如何制备和使用本发明的完全公开和说明,并且不意图限制本发明人看待其发明的范围,也不意图表示以下实验是进行的全部或仅有的实验。虽然已尽力确保就所用数字(例如量、温度等)来说的准确性,但仍应考量一些实验误差和偏差。除非另外指出,否则份数是重量份,分子量是重均分子量,温度是摄氏度并且压力是大气压或接近大气压。实施例1基于clr/ramp受体调节多种中枢神经系统(cns)和外周血管活动的证据,已经合成并研究了肾上腺髓质素、cgrp和垂体中叶素的许多类似物。迄今为止,这些肽激素的已知合成类似物表现出与野生型配体可比较或更差的受体活化活性。同样地,这些肽激素的合成拮抗类似物(例如,cgrp8-37和adm22-52;rovero,p.等人1992,peptides13:1025-1027)表现出温和的生物活性,并且主要对三种clr/ramp受体(即,clr/ramp1、2和3受体)中的一种具有特异性。不存在泛特异性超激动剂或拮抗剂以及clr/ramp2特异性超激动剂。在人和其他哺乳动物(包括啮齿类动物)中,存在肾上腺髓质素、cgrp和垂体中叶素的三种clr/ramp受体。这些是clr/ramp1、2和3受体,其在整个血管系统中表达。据报道,cgrp是clr/ramp1的选择性激动剂,而肾上腺髓质素与clr/ramp2高亲和力相互作用。另一方面,垂体中叶素是低效力配体,并且在clr/ramp1、2和3受体中未表现出特异性偏爱。鉴于这些肽激素的有趣生理学和药理学特征,寻求鉴定对clr/ramp1和2受体表现出优异激动或拮抗活性的配体以及对clr/ramp2受体表现出优异激动活性的配体。设计并合成了肾上腺髓质素和垂体中叶素的一系列系统修饰的衍生物,并与母体化合物比较来表征其信号传导。结果表明,具有n-末端酰化和有或无微型-peg修饰的嵌合类似物的活性显著优于生理递质、cgrp、adm或imd。此外,具有n-末端酰化和微型-peg修饰的肾上腺髓质素类似物特异性地表现出对clr/ramp2受体的超激动活性。此外,当与一般clr/ramp1受体拮抗剂cgrp8-38和/或clr/ramp2受体拮抗剂adm22-52相比时,包含adm和imd序列的分子显示以高效力竞争与clr/ramp1、2和/或3受体的cgrp和adm相互作用。此外,选定超拮抗类似物表现出clr/ramp1或clr/ramp2特异性拮抗活性。因此,所述类似物代表泛特异性或选择性的超拮抗剂,其与其互补的生物活性受体结合并且比生理配体更强地抑制受体的生理反应。实施例1使用受体活化测定,测定本发明的肽激动剂对clr/ramp1受体、clr/ramp2或clr/ramp3受体复合物的剂量依赖性刺激反应。在所述测定中使用携带重组clr/ramp1、clr/ramp2或clr/ramp3受体的细胞系。以10种不同浓度一式两份测试了肽激动剂活性,从1.0μm开始并在dmso中连续稀释3倍。人β-cgrp(一种已知的clr/ramp1受体激动剂)在clr/ramp1测定中用作阳性对照,并且adm(一种已知的clr/ramp2受体激动剂)用作clr/ramp2测定中的阳性对照。使用了clr/ramp1camp、clr/ramp2抑制蛋白测定和clr/ramp3camp(discoverx,fremont,calif.)。以单一浓度一式两份进行测定,并使用10点剂量反应曲线、在起始浓度下3倍稀释,一式两份进行ec50和ic50测定。结果在稳定表达clr/ramp1(1321n1细胞)、clr/ramp2(cho-k1细胞)或clr/ramp3(cho-k1细胞)受体的细胞中研究了合成类似物的超激动活性的药理学在使用0.03-1000nm剂量的野生型配体和修饰的类似物的受体活化测定中,clr/ramp2受体中肾上腺髓质素的半最大有效浓度(ec50)是大约13-26nm,并且clr/ramp1受体中clr/ramp1特异性β-cgrp的ec50是大约1-1.5nm(表2)。野生型adm肽(seqidno:53和54)和imd肽(seqidno:52)的另外对照显示这些肽是clr/ramp1受体的低效力配体。野生型adm肽的ec50是介于9-12nm之间,而野生型imd的ec50是70nm。合成类似物的生物活性的比较显示adm和imd的六种主要嵌合肽(seqidno:55-60)在刺激clr/ramp1和/或clr/ramp2受体中具有低效力或无活性。出人意料地,在选定肽(seqidno:28-29)的n-末端的微型-peg和棕榈酰化修饰使这些肽的效力增加10至1000倍。另外的测试显示,在这些肽和另外的嵌合肽中用棕榈酰化进行的选择性修饰也导致效力的显著增加(seqidno:30-51和92)。大多数这些合成肽刺激clr/ramp1和2受体的ec50处于高皮摩尔范围(即,<1nm)。重要的是,当与肾上腺髓质素相比时,这些合成肽中的一些(seqidno:28、30、31、34和36)在clr/ramp2受体中也表现出>110%的最大活性。此外,这些有效激动肽中的一些代表微型化激动剂。例如,seqidno:48和92仅含有36个氨基酸,其比39或40个氨基酸的野生型肽小得多。此外,这些激动肽中的一些还表现出对clr/ramp3的超激动活性。虽然adm对clr/ramp受体的ec50是大约0.4nm(表2),但seqidno:28和48的ec50是0.06-0.07nm。因此,这些数据表明这些合成激动剂是clr/ramp1、2和/或3受体的泛特异性超激动剂。这些合成配体的效力的增加对这些配体是特异性的和独特的。具有n-末端微型-peg和/或棕榈酰化修饰的其他嵌合肽(seqidno:61-68)、非酰化截短的嵌合肽(seqidno:93)、酰化嵌合cgrp-adm肽(seqidno:104)、酰化嵌合adm-imd-adm肽(seqidno:105)和酰化截短的cgrp(seqidno:108)未表现出对clr/ramp1和2受体的效力增加。利用这些观察结果,寻求鉴定对clr/ramp2受体具有选择性的超激动剂,并测试了另外的合成类似物(seqidno:71-74)。结果表明cgrp(seqidno:74)的棕榈酰化修饰不影响cgrp活性的特征。同样地,具有不同长度的adm肽的n-末端的棕榈酰化(seqidno:71-73)仅适度增加这些肽对clr/ramp1和2受体的效力。相比之下,使用adm肽的微型-peg基序和棕榈酰化两者的特定修饰(seqidno:69-70)使ec50降低至低纳摩尔浓度或亚纳摩尔浓度并维持对clr/ramp2受体的偏爱。还显示adm的微型-peg和棕榈酰化修饰(seqidno:69)使clr/ramp2受体的最大活性增加至147%。此外,发现在序列中间具有截短的选定adm和嵌合类似物产生微型化clr/ramp2特异性类似物(seqidno:94、101、103和110)。这些数据表明这些配体代表clr/ramp2特异性超激动剂。具有阳性对照值的这些实验的结果列于表2中。结果证明选定肽的出人意料的高效力,例如,与野生型肽的高纳摩尔ec50浓度相比,许多具有在高皮摩尔范围内的ec50浓度。这些发现表明这些超激动剂在刺激细胞功能方面是比野生型配体更有效的激动剂。确实,使用培养的人淋巴内皮细胞(hlec)的功能测试表明,这些超激动剂在刺激hlec细胞存活和增殖方面表现出比野生型adm和imd更高的内在功效。使用mts测定定量细胞存活和增殖显示合成类似物(seqidno:28、30、33、38、39、40和69)在30-100nm范围内剂量依赖性地刺激hlec细胞增殖和存活(图1和2)。相比之下,野生型adm(seqidno:53和54)、野生型imd(seqidno:52)和主要嵌合肽(seqidno:59)在此剂量范围内对hlec细胞增殖和存活具有最小影响(图1和2)。这些数据因此证明在刺激受体信号传导和受体介导的细胞存活和增殖中,这些新颖类似物的相对内在功效优于已知的clr/ramp受体配体。表2.合成clr/ramp受体激动剂的激动活性的列表为了分析拮抗活性,将合成类似物与细胞一起预孵育,然后在其ec80处加入参考配体。所述测定显示野生型adm22-52(seqidno:75)抑制cgrp刺激的clr/ramp1和adm刺激的clr/ramp2受体活化,ic50分别>20000和631nm(表3)。另一方面,对于clr/ramp1和clr/ramp3,clr/ramp1特异性cgrp8-37(seqidno:137)分别具有133和>10000nm的ic50。这些数据与文献一致,即cgrp8-37和adm22-52是分别对clr/ramp1和clr/ramp2具有特异性的低效力拮抗剂。由adm和imd序列(seqidno:76)组成的嵌合肽似乎对clr/ramp1和2受体具有稍微改善的拮抗活性。cgrp刺激的clr/ramp1和adm刺激的clr/ramp2受体信号传导的ic50分别是1123和289nm。相比之下,具有n-末端棕榈酰化或棕榈酰化和微型-peg修饰的嵌合肽(seqidno:77-78、112、114、119、120-125或139)对cgrp刺激的clr/ramp1和/或adm刺激的clr/ramp2受体信号传导表现出高度有效的拮抗活性。在这些拮抗剂中,seqidno:77-78、112、121和125是泛特异性的。seqidno:114、120、122-124和139是clr/ramp1特异性的;而seqidno:119是clr/ramp2特异性的。这些类似物的cgrp刺激的clr/ramp1和adm刺激的clr/ramp2受体信号传导的ic50分别是1.8-9.9和0.6-47nm。另一方面,据报道对clr/ramp受体表现出有效拮抗活性的两种合成肽(seqidno:115和116;表3)在相同的测定中未表现出超拮抗活性。此外,对clr/ramp3受体活化活性的研究表明,选定肽也是clr/ramp3的超激动剂。与cgrp8-37和adm22-52不同,其分别对clr/ramp3具有574和330nm的ic50;seqidno:78、112、114、119、120-122和123的ic50是0.8-9.2nm。同样重要的是要注意,这些超拮抗剂中的一些是微型化拮抗剂,其仅含有17-28个氨基酸。cgrp8-37和adm22-52分别含有30和31个氨基酸。这些数据表明,n-末端修饰的嵌合肽(seqidno:77-78、112、114、119、120-125或139)具有比亲本肽(seqidno:76)或cgrp和adm源性的拮抗剂强一至两个数量级的拮抗活性。因此,这些修饰的嵌合或截短的肽代表clr/ramp1、2和3受体的有效泛特异性、clr/ramp1特异性或clr/ramp2特异性超拮抗剂。表3.合成clr/ramp受体拮抗剂的拮抗活性的列表虽然出于清楚和理解的目的已经在一些细节上描述了本发明的实施方案,但是本领域技术人员将理解,在不脱离所述实施方案的真实范围的情况下,可进行形式和细节的各种改变。上文提及的所有图、表格和附录以及专利、申请和公布都以引用的方式整体并入本文。对照试剂。人β-cgrp和人adm分别用作阳性对照。另外,使用具有序列(人imd,seqidno:52)、(人adm,seqidno:53)和(人adm,seqidno:54)的肽作为另外的对照。在本说明书中引用的所有公布和专利申请都以引用的方式并入本文,如同具体地且单独地指出各个单独的公布或专利申请以引用的方式并入。已经根据本发明人发现或提出的特定实施方案描述了本发明,以包括用于实施本发明的优选模式。本领域普通技术人员将理解,鉴于本公开,在不脱离本发明的预期范围的情况下,可在举例说明的特定实施方案中进行各种修改和改变。此外,由于生物功能等效性考虑,可在蛋白质结构中进行改变而不影响种类或量的生物作用。所有此类修改意图包括在附随权利要求书的范围内。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1